 |
Glob Reg Health Technol Assess 2020; 7(1): 14-25 DOI: 10.33393/grhta.2020.695 ORIGINAL RESEARCH ARTICLE |
 |
Valutazione dell’utilizzo di Floseal®, un agente emostatico topico, in chirurgia cardiotoracica
Evaluation of the use of Floseal®, a topical hemostatic agent, in cardiothoracic surgery
Introduction: Achieving haemostasis is critical in surgical procedures. Surgical bleeding is associated with an increased risk of mortality and morbidity with consequences at both clinical and organizational level, and with significant economic implications. In addition to conventional methods for controlling intraoperative bleeding, many topical adjunctive hemostatic products are available; among them Floseal® (Baxter Healthcare Corporation), a gelatin-based hemostatic matrix.
The aim of this study is to provide an updated systematic literature review of Floseal® in cardiac surgery and estimate its associated economic impact in an Italian hospital.
Methods: A literature search was conducted in MEDLINE and the Cochrane Library over the period 2013-2016 to identify new publications related to Floseal® in cardiac surgery, in addition to those already included in the systematic review of Echave et al. Furthermore, we investigated the economic impact of the use of Floseal® adapting the model elaborated by Tackett et al. to the Italian NHS. Four new studies were selected.
Results: High variability in surgical procedures, choice of hemostatic products compared to Floseal® and outcome definition is confirmed. Clinical, organizational, and economics endpoints were investigated. A cost-consequence analysis estimated relevant savings. A scenario analysis, despite showing a high variability in patient level savings (€ 441-2.831), confirmed economic advantages associated with Floseal®.
Discussion: Results support prior research both in terms of heterogeneity of evidence on the effectiveness of Floseal® in cardiac surgery and cost implications. The use of Floseal® achieves substantial cost savings in a hypothetical Italian hospital with a cardiac surgery unit.
Keywords: Cardiac surgery, Economic impact, Floseal®, Flowable hemostatic matrix
Received: November 29, 2019
Accepted: March 16, 2020
Published online: May 20, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu.
Introduzione
Ottenere l’emostasi, ossia l’arresto di una emorragia, è un obiettivo fondamentale in chirurgia. L’emorragia peri-operatoria è uno dei fattori che contribuisce maggiormente alla morbilità e mortalità operatoria e post-operatoria con ripercussioni non solo cliniche, ma anche a livello organizzativo (durata degli interventi chirurgici e della degenza, necessità di re-interventi) ed economico, sia in termini di costi diretti che indiretti.
I pazienti sottoposti a interventi di cardiochirurgia sono esposti in particolare al rischio di sanguinamenti data la natura degli stessi. Da uno studio retrospettivo (1) è emerso che nel 45,8% dei casi si rende necessario il ricorso a trasfusioni. Inoltre, per i pazienti con sanguinamenti i costi sostenuti sono superiori del 31% nella chirurgia cardiaca e del 93% nel caso di chirurgia vascolare.
L’emostasi può essere ottenuta tramite l’applicazione di metodi tradizionali meccanici, terapia a base di componenti del sangue o l’utilizzo sistemico o topico di agenti emostatici. Sul mercato sono disponibili diversi agenti emostatici che si distinguono in base alla natura del materiale (derivati animali, umani, vegetali e sintetici), al meccanismo d’azione e alla classe di appartenenza. Gli emostatici topici, sigillanti e adesivi sono considerati dispositivi medici. La Tabella I riporta gli agenti emostatici, provvisti del marchio CE di autorizzazione per l’immissione in commercio nei Paesi dell’Unione Europea o con iter negoziale concluso.
Le linee guida non specificano quale agente emostatico sia consigliabile in cardiochirurgia. Recentemente la Society for the Advancement of Blood Management ha costituito un International Hemostatic Expert Panel che, sulla base delle evidenze scientifiche a disposizione, ha definito un algoritmo per guidare nella scelta delle varie tipologie di trattamenti a disposizione (4).
| Prodotto | F | DM | Tipo di agente | Descrizione | ||
|---|---|---|---|---|---|---|
| ET | S | A | ||||
| BioGlue® (CryoLife) | x | x | x | Soluzione collosa di albumina di siero bovino e glutaraldeide | ||
| Coseal, sigillante chirurgico (Baxter Healthcare) | x | x | Idrogel sintetico di due polietilenglicoli | |||
| Floseal®, matrice emostatica (Baxter Healthcare) | x | x | Matrice di gelatina di origine bovina e trombina di origine umana | |||
| Gelfoam® (Pfizer) | x | x | Spugna assorbibile di gelatina di origine suina | |||
| Glubran 2™ (MediVogue) | x | x | Base cianoacrilica + monomero sintetizzato | |||
| Hemaseel APR™ | x | x | Collagene composto da trombina, fibrinogeno e aprotinina | |||
| Hemopatch (Baxter Healthcare) | x | x | Collagene derivato da derma bovino rivestito da NHS-PEG | |||
| Spongostan™ (Ethicon) | x | x | Spugna assorbibile di gelatina suina | |||
| Surgicel® (Ethicon) | x | x | Cellulosa rigenerata ossidata | |||
| Surgiflo® (Ethicon) | x | x | Gelatina suina riassorbibile +/– trombina | |||
| Tabotamp® (Ethicon) | x | x | Cellulosa di origine vegetale | |||
| Tachosil® (Baxter Healthcare) | x | x | Spugna con fibrinogeno umano e trombina umana | |||
| Tisseel® (Baxter Healthcare) | x | x | x | Soluzione di proteine umane (fibrinogeno, aprotinina, fattore XIII) + soluzione di trombina e cloruro di calcio | ||
| Tissucol (Baxter Healthcare) | x | x | x | Soluzione di proteine plasmatiche umane coagulabili (fibrinogeno, fibronectina plasmatica, fattore XIII, plasminogeno, aprotinina) + soluzione di trombina e cloruro di calcio | ||
F = farmaco; DM = dispositivo medico; ET = emostatico topico; S = sigillante; A = adesivo.
Tra gli agenti emostatici utilizzabili vi è Floseal® (Baxter Healthcare Corporation), una matrice gelatinosa di collagene con trombina a elevata concentrazione (2500 UI), derivata da bovino, indicata quando le procedure tradizionali sono inefficaci o non praticabili. L’azione emostatica di Floseal® dipende sia dall’effetto della gelatina di collagene, sia dall’effetto della trombina. Il collagene agisce con un effetto tampone. Infatti, i granuli a contatto col sangue creano una barriera meccanica che determina un rallentamento del sanguinamento, mentre l’esposizione del fibrinogeno endogeno a un’elevata concentrazione di trombina favorisce la rapida formazione del coagulo di fibrina.
Ispirandosi all’approccio del Health Technology Assessment (HTA), per comprendere le ripercussioni nella pratica clinica dell’utilizzo di un agente emostatico specifico quale Floseal®, è stata condotta una valutazione multidimensionale al fine di fornire elementi utili per supportare le scelte dei vari decisori (clinici, management) coinvolti. La valutazione è stata limitata all’impiego di Floseal® negli interventi di chirurgia cardiotoracica.
Metodi
Le dimensioni di HTA che sono state prese in esame sono state: l’efficacia, la sicurezza e l’impatto economico. L’efficacia e la sicurezza sono state valutate sulla base di una revisione sistematica di letteratura. A questa si è affiancata un’analisi di costo-conseguenza per valutare l’impatto dell’uso di Floseal® nella pratica clinica nell’ambito del Servizio Sanitario Nazionale (SSN), anche in considerazione del fatto che le evidenze disponibili sono solitamente riferite ad altri contesti nazionali. Quindi è stato condotto un adattamento utilizzando valori di riferimento italiani.
La Tabella II riporta la domanda di ricerca (PICO model) con la specifica della popolazione di riferimento oggetto della valutazione (P), l’intervento o gli interventi sui quali si sta indagando (I), il comparatore o i comparatori (C) e gli outcome di riferimento (O). Il confronto effettuato è Floseal® versus tutte le procedure e gli agenti emostatici topici riportati nella Tabella I e considerati come un unico omnicomprensivo comparatore. Il confronto effettuato è uno-a-molti e non uno-a-uno. L’intento non è individuare il miglior agente emostatico, ma individuare, se presente, il valore aggiunto di Floseal® rispetto alle alternative attualmente disponibili.
| Popolazione | La popolazione di interesse è rappresentata dai pazienti sottoposti a interventi di chirurgia cardiaca, in modalità laparoscopica o aperta |
| Intervento | Matrice emostatica di gelatina di origine bovina e trombina di origine umana Floseal® come agente emostatico, utilizzata singolarmente o in combinazione con altri agenti |
| Comparatore |
Procedure convenzionali ad azione emostatica; altri agenti emostatici topici, utilizzati singolarmente o in combinazione. Altri nomi: • Surgiflo® con e senza trombina • Surgicel® con e senza trombina • Gelfoam® con e senza trombina |
| Outcome |
Sicurezza, efficacia, aspetti economici, aspetti organizzativi Specifica: • Sanguinamenti post-operatori • Successo nell’ottenimento dell’emostasi • Tempo per l’emostasi • Trasfusioni • Complicazioni • Re-interventi • Mortalità • Degenza • Durata dell’intervento |
| Tipologia degli studi |
Studi comparativi sperimentali o osservazionali Valutazioni economiche In testo completo o come abstract (presentati a convegni non precedenti al 5 luglio 2014) |
| Setting clinico | Ospedale |
Revisione di letteratura
Il punto di partenza è stato la recente revisione sistematica di letteratura condotta da Echave et al. (5), che ha considerato diverse aree chirurgiche (cardiaca, ginecologica, ortopedica, urologica ecc.).
La stringa di ricerca è stata aggiornata e integrata in termini di ambiti di utilizzo clinico, periodo temporale coperto e lingua delle pubblicazioni ricercate (Tab. III). L’obiettivo è stato identificare gli articoli pubblicati dall’1 settembre 2013 all’1 luglio 2016 per la sola cardiochirurgia.
La ricerca è stata effettuata il 5 luglio 2016 nelle banche dati MEDLINE (attraverso il motore di ricerca PubMed) e Cochrane Library. Tre ricercatori hanno selezionato indipendentemente le pubblicazioni. Le difformità di giudizio sono state affrontate tramite discussione tra i valutatori. Il processo è stato ripetuto e verificato a gennaio 2019 adottando la stessa stringa di ricerca.
Inoltre, sono stati analizzati gli alert e le recall presenti nei seguenti database: la sezione sugli avvisi di sicurezza del sito del Ministero della Salute; Medicines and Healthcare products Regulatory Agency (MHRA) del Regno Unito; Recalls, Market Withdrawals, & Safety Alerts della Food and Drug Administration (FDA); il Manufacturer and User Facility Device Experience (MAUDE) dell’FDA.
Analisi di costo-conseguenza
Adottando la prospettiva di una struttura ospedaliera è stata condotta un’analisi di costo-conseguenza per stimare l’impatto economico associato all’utilizzo di Floseal® o di altro agente emostatico topico (Surgiflo®, Gelfoam® con o senza trombina) durante gli interventi di chirurgia cardiaca.
Il modello di costo-conseguenza adottato rappresenta un adattamento al contesto italiano del modello elaborato e validato da Tackett et al. (6,7). L’analisi considera pazienti sottoposti a chirurgia cardiaca primaria (coronarica, valvolare o combinata) e/o chirurgia dell’aorta toracica programmata. Il modello non si basa su un ospedale specifico, ma considera un ipotetico ospedale (italiano nel nostro caso) dotato di una struttura cardiochirurgica.
Il modello scelto si basa sui seguenti parametri clinici: tempo medio per l’emostasi; necessità di trasfusione di sangue o di emocomponenti nel periodo intra e post-operatorio; necessità di re-intervento chirurgico per sanguinamento nell’immediato post-operatorio; complicanze maggiori (ictus, shock, sepsi, infarto miocardico) e minori (insufficienza renale, insufficienza respiratoria, supporto inotropo >24 ore) (8). Ad ogni parametro clinico è associato un costo. L’output del modello è la stima dell’impatto economico su base annua dell’utilizzo degli agenti emostatici selezionati.
| Ricerca | Dettagli | |
|---|---|---|
| #1 | Surgery | ((((((surgery) OR “Surgical Procedures, Operative” [Mesh]) OR “General Surgery” [Mesh]) OR “surgery” [Subheading]) OR “Thoracic Surgery” [Mesh]) OR “Thoracic Surgical Procedures” [Mesh]) |
| #2 | Thrombin | (((thrombin [MeSH Terms]) OR thrombin [All Fields]) OR factor viiia [MeSH Terms]) OR factor viiia [All Fields] |
| #3 | Matrix | ((matrix bands [All Fields]) OR Matrix Metalloproteinases, Membrane-Associated [MeSH]) OR Hemostatic Matrix |
| #4 | Gelatin | ((((((gelatin [MeSH Terms]) OR gelatin [Text Word]) OR gelatin sponge, absorbable [MeSH Terms]) OR gelatin sponge, absorbable [All Fields]) OR surgical sponges [MeSH Terms]) OR (surgical [All Fields] AND sponges [All Fields])) OR surgical sponges [All Fields] |
| #5 | Sealant | Sealant [All Fields] |
| #6 | Floseal | Floseal [All Fields] |
| #7 | Matrix and thrombin | #3 AND #2 |
| #8 | Matrix and gelatin | #3 AND #4 |
| #9 | Matrix and sealant | #3 AND #5 |
| #10 | Product Matrix | #7 OR #8 OR #9 |
| #11 | Thrombin and matrix | #2 AND #3 |
| #12 | Thrombin and gelatin | #2 AND #4 |
| #13 | Thrombin and sealant | #2 AND #5 |
| #14 | Product Thrombin | #11 OR #12 OR #13 |
| #15 | Product | #10 OR #14 |
| #16 | Final Product | #15 OR #6 |
| #17 | Final | #16 AND #1 |
| #18 | Final 04Jul2016 | #17 AND ((“2013/09/01” [PDAT]: “2016/07/31” [PDAT]) AND (Spanish[lang] OR English[lang] OR Italian[lang]))) NOT “case reports” [Publication Type]) NOT “animals” [MeSH Terms:noexp] |
Al pari di quanto effettuato da Tackett et al. (6,7), l’analisi di sensibilità è stata condotta applicando una variazione del ±20% ai parametri del modello.
I valori assegnati ai parametri clinici del modello sono stati scelti sulla base dei risultati della revisione di letteratura e sono stati validati da esperti clinici in cardiochirurgia, mentre per definire i costi associati ai parametri del modello sono state considerate le evidenze disponibili nella letteratura scientifica, economica e nei Registri nazionali disponibili. Anche la scelta di adottare per l’analisi di sensibilità il range del ±20% è stata validata o meno sulla base delle evidenze di letteratura disponibili e del parere di esperti clinici.
Risultati
Revisione di letteratura
La strategia di ricerca ha prodotto 125 risultati, di questi ne sono stati selezionati 4 (Fig. 1) per la chirurgia cardiotoracica. Gli studi selezionati sono: un trial clinico randomizzato (RCT) condotto in Italia (8), due analisi basate su real world evidence (RWE) tratte dal database amministrativo Premier relativo all’attività ospedaliera statunitense (6,7,9) e un’analisi economica (7).
Gli interventi considerati sono di chirurgia elettiva cardiaca primaria (coronarica, valvolare o combinata) o dell’aorta toracica (8), procedure di bypass aorto-coronarico (CABG), o sostituzione o riparazione di valvola cardiaca (9), interventi (elettivi, di emergenza o di urgenza) di CABG o di chirurgia aortica, valvolare, o valvolare con CABG (6).
Gli agenti emostatici di confronto negli studi selezionati sono stati Surgicel® o Gelfoam® (8), Surgicel® con trombina e Gelfoam® con trombina (9) e il solo Surgiflo® (6).
Gli endpoint considerati in questi studi sono:
• clinici: il tempo e il tasso di successo nell’ottenimento dell’emostasi, il sanguinamento post-operatorio (ml/m2), il numero di trasfusioni, la necessità di re-intervento per sanguinamento, le complicanze minori e maggiori e la mortalità intraoperatoria;
• economici: si è andato a stimare il costo per complicanza clinica, trasfusione o re-intervento evitato o per minuto di sala operatoria risparmiato;
• organizzativi: la durata dell’intervento e della degenza o il superamento della degenza attesa.
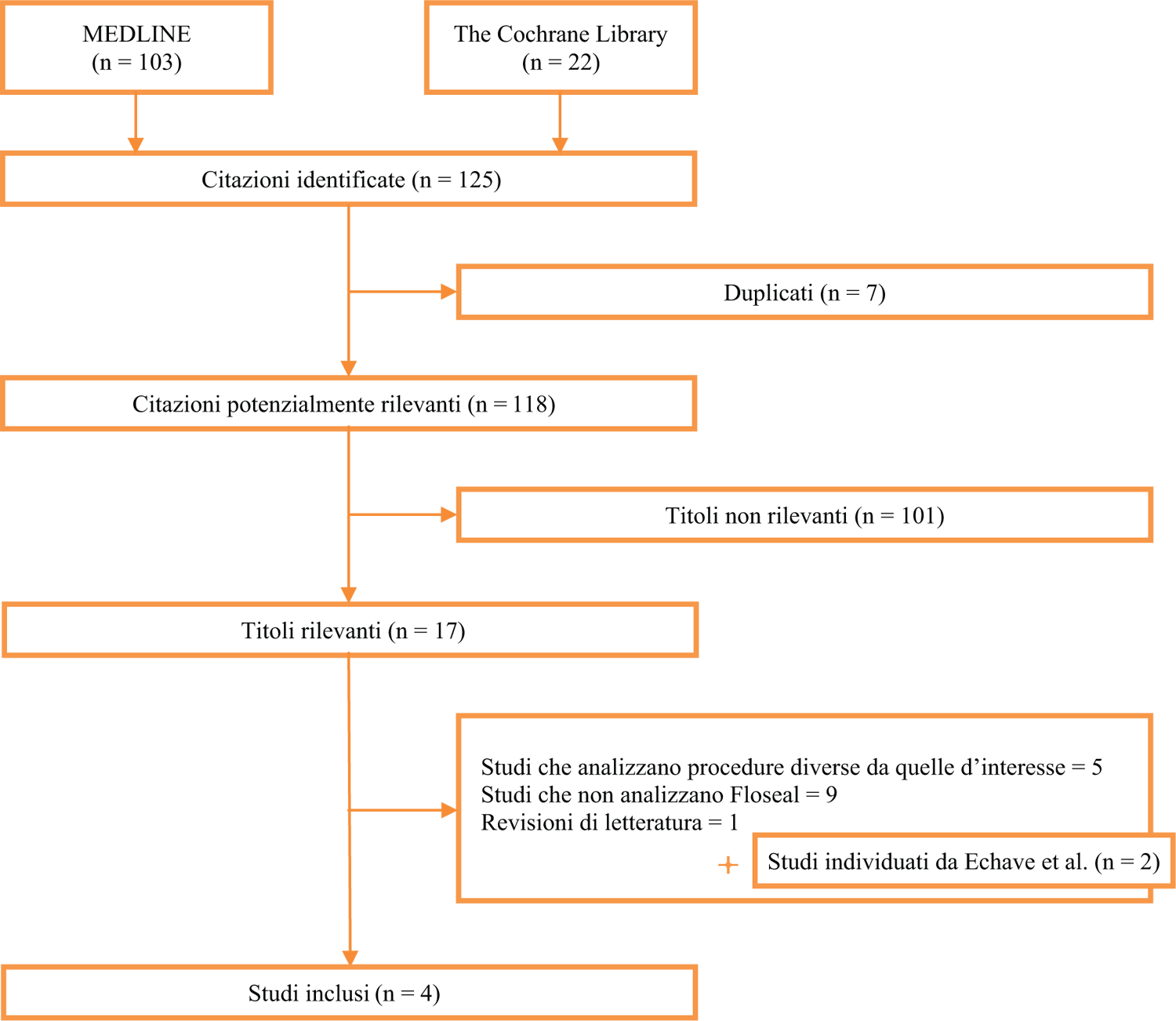
Fig. 1 - Flow chart della ricerca di letteratura
I risultati dei 4 studi disponibili in letteratura sono riportati nella Tabella IV.
La Tabella V riassume e compara le evidenze disponibili per ciascun endpoint considerato. Per la durata delle procedure chirurgiche emergono differenze significative nello studio di Tackett et al. (6), indipendentemente dai confronti effettuati; per gli altri endpoint, le differenze non sono sempre statisticamente significative negli studi selezionati. Solo uno studio [Nasso et al. (8)] fornisce evidenze in merito ai seguenti endpoint: successo e tempo dell’emostasi, entità del sanguinamento, durata della permanenza in terapia intensiva.
Per gli aspetti relativi alla sicurezza, sono stati emanati 2 alert per Floseal® da parte del Ministero della Salute e 1 FDA Recalls & Safety Alert. Mentre Surgiflo® ha avuto 3 FDA Recalls & Safety Alert. L’FDA MAUDE ha emanato 349 report per Floseal® versus i 263 di Surgicel®, i 55 per Gelfoam® e i 9 per Surgiflo®.
Analisi di costo-conseguenza
La revisione di letteratura ha permesso di definire il valore dei parametri utilizzati per l’analisi di costo-conseguenza (Tabella VI). Come in Tackett et al. (6,7), il principale riferimento rimane lo studio di Nasso (8). In aggiunta, per l’adattamento alla realtà italiana sono stati utilizzati i dati resi disponibili dalla Società Italiana di Chirurgia Cardiaca.
Lo studio di Nasso et al. (8) è stato condotto presso il Centro di Ricerche e Formazione ad Alta Tecnologia nelle Scienze Biomediche “Giovanni Paolo II” di Campobasso nel 2005. Si è trattato di uno studio randomizzato controllato, che ha arruolato i pazienti sottoposti a intervento programmato di chirurgia cardiaca primaria (coronarica, valvolare o combinata) e/o chirurgia dell’aorta toracica. Gli agenti emostatici coinvolti sono stati Floseal®, Surgicel e Gelfoam® (Tab. IV).
| Autore, anno Paese | Tipo di studio | Pazienti, Intervento chirurgico | Comparatori (n) | Endpoint primario | Endpoint secondari | Risultati principali |
|---|---|---|---|---|---|---|
| Krishnan et al. 2009 (9)
Stati Uniti |
Analisi retrospettiva di database amministrativi | Pazienti ricoverati e sottoposti a procedura chirurgica, nella quale sia stato utilizzato un solo agente emostatico
Intervento chirurgico: Bypass aorto-coronarico (CABG) Sostituzione di valvola cardiaca Riparazione di valvola cardiaca |
Floseal® (1.603)
Surgicel® + trombina (17.507) Gelfoam® + trombina (10.348) Altri agenti emostatici (baseline-terapia di confronto) (7.492) |
Degenza superiore alla degenza attesa | Degenza superiore al doppio della degenza attesa | Floseal® è stato associato a una minore probabilità di superamento della degenza attesa rispetto al comparatore (OR = 0,791; IC = 0,685-0,914; p < 0,01)
Un minore tasso di pazienti trattati con Floseal® ha superato la degenza attesa rispetto al comparatore (IRR = 0,891; IC = 0,869-0,913; p < 0,01) Un minore tasso di pazienti trattati con Surgiflo® + trombina ha superato del doppio la degenza attesa rispetto al comparatore (IRR = 0,959; IC = 0,932-0,987; p < 0,01) |
| Nasso et al. 2009 (8) Italia | Studio randomizzato controllato | Pazienti sottoposti a chirurgia elettiva
Intervento chirurgico: Chirurgia cardiaca primaria (coronarica, valvolare, o combinata) Chirurgia dell’aorta toracica |
Floseal® (209)
Surgicel® o Gelfoam® (206) |
Tasso di successo nell’ottenimento dell’emostasi
Tempo per l’emostasi Sanguinamento post-operatorio (ml/m2) Numero di trasfusioni di prodotti ematici Necessità di re-intervento chirurgico per sanguinamento |
Degenza in terapia intensiva
Complicanze maggiori (ictus, shock, sepsi o infarto del miocardio) Complicanze minori (insufficienza renale o respiratoria, o supporto inotropo > 24 ore) Mortalità intraoperatoria |
I pazienti trattati con Floseal® hanno presentato maggiori tassi di successo nell’ottenimento dell’emostasi e tempi più corti per il raggiungimento dell’emostasi (p < 0,001), così come tassi di sanguinamento post-operatorio e di trasfusione significativamente minori (p < 0,001)
Non ci sono state differenze significative tra i due gruppi in termini di necessità di re-intervento per sanguinamento. Tuttavia, nell’analisi della sottopopolazione di pazienti che hanno presentato emorragia intraoperatoria, è stato osservato che meno soggetti trattati con Floseal® sono stati sottoposti a re-intervento (4,5% vs 13,5%, p = 0,04) Non vi sono state differenze statisticamente significative tra i due gruppi in termini di degenza in terapia intensiva (p = 0,36), complicanze maggiori (p = 0,95) né mortalità intraoperatoria (p = 0,97) |
| Tackett, Calcaterra, et al. 2014 (6)
Stati Uniti |
Analisi retrospettiva di database amministrativi | Pazienti ospedalizzati a causa di una chirurgia elettiva, di emergenza o di urgenza; a cui sia stata somministrata eparina e protamina
Intervento chirurgico: Bypass aorto-coronarico (CABG) Chirurgia aortica, valvolare, o valvolare con CABG |
Gruppo A:
Floseal® (4.480) Surgiflo® (326) Gruppo B: Floseal® + sigillanti di fibrina, sigillanti, o polvere riassorbibile di polisaccaride emisferico microporoso (MPH) (7.730) Surgiflo® + sigillanti di fibrina, sigillanti, o MPH (646) Gruppo C: Floseal® + Gelfoam® o Surgicel® con o senza trombina (10.180) Surgiflo® + Gelfoam® o Surgicel® con o senza trombina (736) |
Complicanze maggiori
Complicanze minori Necessità di re-intervento per sanguinamento Mortalità Necessità di trasfusione Degenza Durata dell’intervento |
I pazienti trattati con Surgiflo® sono stati associati a rischi significativamente più elevati di complicanze maggiori (OR = 2,21; IC95% = 1,34-3,35; p = 0,001), complicanze minori (OR = 1,84; IC95% = 1,33-2,55; p = 0,001), trasfusioni (OR = 4,90; IC95% = 3,50-6,87; p < 0,001) e maggiore durata dell’intervento (differenza media aggiustata = 64 minuti, p < 0,001) rispetto ai pazienti trattati con Floseal®
I pazienti trattati con Floseal® presentano una minore necessità di re-intervento per sanguinamento rispetto ai pazienti trattati con Surgiflo® (IRR = 2,01; p = 0,04) I pazienti trattati con Floseal® presentano un minore numero di giornate di degenza rispetto a quelli trattati con Surgiflo® |
|
| Tackett, Sugarman, et al. 2014 (7)
Stati Uniti |
Analisi costo-conseguenza
Dati clinici tratti dallo studio di Nasso et al. 2009 |
Pazienti tratti da Nasso et al. 2009 | Matrice emostatica fluida (Floseal®) (600)
Agente emostatico non fluido (Surgicel® o Gelfoam®) (600) |
Costo risparmiato per ogni conseguenza clinica (complicanze gravi, complicanze minori, interventi chirurgici di revisione, trasfusioni, tempo addizionale di utilizzo della sala operatoria) | Numero di eventi evitati per ogni conseguenza | L’utilizzo di una matrice emostatica fluida (Floseal®) negli interventi di cardio-chirurgia, piuttosto che un agente emostatico non fluido ( Surgicel® o Gelfoam®), potrebbe comportare una riduzione di 33 complicanze gravi, 76 complicanze minori, 54 interventi chirurgici di revisione, 194 trasfusioni e 242 ore di tempo di utilizzo della sala operatoria, corrispondenti a un risparmio di 5,38 milioni di dollari |
| Tipologia di studio | RCT | Analisi di database amministrativi | Analisi economica | |||
| Riferimento bibliografico | (8) | (9) | (6) | (7) | ||
| Endpoint | Floseal® vs Surgiflo® | Floseal® vs Surgiflo® con MPH | Floseal® vs Surgiflo® in combinazione con Gelfoam® o Surgicel® | |||
| Mortalità | ||||||
| Complicanze maggiori | ||||||
| Complicanze minori | ||||||
| Successo dell’emostasi | ||||||
| Tempo per l’emostasi | ||||||
| Volume di sangue perso | ||||||
| Re-intervento per sanguinamento | ||||||
| Trasfusioni | ||||||
| Durata della degenza | ||||||
| Degenza in terapia intensiva | ||||||
| Durata della procedura | ||||||
| Quantità di emostatico utilizzata | ||||||
| Costo emostatico | ||||||
| Costo-risparmio | ||||||
| Risultato significativamente migliore del comparatore | Differenza non significativa | Endpoint non analizzato |
Nella presente analisi è stato considerato un ipotetico ospedale italiano con un volume operatorio medio di 665 interventi/anno. Tale valore è stato tratto dai dati di attività disponibili relativi a 23 strutture cardiochirurgiche situate in 16 Regioni italiane (10). Sulla base dello studio di Nasso et al. (8), il numero di pazienti con emorragie intraoperatorie che richiedono il ricorso ad agenti emostatici sarebbe pari a 51,6%, tuttavia le evidenze riportano che l’evoluzione delle tecniche operatorie e dell’expertise degli operatori sta portando a una diminuzione di questa percentuale, come emerge dallo studio di Brouwers et al. (11) relativo a 4 ospedali olandesi. Un confronto con alcuni cardiochirurghi italiani ha ulteriormente confermato questo trend, pur non fornendo valori di riferimento robusti. Gli autori della presente analisi hanno quindi deciso di utilizzare una percentuale di riferimento per il base case pari al 40%, e rispetto a tale valore sono state fatte le opportune variazioni nell’analisi di scenario.
Le componenti di costo considerate sono state:
• il costo dell’intervento chirurgico, per il quale sono state considerate le stime presentate dal Network Italiano Sanitario (N.I.San.) relative al periodo 2011-2012, aggiustate per l’inflazione al 2017, relative al DRG 110 (interventi maggiori sul sistema cardiovascolare senza complicanze) (12);
• il costo delle complicanze, il quale è stato calcolato come la differenza tra il costo assegnato al DRG 111 (interventi maggiori sul sistema cardiovascolare con complicanze) e il costo assegnato al DRG 110 dal N.I.San;
• il costo di sala operatoria, per il quale si è considerato il risultato dell’analisi di Berti et al. (13) basata sui dati di 4 Regioni italiane (Piemonte, Emilia Romagna, Lazio, Sicilia);
• il costo delle trasfusioni di sangue o di emocomponenti, comprendente sia i costi diretti italiani (14) (€ 185,6) sia una stima dei costi indiretti. Shander et al. (15) stima che il costo totale sostenuto a livello ospedaliero possa essere tra 3,2 e 4,8 volte il costo di acquisizione degli emoderivati.
Al fine di verificare la robustezza delle stime, è stata condotta un’analisi di sensibilità multivariata basata su due scenari alternativi. Per la maggioranza dei parametri è stato applicato il range di variabilità adottato da Tackett et al. (6) (±20%).
| Scenario | Referenze | |||
|---|---|---|---|---|
| Base case | Best case | Worst case | ||
| Numero interventi di cardiochirurgia | 665 | 665 | 665 | (10) |
| Pazienti che richiedono un agente emostatico | (8) + (11) + esperti | |||
| % | 40% | 52% | 32% | |
| N. | 266 | 346 | 213 | |
| Parametri clinici | ||||
| Tempo per l’emostasi (min) | (8) | |||
| Floseal® | 32,1 | 29,7 | 34,5 | |
| Comparatore | 56,3 | 59,4 | 53,2 | |
| Minuti evitati | 24,2 | 29,7 | 18,7 | |
| Numero di pazienti che richiedono trasfusioni | (6,7) | |||
| Floseal® | 75 | 77 | 72 | |
| Comparatore | 161 | 250 | 103 | |
| Eventi evitati | 86 | 172 | 31 | |
| Percentuale di pazienti che richiedono trasfusioni | (6,7) | |||
| Floseal® | 28,2% | 29,1% | 27,1% | |
| Comparatore | 60,6% | 93,8% | 38,8% | |
| Eventi evitati | 53,5% | 68,9% | 30,2% | |
| Numero di pazienti che richiedono un re-intervento | (6,7) | |||
| Floseal® | 12 | 12 | 11 | |
| Comparatore | 36 | 56 | 23 | |
| Eventi evitati | 24 | 43 | 11 | |
| Tasso di complicanze minori | (6,7) | |||
| Floseal® | 56 | 57 | 53 | |
| Comparatore | 89 | 138 | 57 | |
| Eventi evitati | 34 | 81 | 4 | |
| Parametri economici | ||||
| Costo dell’intervento chirurgico (€) | (12) | |||
| Con complicanze | 25.585 | 25.585 | 25.585 | |
| Senza complicanze | 13.940 | 13.940 | 13.940 | |
| Costo complicanze | 11.645 | 11.645 | 11.645 | (12) |
| Costo della trasfusione di sangue o di emocomponenti (€) | 742 | 891 | 594 | (14) + (15) |
| Costo orario sala operatoria di cardiochirurgia (€) | 1.046 | 1.046 | 1.046 | (13) |
Le eccezioni sono state: il tempo per l’emostasi, per il quale si è considerato il range di variabilità riportato da Nasso et al. (8); il costo della trasfusione di sangue, per il quale sono stati applicati i valori stimati da Shander et al. (15).
Nella Tabella VI sono riportati i valori dei parametri del modello nello scenario base (base case) e nell’analisi di sensibilità. Per semplificazione si riportano i termini di best e worst case scenario per Floseal®, corrispondenti al valore minimo e massimo adottati nell’analisi di sensibilità per i diversi parametri.
L’analisi di costo-conseguenza che ha considerato un ipotetico ospedale con 665 interventi di cardiochirurgia in un anno, di cui 266 con utilizzo di un agente emostatico, giunge a stimare una minore quantità di complicanze maggiori, complicanze minori, re-interventi chirurgici per sanguinamento, trasfusioni di sangue e ore di sala operatoria grazie a Floseal®.
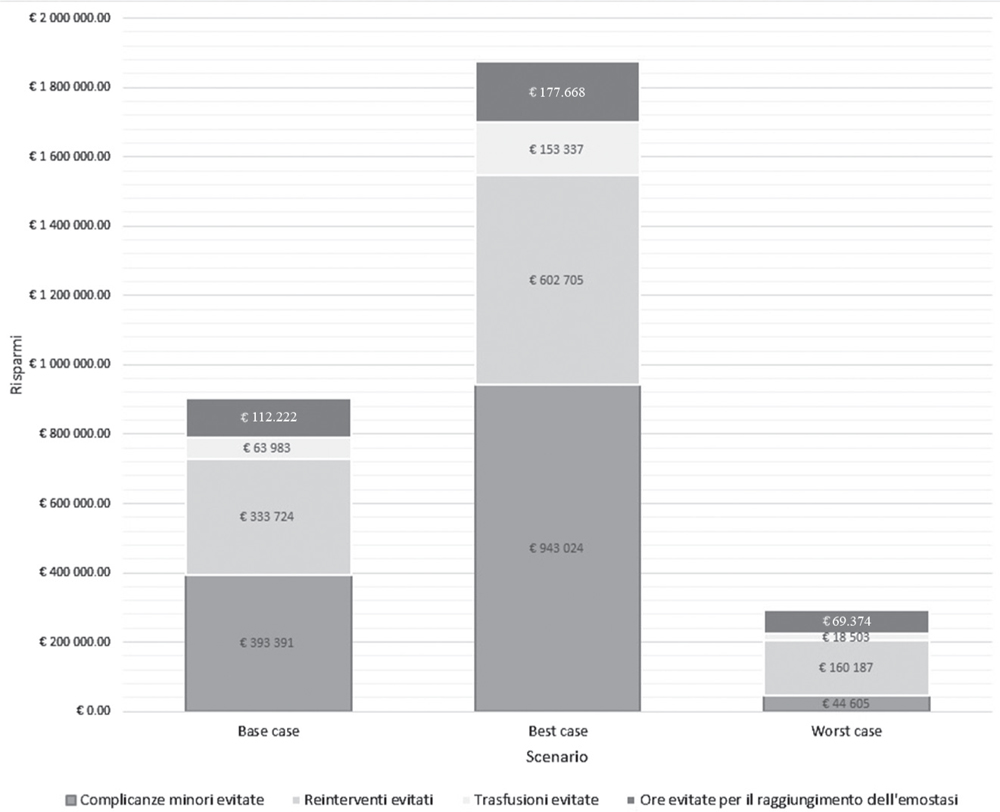
Fig. 2 - Risultati dell’analisi di costo conseguenza: risparmi per voce di costo negli scenari ipotizzati.
Nel base case, il risparmio complessivo è stimato in € 903.320, pari a € 1.358 a paziente (Fig. 2). Quasi la metà del risparmio potenziale (44%) è attribuibile alla minore incidenza di complicanze minori. Il minore ricorso a re-interventi incide per il 37%. Meno rilevanti i risparmi attesi legati all’inferiore tempo per l’emostasi (12%) e alle meno frequenti trasfusioni (7%).
Dall’analisi di scenario (Fig. 2) emerge una variabilità del risparmio per paziente sottoposto a intervento di chirurgia cardiaca compreso nel range di € 441-2.831. L’incidenza delle varie voci di costo varia, date le assunzioni fatte, ma risulta confermato il ruolo chiave svolto dai re-interventi. Nel worst case scenario il tempo per l’emostasi (24%) incide sui risparmi attesi più delle complicanze minori (15%).
Discussione
L’utilizzo degli agenti emostatici è diffuso in chirurgia cardiaca oltre che vascolare, ortopedica, spinale, addominale e della tiroide. Il lavoro presentato ha scelto di limitarsi alla sola chirurgia cardiaca, focalizzandosi sul valore aggiunto di Floseal® rispetto alle principali alternative attualmente utilizzate nella pratica clinica. Inoltre, l’attenzione è stata concentrata sui domini dell’efficacia reale, della sicurezza e dell’impatto economico.
Dalla revisione della letteratura emergono differenze significative tra gli studi in termini di disegno e dimensione, popolazione analizzata, interventi e comparatori, endpoint, risultati raggiunti e loro robustezza. Risulta confermata la necessità di ulteriori RCT per Floseal®, ma si tratta di una carenza in comune con gli altri agenti emostatici utilizzati in cardiochirurgia (4). Tale variabilità metodologica incide sulla robustezza delle evidenze disponibili e giustifica la scelta di condurre una comparazione uno-a-molti e una simulazione circa l’impatto economico di Floseal®.
La revisione di letteratura ha permesso di individuare 4 studi: lo studio di Nasso et al. (8) è l’unico studio randomizzato e controllato disponibile; gli studi di Krishnan et al. (9) e Tackett et al. (6) si basano su database amministrativi; l’unico studio di tipo economico (7) è stato, invece, adottato come riferimento per l’analisi di costo-conseguenza.
La Tabella IV mette in evidenza come la scelta degli endpoint vari da studio a studio. Le evidenze disponibili (Tab. IV), considerate congiuntamente, dimostrano che i principali benefici associati all’utilizzo di Floseal® sono una minore incidenza di complicanze minori (insufficienza renale o respiratoria, o supporto inotropo > 24 ore) e maggiori (ictus, shock, sepsi o infarto del miocardio) (6,8), ridotti tempi di sala operatoria, grazie al più rapido raggiungimento dell’emostasi, e un minore ricorso a re-interventi e trasfusioni.
La riduzione dei tempi di sala operatoria associata all’uso di Floseal® risulta in media di 24 minuti nei pazienti con emorragia intraoperatoria e di 18 minuti in quelli sottoposti a ipotermia sistemica (8). Analogamente, nell’analisi condotta su un database amministrativo (6) considerando i pazienti sottoposti a chirurgia cardiaca emerge una riduzione nei tempi di sala (differenza aggiustata 18-64 minuti). Non emergono invece stime robuste riguardanti la riduzione della durata della degenza ospedaliera (9).
Si osserva che nessuno studio di superiorità ha coinvolto Floseal®. Lo stesso studio di Nasso et al. (8) mira a valutare una differenza statisticamente significativa tra gli agenti emostatici considerati, di conseguenza gli studi permettono di individuare solamente differenze statisticamente (o non statisticamente) significative.
Sulla base delle evidenze di letteratura è stata condotta un’analisi di simulazione di costo-efficacia contestualizzata alla realtà clinica italiana. Tale analisi permette di evidenziare i potenziali benefici economici associati all’utilizzo routinario di Floseal® giungendo a conclusioni coerenti con quelle dell’analisi di Tackett et al. (7). Negli Stati Uniti sono stati stimati costi differenziali totali pari a USD 5,38 milioni (circa € 4,8 milioni). La presente analisi stima, a livello di singolo ospedale, un risparmio annuo di € 903.320 nello scenario base (€ 1.358 per paziente). L’analisi di sensibilità dimostra che il ricorso a Floseal® permette di conseguire comunque dei risparmi a livello di singolo paziente compresi tra € 441 ed € 2.831.
Anche nei lavori di Makhija et al. si giunge a un’analoga stima di risparmio adattando lo stesso modello economico agli ospedali statunitensi (16). A differenza della presente analisi che ha considerato una struttura media e ipotetica, Makhija et al. ha sfruttato i dati di attività e di costo contenuti nel database NIS (National Inpatient Sample) (16).
Anche Joshi et al., sempre tramite lo stesso modello di costo-conseguenza, giunge a stimare, per il Regno Unito, una riduzione dei costi grazie a Floseal® di circa £ 1.783 per paziente (17). Tale risparmio deriva dalle complicanze evitate (n = 18,2, £ 83.536 per 100 pazienti), dal minore tempo di sala operatoria (–40,3 ore, £ 63.969) e dal minore ricorso a re-interventi a seguito di sanguinamento (n = 9, £ 34.038).
L’analisi di costo-conseguenza presenta comunque delle limitazioni basandosi su una semplificazione della realtà clinica e organizzativa. Di conseguenza, ha richiesto il ricorso ad assunzioni in merito alle componenti di costo e ai tempi di sala operatoria. È stato ipotizzato che l’agente emostatico utilizzato influisca sul costo dell’intervento chirurgico, delle complicanze e sul numero e l’entità delle trasfusioni di sangue ed emocomponenti. Inoltre, si è anche presupposto che le differenze nei tempi di sala operatoria siano dovute unicamente all’agente emostatico utilizzato.
Rappresenta un punto di forza dello studio il tentativo di reperire dati specifici del contesto italiano, sebbene debbano essere aggiornate le stime del costo dell’intervento chirurgico. Le stime impiegate nel nostro modello, comunque, sono rappresentative di 23 Strutture cardiochirurgiche localizzate in 16 Regioni.
L’analisi di scenario conferma le conclusioni a cui si giunge in termini di risparmio atteso. Ogni scenario rappresenta un’analisi multivariata deterministica di sensibilità, focalizzata sui parametri – clinici ed economici – direttamente ricollegabili al rischio di sanguinamenti e trasfusioni. Tuttavia, per una più puntuale quantificazione del risparmio associato all’impiego di Floseal® si riconosce la necessità di raccogliere e analizzare dati real world relativi a diverse strutture ospedaliere italiane. Inoltre, l’analisi ha considerato globalmente tutti gli interventi di cardiochirurgia, senza nessuna ulteriore specifica. Implicitamente si è assunto che la distribuzione per tipologia di interventi in un ospedale italiano ricalchi quella presente nell’articolo di Nasso et al. (8) (36% procedure coronariche, 29% vascolari, 17% interventi sull’aorta e 18% procedure combinate).
Il modello, ampiamente utilizzato in letteratura, non considera, infine, il prezzo di acquisto degli agenti emostatici e i relativi volumi di utilizzo. I risparmi stimati da tutte le analisi disponibili sono comunque di un’entità tale da compensare ogni verosimile differenziale di prezzo e consumo. L’analisi di sensibilità ha coinvolto anche tale parametro e ha tenuto conto dell’analisi di activity based costing condotta da Shander et al. (15) che, in aggiunta al costo diretto di acquisizione dei prodotti emoderivati, ha considerato tutti i costi ausiliari o indiretti sostenuti da una struttura ospedaliera.
L’analisi infine, basandosi sullo studio di Nasso et al. (8), confronta Floseal® con Surgicel® e Gelfoam® che si ipotizza abbiano uguale efficacia. Sebbene manchino trial di confronto diretto, gli studi in vitro disponibili supportano tale confronto (18).
Conclusione
La valutazione dell’utilizzo di Floseal® in cardiochirurgia conferma i benefici clinici correlati all’utilizzo della matrice emostatica di gelatina di origine bovina e trombina di origine umana, e identifica e stima le possibili ripercussioni positive a livello organizzativo ed economico.
Ringraziamenti
The authors would like to acknowledge Dott. Marco Marchetti for his contributions in the definition of methods.
Disclosures
Financial support: The study was funded by Baxter S.p.A.
Conflict of interest: The authors declare that there is no conflict of interest.
Bibliografia
- 1. Stokes ME, Ye X, Shah M et al. Impact of bleeding-related complications and/or blood product transfusions on hospital costs in inpatient surgical patients. BMC Health Serv Res. 2011 May 31;11:135.
- 2. Spotnitz WD, Burks S. State-of-the-art review: hemostats, sealants, and adhesives II: update as well as how and when to use the components of the surgical toolbox. Clin Appl Thromb Hemost. 2010 Oct;16(5):497-514.
- 3. Vyas KS, Saha SP. Comparison of hemostatic agents used in vascular surgery. Expert Opin Biol Ther. 2013 Dec;13(12):1663-72.
- 4. Bracey A, Shander A, Aronson S et al. The use of topical hemostatic agents in cardiothoracic surgery. Ann Thorac Surg. 2017 Jul;104(1):353-60.
- 5. Echave M, Oyagüez I, Casado MA. Use of Floseal®, a human gelatine-thrombin matrix sealant, in surgery: a systematic review. BMC Surg. 2014 Dec 20;14:111.
- 6. Tackett SM, Calcaterra D, Magee G, Lattouf OM. Real-world outcomes of hemostatic matrices in cardiac surgery. J Cardiothorac Vasc Anesth. 2014 Dec;28(6):1558-65.
- 7. Tackett SM, Sugarman R, Kreuwel HT et al. Hospital economic impact from hemostatic matrix usage in cardiac surgery. J Med Econ. 2014 Sep;17(9):670-6.
- 8. Nasso G, Piancone F, Bonifazi R et al. Prospective, randomized clinical trial of the FloSeal matrix sealant in cardiac surgery. Ann Thorac Surg. 2009 Nov; 88(5):1520-6.
- 9. Krishnan S, Conner TM, Leslie R et al. Choice of hemostatic agent and hospital length of stay in cardiovascular surgery. Semin Cardiothorac Vasc Anest. 2009 Dec;13(4):225-30.
- 10. Società Italiana di Chirurgia Cardiaca. Elenco delle Strutture Cardiochirurgiche. https://www.sicch.it/strutture-cardiochirurgiche
- 11. Brouwers C, Hooftman B, Vonk S et al. Benchmarking the use of blood products in cardiac surgery to stimulate awareness of transfusion behaviour: results from a four-year longitudinal study. Neth Heart J. 2017 Mar;25(3):207-14.
- 12. Network Italiano Sanitario (N.I.San.). Costi standard, la proposta N.I.San: 579 dati aggregati per DRG e per tipo di ricovero elaborati da 22 aziende sanitarie pubbliche e private sul biennio 2011-2012. Il Sole 24 Ore Sanità, 18-24 novembre 2014.
- 13. Berti E, Fortuna D, Bartoli S et al. I costi di ricovero e follow-up delle procedure di sostituzione valvolare aortica per via percutanea e cardiochirurgica a confronto: analisi secondo le prospettive del Sistema Sanitario Regionale e dell’Ospedale. G Ital Cardiol. 2016;17(12 Suppl 1):22S-30S.
- 14. Ruscitti G. Tutti i costi delle trasfusioni. Il Sole 24 Ore Sanità,1-7 luglio 2008.
- 15. Shander A, Hofmann A, Ozawa S et al. Activity-based costs of blood transfusions in surgical patients at four hospitals. Transfusion. 2010 Apr;50(4):753-65.
- 16. Makhija D, Rock M, Xiong Y et al. Cost-consequence analysis of different active flowable hemostatic matrices in cardiac surgical procedures. J Med Econ. 2017 Jun;20(6):565-73.
- 17. Joshi MR, Latham J, Okorogheye G. Use of a flowable haemostat versus an oxidised regenerated cellulose agent in primary elective cardiac surgery: economic impact from a UK healthcare perspective. J Cardiothorac Surg. 2017 Nov 29;12(1):107.
- 18. Wagner WR, Pachence JM, Ristich J, Johnson PC. Comparative in vitro analysis of topical hemostatic agents. J Surg Res. 1996 Dec;66(2):100-8.