 |
Glob Reg Health Technol Assess 2020; 7(1): 1-8 DOI: 10.33393/grhta.2020.557 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di minimizzazione dei costi di una strategia di test preventivo per le familiari di pazienti con carcinoma dell’ovaio BRCA mutato
A cost-minimization analysis of a preventive testing strategy for relatives of patients with BRCA mutated ovarian cancer
Purpose: This study aims to estimate the cost-minimization strategy of a preventive testing strategy destined to relatives of patients with BRCA mutated cancer versus a no test strategy in Italia.
Methods: A BRCA testing pathway was designed by a panel of experts based on the MSTM Excel (2010) tool; the analysis was carried out considering the perspective of the Italian National Health Service. Two alternatives were considered: 1) preventive BRCA testing for relatives of patients affected by ovarian cancer carrying a BRCA1/BRCA2 mutation; 2) no test. Cost and effectiveness data, derived from literature and published sources validated by a Board of experts, were discounted using a discount factor equal to 3%. Probabilistic sensitivity analysis was performed.
Results: Considering an average cost of therapy for breast and ovarian cancer major of €90,000.00 per case, the economic impact related to the preventive testing strategy are equal to –€17,814,767.25. The sensitivity analysis confirms these results in the totality of the simulations performed.
Conclusions: Preventive genetic testing in relatives of patients affected by ovarian cancer is cost-effective and represents a sustainable cost for the National Healthcare System in Italia, also in the light of its reference values.
Keywords: Costs, Healthcare expenditure, Ovarian cancer, Test BRCA
Received: November 22, 2019
Accepted: February 12, 2020
Published online: April 4, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu.
Introduzione
In Italia per l’anno 2016 si stima un numero di nuovi casi di tumore all’ovaio pari a 5200 (1), il 60% dei quali è rappresentato da neoplasie epiteliali (2). Di queste, si stima che almeno il 5-10% (1) abbia una base ereditaria, principalmente associata alla presenza di varianti patogenetiche germinali dei geni BRCA1 e BRCA2 (di seguito indicate come “mutazioni BRCA”). Studi più recenti sembrano tuttavia dimostrare che le pazienti affette da carcinoma ovarico abbiano una prevalenza di mutazione BRCA superiore al 10% (3,4); in particolare, nell’istotipo sieroso di alto grado si osservano più del 20% di casi con mutazione, anche se in assenza di una chiara storia familiare (4,5).
L’identificazione della predisposizione ereditaria BRCA-relata in un individuo mediante il test genetico BRCA (ha un’importante ricaduta sociale, perché rende possibile individuare nell’intera famiglia altre donne portatrici di mutazione, le quali possono accedere a misure di riduzione del rischio mirate a evitare l’insorgenza della neoplasia e/o una diagnosi tardiva della stessa.
Il rischio di sviluppare nella vita un cancro ovarico è pari all’1,8% nella popolazione generale (2), mentre le donne con mutazione BRCA hanno un rischio molto maggiore di sviluppare cancro ovarico, pari al 20-60% (2). Inoltre, avendo il carcinoma ovarico una sintomatologia aspecifica e tardiva, la maggior parte delle pazienti diagnosticate (75-80%) risulta essere in uno stadio avanzato secondo la classificazione dell’International Federatian of Gynecologists and Obstetricians (FIGO) (III-IV stadio) (1,2). In assenza di una strategia di diagnosi precoce efficace, alle donne con rischio BRCA-associato che abbiano completato il progetto di maternità viene consigliato di effettuare una salpingo-ooforectomia profilattica a partire dai 35-40 anni. È dimostrato infatti che questo intervento ne riduce in modo significativo la mortalità per neoplasia sia ovarica che mammaria (6). Le donne con mutazione BRCA presentano anche un rischio molto elevato di sviluppare tumore della mammella, circa 70% (7), e anche per questa neoplasia sono stati creati dei percorsi di prevenzione al fine di consentire alle donne di intraprendere programmi mirati di diagnosi precoce (risonanza magnetica mammaria) o di riduzione del rischio (mastectomia bilaterale, ovariectomia profilattica).
Infine, il test BRCA ha anche una validità prognostica (8) per l’andamento clinico della malattia e, recentemente, è divenuto anche un test predittivo di risposta ai farmaci per le pazienti con carcinoma ovarico sieroso di alto grado (9,10). Pertanto, come indicato nelle Linee guida AIOM - SIGU - SIBIOC - SIAPEC-IAP (11), per tutte le pazienti con carcinoma ovarico non mucinoso e non borderline è importante effettuare il test BRCA già alla diagnosi di malattia, per una corretta programmazione terapeutica. Attualmente, in assenza di linee guida nazionali, l’accesso al test BRCA in Italia avviene in modo disomogeneo, da Regione a Regione e anche all’interno della stessa Regione. In molte Regioni italiane non sono ancora delineati percorsi diagnostico-molecolari e vi sono inoltre importanti differenze tra le tariffe di rimborsabilità delle Regioni. Inoltre, le infrastrutture di laboratorio presenti sul territorio hanno capacità differenti di gestione dei volumi di lavoro richiesti dal test.
Alla luce dei dati sulla sopravvivenza globale a 5 anni delle pazienti affette da tumori ovarici epiteliali maligni, pari al 20-40% allo stadio III e al 10% allo stadio IV (2), e in relazione alla sintomatologia tardiva che evidenzia uno stadio avanzato, è fondamentale garantire un accesso tempestivo al test genetico BRCA sia per le pazienti sia per le familiari delle stesse. Lo studio realizzato si pone come obiettivo il confronto di una strategia che prevede di testare a scopo preventivo le familiari sane delle pazienti con carcinoma ovarico positive alla mutazione BRCA – denominata strategia test –, rispetto a una strategia di attesa in cui non viene effettuato alcun test a scopo preventivo – denominata strategia no test –. Lo studio stima le differenze nei costi delle due strategie per la gestione di pazienti con carcinoma ovarico e mammario e l’efficacia in termini di casi evitati. Lo studio non si focalizza sulle diverse tipologie di trattamento farmacologico bensì sulle differenze economiche e gestionali derivanti dall’applicazione o meno di una strategia preventiva di test genetico. L’obiettivo, inoltre, è raccogliere delle iniziali evidenze per creare una base informativa utile per decisioni di programmazione regionale, per l’implementazione di potenziali tariffe e per favorire l’utilizzo del test BRCA a scopo preventivo nella popolazione di donne che sono consanguinee, estendendolo anche alle familiari delle pazienti con cancro ovarico.
Metodi
È stato sviluppato un modello decisionale ad albero in Microsoft Excel (2010) che simula gli scenari relativi a un familiare a rischio di cancro ovarico o mammario. Il modello, rappresentato nella Figura 1, è stato costruito partendo dal modello di Manchanda et al., 2015 (12) già presente in letteratura in cui viene delineato un braccio caso (strategia test) e un braccio controllo (strategia no test). Il modello è stato adattato prevedendo uno screening di partenza alle malate e conseguentemente uno screening alle familiari con BRCA positivo. Questo adattamento ha reso il modello consequenziale e più vicino al contesto reale. L’orizzonte temporale del modello è pari a 5 anni. La struttura del modello è stata rivista da un Board scientifico, riunitosi due volte, così composto: 1 farmaco-economista, 1 igienista, 1 epidemiologo, 2 oncologi, 1 genetista, 1 medico esperto di prevenzione, 1 bioeticista e 1 associazione pazienti. Il gruppo di lavoro ha raccolto le evidenze in un questionario che è stato somministrato all’Advisory Board per la validazione dei dati utilizzati e discusso in modalità plenaria nei due incontri.
In particolare, il Board ha fornito indicazioni in merito alla strutturazione degli snodi decisionali dell’albero, all’identificazione dei vari scenari e all’identificazione, misurazione e valorizzazione delle risorse assorbite per ogni scenario previsto dal modello.
In particolare, l’Advisory Board ha validato delle ipotesi che sono alla base del modello: l’orizzonte temporale è fissato a 5 anni in quanto è quello più congruo alla valutazione della storia naturale della patologia; il carcinoma mammario viene inserito nello studio in quanto la mutazione BRCA di pazienti affette da carcinoma ovarico può causare anche il carcinoma mammario, tuttavia la popolazione di partenza dello studio riguarda esclusivamente le pazienti con carcinoma ovarico; il numero medio di familiari per pazienti sottoposte allo screening genetico è pari a 2.
Le analisi sono state condotte sulla media di frequenze per esami e visite mediche riportate nell’Advisory Board e moltiplicate per le tariffe nazionali.
Popolazione target
La popolazione considerata nel modello, ovvero 3.120 pazienti eleggibili per il test BRCA, rappresenta una stima di nuovi casi di tumore ovarico epiteliale maligno in Italia nel 2016 (1) e rappresentano il 60% delle pazienti con tumore ovarico. La popolazione di partenza è formata dalle pazienti con carcinoma ovarico (2) che si sottopongono al test BRCA. Per ogni paziente positiva al test (3), abbiamo ipotizzato che 2 familiari si sottoponessero a loro volta al test BRCA. In seguito al test, le familiari con gene BRCA1 e/o gene BRCA2 mutato (13) possono decidere di sottoporsi a interventi profilattici, quali la mastectomia (14) e la salpingo-ooforectomia (6), che comportano una riduzione del rischio di sviluppare cancro della mammella e dell’ovaio.
A valle del percorso disegnato, i nodi terminali dell’albero sono rappresentati da: no cancro delle ovaie e/o della mammella, cancro delle ovaie e cancro della mammella.
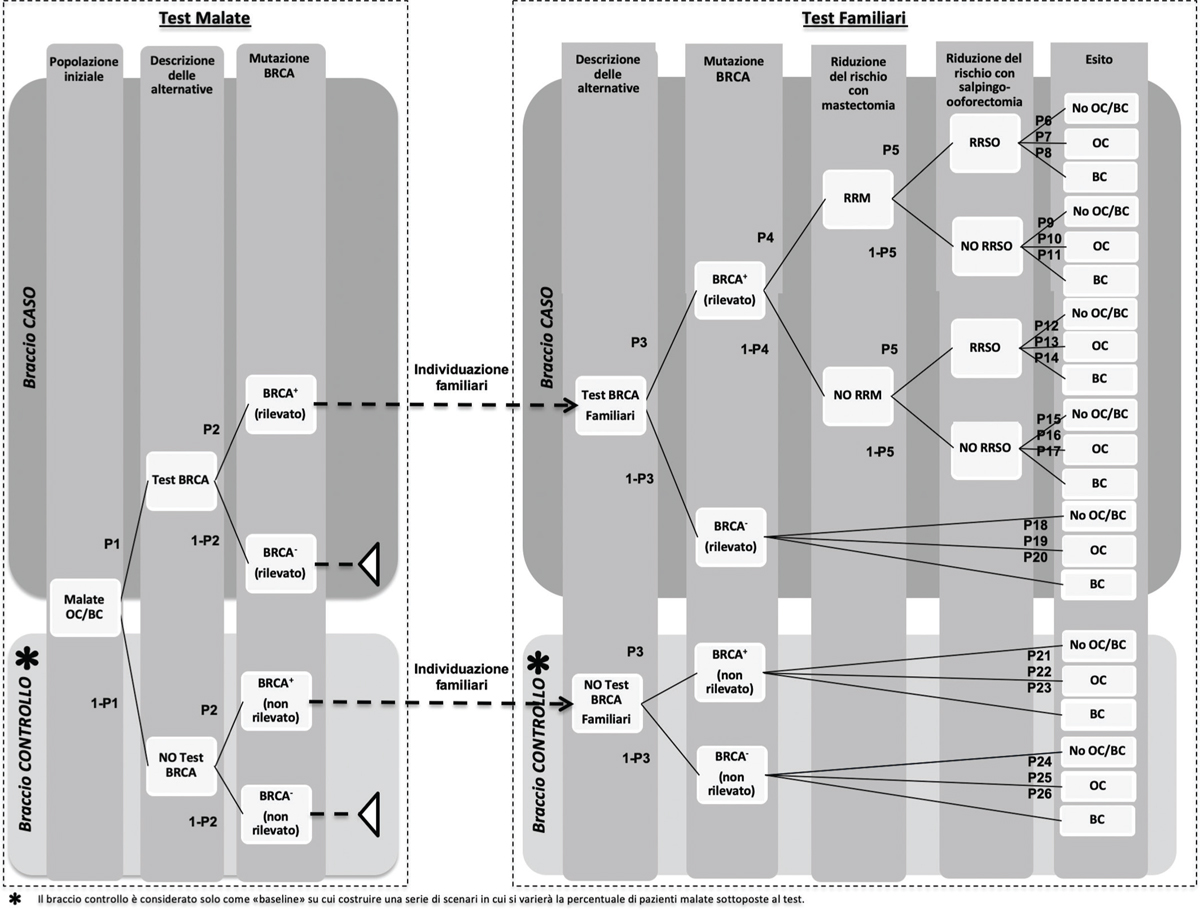
Fig. 1 - Albero decisionale. BC = breast cancer; OC = ovarian cancer
Fonte: adattato da Manchanda et al., 2014 (12)
Nodi probabilistici
Nella Tabella I sono rappresentate le probabilità utilizzate per popolare il modello sopra descritto. I dati delle probabilità di efficacia nei diversi scenari che potevano rappresentarsi in base allo snodo decisionale derivano dalla letteratura (3,12-15). I nodi probabilistici rappresentativi dell’efficacia ripercorrono la storia naturale della malattia differenziando il gruppo sottoposto al test da quello non sottoposto al test. I nodi probabilistici vengono individuati in corrispondenza di un’incertezza di esito clinico che viene rappresentata per il tramite di probabilità.
Costi e valorizzazione delle risorse consumate
Per quantificare l’impatto economico della gestione delle pazienti con cancro delle ovaie e/o cancro della mammella in Italia, è stata applicata la metodologia dell’Activity-Based Costing (ABC). Attraverso questa metodologia è stato stimato il costo medio di gestione per paziente (composto dai costi di somministrazione del test genetico BRCA, dai costi medi del trattamento farmacologico e dai costi dei trattamenti chirurgici della mastectomia e della salpingo-ooforectomia). Le risorse utilizzate durante la gestione del cancro ovarico e mammario (farmaci, esami di laboratorio e strumentali, visite mediche, trattamenti chirurgici) sono state individuate dal Board scientifico e sono state valorizzate utilizzando i prezzi vigenti e le tariffe ospedaliere di competenza nazionali e regionali (16-23).
Nella Tabella II vengono elencate le tariffe del test BRCA (16) alle pazienti diagnosticate (€1.800,00) e alle loro familiari (€100,00), rispettivamente in essere nel Nomenclatore tariffario ospedaliero della Regione Lombardia. La differenza di costo del test tra le pazienti diagnosticate e le loro familiari è così significativa poiché il test alle pazienti va ad indagare l’intera sequenza codificante dei due geni (che corrisponde a numerosi singoli frammenti da sequenziare) alla ricerca dell’eventuale variante patogenetica, mentre nelle familiari la variante da indagare è nota (quindi vi è necessità di sequenziare un solo frammento genico). Le tariffe applicate in questo modello non sono uguali alle tariffe delle altre Regioni, infatti nel corso dello studio è stata evidenziata una forte disomogeneità delle tariffe nelle Regioni italiane. Abbiamo tuttavia utilizzato le tariffe della Regione Lombardia per prediligere un approccio di tipo conservativo, essendo le tariffe di rimborsabilità ad oggi più alte in Italia nei Tariffari consultabili.

Nella Tabella III vengono elencate le prestazioni e i trattamenti farmacologici legati alla gestione del cancro dell’ovaio e della mammella rispettivamente.
Il costo della gestione del cancro dell’ovaio deriva maggiormente dai costi del trattamento farmacologico disponibile, così come per il costo della gestione del cancro della mammella. Un’altra parte dei costi che compongono la spesa totale della gestione, sia del cancro dell’ovaio sia del cancro della mammella, deriva dal set di prestazioni (visite specialistiche, ecografie, esami radiografici, biopsie) erogate durante la fase di gestione della malattia. Infine, anche se non tutte le pazienti accedono alla chirurgia preventiva, l’accesso alla mastectomia e alla salpingo-ooforectomia hanno un peso importante nel costo totale. Nel nostro modello non sono stati inclusi i costi indiretti per il calcolo delle perdite di produttività.
| Item di costo | Tariffa unitaria | Frequenza | Totale | Fonte |
|---|---|---|---|---|
| Test BRCA | €1.800,00 | 1 | €1.800,00 | Nomenclatore tariffario ospedaliero Regione Lombardia (16) |
| Test BRCA familiari | €100,00 | 1 | €100,00 | Nomenclatore tariffario ospedaliero Regione Lombardia (16) |
| Interventi su utero e annessi non per neoplasie maligne senza cc | €3.027,00 | 1 | €3.027,00 | Nomenclatore tariffario dell’assistenza specialistica ambulatoriale Ministero della Salute (17) |
| Mastectomia totale per neoplasie maligne senza cc | €3.341,00 | 1 | €3.341,00 | Nomenclatore tariffario dell’assistenza specialistica ambulatoriale Ministero della Salute (17) |
| Costo gestione cancro delle ovaie | Totale costo |
|---|---|
| Visite mediche | €785,08 |
| Test diagnostici/radiologici e di laboratorio | €2.445,35 |
| Interventi chirurgici | €9.818,00 |
| Trattamenti farmacologici | €76.315,00 |
| Costo totale gestione cancro delle ovaie | €89.363,43 |
| Costo gestione cancro della mammella | Totale costo |
| Visite mediche | €785,08 |
| Test diagnostici/radiologici e di laboratorio | €1.823,38 |
| Interventi chirurgici | €3.948,00 |
| Trattamento per Her2-positivo | €45.672,00 |
| Trattamento per Her2-negativo | €50.947,50 |
| Costo totale gestione cancro della mammella | €103.175,96 |
Analisi di sensibilità
Per verificare la solidità dei risultati e l’impatto sulla spesa sanitaria dell’estensione del test genetico alle familiari delle pazienti con BRCA mutato, è stata eseguita un’analisi di sensibilità multivariata sulle probabilità di transizione, sui driver dei costi e sulle tariffe del test alle malate e alle familiari. Sono state effettuate 10.000 iterazioni del modello variando casualmente e in modo simultaneo i valori dei parametri utilizzando la variabile beta per le probabilità di transizioni e la variabile gamma per i costi.
Risultati
Caso base
Dai risultati del modello, applicando la strategia test alle pazienti e alle familiari delle stesse, si evidenzia un incremento del numero dei casi di donne che non hanno cancro ovarico e/o mammario perché sottoposte a strategie di prevenzione come la mastectomia e la salpingo-ooforectomia. Al contempo, sempre nella Figura 2, si registra un decremento sia dei casi di cancro ovarico sia dei casi di cancro mammario rispettivamente di 81 e 170 casi. Nella Tabella IV vengono elencati i costi legati alla strategia test applicata alle pazienti e alle familiari (€5.719.584,00) e i costi legati al relativo trattamento dei casi intercettati tramite test genetico, quindi agli interventi chirurgici come la mastectomia e la salpingo-ooforectomia (€1.762.051,89). Continuando l’analisi dei costi, si evince una diminuzione dei costi per il trattamento dei casi di cancro ovarico e cancro della mammella pari a €7.052.221,00 e €18.244.182,13 rispettivamente.
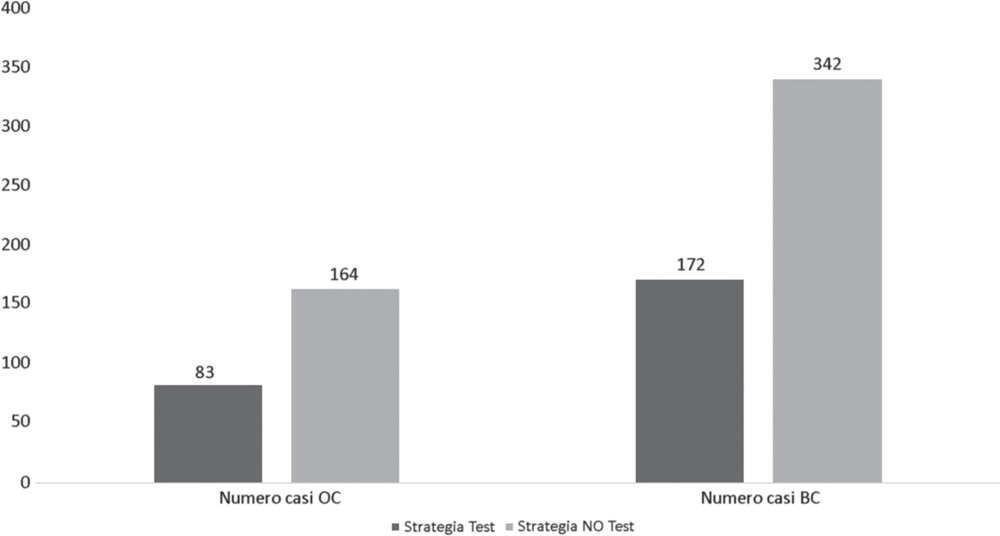
Fig. 2 - Distribuzione della popolazione rispetto all’applicazione del test genetico versus strategia di attesa. BC = breast cancer; OC = ovarian cancer
Fonte: nostra elaborazione
| Costo | Strategia Test | Strategia NO Test | Differenziale |
|---|---|---|---|
| Test | €5.719.584,00 | €0,00 | €5.719.584,00 |
| No OC/BC | €1.762.051,89 | €0,00 | €1.762.051,89 |
| OC | €7.131.492,40 | €14.183.713,41 | –€7.052.221,00 |
| BC | €18.442.244,36 | €36.686.426,49 | –€18.244.182,13 |
| Totale costi | €33.055.372,65 | €50.870.139,90 | –€17.814.767,25 |
BC = breast cancer; OC = ovarian cancer
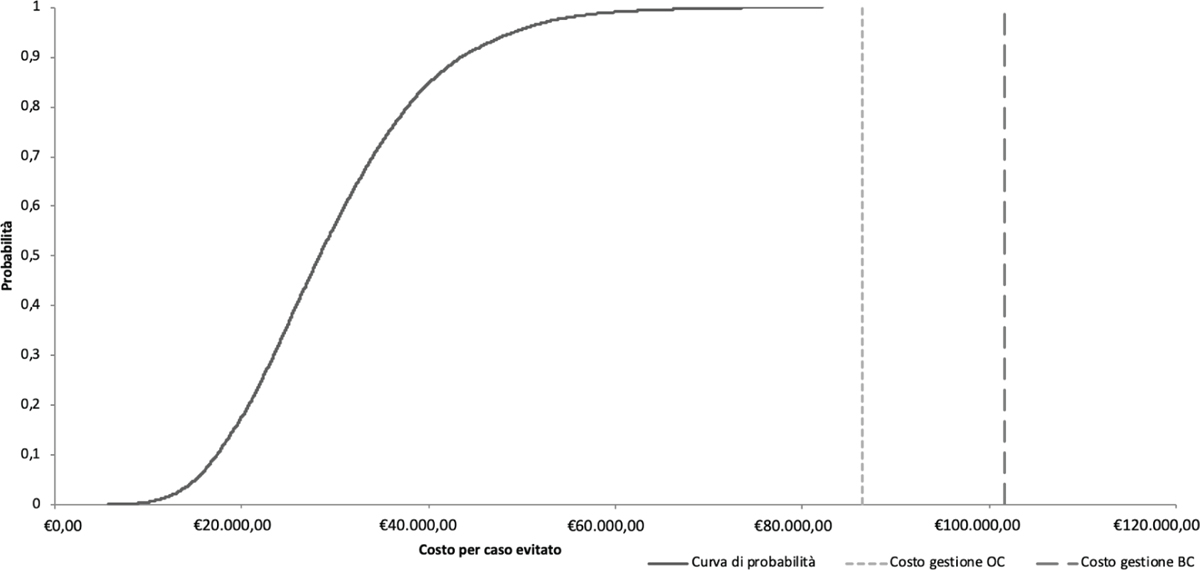
Fig. 3 - Curva di probabilità costo-efficacia. BC = breast cancer; OC = ovarian cancer
Fonte: nostra elaborazione
Si evidenzia che a fronte di un investimento iniziale pari a €5.719.584,00, su una popolazione target di 3.120 nuovi casi stimati per l’anno 2016, il risparmio di risorse economiche, dovuto ai casi evitati di carcinomi dell’ovaio e della mammella, risulta pari a –€17.814.767,25.
Risulta cost-saving attuare la strategia di estensione del test rispetto alla gestione futura di un maggior numero di casi di cancro dell’ovaio e della mammella, considerando un costo di gestione medio del carcinoma dell’ovaio pari a €89.363,43 (Tabella III) e un costo di gestione medio del cancro della mammella pari a €103.175,96 (Tabella III).
Analisi di sensibilità
Per eseguire l’analisi di sensibilità probabilistica, sono stati considerati tutti i parametri di costo e le probabilità di transizione incluse nell’albero decisionale. Le simulazioni effettuate attraverso l’analisi di costo-efficacia sono state ordinate e presentate nella Figura 3. Le simulazioni servono a mappare l’incertezza dei risultati in modo probabilistico. Nel 100% dei casi effettuare il test genetico sia alle donne con tumore dell’ovaio diagnosticato sia alle familiari risulta cost-saving. In particolare, queste 10.000 simulazioni si collocano sempre al di sotto dei due threshold presentati nella Figura 3 che corrispondono al costo che il Sistema Sanitario Nazionale dovrebbe sostenere per la gestione di pazienti con tumore dell’ovaio (€89.363,43) e/o tumore della mammella (€103.175,96).
Discussioni e conclusioni
In conclusione, risulta importante implementare il test genetico BRCA a scopo preventivo, a tutte le pazienti diagnosticate con carcinoma ovarico per poi estendere il test alle loro familiari in caso di positività. Lo studio dimostra che – accertato il beneficio clinico – l’estensione di tali test diagnostici, in linea con le “Raccomandazioni per l’implementazione del test BRCA nei percorsi assistenziali e terapeutici delle pazienti con carcinoma ovarico” elaborate da AIOM - SIGU - SIBIOC - SIAPEC-IAP (11), rappresenta un investimento costo-efficace per il Servizio Sanitario Nazionale. Contribuiscono a tale costo-efficacia la riduzione dei casi di cancro dell’ovaio e cancro della mammella, il controllo dei costi e, infine, l’effettiva equità di accesso alle cure per uguali necessità di salute da parte della popolazione.
Anche in altri Paesi europei, come il Regno Unito, l’estensione del test BRCA alle familiari delle pazienti con mutazione BRCA risulta una strategia costo-efficace, con una probabilità del 99,9% di rimanere sotto la soglia dei £20.000/QALY (24).
Inoltre, la letteratura mostra aspetti di rilevanza etica in questo contesto (25). In particolare, avendo come riferimento i principi ispiratori del Servizio Sanitario Nazionale, vanno sottolineati i seguenti tre fattori: 1) il profilo efficacia/sicurezza/tollerabilità del test; 2) il rispetto dell’autonomia, in termini di libertà e responsabilità dei soggetti coinvolti (paziente ed operatori), così come dell’adeguatezza dell’informazione rispetto ai soggetti per i quali si prevede l’esecuzione del test BRCA; 3) le istanze di giustizia distributiva relativamente all’equo accesso ai test.
Stante la comprovata efficacia del primo fattore, diventano decisivi i successivi due. Rispetto alla libertà e alla responsabilità delle familiari della paziente con tumore ovarico nell’accogliere la proposta di sottoporsi al test BRCA, è essenziale un’informazione esauriente, realistica e chiara sui benefici e i rischi dischiusi dai diversi scenari prospettabili in dipendenza del risultato del test, considerando la possibile vulnerabilità della persona.
Un modello basato sulle voci di costo esaminate può garantire e facilitare ulteriormente l’accesso al test in linea con gli aspetti etici assunti. Inoltre, la giustizia, declinata secondo socialità, sussidiarietà e solidarietà e improntata al valore-persona, giustifica in linea generale la disponibilità di presidi atti a prevenire malattie temibili come il tumore ovarico, assicurando contestualmente la sostenibilità organizzativa ed economico-finanziaria dei servizi sanitari. Ai fini della valutazione etica risulta dunque indispensabile, una volta accertata l’efficacia clinica, la disponibilità di analisi economiche che valutino il rapporto costo/efficacia e il relativo budget impact della tecnologia in oggetto, all’interno della complessità richiesta dalla situazione. Data la rilevata costo/efficacia dell’estensione dei test, come dimostrato in uno studio italiano in cui si evince dall’analisi di sensibilità probabilistica una costo-efficacia del 97% (26), e i conseguenti costi evitati, le istanze di giustizia distributiva – con particolare riferimento all’equità e alla sostenibilità economico-finanziaria e organizzativa – appaiono soddisfatte, avendo peraltro cura di monitorare l’effettiva fruibilità del test su base intra-regionale così come l’adeguata informazione sia ai candidati al test sia in termini di periodiche e aggiornate strategie di comunicazione sociale.
Uno studio americano (27) ha dimostrato che il test potrebbe ridurre il rischio di cancro al seno e cancro dell’ovaio del 23% e del 41% rispettivamente.
La mancanza in molti casi di un protocollo di diagnosi e cura che includa il test BRCA comporta una maggiore difficoltà di gestione della paziente da parte dell’oncologo, ma anche un ulteriore disorientamento nella paziente stessa che venga a conoscenza del test da altre fonti di informazione. In definitiva, è importante sottolineare che la diagnosi di mutazione BRCA ha una rilevante ricaduta sociale, con particolare riferimento alla famiglia intera, all’interno della quale altri individui, in assenza di diagnosi di tumore ma potenziali portatori di mutazione, potrebbero accedere a misure di prevenzione mirata ed evitare così l’insorgenza della neoplasia o una sua diagnosi tardiva.
Uno dei limiti dello studio riguarda l’utilizzo dell’expert opinion per la stima delle probabilità di transizione e dei consumi di risorse stimate. Una comparazione delle esperienze con le linee guida potrà essere effettuata in futuro per un allineamento nelle risorse consumate e nelle probabilità di transizione. Lo sviluppo ottimale di tale studio consisterebbe nell’utilizzo di dati puntuali provenienti da registri. Ovviamente, questo è un modello che risponde all’esigenza di fornire una serie di indicazioni utili alle decisioni e come tale ha l’obiettivo di mappare tutta l’informazione; tuttavia, l’analisi di sensibilità serve a ricavare l’impatto eventuale dell’incertezza dovuta a parametri poco robusti.
Infine, possibili sviluppi futuri del presente studio includono l’adattamento e applicazione di tale modello a una popolazione di partenza con cancro della mammella, per studiare l’impatto economico dell’estensione del test anche alle familiari delle pazienti con cancro mammario.
Acknowledgements
Desideriamo ringraziare i membri del Board che hanno contribuito a questo lavoro: Boccia S., Cerana N., Federici A., Lorusso D., Manzoli L., Mennini F.S., Sacchini D., Savarese A., Varesco L.
Disclosures
Financial support: This study was funded by AstraZeneca (Basiglio, Italia). The views expressed here are those of the authors and not necessarily those of the funders.
Conflict of interest: The authors declare they have no conflicts of interest related to the content of this article.
Bibliografia
- 1. I numeri del cancro in Italia – 2016, Associazione Italiana Registri Tumori (AIRTUM).
- 2. Linee Guida Tumori dell’Ovaio, Edizione 2016, Associazione Italiana di Oncologia Medica.
- 3. Alsop K, Fereday S, Meldrum C et al. BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer: a report from the Australian Ovarian Cancer Study Group. J Clin Oncol. 2012 Jul 20;30(21):2654-63.
- 4. Schrader KA, Hurlburt J, Kalloger SE et al. Germline BRCA1 and BRCA2 mutations in ovarian cancer: utility of a histology-based referral strategy. Obstet Gynecol. 2012 Aug;120(2 Pt 1):235-40.
- 5. Pennington KP, Walsh T, Harrell MI et al. Germline and somatic mutations in homologous recombination genes predict platinum response and survival in ovarian, fallopian tube, and peritoneal carcinomas. Clin Cancer Res. 2014 Feb 1;20(3):764-75.
- 6. Rebbeck TR, Kauff ND, Domchek SM. Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl Cancer Inst. 2009;101(2):80-7.
- 7. Chen S, Parmigiani G. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol. 2007 Apr 10;25(11):1329-33.
- 8. Bolton KL, Chenevix-Trench G, Goh C et al; EMBRACE; kConFab Investigators; Cancer Genome Atlas Research Network. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA. 2012 Jan 25;307(4):382-90.
- 9. Safra T, Rogowski O, Muggia FM. The effect of germ-line BRCA mutations on response to chemotherapy and outcome of recurrent ovarian cancer. Int J Gynecol Cancer. 2014 Mar;24(3):488-95.
- 10. Ledermann J, Harter P, Gourley C et al. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med. 2012;366:1382-92.
- 11. Raccomandazioni per l’implementazione del test BRCA nei percorsi assistenziali e terapeutici delle pazienti con carcinoma ovarico. A cura del Gruppo di Lavoro AIOM - SIGU - SIBIOC - SIAPEC-IAP.
- 12. Manchanda R, Legood R, Burnell M et al. Cost-effectiveness of population screening for BRCA mutations in Ashkenazi jewish women compared with family history-based testing. J Natl Cancer Inst. 2014 Nov 30;107(1):380.
- 13. Ahmad AS, Ormiston-Smith N, Sasieni PD. Trends in the lifetime risk of developing cancer in Great Britain: comparison of risk for those born from 1930 to 1960. Br J Cancer. 2015 Mar 3;112(5):943-7.
- 14. Evans DG, Lalloo F, Ashcroft L et al. Uptake of risk-reducing surgery in unaffected women at high risk of breast and ovarian cancer is risk, age, and time dependent. Cancer Epidemiol Biomarkers Prev. 2009;18(8):2318-24.
- 15. Manchanda R, Burnell M, Abdelraheim A et al. Factors influencing uptake and timing of risk-reducing salpingo-oophorectomy in women at risk of familial ovarian cancer: a competing risk time to event analysis. BJOG. 2012;119(5):527-36.
- 16. Nomenclatore tariffario ospedaliero Regione Lombardia.
- 17. Nomenclatore tariffario dell’assistenza specialistica ambulatoriale Ministero della Salute.
- 18. Gazzetta Ufficiale – Serie generale n. 23 del 28.1.2013 – Supplemento Ordinario n. 8, Decreto 18 ottobre 2012 Ministero della salute.
- 19. Allegato A al Decreto n. 119 del 12 maggio 2015, Regione del Veneto, Area Sanità e Sociale, Raccomandazioni Evidence Based, Bevacizumab - Avastin®.
- 20. Allegato A al Decreto n. 119 del 12 maggio 2015, Regione del Veneto, Area Sanità e Sociale, Raccomandazioni Evidence Based, Pertuzumab - Perjeta®.
- 21. Coordinamento Regionale Unico sul Farmaco, BEVACIZUMAB per l’indicazione: trattamento in prima linea di pazienti con carcinoma mammario metastatico in combinazione con paclitaxel. (09-09-2008), Regione Veneto.
- 22. Coordinamento Regionale Unico sul Farmaco, FULVESTRANT (13-09-2005), Regione Veneto.
- 23. Coordinamento Regionale Unico sul Farmaco, paclitaxel albumina - ABAXTRANE, Regione Veneto.
- 24. Eccleston A, Bentley A, Dyer M et al. Cost-effectiveness evaluation of germline BRCA1 and BRCA2 testing in UK women with ovarian cancer. Value Health. 2017 Apr;20(4):567-76.
- 25. Zeichner SB, Stanislaw C, Meisel JL. Prevention and screening in hereditary breast and ovarian cancer. Oncology (Williston Park). 2016 Oct 15;30(10):896-904.
- 26. Cicchetti A, Ruggeri M, Di Brino E. Cost-effectiveness of a preventive testing strategy in relatives of patients with BRCA mutated ovarian cancer versus a no test strategy. Value in Health, Volume 19, Issue 7, A696.
- 27. Kwon JS, Gutierrez-Barrera AM, Young D et al. Expanding the criteria for BRCA mutation testing in breast cancer survivors. J Clin Oncol. 2010 Sep 20;28(27):4214-20.