 |
Glob Reg Health Technol Assess 2025; 12: 70-79 ISSN 2283-5733 | DOI: 10.33393/grhta.2025.3458 ORIGINAL RESEARCH ARTICLE |
 |
Costo per responder di upadacitinib 30 mg e di dupilumab 300 mg nel trattamento di pazienti con dermatite atopica moderata-grave in Italia
Cost per responder of upadacitinib 30 mg and dupilumab 300 mg in patients with moderate-to-severe atopic dermatitis in italy
Purpose: The objective of this economic evaluation was to compare the cost per responder between upadacitinib (Upa) 30 mg and dupilumab (Dup) 300 mg in patients with moderate-to-severe atopic dermatitis in Italy.
Methods: A cost per responder analysis was developed based on results of Heads Up, a head-to-head randomized clinical trial. The primary endpoint was EASI75 at week 16, and the secondary endpoints were EASI90, EASI100, and WP-NRS improvement ≥4 points at week 16. The analysis also assessed a fifth exploratory endpoint from a Heads Up post-hoc analysis: EASI90 & WP-NRS 0/1 at week 16. The cost per responder was based on the perspective of the Italian National Health System (I-NHS). Ex-factory prices were used, excluding mandatory and other hidden discounts. The treatment cost was based on the number of administrations at week 16. The cost per responder was adopted as a cost-effectiveness indicator.
Results: Independently of the endpoint evaluated, upadacitinib always had the lower cost per responder than dupilumab. In the base case, the cost-effectiveness of upadacitinib ranges from a minimum of €361.50 considering EASI75 index at week 16 (Upa: €8,839.78 vs. Dup: €9,201.28) to a maximum of €50,376.18 considering EASI100 index at week 16 (Upa: €22,535.2 vs. Dup: €72,911.39). The difference in cost per responder between upadacitinib and dupilumab increased with higher EASI response levels.
Conclusion: Considering five clinical endpoints, the cost per responder for upadacitinib 30 mg was always lower than for dupilumab 300 mg, highlighting its substantial clinical and economic benefits for patients with moderate-to-severe atopic dermatitis.
Keywords: Atopic dermatitis, Cost per responder, EASI90, EASI100, EASI90 & WP-NRS 0/1, Upadacitinib
Received: January 8, 2025
Accepted: February 18, 2025
Published online: March 10, 2025
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2025 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La dermatite atopica (DA) è una malattia infiammatoria cutanea caratterizzata da un decorso cronico e recidivante, da una morfologia per lo più eczematosa e da un intenso prurito, spesso accompagnato da dolore e da disturbi del sonno (1,2). Rispetto alla popolazione generale i soggetti affetti da DA sono caratterizzati da un maggior rischio di comorbilità (asma bronchiale, rinite allergica, rinosinusite cronica, congiuntivite allergica, allergia alimentare ed esofagite eosinofila) e da una diminuzione della qualità di vita (QoL) (3,4).
Secondo i risultati di una recente revisione sistematica della letteratura, la prevalenza della DA varia dal 6,3% negli adulti all’11,1% nei bambini e negli adolescenti (5). In Italia non esistono stime precise sulla prevalenza della DA. Una revisione della letteratura, condotta su studi pubblicati dal 2010 in poi, ha stimato una prevalenza mediana del 14,3% nei bambini in età prescolare (da 0 a 5 anni) (6), mentre uno studio multicentrico ha stimato una prevalenza dell’8,1% della DA nella popolazione adulta (7).
Il principale obiettivo dei farmaci somministrati per il trattamento della DA è il controllo della sintomatologia e dell’infiammazione cutanea. La scelta del farmaco da somministrare nel trattamento della DA deve essere effettuata dopo avere valutato la gravità della malattia. Ciò avviene utilizzando differenti indici, tra cui l’Eczema Area and Severity Index (EASI) (8). La DA viene definita moderata-grave con un EASI ≥ 16 oppure con un EASI < 16, ma in presenza di almeno una delle seguenti quattro condizioni: i) localizzazione della malattia al volto, alle mani o ai genitali; ii) prurito con punteggio su scala numerica (Numerical Rating Scale, NRS) > 7; iii) sonno disturbato con punteggio NRS > 7; iv) compromissione della QoL, valutata con il questionario Dermatology Life Quality Index (DLQI) (8).
La forma moderata-grave richiede una terapia sistemica che si basa sulla somministrazione di immunosoppressori sistemici tradizionali (metotrexato [off-label], ciclosporina, micofenolato mofetile [off-label]), di farmaci biologici (dupilumab, tralokinumab e lebrikizumab [attualmente in classe Cnn]) e di inibitori delle Janus chinasi (abrocitinib, baricitinib, upadacitinib).
Upadacitinib, inibitore selettivo e reversibile delle Janus chinasi (JAK), inibisce preferenzialmente la segnalazione da parte di JAK1 o JAK1/3 (9). Dupilumab è un anticorpo IgG4 monoclonale completamente umano che si lega alla subunità alfa condivisa del recettore dell’interleuchina 4 e quindi inibisce la trasduzione del segnale di IL-4 e IL-13 (10).
Lo studio Heads Up (NCT03738397) di fase 3b, multicentrico, randomizzato, in doppio cieco e in doppio placebo, ha confrontato l’efficacia e la sicurezza di upadacitinib (30 mg somministrati una volta al giorno) rispetto a dupilumab (300 mg somministrati per via sottocutanea ogni due settimane) nel trattamento di pazienti affetti da DA moderata-grave in 24 settimane (11). Upadacitinib ha dimostrato una maggiore efficacia rispetto a dupilumab, senza un aumento degli eventi avversi (AE) (11).
È di seguito riportata l’analisi economica del costo per responder di upadacitinib e di dupilumab nel trattamento della DA moderata-grave con l’obiettivo di fornire un giudizio sulla costo-efficacia di farmaci somministrati per una stessa indicazione terapeutica.
Metodi
Premessa
Il calcolo del costo per responder di upadacitinib 30 mg e di dupilumab 300 mg è stato effettuato utilizzando, come base clinica, i principali (primary e secondary) endpoint indagati dallo studio di confronto diretto Heads Up (11). L’analisi economica ha adottato la prospettiva del Servizio Sanitario Nazionale (SSN), considerando i soli costi dei trattamenti farmacologici. Dall’analisi sono stati esclusi i costi per la somministrazione dei farmaci, in quanto si è assunto che, dal momento che upadacitinib 30 mg è somministrato per via orale (OS) e dupilumab 300 mg per via sottocutanea (SC), non determino alcun costo a carico del SSN, poiché somministrati dal paziente (o caregiver) al proprio domicilio. Dall’analisi sono stati inoltre esclusi i costi associati alla gestione degli eventi avversi gravi (Serious Adverse Events, SAE) correlati al trattamento farmacologico somministrato, in quanto il profilo di sicurezza indagato dallo studio di confronto diretto Heads Up (11) non ha evidenziato significative differenze tra upadacitinib 30 mg e dupilumab 300 mg.
Popolazione
In linea con lo studio di confronto diretto Heads Up (11), l’analisi del costo per responder è riferita a una coorte di pazienti adulti (età compresa tra i 18 e i 75 anni) con DA diagnosticata secondo i criteri di Hanifin e Rajka (12), candidati alla terapia sistemica (risposta inadeguata o controindicazioni ai trattamenti topici e sistemici tradizionali per DA) e che presentavano una malattia moderata-grave (definita come ≥ 10% della superficie corporea affetta da DA, EASI ≥ 16, punteggio IGA [Investigator Global Assessment] per la DA ≥ 3 alle visite di screening e al basale e punteggio medio settimanale WP-NRS [Worst Pruritus Numerical Rating Scale] ≥ 4 al basale). Nello studio Heads Up era vietato l’uso precedente di JAK inibitori o di dupilumab (11).
Dati clinici
Gli endpoint utilizzati nell’analisi economica riflettono i risultati dello studio di confronto diretto Heads Up, in cui 673 soggetti adulti con DA moderata-grave sono stati randomizzati a ricevere upadacitinib 30 mg (n = 342; maschi: 53,5%; età media: 36,2 anni) o dupilumab 300 mg (n = 331; maschi: 58,0%; età media: 36,3 anni) (11). Le principali caratteristiche demografiche al basale sono risultate bilanciate tra i due gruppi di trattamento, compresi gli score di malattia (EASI [upadacitinib 31,0 ± 12,6 vs dupilumab 29,2 ± 11,6], IGA [upadacitinib 49,4% moderato e 50,6% grave vs dupilumab 48,0% moderato e 52,0% grave]) (11). Il numero di pazienti che hanno interrotto il trattamento è risultato modesto per entrambi i farmaci; il 96,5% dei pazienti ha, infatti, completato il trattamento a 16 settimane con upadacitinib 30 mg e il 95,5% con dupilumab 300 mg (11).
Il raggiungimento di EASI75 (miglioramento del 75% del punteggio EASI rispetto al valore al basale) a 16 settimane è il primary endpoint dello studio Heads Up (11). I secondary endpoint erano rappresentati dal raggiungimento degli indici EASI90, EASI100 e WP-NRS a 16 settimane, dell’indice WP-NRS a 4 settimane, dell’indice EASI75 a 2 settimane, dell’indice WP-NRS a 1 settimana e del miglioramento del WP-NRS ≥ 4 a 16 settimane (11). A 24 settimane sono stati valutati ulteriori endpoint non classificati, tra cui l’EASI75, l’EASI90 e l’EASI100, nonché il miglioramento del WP-NRS ≥ 4 (11).
La Tabella 1 riporta il dettaglio degli endpoint considerati nella presente analisi economica. Nello specifico sono stati considerati il primary endpoint EASI75 a 16 settimane e i secondary endpoint EASI90 ed EASI100 e miglioramento del WP-NRS ≥ 4 a 16 settimane (11). Oltre a questi, l’analisi economica ha considerato anche l’endpoint esplorativo combinato EASI90 & WP-NRS 0/1 a 16 settimane, valutato in una successiva analisi post-hoc dello studio di confronto diretto Heads Up (13).
Orizzonte temporale
Il calcolo del costo per responder è stato effettuato adottando un orizzonte temporale di 16 settimane, in linea con i timepoint del primary e dei secondary endpoint dello studio Heads Up (11).
Schema di somministrazione
Lo schema di somministrazione adottato per il calcolo del costo per responder di upadacitinib 30 mg e di dupilumab 300 mg riflette il dosaggio somministrato nello studio Heads Up (11). Nello specifico, per upadacitinib è stata considerata una dose di 30 mg somministrata per OS una volta al giorno, mentre per dupilumab è stata considerata una dose di carico iniziale di 600 mg per via SC (due fiale da 300 mg), seguita da una dose di 300 mg per via SC a settimane alterne (9-11).
Costo di acquisto dei farmaci
La valorizzazione dei consumi di upadacitinib 30 mg e di dupilumab 300 mg è stata fatta considerando per entrambe le specialità farmaceutiche i rispettivi prezzi ex-factory pubblicati in Gazzetta Ufficiale, al lordo delle riduzioni temporanee di legge (14) e di eventuali sconti confidenziali o di scontistiche applicate in sede di gara regionale. Nell’analisi economica sono stati quindi considerati un prezzo ex-factory lordo di € 1.600,00 per una confezione di upadacitinib (RINVOQ®) contenente 28 compresse da 30 mg ciascuna (15) e un prezzo ex-factory lordo di € 640,00 per una confezione di dupilumab (DUPIXENT®) contenente 1 siringa da 300 mg (16).
Analisi di sensibilità
Con lo scopo di valutare il grado di incertezza dei risultati del caso base del costo per responder, è stata condotta un’ampia analisi di sensibilità inerente ai dati di efficacia dello studio Heads Up (11,13) e al prezzo di acquisto dei farmaci.
Analisi deterministica
Rispetto al caso base, è stato ricalcolato il costo per responder sostituendo, per ogni confronto, il valore del caso base di dupilumab per gli endpoint EASI75, EASI90, EASI100 e miglioramento del WP-NRS ≥ 4 a 16 settimane con il corrispondente valore indicato dall’estremo superiore dell’intervallo di confidenza riportato nella Tabella 1.
Analisi della soglia
Dal momento che l’analisi post-hoc che ha stimato l’endpoint esplorativo combinato EASI 90 & WP-NRS 0/1 a 16 settimane (13) non ha fornito gli intervalli di confidenza per upadacitinib 30 mg e dupilumab 300 mg, si è deciso di condurre un’analisi della soglia per stimare per quale valore di questo endpoint dupilumab determini un costo per responder inferiore a quello di upadacitinib.
Analisi di scenario
Dal momento che il prezzo ex-factory lordo di upadacitinib 30 mg e di dupilumab 300 mg considerato nel caso base dell’analisi potrebbe non riflettere il reale prezzo di cessione praticato alle strutture sanitarie (presenza di sconti confidenziali), è stata eseguita un’analisi di scenario per stimare la variabilità dei risultati a fronte di alcune ipotesi di sconto. Attraverso una serie di Tabelle a matrice, per ciascun endpoint sono state stimate tutte le possibili combinazioni di risultato, assumendo per entrambi i farmaci una variabilità dello sconto confidenziale tra il 5% e il 90% dell’attuale prezzo ex-factory lordo.
Risultati
Costo per responder
Nelle Figure 1-5 viene presentato il costo per responder di upadacitinib 30 mg e di dupilumab 300 mg calcolato considerando l’EASI75 a 16 settimane, l’EASI90 a 16 settimane, l’EASI100 a 16 settimane, il miglioramento del WP-NRS ≥ 4 a 16 settimane e l’endpoint combinato EASI90 & WP-NRS 0/1 a 16 settimane, rispettivamente.
In ciascuno dei cinque confronti, upadacitinib 30 mg determina sempre il minor costo per responder rispetto a dupilumab 300 mg. La differenza del costo per responder a vantaggio di upadacitinib 30 mg varia da un minimo di € 361,50 considerando l’indice EASI75 a 16 settimane (€ 8.839,78 vs € 9.201,28, Fig. 1) a un massimo di € 50.376,18 considerando l’indice EASI100 a 16 settimane (€ 22.535,20 vs € 72.911,39, Fig. 3).
Analisi deterministica
La Tabella 2 riporta i risultati dell’analisi deterministica. Upadacitinib 30 mg continua a essere costo-efficace rispetto a dupilumab 300 mg considerando gli indici EASI90 a 16 settimane, EASI100 a 16 settimane e miglioramento del WP-NRS ≥ 4 a 16 settimane. Differentemente, un valore dell’endpoint EASI75 di dupilumab superiore al 65,2% (caso base: 62,6% [IC95% 57,4%–67,8%]) determina un costo per responder inferiore a quello calcolato per upadacitinib 30 mg.
Analisi della soglia
Upadacitinib 30 mg non risulta costo-efficace solo a fronte di un incremento superiore al 133,6% del valore del caso base dell’endpoint esplorativo EASI 90 & WP-NRS 0/1 a 16 settimane di dupilumab 300 mg (dal 12,6% al 29,4%).
Analisi di scenario
I risultati dell’analisi di scenario, finalizzata a stimare l’impatto di alcune ipotesi di sconto adottate per il calcolo del costo per responder di upadacitinib 30 mg e di dupilumab 300 mg, sono presentati nelle Tabelle 3–7. Considerando l’indice EASI75 a 16 settimane e tutte le possibili combinazioni di sconto, la probabilità che upadacitinib 30 mg sia costo-efficace rispetto a dupilumab 300 mg è del 52,6% (Tab. 3). Valutando gli endpoint EASI90 a 16 settimane ed EASI100 a 16 settimane, tale probabilità sarebbe del 65,9% (Tab. 4) e dell’89,5% (Tab. 5), rispettivamente. Considerando, invece, il miglioramento del WP-NRS ≥ 4 a 16 settimane e tutte le possibili combinazioni di sconto, la probabilità che il costo per responder di upadacitinib 30 mg sia inferiore a quello di dupilumab 300 mg è del 66,2% (Tab. 6). Infine, l’analisi di scenario riferita all’indice esplorativo combinato EASI90 & WP-NRS 0/1 a 16 settimane determina una probabilità dell’83,1% che upadacitinib 30 mg sia costo-efficace rispetto a dupilumab 300 mg (Tab. 7).
| Endpoint | Timepoint | Upadacitinib 30 mg | Dupilumab 300 mg | Differenza | P value | Fonte |
|---|---|---|---|---|---|---|
| Primary endpoint | ||||||
| EASI75 | 16 settimane | 72,40%
(67,6%-77,2%) |
62,60%
(57,4%-67,8%) |
9,7 | 0,007 | (11) |
| Secondary endpoint | ||||||
| EASI90 | 16 settimane | 61,60%
(56,4%-66,8%) |
40,30%
(35,0%-45,6%) |
21,2 | < 0,001 | (11) |
| EASI100 | 16 settimane | 28,40%
(23,6%-33,2%) |
7,90%
(5,0%-10,8%) |
20,4 | < 0,001 | (11) |
| Miglioramento del WP NRS ≥ 4 | 16 settimane | 56,10%
(50,8%-61,5%) |
36,40%
(31,1%-41,6%) |
19,8 | < 0,001 | (11) |
| Endpoint esplorativo | ||||||
| EASI90 & WP-NRS 0/1 | 16 settimane | 32,70% | 12,60% | 20,1 | < 0,001 | (12) |
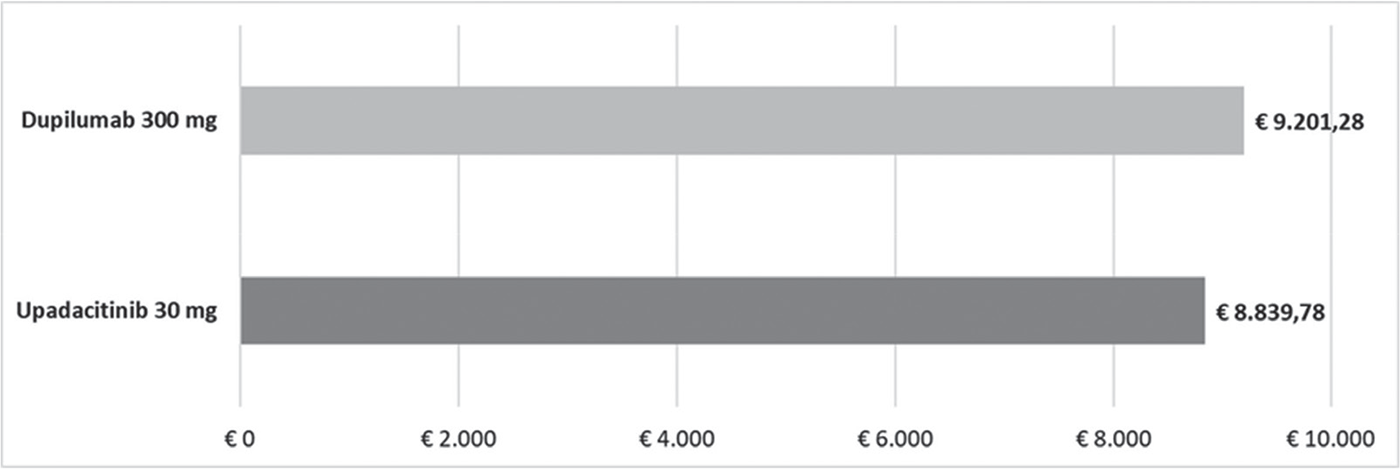
FIGURA 1 - Costo per responder: EASI75 a 16 settimane.
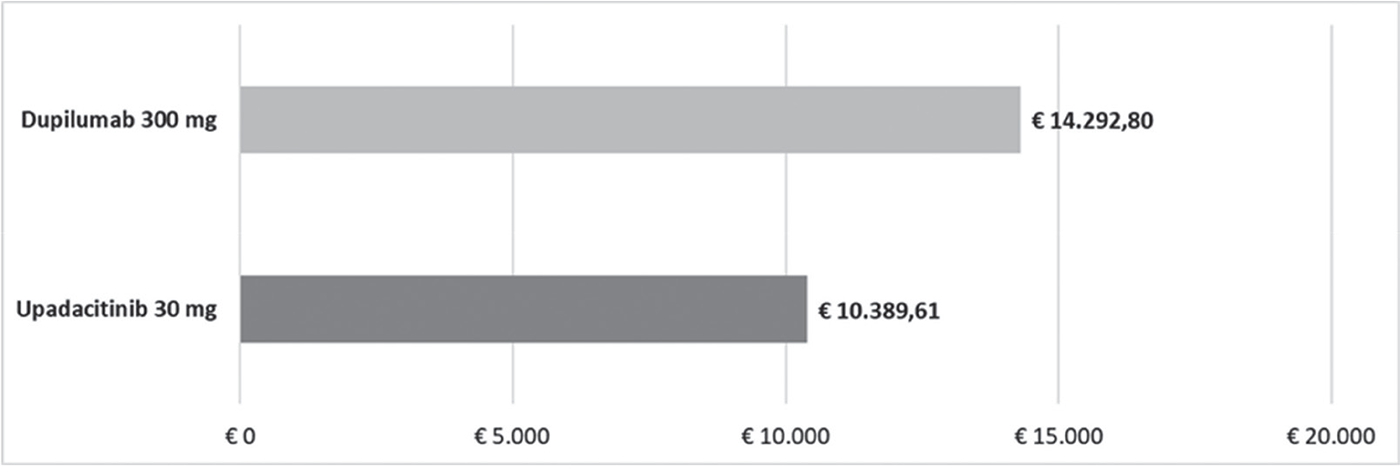
FIGURA 2 - Costo per responder: EASI90 a 16 settimane.
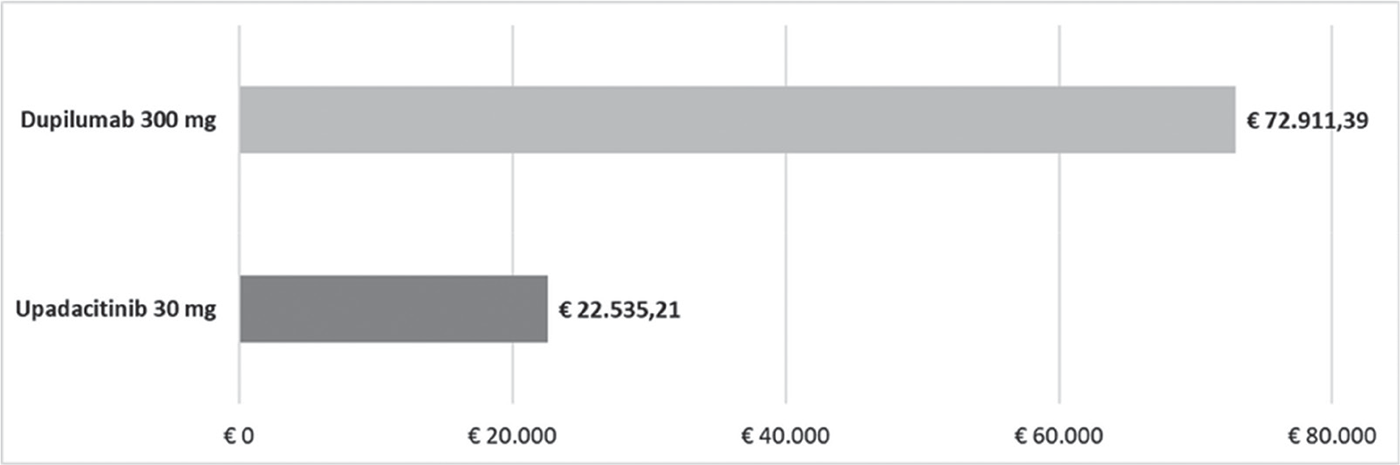
FIGURA 3 - Costo per responder: EASI100 a 16 settimane.
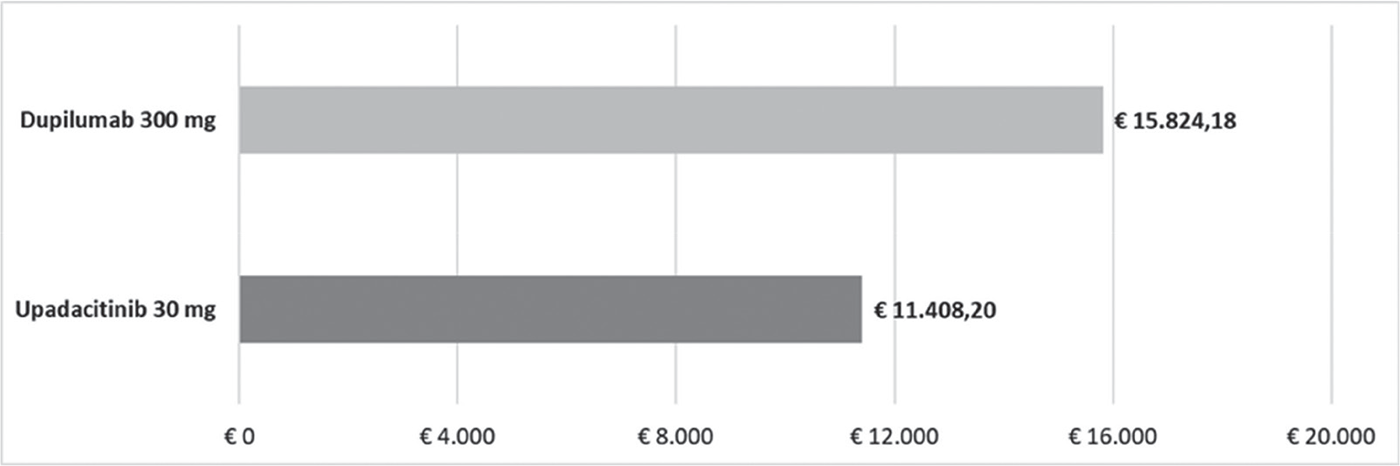
FIGURA 4 - Costo per responder: miglioramento WP-NRS ≥ 4 a 16 settimane.
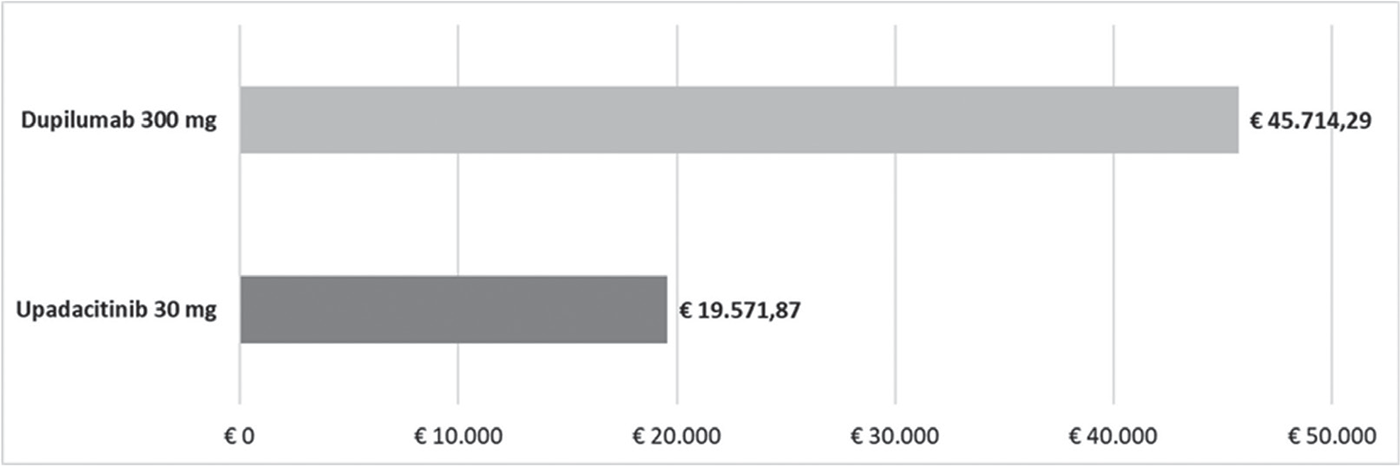
FIGURA 5 - Costo per responder: EASI90 & WP-NRS 0/1 a 16 settimane.
| Endpoint | Efficacia | Costo per responder a 16 settimane |
|---|---|---|
| EASI75 a 16 settimane | ||
| Upadacitinib 30 mg | 72,4% | € 8.839,78 |
| Dupilumab 300 mg* | 67,8% | € 8.495,58 |
| Differenza (upadacitinib - dupilumab) | € 344,20 | |
| EASI90 a 16 settimane | ||
| Upadacitinib 30 mg | 61,6% | € 10.389,61 |
| Dupilumab 300 mg* | 45,6% | € 12.631,58 |
| Differenza (upadacitinib - dupilumab) | -€ 2.241,97 | |
| EASI100 a 16 settimane | ||
| Upadacitinib 30 mg | 28,4% | € 22.535,21 |
| Dupilumab 300 mg* | 10,8% | € 53.333,33 |
| Differenza (upadacitinib - dupilumab) | -€ 30.798,12 | |
| WP NRS ≥ 4 a 16 settimane | ||
| Upadacitinib 30 mg | 56,1% | € 11.408,20 |
| Dupilumab 300 mg* | 41,6% | € 13.846,15 |
| Differenza (upadacitinib - dupilumab) | -€ 2.437,95 | |
*Rispetto al caso base, nell’analisi deterministica è stato ricalcolato il costo per responder sostituendo, per ogni confronto, il valore del caso base di dupilumab per gli endpoint EASI75, EASI90, EASI100 e miglioramento del WP-NRS ≥ 4 a 16 settimane con il corrispondente valore indicato dall’estremo superiore dell’intervallo di confidenza riportato nella Tabella 1.
TABELLA 3 - Analisi di scenario: EASI75 a 16 settimane
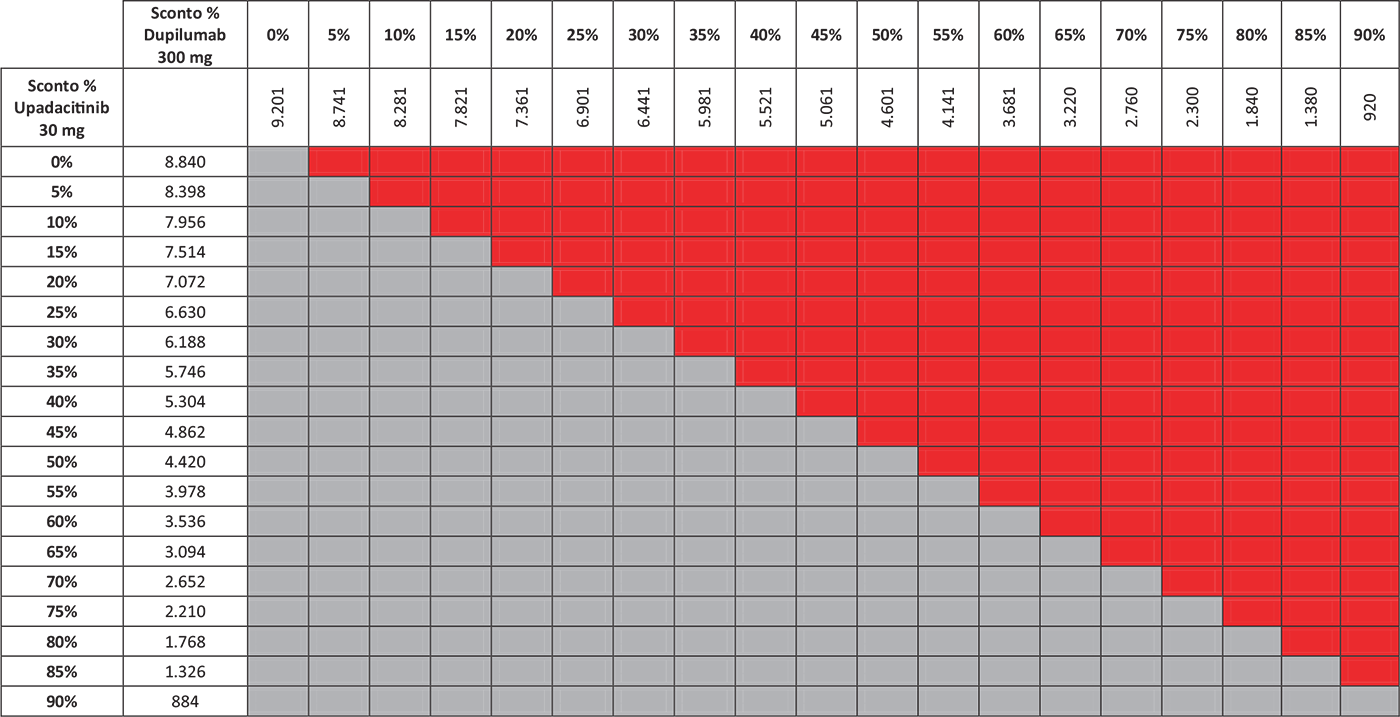
Grigio = costo per responder di upadacitinib < costo per responder di dupilumab; Rosso = costo per responder di upadacitinib > costo per responder di dupilumab.
TABELLA 4 - Analisi di scenario: EASI90 a 16 settimane
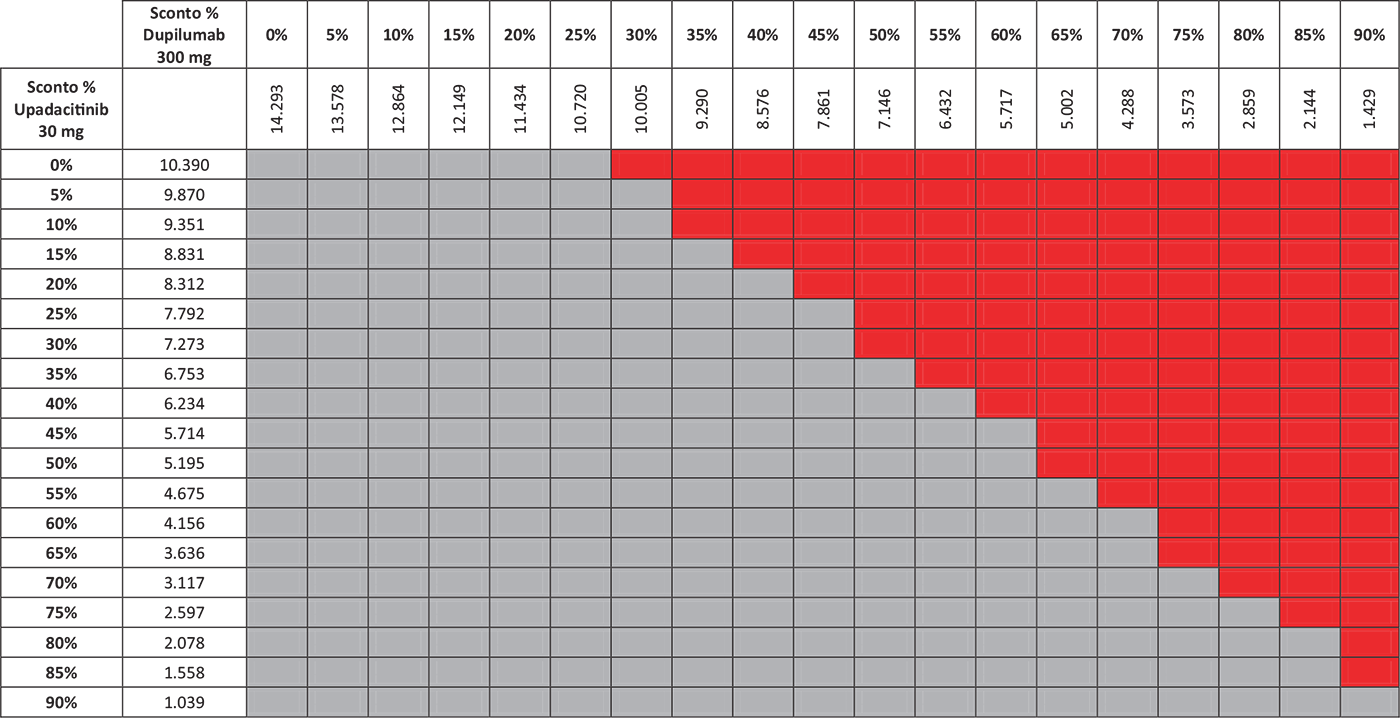
Grigio = costo per responder di upadacitinib < costo per responder di dupilumab; Rosso = costo per responder di upadacitinib > costo per responder di dupilumab.
TABELLA 5 - Analisi di scenario: EASI100 a 16 settimane

Grigio = costo per responder di upadacitinib < costo per responder di dupilumab; Rosso = costo per responder di upadacitinib > costo per responder di dupilumab.
TABELLA 6 - Analisi di scenario: WP-NRS ≥ 4 a 16 settimane
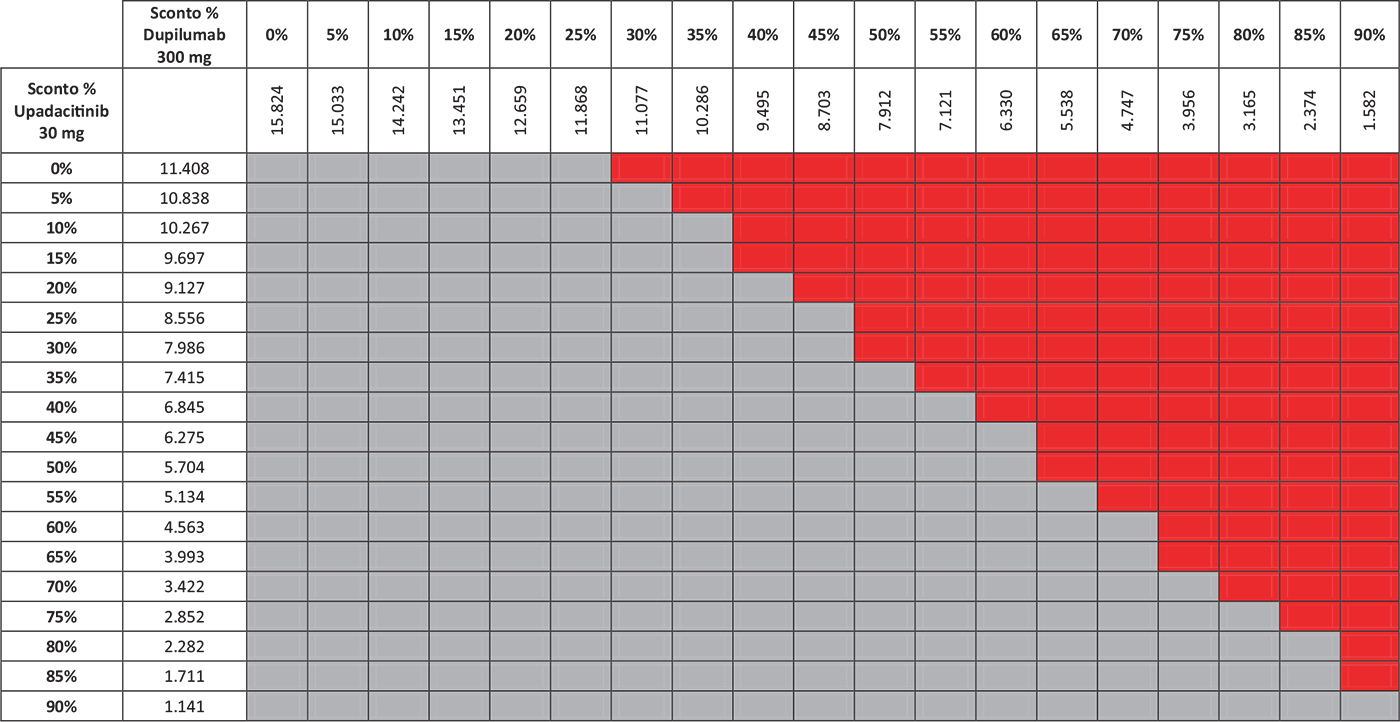
Grigio = costo per responder di upadacitinib < costo per responder di dupilumab; Rosso = costo per responder di upadacitinib > costo per responder di dupilumab.
TABELLA 7 - Analisi di scenario: EASI90 & WP-NRS 0/1
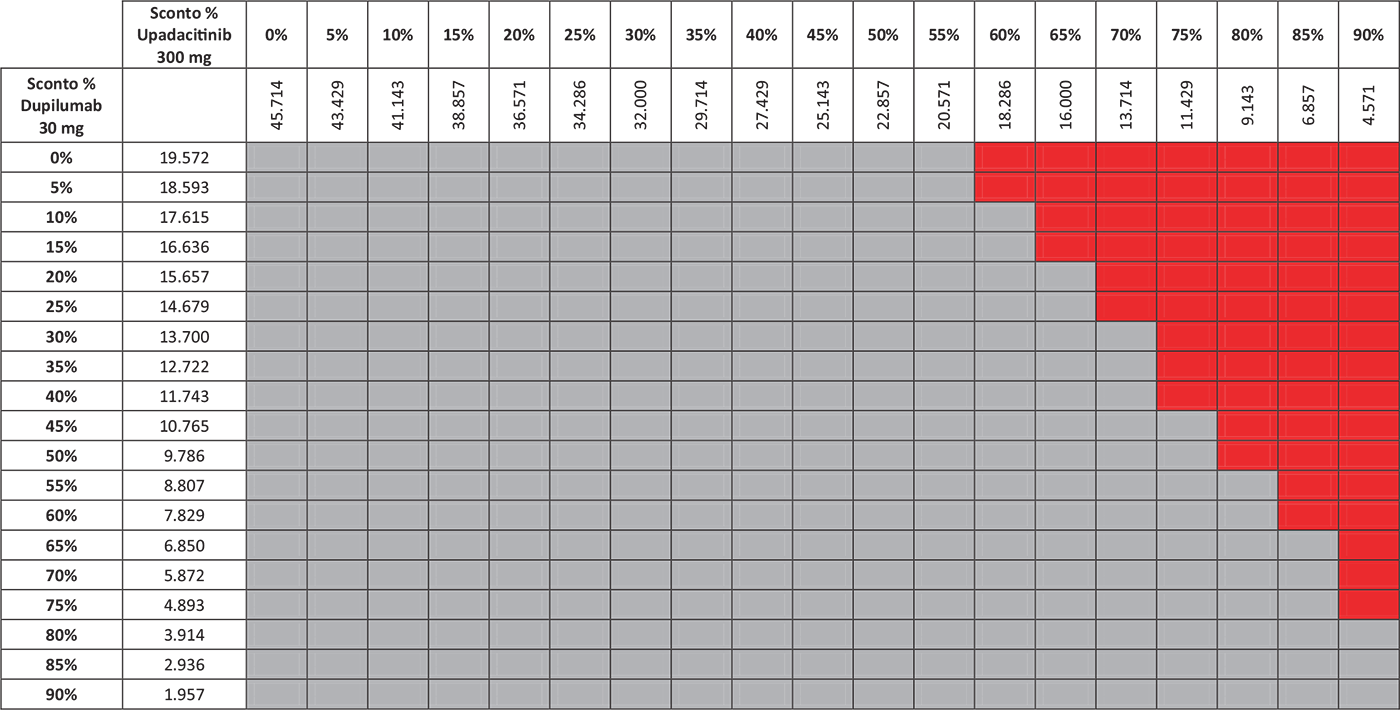
Grigio = costo per responder di upadacitinib < costo per responder di dupilumab; Rosso = costo per responder di upadacitinib > costo per responder di dupilumab.
Discussione
L’analisi economica costituisce un elemento fondamentale nel processo di assessment di un farmaco nel trattamento di malattie infiammatorie croniche, come, per esempio, la DA. Probabilmente, al fine di guidare l’allocazione ottimale delle risorse sanitarie, l’analisi di costo-efficacia (costo per responder) costituisce l’approccio metodologico più appropriato, soprattutto in presenza di esiti clinici concordati per valutare la gravità di una malattia, come quelli indagati dallo studio di confronto diretto Heads Up (11,13). In quest’ottica, la presente analisi ha confrontato, tramite il costo per responder (quale indicatore di sintesi), i benefici clinici e i costi di trattamento associati all’utilizzo di upadacitinib 30 mg o di dupilumab 300 mg nel trattamento di pazienti adulti con diagnosi di DA moderata-grave.
Gli endpoint dello studio Heads Up (11,13), che ha valutato l’efficacia di upadacitinib 30 mg e di dupilumab 300 mg nel trattamento della DA moderata-grave risultano fondamentali per la presente valutazione. È stato scelto questo studio di fase 3b in quanto ha fornito i risultati clinici di un confronto diretto tra upadacitinib 30 mg e dupilumab 300 mg nel trattamento della DA moderata-grave (11,13). Differentemente da quanto avviene solitamente nella conduzione di analisi economiche, dove vengono spesso utilizzati per necessità endpoint clinici forniti da confronti indiretti, la presenza di uno studio di confronto diretto costituisce un importante punto di forza della presente analisi.
Indipendentemente dall’endpoint considerato, il costo per responder di upadacitinib 30 mg è risultato sempre inferiore rispetto a quello calcolato per dupilumab 300 mg, determinando un’efficiente allocazione delle risorse sanitarie. La differenza del costo per responder a vantaggio di upadacitinib 30 mg varia da un minimo di € 361,50 considerando l’EASI75 a 16 settimane (€ 8.839,78 vs € 9.201,28) a un massimo di € 50.376,18 considerando l’EASI100 a 16 settimane (€ 22.535,2 vs € 72.911,39). Questo risultato si traduce in un efficientamento dell’impiego del budget per l’acquisto dei farmaci, poiché, a parità di risorse economiche disponibili, upadacitinib permette a un maggior numero di pazienti di raggiungere il target terapeutico (endpoint primario, secondari e combinato) rispetto a dupilumab.
Dal momento che in letteratura non sono presenti altre valutazioni economiche che abbiano confrontato i due farmaci nel trattamento della DA moderata-grave, non è stato possibile confrontare i presenti risultati con quelli di altre analisi. In alternativa è stata però condotta un’ampia analisi di sensibilità che ha studiato la variabilità sia clinica che economica del confronto.
La variabilità clinica è stata analizzata grazie a un’analisi deterministica in cui i valori medi di efficacia di dupilumab considerati nel caso base sono stati sostituiti dai corrispondenti estremi superiori degli intervalli di confidenza. A esclusione dell’EASI75 a 16 settimane, in tutte le simulazioni upadacitinib 30 mg è risultato costo efficace rispetto a dupilumab 300 mg, evidenziando anche una relazione tra aumento della restrizione del criterio EASI e aumento della differenza di costo per responder (differenza EASI90: € 2.241,97; differenza EASI100: € 30.798,12). Nell’ipotesi, invece, di considerare rispetto al caso base (62,6% [IC 95% 57,4%-67,8%]) un valore superiore al 65,2% dell’EASI75 a 16 settimane, incluso nell’intervallo di confidenza, dupilumab 300 mg sarebbe costo-efficace rispetto a upadacitinib 30 mg. Infine, per l’EASI 90 & WP-NRS 0/1 a 16 settimane, dal momento che l’analisi post-hoc dello studio Heads Up non ha fornito i rispettivi intervalli di confidenza per upadacitinib e dupilumab, è stato individuato il corrispettivo valore soglia per cui dupilumab determini un costo per responder inferiore a quello di upadacitinib. Ciò avviene solo a fronte di un ipotetico aumento del 133,6% del valore considerato nel caso base (dal 12,6% al 29,43%), ipotesi probabilmente poco realistica.
La variabilità economica è stata invece valutata tramite la conduzione di un’analisi di scenario. In questo caso il costo per responder delle due alternative associato a ciascun endpoint è stato ricalcolato ipotizzando per entrambi i farmaci una variabilità del prezzo ex-factory lordo determinata dall’applicazione di un possibile sconto compreso tra il 5% e il 90%. La probabilità che upadacitinib risulti costo-efficace rispetto a dupilumab aumenta all’aumentare della restrizione degli indici EASI a 16 settimane (EASI75: 52,6%; EASI90: 65,9%; EASI100: 89,5%), mentre, per gli indici quali il miglioramento del WP-NRS ≥ 4 a 16 settimane e l’EASI90 & WP-NRS 0/1 a 16 settimane, la probabilità che il costo per responder di upadacitinib 30 mg sia inferiore a quello di dupilumab 300 mg è, rispettivamente, del 66,2% e dell’83,1%.
Alla luce dei risultati dell’analisi di sensibilità è quindi possibile affermare che l’eventuale variabilità associata sia agli endpoint sia al costo di acquisto dei farmaci non determini incertezza sui risultati del caso base.
Un possibile elemento di criticità della valutazione condotta potrebbe risiedere nella scelta dell’orizzonte temporale, in quanto Linee Guida nazionali (17) e internazionali (18,19) raccomandano l’adozione di periodi di osservazione con una durata sufficientemente lunga da catturare le differenze più importanti in termini sia di efficacia che di costi. La scelta di un orizzonte temporale a 16 settimane è stata determinata dai timepoint del primary e dei secondary endpoint dello studio Heads Up (11). Sarebbe stato auspicabile disporre di dati di efficacia a 52 settimane (1 anno), ma, in assenza di ciò, si è ritenuto più corretto limitare l’analisi a 16 settimane, piuttosto che estrapolare all’anno i risultati dello studio Heads Up (11), assumendo che rimanessero costanti nel tempo. In attesa che in futuro possano essere a disposizione dati sul medio e/o lungo periodo, si ritiene che 4 mesi (16 settimane) possano comunque essere sufficienti per dare un’indicazione circa l’efficacia di un farmaco nel trattamento di una malattia cronica come la dermatite atopica.
Dall’analisi del costo per responder sono stati esclusi i costi per la somministrazione e quelli associati a eventi avversi gravi correlati al trattamento somministrato. Nonostante upadacitinib e dupilumab siano caratterizzati da differenti vie di somministrazione, il primo somministrato per OS e il secondo per via SC, si è ipotizzato in via conservativa per entrambi che il farmaco venga assunto dal paziente al proprio domicilio senza determinare costi aggiuntivi per il SSN. L’eventuale inclusione del costo di somministrazione per la formulazione SC di dupilumab, a fronte del basso importo riconosciuto dalla tariffa rimborsata dal SSN, di fatto non modificherebbe significativamente i risultati del caso base. Va però sottolineato come, in ambito organizzativo, la scelta di un trattamento orale rispetto a uno sottocute potrebbe però facilitare l’ottimizzazione della gestione del carico dei pazienti afferenti a una struttura sanitaria, elemento valido soprattutto per le malattie a decorso cronico, come la DA. Infine, i costi correlati alla gestione dei SAE associati al trattamento somministrato sono stati esclusi dalla valutazione, poiché per le due alternative lo studio Heads Up non ha riportato differenze (upadacitinib 30 mg: 2,9% vs dupilumab 300 mg: 1,2%) tali da assumere costi incrementali che potrebbero determinare sensibili scostamenti rispetto ai risultati del caso base.
Infine, essendo basata su un unico studio di confronto diretto, la validità dei risultati trovati in questa sede dovrebbe essere confermata da ulteriori (e future) evidenze cliniche nel trattamento di pazienti con dermatite atopica moderata-grave.
Conclusioni
Alla luce del costo per responder calcolato per il primary (EASI75) e per i secondary (EASI90, EASI100, miglioramento del WP-NRS ≥ 4) endpoint e per quello combinato (EASI90 & WP-NRS 0/1) a 16 settimane dello studio di confronto diretto Heads Up, la presente analisi economica ha evidenziato, nella prospettiva del SSN, la costo-efficacia di upadacitinib 30 mg rispetto a dupilumab 300 mg nel trattamento di pazienti adulti affetti da DA moderata-grave.
Acknowledgements
The Authors wish to thank Marika De Nigris, for providing editorial support on behalf of More Than Access S.r.l. Società Benefit, supported by AbbVie. The Authors wish to thank Marco di Fraia, of AbbVie for the support and critical review of the article on behalf of AbbVie.
Disclosures
Financial support: AbbVie funded the project and participated in the design of the manuscript and in the review of the data.
Conflict of interest: Paolo Gisondi received consultation fees for serving as a speaker in symposia for AbbVie, Almirall, Amgen, UCB, Jannsen, Novartis, Eli Lilly, Sanofi. Luca Stingeni is investigator and speaker for AbbVie, Almirall, Amgen, Leo Pharma, Lilly, Novartis, Pfizer, and Sanofi. Roberto Ravasio is a consultant of More Than Access S.r.l. Società Benefit and he has no conflict of interest in this research. Sara Di Fino, Anna Levi, Chiara Palladino and Gianluca Ronci are AbbVie employees and may own AbbVie stocks.
Bibliografia
- 1. Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers. 2018;4(1):1. CrossRef PubMed
- 2. Langan SM, Irvine AD, Weidinger S. Atopic dermatitis. Lancet. 2020;396(10247):345-360. CrossRef PubMed
- 3. Drucker AM. Atopic dermatitis: burden of illness, quality of life, and associated complications. Allergy Asthma Proc. 2017;38(1):3-8. CrossRef PubMed
- 4. Rønnstad ATM, Halling-Overgaard AS, Hamann CR, Skov L, Egeberg A, Thyssen JP. Association of atopic dermatitis with depression, anxiety, and suicidal ideation in children and adults: A systematic review and meta-analysis. J Am Acad Dermatol. 2018;79(3):448-456.e30. CrossRef PubMed
- 5. Migliavaca CB, Lazzarini R, Stein C, et al. Prevalence of Atopic Dermatitis: A Systematic Review and Meta-Analysis. Dermatitis. 2024; CrossRef PubMed
- 6. Neri I, Galeone C, Pelucchi C, et al. Atopic Dermatitis in Italian Pre-School Children: Literature Review of Epidemiological Data with a Focus on Disease Prevalence and Severity. Children (Basel). 2023;10(10):1629. CrossRef PubMed
- 7. Barbarot S, Auziere S, Gadkari A, et al. Epidemiology of atopic dermatitis in adults: results from an international survey. Allergy. 2018;73(6):1284-1293. CrossRef PubMed
- 8. Calzavara Pinton P, Cristaudo A, Foti C, et al. Diagnosis and management of moderate to severe adult atopic dermatitis: a Consensus by the Italian Society of Dermatology and Venereology (SIDeMaST), the Italian Association of Hospital Dermatologists (ADOI), the Italian Society of Allergy, Asthma and Clinical Immunology (SIAAIC), and the Italian Society of Allergological, Environmental and Occupational Dermatology (SIDAPA). G Ital Dermatol Venereol. 2018;153(2):133-145. PubMed
- 9. EMA. Riassunto delle caratteristiche di prodotto Rinvoq. Online (Accessed January 2025)
- 10. EMA. Riassunto delle caratteristiche di prodotto Dupixent. Online (Accessed January 2025)
- 11. Blauvelt A, Teixeira HD, Simpson EL, et al. Efficacy and Safety of Upadacitinib vs Dupilumab in Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. 2021;157(9):1047-1055. CrossRef PubMed
- 12. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Dermato-Venereologica. 1980;60(92):44-47. 1980;60(92):44-47. CrossRef
- 13. Eric L Simpson, Antonio Costanzo, Vimal H Prajapati, Brian M Calimlim, Alvina D Chu, Tianshuang Wu, Kilian Eyerich. 528 - Rapid skin clearance and itch improvement with upadacitinib versus dupilumab in adults with moderate-to-severe atopic dermatitis: results from a phase 3b head-to-head clinical trial (Heads Up). British Journal of Dermatology, Volume 190, Issue Supplement_2, February 2024, Pages ii30–ii31. CrossRef
- 14. Determinazione AIFA del 3 luglio 2006, GU n 156 del 7 luglio 2006, e successiva Determinazione AIFA del 9 febbraio 2007, GU no 57 del 9 marzo 2007 e proroghe. Online(Accessed January 2025)
- 15. AGENZIA ITALIANA DEL FARMACODETERMINA 16 maggio 2024 Regime di rimborsabilita’ e prezzo a seguito di nuove indicazioni terapeutiche del medicinale per uso umano «Rinvoq». (Determina n. 16/2024). (24A02550) (GU Serie Generale n.118 del 22-05-2024). Online(Accessed January 2025)
- 16. AGENZIA ITALIANA DEL FARMACODETERMINA 8 febbraio 2022 Regime di rimborsabilita’ e prezzo, a seguito di nuove indicazioni terapeutiche, del medicinale per uso umano «Dupixent». (Determina n. 116/2022). (22A01100) (GU Serie Generale n.42 del 19-02-2022). Online (Accessed January 2025)
- 17. Fattore G. Gruppo di lavoro AIES (coordinato da G. Fattore).Proposta di linee guida per la valutazione economica de-gli interventi sanitari in Italia. PharmacoEcon Ital Res Artic. 2009;11(2):83-93. CrossRef
- 18. National Institute for Health and Care Excellence. Guide tothe methods of technology appraisal. 2013. Online (Accessed January 2025)
- 19. Canadian Agency for Drugs and Technologies in Health. Guide-lines for the Economic Evaluation of Health Technologies: Can-ada, 3rd Edition. 2006. Online (Accessed January 2025)