 |
Glob Reg Health Technol Assess 2025; 12: 89-97 ISSN 2283-5733 | DOI: 10.33393/grhta.2025.3433 ORIGINAL RESEARCH ARTICLE |
 |
Gestione e utilizzo del Fondo Farmaci Innovativi: un’indagine qualitativa multistakeholder sulle pratiche regionali e locali
Management and utilization of the Fund for Innovative Medicines: a multistakeholder qualitative survey on regional and local practices
Introduction: The Fund for Innovative Medicines, Fondo Farmaci Innovativi (FFI), enables financing, non-competition, and fast access to innovative medicines. However, limited evidence exists regarding its management processes and the stakeholders involved. In order to identify characteristics, critical issues, and improvement opportunities, this analysis investigates the FFI management processes through the perspective of the Key Opinion Leaders (KOLs) involved.
Methods: The research employs a qualitative research methodology. A survey administered through interviews to 18 KOLs (clinicians, hospital pharmacists, top hospital managers, and regional pharmaceutical service directors) from 9 Italian regions provided evidence of FFI utilization patterns. The content analysis identified FFI management features, challenges, and best practices. The expert meeting discussion validated the findings and developed consensus priority recommendations.
Results: The FFI regulation promotes the convergence between regional and local authorities; however, different regional governance models may determine varying levels of organizational efficiency. Critical interventions were proposed: overall, enhanced AIFA data feedback is supported by 85% of the sample; regionally, strengthened communication with local institutions and centralized planning are recommended (mean score 3.2/4); locally, enhanced digitalization of reporting systems may address operational inefficiencies for clinicians and hospital pharmacists (mean score 3.4/4).
Conclusion: This analysis contributed to a better awareness of the current FFI management process through a multi-level and multi-professional methodology. Partial return of data, potential distortions of a fund’s allocation based on usage, multiplication of accounting processes, and regional variability in healthcare governance provide a foundation for targeted improvement interventions and to direct future research.
Keywords: Financial management, Funds, Innovative medicines, Italy, Organizational models, Pharmaceutical policy
Received: November 12, 2024
Accepted: March 5, 2025
Published online: March 27, 2025
Indirizzo per la corrispondenza:
Andrea Vitagliano
email: andrea.vitagliano@pharmalex.com
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2025 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il Fondo Farmaci Innovativi (FFI) riveste un ruolo cruciale per finanziare e garantire un accesso rapido alle terapie innovative sulla base dei criteri definiti dall’Agenzia Italiana del Farmaco (AIFA) e dalla Commissione Scientifica ed Economica (CSE) (1). Il FFI rappresenta uno strumento finanziario che evidenzia l’attenzione del Servizio Sanitario Nazionale (SSN) verso medicinali considerati prioritari sia per l’elevato valore terapeutico aggiunto sia per lo specifico target di pazienti (2). Questo fondo, pur attingendo alle risorse del Fondo Sanitario Nazionale (FSN), si costituisce come entità separata per evitare la competizione economica con i farmaci a indicazione non innovativa. Tale fondo, infatti, è stato costituito per rispondere non solo alla necessità di destinare risorse specifiche e vincolate al finanziamento dei farmaci innovativi, ma anche alla difficoltà di coprire tali spese con il tetto previsto per i farmaci acquistati dalle aziende sanitarie pubbliche, che risulterebbe insufficiente in assenza di un fondo dedicato.
In uno scenario caratterizzato da limitatezza delle risorse e crescente incapienza del fondo per gli acquisti diretti, risulta cruciale valutare le attuali strategie di gestione e di utilizzo delle risorse da parte di regioni e strutture sanitarie locali. Tale valutazione può guidare, infatti, interventi mirati a ottimizzare i processi di gestione del FFI, consentendone un utilizzo più razionale ed efficiente.
La stessa Legge n. 232 dell’11 dicembre 2016, con la quale venivano istituiti due fondi, innovativi oncologici e non oncologici, ciascuno con una dotazione annua di 500 milioni di euro, prevedeva che il Ministero della Salute e il Ministero dell’Economia e delle Finanze implementassero un monitoraggio degli effetti dell’utilizzo dei farmaci innovativi oncologici e non oncologici rispetto al costo del percorso terapeutico-assistenziale dei pazienti (3). Tale attività si poneva esattamente in una prospettiva di analisi e ottimizzazione dell’allocazione delle risorse programmate per il SSN, sulla base dei dati di real world e delle informazioni ricavate dai Registri Farmaci (2). Tuttavia, per quanto noto agli Autori, le evidenze di questa attività non sono state sistematicamente condotte o rese pubbliche. A seguito della Legge n. 232/2016, le determine AIFA 519/2017 e 1535/2017 hanno definito i criteri per la valutazione e la concessione dell’innovatività (1). Inoltre, con il DL 73/2021, è stato abrogato il comma 400 e modificato il comma 401 per istituire un fondo presso il Ministero dell’Economia e delle Finanze con un budget annuale di 1.000 milioni di euro per il rimborso alle regioni delle spese per l’acquisto di farmaci innovativi. In base ai criteri stabiliti dal comma 405 dello stesso Decreto-Legge, il Ministero della Salute rimane competente per regolare le modalità operative di erogazione delle risorse (4). Successivamente, sono state incrementate le risorse del FFI, con 100 milioni di euro in più per il 2022, 200 milioni di euro per il 2023 e 300 milioni di euro a partire dal 2024 (5).
Secondo il Decreto Ministeriale del 16 febbraio 2018, le modalità operative per l’allocazione delle risorse del FFI prevedono un sistema di acconto e conguaglio che rimborsa integralmente le spese sostenute per i residenti delle regioni a statuto ordinario e al 50% per i residenti della regione a statuto speciale Sicilia, fino al raggiungimento del limite complessivo del fondo stesso (6). Qualora si verifichino scostamenti tra le regioni che partecipano al FFI, questi vengono affrontati tramite un sistema di ridistribuzione delle risorse, trasferendo le eccedenze dalle regioni in credito alle regioni in debito. Qualora invece la spesa totale sia maggiore della capienza del fondo, il margine in eccesso viene ripartito proporzionalmente alla spesa sostenuta, entrando nel canale di spesa farmaceutica per acquisti diretti (2).
L’analisi dei dati più recenti, relativi all’anno 2023, conferma un trend di sottoutilizzo delle risorse del FFI disponibili: complessivamente solo il 64% del fondo è effettivamente impiegato, con una discreta variabilità ravvisabile tra regione e regione (range: 56%-75%; più basso in Abruzzo, più alto in Liguria) (7) (Materiale Supplementare 1). A fronte di eterogeneità e sottoutilizzo di risorse tra regioni, non ci sono a oggi evidenze chiare che permettano di identificare eventuali inefficienze nei processi di gestione delle risorse per farmaci con status di innovatività. A conoscenza degli Autori, gli unici studi che hanno esaminato i modelli regionali e locali di gestione e implementazione del fondo sono stati condotti da Cittadinanza Attiva nel 2019 (8) e da Jommi et al. nel 2021 (2). L’indagine svolta da Cittadinanza Attiva si è proposta di indagare i principali ostacoli che i cittadini incontrano nell’accesso ai farmaci innovativi. La ricerca, finalizzata inoltre a valutare e a proporre azioni per ridurre le disuguaglianze nell’accesso a queste terapie, si è basata sull’esperienza diretta dei professionisti sanitari operanti nei centri di riferimento del SSN, in particolare clinici prescrittori e farmacisti (8). Nel paper di Jommi et al., gli Autori hanno condotto un’indagine mediante metodo Delphi con un panel di esperti su tre aspetti dei FFI: il loro impatto sull’accesso ai farmaci innovativi, i vantaggi e le criticità della loro gestione e le possibili azioni per ottimizzarne il funzionamento. Tra le raccomandazioni prioritarie dell’analisi sono emerse la necessità di garantire la tempestività dei flussi informativi alle regioni sulla spesa per i farmaci innovativi, l’opportunità di valutare l’estensione del criterio di innovatività nei casi in cui manchino alternative terapeutiche e l’importanza di assicurare sia il monitoraggio dei tempi di accesso ai farmaci innovativi sia la loro omogeneità sul territorio nazionale (2).
Sebbene tali studi forniscano un’analisi approfondita della gestione del FFI dal punto di vista degli stakeholder coinvolti, mancano a oggi evidenze sui processi operativi implementati nei diversi contesti sanitari. Questa ricerca si propone di esaminare i processi regionali e locali che governano la gestione del FFI, con l’obiettivo di identificare eventuali disparità tra i diversi livelli del sistema sanitario, di individuare le principali criticità operative e di proporre raccomandazioni prioritarie per ottimizzare il funzionamento e la governance di tali processi. La ricerca è condotta con il contributo di un panel multidisciplinare di esperti provenienti da diverse regioni italiane, garantendo una rappresentatività a livello nazionale.
Materiali e metodi
L’indagine ha previsto l’impiego di strumenti di ricerca quali-quantitativi relativamente a due attività principali: raccolta delle opinioni degli esperti tramite survey e consolidamento delle evidenze con formulazione di raccomandazioni tramite Expert Meeting.
Survey
La metodologia legata all’implementazione della survey si compone delle attività sequenziali di stakeholder mapping (9), strutturazione e somministrazione della survey (10) ed elaborazione dei risultati mediante content analysis (11). Una fase preliminare di stakeholder mapping, condotta tramite desk research, ha identificato e profilato gli esperti del panel a cui sottoporre la survey. Questi esperti rappresentano figure strategiche nei processi clinici, organizzativi, gestionali ed economico-finanziari del FFI. Sono stati inclusi nello studio quattro profili di Key Opinion Leaders (KOLs), che operano su due livelli distinti. A livello delle Agenzie Regionali della Sanità, sono stati considerati i referenti del Servizio Farmaceutico e della Programmazione Finanziaria. A livello locale, nelle Aziende Ospedaliere, sono stati considerati dirigenti della direzione strategica, clinici e farmacisti ospedalieri. La selezione dei KOLs è stata condotta al fine di assicurare una rappresentanza nazionale coerente con gli obiettivi della ricerca.
Successivamente, la fase di strutturazione della survey ha previsto la raccolta di dati e informazioni utilizzando una combinazione di domande aperte e chiuse, integrando i vantaggi degli strumenti quali-quantitativi. Il contenuto della survey (Materiale Supplementare 2) è stato definito sulla base dei gap di conoscenza individuati, con l’obiettivo di analizzare le modalità di gestione e utilizzo del FFI nei diversi livelli di processo. La survey è stata strutturata con un totale di 26 domande, suddivise nelle 6 sezioni tematiche di seguito indicate (Tab. 1). Il contenuto del questionario è stato validato tramite un’intervista pilota (novembre 2023).
| Macroarea | Microarea | Area indagata |
|---|---|---|
| A. Processi di gestione e responsabili di processo del FFI | Processi di gestione e responsabili dei processi | Definizione dei processi di gestione e responsabili di tali processi |
| B. Comprensione dei criteri di allocazione del FFI | Conoscenza dei criteri di allocazione | Conoscenza dei criteri che regolano l’allocazione del fondo da livello nazionale a regionale e da regionale a locale |
| Conoscenza della percentuale di utilizzo | Conoscenza periodica della percentuale di utilizzo del FFI da parte delle regioni sul totale del FFI e da parte degli enti locali sull’entità del fondo da ripartire alla singola regione | |
| Adeguatezza della quota | Valutazione dell’adeguatezza della quota rispetto ai volumi previsti dall’ente regionale o locale | |
| C. Modalità di impiego, di gestione e di monitoraggio delle risorse allocate | Criteri per scelta dei centri prescrittori | Definizione dei criteri di scelta utilizzati per selezione dei centri prescrittori |
| Criteri per ripartizione del fondo | Definizione dei criteri di ripartizione del FFI agli enti locali | |
| Strumenti di monitoraggio | Segnalazione di tutti gli strumenti utilizzati per il monitoraggio clinico e di consumo delle risorse del FFI | |
| Misurazione dell’impatto dell’allocazione intraregionale del FFI | Misurazione dell’impatto clinico dei farmaci che accedono al FFI rispetto alle risorse economiche destinate dal FFI | |
| Ritorno di dati | Percezione del ritorno di dati clinici e di consumo | |
| Aspetti normativi da migliorare | Aspetti burocratici da migliorare per ottimizzare l’intero processo | |
| D. Comprensione dei tempi di accesso e durata di permanenza nel FFI | Maggiore accessibilità grazie al FFI | Percezione di maggiore accessibilità ai farmaci innovativi da parte dei pazienti in termini temporali |
| Adeguatezza della durata di permanenza nel fondo di 36 mesi | Valutazione adeguatezza di 36 mesi di durata dell’innovatività piena | |
| E. Valutazione cambiamenti in seguito a unione Fondo Farmaci Innovativi oncologici e Fondo Farmaci Innovativi non oncologici | Conseguenze unione dei Fondi Farmaci Innovativi oncologici e non oncologici | Valutazione conseguenze dell’unione del Fondo Farmaci Innovativi oncologici e del Fondo Farmaci Innovativi non oncologici |
| F. Necessità di interventi di ottimizzazione del processo di gestione del FFI | Numero e tipologia di interventi ritenuti necessari per ottimizzare la gestione del FFI | Definizione azioni di ottimizzazione del processo di gestione del FFI rispetto alle criticità e alle priorità individuate |
Le survey sono state somministrate durante interviste semi-strutturate virtuali guidate one on one, della durata di 60 minuti, nel periodo dicembre 2023-giugno 2024, per un totale di 18 interviste. L’intervista semi-strutturata ha permesso di selezionare e adattare le domande in funzione del ruolo professionale dell’intervistato. L’elaborazione dei risultati delle survey ha previsto, sulla base di una consolidata letteratura scientifica di riferimento, l’adozione di due metodologie sequenziali con elevata capacità di sintesi: una mappatura di processo e un’analisi quali-quantitativa del percepito mediante content analysis. La mappatura di processo ha delineato le fasi chiave della gestione del FFI con le relative attività. Nella sezione A sono state poi identificate le diverse figure professionali responsabili di tali processi, mediante domanda chiusa a selezione multipla. Sono state riportate le figure responsabili dei processi per cui è stata registrata una maggiore concordanza tra i partecipanti. Per ogni profilo, il livello di concordanza è stato calcolato come rapporto percentuale tra il numero di volte in cui quel profilo è stato indicato come responsabile e il numero totale di risposte, considerando significativi i casi in cui tale rapporto ha raggiunto o superato il 60%. L’analisi qualitativa ha previsto il ricorso a statistiche descrittive, riportando valori medi e tabelle di frequenza sui quesiti che hanno previsto ranking o valutazioni su scala Likert.
Expert Meeting
Al fine di sintetizzare e validare all’interno dell’Expert Meeting le evidenze emerse dalla survey, l’analisi ha adottato la metodologia dei punteggi, appartenente alla famiglia dei metodi multicriterio e multi-obiettivo (12,13). La valutazione a punteggio è stata condotta attraverso una revisione delle informazioni qualitative utilizzate nelle 5 sezioni della survey (B-F) in funzione di scale/valori numerici (Materiale Supplementare 3). Secondo una pesatura che ha tenuto conto della distribuzione in quartili, si è pervenuti all’attribuzione di uno score finale compreso tra 1–3, che esprime una traduzione numerica di sintesi della valutazione condotta. Questa analisi ha permesso la creazione di una mappa di posizionamento o “bersaglio” che restituisce graficamente una sintesi delle aree di criticità su tre livelli (area non critica, area a criticità intermedia e area critica). Tale bersaglio ha rappresentato un input fondamentale per l’Expert Meeting che ha visto la presenza di esperti con differente ruolo professionale e diversa provenienza regionale. La discussione, guidata da un moderatore, è stata finalizzata a validare le evidenze tramite consensus e a definire delle raccomandazioni prioritarie circa gli interventi di miglioramento del processo di gestione e utilizzo del FFI, a livello di sistema sia nazionale che regionale/locale.
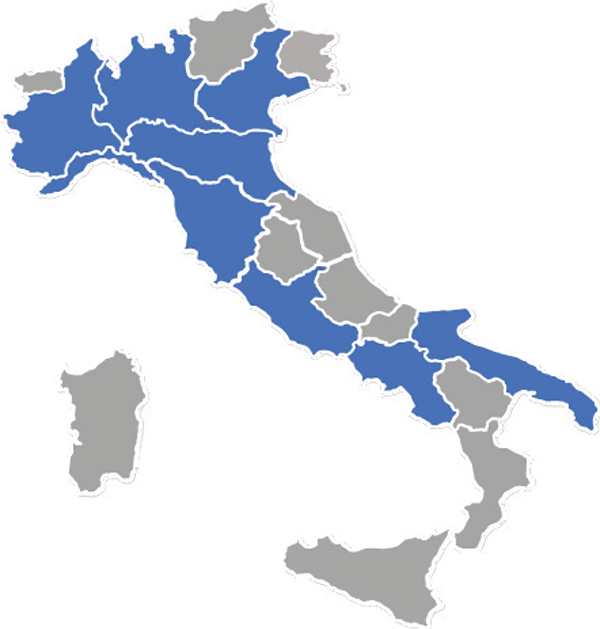
FIGURA 1 - Distribuzione geografica regionale dei KOLs partecipanti al panel.
In blu: regioni dei KOLs partecipanti al panel che accedono integralmente al FFI.
Risultati
Survey
Nella fase preliminare di mappatura degli stakeholder sono stati identificati gli attori più rilevanti coinvolti nell’utilizzo, nella gestione e nel monitoraggio delle risorse del FFI. A livello macro, il Ministero della Salute svolge un ruolo di supervisione e regolazione nell’allocazione delle risorse, definendo congiuntamente ad AIFA le modalità operative per la loro distribuzione. Queste entità sono state, tuttavia, escluse dalla presente indagine, data la differente prospettiva di ricerca.
Il panel finale di esperti coinvolti nella fase di somministrazione della survey si compone di 18 KOLs, con significativa prevalenza di farmacisti ospedalieri (7 esperti), seguiti da clinici (5 esperti), referenti regionali (5 esperti) e un rappresentante della direzione strategica (1 esperto) (Materiale Supplementare 4). I KOLs selezionati sono rappresentativi di nove regioni distribuite sul territorio nazionale (Fig. 1).
L’analisi dei risultati, condotta attraverso mappatura di processo, ha identificato 11 processi chiave nella gestione del FFI (Fig. 2). Esaminando la sezione A, i processi su cui emerge un consenso unanime rispetto alle figure responsabili (100% di concordanza da parte del campione intervistato) risultano:
- “assegnazione quota Fondo Farmaci Innovativi ai centri” di responsabilità della regione;
- “elaborazione Linee Guida o PDTA regionali” di responsabilità congiunta della regione e dei clinici;
- “prescrizione” di responsabilità dei clinici;
- “dispensazione” di responsabilità del farmacista ospedaliero;
- “rendicontazione dei consumi” di responsabilità del farmacista ospedaliero;
- “monitoraggio” di competenza del farmacista ospedaliero;
- “mobilità attiva e passiva” di competenza della regione.
Il farmacista ospedaliero rappresenta il professionista coinvolto nel più alto numero di processi identificati (6/11), seguito dal clinico (responsabile di 5/11 processi).
Relativamente all’ analisi quali-quantitativa delle restanti sezioni, di seguito si evidenziano i principali risultati emersi. Si specifica che i risultati presentati sono riferibili esclusivamente agli aspetti indagati tramite survey somministrata attraverso intervista semi-strutturata, per i quali tutto il campione ha fornito una risposta. I restanti elementi raccolti sono stati utilizzati come commento dei risultati.
Rispetto alla sezione B “comprensione dei criteri di allocazione intraregionale del FFI”, criticità intermedie emergono in merito alla “conoscenza dei criteri di allocazione” e alla “conoscenza della percentuale di utilizzo” (Fig. 3). Con “conoscenza dei criteri di allocazione” si intende la consapevolezza degli attori coinvolti nel processo di gestione del FFI circa i criteri utilizzati per allocare le risorse del fondo da livello nazionale a regionale e da livello regionale a locale. Il 17% degli intervistati ha dichiarato di non conoscerli e il 44% di conoscerli parzialmente. Per “conoscenza della percentuale di utilizzo” si intende la ricezione periodica di informazioni circa la percentuale di utilizzo del FFI da parte delle regioni (sul totale del fondo) e degli enti locali (sul fondo ripartito alla singola regione) durante l’anno in corso. Il 39% ha segnalato di non ottenere un ritorno puntuale sulla percentuale di utilizzo del fondo assegnato. Nello specifico, la frequenza di report o informative AIFA circa le percentuali di utilizzo del fondo da parte delle regioni è considerata limitata e non tempestiva. È anche evidenziata una tardiva comunicazione di AIFA alle regioni circa il riconoscimento di innovatività di un farmaco, che a oggi coincide solo con il momento di pubblicazione in GU. È indicata la necessità di una comunicazione più precoce e tempestiva per facilitare una valutazione preliminare dell’impatto sulla spesa in una determinata area terapeutica. Inoltre, solo 4 regioni su 9 comunicano periodicamente agli enti locali (mensilmente o trimestralmente) la percentuale di utilizzo del fondo. I KOLs condividono l’idea che la mancanza di un aggiornamento costante su consumo e disponibilità del fondo, a livello sia regionale che locale, pregiudichi un’efficace programmazione della spesa e la ripianificazione delle attività operative.
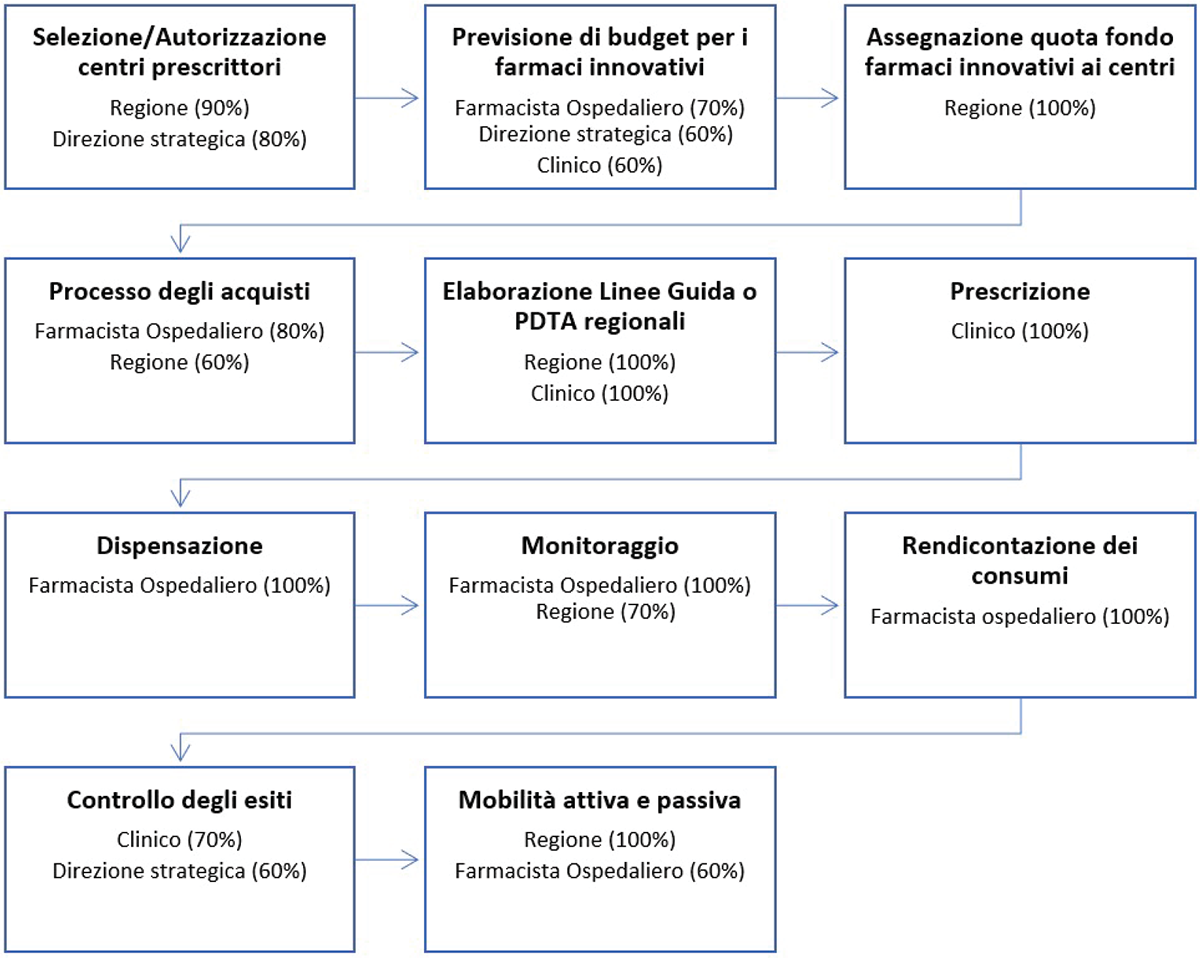
FIGURA 2 - Identificazione dei processi di gestione e dei responsabili di processo del FFI.
Le percentuali di concordanza indicate rappresentano il rapporto tra il numero di volte in cui quel profilo è stato segnalato come responsabile del processo e il numero totale di risposte raccolte; sono stati riportati nella Figura solo i profili per i quali il rapporto percentuale è risultato uguale o superiore al 60%.
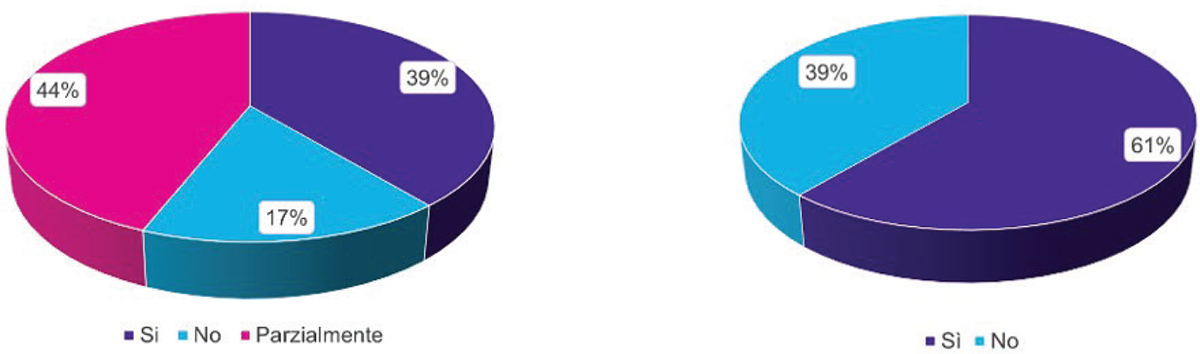
FIGURA 3 - Conoscenza dei criteri di allocazione del FFI e conoscenza della percentuale di utilizzo del FFI.
L’area “modalità di impiego, gestione e monitoraggio” presenta diversi item ad alta criticità. Con “criteri di ripartizione del fondo” sono stati chiesti al campione di esperti i criteri con cui allo stato attuale sono ripartite le risorse del FFI agli enti locali. Il 56% degli intervistati indica che il FFI prevede fondamentalmente un’unica modalità di ripartizione, in base al consumo/utilizzo effettivo dei farmaci innovativi da parte delle strutture sanitarie di ciascuna regione. Per quanto riguarda la programmazione locale, il 61% del campione riporta che questa viene definita analizzando i dati epidemiologici del triennio precedente (Fig. 4). Alcuni esperti sottolineano che la programmazione regionale sulla base dello storico dei dati epidemiologici potrebbe non risultare pienamente in grado di cogliere rapidamente l’evoluzione futura in termini sia epidemiologici che di innovazioni terapeutiche.

FIGURA 4 - Modalità di ripartizione del FFI e programmazione locale (criteri utilizzati).
A elevata criticità risultano anche gli item relativi agli “strumenti di monitoraggio” utilizzati per i farmaci innovativi e la “misurazione dell’impatto dell’allocazione intraregionale del FFI”. Il 35% del campione ha dichiarato di avvalersi di due strumenti di monitoraggio. Nello specifico gli strumenti più frequentemente impiegati sono i registri di monitoraggio AIFA (90%) seguiti dai flussi di consumo della spesa farmaceutica attraverso database/registri regionali (55%). In merito ai registri AIFA, dal momento che l’innovatività viene attribuita per singola indicazione terapeutica, essi sono necessari per monitorare le specifiche indicazioni per le quali il farmaco ha ottenuto lo status di innovativo. Pur essendo stati unanimemente riconosciuti dal campione come principale strumento di monitoraggio, sono considerati critici rispetto alla limitata restituzione dei flussi informativi (Materiale Supplementare 5).
Con “misurazione dell’impatto dell’allocazione intraregionale del FFI” si intende una valutazione di come le risorse del FFI siano utilizzate in relazione ai benefici clinici ottenuti dai farmaci con status di innovatività. Questa analisi da parte degli enti nazionali è considerata a oggi quasi assente: a livello locale, il 43% dei KOLs afferma che la misurazione non è per nulla condotta e il 29% che è condotta in modo parziale. Anche a livello regionale la sua implementazione è considerata frammentata a causa di una limitata conoscenza di dati informativi, con il 33% dei KOLs che ritiene che tale misurazione sia assente e il 50% che sostiene che sia svolta solo parzialmente (Materiale Supplementare 6).
Rispetto alla sezione D, “comprensione dei tempi di accesso dei farmaci al fondo nelle regioni/centri coinvolti e durata di permanenza nel fondo”, l’esistenza del FFI è considerata importante dall’85% degli intervistati per garantire una maggiore e tempestiva accessibilità al farmaco. Tuttavia, l’“adeguatezza della durata di permanenza nel fondo di 36 mesi” è segnalata come item a elevata criticità, con il 90% del campione che non ritiene adeguati i 36 mesi di innovatività piena (Materiale Supplementare 7). Ai fini di una rivalutazione rispetto a nuove alternative terapeutiche, gli esperti ritengono indispensabile una revisione periodica del farmaco. Emerge tuttavia l’esigenza di modulare il periodo di innovatività in base alla specifica condizione clinica e alle caratteristiche terapeutiche del farmaco. Come esempio, i clinici condividono che, per alcune terapie innovative oncologiche, un periodo di osservazione di 3 anni possa risultare inadeguato a valutare in maniera attendibile i principali esiti di sopravvivenza e qualità di vita, ritenendo necessari almeno 5 anni di monitoraggio.
L’unificazione del Fondo Farmaci Innovativi oncologici con il Fondo Farmaci Innovativi non oncologici ha ricevuto un parere ampiamente favorevole (67%) tra gli intervistati (Materiale Supplementare 8). Un consenso positivo emerge riguardo al superamento della logica a silos nella gestione dei fondi. Questo nuovo approccio consente un utilizzo più flessibile e integrato delle risorse disponibili e la possibilità di compensare eventuali squilibri tra i due fondi.
Critico è considerato l’item “necessità di interventi di ottimizzazione del processo di gestione del FFI”. Per ottimizzare la gestione del FFI emergono come prioritarie alcune azioni di miglioramento: il potenziamento del flusso informativo da AIFA verso regioni e aziende locali (punteggio medio 3,5/4) e una maggiore integrazione tra dati clinici (registri di monitoraggio AIFA) e dati amministrativi (Schede di Dimissione Ospedaliera, SDO) (punteggio 3,4/4). Queste azioni sono ritenute fondamentali per supportare sia la programmazione sanitaria che il monitoraggio dei farmaci innovativi (Materiale Supplementare 9).
Expert Meeting
Sulla base dei risultati raccolti dalla survey, è stato sviluppato un bersaglio di sintesi applicando la metodologia a punteggio alle sezioni che vanno dalla B alla F. Questa mappa di posizionamento ha permesso di segnalare le aree di maggiore criticità (aree rosse il cui indicatore si colloca nella parte più esterna del bersaglio) (Fig. 5).
Partendo da questa sintesi, l’Expert Meeting, la cui composizione è dettagliata nel Materiale Supplementare 10, ha discusso i risultati raggiunti e sviluppato una lista di raccomandazioni prioritarie secondo una prospettiva multilivello (locale, regionale e nazionale) (Tab. 2).
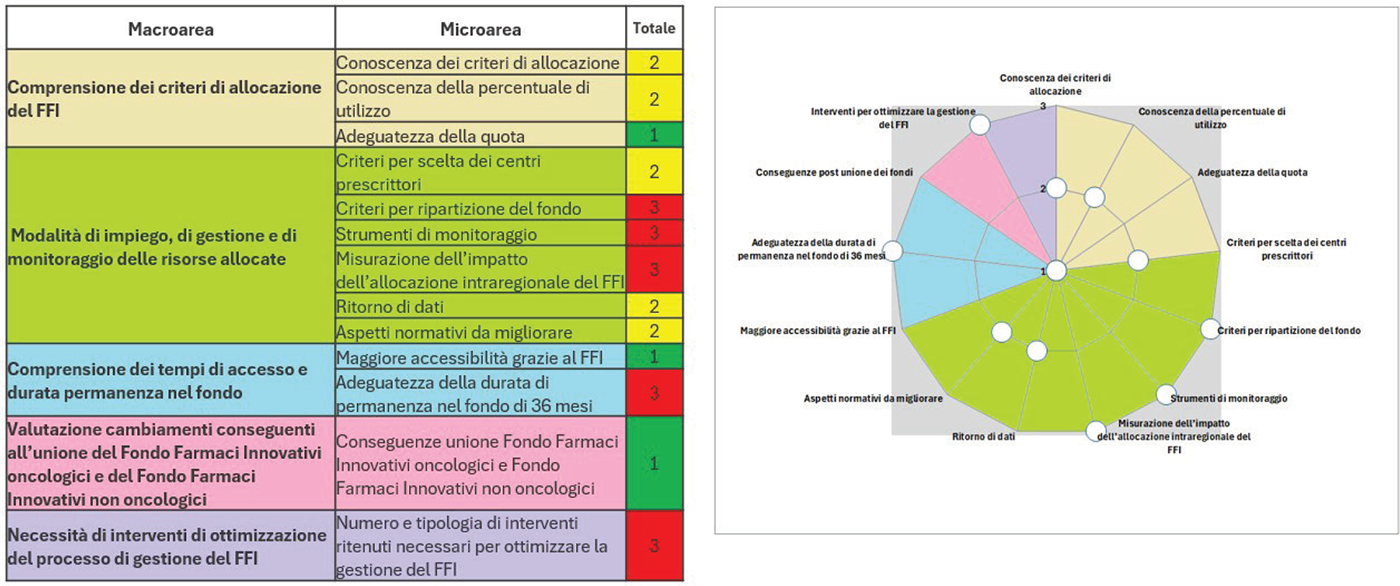
FIGURA 5 - Mappatura e gradiente delle criticità: un bersaglio di sintesi.
1 Area non critica
2 Area con criticità intermedia
3 Area critica
| Livello | Raccomandazioni |
|---|---|
| LOCALE |
|
| REGIONALE |
|
| Nazionale |
|
Discussione
L’analisi presentata ha esplorato peculiarità, differenze regionali e criticità nella gestione del FFI, dal punto di vista degli stakeholder responsabili dei processi, fornendo ai ricercatori e ai policy maker nuove evidenze sulle azioni prioritarie per ottimizzare la gestione del FFI ai diversi livelli del sistema sanitario. Il panel multidisciplinare considera il FFI uno strumento strategico per garantire un accesso non competitivo rispetto ad altri farmaci, facilitando la disponibilità di quelli con status di innovatività, grazie anche a una capienza ritenuta adeguata. Tuttavia, la gestione del FFI a livello regionale e locale presenta significative criticità, in particolare per quanto riguarda la selezione e l’autorizzazione dei centri prescrittori, il monitoraggio del consumo di risorse e la pianificazione dell’impatto derivante dall’ingresso o dall’uscita di farmaci dal fondo. Queste problematiche sono principalmente attribuite a un limitato flusso informativo verso gli enti locali, a un’allocazione dei fondi basata sul consumo e alla moltiplicazione dei processi contabili e organizzativi che ne derivano. Il flusso informativo presenta criticità a diversi livelli. A livello nazionale, circa metà del campione segnala una limitata frequenza di report informativi da parte di AIFA alle regioni, mentre, a livello regionale e locale, la comunicazione agli enti ospedalieri circa i dati mensili di utilizzo del FFI non è considerata sufficientemente tempestiva. Queste carenze informative ostacolano una programmazione efficace della spesa e delle attività ospedaliere. Inoltre, i clinici responsabili delle unità operative, direttamente coinvolti nella gestione del budget, evidenziano la necessità di ricevere aggiornamenti costanti sull’utilizzo del fondo.
In aggiunta, il flusso informativo risente della frammentarietà dei dati clinici estraibili dai registri e dell’assenza di un monitoraggio nazionale dei farmaci, nonostante quanto previsto inizialmente dalla Legge n. 232/2016. Per superare queste limitazioni, il panel di esperti propone una combinazione di interventi: un incremento della frequenza e della completezza dei dati relativi alla percentuale di utilizzo della spesa da parte di AIFA, l’implementazione di un sistema di estrazione di dati aggregati dai registri e/o lo sviluppo di una valutazione strutturata dell’impatto dei farmaci con indicazione innovativa, basata sulle informazioni presenti nei registri. L’esigenza di ottimizzare la tempestività del flusso informativo tra livello nazionale e regionale era già stata evidenziata dall’analisi di Jommi et al. (2021) (2). Il presente studio amplia tale prospettiva, offrendo una visione multidisciplinare e integrata dell’intero percorso di gestione del FFI, con raccomandazioni che includono anche una prospettiva bottom-up (dal livello locale a quello regionale e nazionale). L’adeguatezza del flusso informativo si lega fortemente al tema della programmazione. Come emerso dai risultati (61% dei responder), un’allocazione dei fondi basata principalmente sui dati epidemiologici dell’ultimo triennio risulta a oggi insufficiente. ll dato epidemiologico, infatti, non riflette sempre il reale fabbisogno terapeutico, poiché non tiene conto di fattori determinanti come il place in therapy dei nuovi farmaci, influenzato anche dalla disponibilità di alternative terapeutiche. Pertanto, oltre alla prevalenza e all’incidenza della patologia, si condivide la necessità di associare criteri complementari: lo storico dei consumi farmaceutici, il potenziale place in therapy e le capacità organizzative dei centri prescrittori nel somministrare le terapie innovative. Quest’ultimo aspetto comprende la presenza di percorsi assistenziali strutturati, la disponibilità di strumentazioni e di tecnologie dedicate, nonché l’adeguatezza delle risorse umane in termini di quantità, formazione e competenze specifiche.
Tra le azioni prioritarie implementabili a livello locale, il panel raccomanda di potenziare i modelli organizzativi basati sulla collaborazione tra clinici e farmacisti ospedalieri e di sviluppare sistemi di monitoraggio che garantiscano a direzioni strategiche e a clinici responsabili delle unità operative ospedaliere un accesso tempestivo ai dati di consumo del fondo. Una raccomandazione particolarmente rilevante per i policy maker regionali riguarda la necessità di implementare sistemi informatici per identificare e automatizzare la segnalazione dei farmaci con indicazione di innovatività terapeutica. Gli attuali sistemi, infatti, aumentano la probabilità di errori di rendicontazione e rallentano significativamente le attività di monitoraggio da parte dei farmacisti ospedalieri. A livello regionale, una pianificazione e una gestione efficaci dell’impatto di ingresso e di uscita dei farmaci dal FFI sulla specifica area terapeutica richiedono dati accurati, completi e tempestivi. Tuttavia, l’attuale flusso informativo tra livello nazionale, regionale e locale è percepito come inadeguato, contribuendo a generare significative disparità nelle capacità di programmazione tra le regioni.
Un’ulteriore criticità riguarda il metodo di allocazione delle risorse del FFI attualmente basato sul consumo farmaceutico, che non incentiva regioni ed enti locali a sviluppare progettualità con una visione di lungo periodo. Il panel suggerisce dunque una transizione da una logica di “fondo” a una di “investimento” basata su esiti di salute. Tale transizione potrebbe integrare l’uso dei farmaci innovativi in un programma più ampio di cura, screening e percorsi di prevenzione, valutando il loro impatto non solo come singole tecnologie, ma nell’intero percorso di cura del paziente.
Infine, emerge una criticità legata al mantenimento dello status di innovatività dei farmaci. L’analisi di Jommi et al. (2) evidenzia l’esigenza di estendere il periodo di innovatività solo in assenza di alternative terapeutiche disponibili. Dalla presente indagine, emerge inoltre che gli attuali 36 mesi di innovatività piena possono risultare insufficienti per una valutazione significativa degli endpoint clinici primari, che, nel caso di alcune condizioni oncologiche, sebbene siano presenti alternative terapeutiche, dovrebbero estendersi ad almeno 60 mesi. Il panel sottolinea dunque l’importanza di modulare la durata di permanenza dei farmaci nel FFI in base alla caratteristiche del farmaco e ai tempi per un follow-up clinico significativo.
Tali raccomandazioni forniscono contributi essenziali considerando l’attuale contesto di ridefinizione dei criteri di innovatività da parte della CSE di AIFA, attività prevista dalla Legge di Bilancio 2025 entro marzo 2025 (14). I risultati di questa analisi forniscono un duplice contributo: da un lato, supportano l’elaborazione di nuovi criteri di innovatività e di regole per l’accesso al FFI e, dall’altro, offrono ai policy maker e ai responsabili dei processi operativi Linee Guida concrete per ottimizzare la gestione complessiva del FFI.
Si evidenziano, tuttavia, alcune limitazioni. Sebbene l’approccio multiprofessionale abbia contribuito a una visione complessiva integrata dei processi di gestione del FFI, la composizione del campione non è stata uniforme né per numerosità né per il ruolo professionale degli esperti coinvolti. Questa disparità potrebbe aver influenzato i risultati, poiché alcune prospettive sono state sottorappresentate (direzione strategica) o sovrarappresentate (farmacisti ospedalieri). Infine, sebbene siano stati raccolti dati provenienti da nove regioni italiane, non è stata raggiunta la rappresentanza completa a livello nazionale. Tenuto conto che alcune specificità locali potrebbero non essere state considerate, l’applicabilità generale dei risultati e delle raccomandazioni potrebbe essere limitata.
Conclusioni
Il FFI assicura a livello nazionale l’accessibilità a farmaci designati come innovativi da parte di AIFA, garantendone la non competitività rispetto ad altre tecnologie farmaceutiche. L’analisi ha rilevato criticità principalmente legate alle potenziali distorsioni di un’allocazione dei fondi basata sul consumo, alla complessità dei processi organizzativi e contabili richiesti e all’eterogeneità regionale nell’implementazione degli strumenti di governance sanitaria. I risultati ottenuti contribuiscono a ridurre l’asimmetria informativa e a migliorare la comprensione complessiva dei processi gestionali, offrendo ai policy maker e ai responsabili operativi evidenze concrete per l’implementazione di strategie più efficaci. Tale processo consentirebbe di promuovere una pianificazione a lungo termine più efficace, di migliorare le performance del sistema sanitario e di ottimizzare l’impatto delle risorse impiegate nell’interesse della salute pubblica.
Acknowledgements
Questo progetto è stato condotto da PharmaLex Italy S.p.A. con il supporto del Professor Andrea Marcellusi, Università degli Studi di Milano. Gli Autori ringraziano per il loro prezioso contributo: Gianni Amunni (regione Toscana), Emanuele Angelucci (Policlinico San Martino, Genova), Sabrina Beltramini (Policlinico San Martino, Genova), Mauro Bonin (regione Veneto), Alberto Bortolami (regione Veneto), Ilaria Cutini (AOU Careggi, Firenze), Giulia De Marchi (AO Federico II, Napoli), Roberto Freilone (AOU Città della Salute e della Scienza, Torino), Maria Galdo (regione Campania), Vito Ladisa (IRCCS Istituto Nazionale dei Tumori, Milano), Lorella Lombardozzi (AO Sancamillo Forlanini, Roma), Andrea Marcellusi (Università degli Studi di Milano, Milano), Patrizia Nardulli (IRCCS Giovanni Paolo II, Bari), Vincenzo Panella (Roma), Paolo Pronzato (regione Liguria), Paola Rossi (regione Friuli-Venezia Giulia), Sara Sottosanti (AO Cattinara-Maggiore ASU GI, Trieste), Alessandra Stancari (Policlinico Sant’Orsola, Bologna), Antonietta Vozza (AO Federico II, Napoli).
Disclosures
Conflict of interest: Andrea Vitagliano, Marzia Bonfanti, Chiara Lucchetti, and Andrea Marcellusi declare they have no conflict of interest related to this article. Andrea Vitagliano, Marzia Bonfanti, and Chiara Lucchetti are employees of PharmaLex Italy S.p.A., and Andrea Marcellusi is Researcher Professor at Università degli Studi di Milano. Non-financial competing interest may be political, personal, or intellectual.
Financial support: The Authors Andrea Vitagliano, Marzia Bonfanti, and Chiara Lucchetti disclosed receipt of the following financial support for the research, authorship, and/or publication of this article: Gilead Sciences supported this work. All experts (with the exception of Paola Rossi who did not receive any fee) were compensated for their participation in the panel discussions, but received no payment related to the authorship of this manuscript. Medical Writing support was provided by Pharmalex Italy S.p.A. from Andrea Vitagliano, Marzia Bonfanti, and Chiara Lucchetti, and was funded by Gilead Sciences. No interferences occurred in carrying out the research project and in writing the manuscript for which the Authors hold the sole responsibility. The Authors made the final decision to submit the manuscript.
Data availability statement: The data presented in this study are available on request from the corresponding Author. The data are not publicly available due to restrictions because of corporate ownership rights.
Bibliografia
- 1. AIFA. Farmaci Innovativi. Online (Accessed November 2024)
- 2. Jommi C, Armeni P, Bertolani A, Costa F, Otto M. Il futuro dei Fondi per Farmaci Innovativi: risultati di uno studio basato su Delphi panel. Glob Reg Health Technol Assess. 2021;8:22-28. CrossRef PubMed
- 3. Gazzetta Ufficiale della Repubblica Italiana. Legge 11 dicembre 2016, n. 232. Online (Accessed November 2024)
- 4. Gazzetta Ufficiale della Repubblica Italiana. Decreto-Legge 25 maggio 2021, n. 73. Online (Accessed November 2024)
- 5. Gazzetta Ufficiale della Repubblica Italiana. Legge 30 dicembre 2021, n. 234. Online (Accessed November 2024)
- 6. Gazzetta Ufficiale della Repubblica Italiana. Decreto 16 febbraio 2018. Online (Accessed November 2024)
- 7. AIFA. Monitoraggio della Spesa Farmaceutica Nazionale e Regionale Gennaio-Dicembre 2023 Consuntivo. Online (Accessed November 2024)
- 8. Squillace A, Nardi S. Indagine civica sul grado di accesso ai farmaci innovativi. Cittadinanzattiva. Online (Accessed November 2024)
- 9. Davies EL, Bulto LN, Walsh A, et al. Reporting and conducting patient journey mapping research in healthcare: A scoping review. J Adv Nurs. 2023;79(1):83-100. CrossRef PubMed
- 10. Busetto L, Wick W, Gumbinger C. How to use and assess qualitative research methods. Neurol Res Pract. 2020;2(1):14. CrossRef PubMed
- 11. Martini M. Il benchmarking in Sanità Pubblica. Leadership Medica. 2001; 9:22. Online (Accessed November 2024)
- 12. Cicchetti DV, Shoinralter D, Tyrer PJ. The Effect of Number of Rating Scale Categories on Levels of Interrater Reliability: A Monte Carlo Investigation. Appl Psychol Meas. 1985;9(1):31–36. CrossRef
- 13. York Health Economics Consortium. Rating Scale (2016). Online (Accessed November 2024)
- 14. Camera dei deputati del Parlamento Italiano. Legge di Bilancio 2025 – Provvedimento 8 novembre 2024. Online (Accessed November 2024)