 |
Glob Reg Health Technol Assess 2024; 11: 223-230 ISSN 2283-5733 | DOI: 10.33393/grhta.2024.3309 ORIGINAL RESEARCH ARTICLE |
 |
Impatto economico di dapagliflozin nella gestione della malattia renale cronica in Italia: risultati di un modello di micro-simulazione
Economic impact of dapagliflozin in the management of chronic kidney disease in Italy: results from a micro-simulation model
Background: Dapagliflozin, approved in the treatment of patients with chronic kidney disease (CKD), has demonstrated attenuation of CKD progression and a reduced risk of cardio-renal outcomes and all-cause mortality (ACM) versus placebo, in addition to standard of care (SoC). The aim of this economic evaluation was to assess the potential medical care cost offsets associated with reduced rates of cardio-renal outcomes in Italy.
Methods: A comparative micro-simulation model estimated the outcome-related costs of dapagliflozin plus SoC versus SoC alone over a 3-year horizon based on the DAPA-CKD trial. Incidence rates of end-stage kidney disease (ESKD), hospitalizations for heart failure (hHF), acute kidney injury (AKI) and ACM were estimated for a treated population of 90,564 patients. Associated direct medical costs for non-fatal events (ESKD, hHF and AKI) were calculated using available literature and national tariffs. The analysis was restricted to outcome-associated costs and did not consider the cost of drug treatments and disease management.
Results: Patients treated with dapagliflozin plus SoC experienced fewer incident events of ESKD (6,540 vs 9,751), hHF (2,146 vs 4,242), AKI (3,772 vs. 5,271) and ACM (5,780 vs 8,037) per 90,564 treated patients versus those treated with SoC alone. Reductions (–35,6%) in clinical events (ESKD, hHF and AKI) were associated with a 34.4% reduction in total costs (€ 170 million) over 3 years. The clinical effect of dapagliflozin on ESKD management accounted for a € 134.5 million reduction in total costs.
Conclusion: Based on the DAPA-CKD trial, dapagliflozin may prevent cardio-renal event incidence with a positive effect upon the Italian National Healthcare Service (NHS). Over three years, we estimated that dapagliflozin can reduce the Italian NHS expenditure associated with the management of ESKD, hHF and AKI events by 34.4% (€ 170 million).
Keywords: Acute kidney injury, Chronic kidney disease, Cost, Dapagliflozin, End-stage kidney disease, Hearth failure
Received: September 20, 2024
Accepted: November 11, 2024
Published online: December 2, 2024
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La malattia renale cronica (Chronic Kidney Disease, CKD), definita come una ridotta velocità di filtrazione glomerulare (eGFR < 60 mL/min/1,73 m2) e/o un aumento del rapporto tra albumina/creatinina urinaria (ACR ≥ 30 mg/g) (1), è una condizione progressiva che, con una prevalenza stimata tra il 7% e il 14%, colpisce circa 700-840 milioni di persone in tutto il mondo (2-5).
La gravità della CKD è correlata all’entità della riduzione dell’eGFR e ai valori aumentati di ACR, utilizzati per classificare la malattia dallo stadio 1 (malattia lieve) allo stadio 5 (malattia grave), dove quest’ultimo identifica la perdita completa della funzione renale portando il paziente alla necessità di una terapia sostitutiva (dialisi o trapianto del rene) (1). I pazienti negli stadi 1 e 2 sono spesso asintomatici (6), mentre alcuni studi hanno dimostrato che il 70%-90% dei pazienti con malattia allo stadio 3 non sia consapevole della propria condizione clinica (7). Ciò ritarda l’accesso agli interventi che potrebbero rallentare o prevenire la progressione della malattia. Si stima, infatti, che circa la metà dei pazienti con CKD allo stadio 3 progredisca verso una malattia avanzata entro 10 anni (8). Esistono differenze sostanziali nel burden of disease tra gli stadi più precoci e quelli più avanzati della CKD, con pazienti che subiscono riduzioni significative della qualità di vita correlata alla salute (HRQoL) e dell’aspettativa di vita al momento della progressione verso l’insufficienza renale (9).
La CKD costituisce la terza causa di morte in tutto il mondo, in rapida crescita a causa dell’invecchiamento della popolazione e dell’aumento di fattori di rischio quali il diabete di tipo 2 (T2D), l’ipertensione e la glomerulonefrite (2,10-12).
La CKD favorisce l’infiammazione dei vasi sanguigni, che può avviare e accelerare lo sviluppo di scompenso cardiaco (Hearth Failure, HF), ictus, malattie vascolari periferiche e complicazioni renali associate, tra cui il danno renale acuto (Acute Kidney Injury, AKI) (13). I pazienti affetti da CKD sperimentano complicanze cardiovascolari e ospedalizzazioni con tassi 2-4 volte superiori rispetto alla popolazione generale (14). A causa di ciò, in tutto il mondo, alla CKD viene spesso associata una spesa sanitaria significativa (14,15) che aumenta alla progressione della malattia (16,17), con la somministrazione di una terapia sostitutiva nelle fasi avanzate (dialisi o trapianto del rene) che risulta essere ad alto costo (16,18). Una diagnosi tempestiva e una successiva gestione medica proattiva potrebbero attenuare la gravità della CKD, migliorando potenzialmente gli esiti clinici e riducendone l’impatto economico (19,20).
Recentemente, dapagliflozin, un inibitore del co-trasportatore sodio-glucosio di tipo 2 (sodium-glucose co-transporter 2, SGLT2), è stato rimborsato in Italia per il trattamento della CKD in pazienti con e senza T2D (21) sulla base dell’efficacia clinica dimostrata dallo studio Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease (DAPA-CKD) (22). Una recente analisi economica (23), condotta in 31 Paesi, ha stimato i costi correlati all’assistenza sanitaria associata alla riduzione dei tassi degli esiti clinici del trattamento con dapagliflozin in aggiunta alla terapia standard (SoC) rispetto alla sola SoC nel trattamento dei pazienti con CKD, lungo un orizzonte temporale di 3 anni. Nello specifico, applicando i risultati dello studio DAPA-CKD a una coorte di 100.000 pazienti trattati, l’analisi economica ha considerato i costi sanitari associati alla gestione dei seguenti esiti clinici: incidenza della malattia renale allo stadio terminale (End Stage Kidney Disease, ESKD), incidenza dei ricoveri per scompenso cardiaco (hHF), incidenza dei danni renali acuti (AKI) e mortalità per tutte le cause (All-Cause Mortality, ACM) (23). A fronte della riduzione del numero di eventi clinici (ESKD: 7.221 vs 10.676; hHF: 2.370 vs 4.684; AKI: 4.110 vs 5.819; ACM: 6.383 vs 8.875), ai pazienti trattati con dapagliflozin più SoC è stata associata una riduzione del 33% (264 milioni di dollari) dei costi totali per l’assistenza sanitaria in 3 anni (23).
In linea con quanto proposto dall’analisi internazionale (23), l’obiettivo della presente valutazione è stato stimare l’impatto economico di dapagliflozin in associazione alla SoC rispetto alla sola SoC nel trattamento degli eventi clinici ESKD, hHF e AKI nei i soggetti con CKD in Italia.
Metodi
Prospettiva
L’analisi economica ha considerato la prospettiva del Servizio Sanitario Nazionale (SSN), escludendo i costi a carico del paziente e quelli a carico della società.
Struttura del modello
L’analisi economica è stata condotta utilizzando un preesistente modello di coorte (23) che ha permesso di estrapolare lungo un orizzonte temporale di 3 anni gli esiti clinici analizzati nello studio DAPA-CKD quali ESKD, hHF, AKI e ACM (22,24). La stima del numero di eventi clinici per trattamento somministrato (dapagliflozin + SoC o SoC) è avvenuta applicando alla coorte di pazienti considerati una distribuzione esponenziale della sopravvivenza (23). Nel modello è stato assunto che il rischio di morte fosse uguale per tutti i pazienti (23).
Dopo aver assegnato un costo (diretto sanitario) di gestione a ciascun evento clinico (ESKD, hHF e AKI), il modello ha poi stimato il costo di gestione della malattia correlato a due scenari d’analisi alternativi: i) lo scenario 1, in cui l’intera coorte di pazienti con CKD viene trattata con la SoC, e ii) lo scenario 2, in cui l’intera coorte di pazienti con CKD viene trattata con dapagliflozin più SoC. La Figura 1 rappresenta in forma grafica la struttura del confronto tra i due scenari.
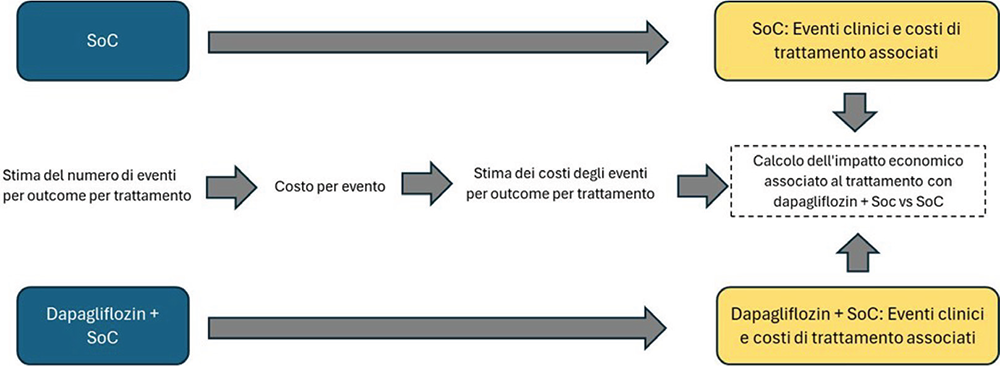
FIGURA 1 - Struttura in forma grafica del confronto tra i due scenari.
Orizzonte temporale
L’analisi è stata condotta considerando un orizzonte temporale di 3 anni, ritenuto sufficientemente lungo da descrivere le principali differenze economiche tra i due scenari confrontati. Infine, dal momento che, presentando flussi finanziari nel tempo, l’analisi qui condotta è riconducibile a un’analisi di Budget Impact (Budget Impact Analysis, BIA), in accordo con quanto indicato dalle linee guida ISPOR, non sono stati applicati tassi di sconto (25).
Popolazione
La presente analisi ha preso in considerazione la popolazione italiana che riflette i criteri di inclusione dello studio DAPA-CKD (22): pazienti adulti con CKD, con o senza T2D, con eGFR 25-75 mL/min per 1,73 m2 e/o un ACR di 200-5.000 mg/g al basale. In linea con tale indicazione, la stima del numero di pazienti con CKD eleggibili al trattamento con dapagliflozin considerati nel modello è stata effettuata partendo dalla popolazione adulta residente in Italia al 1° gennaio 2023 (Tab. 1) (26). Sulla base dei dati raccolti dallo studio CARHES (27,28), è stata considerata una prevalenza della CKD negli stadi 2-4 del 4,3% (Tab. 1). Sulla base della letteratura disponibile (29), si stima che il 15,2% di questi soggetti riceva una diagnosi di CKD (Tab. 1). Di questi si è assunto che il 77,1% sia in trattamento con SoC (30) e che il 36,0% presenti un ACR ≥ 200 mg/g (31) (Tab. 1). Così facendo, si stima che il numero totale di pazienti eleggibili al trattamento con dapagliflozin in associazione con la SoC sia pari a 90.564 (Tab. 1).
| Descrizione | Dato epidemiologico | Pazienti (n) | Fonte |
|---|---|---|---|
| Popolazione italiana (gennaio 2023) | 49.921.488 | (26) | |
| Popolazione CKD stadio 2-4 | 4,3% | 2.146.624 | (27,28) |
| Popolazione CKD stadio 2-4 diagnosticati | 15,2% | 326.287 | (29) |
| Popolazione CKD stadio 2-4 diagnosticati con SoC | 77,1% | 251.567 | (30) |
| Popolazione CKD stadio 2-4 diagnosticati con SoC e ACR ≥ 200 mg/g | 36,0% | 90.564 | (31) |
Eventi clinici
Il modello ha considerato quattro eventi clinici indagati dallo studio DAPA-CKD (22,24) per i quali dapagliflozin più SoC ha dimostrato un’efficacia statisticamente significativa rispetto alla SoC:
– insorgenza di ESKD, definita come dialisi per almeno 28 giorni, trapianto di rene o un eGFR < 15 mL/min/1,73 m2 confermato da una seconda misurazione dopo almeno 28 giorni;
– sviluppo di AKI e brusco declino della funzione renale, definito come un raddoppio della creatinina sierica tra due visite;
– ospedalizzazione per scompenso cardiaco (hHF);
– mortalità per tutte le cause (ACM).
La Tabella 2 riporta il dettaglio dei tassi per evento clinico per 1.000 anni-paziente calcolati nello studio DAPA-CKD (22,24).
| Eventi clinici | Tassi degli eventi clinici per 1.000 anni-paziente | |
|---|---|---|
| Dapagliflozin + SoC | SoC | |
| ESKD | 25,0 | 38,0 |
| hHF | 8,0 | 16,0 |
| AKI | 14,0 | 20,0 |
| Mortalità per tutte le cause | 22,0 | 31,0 |
Costi associati agli eventi clinici
Malattia renale allo stadio terminale (ESKD)
Il costo di trattamento associato alla gestione dell’evento ESKD è stato valorizzato con un importo di € 17.507,17, calcolato come media ponderata del costo medio annuo per la gestione della CKD allo stadio 5 (€ 6.499,38), della dialisi (€ 28.068,97) e del trapianto di rene (€ 61.304,34) (Tab. 3). La ponderazione del calcolo del costo medio è avvenuta considerando l’incidenza dei corrispondenti eventi così come rilevata nello studio DAPA-CKD (CKD stadio 5: 53,4%; emodialisi: 43,7%; trapianto: 2,9%) (22) (Tab. 3).
| ESKD | % utilizzo | Costo |
|---|---|---|
| – CKD stadio 5 | 53,4% | € 6.499,38 |
| – Dialisi | 43,7% | € 28.068,97 |
| – Trapianto | 2,9% | € 61.304,34 |
| Media ponderata | 100% | € 17.507,17 |
Il costo associato alla gestione della CKD nello stadio 5 è stato stimato considerando i risultati dello studio osservazionale IRIDE (32) condotto con l’obiettivo di valutare il costo di trattamento dei pazienti con CKD prima della dialisi. Nello specifico, in questo studio è stato stimato per la gestione della CKD nello stadio 5 un costo medio annuo pari a € 5.452,50 (di cui € 3.686,40 per farmaci, € 456,30 per visite, procedure diagnostiche ed esami di laboratorio ed € 1.309,80 per ricoveri in regime ordinario o accessi in Day Hospital). Poiché riferito all’anno 2014, tramite gli indici ISTAT (33), tale costo è stato rivalutato a gennaio 2024 per un importo corrispondente a € 6.499,38.
Il costo medio associato alla gestione dell’emodialisi di € 28.068,97 ha richiesto una procedura di calcolo più articolata (Tab. 4). Per prima cosa, sulla base di un’analisi condotta in due ospedali italiani (34), sono stati calcolati i costi medi annui associati all’esecuzione dell’emodialisi e della dialisi peritoneale pari a € 29.820,70 e a € 18.872,35, rispettivamente (Tab. 4). Per l’emodialisi sono state identificate tre tipologie di prestazioni (34) e le relative tariffe rimborsate dal SSN (35): i) emodialisi in bicarbonato e membrane sintetiche a basso e ad alto flusso (cod. 39.95.4; tariffa SSN: € 172,75 per singola seduta) (35), ii) emodiafiltrazione (cod. 39.95.5; tariffa SSN: € 240,00 per singola seduta) (35) e iii) altra emodiafiltrazione [Hemodia Filtration Reinfusion (HFR), Acetate Free Biofiltration (AFB), MID Dilution, MIXED Dilution] (cod. 39.95.7; tariffa SSN: € 240,00 per singola seduta) (35) (Tab. 4). Sulla base dell’attività erogata dai due ospedali (34) è stato associato un peso del 73,4% per l’emodialisi in bicarbonato e membrane sintetiche a basso e ad alto flusso, del 18,2% per l’emodiafiltrazione e dell’8,4% per l’altra emodiafiltrazione, ottenendo così un costo medio ponderato di € 190,63 per singola seduta (Tab. 4). Sempre facendo riferimento all’attività erogata dai due ospedali (34) sono state considerate mediamente tre sedute alla settimana per un totale di 52,14 settimane all’anno (365 giorni/7 giorni). Il costo medio di € 190,63 per singola seduta è stato poi moltiplicato per un totale annuo di 156,43 sedute (€ 29.820,70) (Tab. 4). Per la dialisi peritoneale sono state identificate due tipologie di prestazioni (34) e le relative tariffe rimborsate dal SSN (35): i) dialisi peritoneale automatizzata (CCPD e/o APD) con soluzioni di glucosio ipertoniche (cod. 54.98.1; tariffa SSN: € 54,70 per singola seduta) (35) e ii) dialisi peritoneale continua [CAPD] con addestramento (cod. 54.98.2; tariffa SSN: € 46,65 per singola seduta) (35) (Tab. 4). Sempre sulla base dell’attività erogata dai due ospedali (34) è stato associato un peso del 62,8% per la dialisi peritoneale automatizzata e del 37,2% per la dialisi peritoneale continua, ottenendo così un costo medio ponderato di € 51,71 per singola seduta (Tab. 4). Sempre facendo riferimento all’attività erogata dai due ospedali (34) sono state considerate mediamente 7 sedute alla settimana. Il costo medio di € 51,71 per singola seduta è stato poi moltiplicato per un totale annuo di 365 sedute (€ 18.872,35) (Tab. 4). Infine, sulla base di quanto indicato dal report 2021 del Registro Italiano di Dialisi e Trapianto (RIDT) (36), è stata associata una percentuale nazionale di utilizzo dell’84,0% all’emodialisi e una del 16,0% alla dialisi peritoneale, determinando un costo medio per la dialisi di € 28.068,97 (Tab. 4).
| Prestazioni | % di utilizzo | Tariffe nazionali | N. sedute | Costo annuo | % utilizzo nazionale |
|---|---|---|---|---|---|
| Emodialisi | € 190,63 | 156,43 | € 29.820,70 | 84,0% | |
| 39.95.4 emodialisi in bicarbonato e membrane sintetiche a basso e ad alto flusso | 73,4% | € 172,75 | |||
| 39.95.5 emodiafiltrazione | 18,2% | € 240,00 | |||
| 39.95.7 altra emodiafiltrazione [Hemodia Filtration Reinfusion (HFR), Acetate Free Biofiltration (AFB), MID Dilution, MIXED Dilution] | 8,4% | € 240,00 | |||
| Dialisi peritoneale | € 51,71 | 365,00 | € 18.872,35 | 16,0% | |
| 54.98.1 dialisi peritoneale automatizzata (CCPD e/o APD) con soluzioni di glucosio ipertoniche | 62,8% | € 54,70 | |||
| 54.98.2 dialisi peritoneale continua [CAPD] con addestramento | 37,2% | € 46,65 | |||
| Costo medio annuo ponderato dialisi | € 28.068,97 | ||||
Il costo medio di € 61.304,34 per la gestione del trapianto di rene è stato stimato sommando la tariffa DRG 302 di € 33.162,00 rimborsata dal SSN per il trapianto renale (37) ai costi di gestione del paziente nei 12 mesi dopo il trapianto pari a € 28.142,34 (38). Quest’ultimo valore è stato calcolato sulla base dei risultati di uno studio di Real-World Data (RWD) condotto in ambito nazionale che ha stimato il consumo di risorse a carico del SSN nei 12 mesi dopo il trapianto renale (38). Complessivamente al paziente sono stati associati costi per un importo di € 22.622,46, di cui € 11.294,21 per farmaci, € 5.736,31 per procedure diagnostiche, € 1.174,69 per dialisi ed € 4.417,25 per ricoveri. Poiché riferito all’anno 2011, tramite gli indici ISTAT (33), tale costo (€ 22.622,46) è stato rivalutato a gennaio 2024 per un importo corrispondente a € 28.142,34.
Ricovero per scompenso cardiaco (hHF)
Nell’analisi per valorizzare la gestione del ricovero ospedaliero per scompenso cardiaco (hHF) è stato considerato un costo medio di € 14.331,71 che include, oltre al costo per ricovero, anche la gestione del paziente nei successivi 12 mesi. Tale costo è stato calcolato sulla base dei dati raccolti da uno studio di Real-World Evidence (RWE) che ha utilizzato il database ARNO (39). Nello specifico, lo studio di RWE ha stimato un costo medio annuo per la gestione di un paziente con episodio di HF pari a € 11.864,00, di cui € 146,00 per farmaci HF specifici, € 1.051,00 per altri farmaci, € 630,00 per visite specialistiche ed esami diagnostici ed € 10.037,00 per ricovero. Poiché riferito all’anno 2012, tramite gli indici ISTAT (33), il costo stimato dallo studio di RWE (€ 11.864,00) è stato rivalutato a gennaio 2024 per un importo corrispondente a € 14.331,71.
Danni renali acuti (AKI)
La gestione di un episodio di danno renale acuto (AKI) è stata valorizzata considerando un importo di € 3.734,00, corrispondente alla remunerazione prevista dalla tariffa DRG 316 rimborsata dal SSN per il ricovero per insufficienza renale (37).
Output del modello
I risultati clinici ed economici sono stati stimati per una coorte di 90.564 pazienti con CKD eleggibili al trattamento con dapagliflozin seguita per tre anni. Il numero di eventi clinici ESKD, hHF, AKI e ACM viene presentato come incidenza cumulata a tre anni. L’impatto economico associato ai due scenari alternativi è presentato come dato sia cumulato a tre anni sia per singolo anno.
Risultati
Considerando una coorte di 90.564 pazienti con CKD, lo scenario che prevede l’aggiunta di dapagliflozin alla SoC determinerebbe, nei tre anni di osservazione, 2.257 ACM in meno rispetto allo scenario con la sola SoC (dapagliflozin più SoC: 5.780 decessi vs SoC: 8.307 decessi; –28,1%) (Tab. 5).
| Eventi clinici | Incidenza di eventi per 90.564 pazienti in 3 anni | |||
|---|---|---|---|---|
| Dapagliflozin + SoC | SoC | Variazione | ||
| Assoluta | % | |||
| ESKD | 6.540 | 9.751 | –3.212 | –32,9% |
| hHF | 2.146 | 4.242 | –2.095 | –49,4% |
| AKI | 3.722 | 5.271 | –1.548 | –29,4% |
| Mortalità per tutte le cause | 5.780 | 8.037 | –2.257 | –28,1% |
Grazie all’utilizzo di dapagliflozin in aggiunta alla SoC, il modello ha stimato una riduzione sostanziale della progressione degli eventi non fatali per ESKD, hHF e AKI (Tab. 5). Nell’arco di tre anni, infatti, si prevede che 3.212 pazienti (–32,9%) non progrediscano allo stadio di ESKD se trattati con dapagliflozin in aggiunta alla SoC rispetto alla sola SoC (dapagliflozin più SoC: 6.540 vs SoC: 9.751) (Tab. 5). Tale effetto clinico determinerebbe una conseguente riduzione di circa 134,5 milioni di euro dei costi sanitari a carico del SSN per la gestione dell’ESKD (dapagliflozin più SoC: € 279.687.367 vs SoC: € 414.272.632; –32,5%) (Tab. 6).
| Eventi clinici | Costo cumulativo degli eventi per 90.564 pazienti in 3 anni | |||
|---|---|---|---|---|
| Dapagliflozin + SoC | SoC | Variazione | ||
| Assoluta | % | |||
| ESKD | € 279.687.367 | € 414.272.632 | –€ 134.585.265 | –32,5% |
| hHF | € 30.758.838 | € 60.788.746 | –€ 30.029.908 | –49,4% |
| AKI | € 13.899.519 | € 19.680.174 | –€ 5.780.655 | –29,4% |
| Totale | € 324.345.724 | € 494.741.552 | –€ 170.395.828 | –34,4% |
Grazie all’effetto cardioprotettivo, con un tasso d’incidenza ridotto del 49,4% in tre anni, l’utilizzo di dapagliflozin determinerebbe una diminuzione di 2.095 casi di hHF rispetto alla sola SoC (dapagliflozin più SoC: 2.146 vs SoC: 4.242) (Tab. 5). In questo caso l’efficacia clinica di dapagliflozin determinerebbe una riduzione di circa 30 milioni di euro della spesa sanitaria associata alla gestione degli eventi di hHF (dapagliflozin più SoC: € 30.758.838 vs SoC: € 60.788.746; –49,4%) (Tab. 6).
Il modello di simulazione ha infine stimato l’impatto di dapagliflozin sulla progressione degli episodi di AKI. A fronte di una riduzione del 29,4% del tasso di incidenza a tre anni, dapagliflozin otterrebbe sulla coorte simulata 1.548 episodi di AKI in meno rispetto alla sola SoC (dapagliflozin più SoC: 3.722 vs SoC: 5.271) (Tab. 5). Anche se sensibilmente inferiore rispetto a ESKD e hHF, la riduzione del rischio di AKI associata al trattamento con dapagliflozin produrrebbe una diminuzione di circa 6 milioni di euro della spesa sanitaria diretta (dapagliflozin più SoC: € 13.899.519 vs SoC: € 19.680.174; –29,4%) (Tab. 6).
Il burden economico complessivo stimato nell’intero arco di analisi (3 anni) associato all’incidenza cumulata degli eventi ESKD, hHF e AKI (dapagliflozin più SoC: 12.408 vs SoC: 19.263; –35,6%) ammonterebbe a circa 324 milioni di euro per i pazienti trattati con dapagliflozin rispetto ai circa 495 milioni di euro per quelli trattati con la sola SoC (dapagliflozin più SoC: € 324.345.724 vs SoC: € 494.741.552), con una riduzione di circa 170 milioni di euro (–€ 170.395.828; –34,4%) (Tab. 6, Fig. 2).
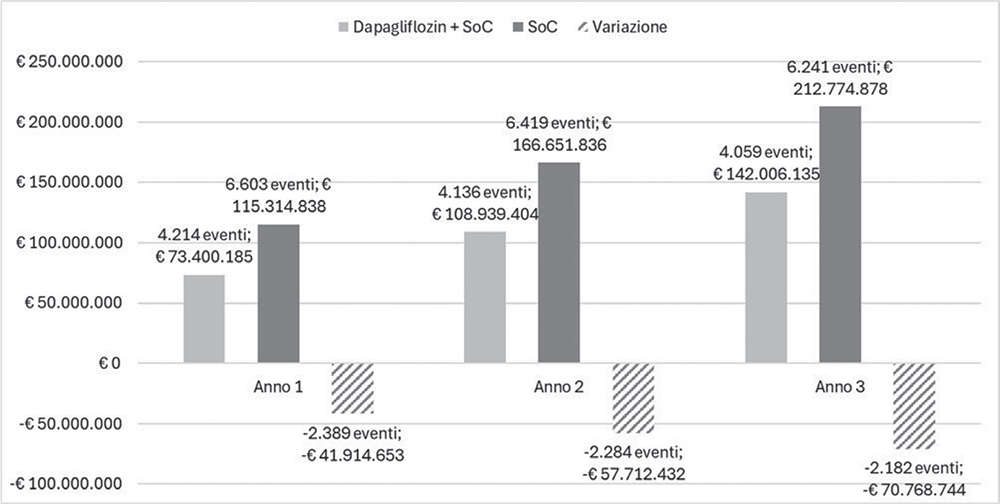
FIGURA 2 - Struttura del modello.
Anche se il differenziale del numero di eventi tra i due scenari diminuisce lievemente nel corso dei tre anni di osservazione (Anno 1: –2.389; Anno 2: –2.284; Anno 3: –2.182), si può notare come, a fronte di un minor numero di pazienti che nel tempo è ricorso alla dialisi, l’impatto finanziario (budget impact) del SSN a vantaggio dei pazienti trattati con dapagliflozin aumenti negli anni, passando da circa 42 milioni di euro del primo anno a circa 71 milioni di euro del terzo anno.
Discussione
La CKD è una grave condizione clinica, associata a morbilità e a significativi costi sanitari (23). Negli ultimi decenni è diventato sempre maggiore il bisogno insoddisfatto di nuove terapie in grado di ridurre la progressione della CKD e di proteggere, al contempo, dalle associate complicanze cardio-renali (23).
Le politiche per migliorare la gestione della CKD dovrebbero sfruttare approcci in linea con le risorse e le esigenze locali; lo screening sistematico è stato identificato come un passo fondamentale per indagare la prevalenza e ottimizzare gli interventi (40). A causa però dei vincoli di tempo e di budget, i policymaker fanno spesso ricorso alla modellizzazione per stimare le tendenze epidemiologiche future, gestirne l’incertezza e prevederne le implicazioni a lungo termine sulla spesa sanitaria (41). Infatti, le micro-simulazioni, integrando i dati clinici, possono simulare analisi a livello di popolazione proiettando sul medio-lungo periodo i risultati attesi (41). Per esempio, gli approcci a livello di paziente consentono di individuare eventi ricorrenti nei vari stati di salute che possono essere quantificati seguendo nel tempo un’ipotetica popolazione. Un approccio di questo tipo diventa importante in quanto permette di valutare come una specifica fascia demografica sia colpita da una patologia o come una malattia sia distribuita in modo diverso sulla base delle caratteristiche sottostanti. In quest’ottica, l’uso di un modello di micro-simulazione permette di valutare scenari alternativi che non possono essere studiati nel mondo reale, anticipando però il modo in cui un determinato scenario potrebbe svolgersi anni dopo.
Seguendo la logica applicata nel programma Inside-CKD (41), la presente analisi, utilizzando i risultati associati agli eventi clinici ESKD, hHF e AKI indagati nello studio DAPA-CKD (22), ha cercato di stimare, attraverso il popolamento di un modello di micro-simulazione, l’impatto economico correlato a due scenari alternativi in cui i pazienti italiani con diagnosi di CKD stadio 2-4 e/o ACR ≥ 200 mg/g possano ricevere o meno dapagliflozin in aggiunta alla SoC.
Considerando un’ipotetica coorte di 90.564 soggetti eleggibili al trattamento con dapagliflozin, a fronte di una riduzione del 35,6% (12.408 vs 19.263) degli eventi clinici ESKD, hHF e AKI, il trattamento con dapagliflozin in aggiunta alla SoC determinerebbe in tre anni un contenimento dei costi a carico del SSN di circa 170 milioni di euro (€ 324.345.724 vs € 494.741.552), di cui il 79,0% (circa 134,5 milioni di euro) imputabile alla gestione dell’ESKD, il 17,6% (circa 30 milioni di euro) alla gestione dell’hHF e il 3,4% (circa 5,7 milioni di euro) alla gestione dell’AKI. Effetti simili, sul breve termine, sono stati dimostrati in recenti studi retrospettivi di coorte (42) e in analisi modellistiche sugli inibitori SGLT2 (23,43,44).
I risultati di quest’analisi sottolineano l’importanza di rivedere i modelli organizzativi e di finanziamento a vantaggio di un’impostazione che non ragioni a livello di singola voce di spesa (ragionamento a silos), ma di budget di salute. Ciò vuol dire definire il livello standard dell’insieme di risorse sanitarie (tecnologie e professionali) necessarie a produrre determinati risultati di salute.
L’accesso limitato alle terapie sostitutive del rene al momento della progressione verso l’ESKD è causa di milioni di morti premature ogni anno a livello globale. Applicando la mortalità per tutte le cause osservata nello studio DAPA-CKD (22) alla coorte di 90.564 soggetti con diagnosi di CKD stadio 2-4 e/o ACR ≥ 200 mg/g, si stimano, nei tre anni, 8.037 decessi in caso di utilizzo della sola SoC e 5.780 decessi in caso di utilizzo di dapagliflozin più SoC; l’utilizzo di dapagliflozin determinerebbe una riduzione del 28,1% dei decessi.
Come ogni analisi modellistica, il presente lavoro è soggetto ad alcune ipotesi adottate per il popolamento dei dati del modello di micro-simulazione.
In primo luogo, si è ipotizzata una completa trasferibilità dei risultati dello studio DAPA-CKD (22), condotto in 21 Paesi, alla coorte dei 90.564 pazienti considerati per l’Italia, assumendo che questi ultimi avessero le stesse caratteristiche della popolazione arruolata nello studio DAPA-CKD (22). A giustificazione di ciò, si osserva che dapagliflozin ha dimostrato per tutti gli esiti dello studio benefici clinici simili in pazienti di razza diversa provenienti da differenti contesti geografici (Asia, Europa, America Latina e Nord America) (45,46).
In secondo luogo, la prevalenza del 4,2% dei pazienti eleggibili al trattamento con dapagliflozin (CKD stadio 2-4 diagnosticati con SoC e ACR ≥ 200 mg/g) (n = 90.564), calcolata rispetto alla coorte dei soggetti con CKD stadio 2-4 (n = 2.146.624), è risultata lievemente inferiore se confrontata con quella compresa nel range 5,3%-5,8% stimata da un recente studio osservazionale retrospettivo condotto utilizzando RWD riferiti al contesto nazionale (47). Di fatto, l’adozione di una prevalenza più alta aumenterebbe il beneficio economico a vantaggio del SSN.
In terzo luogo, nonostante sia stato fatto riferimento, quando possibile, ad analisi di RWD, per stimare i costi unitari utilizzati per valorizzare gli eventi ESKD, hHF e AKI si è fatto ricorso anche alla letteratura disponibile e alle tariffe rimborsate dal SSN, fonti queste ultime che potrebbero però non riflettere pienamente i costi della pratica clinica. Un’eventuale variazione di tali costi unitari determinerebbe un impatto sul risultato del caso base, senza però annullare il vantaggio economico associato all’utilizzo di dapagliflozin.
In quarto luogo, si osserva che la presente analisi ha di fatto escluso altri costi di trattamento attribuibili alla popolazione considerata, quali, per esempio, il costo di gestione degli eventi avversi correlati al trattamento. Quest’ultimo costo non è stato incluso nell’analisi in quanto il profilo di sicurezza di dapagliflozin è ben noto (48) e il farmaco è stato ben tollerato dai pazienti nello studio DAPA-CKD (22), senza che sia stato osservato un aumento statisticamente significativo degli eventi avversi correlati al trattamento. Pertanto, non ci si attende un impatto significativo sui risultati dall’inclusione del costo per la gestione degli eventi avversi correlati al trattamento.
In quinto luogo, dal momento che la presente analisi è stata condotta con l’obiettivo di stimare l’impatto economico a carico del SSN associato alla gestione degli eventi correlati alla CKD in Italia, non è stato incluso il costo di acquisto di dapagliflozin. Considerando l’attuale prezzo ex-factory al netto delle sole riduzioni obbligatorie di legge e un dosaggio giornaliero di 10 mg, il costo triennale di trattamento per dapagliflozin per singolo paziente sarebbe pari a € 1.329,25. Nell’assunzione che l’intera coorte dei pazienti (n = 90.564) assuma il trattamento farmacologico, la relativa spesa nei tre anni di osservazione a carico del SSN sarebbe di circa 120 milioni di euro, più che compensata dalla riduzione dei costi per la gestione degli eventi ESKD, hHF e AKI, stimata in circa 170 milioni di euro.
In sesto luogo, si osserva che i dati raccolti dallo studio CARHES (27,28), utilizzato in questa sede per stimare la prevalenza della CKD negli stadi 2-4, sono riferiti a una popolazione di età compresa tra i 35-79 anni. Ciò potrebbe aver determinato una sottostima della prevalenza della CKD negli stadi 2-4.
Inoltre, l’analisi economica, valutando la sola prospettiva del SSN, non ha considerato l’impatto dei costi a carico del paziente (costi diretti non sanitari) e quelli a carico della Società (costi indiretti). Secondo i risultati di uno studio di costo della malattia condotto nella regione Toscana sulla popolazione adulta con CKD stadio 4 o 5 (49), tali costi ammonterebbero a circa € 3.569,60 per paziente all’anno, di cui l’84,5% imputabile ai costi diretti sanitari (alimenti speciali a basso contenuto proteico, trasferimento, assistenza formale e informale) e il 15,5% ai costi indiretti (perdita di produttività dei pazienti e dei caregiver). L’inclusione di tali costi aumenterebbe il vantaggio economico a favore dei pazienti trattati con dapagliflozin.
Conclusioni
Lo studio clinico DAPA-CKD (22) ha dimostrato che la somministrazione di dapagliflozin in aggiunta alla SoC sia in grado di determinare dei benefici sulla progressione della CKD (riduzione degli eventi ESKD) e una riduzione degli eventi cardio-renali (hHF e AKI) e della mortalità per tutte le cause. La presente analisi ha cercato di tradurre in termini economici tale vantaggio clinico stimandone l’impatto a carico del SSN. Complessivamente, si stima che l’utilizzo di dapagliflozin possa ridurre la spesa sanitaria associata alla gestione degli eventi ESKD, hHF e AKI del 34,4%, con un potenziale risparmio di circa 170 milioni di euro che si ridurrebbe a 50 milioni di euro se venisse considerata anche la spesa associata al consumo di dapagliflozin.
Disclosures
Conflict of interest: LDN reported serving as an advisory board member for Astellas, AstraZeneca, Bayer e Novo Nordisk. The other Authors reported no conflict of interest.
Financial support: This research was made possible by an unrestricted educational grant from AstraZeneca S.p.A.
Bibliografia
- 1. Levey AS, de Jong PE, Coresh J, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2011;80(1):17-28. CrossRef PubMed
- 2. Hill NR, Fatoba ST, Oke JL, et al. Global prevalence of chronic kidney disease—a systematic review and meta-analysis. PLoS One. 2016;11(7):e0158765. CrossRef PubMed
- 3. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7-11. CrossRef PubMed
- 4. Lv JC, Zhang LX. Prevalence and disease burden of chronic kidney disease. Adv Exp Med Biol. 2019;1165:3-15. CrossRef PubMed
- 5. Jager KJ, Kovesdy C, Langham R, Rosenberg M, Jha V, Zoccali C. A single number for advocacy and communication-worldwide more than 850 million individuals have kidney diseases. Nephrol Dial Transplant. 2019;34(11):1803-1805. CrossRef PubMed
- 6. Hirst JA, Hill N, O’Callaghan CA, et al. Prevalence of chronic kidney disease in the community using data from OxRen: a UK population-based cohort study. Br J Gen Pract. 2020;70
(693):e285-e293. CrossRef PubMed - 7. Abdul Sultan A, Wittbrodt E, Malvolti E, et al. POS-300 Patient-reported early stage chronic kidney disease. Kidney Int Rep. 2021;6(4):S129. CrossRef
- 8. Baek SD, Baek CH, Kim JS, Kim SM, Kim JH, Kim SB. Does stage III chronic kidney disease always progress to end-stage renal disease? A ten-year follow-up study. Scand J Urol Nephrol. 2012;46(3):232-238. CrossRef PubMed
- 9. Pagels AA, Söderkvist BK, Medin C, Hylander B, Heiwe S. Health-related quality of life in different stages of chronic kidney disease and at initiation of dialysis treatment. Health Qual Life Outcomes. 2012;10(1):71. CrossRef PubMed
- 10. Xie Y, Bowe B, Mokdad AH, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. Kidney Int. 2018;94(3):567-581. CrossRef PubMed
- 11. Carpio EM, Ashworth M, Asgari E, et al. Hypertension and cardiovascular risk factor management in a multi-ethnic cohort of adults with CKD: a cross sectional study in general practice. J Nephrol. 2022;35(3):901-910. CrossRef PubMed
- 12. Cockwell P, Fisher L-A. The global burden of chronic kidney disease. Lancet. 2020;395(10225):662-664. CrossRef PubMed
- 13. Jankowski J, Floege J, Fliser D, Böhm M, Marx N. Cardiovascular disease in chronic kidney disease: pathophysiological insights and therapeutic options. Circulation. 2021;143(11):1157-1172. CrossRef PubMed
- 14. Darlington O, Dickerson C, Evans M, et al. Costs and healthcare resource use associated with risk of cardiovascular morbidity in patients with chronic kidney disease: evidence from a systematic literature review. Adv Ther. 2021;38(2):994-1010. CrossRef PubMed
- 15. Saran R, Robinson B, Abbott KC, et al. US renal data system 2019 annual data report: epidemiology of kidney disease in the United States. Am J Kidney Dis. 2020;75(1)(suppl 1):A6-A7. CrossRef PubMed
- 16. Elshahat S, Cockwell P, Maxwell AP, Griffin M, O’Brien T, O’Neill C. The impact of chronic kidney disease on developed countries from a health economics perspective: A systematic scoping review. PLoS One. 2020;15(3):e0230512. CrossRef PubMed
- 17. Wyld ML, Lee CM, Zhuo X, et al. Cost to government and society of chronic kidney disease stage 1-5: a national cohort study. Intern Med J. 2015;45(7):741-747. CrossRef PubMed
- 18. Vanholder R, Annemans L, Brown E, et al; European Kidney Health Alliance. Reducing the costs of chronic kidney disease while delivering quality health care: a call to action. Nat Rev Nephrol. 2017;13(7):393-409. CrossRef PubMed
- 19. Levin A, Rigatto C, Brendan B, et al; CanPREDDICT investigators. Cohort profile: canadian study of prediction of death, dialysis and interim cardiovascular events (CanPREDDICT). BMC Nephrol. 2013;14(1):121. CrossRef PubMed
- 20. Shlipak MG, Tummalapalli SL, Boulware LE, et al; Conference Participants. The case for early identification and intervention of chronic kidney disease: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2021;99(1):34-47. CrossRef PubMed
- 21. Agenzia Italiana del Farmaco. Determina 13 gennaio 2023.Regime di rimborsabilita’ e prezzo a seguito di nuove indicazioni terapeutiche e riclassificazione, ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537, del medicinale per uso umano «Forxiga». (Determina n. 6/2023). (23A00305) (GU Serie Generale n.17 del 21-01-2023). Online (Accessed September 2024)
- 22. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in patients with chronic kidney disease. N Engl J Med. 2020;383(15):1436-1446. CrossRef PubMed
- 23. McEwan P, Hafner M, Jha V, et al. Translating the efficacy of dapagliflozin in chronic kidney disease to lower healthcare resource utilization and costs: a medical care cost offset analysis. J Med Econ. 2023;26(1):1407-1416. CrossRef PubMed
- 24. Heerspink HJL, Cherney D, Postmus D, et al; DAPA-CKD Trial Committees and Investigators. A pre-specified analysis of the Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease (DAPA-CKD) randomized controlled trial on the incidence of abrupt declines in kidney function. Kidney Int. 2022;101(1):174-184. CrossRef PubMed
- 25. Mauskopf JA, Sullivan SD, Annemans L, et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on good research practices--budget impact analysis. Value Health. 2007;10(5):336-347. CrossRef PubMed
- 26. Istat. Demografia in cifre. Popolazione residente per sesso, età e stato civile al 1° gennaio 2023. Online (Accessed September 2024)
- 27. De Nicola L, Donfrancesco C, Minutolo R, et al. [Epidemiology of chronic kidney disease in Italy: current state and contribution of the CARHES study]. Ital Nefrol. 2011;28(4):401-407. PubMed
- 28. Conte G, De Nicola L, Minutolo R, Studio CARHES, 44° Congresso Nazionale di Cardiologia, Firenze 30 maggio – 1 giugno 2013. Data on file.
- 29. Conte G, Pacilio M, Garofalo C, Liberti ME, Provenzano M, Santangelo S. [Epidemiology of CKD in Italy and prevention strategies]. G Ital Nefrol. 2014;31(4):gin/31.4.11. PubMed
- 30. Cupisti A, Vigo V, Baronti ME, D’Alessandro C, Ghiadoni L, Egidi MF. Vitamin D status and cholecalciferol supplementation in chronic kidney disease patients: an Italian cohort report. Int J Nephrol Renovasc Dis. 2015;8:151-157. CrossRef PubMed
- 31. Molly Murton 1, Danielle Goff-Leggett 1, Anna Bobrowska et al. Burden of Chronic Kidney Disease by KDIGO Categories of Glomerular Filtration Rate and Albuminuria: A Systematic Review. Adv Ther 2021 Jan; 38 (1): 180-200. CrossRef PubMed
- 32. Jommi C, Armeni P, Battista M, et al; IRIDE Study Group. The Cost of Patients with Chronic Kidney Failure Before Dialysis: Results from the IRIDE Observational Study. PharmacoEconom Open. 2018;2(4):459-467. CrossRef PubMed
- 33. Istat. Rivaluta. Rivalutazioni e documentazione su prezzi, costi e retribuzioni contrattuali. Online (Accessed September 2024)
- 34. Vaccaro CM, Sopranzi F. A comparison between the costs of dialysis treatments in Marche Region, Italy: Macerata and Tolentino hospitals. Ann Ist Super Sanità 2017 | Vol. 53, No. 4: 344-349. Online (Accessed September 2024)
- 35. Ministero della Salute. Tariffe massime di riferimento per la remunerazione delle prestazioni di assistenza specialistica ambulatoriale e di assistenza protesica. Online (Accessed September 2024)
- 36. Società Italiana Nefrologia. Registro Italiano di Dialisi e Trapianto (RIDT) Report Anno 2021. Online (Accessed September 2024)
- 37. Gazzetta Ufficiale della Repubblica Italiana. Remunerazione delle prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. Supplemento ordinario alla “Gazzetta Ufficiale” n. 23 del 28 gennaio 2013 – Serie generale. Online (Accessed September 2024)
- 38. Roggeri DP, Roggeri A, Zocchetti C, Cozzolino M, Rossi C, Conte F. Real-world data on healthcare resource consumption and costs before and after kidney transplantation. Clin Transplant. 2019;33(10):e13728. CrossRef PubMed
- 39. Maggioni AP, Orso F, Calabria S, et al; ARNO Observatory. The real-world evidence of heart failure: findings from 41 413 patients of the ARNO database. Eur J Heart Fail. 2016;18(4):
402-410. CrossRef PubMed - 40. Nagib SN, Abdelwahab S, Amin GEE, Allam MF. Screening and early detection of chronic kidney disease at primary healthcare. Clin Exp Hypertens. 2021;43(5):416-418. CrossRef PubMed
- 41. Tangri N, Chadban S, Cabrera C, Retat L, Sánchez JJG. Projecting the Epidemiological and Economic Impact of Chronic Kidney Disease Using Patient-Level Microsimulation Modelling: Rationale and Methods of Inside CKD. Adv Ther. 2023;40(1):
265-281. CrossRef PubMed - 42. Dwyer JP, Agiro A, Desai P, Cremisi H. Short-term costs in patients with chronic kidney disease treated with dapagliflozin: a retrospective cohort study. Expert Rev Pharmacoecon Outcomes Res. 2023;23(9):1057-1066. CrossRef PubMed
- 43. de Pouvourville G, Rossignol P, Boussahoua M, et al. Budget impact analysis of expanding gliflozin coverage in the CKD population: a french perspective. Adv Ther. 2023;40(9):3751-3769. CrossRef PubMed
- 44. Alnsasra H, Tsaban G, Solomon A, et al. Dapagliflozin versus empagliflozin in patients with chronic kidney disease. Front Pharmacol. 2023;14:1227199. CrossRef PubMed
- 45. Vart P, Jongs N, Wheeler DC, Heerspink HJL, Langkilde AM, Chertow GM. Effectiveness and safety of dapagliflozin for black vs white patients with chronic kidney disease in North and South america: a secondary analysis of a randomized clinical trial. JAMA Netw Open. 2023;6(4):e2310877. CrossRef PubMed
- 46. Vart P, Correa-Rotter R, Hou FF, et al. Efficacy and safety of dapagliflozin in patients with CKD across major geographic regions. Kidney Int Rep. 2022;7(4):699-707. CrossRef PubMed
- 47. Piccinni C, Dondi L, Calabria S, et al. Chronic Kidney Disease Eligible for SGLT2 Inhibitors Through the Integration of Italian Administrative and Primary Care Data. G Ital Nefrol. 2024;41(3):2024-vol3. CrossRef PubMed
- 48. Scheen AJ. An update on the safety of SGLT2 inhibitors. Expert Opin Drug Saf. 2019;18(4):295-311. CrossRef PubMed
- 49. Turchetti G, Bellelli S, Amato M, et al; On Behalf of the Tuscany CKD Study Group. The social cost of chronic kidney disease in Italy. Eur J Health Econ. 2017;18(7):847-858. CrossRef PubMed