 |
Glob Reg Health Technol Assess 2025; 12: 49-60 ISSN 2283-5733 | DOI: 10.33393/grhta.2025.3292 ORIGINAL RESEARCH ARTICLE |
 |
Ottimizzazione nel trattamento del soggetto con HIV: analisi di impatto economico e organizzativo di Bictegravir/Emtricitabina/Tenofovir Alafenamide
Optimization in the HIV treatment: economic and organizational impact analysis of Bictegravir/Emtricitabine/Tenofovir Alafenamide
Introduction: Given the availability of a growing number of HIV treatment options, it becomes essential to have a clear understanding of the related economic-organizational evidence, to operate informed and conscious choices. The study aims to define the economic and organizational impact related to a consolidated use of Bictegravir/Emtricitabine/Tenofovir Alafenamide (BIC/FTC/TAF), within the Italian National Healthcare Service (NHS), for the treatment of both naïve and experienced HIV individuals.
Materials and methods: A budget impact analysis was developed assuming the NHS perspective and considering a 36-month time horizon. Scenario A, representative of the current situation of consumption of the different therapeutic alternatives (derived from the most update guidelines), was compared with Scenario B, assuming a greater adoption of BIC/FTC/TAF. An organizational impact analysis was conducted to define any advantages for hospitals, devoted to the management of any ART-related adverse events.
Results: The BIA revealed an economic saving of 0.97% (26,040,271.36 €) given a higher penetration rate for BIC/FTC/TAF, for the treatment of HIV individuals assuming ART in Italy. From an organizational perspective, a greater BIC/FTC/TAF administration would generate a reduction in the overall hospital accesses devoted to the management of adverse events, generating an overall saving of 245,938 hours, considering the time spent by the healthcare professionals involved in the care and treatment of individuals with HIV.
Conclusions: BIC/FTC/TAF represent an interesting possibility for the rapid initiation of ART, as well as for switches, being able to optimize the clinical pathway of a patient with HIV, from an economic and organizational perspective.
Keywords: BIC/FTC/TAF, Budget Impact Analysis, HIV, Italian setting, Organizational impact
Received: September 6, 2024
Accepted: February 3, 2025
Published online: February 26, 2025
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2025 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’innovazione terapeutica nel contesto del trattamento del virus dell’immunodeficienza umana (HIV), in termini di sviluppo di nuove terapie antiretrovirali (di seguito ART), ha modificato la prognosi dell’infezione stessa, trasformandola da patologia acuta in malattia cronica, con conseguenze significative in termini di qualità di vita (1) e con un’aspettativa di vita quasi sovrapponibile a quella dei soggetti non infetti (2). La disponibilità, inoltre, di strategie terapeutiche sempre più personalizzate permette ai clinici di scegliere il regime terapeutico più appropriato a seconda del tipo di paziente e della condizione clinica che sta attraversando, ottimizzandone la compliance. In linea generale, gli obiettivi specifici dell’ART risultano essere la soppressione duratura della replicazione virale, promuovendo di conseguenza il recupero del sistema immunitario, aumentando il numero dei linfociti T-CD4+ (3) (direttamente colpiti dal virus), nonché la riduzione degli effetti collaterali e della manifestazione di altre malattie legate all’HIV.
L’introduzione nella pratica clinica, nel 2007, degli inibitori dell’integrasi (INSTI) ha rappresentato un progresso significativo nel trattamento dell’infezione da HIV, rendendo disponibile una classe di farmaci con un meccanismo d’azione nuovo e una nuova opzione di trattamento per i soggetti affetti dalla patologia, incrementando il profilo di efficacia e di tollerabilità complessivo (4).
Tra gli INSTI maggiormente somministrati e il cui utilizzo rientra tra i gold standard delle Linee Guida internazionali, è disponibile nella pratica clinica il Bictegravir (BIC), in co-formulazione con FTC/TAF (Emtricitabina e Tenofovir Alafenamide) (5), proposto come trattamento antiretrovirale completo in un’unica compressa (STR, single tablet regimen), somministrata una volta al giorno. Tale principio attivo viene indicato per il trattamento dell’HIV in pazienti adulti e pediatrici di età pari o superiore ai 2 anni e con un peso corporeo di almeno 14 kg senza evidenza presente o passata di resistenza virale alla classe degli inibitori dell’integrasi, all’Emtricitabina o al Tenofovir (6).
Le evidenze scientifiche (7,8) hanno dimostrato come, nei pazienti affetti da HIV, sia naïve al trattamento sia trattati con precedente esposizione agli antiretrovirali, la combinazione Bictegravir/Emtricitabina/Tenofovir Alafenamide (BIC/FTC/TAF) sia efficace e ben tollerata, mostrando il raggiungimento della soppressione virologica (in termini di HIV RNA < 50 copie/mL) che va dall’89% al 92% nei pazienti treatment-naïve e dal 93% al 95% nei pazienti treatment-experienced (9-11).
Dal momento che l’ART ha modificato nel tempo la gestione della patologia, migliorando il profilo di efficacia in termini sia di ottimizzazione del percorso clinico del paziente sia di tollerabilità e di sicurezza della terapia stessa, i decisori di spesa e i clinici si trovano a poter scegliere tra un numero crescente di farmaci anti-HIV. Sono quindi necessari dati ed evidenze chiari per selezionare la migliore strategia terapeutica, concentrandosi non solo sul profilo di efficacia, informazione ampiamente dimostrata e consolidata all’interno della letteratura scientifica, ma anche sul profilo economico-finanziario, oltre che su quello organizzativo, comprendendo così il potenziale impatto sulla struttura sanitaria che prende in carico tali pazienti.
Ciò permetterebbe di colmare un importante knowledge gap, in quanto la letteratura disponibile focalizza primariamente l’attenzione sulla definizione della natura costo-efficace dei regimi terapeutici disponibili (12,13) o sui costi correlati alle mancate diagnosi (14), senza fornire indicazioni specifiche non solo circa il reale assorbimento di risorse economiche stratificato per popolazione treatment-naïve e treatment-experienced, sia essa o meno in controllo virologico (HIV RNA < 50 copie/mL), ma soprattutto in riferimento all’impatto organizzativo in capo alla struttura sanitaria per la corretta gestione del soggetto con infezione da HIV e degli eventuali eventi avversi ART-correlati.
L’approfondimento di tale tematica risulta essere importante, poiché consentirebbe di generare evidenze utili per supportare le decisioni al fine di ottimizzare l’uso di terapie consolidate, caratterizzate da un alto profilo di efficacia e sicurezza (come BIC/FTC/TAF). Inoltre, tale analisi permetterebbe non solo di definire i benefici effettivamente ottenuti ma anche di verificare se le aspettative del Sistema Sanitario Nazionale (SSN) in fase di negoziazione siano state rispettate o se, al contrario, il Sistema abbia tratto ulteriori vantaggi sia in termini di sicurezza sia sotto il profilo organizzativo.
Sulla base di tali premesse, l’obiettivo generale della presente attività di ricerca risulta essere la definizione dell’impatto economico e organizzativo correlato a un utilizzo consolidato del farmaco BIC/FTC/TAF, per il trattamento della popolazione affetta da HIV, all’interno del contesto italiano, così da costituire una base dati per future valutazioni di policy making, andando a definire benefici e costi sostenuti.
Metodologia
Disegno dell’analisi
Per il raggiungimento dell’obiettivo citato sopra, è stata condotta un’analisi di impatto sul budget (Budget Impact Analysis, BIA) (15), così da rappresentare l’evoluzione della spesa sanitaria del SSN italiano, nell’arco dei tre anni, considerando l’intera popolazione HIV italiana in trattamento antiretrovirale.
Nel caso affrontato, la BIA prevede la comparazione tra uno scenario basale, che verrà denominato Scenario A (rappresentativo della situazione di consumo e del tasso di penetrazione delle differenti alternative terapeutiche utilizzate nella pratica clinica per il trattamento dell’HIV, nel corso dell’anno 2022, come da Linee Guida (16,17)), e uno scenario innovativo, che verrà denominato Scenario B, che prevede una modifica nel tasso di consumo dei medesimi farmaci, ipotizzando una maggiore apertura del mercato nei confronti di BIC/FTC/TAF, così come mostra la Tabella 1. Le proiezioni e le quote di mercato sono state validate attraverso un approccio Delphi (18), raccogliendo le opinioni di un panel di esperti clinici e farmacisti (nello specifico 4 dirigenti medici in infettivologia, nonché 2 dirigenti medici operanti all’interno della Farmacia Ospedaliera), oltre che di 2 economisti sanitari esperti nel management del paziente con HIV.
A corredo dell’analisi di impatto economico, è stata condotta un’analisi di impatto organizzativo così da comprendere eventuali vantaggi per la struttura ospedaliera, in riferimento alla fase di utilizzo consolidato del farmaco BIC/FTC/TAF, in un’ottica di liberazione di risorse organizzative così da incrementare la capacity complessiva di sistema, dovuti a un miglioramento nel profilo complessivo di occorrenza e gestione degli eventi avversi farmaco-correlati. L’analisi di natura organizzativa ha contemplato sia una valutazione relativamente alla liberazione di slot ambulatoriali sia una valutazione con riferimento alla riduzione delle giornate di degenza.
I dati di input
Ai fini dell’analisi economico-organizzativa, è stata condotta una review narrativa della letteratura, così da comprendere la dimensione del problema di salute, in termini di definizione della popolazione target in trattamento antiretrovirale nel corso dell’anno 2022, e da identificare gli indicatori clinici di efficacia (in termini di raggiungimento di una soppressione virologica) e di sicurezza (misurata come occorrenza di eventi avversi farmaco-correlati), che agiranno come parametri di input per la valutazione. In riferimento a quest’ultimo punto, infatti, i dati di incidenza degli eventi avversi (considerando nello specifico un grado di severità IV o superiore) nonché il parametro di efficacia terapeutica dei trattamenti (vale a dire la percentuale di pazienti con HIV RNA < 50 copie/mL) sono stati debitamente riportati alla popolazione rispetto alle indicazioni di prescrivibilità e di utilizzo richieste da parte della normativa e delle principali Linee Guida cliniche del contesto nazionale di riferimento (Tabella Supplementare 1). Sono stati, nello specifico, preferiti disegni degli studi tipo “randomized controlled trial” e, per questa ragione, altre evidenze con differenti disegni degli studi sono state oggetto di esclusione.
| Regimi terapeutici SCENARIO A |
Popolazione prevalente treatment-naïve | Popolazione incidente treatment-naïve | Popolazione treatment-experienced |
|---|---|---|---|
| BIC/FTC/TAF | 24% | 50% | 25% |
| 3TC/ABC/DTG | 44% | 22% | 4% |
| FTC/TAF+DTG | 12% | 8% | 3% |
| DTG/3TC | 15% | 15% | 40% |
| FTC/TAF/RPV | 1% | 1% | 10% |
| FTC/TAF/DRV/COB | 1% | 1% | 1% |
| FTC/TAF/EVG/COB | 1% | 1% | 1% |
| FTC/TAF+RAL | 1% | 1% | 1% |
| FTC/TDF/RPV | 1% | 1% | 0% |
| DTG/RPV | 0% | 0% | 15% |
| Totale | 100% | 100% | 100% |
| Regimi terapeutici SCENARIO B |
Popolazione prevalente treatment-naïve | Popolazione incidente treatment-naïve | Popolazione treatment-experienced |
| BIC/FTC/TAF | 35,00% | 60% | 40% |
| 3TC/ABC/DTG | 37,63% | 17,60% | 3,52% |
| FTC/TAF+DTG | 10,26% | 6,40% | 2,08% |
| DTG/3TC | 12,83% | 12,00% | 32,00% |
| FTC/TAF/RPV | 0,86% | 0,80% | 8,18% |
| FTC/TAF/DRV/COB | 0,86% | 0,80% | 0,62% |
| FTC/TAF/EVG/COB | 0,86% | 0,80% | 0,80% |
| FTC/TAF + RAL | 0,86% | 0,80% | 0,80% |
| FTC/TDF/RPV | 0,86% | 0,80% | 0,00% |
| DTG/RPV | 0,00% | 0,00% | 12,00% |
| Totale | 100% | 100% | 100% |
In secondo luogo, è stata condotta una valorizzazione economica del percorso di trattamento e cura del paziente con infezione da HIV, stratificando il risultato sulla base della strategia terapeutica assunta, in un’ottica di Activity Based Costing (19). Nello specifico, sono state prese in considerazione le seguenti voci di costo diretto sanitario: esami di laboratorio, prestazioni diagnostiche, visite specialistiche, ospedalizzazioni, ART e ulteriori trattamenti farmacologici territoriali, il tutto considerando prestazioni e farmaci legati sia alla gestione della patologia che a eventuali eventi avversi farmaco-correlati o a ulteriori comorbidità di cui soffre il paziente, così da fornire una fotografia a 360 gradi delle risorse complessivamente assorbite.
La valorizzazione economica è stata condotta, assumendo il punto di vista del SSN, prendendo in considerazione le tariffe nazionali di rimborso della specialistica ambulatoriale e dell’assistenza ospedaliera, valide per l’anno 2023. I costi delle terapie antiretrovirali derivano, invece, dall’ultima gara ARIA dell’aprile 2019, così come pubblicato anche all’interno del PDTA dell’HIV, di riferimento per la Regione Lombardia, per l’anno 2021.
Da un lato, i dati relativi al numero e alla tipologia di esami di laboratorio, prestazioni diagnostiche e visite specialistiche nonché le informazioni relative ai trattamenti farmacologici territoriali e alle ospedalizzazioni derivano da dati real-life raccolti negli anni 2019-2021, all’interno di una coorte di pazienti HIV-experienced in controllo virologico, provenienti da due centri della Regione Lombardia, e rappresentano così il costo base della valutazione economica. Si specifica che i centri coinvolti, anche se situati in una specifica Regione, potrebbero essere considerati come rappresentativi dei percorsi e degli approcci, generalmente utilizzati per la gestione dei pazienti con HIV e dei relativi trattamenti, con una prospettiva nazionale più ampia. I protocolli e le procedure utilizzati sono infatti sovrapponibili nei diversi contesti regionali e ben allineati con le Linee Guida nazionali e internazionali sulla tematica. A titolo esemplificativo e non esaustivo, la Tabella Supplementare 2 riporta le prestazioni maggiormente erogate per la gestione della patologia, che prevede alcuni esami di laboratorio e prestazioni diagnostiche sovrapponibili per tutti i pazienti.
Dall’altro lato, giacché il modello predisposto ha incluso anche le risorse assorbite per la risoluzione di eventuali eventi avversi farmaco-correlati, poiché determinano non solo l’esecuzione di prestazioni addizionali, ma anche l’eventuale somministrazione di terapie farmacologiche, è doveroso specificare come la modalità di gestione di tali eventi, in termini di risorse consumate, derivi da opinioni di esperti raccolte secondo un approccio Delphi (18) (Tabella Supplementare 3).
Nelle more di quanto sopra, infine, la valorizzazione economica del percorso di gestione del paziente affetto da HIV è stata ulteriormente stratificata sulla base del dato di efficacia, in termini di raggiungimento di una carica virale non rilevabile.
Le ipotesi
Di seguito vengono rappresentate le ipotesi alla base del modello di impatto economico-organizzativo.
a) In assenza di un dato puntuale, all’interno del contesto italiano, circa il numero dei pazienti HIV in trattamento antiretrovirale, si sono effettuate due proiezioni di popolazione, basandosi sui dati epidemiologici di prevalenza e di incidenza, che fossero quanto più recenti possibile. Le due proiezioni sono state condotte utilizzando i seguenti tassi di uptake al trattamento antiretrovirale: un tasso pari all’88% così come stimato da UNAIDS in una pubblicazione del 2021 (20), riferita, però, a dati dell’anno 2012, nonché un secondo tasso pari al 95%, nell’ipotesi di raggiungimento degli obiettivi della Global Aids Strategy. In quest’ottica, il modello prenderà in considerazione una popolazione di minima e una popolazione di massima, come forbice di erogazione.
b) In riferimento ai dati di occorrenza degli eventi avversi farmaco-correlati, si è condotta una stratificazione, dove l’informazione fosse disponibile, tra tasso di incidenza occorso in pazienti treatment-naïve o in pazienti treatment-experienced. La medesima stratificazione è inoltre avvenuta considerando un orizzonte temporale assimilabile. Nella maggior parte dei casi, infatti, la letteratura ha fornito la disponibilità di dati di incidenza occorsi nelle 48 o nelle 96 settimane dall’esposizione al trattamento antiretrovirale. In alcuni casi, emerge la disponibilità anche del dato a 144 settimane, quindi a 3 anni dall’inizio del trattamento. Per consistency, però, l’analisi di impatto su budget ha assunto un dato di incidenza di eventi avversi dei 3 anni (144 settimane) uguale a quello dei 2 anni (96 settimane) per tutte le opzioni terapeutiche considerate.
c). Come indicato nella sezione precedente, la valorizzazione economica dei percorsi dei pazienti, in termini di esami di laboratorio, visite specialistiche, prestazioni diagnostiche e trattamenti somministrati, deriva da dati raccolti nel corso degli anni 2019-2021 all’interno di una coorte di soggetti HIV in trattamento antiretrovirale, relativamente a due differenti centri di cura nel contesto della Regione Lombardia. Dalla valorizzazione economica del percorso relativo alla gestione del paziente treatment-experienced in controllo virologico, è stato possibile stimare il costo del paziente treatment-naïve sia in controllo sia non in controllo virologico e del paziente treatment-experienced non in controllo. I risultati ottenuti sono coerenti con le variazioni riscontrabili nella più recente letteratura sul tema, che fornisce specificatamente un affondo sui costi di gestione del paziente trattato con regimi terapeutici a base di TAF/FTC, TDF/FTC, 3TC/ABC o altri regimi terapeutici e dual therapy (21). Dal momento che non sono presenti dati di letteratura, almeno nel contesto italiano, che descrivano la differenza di assorbimento di risorse economiche tra pazienti naïve ed experienced, con una stratificazione per strategia terapeutica, sono state prese in considerazione le variazioni percentuali disponibili solo in riferimento al backbone, così come illustrato nella Tabella 2.
d) Per la conduzione dell’analisi organizzativa, si sono stimate le tempistiche medie legate agli accessi ambulatoriali per la gestione degli eventi avversi farmaco-correlati nonché la degenza media per quegli eventi avversi che necessitano di un ricovero ordinario, il tutto ponderato per il tasso di occorrenza di tali eventi avversi, così come riscontrabile all’interno delle evidenze della letteratura di riferimento (Tabella Supplementare 2).
| Naïve in controllo virologico rispetto agli experienced in controllo | Naïve non in controllo rispetto ai naïve in controllo | Experienced non in controllo virologico rispetto agli experienced in controllo | |
|---|---|---|---|
| Regimi TAF/FTC-based | –66% | +30% | +26% |
| Regimi TDF/FTC-based | –20% | +11% | +10% |
| Regimi 3TC/ABC-based | –5% | +9% | +8% |
| Altri regimi terapeutici e dual therapy | –30% | +17% | +15% |
Analisi di scenario e di sensitività
Per garantire la robustezza dei risultati della BIA, oltre alla modifica dei tassi di uptake già illustrata, sono state condotte tre ulteriori analisi di scenario.
1. Modifica degli scostamenti economici: in assenza di dati italiani specifici sulle variazioni di costo tra pazienti treatment-naïve e treatment-experienced, si sono ipotizzati i seguenti scostamenti, derivanti da opinioni di esperti, raccolte secondo un approccio Delphi: i) il paziente naïve in controllo virologico ha un impatto economico in riduzione del 32% rispetto al paziente experienced in controllo; ii) il paziente experienced non in controllo virologico costa il 7% in più del paziente experienced, ma in controllo virologico; iii) il paziente naïve non in controllo virologico assorbe il 17% rispetto al paziente experienced in controllo virologico.
2. Depurazione dei costi legati alle comorbidità: un’ulteriore analisi di sensitività ha escluso i costi di ospedalizzazione, degli accessi in PS e delle terapie per comorbidità non correlate all’HIV, omogeneizzando così il percorso di cura dei pazienti e andando a studiare gli effetti delle differenti scelte a prescindere dalle comorbidità rilevate sui pazienti.
3. Modifica del tasso di utilizzo di BIC/FTC/TAF: a integrazione delle analisi già presentate, sono stati considerati due ulteriori scenari ipotetici per valutare l’impatto delle variazioni nei tassi di utilizzo di BIC/FTC/TAF. Nello specifico sono stati ipotizzati due ulteriori scenari, che vengono di seguito proposti.
• Scenario C: rappresenta un’ipotesi di minimo utilizzo, in cui il tasso di somministrazione di BIC/FTC/TAF è stimato al 13% per la popolazione prevalente treatment-naïve, al 40% per la popolazione incidente treatment-naïve e al 10% per la popolazione treatment-experienced.
• Scenario D: rappresenta un’ipotesi di massimo utilizzo, in cui il tasso di somministrazione di BIC/FTC/TAF raggiunge il 46% per la popolazione prevalente treatment-naïve, il 70% per la popolazione incidente treatment-naïve e il 55% per la popolazione treatment-experienced.
Questi scenari aggiuntivi sono stati sviluppati per esplorare il potenziale impatto economico-organizzativo di una variazione più ampia nei tassi di penetrazione del regime terapeutico, ampliando così il range di possibilità rispetto agli scenari A e B già analizzati.
Oltre alle analisi di scenario riportate sopra, ulteriori analisi di sensibilità sono state condotte applicando la statistica Bayesiana (22). Sono state quindi sviluppate delle distribuzioni Gamma, al fine di verificare la robustezza dei risultati, in presenza di fattori di incertezza: in questo specifico contesto, la distribuzione Gamma è stata effettuata, considerando come variabile aleatoria il costo del percorso del paziente HIV, al netto del costo dell’ART. Tale distribuzione Gamma è stata creata in base al valore medio del costo del percorso del paziente HIV, stratificato per tipologia di trattamento assunto, e alla relativa deviazione standard, effettuando così una simulazione Monte-Carlo. Nello specifico, le analisi di statistica Bayesiana sono da ricondursi alla valutazione della probabilità di avere un qualsiasi valore medio di costo del percorso della distribuzione Gamma di BIC/FTC/TAF più basso rispetto alle alternative terapeutiche considerate, sia per la popolazione treatment-naïve che per la popolazione treatment-experienced. Sulla base di questa ipotesi, l’analisi di sensibilità ha confrontato BIC/FTC/TAF con 3TC/ABC/DTG, FTC/TAF+DTG e DTG/3TC nella popolazione treatment-naïve, nonché BIC/FTC/TAF con DTG/3TC, FTC/TDF/RPV e RPV/DTG nella popolazione treatment-experienced, poiché le alternative terapeutiche sono state somministrate rispettivamente al 95% e al 90% dei soggetti naïve ed experienced, in base alle percentuali riportate nella Tabella 1, garantendo così che queste analisi di sensibilità rimangano basate su risultati plausibili in termini reali.
Risultati
Definizione della popolazione
Incrociando i dati epidemiologici di prevalenza (23) con i dati riferiti alla dimensione della popolazione diagnosticata e successivamente trattata (20), si è definita la popolazione con infezione da HIV in trattamento antiretrovirale (N = 100.672). Oltre ad analizzare e a quantificare la quota parte di popolazione prevalente affetta da patologia, risulta essere importante chiarire l’incidenza della patologia stessa, vale a dire l’impatto delle nuove diagnosi. All’interno del contesto italiano, l’ISS stima un’incidenza di patologia, all’anno 2021, pari allo 0,002% dell’intera popolazione italiana. Sulla base di questa considerazione, applicando tale dato di incidenza alla popolazione residente in Italia (N = 59.236.213 abitanti, ISTAT, 2021), si considerano 1.303 nuove diagnosi.
Alla luce di quanto illustrato e nelle more di dover suddividere gli individui con infezione da HIV tra popolazione treatment naïve, TN (considerando sia le nuove diagnosi, per le quali si ipotizza un tasso di trattamento dell’88% come indicato sopra, sia i pazienti in prima linea di trattamento che risultano essere il 24% dei pazienti prevalenti (24)), e popolazione treatment-experienced, TE (vale a dire pazienti che hanno avuto esperienza di almeno un cambio di terapia e che risultano essere il 76% della popolazione HIV prevalente (24)), la popolazione target contemplata all’interno dell’analisi di impatto sul budget e nel modello organizzativo, considerando il primo anno oggetto di indagine, sarà costituita da 24.916 soggetti treatment-naïve (di cui 1.147 incidenti e 23.769 prevalenti) e da 76.903 soggetti treatment-experienced, per un totale di 101.819 soggetti in trattamento antiretrovirale. Le medesime considerazioni sono state condotte anche in riferimento a un eventuale tasso di uptake al trattamento antiretrovirale pari al 95%: in questo caso, la popolazione in trattamento antiretrovirale è costituita da 109.918 pazienti con HIV, dei quali 26.897 soggetti treatment-naïve e 83.021 soggetti treatment-experienced.
Dal momento che il modello di impatto sul budget prevede una natura dinamica, assumendo, pertanto, un orizzonte temporale di 36 mesi, è risultato necessario andare a comprendere l’evoluzione della popolazione HIV nei tre anni indagati, all’interno del contesto italiano. Per questo motivo, l’evoluzione della popolazione è stata aggiustata anche per il tasso di mortalità registrato in Italia, applicato ai pazienti HIV prevalenti, dal momento che, grazie al successo terapeutico dell’ART, tali soggetti presentano un’aspettativa di vita pari alla popolazione generale. In tal senso, il tasso di mortalità utilizzato risulta essere pari all’1,25% (25).
La Tabella 3 riporta la popolazione target oggetto di indagine, considerando un orizzonte temporale di 36 mesi, nella sua proiezione di minima (uptake al trattamento antiretrovirale pari all’88%) e di massima (uptake al trattamento antiretrovirale pari al 95%).
Definizione dell’impatto economico
L’assorbimento di risorse economiche destinate alla presa in carico e alla cura di un paziente naïve ed experienced, in controllo o non in controllo virologico, assumendo un orizzonte temporale annuale, è dettagliato nella Tabella 4.
Alla luce della valorizzazione economica illustrata sopra e includendo il costo di gestione degli eventi avversi farmaco-correlati, si riscontra come un aumento nell’utilizzo del farmaco BIC/FTC/TAF sia correlato alla generazione di un risparmio economico pari allo 0,97% rispetto alla situazione basale, considerando i tre anni oggetto di indagine, nell’ipotesi generale di considerare un tasso di uptake al trattamento antiretrovirale pari all’88% (Tab. 5).
Il medesimo trend si riscontra anche qualora si considerasse un tasso di uptake al trattamento del -95%, ipotizzando pertanto che il 95% della popolazione con diagnosi di HIV riceva effettivamente ART: in questo caso, il risparmio generato da un maggiore utilizzo di BIC/FTC/TAF risulterebbe essere pari allo 0,98% (vale a dire pari a -28.145.826 €), assumendo sempre un orizzonte temporale di 3 anni.
Considerando, invece, una modifica nella valorizzazione economica del costo di gestione del paziente con infezione da HIV, in base alle assunzioni delle analisi di sensitività proposte nella sezione metodologica, lo scostamento economico, in termini di variazione di budget, tra lo Scenario A e lo Scenario B risulterebbe essere variabile da una necessità di investimento pari al +0,25% (vale a dire pari a 6.216.781,19 €, qualora la valorizzazione economica non considerasse i costi correlati a ospedalizzazioni/accessi in PS/somministrazione di farmaci, per comorbidità del soggetto con infezione da HIV, non correlate alla patologie principale, come da prima analisi di scenario) a una generazione di costi cessanti pari al -0,85% (vale a dire pari a -22.688.011,80 €, qualora si modificassero i differenziali economici tra popolazione treatment-experienced in controllo virologico e le altre tre popolazioni investigate, come da seconda analisi di scenario), così come riportato nella Tabella 6.
Inoltre, le analisi di scenario condotte modificando le market share relative all’utilizzo di BIC/FTC/TAF (terza e quarta analisi di scenario) hanno dimostrato come una riduzione di utilizzo di BIC/FTC/TAF comporti un aumento complessivo dei costi rispetto allo Scenario A (+0,98%), guidato principalmente da un incremento nei costi di gestione degli eventi avversi e da un maggiore assorbimento di risorse organizzative destinate al management del paziente con HIV. Dall’altro lato, dalla comparazione tra Scenario A e Scenario D (che rappresenta lo scenario di maggiore utilizzo di BIC/FTC/TAF) si riscontra un sostanziale vantaggio economico (-1,95%), attribuibile principalmente alla riduzione dell’incidenza di eventi avversi, che porta a una minore occupazione di risorse ospedaliere, in termini sia di giornate di degenza sia di slot ambulatoriali, rafforzando ulteriormente il vantaggio organizzativo ed economico di un maggiore utilizzo di BIC/FTC/TAF.
| Evoluzione della popolazione HIV, considerando un uptake al trattamento antiretrovirale pari all’88% | Anno I | Anno II | Anno III |
|---|---|---|---|
| Popolazione incidente treatment-naïve | 1.147 | 1.128 | 1.109 |
| Popolazione prevalente treatment-naïve | 23.769 | 24.604 | 25.410 |
| Popolazione treatment-experienced | 76.903 | 75.942 | 74.993 |
| Totale popolazione in trattamento | 101.819 | 101.674 | 101.512 |
| Evoluzione della popolazione HIV, considerando un uptake al trattamento antiretrovirale pari all’95% | Anno I | Anno II | Anno III |
| Popolazione incidente treatment-naïve | 1.238 | 1.233 | 1.227 |
| Popolazione prevalente treatment-naïve | 25.659 | 26.561 | 27.446 |
| Popolazione treatment-experienced | 83.021 | 81.983 | 80.958 |
| Totale popolazione in trattamento | 109.918 | 109.777 | 109.632 |
| Regime terapeutico | Costo ART* | Costo di gestione di un paziente treatment-experienced in controllo virologico§ | Costo di gestione di un paziente treatment-naïve in controllo virologico§ | Costo di gestione di un paziente treatment-experienced non in controllo virologico§ | Costo di gestione di un paziente treatment-naïve non in controllo virologico§ |
|---|---|---|---|---|---|
| BIC/FTC/TAF | 7.185,42 € | 1.152,98 € | 391,32 € | 1.456,89 € | 508,59 € |
| 3TC/ABC/DTG | 7.732,80 € | 1.181,90 € | 1.124,18 € | 1.276,71 € | 1.230,16 € |
| FTC/TAF+DTG | 9.975,60 € | 1.675,22 € | 568,57 € | 2.116,79 € | 738,96 € |
| DTG/3TC | 5.974,78 € | 2.746,55 € | 1.915,44 € | 3.154,58 € | 2.236,64 € |
| FTC/TAF/RPV | 7.185,60 € | 1.179,28 € | 400,24 € | 1.490,12 € | 520,19 € |
| FTC/TAF/DRV/COB | 7.866,00 € | 1.067,39 € | 362,27 € | 1.348,74 € | 470,84 € |
| FTC/TAF/EVG/COB | 9.558,00 € | 1.342,70 € | 455,71 € | 1.696,62 € | 592,28 € |
| FTC/TAF+RAL | 8.539,20 € | 1.196,70 € | 406,16 € | 1.512,14 € | 527,88 € |
| FTC/TDF/RPV | 7.185,60 € | 1.458,12 € | 1.168,87 € | 1.606,66 € | 1.296,41 € |
| DTG/RPV | 6.591,60 € | 1.761,71 € | 1.228,61 € | 2.023,43 € | 1.434,64 € |
*Dato economico IVA inclusa derivante dall’ultima gara ARCA dell’aprile 2019, così come pubblicato anche all’interno del PDTA dell’HIV della Regione Lombardia per l’anno 2021. Si specifica come si tratti del costo annuale, considerando il 100% di aderenza.
§Le informazioni sul percorso del paziente sono state valorizzate economicamente, su base annua, prendendo in considerazione le tariffe nazionali di rimborso della specialistica ambulatoriale e dell’assistenza ospedaliera valide per l’anno 2022, stratificando il paziente non solo considerando la sua storia clinica pregressa (paziente naïve al trattamento o paziente experienced al trattamento), ma considerando anche il raggiungimento o meno di una carica virale non rilevabile (in termini di HIV RNA < 50 copie/mL), sulla base dei tassi di efficacia derivanti dalla letteratura di riferimento. Si specifica come le variazioni di assorbimento economico dipendono anche dalle comorbidità di cui soffre il paziente, la cui occorrenza e la cui tipologia possono essere differenziali tanto da generare variazioni nei costi di gestione.
| Treatment-naïve | Treatment-experienced | Totale Scenario A | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale treatment-naïve | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale treatment-experienced | |||
| Scenario A | Anno 1 | 3.458.516 € | 18.983.630 € | 193.707.786 € | 216.149.932 € | 10.914.746 € | 146.198.326 € | 519.258.405 € | 676.371.477 € | 892.521.409 € |
| Anno 2 | 3.565.569 € | 19.603.021 € | 200.076.166 € | 223.244.756 € | 10.672.650 € | 144.369.368 € | 512.762.847 € | 667.804.865 € | 891.049.622 € | |
| Anno 3 | 3.668.771 € | 20.200.347 € | 206.217.984 € | 230.087.102 € | 10.538.834 € | 142.563.401 € | 506.337.792 € | 659.440.026 € | 889.527.129 € | |
| Totale | 10.692.857 € | 58.786.998 € | 600.001.935 € | 669.481.791 € | 32.126.230 € | 433.131.094 € | 1.538.359.044 € | 2.003.616.368 € | 2.673.098.159 € | |
| Treatment-naïve | Treatment-experienced | Totale Scenario B | ||||||||
| Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale treatment-naïve | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale treatment-experienced | |||
| Scenario B | Anno 1 | 3.435.110 € | 17.621.036 € | 191.570.036 € | 212.626.183 € | 10.624.038 € | 134.693.166 € | 525.935.636 € | 671.252.840 € | 883.879.023 € |
| Anno 2 | 3.540.665 € | 18.197.444 € | 197.865.735 € | 219.603.844 € | 10.406.401 € | 133.008.148 € | 519.348.303 € | 662.762.852 € | 882.366.696 € | |
| Anno 3 | 3.642.417 € | 18.753.327 € | 203.937.443 € | 226.333.186 € | 10.276.543 € | 131.347.498 € | 512.854.942 € | 654.478.983 € | 880.812.169 € | |
| Totale | 10.618.192 € | 54.571.807 € | 593.373.214 € | 658.563.212 € | 31.306.982 € | 399.048.813 € | 1.558.138.881 € | 1.988.494.675 € | 2.647.057.888 € | |
| Scostamento (%) | Anno 1 | -0,68% | -7,18% | -1,10% | -1,63% | -2,66% | -7,87% | 1,29% | -0,76% | -0,97% |
| Anno 2 | -0,70% | -7,17% | -1,10% | -1,63% | -2,49% | -7,87% | 1,28% | -0,76% | -0,97% | |
| Anno 3 | -0,72% | -7,16% | -1,11% | -1,63% | -2,49% | -7,87% | 1,29% | -0,75% | -0,98% | |
| Totale | -0,70% | -7,17% | -1,10% | -1,63% | -2,55% | -7,87% | 1,29% | -0,75% | -0,97% | |
In conclusione, l’analisi di sensibilità, condotta mediante applicazione di tecniche di statistica Bayesiana, ha dimostrato come, all’interno del contesto della popolazione treatment-naïve (Fig. 1), la gestione dei pazienti con HIV che ricevono BIC/FTC/TAF presenti un minore utilizzo di risorse economiche che con gli altri farmaci investigati. Tuttavia, esiste una probabilità del 5% che i pazienti in trattamento con FTC/TAF+DTG assorbano meno risorse economiche rispetto ai pazienti in trattamento con BIC/FTC/TAF. Focalizzando l’attenzione sulla popolazione con esperienza di trattamento (Fig. 2), BIC/FTC/TAF presenta una probabilità del 100%, del 98% e dell’89% di assorbire meno risorse economiche rispetto a RPV+DTG, FTC/TDF/RPV e 3TC+DTG, rispettivamente.
Definizione dell’impatto organizzativo
L’analisi dell’impatto organizzativo ha fornito una fotografia di ritorno circa il saving organizzativo, in termini di minuti o di ore guadagnati, sia in ambulatorio che in reparto (Tab. 7).
| Analisi di impatto sul budget | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale |
|---|---|---|---|---|
| Scenario A | 42.819.087 € | 491.918.093 € | 2.138.360.979 € | 2.673.098.159 € |
| Scenario B | 41.925.173 € | 453.620.620 € | 2.151.512.095 € | 2.647.057.888 € |
| Scostamento (Euro) | -893.914 € | -38.297.473 € | 13.151.116 € | -26.040.271 € |
| Scostamento (%) | -2,09% | -7,79% | 0,62% | -0,97% |
| Prima analisi di scenario (modifica degli scostamenti economici) | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale |
| Scenario A | 42.819.087 € | 324.996.577 € | 2.138.360.979 € | 2.506.176.643 € |
| Scenario B | 41.925.173 € | 318.956.156 € | 2.151.512.095 € | 2.512.393.425 € |
| Scostamento (Euro) | -893.914 € | -6.040.420 € | 13.151.116 € | 6.216.781 € |
| Scostamento (%) | -2,09% | -1,86% | 0,62% | 0,25% |
| Seconda analisi di scenario (depurazione dei costi legati alle comorbidità) | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale |
| Scenario A | 42.819.087 € | 499.608.363 € | 2.138.360.979 € | 2.680.788.430 € |
| Scenario B | 41.925.173 € | 464.663.150 € | 2.151.512.095 € | 2.658.100.418 € |
| Scostamento (Euro) | -893.914 € | -34.945.213 € | 13.151.116 € | -22.688.012 € |
| Scostamento (%) | -2,09% | -6,99% | 0,62% | -0,85% |
| Terza analisi di scenario (riduzione del tasso di utilizzo di BIC/FTC/TAF) | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale |
| Scenario A | 42.819.087 € | 491.918.093 € | 2.138.360.979 € | 2.673.098.159 € |
| Scenario C | 43.713.290 € | 530.218.675 € | 2.125.229.602 € | 2.699.161.568 € |
| Scostamento (Euro) | 894.203 € | 38.300.582 € | -13.131.377 € | 26.063.408 € |
| Scostamento (%) | 2,09% | 7,79% | -0,61% | 0,98% |
| Quarta analisi di scenario (aumento del tasso di utilizzo di BIC/FTC/TAF) | Costo gestione eventi avversi | Costo gestione paziente con HIV | Costo della terapia ART | Costo totale |
| Scenario A | 42.819.087 € | 491.918.093 € | 2.138.360.979 € | 2.673.098.159 € |
| Scenario D | 41.030.962 € | 415.321.012 € | 2.164.647.478 € | 2.620.999.453 € |
| Scostamento (Euro) | -1.788.125 € | -76.597.080 € | 26.286.499 € | -52.098.706 € |
| Scostamento (%) | -4,18% | -15,57% | 1,23% | -1,95% |
Focalizzando l’attenzione sui minutaggi di natura ambulatoriale, si riscontra come, nella comparazione tra lo Scenario A e lo Scenario B, sia necessario un investimento di slot ambulatoriali pari a 7.237 ore, nei tre anni oggetto di indagine. Tuttavia, considerando le ore di degenza spese dal soggetto con HIV per la risoluzione dell’evento avverso occorso, un utilizzo maggiore della strategia terapeutica costituita da BIC/FTC/TAF è correlato, nei tre anni oggetto di indagine, a un saving organizzativo del 19,64%, direttamente in capo all’Unità Operativa. Chiaramente a questo vantaggio organizzativo in termini di giornate di degenza liberate consegue un risparmio significativo sotto un profilo economico-finanziario, considerando gli attori clinici e infermieristici coinvolti nel percorso di degenza del paziente: da questo punto di vista, quantificando il vantaggio economico-organizzativo in capo alle strutture che prendono in carico i pazienti affetti da HIV, si riscontra un saving generale di 245.938 ore risparmiate, rappresentative di circa -7.525.703 €.
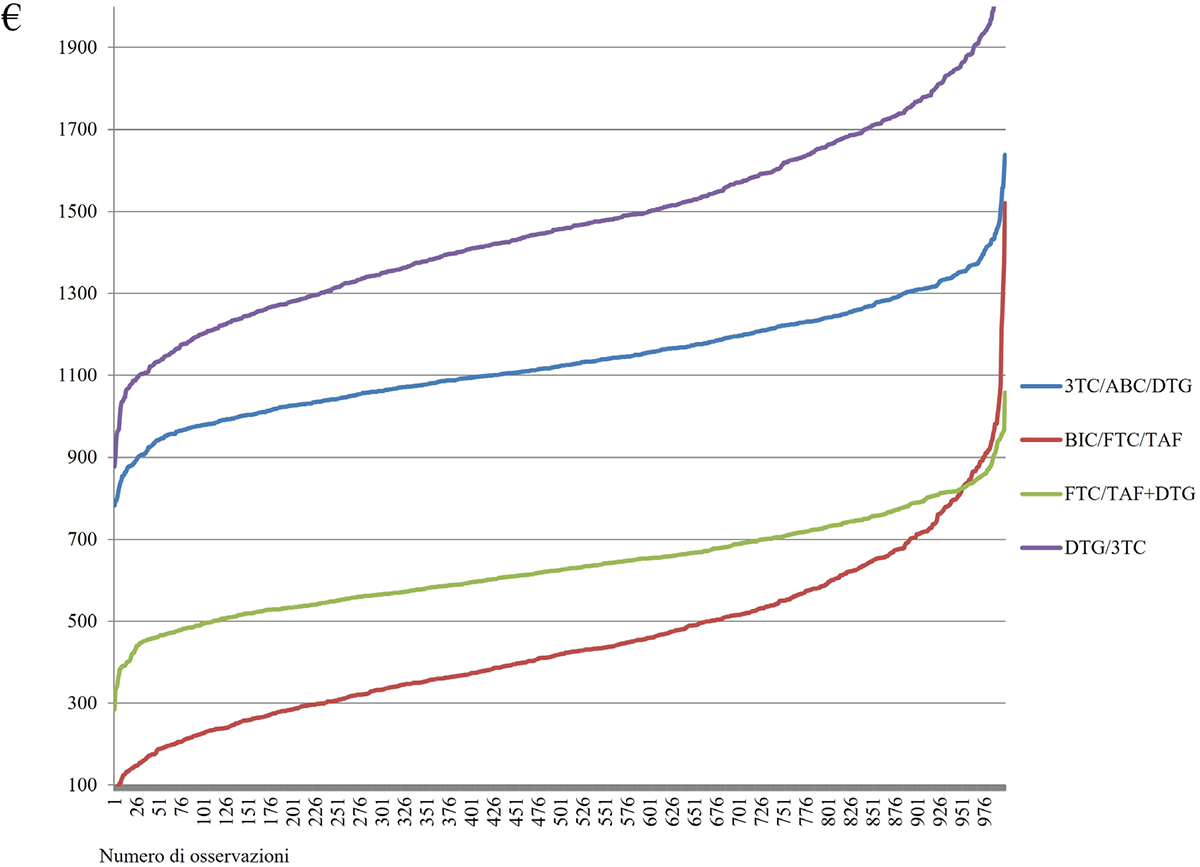
FIGURA 1 - Distribuzione Gamma per la popolazione treatment-naive. Ogni curva rappresenta l’andamento dei costi per i diversi regimi terapeutici analizzati. L’asse verticale indica il costo (€) associato alla gestione del paziente, mentre l’asse orizzontale rappresenta il numero cumulativo di osservazioni. Curve posizionate più in basso indicano costi mediamente inferiori nella gestione del paziente rispetto ad altre terapie.
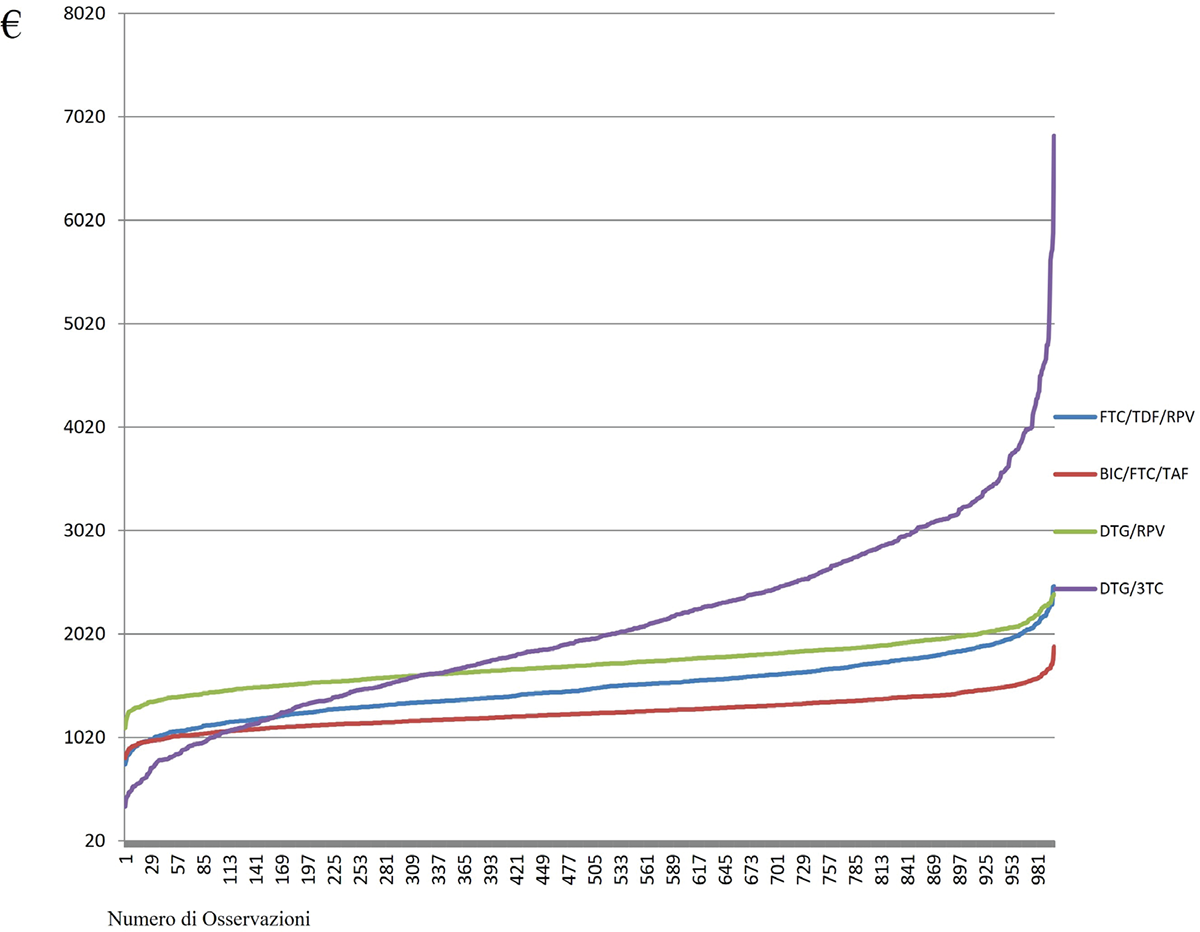
FIGURA 2 - Distribuzione Gamma per la popolazione treatment-experienced. Ogni curva rappresenta l’andamento dei costi per i diversi regimi terapeutici analizzati. L’asse verticale indica il costo (€) associato alla gestione del paziente, mentre l’asse orizzontale rappresenta il numero cumulativo di osservazioni. Curve posizionate più in basso indicano costi mediamente inferiori nella gestione del paziente rispetto ad altre terapie.
Discussione
I risultati del presente studio forniscono una fotografia di ritorno, di natura economico-organizzativa, circa un utilizzo maggiormente consolidato di BIC/FTC/TAF all’interno della pratica clinica italiana, fornendo delle informazioni addizionali e differenziali per supportare il processo di presa di decisioni all’interno di questo contesto terapeutico.
Da un punto di vista economico, la somministrazione di BIC/FTC/TAF a un numero maggiore di soggetti con infezione da HIV rappresenterebbe un’opzione sostenibile per il SSN: un consolidato utilizzo di tale regime terapeutico genererebbe un vantaggio economico di circa l’1%, assumendo un orizzonte temporale di 36 mesi. Complessivamente, i risultati delle valutazioni effettuate evidenziano che, sia nell’analisi di impatto sul budget che in quella di sensibilità, emerge un differenziale di risorse economiche potenzialmente assorbite qualora questa opzione terapeutica venga somministrata al 24% della popolazione prevalente non precedentemente trattata, al 50% della popolazione incidente non precedentemente trattata e al 25% della popolazione con esperienze di trattamento, con una variazione che va dal -0,98% al +0,25%, considerando un orizzonte temporale di 36 mesi.
I risultati generati sono perfettamente in linea con quanto emerge in altri contesti nazionali e internazionali, che dimostrano come l’erogazione di BIC/FTC/TAF rappresenti una strategia terapeutica potenzialmente vantaggiosa da offrire ai pazienti con HIV (siano essi treatment-naïve o treatment-experienced), garantendo anche la sostenibilità economica per il Sistema Sanitario (13,26).
I vantaggi relativi alla potenziale modifica dei trattamenti erogati alla popolazione eleggibile non devono prendere in considerazione la sola sfera economica e finanziaria, ma possono impattare anche sotto un profilo organizzativo, andando a prendere in considerazione il punto di vista dei professionisti e delle strutture che assistono ed erogano prestazioni di cura ai soggetti con infezione da HIV. In linea generale, infatti, grazie all’introduzione di opzioni terapeutiche a base di INSTI, la gestione degli eventi avversi farmaco-correlati nonché l’occorrenza di episodi di ricovero si sono abbattute notevolmente (27). In questa ottica, nel tentativo di quantificare la riduzione dell’occorrenza di complicanze in termini di ore di lavoro risparmiate, i risultati dell’analisi hanno di fatto dimostrato come un maggiore tasso di penetrazione di BIC/FTC/TAF potrebbe generare un saving organizzativo di circa 245.938 ore salvate, rappresentative di un risparmio economico di 7.525.703 €, guidato principalmente da un significativo abbattimento nel numero complessivo di giornate di degenza destinate alla gestione del soggetto con infezione da HIV che sviluppa eventi avversi farmaco-correlati. Questo miglioramento organizzativo consentirebbe di liberare risorse preziose all'interno del sistema sanitario, permettendo una maggiore capacità di risposta a ulteriori esigenze cliniche.
| Definizione dell’impatto organizzativo in capo all’ambulatorio | ||||
|---|---|---|---|---|
| Anno di riferimento | Scenario A (ore di ambulatorio) | Scenario B (ore di ambulatorio) | Scostamento (valore assoluto) | Scostamento (%) |
| Anno 1 | 70.413 | 72.995 | 2.581 | 3,67% |
| Anno 2 | 71.715 | 74.055 | 2.340 | 3,26% |
| Anno 3 | 71.921 | 74.237 | 2.316 | 3,22% |
| Totale | 214.050 | 221.287 | 7.237 | 3,38% |
| Definizione dell’impatto organizzativo in capo al reparto | ||||
| Anno di riferimento | Scenario A (giornate di degenza, espresse in ore) | Scenario B (giornate di degenza, espresse in ore) | Scostamento (valore assoluto) | Scostamento (%) |
| Anno 1 | 459.297 | 368.999 | -90.298 | -19,66% |
| Anno 2 | 417.403 | 335.443 | -81.961 | -19,64% |
| Anno 3 | 412.365 | 331.449 | -80.917 | -19,62% |
| Totale | 1.289.065 | 1.035.890 | -253.175 | -19,64% |
L’interpretazione dei dati della presente analisi deve tenere conto di alcune limitazioni. In primo luogo, occorre considerare che, così come condotto in altri studi pubblicati in letteratura, il modello economico-organizzativo qui presentato non ha preso in considerazione l’aderenza al trattamento antriretrovirale (12) come variabile discriminante. Benché tale parametro sia rilevante all’interno del contesto di riferimento, la maggior parte delle terapie antiretrovirali erogate alla popolazione eleggibile risulta essere rappresentata da STR, con un’aderenza comparabile all’interno della reale pratica clinica. In secondo luogo, l’approccio Delphi utilizzato per definire le quote di mercato dello Scenario B e per confermare le differenze di costo di gestione del paziente si basa su opinioni di esperti, che, anche se informate, possono essere soggettive e influenzate da bias individuali e risultano essere rappresentative della sola pratica clinica italiana, limitando la generalizzabilità dei risultati in altri contesti. Questi limiti suggeriscono la necessità di ulteriori studi per confermare i risultati ottenuti e per esplorare l’impatto di BIC/FTC/TAF in diversi contesti clinici e geografici.
Nonostante queste limitazioni, i risultati del presente studio forniscono un solido supporto per i decisori di spesa e per i gestori delle strutture sanitarie, evidenziando i benefici economici e organizzativi derivanti dall’adozione di BIC/FTC/TAF. L’analisi dimostra che l’adozione di questo regime terapeutico può ridurre i costi complessivi della gestione dei pazienti con HIV e migliorare l’efficienza delle risorse ospedaliere. Questo contribuisce alla sostenibilità del Sistema Sanitario, permettendo una migliore allocazione delle risorse e una maggiore qualità dell’assistenza sanitaria.
Conclusioni
I risultati presentati potrebbero essere utili per il processo decisionale in termini di pianificazione e programmazione sanitaria, rivelando come BIC/FTC/TAF rappresenti una scelta non solo clinicamente valida, ma anche economicamente e organizzativamente vantaggiosa per il SSN italiano. Una modifica nell’attuale utilizzo delle terapie antiretrovirali potrebbe portare all’ottimizzazione del percorso del paziente con HIV per il SSN, sia da un punto di vista economico che considerando gli aspetti organizzativi in capo alla struttura ospedaliera che prende in carico il paziente.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: An unconditional grant from Gilead Science SRL was received to support the draft of this paper. Otherwise, the views expressed are those of the Authors, without any influence by the sponsor.
Authors contribution: AR and EF conceived the study. BM and GR conducted data collection and expressed their clinical views. LF and EG analyzed data. DB and FS developed the model through MS EXCEL. LF and EF wrote the paper. AR, BM and GR critically revised the contents. All Authors reviewed the manuscript and, in general terms, contributed equally to this work.
Data Availability Statement: Data available on request: the data presented in this study are available on request from the corresponding Author.
Bibliografia
- 1. Duracinsky M, Herrmann S, Berzins B, et al. The development of PROQOL-HIV: an international instrument to assess the health-related quality of life of persons living with HIV/AIDS. J Acquir Immune Defic Syndr. 2012;59(5):498-505. CrossRef PubMed
- 2. Nakagawa F, Lodwick RK, Smith CJ, et al. Projected life expectancy of people with HIV according to timing of diagnosis. AIDS. 2012;26(3):335-343. CrossRef PubMed
- 3. Havlir DV, Kendall MA, Ive P, et al; AIDS Clinical Trials Group Study A5221. Timing of antiretroviral therapy for HIV-1 infection and tuberculosis. N Engl J Med. 2011;365(16):1482-1491. CrossRef PubMed
- 4. Lee SA, Sinclair E, Hatano H, et al. Impact of HIV on CD8+ T cell CD57 expression is distinct from that of CMV and aging. PLoS One. 2014;9(2):e89444. CrossRef PubMed
- 5. Deeks ED. Bictegravir/Emtricitabine/Tenofovir Alafenamide: A Review in HIV-1 Infection. Drugs. 2018;78(17):1817-1828. CrossRef PubMed
- 6. EMA. Riassunto delle Caratteristiche Tecniche del prodotto. Online (Accessed September 2024)
- 7. Wohl D, Clarke A, Maggiolo F, et al. Patient-Reported Symptoms Over 48 Weeks Among Participants in Randomized, Double-Blind, Phase III Non-inferiority Trials of Adults with HIV on Co-formulated Bictegravir, Emtricitabine, and Tenofovir Alafenamide versus Co-formulated Abacavir, Dolutegravir, and Lamivudine. Patient. 2018;11(5):561-573. CrossRef PubMed
- 8. Gallant J, Lazzarin A, Mills A, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet. 2017;390(10107):2063-2072. CrossRef PubMed
- 9. Molina J-M, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir and lamivudine in virologically suppressed adults with HIV-1: 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e357-e365. CrossRef PubMed
- 10. Sax PE, Pozniak A, Montes ML, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082. CrossRef PubMed
- 11. Sax PE, Rockstroh JK, Luetkemeyer AF, et al; GS-US-380–4030 Investigators. Switching to Bictegravir, Emtricitabine, and Tenofovir Alafenamide in Virologically Suppressed Adults With Human Immunodeficiency Virus. Clin Infect Dis. 2021;73(2):e485-e493. CrossRef PubMed
- 12. Butler K, Anderson SJ, Hayward O, et al. Cost-effectiveness and budget impact of dolutegravir/lamivudine for treatment of human immunodeficiency virus (HIV-1) infection in the United States. J Manag Care Spec Pharm. 2021;27(7):891-903. CrossRef PubMed
- 13. Estrada V, Górgolas M, Peña JA, et al. Epidemiologic and Economic Analysis of Rapid Antiretroviral Therapy Initiation with Bictegravir/Emtricitabine/Tenofovir Alafenamide in Spain. PharmacoEconom Open. 2022;6(3):415-424. CrossRef PubMed
- 14. Gill MJ, Powell M, Vu Q, Krentz HB. Economic impact on direct healthcare costs of missing opportunities for diagnosing HIV within healthcare settings. HIV Med. 2021;22(8):723-731. CrossRef PubMed
- 15. Mauskopf JA, Sullivan SD, Annemans L, et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on good research practices--budget impact analysis. Value Health. 2007;10(5):336-347. CrossRef PubMed
- 16. Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. Department of Health and Human Services. Online (Accessed September 2024)
- 17. Lombardia R. Direzione Generale Welfare. Percorso diagnostico terapeutico assistenziale (PDTA) del paziente affetto da infezione/malattia HIV/AIDS. Anno 2021. Online (Accessed September 2024)
- 18. Shang Z. Use of Delphi in health sciences research: A narrative review. Medicine (Baltimore). 2023 Feb 17;102(7):e32829. CrossRef PubMed
- 19. D’Achille A. An analysis of healthcare processes through an Activity-based Costing approach. Economia Aziendale Online, 2019; S 10(1):93-10.
- 20. UNAIDS. End Inequalities. End Aids. Global Aids Strategy 2021-2026. 2021. Online (Accessed September 2024)
- 21. Garagiola E, Foglia E, Ferrario L, et al. HTA and HIV: The Case of Dual NRTI Backbones in the Italian Setting. Int J Environ Res Public Health. 2020;17(23):9010. CrossRef PubMed
- 22. Spiegelhalter DJ, Myles JP, Abrams KR. Bayesian Approaches to Clinical Trials and Health-Care Evaluation. 2003. CrossRef
- 23. Galli M, Borderi M, Viale P. HIV policy in Italy and recommendations across the HIV care continuum. Le Infezioni in Medicina, n. 1, 17-28, 2020 PubMed
- 24. Croce D, Lazzarin A, Rizzardini G, et al. HIV Clinical Pathway: A New Approach to Combine Guidelines and Sustainability of Anti-Retroviral Treatment in Italy. PLoS One. 2016;11(12):e0168399. CrossRef PubMed
- 25. ISTAT. Indicatori demografici anno 2022. Online (Accessed September 2024)
- 26. Guinan K, Mathurin K, Lachain J. Economic Impact of Rapid Treatment Initiation of HIV with Bictegravir/Emtricitabine/Tenofovir Alafenamide (B/F/TAF) from a Canadian Healthcare Perspective. Value Health. 2023; S26 (6): S184-S185. CrossRef
- 27. Kolakowska A, Maresca AF, Collins IJ, Cailhol J. Update on Adverse Effects of HIV Integrase Inhibitors. Curr Treat Options Infect Dis. 2019;11(4):372-387. CrossRef PubMed