 |
Glob Reg Health Technol Assess 2025; 12: 1-6 ISSN 2283-5733 | DOI: 10.33393/grhta.2025.3259 SHORT COMMUNICATION |
 |
La durata delle procedure di negoziazione di prezzo e rimborso in Italia nel periodo 2021-2023 è stata indipendente dal prezzo dei medicinali
The length of price&reimbursement negotiation procedures in Italy in the period 2021-2023 was independent from the price of medicines
Background: The duration of price&reimbursement (P&R) procedures is taken as a key performance indicator of Regulatory Agencies in Europe. In this study we have tested the hypothesis that the price of medicines may have negatively affected the duration of P&R negotiations in Italy in the period 2021-2023.
Methods: Data were retrieved from the Intexo database, which included all medicines with EC approval within the period 2021-2023. Biosimilars, generics, gene therapies, Sars-Cov-2 vaccines and medicines with no negotiated price at the datalock of December 2023 were excluded from the analysis. The ex-factory price of the most expensive package was taken as the price of each reimbursed medicine, whereas the time between the publication of EC decision in the European GU and the publication of P&R AIFA decision in the Italian GU (gazette-to-gazette time) as well as the time between the submission of P&R dossier and the publication of AIFA decision in the Italian GU (AIFA negotiation time) were taken as the procedure duration.
Results: Sixty-seven EC approved medicines completed the P&R procedure in Italy within the study period, and had a reimbursed price. The median and mean gazette-to-gazette times were 395 and 442.6 days, respectively, whereas the mean and median AIFA negotiation times were 389.5 and 434.7 days, respectively. The mean price was 10,942 euros. The analysis of correlation between the duration of procedure and the negotiated price showed that there is no correlation whatsoever between the length of procedures and the price of medicines.
Conclusions: We can reasonably exclude that the price of medicines negatively affected the duration of P&R negotiation procedures.
Keywords: Italy, Price&Reimbursement procedures
Received: August 12, 2024
Accepted: December 10, 2024
Published online: January 15, 2025
Indirizzo per la corrispondenza:
CPierluigi Navarra
email: pierluigi.navarra@unicatt.it
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2025 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La durata delle procedure di negoziazione di prezzo e rimborso dei nuovi medicinali è considerata uno dei parametri più rilevanti nella valutazione della performance complessiva delle Agenzie regolatorie in Europa. Di questo parametro si è tenuto conto nella recente riorganizzazione dell’Agenzia Italiana del Farmaco (AIFA), finalizzata a rendere l’Agenzia più snella ed efficiente (1).
La durata delle procedure di negoziazione del prezzo in AIFA è stata oggetto di diverse valutazioni negli anni recenti (24). In queste valutazioni, i parametri statistici usati preferenzialmente per descrivere la performance dell’Agenzia sono stati la media o la mediana della durata in giorni delle procedure di negoziazione. Dal confronto fra le varie Agenzie europee è emerso che i valori medi dell’Agenzia italiana negli ultimi anni sono risultati in linea con la media europea o anche inferiori (4). Tuttavia, accanto ai valori medi è altrettanto importante considerare le misure di variabilità intorno alla media o alla mediana. Infatti, a fronte di valori medi anche pienamente accettabili se confrontati con il dato europeo, negli anni scorsi si sono registrate in Italia delle negoziazioni con durata della procedura oltre i 3 anni (3,4).
Nel contesto del presente processo di riorganizzazione ed efficientamento dell’AIFA, ci è sembrato utile condurre un’analisi delle possibili cause per cui alcune procedure di valutazione di prezzo e rimborso richiedono tempi particolarmente lunghi per giungere a conclusione. Oltre agli aspetti di carattere squisitamente strutturale e gestionale, che riguardano l’organizzazione dell’Agenzia e delle sue Commissioni (e che sono stati di recente oggetto di modifiche nell’ambito della riforma dell’AIFA), è da considerare l’ipotesi che un fattore in grado di influenzare la durata delle procedure possa essere il prezzo del farmaco proposto dal titolare dell’Autorizzazione all’Immissione in Commercio (AIC) in sede di negoziazione; è ragionevole pensare che più alto sia stato il prezzo proposto dall’Azienda più difficile sarà stato trovare un punto di incontro fra le parti.
Scopo del nostro studio è stato verificare l’ipotesi se esiste o meno una correlazione fra il prezzo del farmaco e la durata della relativa procedura di prezzo e rimborso. Il campo di indagine è stato limitato ai medicinali che hanno ricevuto un’approvazione da parte dell’Unione Europea (European Union, EU) nel triennio 2021-2023. Sono pertanto escluse dall’analisi le procedure valutate o in corso di valutazione in AIFA successivamente all’implementazione della recente riforma.
Metodi
Banca dati
I dati analizzati in questo studio sono stati ottenuti da un database elaborato da Intexo Società Benefit (Roma, Italia). Il database comprende 239 medicinali, vale a dire tutti i medicinali approvati in EU nel periodo compreso fra il 1° gennaio 2021 e il 16 novembre 2023; il medicinale approvato dall’EU in quest’ultima data ha avuto la pubblicazione del decreto nella Gazzetta Ufficiale (GU) europea del 29 dicembre 2023 e pertanto è stato l’ultimo incluso nel database.
Per ogni prodotto, nel database sono presenti: 1) informazioni relative al medicinale, 2) informazioni relative alla fase comunitaria di valutazione e 3) informazioni relative alla fase nazionale di valutazione. Fra le informazioni relative al medicinale, per ogni prodotto sono riportati: il brand name, il titolare dell’AIC, l’area terapeutica e il gruppo farmaco-terapeutico per l’uomo, il codice Anatomico Terapeutico Chimico (ATC), il nome comune (International Non-proprietary Name, INN), il nome del principio attivo, la presenza o meno di monitoraggio addizionale, di misure di gestione del rischio, di approvazione condizionata e di autorizzazione in circostanze eccezionali e, infine, lo status di medicinale orfano o di farmaco innovativo. Per quanto riguarda la fase comunitaria di valutazione, per ogni prodotto sono riportati: il numero di procedura europeo, la data di opinione del Committee for Human Medicinal Products (CHMP), la data di approvazione dell’European Medicines Agency (EMA), la data di pubblicazione nella GU europea e, infine, l’European Public Assessment Report (EPAR) del prodotto. Per la fase nazionale di valutazione, per ogni prodotto vengono riportati, se disponibili, il regime di fornitura e la classe di rimborsabilità, le date relative alla pubblicazione in GU italiana della procedura EMA e alla pubblicazione in GU della determina di Classe C non negoziata (Cnn), la domanda di prezzo e rimborso (P&R) da parte del titolare dell’AIC, i verbali della Commissione Tecnico-Scientifica (CTS), Ufficio Health Technology Assessment (HTA), l’ultimo verbale della CTS, l’ultimo verbale del Comitato Prezzi e Rimborso (CPR), la decisione del Consiglio di amministrazione (CdA) di AIFA, la riclassificazione in GU italiana e, infine, la pubblicazione in GU italiana della determina AIFA di prezzo e rimborso.
Obiettivi ed endpoint
L’obiettivo di questo studio era di valutare se esiste una correlazione fra la durata della procedura di prezzo e rimborso in AIFA e il prezzo del medicinale; in particolare, eravamo interessati a verificare l’ipotesi se la richiesta di un prezzo elevato da parte del titolare di AIC potesse influenzare negativamente il processo di negoziazione, prolungandone la durata. A questo scopo, è stato necessario predefinire i 2 endpoint di misura, vale a dire il prezzo del medicinale e la durata della procedura AIFA di prezzo e rimborso.
Per quanto riguarda il prezzo del medicinale, abbiamo considerato l’ipotesi di utilizzare come endpoint il costo complessivo della terapia, poiché questo è un parametro “integrato” che tiene conto di numerosi fattori, come la durata del trattamento, la posologia, il peso del paziente o, in alcuni casi, la superficie corporea. Tuttavia, in questo lavoro, avendo come obiettivo di studio il calcolo di una correlazione, è opportuno individuare due valori numerici precisi da correlare, uno per descrivere il tempo di negoziazione e uno per descrivere il costo delle terapie. A questo riguardo, il costo complessivo delle terapie risulta paradossalmente meno preciso, poiché un valore numerico definito si può calcolare solo in alcuni casi, per esempio una terapia one-shot o una terapia di durata pluriennale con compresse a dosaggio giornaliero fisso, indipendente dal peso corporeo del paziente. Nei casi rimanenti il costo complessivo resta mal definito e bisogna ricorrere a delle approssimazioni (base mensile, base annua, peso medio di 70 kg) che sono poco compatibili con la necessità di valori numerici ben definiti. Abbiamo pertanto optato per il prezzo ex-factory, per confezione, pubblicato in GU nella determina AIFA di prezzo e rimborso. Nel caso di più confezioni, abbiamo considerato quella a prezzo più elevato. Il prezzo ex-factory è una misura surrogata del costo complessivo del trattamento farmacologico, ma è comunque un proxy affidabile, strettamente correlato al costo complessivo della terapia (5).
Per quanto riguarda invece la durata della procedura, quest’ultima è un processo complesso, articolato in diversi momenti (Fig. 1). Accanto a tempi tecnici relativamente prevedibili e costanti (tempo dalla pubblicazione in GU europea al recepimento in AIFA della decisione EU, tempi di pubblicazione in GU della determina Cnn, passaggio in CdA AIFA), vi sono i tempi di valutazione da parte degli Uffici AIFA e di CTS e CPR, i quali sono ampiamente variabili, con l’aggravante di possibili prolungamenti per richieste di rivalutazioni da parte della CTS per procedure già in fase di negoziazione di prezzo in CPR. Un’altra fonte di forte variabilità è data dalle tempistiche di presentazione della domanda di P&R da parte dei titolari di AIC, per la complessità nell’allestimento dei dossier o anche per semplici considerazioni di opportunità da parte dell’Azienda (Fig. 1). A fronte della complessità dei passaggi intermedi, abbiamo perciò stabilito 2 endpoint tempo-correlati sempre tracciabili con precisione: il tempo complessivo intercorso dalla pubblicazione della decisione EU nella GU europea alla pubblicazione della determina AIFA di prezzo e rimborso nella GU italiana (tempo “da-Gazzetta-a-Gazzetta”) e il tempo intercorso dalla presentazione della domanda di P&R alla pubblicazione della determina AIFA in GU (tempo di negoziazione AIFA).
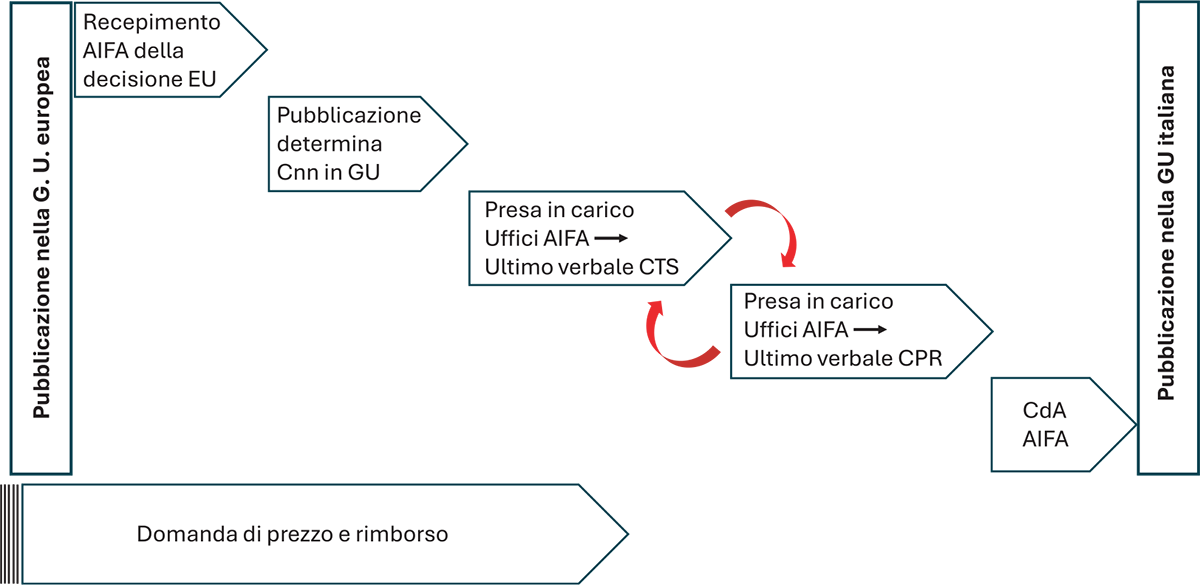
FIGURA 1 - Descrizione schematica delle fasi della procedura di negoziazione di P&R in AIFA fino a dicembre 2023. Le frecce rosse indicano la possibilità che alcune procedure fossero riesaminate dalla CTS anche successivamente alla presa in carico da parte del CPR. Il momento in cui le Aziende titolari di AIC presentano domanda di rimborso è caratterizzato da un’ampia variabilità.
Criteri di esclusione e di inclusione
Una volta definiti gli endpoint dello studio, abbiamo introdotto dei criteri di esclusione, con motivazioni legate sia alla tipologia dei farmaci che alla coerenza con gli endpoint di misura. Sono stati esclusi dalla valutazione: 1) farmaci biosimilari, generici o approvati con altre procedure abridged (combinazioni a dosi fisse, ibridi, ecc.). Per queste categorie di medicinali, le negoziazioni di prezzo sono di default più rapide ed è anche possibile concordare un prezzo evitando il processo di negoziazione; 2) vaccini anti-SARS-Cov-2, per le peculiarità della negoziazione del prezzo di questi prodotti; 3) terapie geniche. Nell’intervallo di tempo considerato, è stato negoziato il prezzo di 4 terapie geniche: idecabtagene vicleucel (577.644,41 euro/confezione), lisocabtagene maraleucel (345.000,00 euro/confezione), eladocagene exuparvovec (3.500.000 euro/confezione) e valoctocogene roxaparvovec (60.781,25 euro/confezione, ma sono necessarie almeno 20 confezioni per completare un trattamento). Si tratta chiaramente di outlier, per i costi di terapia marcatamente più elevati rispetto a medicinali standard, che avrebbero distorto i risultati dello studio e la loro interpretazione; 4) medicinali che non avevano ancora un prezzo negoziato al momento del datalock. La maggior parte di questi (67 prodotti) si trovava in classe Cnn.
Analisi statistica
Il calcolo della correlazione fra tempi di negoziazione e prezzi delle terapie è stato condotto utilizzando il programma per computer PrismTM versione 6.01 (GraphPad, San Diego CA, USA).
Risultati
Esclusi biosimilari, generici e affini, vaccini anti-SARS-Cov-2 e terapie geniche, nel periodo in esame i medicinali autorizzati in EU che hanno completato la procedura di negoziazione di P&R in AIFA sono stati 67. Questi farmaci sono elencati nella Tabella 1 in ordine temporale di pubblicazione della determina AIFA di P&R in GU e sono indicati con il loro INN, insieme con il tempo “da-Gazzetta-a-Gazzetta” il tempo di negoziazione AIFA e il prezzo ex-factory della confezione a più alto prezzo fra quelle approvate.
| Medicinale | Durata totale | Durata AIFA | Costo confezione | |
|---|---|---|---|---|
| 1 | Tagraxofusp | 735 | 722 | 23.329,36 |
| 2 | Trastuzumab deruxtecan | 857 | 735 | 2.332,56 |
| 3 | Fostemsavir | 437 | 472 | 3.324,10 |
| 4 | Fedratinib | 403 | 362 | 4.575,00 |
| 5 | Selpercatinib | 501 | 390 | 10.256,41 |
| 6 | Tucatinib | 600 | NA | 2.122,81 |
| 7 | Risdiplam | 283 | 344 | 8.285,00 |
| 8 | Pemigatinib | 395 | 481 | 7.732,00 |
| 9 | Cenobamate | 389 | 389 | 77,98 |
| 10 | Ofatumumab | 339 | 365 | 1.366,44 |
| 11 | Dostarlimab | 475 | 566 | 6.950,00 |
| 12 | Berotralstst | 971 | 315 | 12.197,00 |
| 13 | Ponesimod | 330 | 351 | 1.152,00 |
| 14 | Hydrocortisone (for Congenital adrenal hyperplasia) | 427 | 364 | 337,95 |
| 15 | Tralokinumab | 370 | 400 | 1.280,00 |
| 16 | Selumetinib | 907 | 970 | 12.814,40 |
| 17 | Evinacumab | 819 | 732 | 7.571,58 |
| 18 | Azacitidine | 661 | 663 | 12.895,00 |
| 19 | Satralizumab | 406 | 410 | 8.100,00 |
| 20 | Relugolix, estradiol, norethisterone acetate | 643 | 490 | 100,00 |
| 21 | Odevixibat | 365 | 431 | 22.008,00 |
| 22 | Setmelanotide | 365 | 402 | 2.750,00 |
| 23 | Tirbanibulin | 393 | 281 | 50,75 |
| 24 | Vericiguat | 666 | 615 | 39,20 |
| 25 | Roxadustat | 514 | 543 | 585,71 |
| 26 | Bimekizumab | 413 | 382 | 2.400,00 |
| 27 | Vosoritide | 348 | 296 | 6.575,30 |
| 28 | Tafasitamab | 404 | 474 | 782,00 |
| 29 | Pitolisant | 242 | 287 | 379,37 |
| 30 | Pralsetinib | 323 | 412 | 9.085,87 |
| 31 | Ripretinib | 625 | 368 | 21.500,00 |
| 32 | Zanubrutinib | 288 | 321 | 6.066,15 |
| 33 | Sacituzumab govitecan | 223 | 313 | 1.031,40 |
| 34 | Amivantamab | 392 | 432 | 1.547,93 |
| 35 | Abrocitinib | 361 | 372 | 4.576,00 |
| 36 | Pegcetacoplan | 194 | 289 | 24.846,16 |
| 37 | Sotorasib | 817 | 844 | 7.368,00 |
| 38 | Avacopan | 831 | 590 | 6.381,00 |
| 39 | Glucarpidase | 641 | 556 | 30.470,91 |
| 40 | Eptinezumab | 487 | 436 | 1.483,39 |
| 41 | Nirmatrelvir, ritonavir | 691 | 648 | 1.336,29 |
| 42 | Anifrolumab | 364 | 384 | 926,05 |
| 43 | Risperidone (retard) | 431 | 369 | 367,15 |
| 44 | Somatogron | 362 | 404 | 652,59 |
| 45 | Tepotinib | 331 | 323 | 9.418,86 |
| 46 | Tebentafusp | 281 | 351 | 12.431,00 |
| 47 | Enfortumab vedotin | 407 | 560 | 1.274,24 |
| 48 | Inebilizumab | 297 | 301 | 52.650,00 |
| 49 | Relugolix | 633 | 322 | 173,97 |
| 50 | Mosunetuzumab | 413 | 455 | 7.640,59 |
| 51 | Capmatinib | 277 | 313 | 8.000,00 |
| 52 | Birch bark extract | 595 | 486 | 8.310,00 |
| 53 | Avalglucosidase alfa | 544 | 573 | 27.500,00 |
| 54 | Olipudase alfa | 483 | 541 | 93.490,25 |
| 55 | Efgartigimod alfa | 284 | 337 | 7.721,94 |
| 56 | Lenacapavir | 323 | 407 | 20.222,00 |
| 57 | Asciminib | 231 | 325 | 4.884,00 |
| 58 | Voclosporin | 243 | 239 | 1.148,87 |
| 59 | Faricimab | 341 | 432 | 700,19 |
| 60 | Vutrisiran | 291 | 347 | 99.250,00 |
| 61 | Tezepelumab | 477 | 489 | 1.173,50 |
| 62 | Maribavir | 175 | 265 | 11.080,34 |
| 63 | Maralixibat | 307 | 353 | 35.200,00 |
| 64 | Loncastuximab tesirine | 410 | 351 | 23.933,11 |
| 65 | Tremelimumab | 323 | 325 | 22.160,66 |
| 66 | Ruxolitinib | 360 | 347 | 750,00 |
| 67 | Glofitamab | 197 | 280 | 4.000,00 |
| Valore minimo | 175 | 239 | 39,20 | |
| Valore massimo | 971 | 970 | 99.250,00 | |
| Media ± Deviazione Standard (n) | 446,4±186 (67) | 434,7±145,6 (66) | 10.942±2.217 (67) | |
| Mediana | 395 | 389,5 | 6.066 | |
Esprimendo la durata della procedura di negoziazione come tempo “da-Gazzetta-a-Gazzetta”, la durata media delle procedure è stata di 446,4 giorni, con una deviazione standard di 186 giorni. La mediana di durata è stata di 395 giorni. La variabilità intorno a questi valori medi è piuttosto ampia, passando dalla durata minima di 175 giorni alla durata massima di 971 giorni, con un intervallo di 796 giorni (circa 2 anni e 2 mesi) fra la procedura più rapida e quella più prolungata. Il 25% delle procedure (ultimo quartile) ha avuto una durata superiore a 536 giorni. Un indicatore indiretto della durata delle procedure di valutazione si può ritrovare nel fatto che il numero di procedure concluse nel periodo di tempo in esame è uguale al numero di procedure che si trovavano ancora in Cnn (67) al momento del datalock.
Esprimendo invece la durata della negoziazione come tempo dalla presentazione della domanda di P&R alla pubblicazione in GU, la durata media delle procedure è stata di 434,7 giorni, con una deviazione standard di 145,6 giorni. La mediana di durata è stata di 389,5 giorni. La durata minima e quella massima sono state rispettivamente di 239 e 970 giorni, con un intervallo di 731 giorni fra la procedura più rapida e quella più prolungata.
I tempi medi e mediani di negoziazione ottenuti adottando i 2 diversi endpoint tempo-correlati tendono a sovrapporsi. In effetti, il dato atteso di tempi di negoziazione AIFA più brevi rispetto ai tempi complessivi “da-Gazzetta-a-Gazzetta” tende a essere bilanciato dal fatto che, in 41 casi sui 67 analizzati (vale a dire il 61,2% dei casi), le Aziende hanno presentato domanda prima della pubblicazione dell’EC approval in GU europea, con un anticipo medio di 51,4 giorni rispetto alla data di pubblicazione.
Per quanto riguarda i prezzi ex-factory dei 68 medicinali in esame, il prezzo medio per confezione è di 10.942 €, con un’oscillazione molto ampia fra il valore minimo di 39,2 €/confezione e il massimo di 99.250 €/confezione.
Quando si calcola la correlazione fra prezzi dei medicinali e durata della procedura espressa come tempo “da-Gazzetta-a-Gazzetta”, emerge in maniera molto netta che non vi è alcuna correlazione fra il prezzo dei medicinali e la durata della procedura di negoziazione (Fig. 2A). Infatti, il parametro r di Pearson è = −0,0497 (limiti fiduciali al 95%: −0,286-0,193) e la r2 è = 0,00247. Allo stesso modo, quando si calcola la correlazione fra prezzi dei medicinali e durata della procedura espressa come tempo di negoziazione in AIFA, la r di Pearson è = 0,00866 (limiti fiduciali al 95%: −0,234-0,250) e la r2 è = 0,000075 (Fig. 2B).
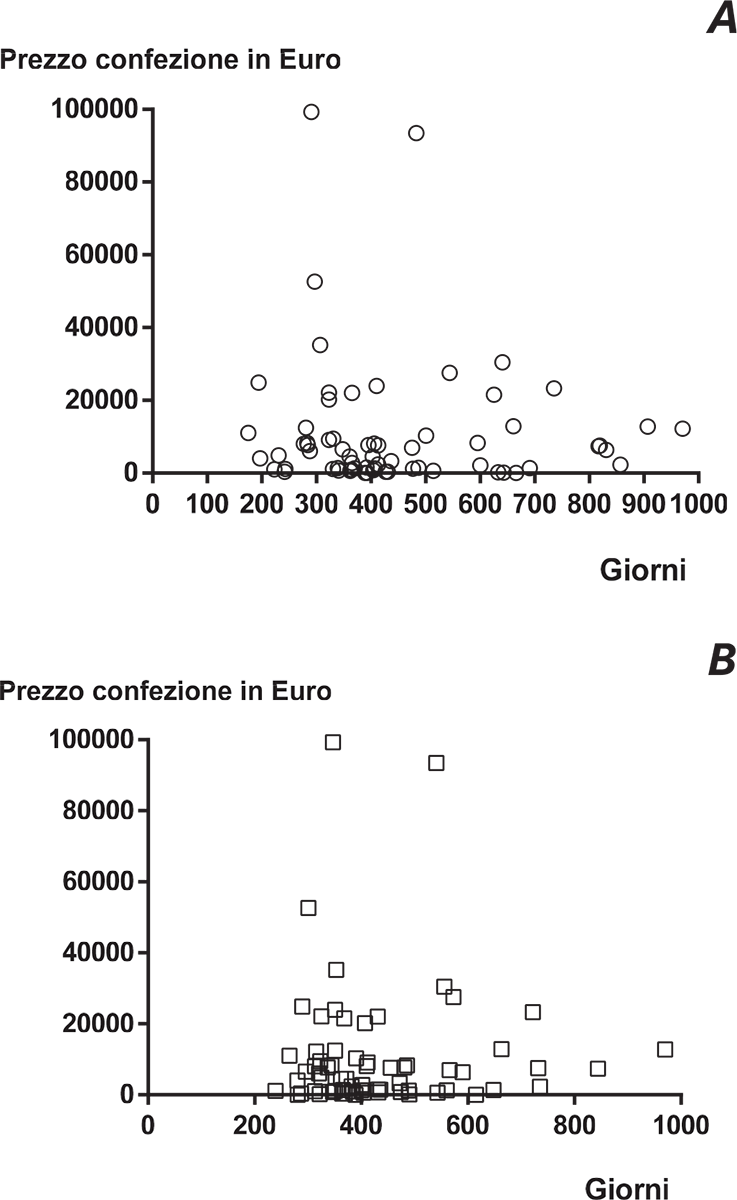
FIGURE 2 - La Figura mostra che non vi è alcuna correlazione positiva fra prezzo del medicinale, espresso come prezzo ex-factory, e durata della negoziazione, espressa sia come tempo “da-Gazzettaa- Gazzetta” (A) che come tempo di negoziazione AIFA (B).
Discussione
In questo lavoro abbiamo osservato che, nell’ambito dei medicinali che hanno ricevuto un’EC approval e che hanno successivamente completato la procedura di negoziazione di prezzo in Italia nel triennio 2021-2023, la durata della procedura è stata del tutto indipendente dal prezzo del farmaco. A nostra conoscenza, questo è il primo studio in cui sia stata valutata l’ipotesi che il prezzo del medicinale possa influenzare la durata della procedura di negoziazione.
Le nostre stime relative al tempo complessivo di negoziazione sono strettamente correlate con quelle calcolate dall’European Federation of Pharmaceutical Industries and Associations (EFPIA) (4). Quest’ultima, nella sua più recente survey, ha esaminato il periodo dal 2018 fino al 5 gennaio 2023 e ha definito il “Time to availability” come i giorni intercorsi fra la concessione dell’AIC europea e la data in cui il prodotto ha accesso alle liste di rimborsabilità (definizione corrispondente al nostro tempo “da-Gazzetta-a-Gazzetta”) (4). Secondo la survey EFPIA, il tempo medio di negoziazione in Italia è di 436 giorni (a fronte della media nell’EU di 517 giorni), e la mediana è di 425 giorni (a fronte della mediana europea di 442 giorni). È da notare che anche EFPIA registra per l’Italia un’ampia variabilità fra tempo minimo e massimo (anche maggiore rispetto alla nostra stima, poiché sono inclusi anni precedenti), ma questa sembra essere una caratteristica comune a molti Paesi europei, inclusi Germania, Francia e Spagna.
Conclusioni
Facendo riferimento alla performance di AIFA nel periodo 2021-2023, nell’analisi delle possibili cause di prolungamento dei tempi nelle procedure di P&R, si può escludere con sicurezza che il prezzo (elevato) dei medicinali possa essere stato un fattore responsabile dell’allungamento dei tempi di negoziazione.
Disclosures
Conflict of interest: RC and PT are employes of Intexo Società Benefit. DP and PN have no conflict of interest to declare.
Financial support: This study received no financial support.
Authors contribution: RC and PT provided and analyzed the data; DP analyzed the data; PN conceived the study, analyzed the data and drafted the manuscript; all Authors critically read and approved the draft.
Bibliografia
- 1. Quotidiano sanità. Scienza e Farmaci. Riforma Aifa. Il decreto con il nuovo regolamento pubblicato in Gazzetta. Sarà in vigore dal 30 gennaio. Online (Accessed August 2024)
- 2. Raimondo P, Casilli G, Isernia M, Lidonnici D, Ravasio R, Ronco V, Lanati E. Le tempistiche autorizzative di AIFA: un confronto tra le due commissioni consultive e tecnico-scientifiche succedutesi nel periodo 2015-2020. Glob Reg Health Technol Assess 2020 Dec 14; 7: 109-114. CrossRef
- 3. Agenzia Italiana del Farmaco. Rapporto sulle tempistiche delle procedure di prezzo e rimborso dei farmaci nel quinquennio 2018-2022. Online (Accessed August 2024)
- 4. IQVIA. EFPIA Patients W.A.I.T. Indicator 2022 Survey. Online (Accessed August 2024)
- 5. Villa F, Di Filippo A, Pierantozzi A, Genazzani A, Addis A, Trifirò G, Cangini A, Tafuri G, Settesoldi D, Trotta F. Orphan Drug Prices and Epidemiology of Rare Diseases: A Cross-Sectional Study in Italy in the Years 2014-2019. Front Med (Lausanne). 2022 Feb 17; 9: 820757. CrossRef PubMed