 |
Glob Reg Health Technol Assess 2024; 11: 248-257 ISSN 2283-5733 | DOI: 10.33393/grhta.2024.3167 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di costo-efficacia di brentuximab vedotin in combinazione con doxorubicina, vinblastina e dacarbazina (AVD) in pazienti adulti affetti da linfoma di Hodgkin in stadio IV
Cost-effectiveness of brentuximab vedotin plus chemotherapy as frontline treatment of stage IV Hodgkin lymphoma in Italy
Objectives: Advanced Hodgkin’s lymphoma (HL) is a rare severe neoplasm, significantly limiting the ability of patients to do daily activities among other impacts of the cancer. Many adult patients present with advanced stage disease (stages III/IV). This analysis investigates the cost-effectiveness of brentuximab vedotin (BV) in combination with doxorubicin, vinblastine, and dacarbarzine (AVD) versus ABVD (doxorubicin, bleomycin, vinblastine, and dacarbazine) for the frontline treatment of stage IV HL in Italy based on data from the ECHELON-1 clinical trial.
Methods: The analysis was conducted from the perspective of the National Health Service using a Markov model with three mutually exclusive health states and a lifetime time horizon. Transition probabilities were taken from the six-year follow-up data of ECHELON-1. Costs were obtained mainly from published literature and national tariffs. For all drugs, ex-factory prices net of the mandatory reductions required by law were considered. Scenarios on possible confidential drug discounts were also explored.
Results: BV in combination with AVD was associated with an increase of € 44,551 in total costs of 1.03 life-years (LYs) and 0.85 quality-adjusted life-years (QALYs) as compared with ABVD in the base-case scenario. The incremental cost-effectiveness ratio and the incremental cost-utility ratio were estimated equal to € 43,179/LYs and € 52,257/QALYs, respectively, when based on ex-factory prices. BV in combination with AVD was shown to be a cost-effective option in 24 out of 36 scenarios examining possible confidential discounts (ranging from 0% to 60%) for high-cost drugs included in the analysis based on a € 41,411/QALYs threshold for severe diseases.
Conclusions: Based on data from 6 years of follow-up from the ECHELON-1 trial, BV in combination with AVD has the potential to be a cost-effective option versus ABVD for the frontline treatment of stage IV HL in Italy.
Keywords: Brentuximab Vedotin, Cost-effectiveness analysis, Economic evaluation, Hodgkin lymphoma
Received: June 18, 2024
Accepted: October 31, 2024
Published online: December 10, 2024
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il linfoma di Hodgkin (LH) in stadio avanzato (stadio III e IV) è una neoplasia severa rara che colpisce in modo particolare i giovani adulti in età lavorativa e le persone anziane, limitandone significativamente la capacità di svolgere le attività quotidiane.
Tale neoplasia colpisce i linfonodi e ha origine dai linfociti B, una specifica sottopopolazione di globuli bianchi o leucociti. Il linfoma di Hodgkin si differenzia dalle leucemie poiché si sviluppa come una massa localizzata e non si diffonde nel sangue o nel midollo osseo; inoltre, si distingue dai linfomi non Hodgkin in termini di sede di comparsa, di modalità di avanzamento e di presenza extranodale (diffusione del tumore al di fuori dei linfonodi).
Il LH mostra una distribuzione bimodale per età peculiare, con un primo picco nei pazienti < 40 anni di età e un secondo picco dopo i 60 anni di età. Il LH rappresenta uno dei tumori maligni più comuni nei giovani adulti, colpendo i giovani in età lavorativa, in particolare quelli di 20-40 anni di età (1,2), con un’età media alla diagnosi generalmente riportata tra i 30 e i 42 anni (1,2). L’incidenza di LH è anche particolarmente alta nei pazienti di età ≥ 60 anni (3). Pertanto, dal momento che il LH limita significativamente la capacità di una persona di svolgere le attività quotidiane, questa malattia viene definita severa (4). Il tasso di sopravvivenza a 5 anni dopo la diagnosi del LH è dell’85% negli uomini e dell’87% nelle donne (4).
Dal punto di vista del trattamento, il linfoma di Hodgkin può essere gestito attraverso diverse opzioni terapeutiche. La stadiazione della malattia viene effettuata attraverso il sistema di Ann Arbor che distingue tra malattia localizzata (stadio I o II) e malattia avanzata (stadio III o IV) in relazione ad alcuni criteri (5).
Alla diagnosi, circa il 40% dei pazienti con LH presenta la malattia in stadio avanzato (stadio III e IV) secondo i criteri del sistema Ann Arbor; tali pazienti risultano caratterizzati da una prognosi più severa e sfavorevole (6).
Negli ultimi decenni, i progressi raggiunti nella chemioterapia in combinazione o meno con la radioterapia hanno aumentato significativamente il tasso di guarigione dei pazienti affetti da LH. In Italia, le chemioterapie autorizzate e rimborsate per il trattamento dei pazienti adulti precedentemente non trattati affetti da LH (stadio III/IV) sono ABVD (doxorubicina, bleomicina, vinblastina e dacarbazina) e BEACOPP (bleomicina, etoposide, doxorubicina, ciclofosfamide, vincristina, procarbazina e prednisone), sebbene il trattamento con bleomicina sia spesso associato a tossicità polmonare. Tuttavia, una quota sostanziale di pazienti con LH in stadio avanzato (stadio III e IV) presenta una recidiva o risulta refrattaria al trattamento con ABVD (11-13). I regimi a base di BEACOPP, invece, possono provocare effetti avversi sulla fertilità ed essere associati a un aumentato rischio di tumori secondari (7).
Oltre ai regimi ABVD e BEACOPP, anche brentuximab vedotin in combinazione con doxorubicina, vinblastina e dacarbazina (BV+AVD) è autorizzato e rimborsato per i pazienti precedentemente non trattati con LH in stadio IV. BV+AVD è l’unico trattamento che ha dimostrato un vantaggio significativo in termini di sopravvivenza globale (OS) rispetto ad ABVD. Nello studio clinico di fase 3 ECHELON-1, nell’ultimo follow-up a 6 anni, il trattamento di prima linea con BV+AVD ha dimostrato una superiorità statisticamente significativa dell’OS rispetto ad ABVD, sia nella popolazione ITT (stadio III e IV, HR = 0,59; IC 95%: 0,40-0,88; p = 0,009), sia nella popolazione in stadio IV (HR: 0,48; IC 95%: 0,29-0,80) (8).
Lo studio ECHELON-1 ha inoltre dimostrato che il trattamento con BV+AVD migliora significativamente la sopravvivenza libera da progressione dei pazienti con LH rispetto al trattamento con ABVD (8); infatti, i dati a 6 anni di follow-up hanno dimostrato un beneficio di lungo periodo in termini di sopravvivenza libera da progressione per i pazienti in trattamento con BV+AVD rispetto ad ABVD sia nella popolazione ITT (HR per progressione della malattia o morte pari a 0,68; IC 95%, 0,53-0,87) sia nella popolazione in stadio IV (HR: 0,72; IC 95%: 0,53-0,96) (8).
Questi dati dimostrano che BV+AVD garantisce un maggior tasso di guarigione rispetto ad ABVD. Inoltre, BV+AVD ha ridotto notevolmente il rischio di tossicità polmonare grave, imprevedibile e potenzialmente fatale nei pazienti con malattia in stadio III/IV, vs ABVD, grazie all’eliminazione della bleomicina (2,0% vs 7,0% nella popolazione generale e 2,0% vs 13% nella popolazione con età ≥ 60 anni) (8,9).
A oggi, non è stata ancora condotta una valutazione economica volta a confrontare i costi e i benefici di BV+AVD rispetto ad ABVD in Italia. L’obiettivo di questo studio è stato quello di valutare la costo-efficacia di brentuximab vedotin in associazione a doxorubicina, vinblastina e dacarbazina per il trattamento dei pazienti adulti precedentemente non trattati affetti da LH in stadio IV utilizzando i dati dello studio clinico ECHELON-1.
Metodi
L’analisi di costo-efficacia è stata condotta secondo la prospettiva del Servizio Sanitario Nazionale (SSN) utilizzando un modello di Markov con orizzonte temporale lifetime. La popolazione oggetto di studio conserva le caratteristiche della popolazione arruolata all’interno dello studio clinico ECHELON-1 (1), dunque si tratta di una popolazione costituita da pazienti adulti affetti da linfoma di Hodgkin (LH) CD30+ in stadio IV non precedentemente trattati con un’età media pari a 39,4 anni, una BSA media pari a 1,86 m2 e un peso medio pari a 73,53 kg. Le probabilità di transizione sono state derivate dai dati di follow-up a 6 anni dello studio clinico ECHELON-1; in particolare, in linea con la popolazione target di questa analisi economica, sono state utilizzate le probabilità di transizione relative alla popolazione con LH in stadio IV (8). La mortalità della popolazione generale è stata implementata attraverso le tavole di mortalità della popolazione residente in Italia (10). L’estrapolazione a lungo termine delle curve di sopravvivenza dal trial clinico ECHELON-1 è stata valutata considerando sia le distribuzioni parametriche standard sia i modelli misti di guarigione (mixture cure models) (11).
Il modello economico ha restituito, per ciascuna opzione di trattamento in analisi (BV+AVD e ABVD), i costi diretti sanitari totali, gli anni di vita (LY) e gli anni di vita aggiustati per la qualità (QALY). Sono stati quindi calcolati il rapporto incrementale di costo-efficacia per LY e per QALY. Sia i costi che gli outcome sono stati scontati a un tasso del 3% annuo (12-14).
Struttura del modello di Markov
Il modello di Markov utilizzato ai fini dell’analisi risulta costituito da tre stati di salute mutualmente esclusivi: sopravvivenza libera da progressione (Progression-Free Survival, PFS), sopravvivenza post-progressione (Post-Progression Survival, PPS) e morte (Fig. 1).
Tutti i pazienti entrano nel modello nello stato di salute PFS e sono seguiti fino alla morte. Una volta entrati nel modello, in corrispondenza di ogni ciclo i pazienti possono rimanere nello stato di salute PFS, passare allo stato di salute PPS (dopo aver sperimentato un evento di progressione) o morire. I pazienti in post-progressione possono passare a una linea di trattamento successiva sulla base della percentuale di pazienti che ricevono ciascuna terapia successiva nel trial ECHELON-1. Le terapie successive sono state valutate solamente in termini di costi. L’impatto delle terapie successive sulla sopravvivenza non è stato modellato esplicitamente; tuttavia, è stato assunto che tale impatto potesse essere rappresentato dai dati di PPS provenienti da ECHELON-1.
Il modello tiene conto della correzione half-cycle. I cicli del modello hanno una durata pari a una settimana.
Dati di efficacia ed estrapolazione oltre l’orizzonte temporale dello studio clinico
Gli input di efficacia del modello sono stati calibrati sulla base dei dati riferiti ai pazienti in stadio IV arruolati all’interno dello studio clinico ECHELON-1 (dati aggiornati a 6 anni (8)). In particolare, le probabilità di transizione tra gli stati di salute mostrati nella Figura 1 sono state alimentate dalle seguenti curve di sopravvivenza:
– tempo alla progressione (Time To Progression, TTP), definito a partire dalla curva di PFS censurando gli eventi di morte prima della progressione e di uscita dal follow-up;
– tempo al decesso (Time to Death, TTD), definito a partire dalla curva di PFS censurando gli eventi di progressione prima della morte e di uscita dal follow-up;
– tempo dalla progressione della malattia alla morte (Post-Progression Survival, PPS), definito come il tempo dalla progressione della malattia alla morte.
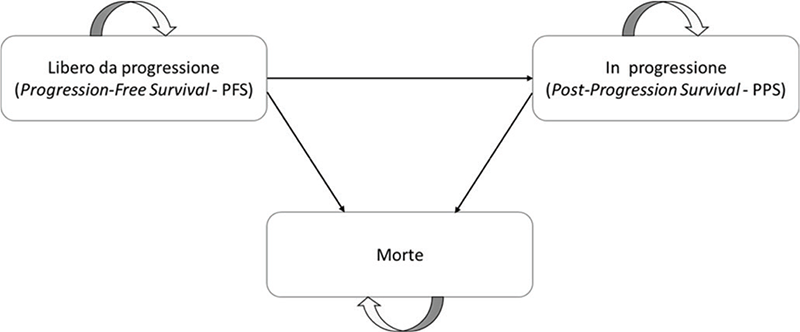
FIGURA 1 - Struttura del modello di Markov.
Gli studi condotti sul LH (15,16) suggeriscono che i pazienti possano essere guariti in prima linea attraverso la chemioterapia o la terapia BV+AVD (16,17). Questo risulta particolarmente evidente nei pazienti con LH che sopravvivono senza recidive oltre i cinque anni (17,18). Il lungo e piatto plateau delle curve di PFS e OS all’interno dello studio clinico ECHELON-1 dopo un esteso follow-up suggerisce che una percentuale di pazienti potrebbe aver raggiunto una remissione a lungo termine e quindi una potenziale guarigione, dopo aver ricevuto la terapia BV+AVD in prima linea. Pertanto, per l’estrapolazione a lungo termine delle curve di sopravvivenza sono stati esplorati sia le distribuzioni parametriche standard sia i mixture cure models (11).
Il tempo alla progressione (Time To Progression, TTP) si basa sulle curve KM di PFS dello studio ECHELON-1 con censura degli eventi di morte in pre-progressione ed è stato impiegato per alimentare le probabilità di transizione dallo stato di salute “Libero da progressione” allo stato “In progressione”. Dal momento che, dopo il punto di cura (73 mesi), le curve KM TTP hanno mostrato un plateau esteso, l’estrapolazione delle curve è stata effettuata sulla base dell’ultimo valore osservato sulla curva KM (Fig. A in appendice), che si assume si applichi a tempo indeterminato. Il tempo al decesso (Time To Death, TTD) si basa sulle curve KM di PFS dello studio ECHELON-1 con censura degli eventi di progressione della malattia ed è stato impiegato per alimentare le probabilità di transizione dallo stato di salute “Libero da progressione” allo stato “Morte”. Dopo il punto di cura (73 mesi), le curve sono state estrapolate sulla base dei dati di sopravvivenza della popolazione generale (10) aggiustati per tenere conto del rischio di mortalità in eccesso dovuto all’impatto sul lungo termine del trattamento antitumorale (Fig. B in appendice). L’aggiustamento è stato effettuato utilizzando uno standardized mortality ratio (SMR) pari a 2,2 (19); tale SMR è stato stimato all’interno dello studio osservazionale condotto sui dati del registro SEER in pazienti con diagnosi di cHL in stadio III/IV trattati con chemioterapia nel periodo 2000-2015 e fa riferimento a tutte le cause di morte (a esclusione del LH).
La sopravvivenza post-progressione (PPS) è stata utilizzata per implementare le probabilità di transizione dallo stato di salute “In progressione” allo stato di salute “Morte”; la PPS è stata derivata dai dati provenienti dallo studio clinico ECHELON-1 ed è stata stimata mediante l’adozione di un’unica distribuzione esponenziale per entrambi i bracci di trattamento (assenza di un effetto del trattamento applicato alla PPS) (Fig. C in appendice). La scelta di una distribuzione esponenziale è stata effettuata in quanto il modello di Markov, per sua natura, richiede l’uso di una probabilità di transizione che sia costante nel tempo.
Valori di utilità per stato di salute
A ciascuno stato di salute è stata assegnata una stima di utilità con valori tra 0 e 1, dove 0 rappresenta il livello di utilità equivalente alla morte e 1 rappresenta uno stato di perfetta salute. I QALYs sono stati calcolati moltiplicando la stima di utilità associata a ciascuno stato di salute per la durata di permanenza nello stesso.
Nel caso base, le utilità relative al periodo che precede il punto di cura sono state stimate attraverso il modello a misure ripetute adattato ai dati EQ-5D-3L raccolti durante lo studio clinico ECHELON-1 (dati raccolti fino a 3 anni dopo la fine del trattamento) e adattato alle utilità della popolazione generale per età (scegliendo in maniera conservativa in corrispondenza di ciascuna età la più bassa tra le due) (20). Dopo il punto di cura (73 mesi), la qualità della vita correlata alla salute è stata considerata assimilabile a quella della popolazione generale, pertanto, dal punto di cura in poi, sono stati utilizzati i valori di utilità della popolazione italiana in base all’età (20).
I modelli a misure ripetute includono un effetto casuale per tenere conto dell’autocorrelazione dei punteggi di utilità dovuta a più osservazioni registrate per un dato paziente.
Infine, è stato assunto che l’utilità riferita allo stato di salute post-progressione potesse essere indipendente dal trattamento ricevuto in prima linea; tale stima è stata pertanto applicata a tutti i pazienti nello stato di progressione indipendentemente dal trattamento ricevuto. Il modello non tiene conto di stime di disutilità aggiuntive per gli eventi avversi in quanto queste dovrebbero riflettersi nelle stime di utilità raccolte all’interno dello studio clinico. Le utilità utilizzate nel modello sono riportate nella Tabella A.1 in appendice.
Parametri di costo
In accordo con la prospettiva del modello, l’analisi ha tenuto conto dei costi di acquisizione e somministrazione delle terapie farmacologiche di prima linea, dei costi di monitoraggio associati agli stati di salute, dei costi delle terapie concomitanti, dei costi di gestione degli eventi avversi, dei costi associati alla radioterapia ricevuta in pre-progressione e dei costi dei trattamenti successivi ricevuti in post-progressione.
Il costo di acquisizione associato a ciascun trattamento di prima linea è stato stimato considerando la posologia, il numero medio di cicli di trattamento, il peso medio (73,53 kg) e la BSA media (1,86 m2) riportati nello studio clinico ECHELON-1 e facenti riferimento alla popolazione in stadio IV (21) (Tab. A.1 in appendice). Il costo di acquisizione dei trattamenti farmacologici è stato calcolato a partire dal prezzo al milligrammo di ciascun farmaco all’interno dei rispettivi regimi. Per tutti i farmaci sono stati presi in considerazione i prezzi ex-factory al netto delle riduzioni obbligatorie di legge (5%+5%). Nella Tabella A.1 in appendice sono riportati la posologia e il costo per dose di ciascun trattamento considerato nell’analisi.
Per il costo di somministrazione delle terapie di prima linea è stata utilizzata la tariffa nazionale delle prestazioni di assistenza specialistica ambulatoriale associata al codice 99.25 (Iniezione o infusione di sostanze chemioterapiche per tumore) e pari a € 9,71 (22).
I costi di monitoraggio della malattia sono stati stimati in modo differente per lo stato di salute progression-free e per lo stato di salute post-progression; in particolare, per lo stato di salute progression-free, in accordo con le Linee Guida ESMO (23), sono stati considerati 3 intervalli temporali: 0-0,5 anni, 0,5-4 anni, ≥ 4 anni dalla diagnosi. La frequenza di utilizzo di ciascuna prestazione sanitaria in relazione alla fase di malattia è stata ottenuta dalle Linee Guida ESMO (24) e dall’opinione di esperti clinici (Tab. A.2 in appendice). I costi unitari associati a ciascuna prestazione sanitaria sono stati stimati mediante l’impiego del tariffario nazionale delle prestazioni di assistenza specialistica ambulatoriale (Tab. A.1 in appendice) (22).
Il costo delle terapie concomitanti è stato calcolato considerando i famaci antiemetici e antinfettivi, i fattori di crescita e i farmaci per la gestione del dolore. I regimi specifici sono stati selezionati in base a quelli maggiormente ricevuti dai pazienti all’interno dello studio clinico ECHELON-1. La quota di pazienti in trattamento con BV+AVD e ABVD che utilizzano ciascun trattamento concomitante è stata ottenuta dallo studio clinico ECHELON-1 con riferimento alla popolazione in stadio IV, a eccezione dei trattamenti antiemesi, per i quali la quota di pazienti che utilizza ciascun trattamento antiemesi (100% dei pazienti) è stata ottenuta dalle Linee Guida NCCN per la terapia antiemetica (Berger et al. 2017 (24)). La posologia dei farmaci antiemetici è stata derivata dalle Linee Guida AIOM 2018 per la terapia antiemetica (25), la posologia dei farmaci antinfettivi è stata ottenuta dal riassunto delle caratteristiche del prodotto per aciclovir (26) e da Petrosillo 2011 (27) per la levofloxacina, mentre, per i fattori di crescita e i farmaci per la gestione del dolore, la posologia è stata derivata dalle Linee Guida AIOM 2019 per la gestione della tossicità ematopoietica in oncologia (28) e dalle Linee Guida AIOM 2019 per la terapia del dolore in oncologia (29) rispettivamente (Tab. A.1 in appendice). Per ciascun farmaco, sono stati considerati i dosaggi derivanti dalle Linee Guida o dalla letteratura pubblicata (25,27,28) (Tab. A.1 in appendice).
Il costo di somministrazione per le terapie concomitanti non è stato considerato in quanto si è assunto che fosse assorbito dalle terapie di prima linea. Le terapie concomitanti rappresentano un add-on al costo delle terapie di prima linea; pertanto, il costo per ciclo delle terapie concomitanti è stato moltiplicato per il numero massimo di cicli associato a ciascun trattamento di prima linea e per la quota di pazienti che ne fanno uso. Il numero massimo di cicli è risultato pari a 5,7 per BV+AVD (perché 5,7 è il numero massimo di cicli che può essere raggiunto con dacarbazina e doxorubicina) e pari a 5,8 per ABVD (numero massimo di cicli che può essere raggiunto con doxorubicina).
Il costo degli eventi avversi correlati al trattamento è stato calcolato moltiplicando l’incidenza degli aventi avversi di grado ≥ 3 (con incidenza > 5%) per i costi unitari degli stessi. Le stime di incidenza sono state ricavate dallo studio ECHELON-1 (21) e fanno riferimento alla popolazione ITT, mentre i costi unitari sono stati derivati dal tariffario nazionale delle prestazioni di assistenza ospedaliera per acuti (30) (Tab. A.1 in appendice). In particolare, il costo unitario associato agli eventi avversi anemia, neutropenia febbrile, neutropenia e riduzione della conta dei neutrofili è stato valorizzato mediante la tariffa associata al DRG 395 (Anomalie dei globuli rossi, età > 17 anni), mentre il costo associato alla gestione della neuropatia periferica è stato valorizzato mediante le tariffe associate ai DRG 18 (Malattie dei nervi cranici e periferici con CC) e 19 (Malattie dei nervi cranici e periferici senza CC) ponderate per il rispettivo numero di dimissioni riportate nel rapporto annuale sull’attività di ricovero ospedaliero per l’anno 2020 (dimissioni entro soglia e con giorni di ricovero > 1) (31) (Tab. A.1 in appendice). Il costo associato a ciascun evento avverso, ponderato per le rispettive stime di incidenza, è stato applicato come costo one-off in corrispondenza del primo ciclo del modello. L’impatto degli eventi avversi è stato considerato solo sui costi.
Il modello tiene conto del costo della radioterapia nella fase di pre-progressione in quanto, all’interno dello studio clinico ECHELON-1, un piccolo numero di pazienti ha ricevuto la radioterapia in assenza di un evento di progressione (quindi come terapia concomitante di prima linea). Pertanto, all’interno del modello è stato assunto che l’1,2% e lo 0,2% dei pazienti in trattamento rispettivamente con BV+AVD e ABVD possano ricevere la radioterapia in fase di pre-progressione (stime da studio ECHELON-1 (21), Tab. A.1 in appendice). Il costo della radioterapia è stato stimato considerando il costo della preparazione e dell’esecuzione della radioterapia. Il costo della preparazione della radioterapia è stato stimato effettuando una media delle tariffe associate ai codici di specialistica ambulatoriale 92.29.1, 92.29.2, 92.29.3 e relativi all’individuazione del volume bersaglio e alla simulazione, mentre il costo relativo all’esecuzione della radioterapia è stato stimato attraverso una media delle tariffe associate ai codici di specialistica ambulatoriale 92.24.1, 92.24.2, 92.24.3 e relativi alla teleterapia con acceleratore lineare (22) (Tab. A.1 in appendice).
Il costo complessivo imputabile alla radioterapia in fase di pre-progressione è stato applicato come costo one-off in quanto la stima del costo tiene già conto della percentuale di pazienti che necessita di questa risorsa sanitaria. La radioterapia effettuata durante o dopo la progressione è stata inclusa all’interno del costo associato ai trattamenti successivi.
Il costo dei trattamenti successivi somministrati in fase di post-progressione è stato calcolato tenendo conto delle terapie successive impiegate all’interno dello studio clinico ECHELON-1. Con riferimento alle terapie farmacologiche sono stati impiegati il prezzo ex-factory al netto del 5%+5% e la posologia e la durata media di trattamento riportate negli studi clinici relativi a ciascun trattamento (32-38) (Tab. A.3 in appendice).
Il costo di somministrazione è stato valorizzato mediante la tariffa nazionale delle prestazioni di assistenza specialistica ambulatoriale associata al codice 99.25 (Iniezione o infusione di sostanze chemioterapiche per tumore) e pari a € 9,71 (22) per BV, mentre, per tutti gli altri regimi, sulla base del parere di esperti, è stato assunto il costo di un ricovero (DRG 404, € 1.823 (30)).
Il trapianto di cellule staminali è stato valorizzato mediante la tariffa associata al DRG 481 (TRAPIANTO DI MIDOLLO OSSEO) e pari a € 59.806 (30), mentre la radioterapia è stata valorizzata mediante la tariffa associata al DRG 409 (RADIOTERAPIA) e pari a € 1.471 (30) (Tab. A.2 in appendice).
Il costo complessivo di ciascun trattamento successivo, ponderato per ciascuna rispettiva quota di utilizzo (Tab. A.1 in appendice), è stato poi applicato, in corrispondenza di ciascun ciclo, alla percentuale di pazienti in progressione stimata attraverso l’impiego delle curve di TTP.
Analisi di sensibilità
Al fine di valutare l’incertezza degli input utilizzati all’interno del modello economico, sono state condotte un’analisi di sensibilità deterministica (DSA) e un’analisi di sensibilità probabilistica (PSA). I parametri inclusi all’interno dell’analisi di sensibilità probabilistica sono riportati nella Tabella A.1 in appendice. Per tutte le stime provenienti dallo studio clinico ECHELON-1 è stata presa in considerazione la variabilità riscontrata all’interno dello stesso, mentre, per le utilità e i costi, è stata assunta una variabilità rispettivamente pari al 10% e al 20%. Inoltre, dal momento che la profilassi primaria con fattori di crescita è raccomandata per i pazienti con LH avanzato in trattamento con BV+AVD, nell’ambito della DSA è stata testata anche l’ipotesi per cui il 100% dei pazienti trattati con BV+AVD sia trattato con fattori di crescita (il 77% con filgrastim e il 23% con pegfilgrastim).
Inoltre, dal momento che, per l’analisi del caso-base, sono stati utilizzati i prezzi ex-factory, al fine di valutare l’impatto degli accordi di non divulgazione sui risultati dell’analisi, sono state condotte delle analisi di scenario considerando la variabilità dei prezzi per brentuximab vedotin e dei farmaci ad alto costo inclusi come terapie successive (36 scenari di sconti potenziali che vanno dallo 0% al 60%).
Risultati
Come riportato nella Tabella 1, il modello ha stimato, per un paziente rappresentativo affetto da LH CD30+ in stadio IV non precedentemente trattato in un orizzonte temporale lifetime, un incremento dei costi totali associati al trattamento con BV+AVD rispetto ad ABVD pari a € 44.551; tale incremento dei costi risulta principalmente attribuibile al costo di acquisizione più elevato, mentre si osservano riduzioni di costo in termini di terapie successive (–€ 14.762) e di monitoraggio (–€ 867) (Tab. 1). In termini efficacia, il modello ha stimato un aumento pari a 1,0 LYs e un aumento pari a 0,9 QALYs per BV+AVD rispetto ad ABVD. Pertanto, l’ICER per LY e l’ICER per QALY sono risultati rispettivamente pari a € 43.179/LY e pari a € 52.257/QALY.
| Valori attesi scontati caso base (prospettiva SSN) | ABVD [A] | BV+AVD [B] | Differenza [Δ = B-A] | ICER |
|---|---|---|---|---|
| Costi totali (€) | € 41.020 | € 85.571 | € 44.551 | |
| Costi di acquisizione | € 1.525 | € 59.359 | € 57.834 | |
| Costi di somministrazione | € 112 | € 110 | –€ 2 | |
| Costi dei trattamenti concomitanti | € 5.764 | € 7.672 | € 1.908 | |
| Costi degli eventi avversi | € 1.588 | € 2.014 | € 426 | |
| Costi della radioterapia in pre-progressione | € 4 | € 18 | € 15 | |
| Costi di monitoraggio | € 7.840 | € 6.973 | –€ 867 | |
| Costi dei trattamenti successivi | € 24.186 | € 9.424 | –€ 14.762 | |
| Anni di vita | 18,8 | 19,9 | 1,0 | € 43.179 |
| QALY | 16,5 | 17,3 | 0,9 | € 52.257 |
Mediante l’osservazione del grafico tornado è possibile notare come i parametri a cui è risultato associato il maggior impatto sui risultati dell’analisi facciano riferimento al tasso di sconto riferito agli outcome, al peso medio del paziente e alla durata del trattamento con brentuximab vedotin (Fig. D in appendice).
Il piano di costo-efficacia (Fig. 2) e la curva di accettabilità di costo-efficacia (Fig. E in appendice) mostrano come BV+AVD rappresenti l’opzione di trattamento con maggiore probabilità di essere costo-efficace rispetto ad ABVD in corrispondenza di qualsiasi soglia di disponibilità a pagare per QALY guadagnato sopra € 50.000/QALY.
Discussione
Questa analisi è stata condotta al fine di valutare i costi diretti sanitari e l’efficacia di BV+AVD rispetto ad ABVD (doxorubicina, bleomicina, vinblastina e dacarbazina) per il trattamento dei pazienti con linfoma di Hodgkin avanzato in stadio IV non precedentemente trattati, utilizzando i dati di follow-up a 6 anni provenienti dallo studio ECHELON-1.
I valori di ICER per LY e per QALY stimati secondo un orizzonte temporale lifetime sono risultati rispettivamente pari a € 43.179/LY e a € 52.257/QALY. L’ICER per QALY stimato risulta superiore al valore medio di ICER per QALY osservato a livello nazionale per patologie severe pari a € 41.411/QALY (39). Tuttavia, questa soglia potrebbe non essere rappresentativa per la limitata numerosità del campione; specialmente in oncologia, i valori di ICER per QALY risultano spesso superiori a questo valore soglia (40,41). Inoltre, l’ICER per QALY stimato si è basato sui prezzi ex-factory dei trattamenti farmacologici considerati nell’analisi, ma, come riportato nello studio condotto da Russo et al. nel 2022 (42), i prezzi confidenziali possono influenzare il valore stimato dell’ICER per QALY di un nuovo farmaco e, di conseguenza, la sua interpretazione. I fattori che maggiormente hanno influenzato i risultati sono l’incremento dei costi di acquisizione dei farmaci e la riduzione dei costi associati ai trattamenti successivi, dunque entrambi i fattori potrebbero potenzialmente essere influenzati dai prezzi confidenziali. Al fine di valutare l’impatto degli sconti confidenziali dei farmaci sui risultati dell’analisi, sono state condotte delle analisi di scenario considerando la possibile variabilità dei prezzi per brentuximab vedotin e per i farmaci ad alto costo utilizzati nell’analisi come linee di trattamento successive; considerando queste simulazioni sul prezzo, brentuximab vedotin risulterebbe un’opzione costo-efficace per il trattamento di prima linea del linfoma di Hodgkin in stadio IV in Italia nella maggior parte degli scenari di sconto considerati (Tab. 2).
Le analisi di costo-efficacia condotte per i trattamenti di prima linea in pazienti con linfoma di Hodgkin avanzato identificate dalla letteratura mostrano come la struttura di Markov rappresenti l’approccio più utilizzato fino a oggi. Tuttavia, a causa delle diverse prospettive di analisi e dei diversi regimi di trattamento valutati, i risultati delle valutazioni economiche precedentemente condotte per gli Stati Uniti e il Canada risultano incoerenti e difficili da confrontare con i risultati di questa analisi. Gli studi di Huntington et al. del 2018 (USA) e di Raymakers et al. del 2020 (Canada) hanno dimostrato come BV+AVD non risulti un’opzione di trattamento costo-efficace rispetto ad ABVD tenendo conto dei costi dei farmaci utilizzati all’interno delle analisi (43,44), mentre lo studio di Delea et al. del 2018 ha mostrato come BV+AVD possa rappresentare un’opzione di trattamento costo-efficace utilizzando una soglia di disponibilità a pagare per gli Stati Uniti ≥ $ 100.000) (45). Tali differenze potrebbero essere attribuibili all’utilizzo della PFS modificata (mPFS), all’impiego della prospettiva dell’investigatore rispetto alla prospettiva dell’IRF (independent review facility), a differenze nelle assunzioni circa l’utilizzo dei fattori di crescita, all’utilizzo dei prezzi dell’assistenza sanitaria commerciale rispetto alla spesa Medicare (per gli studi condotti negli Stati Uniti) e alle assunzioni circa l’impatto a lungo termine della tossicità polmonare sulla mortalità. Le analisi di Huntington et al. del 2018 e di Delea et al. del 2019 sono state condotte secondo un orizzonte temporale lifetime, mentre lo studio di Raymakers et al. del 2020 è stato condotto considerando un orizzonte temporale pari a 15 anni.
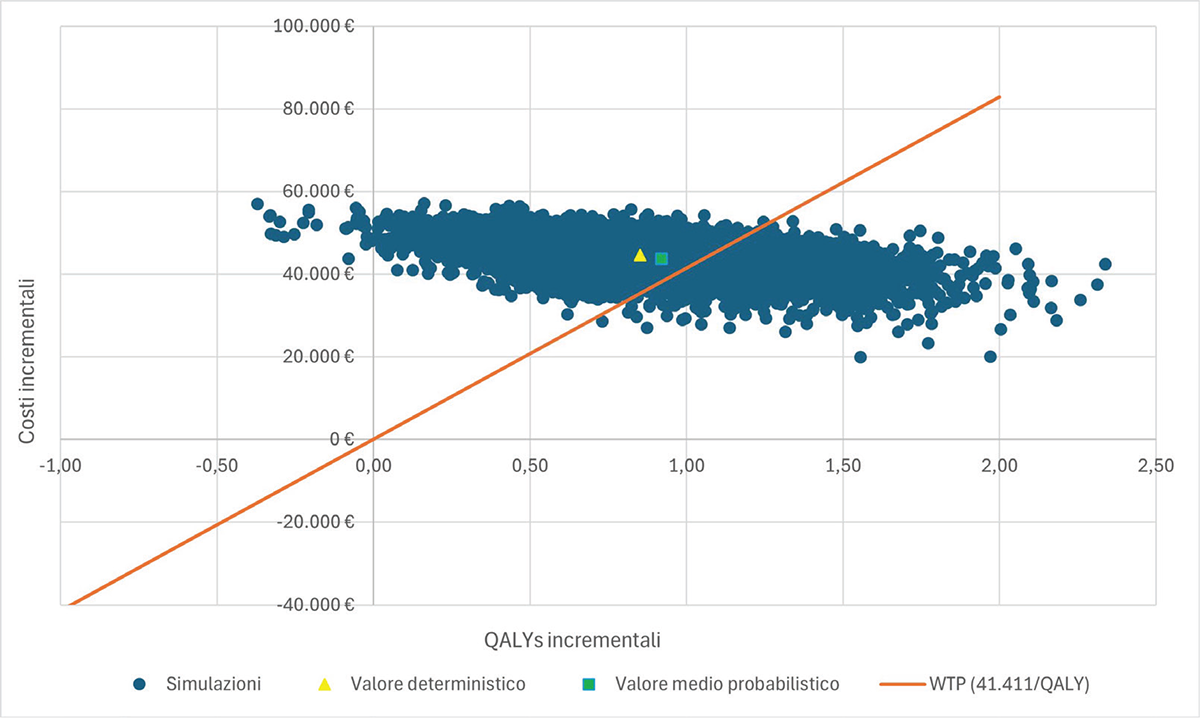
FIGURA 2 - Piano di costo-efficacia. WTP: Willingness To Pay Threshold. QALYs: Quality Adjusted Life-Years.
| BV | Farmaci ad alto costo nelle terapie successive (nivolumab, pembrolizumab) | |||||
|---|---|---|---|---|---|---|
| [–0/–10%) | [–10/–20%) | [–20/–30%) | [–30/–40%) | [–40/–50%) | [–50/–60%] | |
| [–0/–10%) | € 49.876 | € 50.011 | € 50.146 | € 50.280 | € 50.415 | € 50.556 |
| [–10/–20%) | € 44.452 | € 44.587 | € 44.721 | € 44.856 | € 44.991 | € 45.132 |
| [–20/–30%) | € 39.028 | € 39.163 | € 39.297 | € 39.432 | € 39.566 | € 39.708 |
| [–30/–40%) | € 33.604 | € 33.739 | € 33.873 | € 34.008 | € 34.142 | € 34.284 |
| [–40/–50%) | € 28.180 | € 28.314 | € 28.449 | € 28.584 | € 28.718 | € 28.860 |
| [–50/–60%] | € 22.485 | € 22.619 | € 22.754 | € 22.888 | € 23.023 | € 23.164 |
Ogni classe include i punti percentuali che sono stati simulati come sconti ipotetici sia per BV (come trattamento iniziale e successivo) sia per nivolumab e pembrolizumab (come trattamento successivo).
Esempio: ogni fascia di sconto (p. es., [–0/–10%)) esprime la gamma di sconti applicati sia a BV sia ai trattamenti successivi. Così € 49.876 esprime l’ICER per QALY medio dopo aver applicato sconti tra l’1% e il 10%.
Un ulteriore studio condotto nella prospettiva canadese da Vijenthira et al. nel 2020 ha valutato una gamma più ampia di regimi terapeutici, inclusi BV+AVD e ABVD e ha mostrato come la de-escalation del trattamento PET-guidata (come specificato nello studio AHL2011) rappresenti l’opzione di trattamento dominante (Vijenthira et al. 2020 (46)); tuttavia, per valutare questi regimi terapeutici, sono stati necessari dati provenienti da cinque diversi studi clinici e, in tre di questi, come evidenziato anche dagli autori, i pazienti in stadio III-IV risultavano sotto-rappresentati.
Nel confronto dei risultati di questa analisi di costo-efficacia con quelli precedentemente pubblicati è importante evidenziare che questo studio ha utilizzato i dati di follow-up a 6 anni dello studio ECHELON-1, mentre le analisi precedenti sono state basate su dati provenienti dal medesimo studio clinico ma con follow-up più breve; tale aspetto risulta importante poiché BV+AVD non ha dimostrato un beneficio statisticamente significativo in termini di OS rispetto ad ABVD fino ai 6 anni di follow-up.
Alcune analisi di costo-efficacia condotte per la valutazione dei trattamenti di prima linea in pazienti con linfoma di Hodgkin avanzato presenti in letteratura hanno considerato un orizzonte temporale più breve (per esempio, Raymakers 2020 (44)) rispetto a quello considerato in questa analisi; considerando la risposta duratura e i tassi di cura osservati per questa malattia, al fine di catturare tutte le differenze in termini di outcome e di costi tra le terapie poste a confronto, per questa analisi è risultato appropriato considerare un orizzonte temporale lifetime.
Inoltre, nonostante nel modello non sia stato possibile per costruzione incorporare i costi associati alla perdita di produttività dovuta alla malattia, dalla letteratura risultano presenti studi che hanno valutato il beneficio di BV in termini di produttività utilizzando i dati provenienti dallo studio clinico ECHELON-1. Uno studio condotto negli Stati Uniti ha stimato come a una quota di pazienti trattata con BV+AVD pari al 27% rispetto al non utilizzo di BV+AVD possa corrispondere una riduzione del numero di morti pari al 14% e una riduzione della perdita di produttività pari al 14% in un orizzonte temporale pari a 10 anni. Le analisi di scenario condotte sempre nell’ambito dello stesso studio hanno mostrato come al 40-80% di pazienti trattati con BV-AVD rispetto al non utilizzo dello stesso possa corrispondere una riduzione del 20-32% della perdita di produttività in 10 anni (47). La perdita di produttività è stata stimata mediante l’approccio del capitale umano mentre i decessi evitati e gli anni di vita risparmiati sono stati calcolati attraverso l’impiego di un modello basato su dati real-world di utilizzo dei trattamenti, dati di OS specifici per ciascun trattamento e l’opinione di esperti clinici.
Come tutti i modelli decisionali pubblicati in letteratura che tentano di fornire una rappresentazione sintetica della realtà, anche l’approccio modellistico impiegato in questa analisi ha delle limitazioni. In particolare, l’efficacia dei trattamenti successivi riflette solo quanto osservato nello studio clinico ECHELON-1. Le valutazioni economiche precedentemente pubblicate hanno cercato di catturare l’efficacia dei trattamenti successivi utilizzando modelli di transizione più complessi con un maggior numero di stati di salute, sfruttando i dati provenienti da altri studi clinici condotti sul linfoma di Hodgkin refrattario. Considerato il numero limitato di pazienti che nello studio ECHELON-1 hanno sperimentato una progressione della malattia è risultato complicato stimare in modo robusto la PPS stratificata per i singoli trattamenti successivi. Inoltre, dal momento che lo studio clinico ECHELON-1 è il primo studio clinico degli ultimi 20 anni ad aver dimostrato un beneficio significativo in termini di OS nel linfoma di Hodgkin rispetto ad ABVD, è risultato fondamentale utilizzare direttamente i dati di PPS/OS provenienti da tale studio piuttosto che cercare di modellare gli esiti post-progressione in modo indipendente utilizzando fonti di dati esterne.
Inoltre, risultano presenti delle limitazioni circa i dati che sono stati impiegati. Ai fini dell’analisi è stata utilizzata la PFS basata sulla valutazione dell’investigatore (INV) poiché le valutazioni basate sulla revisione indipendente (IRF) non sono state raccolte oltre il periodo di trattamento dello studio. Inoltre, i risultati della PFS devono essere interpretati con cautela poiché lo studio non è stato progettato specificamente per misurare la PFS (la mPFS era l’endpoint primario, ma la PFS è stata utilizzata per il follow-up a lungo termine) (48).
Ancora, il modello assume che, dopo 73 mesi trascorsi nello stato di salute “Libero da progressione”, i pazienti possono considerarsi curati. L’assunzione che i pazienti con LH possano essere curati con la terapia di prima linea è supportata sia dai dati di letteratura (23-25), sia dalle curve KM dello studio clinico ECHELON-1 con dati aggiornati a 6 anni.
La mortalità dei pazienti curati è stata valutata pari a circa il doppio di quella della popolazione generale; tale assunzione proviene da uno studio osservazionale condotto sui dati del registro SEER in pazienti con diagnosi di cHL in stadio III/IV trattati con chemioterapia nel periodo 2000-2015 e fa riferimento a tutte le cause di morte (a esclusione del LH) (19).
Inoltre, i valori di qualità della vita dei pazienti curati, in assenza di dati in letteratura, secondo l’opinione di clinici esperti sono stati considerati pari a quelli della popolazione generale. L’impatto delle terapie successive è stato considerato solamente a livello di costi; per le linee successive di trattamento è stata assunta la medesima efficacia indipendentemente dalla terapia di prima linea ricevuta. Tale scelta è stata effettuata al fine di assicurare che i guadagni in termini di sopravvivenza complessiva potessero essere attribuibili alle sole terapie di prima linea.
Ulteriori limiti riguardano la modellizzazione delle curve di KM. In particolare, le probabilità di transizione dallo stato di salute “In progressione” allo stato “Morte” (Post-Progression Survival, PPS) sono state stimate assumendo una distribuzione esponenziale; la scelta della distribuzione esponenziale è stata effettuata al fine di riflettere l’assenza di memoria alla base del modello di Markov, la quale richiede l’impiego di probabilità di transizione costanti nel tempo. La modellizzazione lifetime delle curve di KM di Time To Progression (TTP) (PFS with pre-progression deaths censored) provenienti dallo studio clinico ECHELON-1 è stata effettuata sulla base dell’ultimo valore osservato sulla curva KM, che si assume si applichi a tempo indeterminato; tale scelta è stata effettuata in quanto le curve di KM TTP hanno mostrato un plateau esteso (che, come discusso, è indicativo di guarigione).
La modellizzazione lifetime delle curve di KM di Time To Death (TTD) (PFS with disease progressions censored) provenienti dallo studio clinico ECHELON-1 oltre che dagli ultimi dati osservati è stata effettuata utilizzando i dati di sopravvivenza della popolazione generale aggiustati per tenere conto del rischio di mortalità in eccesso per i pazienti trattati per tumore; tale scelta è stata effettuata a causa del numero limitato di eventi di morte osservati senza progressione, che rendeva difficile effettuare adattamenti mediante modelli parametrici.
Infine, le stime di incidenza degli eventi avversi associati ai trattamenti, per i pazienti in stadio IV, sono state assunte pari a quelle osservate per la popolazione ITT all’interno dello studio clinico a causa della mancanza di dati pubblicati per la popolazione in stadio IV.
Il modello fornisce delle stime ragionevoli di OS tra i vari scenari; la sopravvivenza a 10 anni generata per il braccio ABVD nel caso base è dell’85,4%; tale stima rientra tra le stime di sopravvivenza a 10 anni osservate per i pazienti nel registro SEER con malattia regionale e distante alla diagnosi rispettivamente pari al 90,3% e al 74,7% (47).
Conclusioni
Questo studio ha utilizzato quanto dimostrato nello studio ECHELON-1 circa il miglioramento dell’OS e della PFS per BV+AVD rispetto ad ABVD per il trattamento di prima linea del linfoma di Hodgkin in stadio IV al fine di estrapolare LYs, QALYs e costi secondo un orizzonte temporale lifetime considerando la prospettiva del Servizio Sanitario Nazionale italiano. Sulla base di questa valutazione economica, BV+AVD si stima sia un’opzione costo-efficace rispetto ad ABVD in Italia, specialmente considerando la potenziale variabilità dei prezzi delle terapie ad alto costo.
Disclosures
Conflict of interest: AM, CB and FSM, declare that they have no conflicts of interest. VFP and ALM employment and stock ownership (Takeda). SK and SL are employees of Evidera. SR, LF and PM are employees of Takeda Italia S.p.A.
Financial support: This study was initiated and funded by Takeda Italia S.p.A.
Authors/Contributors role: AM, CB and FSM: Conceptualization, Data curation, Investigation, Writing – Original Draft. SR and LF: Conceptualization, Funding acquisition, Writing – Review & Editing. VFP, ALM and PM: Methodology, Resources, Validation, Writing – Review & Editing. SK and SL: Methodology, Formal analysis, Validation, Writing – Review & Editing.
Data availability statement: Not applicable.
Bibliografia
- 1. Smith A, Crouch S, Lax S, et al. Lymphoma incidence, survival and prevalence 2004-2014: sub-type analyses from the UK’s Haematological Malignancy Research Network. Br J Cancer. 2015;112(9):1575-1584. CrossRef PubMed
- 2. Hanly P, Soerjomataram I, Sharp L. Measuring the societal burden of cancer: the cost of lost productivity due to premature cancer-related mortality in Europe. Int J Cancer. 2015;136(4):E136-E145. CrossRef PubMed
- 3. HMRN. R. HMRN incidence – Classical Hodgkin lymphoma. 2022; Online. (Accessed June 2024)
- 4. AIOM. I numeri del cancro in Italia 2023. Online. (Accessed June 2024)
- 5. International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med. 1993;329(14):987-994. CrossRef PubMed
- 6. Koshy M, Fairchild A, Son CH, Mahmood U. Improved survival time trends in Hodgkin’s lymphoma. Cancer Med. 2016;5(6):997-1003. CrossRef PubMed
- 7. Behringer K, Mueller H, Goergen H, et al. Gonadal function and fertility in survivors after Hodgkin lymphoma treatment within the German Hodgkin Study Group HD13 to HD15 trials. J Clin Oncol. 2013;31(2):231-239. CrossRef PubMed
- 8. Ansell SM, Radford J, Connors JM, et al; ECHELON-1 Study Group. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2022;387(4):310-320. CrossRef PubMed
- 9. European Medicines Agency. EPAR, ADCETRIS. Online. (Accessed June 2024)
- 10. ISTAT. Tavola di mortalità. Anno 2022. Online. (Accessed June 2024)
- 11. Latimer NR. Survival analysis for economic evaluations alongside clinical trials--extrapolation with patient-level data: inconsistencies, limitations, and a practical guide. Med Decis Making. 2013;33(6):743-754. CrossRef PubMed
- 12. Capri S, Ceci A, Terranova L, Merlo F, Mantovani L. Guidelines for economic evalu-ations in Italy: recommendations from the Italian Group of phar-macoeconomic studies. Drug Inf J. 2001;35(1):189-201. CrossRef
- 13. Associazione Italiana di Economia Sanitaria (AIES). Proposta di lineeguida per la valutazione economica degli interventi sanitari. Politiche Sanitarie. 2009;10:91-99.
- 14. AIFA. Linee guida per la compilazione del Dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale ai sensi del D.M. 2 agosto 2019. Online. (Accessed June 2024)
- 15. Blank O, von Tresckow B, Monsef I, Specht L, Engert A, Skoetz N. Chemotherapy alone versus chemotherapy plus radiotherapy for adults with early stage Hodgkin lymphoma. Cochrane Database Syst Rev. 2017;4(4):CD007110. CrossRef PubMed
- 16. Allen PB, Gordon LI. Frontline Therapy for Classical Hodgkin Lymphoma by Stage and Prognostic Factors. Clin Med Insights Oncol. 2017;11:1179554917731072. CrossRef PubMed
- 17. Chen R, Gopal AK, Smith SE, et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2016;128(12):1562-1566. CrossRef PubMed
- 18. Straus DJ, Długosz-Danecka M, Connors JM, et al. Brentuximab vedotin with chemotherapy for stage III or IV classical Hodgkin lymphoma (ECHELON-1): 5-year update of an international, open-label, randomised, phase 3 trial. Lancet Haematol. 2021;8(6):e410-e421. CrossRef PubMed
- 19. Dores GM, Curtis RE, Dalal NH, Linet MS, Morton LM. Cause-Specific Mortality Following Initial Chemotherapy in a Population-Based Cohort of Patients With Classical Hodgkin Lymphoma, 2000-2016. J Clin Oncol. 2020;38(35):4149-4162. CrossRef PubMed
- 20. Scalone L, Cortesi PA, Ciampichini R, Cesana G, Mantovani LG. Health Related Quality of Life norm data of the Italian general population: results using the EQ-5D-3L and EQ-5D-5L instruments. Epidemiol Biostat Public Health. 2022;12(3). CrossRef
- 21. Connors JM, Jurczak W, Straus DJ, et al; ECHELON-1 Study Group. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2018;378(4):331-344. CrossRef PubMed
- 22. Decreto del Ministero della Salute 18 ottobre 2012. Tariffe delle prestazioni di assistenza specialistica ambulatoriale. Online (Accessed June 2024)
- 23. Eichenauer DA, Aleman BMP, André M, et al; ESMO Guidelines Committee. Hodgkin lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018;29(suppl 4):iv19-iv29. CrossRef PubMed
- 24. Berger MJ, Ettinger DS, Aston J, et al. NCCN Guidelines Insights: Antiemesis, Version 2.2017. J Natl Compr Canc Netw. 2017;15(7):883-893. CrossRef PubMed
- 25. AIOM. Linee guida terapia antiemetica. Edizione; 2018. Online. (Accessed June 2024)
- 26. AIFA. RCP ACICLOVIR. Online. (Accessed June 2024)
- 27. Petrosillo N. Therapy and prophylaxis of bacterial infections of the onco-haematological patient. Trends Med. 2011;11(4):179-184. Online. (Accessed June 2024)
- 28. AIOM. Linee guida gestione della tossicità ematopoietica in oncologia. Edizione 2018. Online. (Accessed June 2024)
- 29. AIOM. Terapia del dolore in oncologia. Edizione 2019. Online. (Accessed June 2024)
- 30. Decreto del Ministero della Salute 18 ottobre 2012. Tariffe delle prestazioni di assistenza ospedaliera per acuti, per tipo di ricovero. Online. (Accessed June 2024)
- 31. Ministero della Salute. Rapporto annuale sull’attività di ricovero ospedaliero. DATI SDO 2020. Online. (Accessed June 2024)
- 32. Gisselbrecht C, Glass B, Mounier N, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol. 2010;28(27):4184-4190. CrossRef PubMed
- 33. Armand P, Engert A, Younes A, et al. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol. 2018;36(14):1428-1439. CrossRef PubMed
- 34. Kuruvilla J, Ramchandren R, Santoro A, et al; KEYNOTE-204 investigators. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021;22(4):512-524. CrossRef PubMed
- 35. Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol. 2012;30(18):2183-2189. CrossRef PubMed
- 36. Moskowitz AJ, Hamlin PA Jr, Perales MA, et al. Phase II study of bendamustine in relapsed and refractory Hodgkin lymphoma. J Clin Oncol. 2013;31(4):456-460. CrossRef PubMed
- 37. Santoro A, Magagnoli M, Spina M, et al. Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin’s lymphoma. Haematologica. 2007;92(1):35-41. CrossRef PubMed
- 38. Crump M, Kuruvilla J, Couban S, et al. Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. J Clin Oncol. 2014;32(31):3490-3496. CrossRef PubMed
- 39. Russo P, Zanuzzi M, Carletto A, Sammarco A, Romano F, Manca A. Role of Economic Evaluations on Pricing of Medicines Reimbursed by the Italian National Health Service. PharmacoEconomics. 2023;41(1):107-117. CrossRef PubMed
- 40. Lazzaro C, Barone C, Caprioni F, et al. An Italian cost-effectiveness analysis of paclitaxel albumin (nab-paclitaxel) + gemcitabine vs gemcitabine alone for metastatic pancreatic cancer patients: the APICE study. Expert Rev Pharmacoecon Outcomes Res. 2018;18(4):435-446. CrossRef PubMed
- 41. Pradelli L, Bellone M, Sanchez Alvarez J, Leibfried M, Caputo A. POSB108 Cost-Effectiveness and Cost-Utility Analyses of Atezolizumab-Based Therapy in Patients with Advanced or Unresectable Hepatocellular Carcinoma in Italy. Value Health. 2022;25(1):S82. CrossRef
- 42. Russo P. How reliable are ICER’s results published in current pharmacoeconomic literature? The controversial issue of price confidentiality. Glob Reg Health Technol Assess. 2022;9:31-35. CrossRef PubMed
- 43. Huntington SF, von Keudell G, Davidoff AJ, Gross CP, Prasad SA. Cost-Effectiveness Analysis of Brentuximab Vedotin With Chemotherapy in Newly Diagnosed Stage III and IV Hodgkin Lymphoma. J Clin Oncol. 2018;36(33):JCO1800122. CrossRef PubMed
- 44. Raymakers AJN, Costa S, Cameron D, Regier DA. Cost-effectiveness of brentuximab vedotin in advanced stage Hodgkin’s lymphoma: a probabilistic analysis. BMC Cancer. 2020;20(1):992. CrossRef PubMed
- 45. Delea TE, Sharma A, Grossman A, et al. Cost-effectiveness of brentuximab vedotin plus chemotherapy as frontline treatment of stage III or IV classical Hodgkin lymphoma. J Med Econ. 2019;22(2):117-130. CrossRef PubMed
- 46. Vijenthira A, Chan K, Cheung MC, Prica A. Cost-effectiveness of first-line treatment options for patients with advanced-stage Hodgkin lymphoma: a modelling study. Lancet Haematol. 2020;7(2):e146-e156. CrossRef PubMed
- 47. National Cancer Institute. Hodgkin Lymphoma, SEER Survival Rates by Time Since Diagnosis, 2000-2018, By Stage at Diagnosis. 2018; Online. (Accessed June 2024)
- 48. Pan-Canadian Oncology Drug Review. pCODR Expert Review Committee (pERC). Brentuximab vedotin (BV) in combination with doxorubicin, vinblastine, and dacarbazine (AVD) for the treatment of previously untreated patients with stage IV Hodgkin lymphoma (HL). Final Recommendation. Online. (Accessed June 2024)