 |
Glob Reg Health Technol Assess 2024; 11: 38-50 ISSN 2283-5733 | DOI: 10.33393/grhta.2024.2728 ORIGINAL RESEARCH ARTICLE |
 |
Costo per NNT di upadacitinib nel trattamento dei pazienti con dermatite atopica da moderata a severa in Italia
Cost per NNT for upadacitinib in the treatment of patients with moderate-severe atopic dermatitis in Italy
Background: Targeted systemic therapies, including abrocitinib, baricitinib, dupilumab, tralokinumab and upadacitinib, are new treatments for moderate to severe atopic dermatitis (AD). We evaluated the efficacy and the costs of these targeted systemic therapies in the treatment of adult patients with moderate to severe AD.
Methods: The clinical efficacy was assessed considering the results of a previous network meta-analysis (NMA). The analysis involved five therapies approved in Italy for the treatment of moderate to severe AD: abrocitinib (ABR), baricitinib (BAR), dupilumab (DUP), tralokinumab (TRA) and upadacitinib (UPA). According to the NMA, the cost of the treatment was based on the number of administrations dispensed at 16 weeks and the clinical efficacy was measured by the number needed to treat (NNT) compared to placebo using the improvement ≥ 75% (EASI-75) or ≥ 90 (EASI-90) from baseline of the eczema area and severity index (EASI). Only the ex-factory price of the targeted systemic therapies was considered. The cost per NNT was adopted as a cost-effectiveness indicator.
Results: At 16 weeks, the cost per NNT based on EASI-75 was lower for UPA 15 mg (€ 6,384.00) compared to BAR 4 mg (€ 11,619.73) and 2 mg (€ 14,524.66), ABR 100 mg (€ 16,265.22), DUP 300 mg (€ 16,115.04) and TRA 300 mg (€ 31,710.24). UPA 15 (€ 8,512.00) also showed the lower cost per NNT based on EASI-90 at 16 weeks compared to BAR 4 mg (€ 14,788.75) and 2 mg (€ 20,862.70), ABR 100 mg (€ 25,922.69), DUP 300 mg (€ 25,992.00) and TRA 300 mg (€ 41,067.36).
Conclusions: The findings show that upadacitinib is the most cost-effective option (cost per NNT) for the treatment of moderate to severe atopic dermatitis.
Keywords: Atopic dermatitis, Cost per NNT, EASI-75, EASI-90, Italian NHS, Upadacitinib
Received: November 17, 2023
Accepted: January 21, 2024
Published online: February 16, 2024
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La dermatite atopica (Atopic Dermatitis, AD) è una malattia infiammatoria cronica della pelle, altamente debilitante, con una fisiopatologia complessa e una presentazione clinica eterogenea (1). I pazienti con AD da moderata a severa manifestano lesioni eczematose ricorrenti, prurito, dolore e disturbi del sonno. Inoltre, sono soggetti a un maggiore rischio di comorbilità e spesso riportano una diminuzione dell’autostima, prestazioni scadenti a scuola o sul luogo di lavoro e, in generale, una riduzione della qualità di vita rispetto alla popolazione generale (2,3).
La AD è una malattia a elevata prevalenza. Secondo una recente revisione della letteratura, nei bambini la prevalenza dei sintomi della AD varia tra l’1,7% e il 32,8%, mentre negli adulti varia tra l’1,2% e il 9,7% (4). In questi ultimi la AD può persistere dall’infanzia oppure può iniziare o ripresentarsi (5,6). In Italia non esistono stime precise sulla prevalenza della AD; uno studio multicentrico, condotto nel 2018 attraverso la somministrazione di una survey web-based, ha stimato una prevalenza dell’8,1% della AD nella popolazione adulta (7).
Con l’obiettivo di identificare il migliore approccio terapeutico, una volta effettuata la diagnosi di AD, ne viene successivamente valutata la severità. Per fare ciò vengono utilizzati differenti score; quello maggiormente utilizzato è l’Eczema Area and Severity Index (EASI) (8). Sulla base dell’utilizzo di questo score la AD viene definita da moderata a severa con un punteggio EASI ≥ 16 oppure con un punteggio EASI < 16, ma in presenza di almeno una delle seguenti condizioni: i) localizzazione della malattia al volto, alle mani o ai genitali; ii) prurito con punteggio su scala numerica (NRS) > 7; iii) sonno disturbato con punteggio NRS > 7; iv) compromissione della qualità della vita, valutata con il questionario Dermatology Life Quality Index (DLQI) (8).
La principale finalità delle terapie farmacologiche somministrate per il trattamento della AD è il controllo della sintomatologia e dell’infiammazione cutanea. Come accennato, la scelta del corretto trattamento deve essere fatta in funzione della severità della malattia. Nella maggior parte dei casi di malattia moderata o severa, le terapie topiche, fornendo un miglioramento temporaneo, devono essere integrate o sostituite da altri trattamenti che riducono l’infiammazione, quali fototerapia, farmaci immunomodulatori sistemici o farmaci modificanti la malattia (Disease Modifying Therapy, DMT) (9). La terapia sistemica, come corticosteroidi e ciclosporina, è indicata in pazienti che non sono adeguatamente controllati e/o che non tollerano il trattamento topico (10). Sempre nei soggetti che non rispondono alla terapia topica convenzionale, in alternativa alla ciclosporina viene raccomandata la somministrazione di metotrexato, micofenolato mofetile e azatioprina (10). Sebbene queste terapie immunosoppressive siano efficaci, possono però causare sia nel breve che nel lungo periodo eventi avversi (EA) e una progressiva perdita della risposta (10,11).
La mancanza di trattamenti in grado di garantire sia nel breve che nel lungo periodo il mantenimento della risposta clinica in assenza di eventi avversi (EA) ha portato allo sviluppo di nuove molecole (12). Negli ultimi anni in Italia sono stati rimborsati diversi farmaci per il trattamento della dermatite atopica da moderata a severa vale a dire abrocitinib (ABR) (13), baricitinib (BAR) (14), dupilumab (DUP) (15,16), tralokinumab (TRA) (17) e upadacitinib (UPA) (18).
Abrocitinib è un inibitore della Janus chinasi (JAK) 1. Le JAK sono enzimi che trasducono segnali intracellulari dai recettori sulla superficie cellulare per una serie di citochine e di fattori di crescita coinvolti nell’ematopoiesi, nell’infiammazione e nella funzione immunitaria. Le JAK fosforilano e attivano trasduttori di segnale e attivatori della trascrizione (STAT) che inducono l’espressione genica all’interno della cellula (19). L’efficacia e la sicurezza di abrocitinib in monoterapia e in associazione con terapie topiche sono state valutate in 3 studi cardine di fase III randomizzati, in doppio cieco, controllati con placebo (MONO-1, MONO-2 e COMPARE) (20-22).
Baricitinib è un inibitore selettivo e reversibile di JAK1 e JAK2 (23), le cui efficacia e sicurezza in monoterapia o in combinazione con corticosteroidi topici (CST) sono state valutate in tre studi di fase III randomizzati, in doppio cieco, controllati con placebo, di 16 settimane (BREEZE-AD1, -AD2, -AD5 e -AD7) (24-26).
Dupilumab è un anticorpo IgG4 monoclonale completamente umano che si lega alla subunità alfa condivisa del recettore dell’interleuchina 4 e che quindi inibisce la trasduzione del segnale di IL-4 e IL-13 (27). L’efficacia e la sicurezza di dupilumab come monoterapia e in combinazione con corticosteroidi topici sono state valutate in tre studi clinici registrativi, randomizzati, in doppio cieco e controllati con placebo (SOLO 1, SOLO 2 e CHRONOS) (28,29).
Tralokinumab è un anticorpo monoclonale IgG4 completamente umano che si lega specificamente alla citochina interleuchina 13 (IL-13) di tipo 2 e ne inibisce l’interazione con i rispettivi recettori (30). Tralokinumab neutralizza l’attività biologica dell’IL-13 bloccandone l’interazione con il complesso di recettori IL-13Rα1/IL-4Rα (30). L’efficacia e la sicurezza di tralokinumab in monoterapia e con corticosteroidi topici concomitanti sono state valutate in tre studi cardine randomizzati, in doppio cieco, controllati con placebo (ECZTRA 1, ECZTRA 2 ed ECZTRA 3) (31,32).
Upadacitinib, infine, è un inibitore selettivo e reversibile delle JAK, in grado di inibire preferenzialmente la segnalazione da parte di JAK1 o JAK1/3 (33). L’efficacia e la sicurezza di upadacitinib sono state valutate in tre studi multicentrici di fase III randomizzati, in doppio cieco (Measure Up 1, Measure Up 2 e AD Up) (34,35).
Obiettivo
La disponibilità sul mercato di farmaci con efficacia e costi variabili per la stessa indicazione terapeutica determina per i pagatori il bisogno di disporre di analisi che confrontino per ogni opzione vantaggi clinici e costi associati. In quest’ottica, l’obiettivo della presente analisi è stato quello di stimare, sulla base dei risultati clinici della Network Meta-Analysis (NMA) condotta da Silverberg et al. (36), il costo per Number Needed to Treat (NNT) di abrocitinib, baricitinib, dupilumab, tralokinumab e upadacitinib nel trattamento della dermatite atopica da moderata a severa nei pazienti adulti candidabili alla terapia sistemica.
Metodi
Premessa
L’analisi del costo per NNT è stata condotta considerando la prospettiva del Servizio Sanitario Nazionale (SSN). Il costo totale del trattamento farmacologico è stato calcolato in riferimento a un orizzonte temporale di 16 settimane. L’efficacia dei trattamenti farmacologici, su cui si basa il calcolo del costo per NNT, è stata valutata considerando gli endpoint clinici EASI-75 (miglioramento ≥ 75% rispetto al punteggio al basale) ed EASI-90 (miglioramento ≥ 90% rispetto al punteggio al basale).
Nella valutazione economica non è stato incluso alcun costo per la gestione degli eventi avversi gravi correlati ai trattamenti somministrati, poiché la NMA non ha fornito alcun dato in merito (36).
Sebbene i farmaci siano caratterizzati da differenti vie di somministrazione, orale nel caso di ABR, BAR e UPA e sottocutanea per DUP e TRA, in via conservativa, si è assunto che in entrambi i casi il trattamento venga autosomministrato dal paziente o somministrato dal caregiver (familiare), senza determinare alcun costo a carico del SSN.
Dati clinici
Gli endpoint clinici EASI-75 ed EASI-90 utilizzati nel calcolo del costo per NNT riflettono i risultati della NMA condotta da Silverberg et al. (36), che ha valutato l’efficacia comparativa delle terapie sistemiche senza l’aggiunta di corticosteroidi topici (TCS) e/o di inibitori topici della calcineurina (TCI) nel trattamento degli adulti con AD da moderata a severa (36). Gli esiti sono stati valutati al timepoint primario di ogni studio considerato nella NMA (dodicesima settimana per abrocitinib e sedicesima settimana per tutte le altre terapie), nonché alla quarta e all’ottava settimana come timepoint secondari (36).
La Tabella 1 presenta i risultati della NMA per il timepoint primario (16 settimane) distinguendo tra EASI-75 ed EASI-90 (36). Per ciascuno dei due endpoint clinici vengono indicati il numero di pazienti considerati nella NMA, l’odds ratio (OR) rispetto al placebo, il NNT (calcolato rispetto al placebo), il tasso di risposta per l’endpoint clinico e l’indice dell’analisi dell’area sotto la curva del ranking cumulativo (surface under the cumulative ranking curve, SUCRA) (36). Quest’ultimo corrisponde a una presentazione numerica di un ranking generale, in cui a ciascun trattamento viene associato un valore compreso tra lo 0% e il 100% (37). Quanto più alto è il valore SUCRA e quanto più si avvicina al 100% tanto maggiore è la probabilità che un trattamento si trovi nella prima posizione o in una delle prime posizioni (37). Viceversa, quanto più vicino a 0 è il valore SUCRA tanto più probabile è che un trattamento si trovi nell’ultima posizione o in una delle ultime posizioni (37).
Considerando entrambi gli endpoint clinici, rispetto alle altre molecole, UPA 15 mg somministrato una volta al giorno (QD) determina la maggiore efficacia espressa in termini di OR versus placebo, di NNT versus placebo, di tasso di risposta per esito clinico e di punteggio SUCRA (Tab. 1) (36).
Popolazione
In accordo con quanto fatto nella NMA di Silverberg et al. (36), nella presente analisi economica è stata considerata una popolazione costituita da soggetti adulti (età ≥ 18 anni) con AD da moderata a severa candidabili alla terapia sistemica.
Orizzonte temporale
Anche in questo caso, in accordo con il timepoint primario considerato nella NMA di Silverberg et al. (36), il costo totale del trattamento farmacologico e il conseguente costo per NNT sono stati calcolati in riferimento a un orizzonte temporale di 16 settimane. Dal momento che i dati clinici considerati nella NMA per ABR sono riferiti a un orizzonte temporale di 12 settimane, si è assunto che tali dati rimangano costanti anche a 16 settimane. Tale assunzione trova giustificazione nel fatto che le valutazioni di efficacia effettuate in momenti precedenti (a 4 e a 8 settimane, timepoint secondari) al timepoint primario non hanno evidenziato differenze tali da non poter assumere che l’efficacia di ABR a 12 settimane rimanga costante anche a 16 settimane (36).
Trattamenti considerati
L’analisi economica è stata condotta considerando abrocitinib (13), baricitinib (14), dupilumab (15), tralokinumab (17) e upadacitinib (18), molecole attualmente tutte rimborsate in Italia per il trattamento di pazienti adulti con diagnosi di AD da moderata a severa candidabili alla terapia sistemica.
Schema di somministrazione
Sulla base di quanto indicato dai corrispondenti riassunti delle caratteristiche di prodotto (RCP) (19,23,27,30,33), la Tabella 2 riporta lo schema posologico, la via di somministrazione e il numero di somministrazioni a 16 settimane di trattamento (timepoint primario) per i farmaci considerati. Per baricitinib, dal momento che sono entrambi rimborsati (14), sono stati considerati due schemi posologici che prevedono la somministrazione di 2 mg QD o di 4 mg QD. Per ciascun trattamento, infine, è stata considerata un’aderenza del 100%.
| Endpoint clinico | Trattamento | N. pazienti | Odds ratio versus placebo | NNT | Tasso di risposta | SUCRA (%) |
|---|---|---|---|---|---|---|
| EASI-75 | Upadacitinib 15 mg | 557 | 10,89 (8,16-14,71) | 2,1 (1,8-2,9) | 58,1% (40,9-73,5%) | 77,9 |
| Dupilumab 300 mg | 457 | 6,05 (4,38-8,44) | 3,1 (2,3-4,9) | 43,5% (27,4-61,0%) | 55,6 | |
| Abrocitinib 100 mg | 314 | 5,93 (3,49-10,72) | 3,2 (2,1-5,9) | 43,0% (24,8-64,0%) | 53,9 | |
| Baricitinib 4 mg | 248 | 4,07 (2,64-6,31) | 4,4 (2,8-8,4) | 34,1% (19,4-52,6%) | 36,4 | |
| Baricitinib 2 mg | 392 | 3,31 (2,27-4,87) | 5,5 (3,4-10,6) | 29,6% (16,8-46,8%) | 23,2 | |
| Tralokinumab 300 mg | 1.196 | 3,02 (2,19-4,24) | 6,1 (3,8-11,4) | 27,8% (15,9-43,9%) | 19,1 | |
| Placebo | 2.214 | 11,3% (6,3-19,2%) | ||||
| EASI-90 | Upadacitinib 15 mg | 557 | 12,84 (8,93-18,85) | 2,8 (1,9-4,6) | 41,4% (24,5-60,8%) | 79,8 |
| Dupilumab 300 mg | 457 | 6,20 (4,19-9,41) | 5,0 (2,9-9,6) | 25,5% (13,4-43,2%) | 50,2 | |
| Abrocitinib 100 mg | 314 | 5,98 (2,84-14,92) | 5,1 (2,3-14,2) | 24,9% (10,7-50,6%) | 46,3 | |
| Baricitinib 4 mg | 248 | 5,50 (3,11-9,94) | 5,6 (2,9-13,0) | 23,2% (11,1-42,8%) | 44,0 | |
| Tralokinumab 300 mg | 1.196 | 3,99 (2,51-6,73) | 7,9 (3,9-18,2) | 18,1% (8,7-34,2%) | 25,0 | |
| Baricitinib 2 mg | 392 | 3,98 (2,40-6,79) | 7,9 (3,9-19,0) | 18,0% (8,6-34,3%) | 23,8 | |
| Placebo | 2.214 | 5,2% (2,7-9,9%) |
Number Needed to Treat
Il costo per NNT è stato calcolato stimando il NNT di ABR, BAR, DUP, TRA e UPA rispetto al placebo lungo un orizzonte temporale di 16 settimane. Il NNT determina il numero di pazienti da trattare per ottenere un beneficio terapeutico (p. es., paziente che raggiunge un target terapeutico). Esso, quindi, definisce il numero di pazienti che è necessario trattare con una delle molecole indicate sopra (gruppo sperimentale) rispetto al placebo (gruppo di controllo) per ottenere un beneficio terapeutico addizionale che nel presente caso corrisponde alla percentuale di pazienti che ottengono un miglioramento clinico (EASI-75 o EASI-90). Il NNT corrisponde al reciproco della riduzione del rischio assoluto (ARR), dove quest’ultima corrisponde alla differenza dell’incidenza dell’evento tra gruppo sperimentale (experimental event rate, EER), intesa come efficacia (EASI-75 o EASI-90) di ABR, BAR, DUP, TRA e UPA, e gruppo di controllo (control event rate, CER), intesa come efficacia (EASI-75 o EASI-90) del gruppo placebo. Quanto più il valore di NNT si avvicina a 1 tanto più l’esito è favorevole.
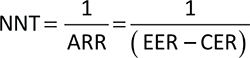
Moltiplicando, infine, tale indicatore (NNT) per il relativo costo medio di trattamento, si ottiene il costo per NNT associato a ciascuno dei farmaci considerati in relazione al timepoint di 16 settimane.
Costo di acquisto dei farmaci
I consumi dei farmaci sono stati valorizzati considerando per ciascuno di essi il rispettivo prezzo ex-factory al netto degli sconti temporanei di legge (38), ma al lordo di eventuali sconti confidenziali o di scontistiche applicate in sede di gara regionale (Tab. 3). La valorizzazione dei consumi di BAR (2 mg e 4 mg) e UPA è stata fatta considerando il prezzo ex-factory al netto di uno solo dei due sconti temporanei di legge (38), poiché le aziende titolari delle AIC (Autorizzazione all’Immissione in Commercio) hanno aderito all’istituto del pay-back 5% relativo alla spesa farmaceutica, che consente alla stessa azienda farmaceutica di chiedere all’AIFA (Agenzia Italiana del Farmaco) la sospensione della riduzione del prezzo del 5% per le specialità medicinali di cui è titolare dietro versamento (pay-back) del relativo controvalore su appositi conti correnti indicati dalle Regioni (39) (Tab. 3).
| Molecola | Posologia | Via di somministrazione | Numero di somministrazioni a 16 settimane |
|---|---|---|---|
| Upadacitinib 15 mg | 15 mg una volta al giorno | Orale | 112 |
| Abrocitinib 100 mg | 100 mg una volta al giorno | Orale | 112 |
| Baricitinib 2 mg | 2 mg una volta al giorno | Orale | 112 |
| Baricitinib 4 mg | 4 mg una volta al giorno | Orale | 112 |
| Dupilumab 300 mg | La dose iniziale raccomandata per i pazienti adulti è di 600 mg (due iniezioni da 300 mg), seguita da una dose di 300 mg somministrata a settimane alterne sotto forma di iniezione sottocutanea | Sottocute | 8 |
| Tralokinumab 300 mg | La dose iniziale raccomandata per i pazienti adulti è di 600 mg (quattro iniezioni da 150 mg), seguita da una dose di 300 mg (due iniezioni da 150 mg) somministrata a settimane alterne sotto forma di iniezione sottocutanea | Sottocute | 8 |
| Trattamento | Confezione | Prezzo
ex-factory lordo |
Prezzo
ex-factory netto* |
Costo per unità* | Costo per mg* | |
|---|---|---|---|---|---|---|
| Abrocitinib 100 mg | 28,0 compresse | 100,0 mg | € 1.408,00 | € 1.270,72 | € 45,38 | € 0,45 |
| Baricitinib 2 mg | 28,0 compresse | 2,0 mg | € 694,96 | € 660,21 | € 23,58 | € 11,79 |
| Baricitinib 4 mg | 28,0 compresse | 4,0 mg | € 694,96 | € 660,21 | € 23,58 | € 5,89 |
| Dupilumab 300 mg | 2,0 siringhe | 300,0 mg | € 1.280,00 | € 1.155,20 | € 577,60 | € 1,93 |
| Tralokinumab 150 mg | 4,0 siringhe | 150,0 mg | € 1.280,00 | € 1.155,20 | € 288,80 | € 1,93 |
| Upadacitinib 15 mg | 28,0 compresse | 15,0 mg | € 800,00 | € 760,00 | € 27,14 | € 1,81 |
*Prezzo Ex-Factory al netto delle sole riduzioni obbligatorie di legge.
Analisi di scenario
Dal momento che il costo di trattamento rappresenta uno dei principali driver del calcolo del costo per NNT, è stata condotta un’analisi di scenario sui prezzi utilizzati nel caso base per valorizzare i consumi dei farmaci. Infatti, quelli considerati nel caso base potrebbero non riflettere i reali prezzi di cessione dei farmaci praticati alle strutture sanitarie. L’analisi di scenario è stata quindi condotta con l’obiettivo di stimare l’impatto sul costo per NNT di alcune ipotesi di sconto sui prezzi di ABR, BAR, DUP, TRA e UPA. È stato quindi ipotizzato che ai farmaci possano essere praticati degli ulteriori sconti compresi tra lo 0% e l’80%, con scaglioni incrementali di 5 punti percentuali. L’analisi di scenario, tramite una serie di tabelle a matrice, mostra tutti i possibili confronti dei valori di costo per NNT a 16 settimane di UPA rispetto agli altri farmaci, per ciascuno dei due endpoint considerati.
Risultati
Costo per NNT: EASI-75
La Figura 1 riporta il costo per NNT a 16 settimane di ABR 100 mg, BAR 2 mg, BAR 4 mg, DUP 300 mg, UPA 15 mg e TRA 300 mg calcolato rispetto all’endpoint clinico EASI-75. Upadacitinib 15 mg determina il minor costo per NNT con un range di differenza che varia da € 5.235,73 rispetto a BAR 4 mg a € 25.326,24 rispetto a TRA 300 mg.
Costo per NNT: EASI-90
La Figura 2 riporta invece il costo per NNT a 16 settimane di ABR 100 mg, BAR 2 mg, BAR 4 mg, DUP 300 mg, UPA 15 mg e TRA 300 mg calcolato rispetto all’endpoint clinico EASI-90. Anche in questo confronto upadacitinib 15 mg determina il minor costo per NNT con un range di differenza che varia da € 6.276,75 rispetto a BAR 4 mg a € 32.555,36 rispetto a TRA 300 mg.
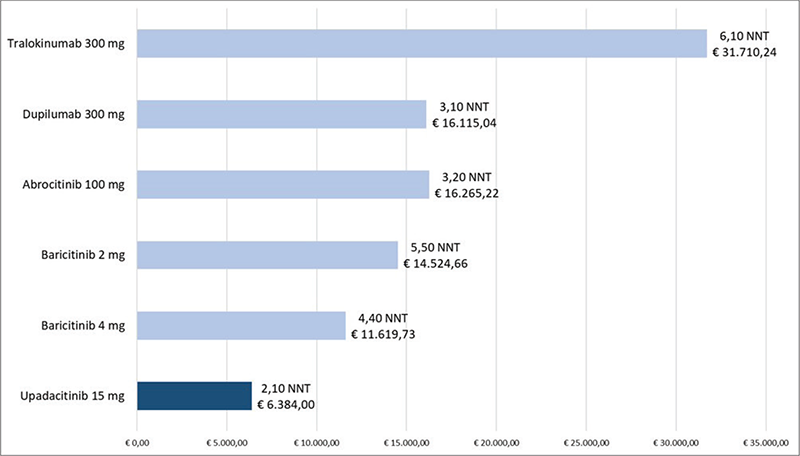
FIGURA 1 - Costo per NNT a 16 settimane: EASI-75.
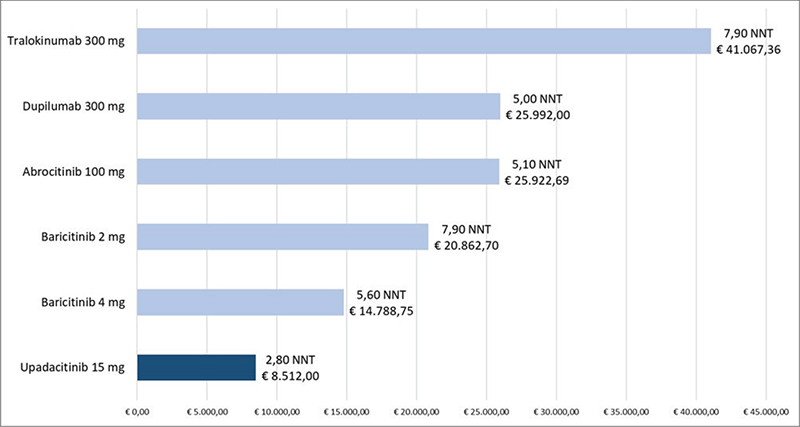
FIGURA 2 - Costo per NNT a 16 settimane: EASI-90.
Analisi di scenario
Le Tabelle 4-8 presentano i risultati dell’analisi di scenario del costo per NNT di UPA 15 mg rispetto agli altri trattamenti considerando come endpoint clinico l’EASI-75 a 16 settimane. Valutando tutte le possibili combinazioni di sconto, la probabilità che UPA 15 mg determini un minor costo per NNT è del 91,0% rispetto ad ABR 100 mg (Tab. 4), dell’88,2% rispetto a BAR 2 mg (Tab. 5), dell’81,3% rispetto a BAR 4 mg (Tab. 6), del 91,0% rispetto a DUP 300 mg (Tab. 7) e del 99,7% rispetto a TRA 300 mg (Tab. 8).
TABELLA 4 - Analisi di scenario: EASI-75 A 16 settimane UPA 15 MG versus ABR 100 MG
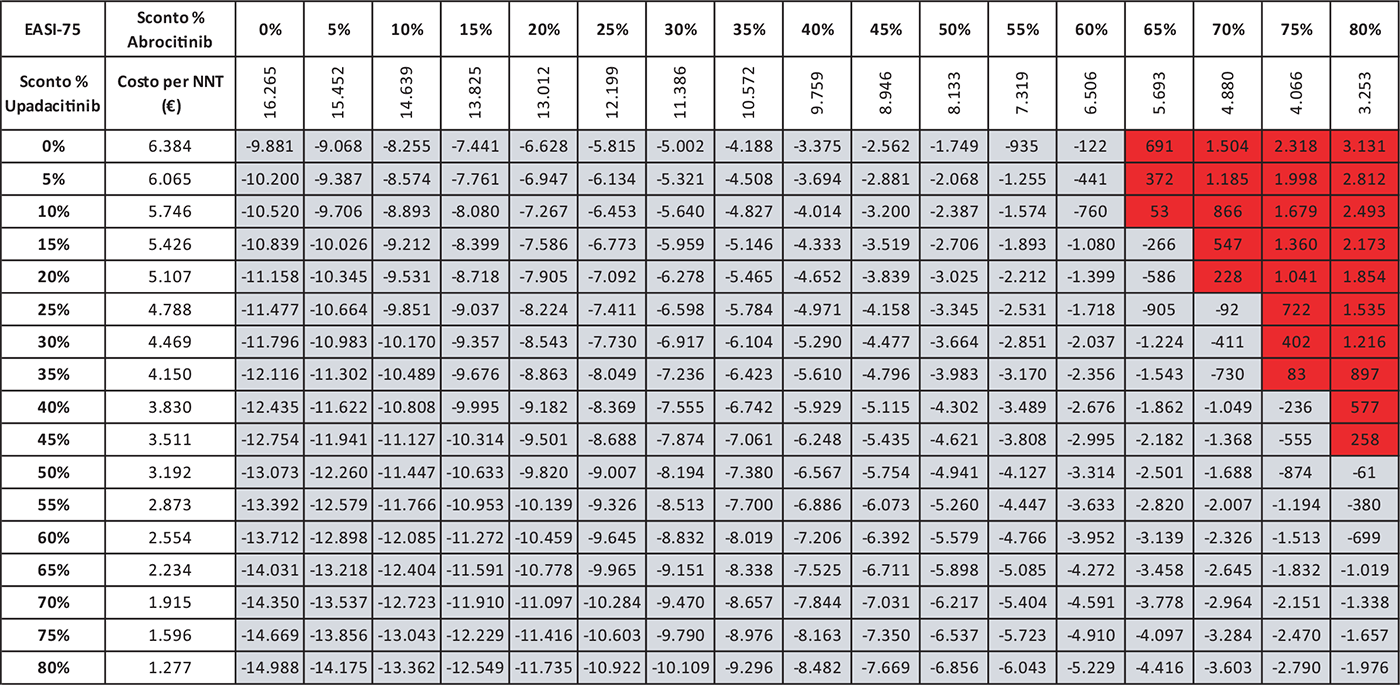
Grigio = costo per NNT UPA 15 mg < costo per NNT ABR 100 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT ABR 100 mg
TABELLA 5 - Analisi di scenario: EASI-75 A 16 settimane UPA 15 MG versus BAR 2 MG
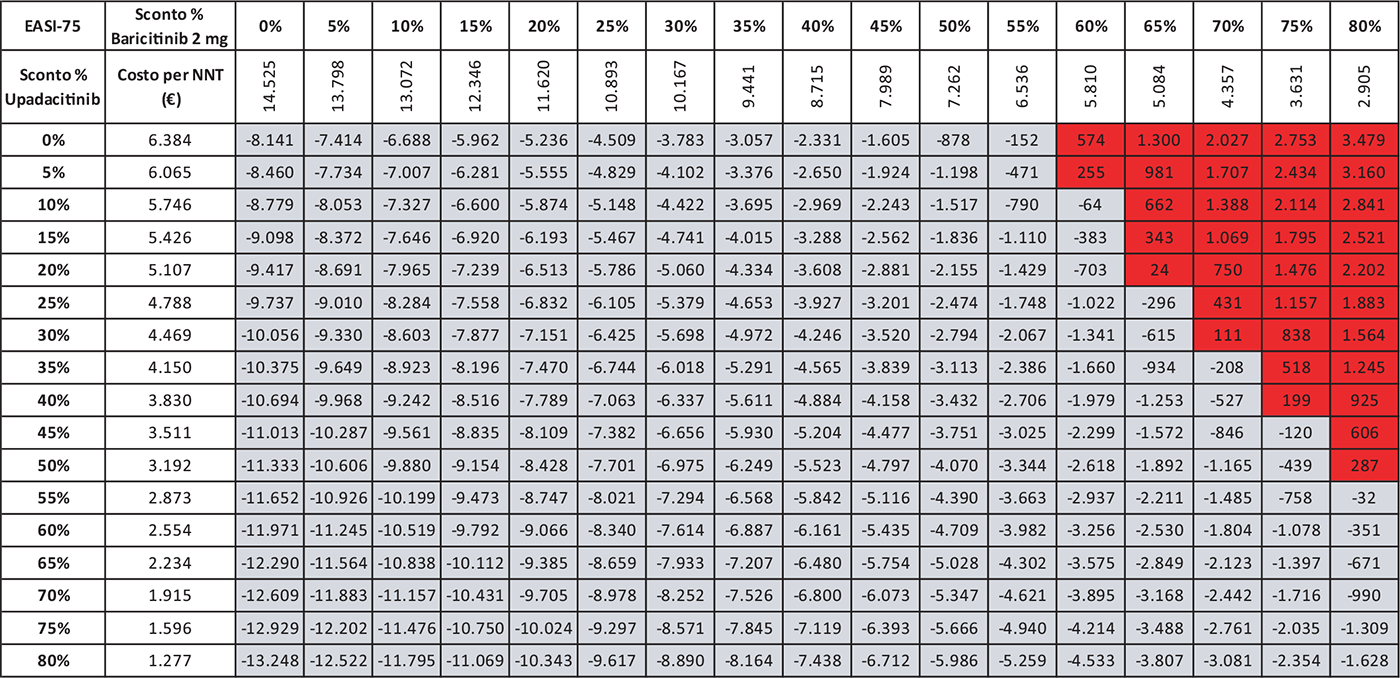
Grigio = costo per NNT UPA 15 mg < costo per NNT BAR 2 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT BAR 2 mg
Le Tabelle 9-13 presentano i risultati dell’analisi di scenario del costo per NNT di UPA 15 mg rispetto ai trattamenti alternativi utilizzando come endpoint clinico l’EASI-90 a 16 settimane. Considerando tutte le possibili combinazioni di sconto, la probabilità che UPA 15 mg determini un minor costo per NNT è del 94,8% rispetto ad ABR 100 mg (Tab. 9), del 90,0% rispetto a BAR 2 mg (Tab. 10), del 79,2% rispetto a BAR 4 mg (Tab. 11), del 94,8% rispetto a DUP 300 mg (Tab. 12) e del 99,7% rispetto a TRA 300 mg (Tab. 13).
TABELLA 6 - Analisi di scenario: EASI-75 A 16 settimane UPA 15 MG versus BAR 4 MG
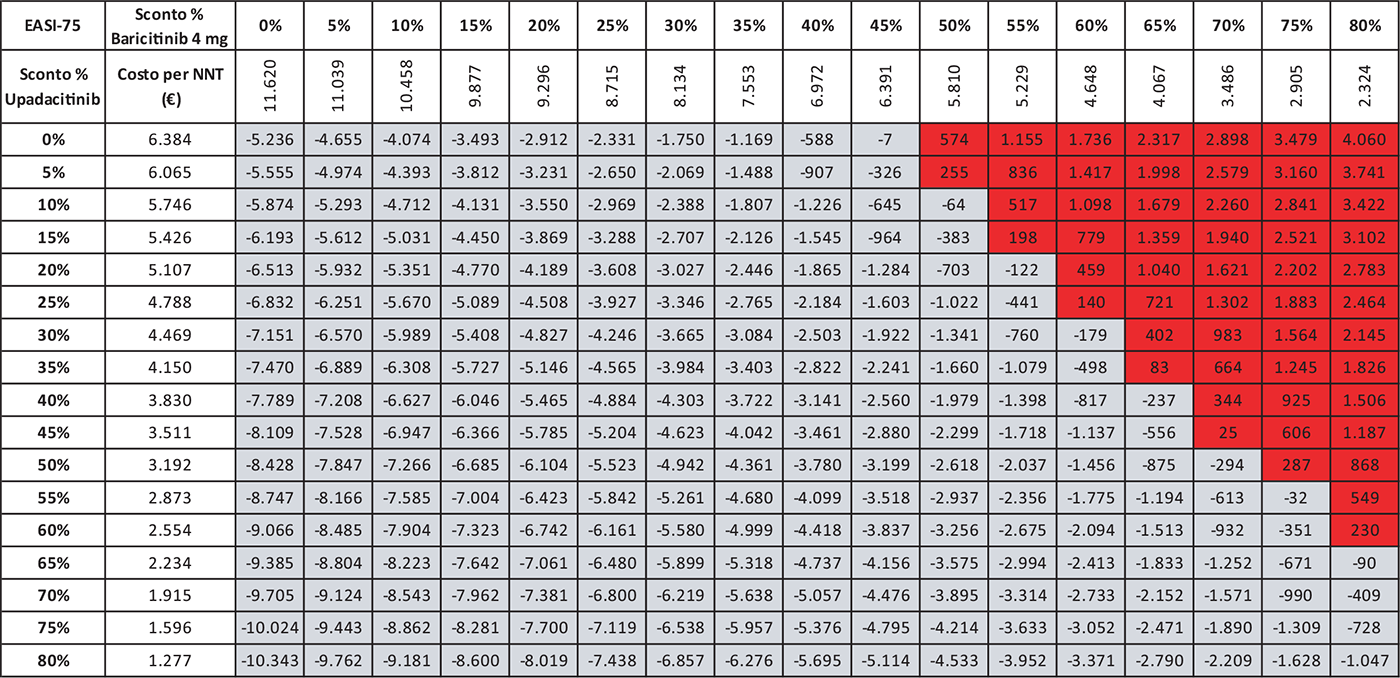
Grigio = costo per NNT UPA 15 mg < costo per NNT BAR 4 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT BAR 4 mg
TABELLA 7 - Analisi di scenario: EASI-75 A 16 settimane UPA 15 MG versus DUP 300 MG
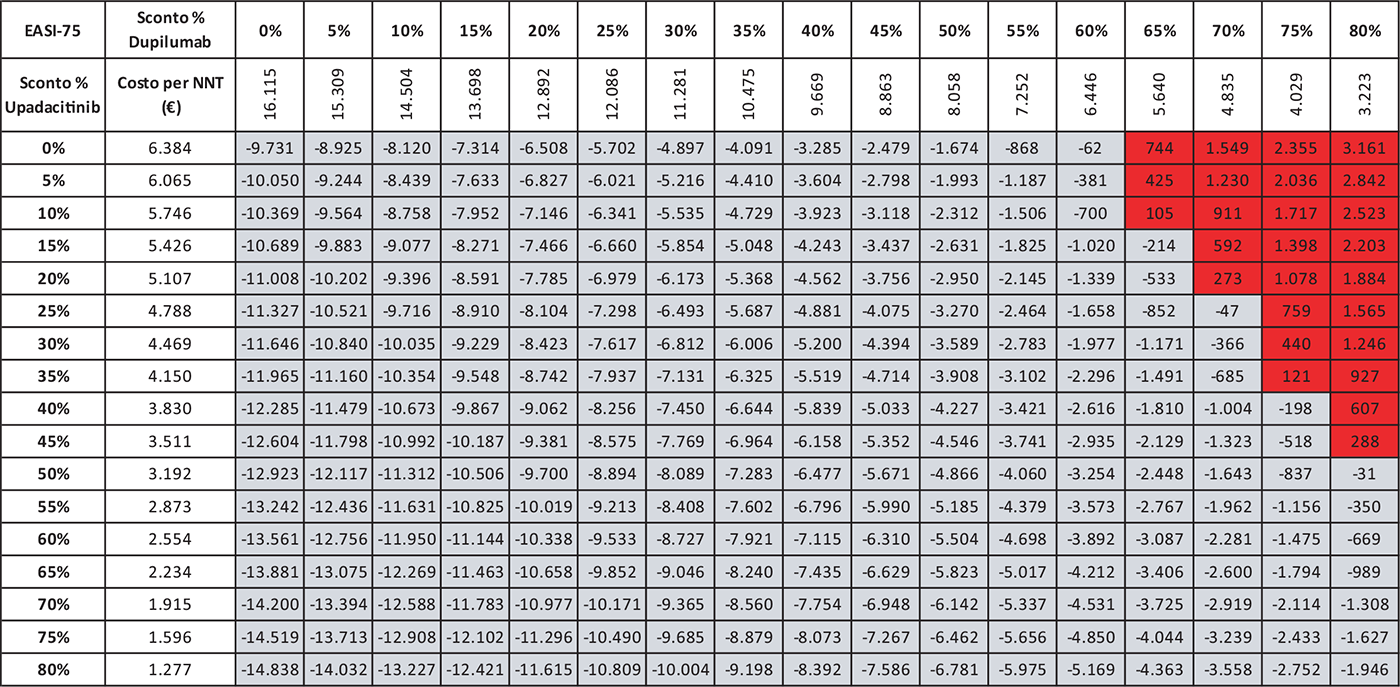
Grigio = costo per NNT UPA 15 mg < costo per NNT DUP 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT DUP 300 mg
TABELLA 8 - Analisi di scenario: EASI-75 A 16 settimane UPA 15 MG versus TRA 300 MG
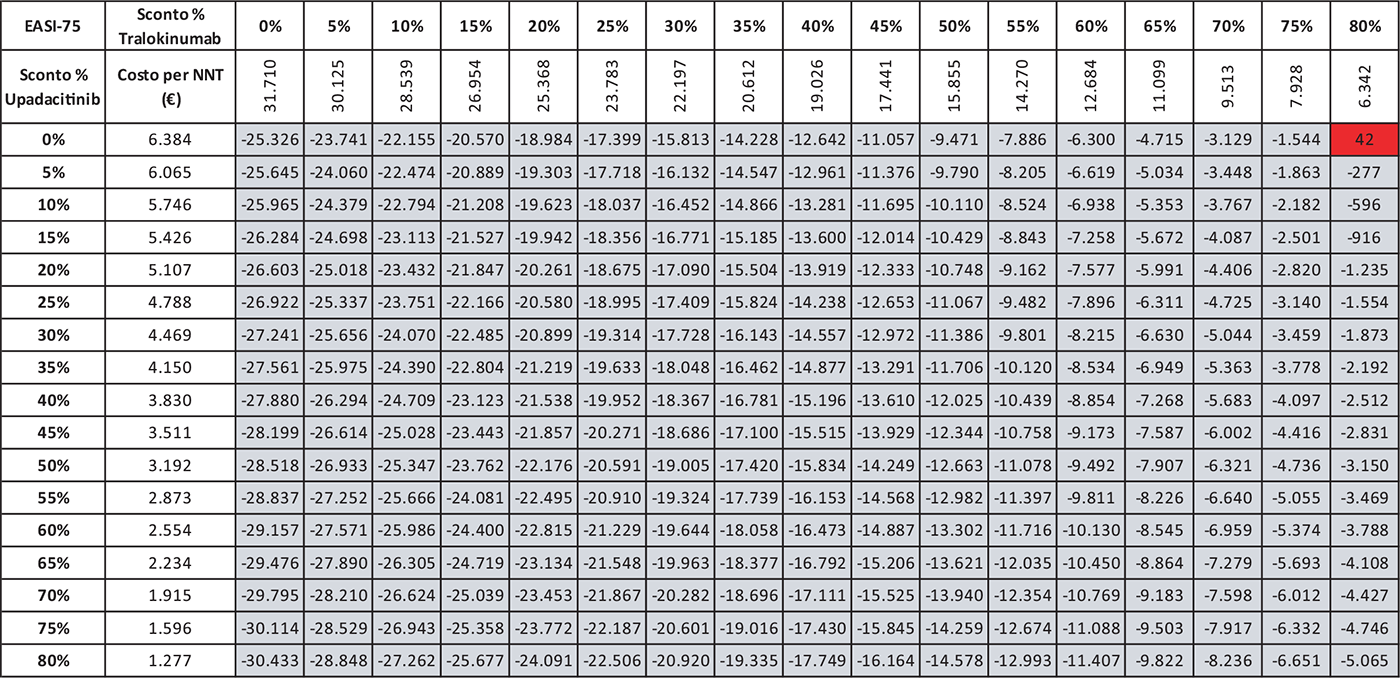
Grigio = costo per NNT UPA 15 mg < costo per NNT TRA 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT TRA 300 mg
TABELLA 9 - Analisi di scenario: EASI-90 A 16 settimane UPA 15 MG versus ABR 100 MG
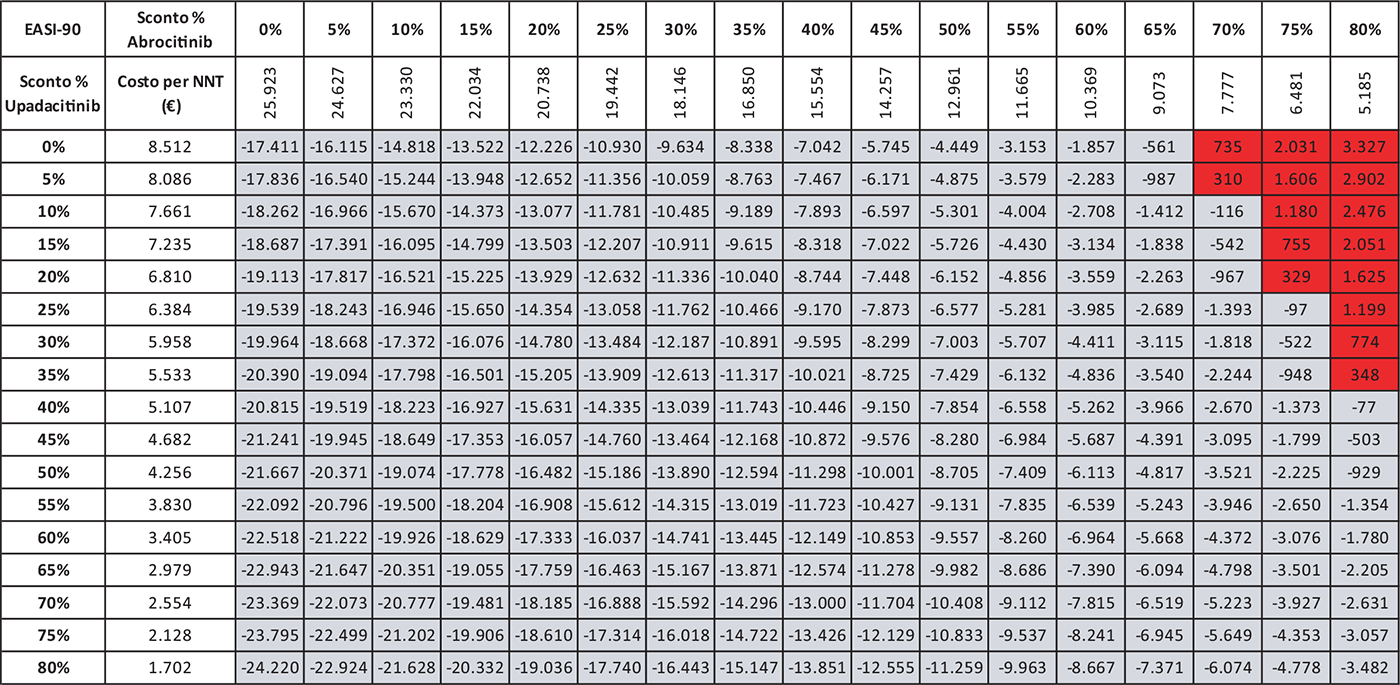
Grigio = costo per NNT UPA 15 mg < costo per NNT ABR 100 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT ABR 100 mg
TABELLA 10 - Analisi di scenario: EASI-90 A 16 settimane UPA 15 MG versus BAR 2 MG
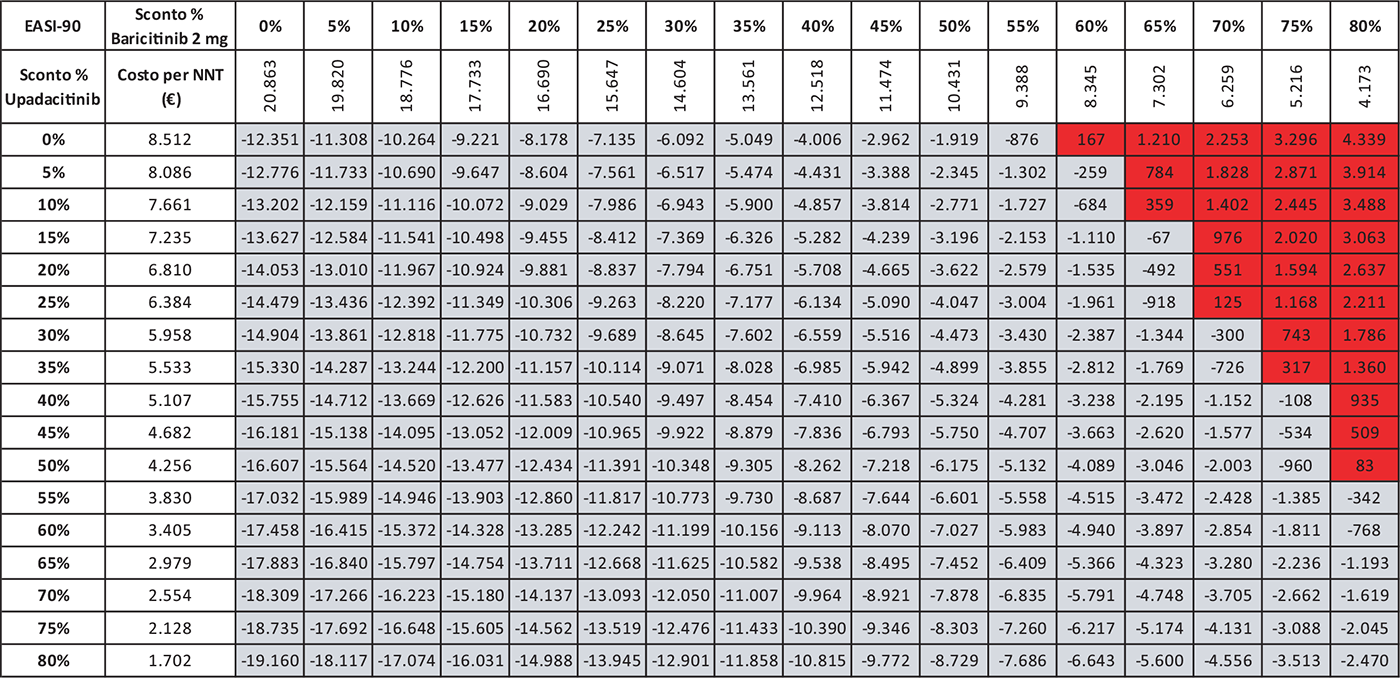
Grigio = costo per NNT UPA 15 mg < costo per NNT BAR 2 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT BAR 2 mg
TABELLA 11 - Analisi di scenario: EASI-90 A 16 settimane UPA 15 MG versus BAR 4 MG
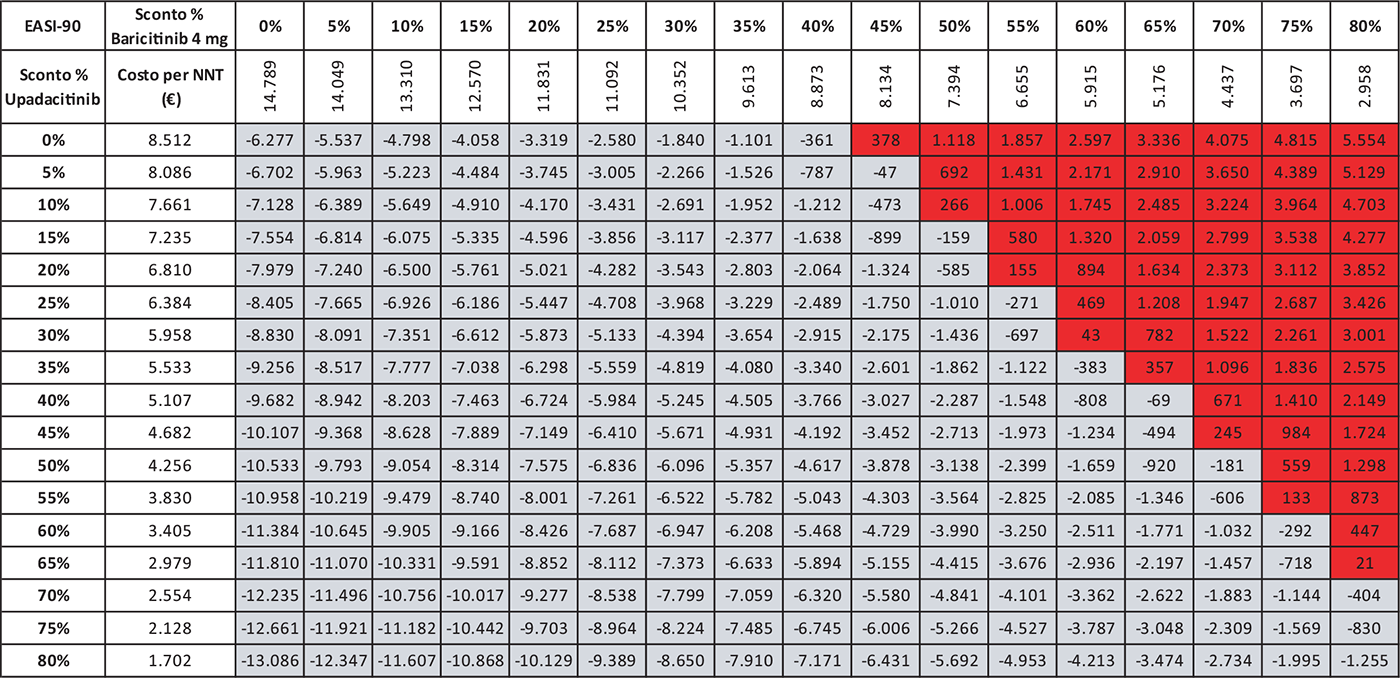
Grigio = costo per NNT UPA 15 mg < costo per NNT BAR 4 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT BAR 4 mg
TABELLA 12 - Analisi di scenario: EASI-90 A 16 settimane UPA 15 MG versus DUP 300 MG
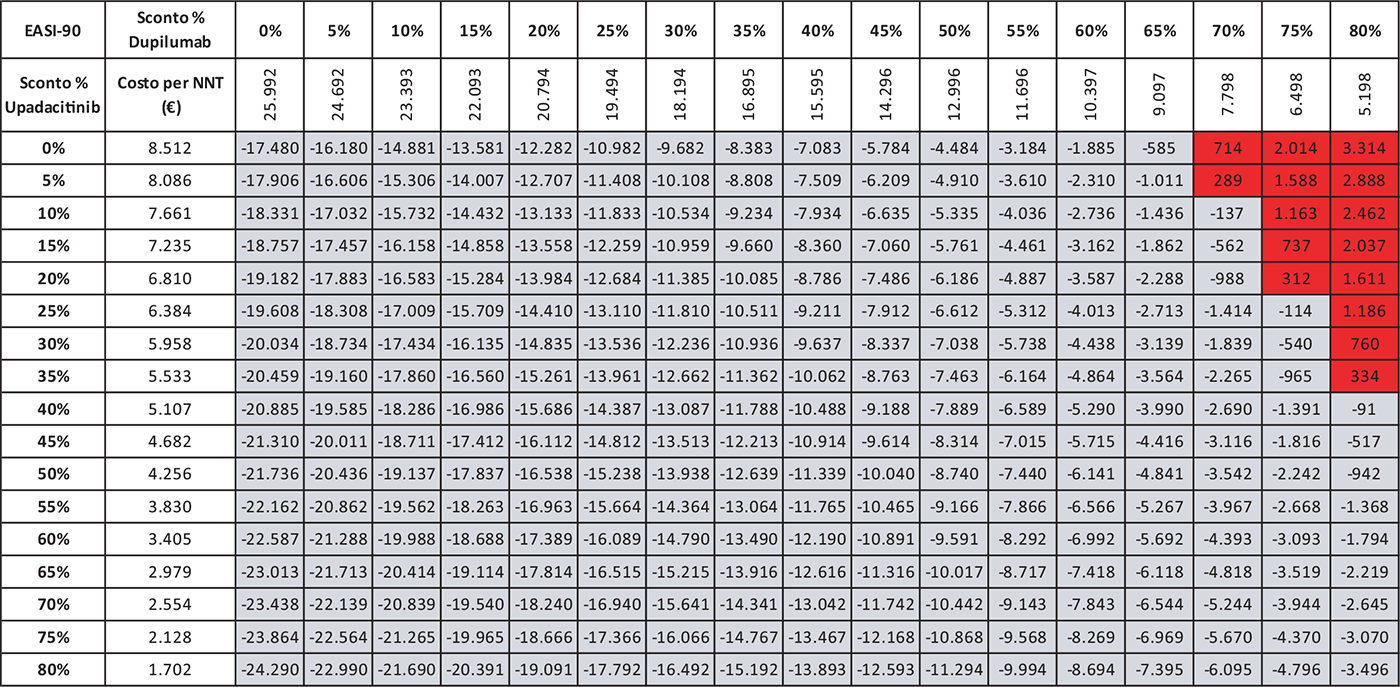
Grigio = costo per NNT UPA 15 mg < costo per NNT DUP 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT DUP 300 mg
TABELLA 13 - Analisi di scenario: EASI-90 A 16 settimane UPA 15 MG versus TRA 300 MG
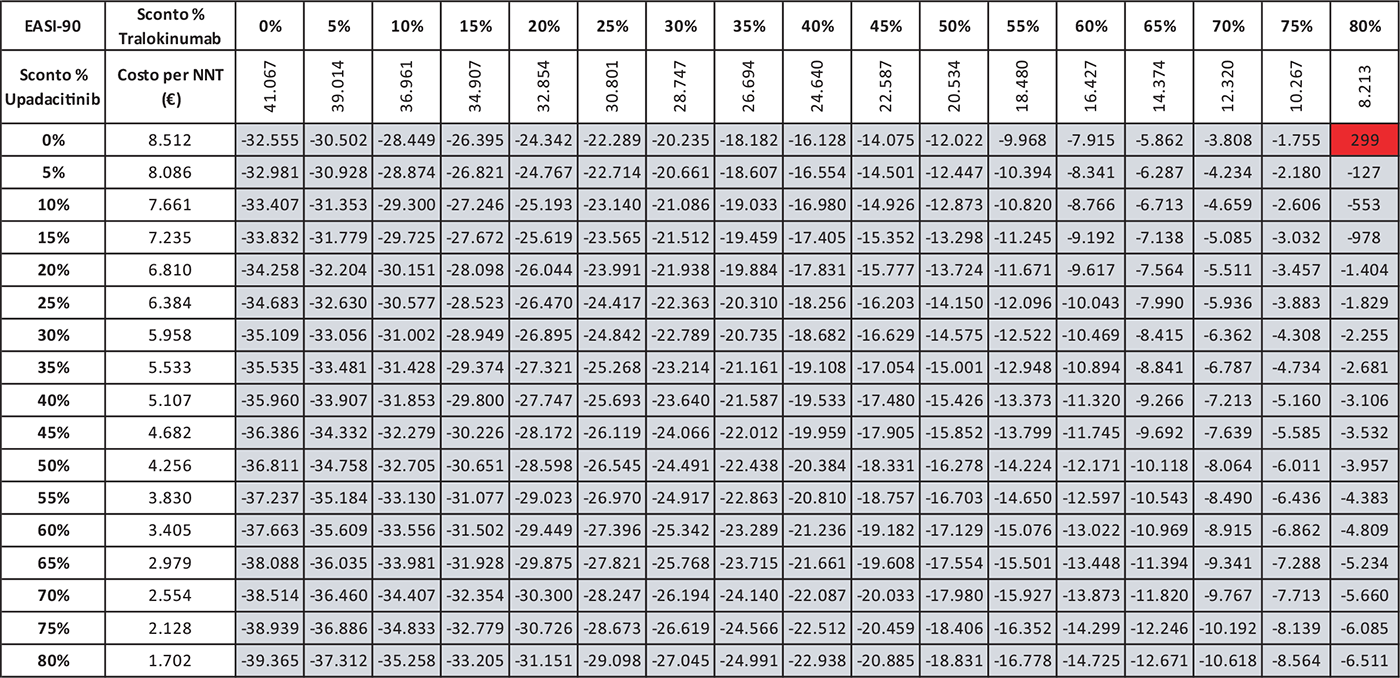
Grigio = costo per NNT UPA 15 mg < costo per NNT TRA 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT TRA 300 mg
Discussione
La presente analisi ha considerato il costo per NNT quale indicatore per pesare i benefici clinici e i costi associati all’utilizzo di upadacitinib rispetto ad abrocitinib, baricitinib, dupilumab e tralokinumab nel trattamento di pazienti adulti con diagnosi di dermatite atopica da moderata a severa candidabili alla terapia sistemica.
Il costo per NNT è stato calcolato con riferimento alle percentuali di risposta determinate dagli endpoint EASI-75 ed EASI-90 stimati dalla NMA condotta da Silverberg et al. (36), nella quale si evidenzia la maggiore efficacia (EASI-75 ed EASI-90) di UPA rispetto ad ABR, BAR, DUP e TRA. Dal momento che, nella conduzione delle analisi economiche, a causa dell’assenza di confronti diretti, si devono spesso utilizzare dati clinici forniti da analisi aggregate o da confronti indiretti, la NMA costituisce un valido approccio statistico alternativo a un confronto diretto per determinare l’efficacia relativa di differenti trattamenti rispetto al placebo o allo standard of care. È necessario però sottolineare come la qualità di una NMA dipenda dai disegni, dai bias di selezione e dai criteri di elezione adottati negli studi clinici esaminati. Le NMA non sostituiscono confronti multipli di studi randomizzati head-to-head, ma, in assenza di essi, ne rappresentano una valida alternativa (36).
La ponderazione della dimensione clinica (NNT) rispetto a quella economica (costo di trattamento), vale a dire il calcolo del costo per NNT, ha permesso di determinare un ranking di efficienza delle sei alternative considerate (ABR 100 mg, BAR 2 mg, BAR 4 mg, DUP 300 mg, UPA 15 mg e TRA 300 mg) con riferimento alla popolazione adulta con AD da moderata a severa candidabile alla terapia sistemica. Indipendentemente dall’endpoint considerato (EASI-75 ed EASI-90), a 16 settimane di trattamento UPA 15 mg ha sempre determinato il minor costo per NNT rispetto a tutte le alternative.
La NMA ha valutato l’efficacia delle opzioni farmacologiche per un periodo di trattamento relativamente breve (16 settimane), ma in linea con i timepoint degli endpoint primari di efficacia prevalentemente utilizzati negli studi clinici sull’AD. A oggi non sono disponibili NMA con valutazioni di efficacia nel lungo periodo e al momento della conduzione della NMA di Silverberg et al. (36) non erano disponibili risultati di studi clinici a lungo termine che, tuttavia, potrebbero rappresentare una sfida metodologica per la conduzione di una NMA a causa delle differenze nei disegni degli studi clinici.
Una specifica limitazione della NMA condotta da Silverberg et al. (36) è da ricercarsi nella variabilità del timepoint primario riportato tra gli studi considerati: 12 settimane per ABR e 16 settimane per gli altri trattamenti. A sostegno di una confrontabilità dei risultati di ABR rispetto agli altri trattamenti, gli Autori affermano che, dal momento che le valutazioni di efficacia effettuate in momenti precedenti (a 4 e a 8 settimane, timepoint secondari) al timepoint primario non hanno evidenziato differenze rispetto a quelle osservate a 16 settimane, sia plausibile assumere che l’efficacia di ABR a 12 settimane rimanga costante anche a 16 settimane (36).
La dimensione clinica dei risultati della NMA di Silverberg et al. (36) è stata infine valutata osservando quanto recentemente pubblicato in letteratura. Nella revisione sistematica della letteratura (SLR) e NMA condotta da Druker et al. (40) e pubblicata nel 2022, abrocitinib 200 mg e upadacitinib 30 mg hanno evidenziato endpoint (EASI, Patient Oriented Eczema Measure [POEM], Dermatology Life Quality Index [DLQI] e Peak Pruritus Numeric Rating Scales [PP-NRS]) leggermente migliori rispetto a dupilumab e a upadacitinib 15 mg, mentre ad abrocitinib 100 mg, baricitinib 2 mg e 4 mg e tralokinumab 300 mg sono stati associati punteggi leggermente peggiori rispetto a dupilumab e a upadacitinib 15 mg. Una seconda NMA, pubblicata nel 2022, è stata condotta da Wan et al. (41) per determinare l’efficacia comparativa di tre JAK inibitrici orali nel trattamento dell’AD da moderata a severa: abrocitinib 100 mg e 200 mg, baricitinib 1 mg, 2 mg e 4 mg (solo questi ultimi due sono approvati e rimborsati) e upadacitinib 30 mg e 15 mg. In termini di risposta IGA (Investigator Global Assessment) ed EASI, upadacitinib 30 mg è risultato il trattamento migliore rispetto a tutti gli altri regimi, seguito da upadacitinib 15 mg e da abrocitinib 200 mg (41). Una terza SLR e NMA condotta da Pereyra-Rodriguez et al. (42) e pubblicata nel 2021 ha valutato l’efficacia degli agenti biologici e di alcune Small Molecule Drug (SMD) nel trattamento dell’AD. L’analisi ha valutato due endpoint primari EASI-75 ed EASI-90 dal basale alla settimana 12/16, a seconda dei cut-off degli studi clinici (42). Upadacitinib e abrocitinib sono risultati i farmaci con la maggiore efficacia, sia in monoterapia che in associazione con TCS (42). I risultati di tutte e tre le NMA sembrano in linea con quelli trovati dalla NMA di Silverberg et al. (36), identificando in upadacitinib un’opzione terapeutica efficace nel trattamento della AD da moderata a severa.
Dal momento che l’analisi del caso base potrebbe non riflettere il reale prezzo di cessione dei farmaci praticato alle strutture sanitarie, è stata condotta un’analisi di scenario finalizzata a stimare l’impatto sul costo per NNT di alcune ipotesi di sconto (dallo 0% all’80%) applicate ai prezzi dei farmaci considerati nel caso base.
Valutando l’endpoint EASI-75 a 16 settimane e considerando tutte le possibili combinazioni di sconto, la probabilità che UPA 15 mg determini un minor costo per NNT rispetto agli altri trattamenti è compresa tra l’81,3% (versus BAR 4 mg) e il 99,7% (versus TRA 300 mg). Considerando invece l’endpoint EASI-90 a 16 settimane e valutando tutte le possibili combinazioni di sconto, la probabilità che UPA 15 mg determini un minor costo per NNT rispetto agli altri trattamenti è compresa tra il 79,2% (versus BAR 4 mg) e il 99,7% (versus TRA 300 mg).
È necessario evidenziare che dalla presente analisi sono stati esclusi i costi correlati alla gestione di eventuali eventi avversi associati al trattamento somministrato poiché la NMA di Silverberg et al. (36) non ha fornito dati sulla sicurezza. L’assenza di tale voce di costo potrebbe costituire un limite dell’analisi condotta, anche se, a parziale giustificazione, si riporta che, sulla base della letteratura disponibile, non si evidenziano differenze significative in termini di sicurezza tra le JAK considerate (43) e che l’eventuale inclusione di tali costi non modificherebbe significativamente i risultati del caso base.
Infine, si sottolinea come, sebbene i farmaci analizzati siano caratterizzati da differenti modalità di assunzione, orale per le JAK inibitrici e per via sottocutanea per gli anticorpi monoclonali, in via conservativa, non è stato considerato alcun costo a carico del SSN, assumendo che in entrambi i casi il farmaco venga autosomministrato dal paziente o somministrato dal caregiver (familiare). Così facendo, l’esclusione dei costi di somministrazione ha, anche se limitatamente, penalizzato i risultati di ABR, BAR e UPA rispetto a quelli di DUP e TRA.
Conclusioni
I risultati della presente valutazione economica mostrano come nella prospettiva del SSN, UPA 15 mg rappresenti un’alternativa costo-efficace rispetto ad ABR 100 mg, a BAR 2 mg, a BAR 4 mg, a DUP 300 mg e a TRA 300 mg nel trattamento di pazienti adulti con AD da moderata a severa candidabili alla terapia sistemica.
Si ritiene infine che questa analisi possa costituire una valida base di partenza per la conduzione di future indagini osservazionali finalizzate a paragonare questi risultati con quelli della pratica clinica.
Acknowledgements
The Authors wish to thank Marzia Bonfanti, for providing editorial support on behalf of PharmaLex Italy S.p.A. formerly MA Provider, and Dario Scaduto of AbbVie, for critical reading of the manuscript.
Disclosures
Conflict of interest: A. Chiricozzi has served as advisory board member and consultant and has received fees and speaker’s honoraria or has participated in clinical trials for AbbVie, Almirall, Bristol Myers Squibb, Leo Pharma, Lilly, Janssen, Novartis, Pfizer and Sanofi Genzyme. A. Costanzo has served as advisory board member and consultant and has received fees and speaker’s honoraria or has participated in clinical trials for AbbVie, Almirall, Bristol Myers Squibb, Leo Pharma, Lilly, Janssen, Novartis, Pfizer and Sanofi Genzyme. A. Levi and F. Parretta are AbbVie employees and may own AbbVie stocks/options. R. Ravasio is a consultant of PharmaLex Italy S.p.A. formerly MA Provider and he has no conflicts of interest in this research.
Financial support: AbbVie funded the project and participated in the design of the manuscript and in the review of the data. No honoraria were given for the publication.
Bibliografia
- 1. Langan SM, Irvine AD, Weidinger S. Atopic dermatitis. Lancet. 2020;396(10247):345-360. CrossRef PubMed
- 2. Drucker AM. Atopic dermatitis: burden of illness, quality of life, and associated complications. Allergy Asthma Proc. 2017;38(1):3-8. CrossRef PubMed
- 3. Rønnstad ATM, Halling-Overgaard AS, Hamann CR, Skov L, Egeberg A, Thyssen JP. Association of atopic dermatitis with depression, anxiety, and suicidal ideation in children and adults: A systematic review and meta-analysis. J Am Acad Dermatol. 2018;79(3):448-456.e30. CrossRef PubMed
- 4. Bylund S, Kobyletzki LB, Svalstedt M, Svensson Å. Prevalence and Incidence of Atopic Dermatitis: A Systematic Review. Acta Derm Venereol. 2020;100(12):adv00160. CrossRef PubMed
- 5. Kim JP, Chao LX, Simpson EL, Silverberg JI. Persistence of atopic dermatitis (AD): A systematic review and meta-analysis. J Am Acad Dermatol. 2016;75(4):681-687.e11. CrossRef PubMed
- 6. Lee HH, Patel KR, Singam V, Rastogi S, Silverberg JI. A systematic review and meta-analysis of the prevalence and phenotype of adult-onset atopic dermatitis. J Am Acad Dermatol. 2019;80(6):1526-1532.e7. CrossRef PubMed
- 7. Barbarot S, Auziere S, Gadkari A, et al. Epidemiology of atopic dermatitis in adults: results from an international survey. Allergy. 2018;73(6):1284-1293. CrossRef PubMed
- 8. Calzavara Pinton P, Cristaudo A, Foti C, et al. Diagnosis and management of moderate to severe adult atopic dermatitis: a Consensus by the Italian Society of Dermatology and Venereology (SIDeMaST), the Italian Association of Hospital Dermatologists (ADOI), the Italian Society of Allergy, Asthma and Clinical Immunology (SIAAIC), and the Italian Society of Allergological, Environmental and Occupational Dermatology (SIDAPA). G Ital Dermatol Venereol. 2018;153(2):133-145. PubMed
- 9. Hajar T, Gontijo JRV, Hanifin JM. New and developing therapies for atopic dermatitis. An Bras Dermatol. 2018;93(1):104-107. CrossRef PubMed
- 10. Megna M, Napolitano M, Patruno C, et al. Systemic Treatment of Adult Atopic Dermatitis: A Review. Dermatol Ther (Heidelb). 2017;7(1):1-23. CrossRef PubMed
- 11. Waljee AK, Rogers MA, Lin P, et al. Short term use of oral corticosteroids and related harms among adults in the United States: population based cohort study. BMJ. 2017;357:j1415. CrossRef PubMed
- 12. Boguniewicz M, Fonacier L, Guttman-Yassky E, Ong PY, Silverberg J, Farrar JR. Atopic dermatitis yardstick: practical recommendations for an evolving therapeutic landscape. Ann Allergy Asthma Immunol. 2018;120(1):10-22.e2. CrossRef PubMed
- 13. Agenzia Italiana del Farmaco (AIFA). Determina 13 gennaio 2023 Riclassificazione del medicinale per uso umano «Cibinqo», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 36/2023). (23A00343) (GU Serie Generale n.22 del 27-01-2023). Online (Accessed November 2023).
- 14. Agenzia Italiana del Farmaco (AIFA). Determina 3 luglio 2023 Regime di rimborsabilita’ e prezzo, a seguito di nuove indicazioni terapeutiche, del medicinale per uso umano «Olumiant». (Determina n. 456/2023). (23A03875) (GU Serie Generale n.157 del 07-07-2023). Online (Accessed November 2023).
- 15. Agenzia Italiana del Farmaco (AIFA). Determina 24 novembre 2020 Rinegoziazione e riclassificazione del medicinale per uso umano «Dupixent», ai sensi dell’art. 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. DG/1205/2020). (20A06600) (GU Serie Generale n.305 del 09-12-2020). Online (Accessed November 2023).
- 16. Agenzia Italiana del Farmaco (AIFA). Determina 8 febbraio 2022 Regime di rimborsabilita’ e prezzo, a seguito di nuove indicazioni terapeutiche, del medicinale per uso umano «Dupixent». (Determina n. 115/2022). (22A01099) (GU Serie Generale n.42 del 19-02-2022). Online (Accessed November 2023).
- 17. Agenzia Italiana del Farmaco (AIFA). Determina 26 luglio 2022 Riclassificazione del medicinale per uso umano «Adtralza», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 537/2022). (22A04366) (GU Serie Generale n.181 del 04-08-2022). Online (Accessed November 2023).
- 18. Agenzia Italiana del Farmaco (AIFA). Determina 13 gennaio 2023 Regime di rimborsabilita’ e prezzo, a seguito di nuove indicazioni terapeutiche, del medicinale per uso umano «Rinvoq». (Determina n. 19/2023). (23A00338) (GU Serie Generale n.22 del 27-01-2023). Online. (Accessed November 2023).
- 19. Riassunto delle caratteristiche di prodotto Cibinqo. Online. (Accessed November 2023).
- 20. Simpson EL, Sinclair R, Forman S, et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet. 2020;396(10246):255-266. CrossRef PubMed
- 21. Silverberg JI, Simpson EL, Thyssen JP, et al. Efficacy and Safety of Abrocitinib in Patients With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. 2020;156(8):863-873. CrossRef PubMed
- 22. Bieber T, Simpson EL, Silverberg JI, et al; JADE COMPARE Investigators. Abrocitinib versus Placebo or Dupilumab for Atopic Dermatitis. N Engl J Med. 2021;384(12):1101-1112. CrossRef PubMed
- 23. Riassunto delle caratteristiche di prodotto Olumiant. Online (Accessed November 2023).
- 24. Simpson EL, Lacour J-P, Spelman L, et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials. Br J Dermatol. 2020;183(2):242-255. CrossRef PubMed
- 25. Simpson EL, Forman S, Silverberg JI, et al. Baricitinib in patients with moderate-to-severe atopic dermatitis: results from a randomized monotherapy phase 3 trial in the United States and Canada (BREEZE-AD5). J Am Acad Dermatol. 2021;85(1):62-70. CrossRef PubMed
- 26. Reich K, Kabashima K, Peris K, et al. Efficacy and Safety of Baricitinib Combined With Topical Corticosteroids for Treatment of Moderate to Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. 2020;156(12):1333-1343. CrossRef PubMed
- 27. Riassunto delle caratteristiche di prodotto Dupixent. Online (Accessed November 2023).
- 28. Simpson EL, Bieber T, Guttman-Yassky E, et al; SOLO 1 and SOLO 2 Investigators. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335-2348. CrossRef PubMed
- 29. Blauvelt A, de Bruin-Weller M, Gooderham M, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389(10086):2287-2303. CrossRef PubMed
- 30. Riassunto delle caratteristiche di prodotto Adtralza Online (Accessed November 2023).
- 31. Wollenberg A, Blauvelt A, Guttman-Yassky E, et al; ECZTRA 1 and ECZTRA 2 study investigators. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol. 2021;184(3):437-449. CrossRef PubMed
- 32. Silverberg JI, Adam DN, Zirwas M, et al. Tralokinumab Plus Topical Corticosteroids as Needed Provides Progressive and Sustained Efficacy in Adults with Moderate-to-Severe Atopic Dermatitis Over a 32-Week Period: An ECZTRA 3 Post Hoc Analysis. Am J Clin Dermatol. 2022;23(4):547-559. CrossRef PubMed
- 33. Riassunto delle caratteristiche di prodotto Rinvoq Online (Accessed November 2023).
- 34. Guttman-Yassky E, Teixeira HD, Simpson EL, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021;397(10290):2151-2168. CrossRef PubMed
- 35. Reich K, Teixeira HD, de Bruin-Weller M, et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2021;397(10290):2169-2181. CrossRef PubMed
- 36. Silverberg JI, Hong HC, Thyssen JP, et al. Comparative Efficacy of Targeted Systemic Therapies for Moderate to Severe Atopic Dermatitis without Topical Corticosteroids: Systematic Review and Network Meta-analysis. Dermatol Ther (Heidelb). 2022;12(5):1181-1196. CrossRef PubMed
- 37. Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011;64(2):163-171. CrossRef PubMed
- 38. Elenco dei medicinali di classe a) rimborsabili dal Servizio sanitario nazionale (SSN) ai sensi dell’articolo 48, comma 5, lettera c), del decreto-legge 30 settembre 2003, n. 269, convertito, con modificazioni, nella legge 24 novembre 2006, n. 326. (Prontuario farmaceutico nazionale 2006). (GU Serie Generale n.156 del 07-07-2006 - Suppl. Ordinario n. 161). Online (Accessed November 2023).
- 39. Gazzetta Ufficiale (G.U.) Serie Generale n° 154 del 30 giugno 2021. Online (Accessed November 2023).
- 40. Drucker AM, Morra DE, Prieto-Merino D, et al. Systemic Immunomodulatory Treatments for Atopic Dermatitis: Update of a Living Systematic Review and Network Meta-analysis. JAMA Dermatol. 2022;158(5):523-532. CrossRef PubMed
- 41. Wan H, Jia H, Xia T, Zhang D. Comparative efficacy and safety of abrocitinib, baricitinib, and upadacitinib for moderate-to-severe atopic dermatitis: A network meta-analysis. Dermatol Ther. 2022;35(9):e15636. CrossRef PMID:35703351
- 42. Pereyra-Rodriguez J-J, Alcantara-Luna S, Domínguez-Cruz J, et al. Short-Term Effectiveness and Safety of Biologics and Small Molecule Drugs for Moderate to Severe Atopic Dermatitis: A Systematic Review and Network Meta-Analysis. Life (Basel). 2021;11(9):927. CrossRef PubMed
- 43. Alves C, Penedones A, Mendes D, Batel Marques F. The safety of systemic Janus kinase inhibitors in atopic dermatitis: a systematic review and network meta-analysis. Eur J Clin Pharmacol. 2022;78(12):1923-1933. CrossRef PubMed