 |
Glob Reg Health Technol Assess 2024; 11: 68-74 ISSN 2283-5733 | DOI: 10.33393/grhta.2024.2677 ORIGINAL RESEARCH ARTICLE |
 |
Prontuari Terapeutici Regionali in Italia: stato dell’arte e prospettive future
Regional Formularies in Italy: current state and future perspectives
Regional Formularies (RF) are considered part of pharmaceutical policies implemented by regions to govern access of medicines to regional market. However, they have been actually challenged, because of their presumed impact on differences of patient’s access across the regions. The paper aimed at investigating the current status of RF and Regional Therapeutic Committees (CTR) and at suggesting/recommending possible reforms.
The current status was investigated through a questionnaire administered to the regional pharmaceutical departments. Recommendations were retrieved from a multi-stakeholder work group carried out on 30-31 March 2023, embedded into a Forum focused on the regional pharmaceutical policies.
Nineteen out of twenty-one regions responded to the survey: 12 use RF, mainly managed by the CTR; the RF frequency of update and the time needed for drugs listing greatly vary across regions; pharmacists, specialists and general practitioners are always represented in CTR, whereas other healthcare professionals and experts are more rarely involved; in 3 regions the CTR does not publish any RF update; the CTR mainly rely, to take decisions, on the dimension of the target population, the cost of therapy compared to alternative treatments and the impact on pharmaceutical expenditure.
The working group recommended to overcome the RFs, if they are merely considered a list of available drugs at regional level, focusing CTR activities to ensure market access and to govern the prescribing behaviour, and strengthening/anticipating the flow of information from the Italian Medicines Agency (AIFA) to the regions, to enable a more efficient approach to local access to drugs.
Keywords: Italy, Regional Formularies, Regional Therapeutic Committees
Received: October 4, 2023
Accepted: January 22, 2024
Published online: March 8, 2024
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il ruolo delle regioni nel governo dell’assistenza farmaceutica è oggetto di dibattito da diversi anni (1). Da una parte, le condizioni di accesso (classificazione ai fini della fornitura e della rimborsabilità, prezzi e altre componenti contrattuali, come registri, note, richiesta di selezione dei centri e dei professionisti prescrittori, sconti e accordi di rimborso condizionato) vengono negoziate a livello centrale. Dall’altra, le regioni sono responsabili della gestione della spesa sanitaria e di coprire gli eventuali disavanzi con entrate tributarie, compartecipazioni alla spesa e azioni di contenimento della spesa, inclusi interventi sui meccanismi distributivi dei farmaci, nonché attingendo alle risorse già assegnate per la gestione dei LEA (Livelli Essenziali di Assistenza) del 50% dello sfondamento del tetto sui farmaci acquistati da aziende sanitarie (acquisti diretti). Le regioni provvedono poi a implementare gli indirizzi nazionali rispetto alle scelte dei centri prescrittori, gestiscono gli acquisti attraverso le centrali di committenza e hanno attuato iniziative specifiche di governo del comportamento prescrittivo (indirizzi su aree caratterizzate dalla presenza di diverse alternative terapeutiche e sulle sequenze terapeutiche).
Una delle aree più critiche è però quella dei PTR (Prontuari Terapeutici Regionali) (2). Da una parte, se implementati come liste selettive di rimborsabilità dei farmaci, già approvati a livello nazionale, rappresentano in linea di principio una violazione del principio di uniforme applicazione dei LEA. Dall’altra, esistono aree terapeutiche caratterizzare da un’ampia disponibilità di farmaci e per le quali può essere considerata una selezione degli stessi a supporto anche della gestione a livello locale.
Oltre alla discussione sulla liceità e sull’opportunità di introdurre (o mantenere) i PTR, vi è anche una sensibilità marcata sui tempi di valutazione per l’inserimento (vale a dire i tempi tra la pubblicazione in Gazzetta Ufficiale della Determina AIFA, Agenzia Italiana del Farmaco, di P&R, Prezzo e Rimborso, e l’inserimento nei PTR) e sugli effetti reali sull’accesso ai farmaci, dove per accesso reale si intende la quota dei pazienti eleggibili al trattamento effettivamente trattata nel tempo.
Non esistono a oggi evidenze strutturate su tutti i farmaci né sul primo né sul secondo aspetto. Le due attuali analisi comparative interregionali pubblicate si sono focalizzate sui farmaci oncologici. Un primo contributo (3) ha misurati i tempi intercorrenti tra pubblicazione della Determina di P&R e data di primo acquisto a livello regionale, rilevando una distanza temporale media di 175 giorni, con valori compresi tra 120 giorni in Lombardia e quasi 280 in Basilicata. Un secondo contributo (4) ha misurato i tempi di penetrazione del farmaco sulla popolazione target, vale a dire l’incidenza dei pazienti eleggibili al trattamento effettivamente trattati nel tempo, evidenziando come la quota di pazienti in trattamento nel medio-lungo periodo (due anni) sia condizionata molto più da politiche nazionali (presenza di accordi di rimborso condizionato dalla risposta del paziente, con effetti positivi sull’accesso) che da PTR (che non risultano essere un fattore predittivo rilevante delle differenze interregionali). Gli unici dati esistenti cross-patologia sono stati pubblicati su un abstract (5) e si riferiscono, anche in questo caso, alla prima data di acquisto per 39 farmaci. L’analisi evidenzia tempi medi di accesso di 2,8 mesi (inferiori quindi a quelli rilevati da Prada et al.), con valori più alti nelle Regioni del Sud e per i farmaci oncologici. Esiste infine un contributo specifico riferito alla Regione Sicilia che riporta su 117 farmaci un tempo medio di ingresso in prontuario di 4,2 mesi (6).
Il contributo più recente sullo stato dell’arte dei PTR (processo valutativo, criteri decisionali, ecc.) è stato pubblicato nel 2021 (7). Il paper si è focalizzato sul ruolo dei PTR nella gestione dei farmaci ad uso territoriale (e in particolare dei farmaci sul diabete) ma contiene anche una mappatura più generale dei PTR, con riferimento a quattro aspetti: esistenza di un PTR e sua natura vincolante/non vincolante, esistenza di una Commissione Terapeutica Regionale (CTR) e presenza di un diabetologo, numero di riunioni all’anno della CTR e soggetto autorizzato alla richiesta di inserimento in PTR. Tale analisi non riporta informazioni di processo (dati richiesti, percorso valutativo, eventuali differenziazioni tra farmaci, supporto di soggetti esterni, interazione con gli stakeholder) e di come l’attività di gestione dei PTR si colloca nel più ampio contesto delle attività dell’eventuale CTR. Questi aspetti sono stati indagati in altri contributi, che però sono datati (2,8) o riportati in abstract che non forniscono informazioni nel dettaglio (9,10). I contributi citati sopra non contengono poi valutazioni percettive sulle prospettive dei PTR.
Scopo del presente contributo è coprire entrambi i gap informativi, vale a dire aggiornare e completare le analisi sullo stato dell’arte dei PTR ed effettuare una valutazione prospettica del loro utilizzo nell’azione di governo regionale.
Metodo
Il ruolo attuale dei PTR è stato analizzato attraverso una survey effettuata tra febbraio e giugno 2023. La survey è stata condotta tramite un questionario strutturato, somministrato ai responsabili dei servizi farmaceutici di tutte le Regioni/Province Autonome, composto da 60 domande strutturate in quattro aree (cfr. Supplementary questionnaire):
- PTR: sono state richieste informazioni sulla presenza di un PTR o di Prontuari Terapeutici Aziendali (PTA), le caratteristiche che li contraddistinguono (iter e cadenza temporale per l’aggiornamento) e le motivazioni in caso di risposta negativa rispetto alla richiesta di inserimento dei farmaci;
- CTR: ambiti principali di competenza, figure professionali che la compongono, eventuale interazione con stakeholder esterni e modalità di pubblicazione delle decisioni assunte;
- informazioni richieste per l’inserimento dei farmaci in PTR: stima dei pazienti eleggibili al trattamento, costi associati alla nuova terapia, confronto di costo rispetto ai principali comparatori, impatto sulla spesa farmaceutica e presenza di centri specialistici autorizzati alla prescrizione;
- centri specialistici autorizzati alla prescrizione: criteri e iter utilizzato per l’individuazione dei centri.
Il Questionario è stato disegnato dai co-Autori del presente paper, sulla base anche degli studi precedenti (2,7,8) e validato da esperti del settore.
La valutazione prospettica è stata effettuata sulla base di una discussione aperta organizzata nell’ambito di un Forum dedicato alle politiche farmaceutiche regionali dal titolo “Riflessioni e proposte per condividere gli strumenti di governance dell’assistenza farmaceutica regionale”, organizzato a Roma il 30 e il 31 marzo. Nello specifico, la discussione e la produzione di raccomandazioni/idee innovative sono avvenute nell’ambito di un Gruppo di Lavoro multiprofessionale, formato da soggetti istituzionali (AIFA, Agenzia Italiana del Farmaco, regioni e aziende sanitarie), ricercatori e stakeholder di riferimento (imprese farmaceutiche, clinici, associazioni di pazienti) (cfr. Ringraziamenti).
La discussione si è focalizzata su 5 quesiti:
- Sono ancora necessari i PTR?
- Qual è il ruolo dei PTR rispetto al processo di accesso e, in particolare, alle gare?
- Sono ancora necessarie le CTR? Se sì, quali funzioni dovrebbero avere? Quali competenze e interazioni tra CTR e portatori di interesse?
- Sono ancora necessarie le Commissioni Terapeutiche Aziendali (CTA)? Se sì, quali funzioni dovrebbero avere e che significato ha il PTA?
- L’AIFA valuta (ed eventualmente integra) evidenze scientifiche ed economiche sui nuovi farmaci e nuove indicazioni, fornite dalle imprese. Queste valutazioni dovrebbero essere rese disponibili alle regioni? Se sì, quali informazioni minime dovrebbero contenere per essere utili alle regioni?
Risultati
a. I risultati della survey su PTR e CTR
Stato attuale dei PTR
Al questionario hanno risposto 19 regioni, che rappresentano il 97% della popolazione italiana (11). Delle 19 regioni rispondenti, 12 hanno un PTR, per tutte vincolante per i PTA, presenti in 4 regioni (Fig. 1). In 11 regioni il PTR è gestito da una CTR; solo in una regione la gestione è in carico al servizio farmaceutico regionale. In una delle 7 regioni senza PTR è presente una CTR (in 2 regioni esistono Gruppi di Lavoro con funzioni simili alla CTR) e in 6 di tali regioni sono stati introdotti i PTA.
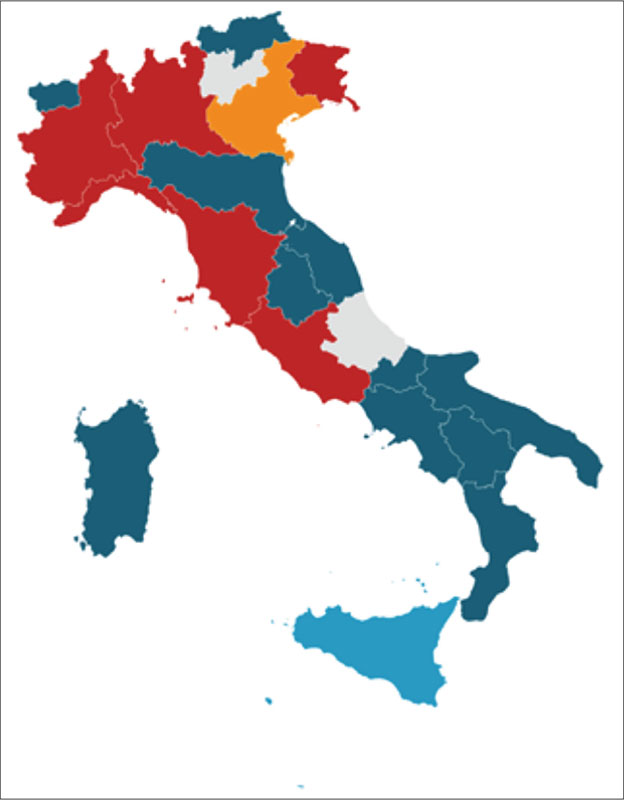
FIGURA 1 - Stato dell’arte di Prontuari e Commissioni Terapeutici Regionali (2023).
Nostre elaborazioni su Survey PTR. In rosso le regioni senza PTR e senza CTR; in arancione la regione senza PTR ma con CTR; in blu le regioni con PTR e CTR; in azzurro la regione con PTR e senza CTR; in grigio le regioni che non hanno risposto.
Le principali motivazioni addotte per l’assenza o l’abolizione del PTR sono rappresentate dalla necessità di rendere immediatamente disponibili i farmaci sul territorio e dalla volontà di garantire equità nell’accesso, considerando che la decisione sulla rimborsabilità spetta ad AIFA e che il farmaco rimborsato è parte dei LEA. Una regione ha sottolineato come il PTR non sia necessario, in quanto, essendo la logistica centralizzata, è un collegio tecnico a decidere cosa avere in giacenza in magazzino regionale e cosa mantenere in economia.
La frequenza di aggiornamento dei PTR è molto variabile: 6 regioni effettuano un aggiornamento ogni 1/3 mesi, 5 ogni semestre e una su base annuale. Ai responder è stato poi chiesto di fornire una stima di massima dei tempi di inserimento dei farmaci nel PTR. Le risposte, pervenute da 9 su 12 regioni, presentano un’elevata variabilità, con un valore mediano, minimo e massimo rispettivamente di 60, 20 (dichiarato dalla regione senza CTR) e 180 giorni. In generale, i responder hanno riconosciuto che non ci sono differenze sostanziali tra farmaci nei tempi di inclusione in PTR. Solo 3 regioni hanno citato alcune eccezioni: farmaci innovativi (che dovrebbero essere per norma immediatamente accessibili), farmaci per malattie rare e farmaci onco-ematologici, per i quali una regione ha previsto l’ingresso d’ufficio alla prima riunione utile rimandando alla Rete Oncologica Regionale la valutazione sul loro utilizzo razionale.
La gestione dell’inserimento nei PTR spetta alla CTR, laddove presente, alla CTA nel caso della Provincia Autonoma di Bolzano/Alto Adige e agli uffici dell’Assessorato della Salute in Sicilia.
Come specificato sopra, in 6 regioni delle 7 senza PTR non esiste una CTR. In 3 regioni la CTR è scaduta e in un caso è in valutazione la sua ricostituzione e in una regione l’assenza della CTR è stata motivata dall’assenza del PTR; nelle rimanenti due regioni esistono altre strutture di supporto all’ingresso dei farmaci nel contesto regionale (Gruppi di Lavoro per aree tematiche specifiche e commissione per l’appropriatezza, con un ruolo di monitoraggio di indicatori regionali di appropriatezza prescrittiva e della spesa).
Caratteristiche delle CTR
Le CTR, oltre alla gestione delle richieste di inserimento nei PTR, svolgono altre funzioni, come la produzione di raccomandazioni sul comportamento prescrittivo (9 delle 11 CTR), l’individuazione dei centri abilitati alla prescrizione (6 CTR) e il monitoraggio della prescrizione e la gestione di richieste sulla cosiddetta “equivalenza terapeutica” (4 CTR) (Tab. 1).
| Ambiti in cui si esprime la CTR | N. regioni (su 11) |
|---|---|
| Raccomandazioni/linee di indirizzo sull’utilizzo dei farmaci | 9 |
| Inserimento dei farmaci nel PTR | 9 |
| Individuazione dei centri autorizzati alla prescrizione di farmaci | 6 |
| Aspetti farmacologici dei PDTA regionali proposti dalle strutture competenti | 6 |
| Richieste di equivalenza terapeutica | 4 |
| Monitoraggio dell’appropriatezza prescrittiva | 4 |
| Modalità di dispensazione dei farmaci del PHT | 3 |
| Monitoraggio dei dati di farmacovigilanza | 2 |
| Informazione scientifica sul farmaco | 2 |
| Monitoraggio della spesa farmaceutica | 2 |
| Altri aspetti (p. es., Cnn) | 1 |
Nostre elaborazioni su Survey PTR. PDTA: Percorso Diagnostico Terapeutico Assistenziale; PHT: Prontuario della continuità Ospedale-Territorio; Cnn: farmaci in fascia “C non negoziata” in quanto la negoziazione di P&R non si è ancora conclusa.
Con riferimento alla composizione della CTR, sono sempre presenti farmacisti (e il dirigente regionale responsabile del servizio farmaceutico), medici specialisti e (tranne in una CTR) medici di medicina generale (MMG)/pediatri di libera scelta (PLS), mentre minore è la presenza di altre professioni sanitarie e di altri soggetti con competenze tecniche diverse (Tab. 2).
| Professioni presenti in CTR | N. regioni (su 11) |
|---|---|
| Farmacisti | 11 |
| Medici specialisti | 11 |
| Dirigente regionale servizio farmaceutico | 11 |
| MMG/PLS | 10 |
| Farmaco-economisti | 5 |
| Direttori sanitari | 5 |
| Direttori di distretti | 4 |
| Rappresentanti associazioni di pazienti | 3 |
| Farmacologi | 2 |
| Direttori amministrativi | 1 |
| Rappresentanti Ordine Farmacisti | 1 |
| Altro | 1 |
Nostre elaborazioni su Survey PTR.
Oltre ai membri della Commissione, 7 CTR si avvalgono di specifici Gruppi di Lavoro per patologia nelle aree caratterizzate da una pipeline più ricca (come quella onco-ematologica e del diabete) o tecnicamente più complessa (come quella dei radiofarmaci). In 4 regioni si tratta di gruppi fissi, mentre nelle altre 3 vengono istituiti ad hoc. In 4 regioni sono previste audizioni da parte delle CTR di stakeholder, come imprese farmaceutiche, rappresentanti di società scientifiche e associazioni di pazienti. Dalla survey è emerso anche un caso di consultazione tra 2 CTR.
In 8 regioni sono attuati sistemi di monitoraggio dell’aderenza alle indicazioni della CTR da parte delle aziende sanitarie: in 7 casi viene specificamente assegnato ai direttori generali l’obiettivo di seguire le indicazioni della CTR.
L’accessibilità alle decisioni della CTR è possibile in 8 casi (3 con Decreto, 2 con Determina, uno con Delibera di Giunta Regionale, uno con pubblicazione del verbale della seduta della CTR e uno con una nota di trasmissione del verbale). Nelle altre 3 regioni non vengono pubblicati gli aggiornamenti del PTR.
Attività istruttoria della CTR e criteri di identificazione dei Centri Specialistici
Con riferimento alle azioni di governo regionale, inclusi l’immissione in PTR, il governo del comportamento prescrittivo e l’individuazione dei centri prescrittori, qualora ciò sia previsto a livello nazionale, 17 su 19 regioni hanno dichiarato di svolgere una vera e propria attività istruttoria, intesa come valutazione critica delle informazioni fornite dalle imprese e raccolta autonoma di dati a supporto delle scelte.
La Tabella 3 illustra gli elementi considerati nell’attività istruttoria, in ordine decrescente per numero di regioni. La stima dei pazienti eleggibili al trattamento, i costi associati alla nuova terapia, il confronto del costo rispetto ai principali comparatori, l’impatto sulla spesa farmaceutica, la presenza di centri specialistici già coinvolti per la patologia target e il parere di tali centri/professionisti sono le informazioni maggiormente valutate e processate. I costi evitati grazie alle nuove terapie e l’effetto complessivo sulla spesa sanitaria vengono presi in considerazione rispettivamente solo da 5 e 6 regioni.
| Elementi considerati nell’attività istruttoria del governo regionale del farmaco | N. regioni (su 15) |
|---|---|
| Stima dei pazienti eleggibili al trattamento | 15 |
| Presenza di reti di patologia o di centri specialistici già autorizzati per la patologia del farmaco in valutazione | 14 |
| Costi associati alla nuova terapia (farmaco, somministrazione, gestione del follow-up, ecc.) | 12 |
| Principali comparatori e confronto dei relativi costi | 12 |
| Place in therapy | 11 |
| Previsioni di spesa per il farmaco | 11 |
| Impatto sulla spesa farmaceutica (BIA, Budget Impact Analysis, nella prospettiva della spesa per i farmaci) | 11 |
| Parere della rete di patologia, del centro specializzato e dei clinici di competenza specialistica | 11 |
| Impatto sulla spesa sanitaria regionale (Budget Impact Analysis nella prospettiva del SSR, Servizio Sanitario Regionale) | 6 |
| Costi sanitari aggiunti o evitati per effetto del nuovo farmaco | 5 |
Nostre elaborazioni su Survey PTR.
Sono state poi raccolte alcune informazioni specifiche sulla BIA (cfr. Supplementary Tables, Tab. 1):
- l’arco temporale richiesto è di 3 anni in 9 regioni (di 1 anno in 5);
- la casistica attesa viene stimata prevalentemente sulla base di dati epidemiologici di letteratura e di dati real world e sulla base dei dati del Dossier di P&R adattato ai contesti regionali;
- la stima della popolazione target dovrebbe includere sia i pazienti prevalenti che quelli incidenti; in alcune regioni viene richiesta una valutazione al netto della mobilità regionale;
- l’identificazione delle alternative terapeutiche avviene principalmente sulla base delle Linee Guida nazionali e internazionali e degli studi registrativi;
- il prezzo di gara è preferibilmente richiesto/utilizzato per la valorizzazione del costo terapia (solo in 4 casi viene fatto esplicito riferimento al prezzo ex-factory al netto delle riduzioni di legge).
Infine, sono state raccolte informazioni riguardo all’individuazione dei centri autorizzati alla prescrizione, qualora questo sia richiesto nella Determina di P&R. I criteri, nella maggioranza dei casi, fanno riferimento alla specializzazione dei centri, al volume atteso di pazienti presi in carico e alla dotazione tecnologica. La proposta dei centri prescrittori viene in genere avanzata dalle Direzioni Sanitarie, dalle Reti di area terapeutica o dall’Assessorato, mentre solo in due casi è la CTR ha effettuare tale proposta. Sono poi quasi sempre gli uffici regionali competenti ad autorizzare formalmente i centri di riferimento (cfr. Supplementary Tables, Tab. 2).
b. I risultati del Gruppo di Lavoro sul ruolo prospettico di PTR e CTR
I risultati del Gruppo di Lavoro vengono qui di seguito descritti e sintetizzati nella Tabella 4.
Il primo quesito, riferito alla necessità di un PTR, è stato oggetto di ampia discussione, anche in relazione alla forte variabilità interregionale. In generale è emerso che:
- se i PTR sono intesi come lista selettiva di farmaci in Fascia A/H a carico del SSR, non sono necessari e peraltro tale selezione negherebbe il principio di offerta dei LEA, se questi coincidono con il prontuario nazionale;
- è invece importante un’azione di governo dell’ingresso dei farmaci a livello regionale. In particolare tale azione è:
o necessaria per attivare le condizioni di accesso previste a livello nazionale (per esempio, individuazione dei centri prescrittori, eventuali vincoli sulle modalità di erogazione del farmaco);
o opportuna per fornire indicazioni sull’eventuale rimborso di farmaci in Fascia C, purché questo sia possibile (regioni non in Piano di Rientro);
o utile per l’adozione di eventuali azioni di governo del comportamento prescrittivo.
La discussione sul secondo tema (inerente al ruolo di PTR e alle gare sull’accesso) è andata al di là, anche per quanto è emerso dal dibattito sul primo quesito, del rapporto tra prontuari e gare. Si è infatti discusso non solo dell’opportunità che l’eventuale selezione dei farmaci, laddove esistono alternative terapeutiche, venga effettuata a monte attraverso il PTR (con il caveat del mancato rispetto dei LEA) o a valle, attraverso il meccanismo competitivo degli acquisti (che prevedono la fase di raccolta dei fabbisogni), ma anche, e più in generale, degli elementi critici nelle diverse fasi di accesso del paziente al farmaco a livello regionale.
A questo proposito è emerso che i PTR rappresentano uno degli step di accesso, ma non necessariamente quello più impattante. Di notevole importanza è, laddove prevista, l’individuazione dei centri prescrittori. Per accelerare tale processo sarebbe opportuno:
- anticiparlo il più possibile, per esempio attraverso l’invio di un’informativa AIFA, subito dopo la ratifica dell’accordo di P&R (Prezzo e Rimborso) da parte del Consiglio di Amministrazione, accordo che include appunto la richiesta di selezione di centri (e professionisti) autorizzati alla prescrizione;
- ottimizzare i tempi di comunicazione della scelta da parte delle regioni e della formalizzazione di tale decisione (per esempio, attraverso l’invio immediato ai centri abilitati di una nota informativa sulla loro selezione).
Un altro suggerimento è quello di individuare in modo precoce e, se possibile, uniforme sul territorio regionale la modalità di erogazione/distribuzione del farmaco.
Con riferimento invece agli acquisti è emersa l’opportunità di centralizzare a livello nazionale le gare per farmaci per i quali tale centralizzazione semplifica ed evita duplicazioni di procedure regionali che non portano valore aggiunto al SSN, Servizio Sanitario Nazionale (per esempio, farmaci unici e infungibili). Su questo tema non è emersa un’indicazione chiara su chi dovrebbe gestire tale procedura d’acquisto (Consip o stazione appaltante regionale per conto delle altre regioni).
Di particolare importanza per l’accesso regionale ai farmaci, è infine l’inserimento nelle «piattaforme» prescrittive a livello regionale (registro farmaci AIFA, eventualmente integrato da altri registri regionali).
Infine, a prescindere dalle scelte regionali relative al PTR, sono fondamentali le azioni di governo del comportamento prescrittivo (attraverso valutazioni comparative), purché queste avvengano successivamente all’attivazione delle condizioni di accesso per i singoli farmaci.
Rispetto al terzo quesito (necessità, funzioni, competenze e interazioni con i portatori di interesse delle CTR), è stata sottolineata l’importanza, in termini generali, di avere un soggetto regionale che governi l’accesso. Tale soggetto può essere rappresentato da una CTR con funzioni decisionali, da CTR/uffici regionali se la CTR ha funzioni consultive o dai soli uffici regionali, se non si ritiene utile avere una CTR.
Tale soggetto dovrebbe avere:
- la funzione prioritaria di attivazione delle condizioni di accesso dei farmaci (centri prescrittori, raccolta informativa per acquisti, scelta su erogazione, piattaforme prescrittive) e di verifica delle altre condizioni abilitanti l’accesso (per esempio, rapidità di test molecolari per individuazioni di mutazioni, spesso necessari per terapie target);
- la funzione di governo del comportamento prescrittivo attraverso analisi comparative, anche di costo.
La discussione sulla CTR ha rappresentato l’occasione per affrontare il tema della gestione dell’eventuale accesso a livello regionale ai farmaci in C(nn). A fronte di una variabilità interregionale [e di strategie di impresa nella proposta di farmaci in C(nn)], si è sollevata una richiesta decisa di individuare un modello nazionale di gestione della C(nn), nel quadro:
- di una politica di prioritizzazione dei farmaci/indicazioni approvati ma non ancora rimborsati dal SSN (la prioritizzazione potrebbe avvenire, per esempio, sulla base dell’elevato unmet need e/o valore terapeutico aggiunto);
- di una gestione omogenea dell’eventuale accesso pre-finalizzazione della negoziazione di P&R per gli altri farmaci (p. es., prezzo simbolico).
Il GdL (Gruppo di Lavoro) non ha invece affrontato, viste la numerosità e la rilevanza degli altri temi, quello delle competenze dei membri della CTR e dell’interazione con gli stakeholder.
Con riferimento al quarto quesito (necessità di mantenere PTA e CTA), i PTA, nati prima dei PTR come strumenti informativi per i clinici e di governo dei farmaci in ambito ospedaliero, hanno sollevato un acceso dibattito, da cui è scaturita una convergenza verso una visione comune sul loro ruolo e sulle rispettive CTA:
- i PTA rappresentano la lista dei farmaci disponibili per la prescrizione in ospedale e rappresentano l’applicazione locale delle gare regionali;
- i PTA consentono di escludere i farmaci per i quali non esistono specialità cliniche di riferimento;
- qualora i PTR non siano vincolanti, i PTA sono anche uno strumento per rendere accessibile immediatamente il farmaco, se ci sono dei ritardi a livello regionale. Se, invece, il PTR è vincolante, l’inserimento nei PTA non è possibile fino a quanto il farmaco non è inserito nei PTR e l’uso da parte dei clinici può avvenire solo su base personalizzata e motivata;
- le CTA possono essere utili per le proprie azioni di governo aziendale.
Il GdL non ha invece raggiunto una piena convergenza su un’osservazione, supportata soprattutto da farmacisti ospedalieri e dei Servizi Farmaceutici Regionali, per cui i PTA non possono essere eliminati perché non è possibile per un ospedale tenere in magazzino tutti i principi attivi e le specialità in commercio.
Con riferimento all’ultimo quesito (opportunità di trasmettere informazioni da AIFA alle regioni), si è raccomandato in primo luogo di anticipare il più possibile la trasmissione delle informazioni rilevanti per gli acquisti, per esempio la dimensione della popolazione target e le quote di mercato previste per la definizione del fabbisogno a livello regionale, informazione che potrebbe essere già inserita nel Dossier di P&R e che potrebbe essere modificata a seguito di una revisione da parte di AIFA o di condizioni più restrittive alla rimborsabilità. Il dato regionale potrebbe essere poi articolato, in collaborazione con le imprese, in fabbisogno per ciascuna azienda sanitaria. Oltre alla dimensione della popolazione target e della scelta di richiedere una selezione dei centri (e dei professionisti) prescrittori (cfr. supra), per le regioni sarebbe utile avere preliminarmente:
- le valutazioni sull’innovatività del farmaco;
- le schede sintetiche di HTA degli uffici AIFA da integrare con eventuali modifiche a seguito di una rivalutazione delle commissioni attuali (Commissione Tecnico-Scientifica/Comitato Prezzi-Rimborso) e che contengano, per tutti i farmaci per le quali è prevista la Tipologia Negoziale 1 (nuovo principio attivo, farmaco orfano, estensione delle indicazioni terapeutiche di farmaco originatore, riclassificazione di confezione autorizzata in classe C su istanza di parte), la valutazione e il ranking di unmet need e valore terapeutico aggiunto;
- le valutazioni comparative di costo;
- le analisi di impatto sulla spesa.
Il dibattito ha fatto emergere anche quesiti non affrontati in modo specifico dalla survey, come il ruolo di CTR/PTR nella valutazione di farmaci in Fascia C. Tali quesiti non sono stati affrontati in quanto la survey si è focalizzata sui farmaci rimborsabili (Fascia A/H).
| Quesiti | Esito della discussione del GdL |
|---|---|
1) Sono ancora necessari i PTR? |
No, è invece importante un’azione di governo dell’ingresso dei farmaci a livello regionale. |
2) Qual è il ruolo dei PTR rispetto al processo di accesso e, in particolare, alle gare? |
Rappresentano uno degli step di accesso, ma non necessariamente quello più impattante; di notevole importanza, laddove prevista, è l’individuazione dei centri prescrittori. |
3) Sono ancora necessarie le CTR? |
Sì, in termini generali è necessario un soggetto regionale che governi l’accesso al farmaco e il comportamento prescrittivo. |
4) Sono ancora necessarie le commissioni Terapeutiche Aziendali (CTA)? Se sì, quali funzioni dovrebbero avere e che significato ha il PTA? |
Sì, possono essere utili per le proprie azioni di governo aziendale. I PTA rappresentano l’applicazione locale delle gare regionali, consentono di escludere i farmaci per i quali non esistono specialità cliniche di riferimento e possono avere la funzione di rendere accessibile immediatamente il farmaco. |
5) Le valutazioni di AIFA dovrebbero essere rese disponibili alle regioni? Se sì, quali informazioni minime dovrebbero contenere per essere utili alle regioni? |
Sì, con le seguenti informazioni: valutazioni di innovatività, schede sintetiche di HTA, valutazioni comparative di costo e analisi di impatto sulla spesa regionale. |
Conclusioni
Il presente contributo ha analizzato lo stato attuale di PTR e CTR in Italia e illustra un set di suggerimenti/raccomandazioni emersi nell’ambito di un Gruppo di Lavoro che ha visto il coinvolgimento di soggetti istituzionali (AIFA, regioni e aziende sanitarie), ricercatori e stakeholder di riferimento (imprese farmaceutiche, clinici, associazioni di pazienti).
Il tema è molto rilevante nel dibattito attuale sulla politica del farmaco in quanto da una parte i PTR rappresentano uno degli strumenti di governo dell’assistenza farmaceutica a livello regionale e dall’altra sono stati spesso rappresentati come una fonte di iniquità nell’accesso ai farmaci, soprattutto per i tempi molto diversi di inserimento dei farmaci nei PTR.
Il Gruppo di Lavoro ha affrontato diversi aspetti, dall’opportunità di mantenere o meno i PTR e dal loro futuro ruolo al rapporto tra CTA e CTR, fino ai flussi informativi tra AIFA e regioni per gestire al meglio l’ingresso dei nuovi farmaci. In termini generali, il Gruppo di Lavoro ha auspicato: (i) il superamento dei PTR, intesi come lista selettiva dei farmaci messi a disposizione nei SSR; (ii) una prioritizzazione dell’attività delle CTR nell’attivazione delle condizioni di accesso dei farmaci, nella verifica delle condizioni abilitanti l’accesso e nel governo del comportamento prescrittivo; (iii) un rafforzamento e un’anticipazione di informazioni da AIFA alle regioni affinché le stesse gestiscano per tempo e in modo ottimale l’accesso a livello locale.
Il rafforzamento del flusso informativo tra AIFA e Regioni può anche avere come effetto una maggiore attenzione all’integrazione tra evidenze sulla coerenza tra costo ed efficacia di un farmaco rispetto ad alternative terapeutiche (value for money) (la costo-efficacia è in linea di principio richiesta a livello centrale per tutti i nuovi farmaci e indicazioni) e impatto finanziario (sostenibilità della spesa). Per quanto la coerenza tra costo ed efficacia incrementale presidi maggiormente le scelte a livello centrale su prezzi e rimborsabilità, le azioni di governo regionale non dovrebbero comunque prescindere da questo valore.
L’auspicio è che il quadro qui presentato e i suggerimenti/raccomandazioni rappresentino un utile spunto di riflessione nei luoghi istituzionali preposti al confronto Stato-Regioni (Conferenza Stato-Regioni) e di decisione legislativa ed esecutiva in ambito politico (Parlamento e Governo).
Acknowledgements
Un ringraziamento a tutto il team di Dephaforum e, in particolare, a Massimo Medaglia, per l’organizzazione del Forum sulle politiche farmaceutiche regionali. Si ringraziano tutti i partecipanti al Gruppo di Lavoro sui Prontuari Regionali, che, nell’ambito del Forum, hanno condiviso le raccomandazioni qui presentate (Francesco Berardo, Seagen; Renato Bernardini, AIFA; Giovanni Maria Bizzozero, Servier; Luca Bolognese, Astra Zeneca; Enrico Boscato, Alexion; Elisabetta Brioschi, Daichii Sankyio; Mascia Bufarale, Galapagos; Pasquale Cananzi, Regione Sicilia; Chiara Cernetti, Beigene; Marzia Colani, Bayer; Alberto Costantini, ASL Pescara; Alessandro D’Arpino, Azienda Ospedaliera di Perugia; Luca Del Monaco, Roche; Filippo Drago, Università di Catania; Alessandra Falcone, Advanced Accelerator Applications (Novartis); Moreno Griggio, UCB; Alessandro Mantineo, Novo Nordisk; Francesco Mazza, Farmindustria; Alessandro Monti, Chiesi; Gianni Pampaloni, Eli Lilly; Francesco Pavone, Biogen; Emanuele Pria, Gilead; Francesca Patarnello, Astra Zeneca; Stefania Pulimeno, Teva; Paola Rossi, Regione Friuli Venezia Giulia; Riccardo Samele, GSK; Paolo Serra, Azienda Ospedaliera Brotzu Cagliari; Daniela Settesoldi, AIFA; Flavio Spezia, Almirall; Cristian Stefenoni, Pfizer).
Si ringraziano Laura Poggi (Regione Piemonte), Claudio Perratone (Regione Valle d’Aosta), Barbara Rebesco (Regione Liguria), Ida Fortino (Regione Lombardia), Horand Meier (Provincia Autonoma di Bolzano-Alto Adige), Paola Rossi (Regione Friuli-Venezia Giulia), Francesco Attanasio (Regione Toscana), Mariangela Rossi (Regione Umbria), Luigi Patregnani (Regione Marche), Lorella Lombardozzi (Regione Lazio), Ugo Trama (Regione Campania), Antonella Lavalle (Regione Molise), Rosalia Puzo (Regione Basilicata), Paolo Stella (Regione Puglia), Iole Fantozzi (Regione Calabria), Pasquale Cananzi (Regione Sicilia), Donatella Garau (Regione Sardegna). Per la Regione Veneto e la Regione Emilia-Romagna la compilazione è stata curata dai co-Autori regionali del presente contributo. Non hanno risposto al questionario la Provincia Autonoma di Trento e la Regione Abruzzo.
Disclosures
Conflict of interest: CJ was an advisory board member and a paid speaker for AbbVie, Amgen, AstraZeneca, Bristol Myers Squibb, CSL Behring, Gilead, Incyte, Merck Sharp & Dohme, Roche, Sanofi, Takeda, outside the submitted work. FB is an employee of Ipsen. AB, LP, ES and GS have no conflict of interest to declare.
Financial support: This study received no grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Jommi C, Pippo L, Bortolami A et al. Il governo dell’assistenza farmaceutica in Italia: il ruolo di Stato e Regioni. Politiche sanitarie. Anno 2021, Vol. 22, N. 3: 117-124. Online (Accessed July 2023).
- 2. De Rosa M, Messori A, Scroccaro G. Il sistema dei prontuari in Italia 2. Aboutpharma Srl; 2010.
- 3. Prada M, Ruggeri M, Sansone C, et al. Timeline of authorization and reimbursement for oncology drugs in Italy in the last 3 years, Medicine Access @. Point Care. 2017;1(1):e29-e36.
- 4. Russo P, Mennini FS, Siviero PD, Rasi G. Time to market and patient access to new oncology products in Italy: a multistep pathway from European context to regional health care providers. Ann Oncol. 2010;21(10):2081-2087. CrossRef PubMed
- 5. Mantuano M, Daniel F, Urbinati D. Regional time to market of innovative drugs in Italy. PHP70. Value Health. 2016;19(7):451. CrossRef
- 6. Pizzimenti V, Formica D, Sultana J, et al. Access of medicines to the market: three years’ experience of Sicily’s regional drug formulary. Gazz Med Ital- Arch Sci Med. 2020;179(5):317-325. CrossRef
- 7. Nicolucci A, Caputi A. Difformità regionali di accesso ai nuovi farmaci per il diabete a distribuzione territoriale. JAMD. 2021;24(4):257-263. CrossRef
- 8. Jommi C, Costa E, Michelon A, Pisacane M, Scroccaro G. Multi-tier drugs assessment in a decentralised health care system. The Italian case-study. Health Policy. 2013;112(3):241-247. CrossRef PubMed
- 9. Prada M, Rossi L, Molchanova E, Mariano EE. Italian regional access for drugs: 20 regions vs 21 procedures. PNS59. Value Health. 2020;23:S653. CrossRef
- 11. Urbinati D, Cioni L, Tucci C. Centralization and complexity of drug market access process across Italian Regions. PHP157. Value Health. 2017;20(9):679. CrossRef
- 11. ISTAT. Popolazione residente al 1/1/2023 Online, (Accessed July 2023).