 |
Glob Reg Health Technol Assess 2024; 11: 55-67 ISSN 2283-5733 | DOI: 10.33393/grhta.2024.2658 ORIGINAL RESEARCH ARTICLE |
 |
Costo per Number Needed to Treat (NNT) di upadacitinib nel trattamento dei pazienti bio-exposed con rettocolite ulcerosa attiva da moderata a grave
Cost per Number Needed to Treat (NNT) for upadacitinib in the treatment of bio-exposed patients with moderately-severely active ulcerative rectocolitis
Background: Only limited information is available on cost efficacy of the advanced therapies for the treatment of ulcerative rectocolitis. We evaluated the efficacy and the treatment costs of these advanced therapies in the treatment of bio-exposed (primary failure to a biological agent) patients with moderately to severely active ulcerative rectocolitis.
Methods: Data from a previous network meta-analysis (NMA) in the treatment of bio-exposed patients with moderately to severely active ulcerative rectocolitis was used. The analysis involved three therapies approved in Italy for the treatment of moderately to severely active ulcerative rectocolitis: upadacitinib (UPA), ustekinumab (UST) and vedolizumab (VDZ). According to the NMA results, the analysis was conducted considering two different timepoints: induction and maintenance. The pharmacoeconomic comparison between advanced therapies was carried out to estimate the respective cost for the NNT (Number Needed to Treat) compared to placebo using the clinical response (CRes) for the induction and clinical remission (CRem) and endoscopic improvement (EI) for the maintenance. Only the ex-factory price of each advanced therapy was considered. The cost per NNT was adopted as a cost-effectiveness indicator.
Results: Independently of the timepoint considered (induction or maintenance) and the clinical (CRem and CRes) or endoscopic endpoint (EI) evaluated, UPA had always the lower cost per NNT than UST and VDZ. For example, considering the induction and the CRes, the cost per NNT for upadacitinib (45 mg) was € 7,862.07 compared to € 30,459.38 for ustekinumab (6 mg/kg) and to € 67,868.00 for vedolizumab.
Conclusion: Upadacitinib is a cost-effective therapeutic option compared to ustekinumab and vedolizumab in the treatment of bio-exposed patients with moderately to severely active ulcerative rectocolitis.
Keywords: Bio-exposed, Cost per NNT, Italian NHS, Ulcerative rectocolitis, Upadacitinib
Received: September 8, 2023
Accepted: February 14, 2024
Published online: March 7, 2024
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La rettocolite ulcerosa (Ulcerative Rectocolitis, RCU) è una malattia infiammatoria cronica intestinale che colpisce la mucosa dell’intestino crasso interessando primitivamente il retto, fino ad arrivare a coinvolgere parzialmente o totalmente il colon (1). Le manifestazioni cliniche della RCU includono diarrea ematica, urgenza defecatoria, tenesmo, dolore addominale, malessere, perdita di peso e febbre (2). La RCU si presenta con maggiore frequenza tra la terza e la quinta decade di vita, con un’incidenza globale che varia da 9 a 20 casi ogni 100.000 individui all’anno (con tassi più elevati in Nord America e in Europa settentrionale) (3). Spesso è associata a una compromissione della qualità di vita correlata alla salute e a un notevole onere economico per il Sistema Sanitario Nazionale e per il paziente (4,5). La rapida risoluzione dei sintomi e il mantenimento nel lungo periodo della risposta clinica o della remissione sono target terapeutici fondamentali per tutti i pazienti affetti da RCU (6,7). Inoltre, la guarigione dell’infiammazione mucosale rappresenta un importante goal della terapia ed è associata a migliori traguardi a lungo termine come riduzione dei tassi di ospedalizzazione e di intervento chirurgico (8,9).
Sebbene, attualmente, non ci sia una cura definitiva per la RCU, sono comunque disponibili diversi farmaci che consentono un controllo prolungato dei sintomi e una normalizzazione della qualità di vita dei pazienti. In quest’ottica diviene, quindi, fondamentale indentificare una strategia terapeutica in grado di raggiungere una veloce risposta clinica nella fase iniziale (induzione) e una prolungata remissione libera da corticosteroidi nella successiva fase di mantenimento.
Negli anni, il panorama terapeutico per la gestione della RCU con attività da moderata a grave è progredito significativamente. I farmaci biologici, a partire da quelli neutralizzanti il TNF (anti-Tumor Necrosis Factor), quali infliximab (IFX), adalimumab (ADA) e golimumab (GOL), seguiti da quelli con differenti meccanismi d’azione quali vedolizumab (VDZ) e ustekinumab (UST), hanno rappresentato delle pietre miliari nel trattamento della RCU. Vedolizumab è un anticorpo monoclonale anti-integrina α4β7 con azione selettiva sul traffico linfocitario intestinale (10), mentre ustekinumab è un anticorpo monoclonale IgG1κ interamente umano che si lega specificamente alla subunità proteica p40 condivisa dalle citochine IL-12 e IL-23, neutralizzandole (11). Entrambe le molecole sono indicate per il trattamento di pazienti adulti con RCU con attività da moderata a grave che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o a una terapia biologica oppure che presentano controindicazioni mediche a tali terapie (10,11).
Nonostante i molteplici progressi, permangono numerosi bisogni terapeutici relativi al trattamento della RCU con attività da moderata a grave, tra cui la mancata risposta primaria e la perdita di risposta secondaria. Infatti, circa il 30-40% dei pazienti trattati con farmaci biologici non risponde alla terapia e una quota variabile, a seconda del farmaco utilizzato, perderà nel tempo la risposta inizialmente ottenuta. La perdita di risposta, soprattutto nel caso di farmaci anti-TNF, si ritiene sia dovuta alla produzione di anticorpi anti-farmaco con la progressiva neutralizzazione del farmaco somministrato e la manifestazione di eventi avversi. Inoltre, la somministrazione endovenosa dei farmaci impiega risorse ospedaliere, mentre l’autosomministrazione sottocutanea può porre dei problemi di aderenza alla terapia (12).
Con l’obiettivo di superare queste limitazioni, è cresciuto l’interesse per gli Small Molecule Drugs (SMD), farmaci che possono essere somministrati per via orale e che non inducono immunogenicità (13). Tra questi, upadacitinib (UPA) ha recentemente ottenuto la rimborsabilità in Italia nel trattamento di pazienti adulti affetti da RCU con attività da moderata a grave che hanno avuto una risposta inadeguata, hanno perso la risposta o sono risultati intolleranti alla terapia convenzionale o con farmaci biologici. UPA è un inibitore selettivo e reversibile delle Janus chinasi (Janus Kinases, JAK) (14). Le JAK sono enzimi intracellulari che trasmettono segnali di citochine o di fattori di crescita coinvolti in una vasta gamma di processi cellulari, tra cui le risposte infiammatorie, l’emopoiesi e la sorveglianza immunitaria (14). L’efficacia e la sicurezza di UPA è stata valutata attraverso la conduzione di un ampio programma clinico. Gli studi U-ACCOMPLISH (15) e U-ACHIEVE (16) sono stati entrambi disegnati per valutare l’efficacia e la sicurezza di upadacitinib 45 mg (somministrato una volta al giorno), rispetto al placebo, nel trattamento di induzione in pazienti con RCU attiva da moderata a grave con risposta inadeguata, perdita di risposta o intolleranza agli aminosalicilati, agli immunosoppressori, ai corticosteroidi o alle terapie biologiche. Oltre all’induzione, lo studio U-ACHIEVE (16) ha valutato anche il raggiungimento della remissione clinica (secondo il punteggio Mayo adattato) di UPA 15 mg e 30 mg (somministrati una volta al giorno) rispetto al placebo nel trattamento di mantenimento in pazienti con una risposta clinica (secondo il punteggio Mayo adattato) dopo il trattamento di induzione (studio U-ACHIEVE o studio U-ACCOMPLISH). Attualmente è inoltre in corso lo studio di estensione a lungo termine U-ACTIVATE (M14-533) (17) che fornirà risultati di efficacia e sicurezza durante un periodo di follow-up inferiore o uguale a 288 settimane. In entrambi gli studi di induzione (15,16), UPA 45 mg ha determinato un miglioramento significativo nell’endpoint primario (remissione clinica all’ottava settimana) rispetto al placebo: i) U-ACHIEVE 26% upadacitinib vs 5% placebo (IC 95%, differenza di trattamento aggiustata 21,6% [15,8%-27,4%], p < 0,0001); ii) U-ACCOMPLISH 33% upadacitinib vs 4% placebo (IC 95%, differenza di trattamento aggiustata 29,0% [23,2%-34,7%], p < 0,0001). Nella fase di mantenimento dello studio U-ACHIEVE il 52% e il 42% dei pazienti trattati rispettivamente con UPA 30 mg e UPA 15 mg hanno raggiunto la remissione clinica alla settimana 52 rispetto al 12% dei pazienti trattati con placebo (p < 0,0001) (16).
Obiettivo
All’interno del sistema salute, dove uno dei principali obiettivi è rappresentato dall’efficientamento della spesa farmaceutica, la presenza per la stessa indicazione di farmaci con differenti meccanismi d’azione, con efficacia variabile e con differenti costi di trattamento, determina, sia per il clinico che per il decisore, la necessità di disporre di confronti che soppesino per ogni alternativa vantaggi clinici e costi associati. Per colmare almeno in parte questa lacuna, è stata condotta un’analisi economica per stimare il costo sostenuto per il raggiungimento di uno specifico obiettivo terapeutico. A tale fine l’analisi è stata effettuata utilizzando il costo per Number Needed to Treat (NNT) di upadacitinib rispetto a vedolizumab e a ustekinumab per diversi obiettivi terapeutici in pazienti con diagnosi di RCU con attività da moderata a grave dopo fallimento di una precedente terapia biologica.
Metodi
Premessa
L’analisi del costo per NNT è stata condotta considerando la prospettiva del Servizio Sanitario Nazionale (SSN) tramite lo sviluppo di un modello ad hoc in ambiente Microsoft Excel®. Il costo totale del trattamento farmacologico è stato calcolato in riferimento a due differenti orizzonti temporali (timepoint): il periodo di induzione e il periodo di mantenimento. L’efficacia dei trattamenti farmacologici è stata valutata considerando la risposta clinica (Clinical Response, CResp) per il periodo di induzione e la remissione clinica (Clinical Remission, CRem) e il miglioramento endoscopico (Endoscopic Improvement, EI) per il periodo di mantenimento. Dal momento che nel trattamento della RCU l’efficacia nel breve termine è principalmente volta a indagare la capacità di un farmaco di ridurre la sintomatologia della malattia, si è ritenuto più opportuno valutare, quale endpoint, la sola risposta clinica in riferimento al periodo di induzione, mentre la remissione clinica e il miglioramento endoscopico, essendo endpoint finalizzati a indagare nel medio-lungo periodo l’assenza di sintomi e dell’attività infiammatoria della RCU, sono stati valutati in riferimento al solo periodo di mantenimento.
Popolazione
In accordo con l’obiettivo dell’analisi economica è stata considerata una popolazione costituita da soggetti adulti con RCU attiva da moderata a grave dopo fallimento di una precedente terapia biologica (pazienti bio-exposed).
Trattamenti considerati
Considerando che, sulla base di recenti stime di mercato (18), circa il 70% della popolazione con RCU con attività da moderata a grave bio-exposed viene trattata in Italia con UST o VDZ, questi ultimi, nella presente analisi, sono stati considerati quali trattamenti alternativi a UPA nel calcolo del costo per NNT.
Dati clinici
Gli endpoint clinici (CRem, CResp) ed endoscopici (EI) considerati nella presente valutazione economica riflettono i risultati di una recente network meta-analysis (NMA), condotta da Panaccione et al. (19) con lo scopo di valutare l’efficacia e la sicurezza durante i periodi di induzione e di mantenimento dei trattamenti farmacologici utilizzati nella gestione della RCU con attività da moderata a grave. La NMA, le cui principali caratteristiche sono riportate nella Tabella 1, ha valutato gli endpoint in riferimento a due popolazioni, una bio-naïve e una bio-exposed. Gli esiti clinici sono stati valutati considerando il Full Mayo Score (FMS) (20). Il FMS è costituito da 4 parametri (frequenza delle evacuazioni, SFS, sanguinamento rettale, RBS, valutazione globale del medico, PGA, e valutazione endoscopica, EMS per Endoscopic Mayo Score), ciascuno dei quali ha un sotto-punteggio che varia da 0 a 3. Il punteggio complessivo del FMS va da 0 a 12 con i punteggi più alti che indicano una maggiore gravità della malattia (20). La CResp è stata definita a fronte di una diminuzione dal basale del FMS ≥ 3 punti e ≥ 30%, accompagnata da una diminuzione del RBS ≥ 1 punto o da un RBS assoluto ≤ 1, la CRem è stata definita alla luce di un FMS ≤ 2 con nessun sotto-punteggio > 1, mentre l’EI è stato definito a fronte di un EMS ≤ 1.
Ciò premesso, focalizzando l’attenzione sugli endpoint (CRem, CResp ed EI), sui trattamenti (UPA, VDZ e UST) e sulla popolazione (pazienti bio-exposed) di interesse per la presente analisi, la Tabella 2 restituisce i risultati della NMA per il periodo di induzione e di mantenimento. Per ciascun trattamento, distinto per endpoint, nella Tabella 2 sono riportati l’Odds Ratio (OR) rispetto al placebo, il tasso assoluto per esito clinico e l’indice dell’analisi dell’area sotto la curva del ranking cumulativo (surface under the cumulative ranking curve, SUCRA). Quest’ultimo corrisponde a una presentazione numerica di un ranking generale riferito a tutti i trattamenti considerati nella NMA, in cui a ciascun trattamento viene associato un valore compreso tra lo 0% e il 100% (21). Quanto più alto è il valore SUCRA e quanto più si avvicina al 100%, tanto maggiore è la probabilità che un trattamento si trovi nella prima posizione o in una delle prime posizioni del ranking (21). Viceversa, quanto più vicino a 0 è il valore SUCRA, tanto più probabile è che un trattamento si trovi nell’ultima posizione o in una delle ultime posizioni del ranking (21).
| Elementi | Descrizione |
|---|---|
| Disegno degli studi e numero | La NMA ha considerato solo studi randomizzati di fase II/III, in doppio-cieco. Nello specifico sono stati considerati in totale 23 articoli, di cui 18 hanno fornito i dati per il periodo di induzione e 14 per il periodo di mantenimento. |
| Popolazione | Soggetti adulti (età ≥ 16 anni) con CU da moderata a grave. I 23 articoli hanno raccolto informazioni per un totale di 7.964 pazienti con un’età media compresa nel range 34,3-44,4 anni, una prevalenza dei maschi compresa nel range 49-73% e una storia di malattia compresa nel range 3,7-10,2 anni. |
| Endpoint | Risposta clinica, remissione clinica, miglioramento endoscopico. |
| Popolazione bio-naïve | La NMA per il periodo di induzione comprende 12 trattamenti, 5.080 pazienti e 66 possibili confronti a coppie. La NMA per il periodo di mantenimento comprende 17 trattamenti (14 per il miglioramento endoscopico), 2.648 pazienti (2.579 per la risposta clinica e 2.230 per il miglioramento endoscopico) e 136 possibili confronti a coppie (91 per il miglioramento endoscopico). |
| Popolazione bio-exposed | La NMA per il periodo di induzione comprende 9 trattamenti, 2.839 pazienti (2.823 per risposta clinica e miglioramento endoscopico) e 36 possibili confronti a coppie. La NMA per il periodo di mantenimento comprende 13 trattamenti (12 per il miglioramento endoscopico), 1.405 pazienti (1.348 per la risposta clinica e 1.283 per il miglioramento endoscopico) e 78 possibili confronti a coppie (66 per il miglioramento endoscopico). |
Considerando la fase di induzione, rispetto a UST 6 mg/kg e a VDZ 300 mg, UPA 45 mg somministrato una volta al giorno (QD) determina per tutti e tre gli endpoint la maggiore efficacia espressa in termini di tasso assoluto per esito clinico, di OR rispetto al placebo e di punteggio SUCRA (Tab. 2). Anche nella fase di mantenimento, rispetto a UST 90 mg ogni 8 settimane (Q8W) e a VDZ 300 mg ogni 8 settimane (Q8W), i due dosaggi di UPA, 15 mg QD e 30 mg QD, mostrano per tutti e tre gli endpoint la maggiore efficacia espressa in termini di tasso assoluto per esito clinico, di OR rispetto al placebo e di punteggio SUCRA (Tab. 2).
| Fase di trattamento | Trattamento | Risposta clinica | Remissione clinica | Miglioramento endoscopico | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| OR (vs PBO) | Tasso assoluto | SUCRA | OR (vs PBO) | Tasso assoluto | SUCRA | OR (vs PBO) | Tasso assoluto | SUCRA | ||
| Induzione (6-10 settimane post-baseline) | Upadacitinib 45 mg QD | 13,6 | 79% (60%-90%) | 99% | 9,8 | 18% (6%-45%) | 97% | 15,1 | 61% (33%-85%) | 99% |
| Ustekinumab 6 mg/kg | 3,6 | 49% (26%-72%) | 62% | 5,9 | 12% (3%-35%) | 77% | 3,7 | 28% (11%-56%) | 72% | |
| Vedolizumab 300 mg | 1,6 | 30% (14%-53%) | 24% | 3,2 | 7% (2%-20%) | 45% | 1,2 | 11% (4%-26%) | 25% | |
| PBO | 1,0 | 21% (12%-34%) | 4% | 1,0 | 2% (1%-6%) | 2% | 1,0 | 9% (5%-18%) | 12% | |
| Mantenimento
(42-54 settimane dopo risposta induzione) |
Upadacitinib 30 mg QD | 12,1 | 78% (54%-91%) | 93% | 19,4 | 66% (35%-90%) | 93% | 14,6 | 70% (42%-90%) | 93% |
| Upadacitinib 15 mg QD | 7,4 | 68% (42%-86%) | 76% | 15,4 | 61% (30%-87%) | 87% | 9,5 | 61% (32%-85%) | 81% | |
| Vedolizumab 300 mg Q8W | 4,3 | 55% (30%-79%) | 55% | 8,2 | 45% (21%-75%) | 74% | 7,1 | 53% (26%-80%) | 73% | |
| Ustekinumab 90 mg Q8W | 3,0 | 46% (24%-69%) | 37% | 3,2 | 24% (10%-48%) | 39% | 2,8 | 31% (14%-57%) | 41% | |
| PBO | 1,0 | 22% (15%-31%) | 1% | 1,0 | 9% (6%-14%) | 2% | 1,0 | 14% (9%-22%) | 5% | |
PBO = placebo; SUCRA = surface under the cumulative ranking curve; OR = odds ratio; QD = una volta al giorno; Q8W = ogni 8 settimane.
Orizzonte temporale
Come citato, il costo totale del trattamento farmacologico è stato calcolato in riferimento a due differenti timepoint: il periodo di induzione e il periodo di mantenimento. Sulla base dei rispettivi riassunti delle caratteristiche di prodotto (RCP) (10,11,14), si è assunto che ciascun trattamento completi la propria fase di induzione lungo un arco temporale di 8 settimane. Differentemente, per la fase di mantenimento è stato considerato un orizzonte temporale di 52 settimane, assumendo che i dati di efficacia stimati dalla NMA (range 42-54 settimane dalla risposta dopo la fase di induzione) siano comparabili all’anno (19).
Schema di somministrazione
Alla luce di quanto indicato dai corrispondenti RCP (10,11,14), le Tabelle 3 e 4 riportano, rispettivamente, lo schema posologico e il numero di somministrazioni di UPA, VDZ e UST adottati nella fase di induzione e di mantenimento. Nello specifico, per la fase di induzione di UPA, è stato considerato un dosaggio di 45 mg QD, mentre, per il mantenimento, sono stati considerati entrambi gli schemi posologici rimborsati che prevedono la somministrazione di 15 mg QD o di 30 mg QD (Tab. 3) (14). Dal momento che è peso-dipendente, la dose di 390 mg somministrata per via endovenosa (IV) di UST durante l’induzione (11) è stata calcolata facendo riferimento a un paziente standard con un peso medio corporeo di 70 kg (22), mentre, nel mantenimento, è stato considerato lo schema posologico più utilizzato nella pratica clinica che prevede la somministrazione sottocute (SC) di UST 90 mg QW8 (11,18,23,24). Per vedolizumab, nella fase di induzione, è stata considerata la dose raccomandata di 300 mg somministrata mediante infusione endovenosa alle settimane 0, 2 e 6, mentre, nella fase di mantenimento, è stata considerata una dose raccomandata di 300 mg somministrata mediante infusione endovenosa ogni Q8W (10), anche se, nella pratica clinica, circa il 20-25% dei pazienti ricorre a una somministrazione ogni 4 settimane (Q4W) (25,26).
| Molecola | Posologia | Numero di somministrazioni |
|---|---|---|
| Upadacitinib 45 mg | Dose di 45 mg una volta al giorno per 8 settimane | 56 |
| Ustekinumab 6 mg/kg | Dose raccomandata di 390 mg per via endovenosa* | 1 |
| Vedolizumab 300 mg | Dose raccomandata di 300 mg da somministrare mediante infusione endovenosa a zero, due e sei settimane | 3 |
*La dose di 390 mg somministrata per via endovenosa è stata calcolata facendo riferimento a un paziente standard con un peso medio corporeo di 70 kg.
| Molecola | Posologia | Numero di somministrazioni |
|---|---|---|
| Upadacitinib 15 mg | Dose di 15 mg una volta al giorno per 52 settimane | 52 |
| Upadacitinib 30 mg | Dose di 30 mg una volta al giorno per 52 settimane | 52 |
| Ustekinumab 90 mg/kg | Dose raccomandata di 90 mg da somministrare per via sottocutanea ogni 8 settimane* | 7 |
| Vedolizumab 300 mg | Dose raccomandata di 300 mg da somministrare mediante infusione endovenosa ogni 8 settimane (ogni 4 settimane in caso di riduzione della risposta) | 7 |
*Schema posologico utilizzato nella pratica clinica e adottato nella presente valutazione economica (20,21).
Infine, per ciascun farmaco è stata considerata un’aderenza al trattamento del 100%.
Number Needed to Treat
Il costo per NNT è stato calcolato stimando il NNT di UPA, UST e VDZ rispetto al placebo per la fase sia di induzione che di mantenimento. Il NNT rappresenta il numero di pazienti da trattare per ottenere un beneficio terapeutico. Esso rappresenta quindi il numero di pazienti che è necessario trattare con UPA, UST o VEZ (gruppo sperimentale) rispetto al placebo (gruppo di controllo) per ottenere un beneficio terapeutico addizionale (CResp, CRem o IE). Il NNT corrisponde al reciproco della riduzione del rischio assoluto (ARR), dove quest’ultima corrisponde alla differenza dell’incidenza dell’evento tra gruppo sperimentale (experimental event rate, EER), intesa come efficacia (CResp, CRem o IE) di UPA, UST o VDZ, e gruppo di controllo (control event rate, CER), intesa come efficacia (CResp, CRem o IE) del gruppo placebo. Quanto più il valore di NNT si avvicina a 1, tanto più l’esito è favorevole.
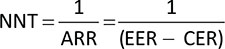
Moltiplicando, infine, tale indicatore (NNT) per il relativo costo medio di trattamento, si ottiene il costo per NNT associato a ciascuno dei tre farmaci considerati in relazione ai due timepoint selezionati (induzione e mantenimento).
Costo di acquisto dei farmaci
La valorizzazione dei consumi di UST e VDZ è stata fatta considerando i rispettivi prezzi ex-factory al netto degli sconti temporanei di legge (–5% più un secondo –5%) (27), ma al lordo di eventuali sconti confidenziali o di scontistiche applicate in sede di gara regionale (Tab. 5). La valorizzazione dei consumi di UPA è stata fatta considerando il prezzo ex-factory al netto di uno solo dei due sconti temporanei di legge (–5%) (27), poiché l’azienda titolare dell’AIC (Autorizzazione all’Immissione in Commercio) ha aderito all’istituto del pay-back 5% relativo alla spesa farmaceutica, che consente all’azienda farmaceutica di chiedere all’AIFA (Agenzia Italiana del Farmaco) la sospensione della riduzione del prezzo del 5% per le specialità medicinali di cui è titolare dietro versamento (pay-back) del relativo controvalore su appositi conti correnti indicati dalle Regioni (28) (Tab. 5). Il costo di trattamento associato alla fase di induzione è di € 4.560,00 per UPA 45 mg QD, di € 8.528,63 per UST 6 mg/kg e di € 6.108,12 per VDZ 300. Il costo di trattamento associato alla fase di mantenimento è di € 9.880,00 per UPA 15 mg QD, di € 19.760,00 per UPA 30 mg QD, di € 19.900,13 per UST 90 mg Q8W e, infine, di € 14.252,28 per VDZ 300 mg Q8W.
Altri costi sanitari
Nella valutazione economica non è stato incluso alcun costo per la gestione degli eventi avversi gravi, poiché, alla luce dei profili di sicurezza riportati nella NMA non sono emerse differenze significative dei trattamenti rispetto al placebo (19).
Sebbene i farmaci siano caratterizzati da differenti vie di somministrazione (orale, sottocute ed endovenosa), in via conservativa, non è stato considerato alcun costo a carico del SSN per l’erogazione di tale attività. Si è così assunto che la gestione dell’attività di somministrazione non determini significative differenze tra i costi di trattamento delle alternative considerate.
| Trattamento | Confezione | Prezzo ex-factory lordo | Prezzo ex-factory netto* | Costo per unità | Costo per “mg” | |
|---|---|---|---|---|---|---|
| Upadacitinib 15 mg | 28,0 compresse | 15,0 mg | € 800,00 | € 760,00 | € 27,14 | € 1,81 |
| Upadacitinib 30 mg | 28,0 compresse | 30,0 mg | € 1.600,00 | € 1.520,00 | € 54,29 | € 1,81 |
| Upadacitinib 45 mg | 28,0 compresse | 45,0 mg | € 2.400,00 | € 2.280,00 | € 81,43 | € 1,81 |
| Ustekinumab 130 mg | 1,0 flaconcino | 130,0 mg | € 3.150,00 | € 2.842,88 | € 2.842,88 | € 21,87 |
| Ustekinumab 90 mg | 1,0 flaconcino | 90,0 mg | € 3.150,00 | € 2.842,88 | € 2.842,88 | € 31,59 |
| Vedolizumab 300 mg | 1,0 flaconcino | 300,0 mg | € 2.256,00 | € 2.036,04 | € 2.036,04 | € 6,79 |
*Al netto delle sole riduzioni obbligatorie di legge.
Infine, si è ritenuto opportuno non valorizzare l’attività di monitoraggio dei farmaci somministrati in quanto in letteratura non sono presenti analisi economiche che, nel trattamento della RCU con attività da moderata a grave, abbiano stimato consumi e costi associati, differenziando per via di somministrazione o per molecola.
Analisi di sensibilità
Per valutare la solidità dei risultati della presente analisi economica in risposta a scostamenti che nella realtà potrebbero verificarsi rispetto ai valori dei parametri utilizzati nel caso base sono state condotte un’analisi di sensibilità deterministica (deterministic sensitivity analysis, DSA) e un’analisi di scenario.
Rispetto agli endpoint risposta clinica, remissione clinica e miglioramento endoscopico, l’analisi di sensibilità deterministica ha ricalcolato il costo per NNT di ciascun farmaco considerando due ipotesi alternative al caso base. Nella prima il costo per NNT di ciascun farmaco è stato calcolato considerando per ogni endpoint il corrispettivo estremo inferiore degli intervalli di confidenza riportati nella Tabella 2. Dal momento che il NNT di ciascun farmaco è calcolato rispetto al placebo, anche per quest’ultimo è stato considerato l’estremo inferiore degli intervalli di confidenza di ciascun endpoint riportato nella Tabella 2. Applicando la medesima metodologia, nella seconda ipotesi l’analisi di sensibilità deterministica ha calcolato il costo per NNT di ogni farmaco considerando contemporaneamente per ciascun endpoint gli estremi superiori degli intervalli di confidenza riportati nella Tabella 2.
Dal momento che quello considerato nel caso base potrebbe non riflettere il reale prezzo di cessione dei farmaci praticato alle strutture sanitarie, l’analisi di scenario è stata condotta per stimare l’impatto sul costo per NNT di alcune ipotesi di sconto sui prezzi di UPA, UST e VDZ. È stato ipotizzato che ai farmaci possano essere praticati degli ulteriori sconti compresi tra lo 0% e il 90% con scaglioni incrementali di 5 punti percentuali. L’analisi di scenario, tramite una serie di tabelle a matrice, mostra tutti i possibili confronti dei valori di costo per NNT a 8 (induzione) e a 52 (mantenimento) settimane, calcolati per ogni endpoint considerato.
Risultati
NNT: induzione
La Tabella 6 riporta, calcolato rispetto alla risposta clinica, il NNT di UPA 45 mg, UST 6 mg/kg e VDZ 300 mg nella fase di induzione. Considerando come endpoint clinico la percentuale di pazienti che raggiungono la risposta clinica nella fase di induzione, UPA risulta il farmaco più efficace determinando il minor NNT.
| Fase | Molecola | NNT |
|---|---|---|
| Risposta Clinica | ||
| Induzione | Upadacitinib 45 mg | 1,72 |
| Ustekinumab 6 mg/kg | 3,57 | |
| Vedolizumab 300 mg | 11,11 |
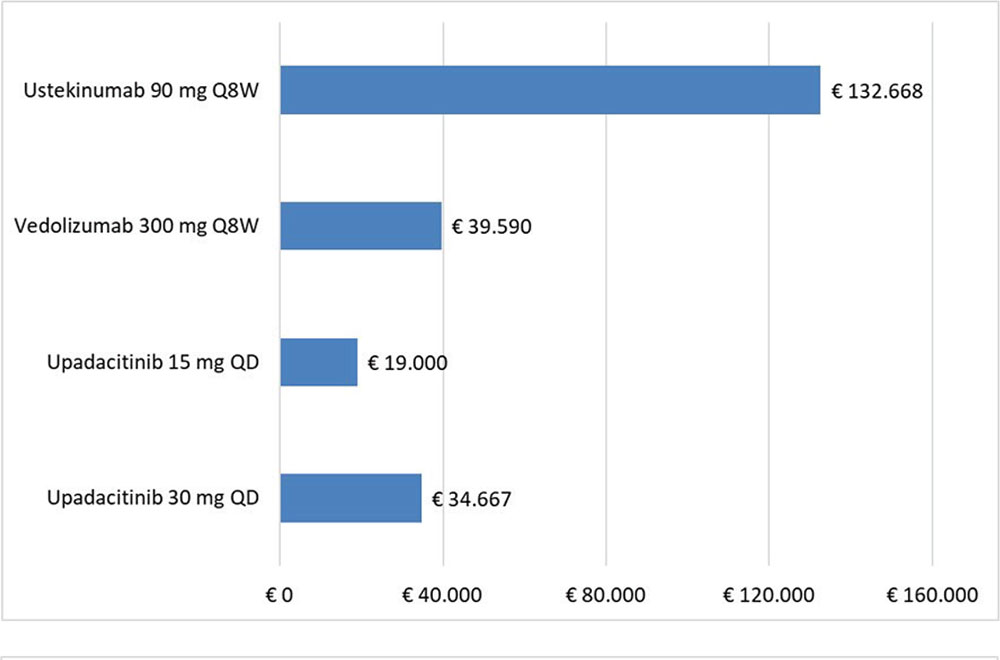
FIGURE 1 - Costo per NNT: risposta clinica nell’induzione.
Costo per NNT: induzione
La Figura 1 riporta il costo per NNT a 8 settimane di UPA 45 mg, UST 6 mg/kg e VDZ 300 mg, calcolato rispetto alla risposta clinica. Upadacitinib 45 mg determina il minor costo per NNT con una differenza di € 22.587 rispetto a UST e di € 60.006 rispetto a VDZ.
NNT: mantenimento
La Tabella 7 riporta, calcolato rispetto alla remissione clinica e al miglioramento endoscopico, il NNT di UPA 15 mg QD o 30 mg QD, UST 90 mg Q8W e VDZ 300 mg Q8W nella fase di mantenimento. Considerando come endpoint clinico la percentuale di pazienti che raggiungono la remissione clinica o il miglioramento endoscopico, UPA, 15 mg QD o 30 mg QD, risulta più efficace rispetto ai comparatori, determinando i minori NNT.
Costo per NNT: mantenimento
Le Figure 2 e 3 riportano il costo per NNT a 52 settimane di UPA 15 mg QD o 30 mg QD, di UST 90 mg Q8W e di VDZ 300 mg Q8W, calcolato rispetto alla remissione completa e al miglioramento endoscopico, rispettivamente. Indipendentemente dall’endpoint considerato, upadacitinib, 15 mg QD o 30 mg QD, determina i minori costi per NNT rispetto a UST 90 mg Q8W e a VDZ 300 mg Q8W nella fase di mantenimento.
| Fase | Molecola | NNT | |
|---|---|---|---|
| Remissione clinica | Miglioramento endoscopico | ||
| Mantenimento | Upadacitinib 30 mg | 1,75 | 1,79 |
| Upadacitinib 15 mg | 1,92 | 2,13 | |
| Vedolizumab 300 mg Q8W | 2,78 | 2,56 | |
| Ustekinumab 90 mg Q8W | 6,67 | 5,88 | |

FIGURE 2 - Costo per NNT: remissione clinica nel mantenimento.
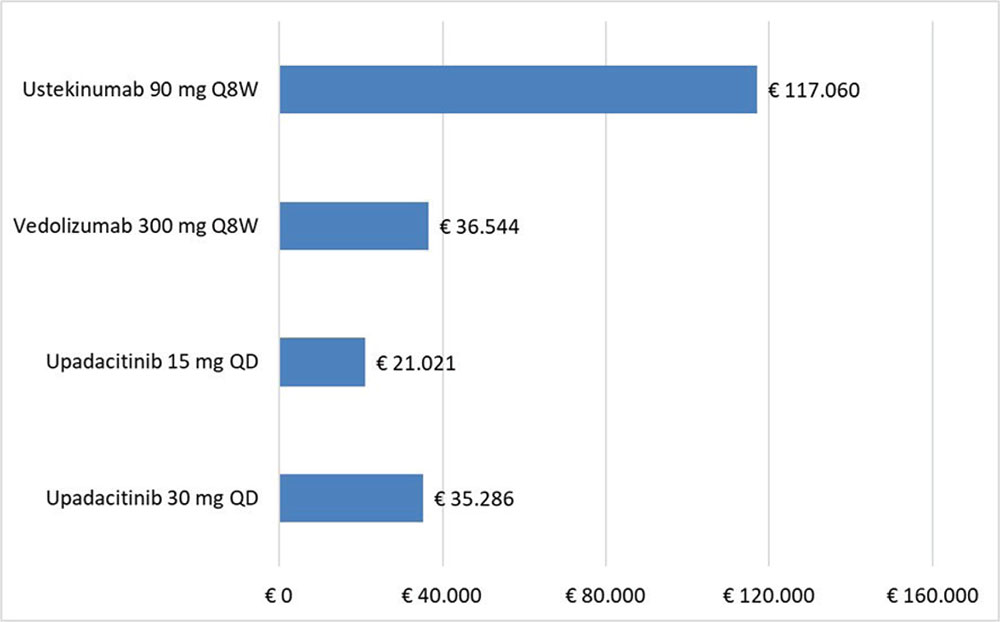
FIGURE 3 - Costo per NNT: miglioramento endoscopico nel mantenimento.
Analisi di sensibilità deterministica
Con riferimento al periodo di induzione e all’endpoint risposta clinica, UPA 45 mg QD determina sempre il minor costo per NNT, considerando gli estremi sia inferiori sia superiori dei corrispettivi intervalli di confidenza (Tab. 8). Spostando l’attenzione sul periodo di mantenimento e sull’endpoint remissione clinica, a UPA 15 mg QD viene sempre associato il minor costo per NNT, mentre, considerando il risultato dell’analisi deterministica riferita ai soli estremi superiori degli intervalli di confidenza, UPA 30 mg QD determina un costo per NNT superiore a VDZ 300 mg Q8W e inferiore a UST 90 mg Q8W (Tab. 8). Il medesimo risultato si presenta analizzando l’analisi deterministica condotta considerando il periodo di mantenimento e l’endpoint miglioramento endoscopico (Tab. 8); UPA 15 mg QD determina in ogni confronto il minor costo per NNT, mentre UPA 30 mg QD non determina il minor costo per NNT rispetto a VDZ 300 mg Q8W, considerando i risultati dell’analisi deterministica condotta utilizzando gli estremi superiori dei rispettivi intervalli di confidenza.
Analisi di scenario
I risultati delle analisi di scenario, finalizzati a stimare l’impatto di alcune ipotesi di sconto adottate per il calcolo del costo per NNT di UPA rispetto a UST e VDZ, sono riportati nelle Tabelle 9-18.
Considerando come endpoint clinico la risposta clinica nella fase di induzione e tutte le possibili combinazioni di sconto, la probabilità che UPA 45 mg determini un minor costo per NNT rispetto a UST 6 mg/kg è del 92,2% (Tab. 9), mentre sale al 99,2% nel confronto con VDZ 300 mg (Tab. 10).
Considerando come endpoint clinico la remissione clinica nella fase di mantenimento e tutte le possibili combinazioni di sconto, la probabilità che UPA 30 mg QD determini un minor costo per NNT è del 92,2% rispetto a UST 90 mg Q8W (Tab. 11) e del 57,1% rispetto a VDZ 300 mg Q8W (Tab. 12); se invece consideriamo UPA 15 mg QD, la probabilità che il costo per NNT sia inferiore a quello di UST 90 mg Q8W o di VDZ 300 Q8W è del 98,1% (Tab. 13) e dell’80,1% (Tab. 14), rispettivamente.
Considerando infine come endpoint il miglioramento endoscopico nella fase di mantenimento e tutte le possibili combinazioni di sconto, la probabilità che UPA 30 mg QD determini un minor costo per NNT è dell’89,8% rispetto a UST 90 mg Q8W (Tab. 15) e del 52,6% rispetto a VDZ 300 mg Q8W (Tab. 16); se invece consideriamo UPA 15 mg QD, la probabilità che il costo per NNT sia inferiore a quello di UST 90 mg Q8W o di VDZ 300 mg Q8W è del 96,4% (Tab. 17) e del 74,5% (Tab. 18), rispettivamente.
| Parametro | Costo per NNT | ||
|---|---|---|---|
| Caso base | Estremo inferiore | Estremo superiore | |
| Induzione | |||
| Risposta clinica upadacitinib 45 mg QD | € 7.862,07 | € 9.500,00 | € 8.142,86 |
| Risposta clinica ustekinumab 6 mg/kg | € 30.459,38 | € 60.918,75 | € 22.443,75 |
| Risposta clinica vedolizumab 300 mg | € 67.868,00 | € 305.406,00 | € 32.148,00 |
| Mantenimento | |||
| Remissione clinica upadacitinib 30 mg QD | € 34.666,67 | € 68.137,93 | € 26.000,00 |
| Remissione clinica upadacitinib 15 mg QD | € 19.000,00 | € 41.166,67 | € 13.534,25 |
| Remissione clinica vedolizumab 300 mg Q8W | € 39.589,67 | € 95.015,20 | € 23.364,39 |
| Remissione clinica ustekinumab 90 mg Q8W | € 132.667,50 | € 497.503,13 | € 58.529,78 |
| Mantenimento | |||
| Miglioramento endoscopico upadacitinib 30 mg QD | € 35.285,71 | € 59.878,79 | € 29.058,82 |
| Miglioramento endoscopico upadacitinib 15 mg QD | € 21.021,28 | € 42.956,52 | € 15.682,54 |
| Miglioramento endoscopico vedolizumab 300 mg Q8W | € 36.544,31 | € 83.836,94 | € 24.572,90 |
| Miglioramento endoscopico ustekinumab 90 mg Q8W | € 117.059,56 | € 398.002,50 | € 56.857,50 |
Discussione
Il rapido susseguirsi dell’immissione sul mercato di nuove molecole indicate nel trattamento della RCU con attività da moderata a grave, tra cui upadacitinib recentemente rimborsato dall’AIFA, genera la necessità di disporre di valutazioni economiche comparative, quali il costo per NNT, in grado di combinare la dimensione clinica con quella economica.
TABELLA 9 - Analisi di scenario: risposta clinica upa 45 mg vs UST 6 mg/kg (induzione)
Grigio = costo per NNT UPA 45 mg < costo per UST 6 mg/kg; Rosso = costo per NNT UPA 45 mg > costo per NNT UST 6 mg/kg
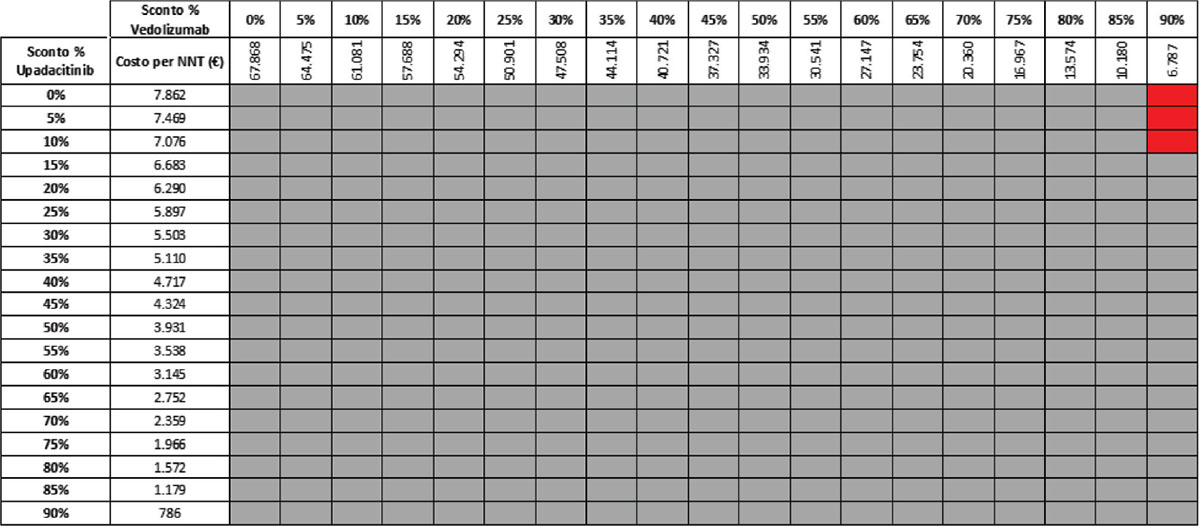
TABELLA 10 - Analisi di scenario: risposta clinica upa 45 mg vs VDZ 300 mg (induzione)
Grigio = costo per NNT UPA 45 mg < costo per VDZ 300 mg; Rosso = costo per NNT UPA 45 mg > costo per NNT VDZ 300 mg
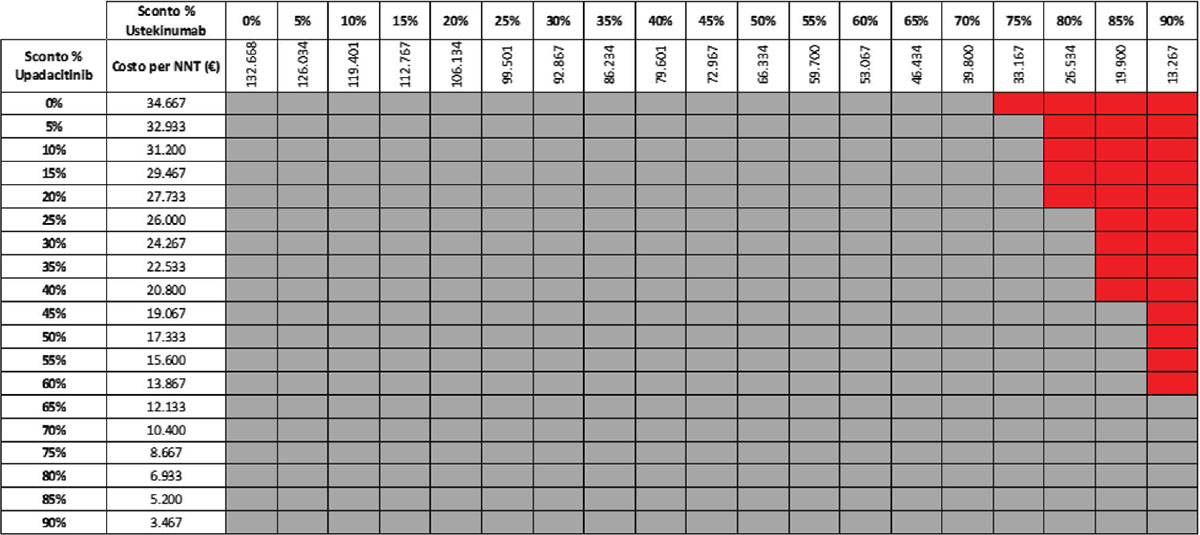
TABELLA 11 - Analisi di scenario: remissione clinica upa 30 mg vs UST 90 mg q8w (mantenimento)
Grigio = costo per NNT UPA 30 mg < costo per UST 90 mg; Rosso = costo per NNT UPA 30 mg > costo per NNT UST 90 mg
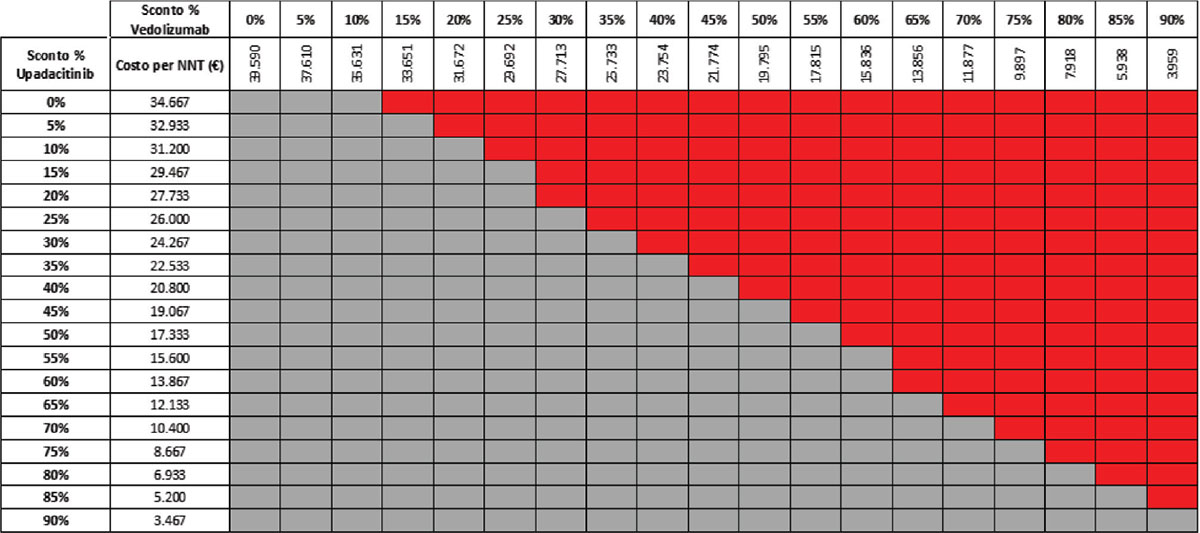
TABELLA 12 - Analisi di scenario: remissione clinica upa 30 mg vs VDZ 300 mg q8w (mantenimento)
Grigio = costo per NNT UPA 30 mg < costo per VDZ 300 mg; Rosso = costo per NNT UPA 30 mg > costo per NNT VDZ 300 mg
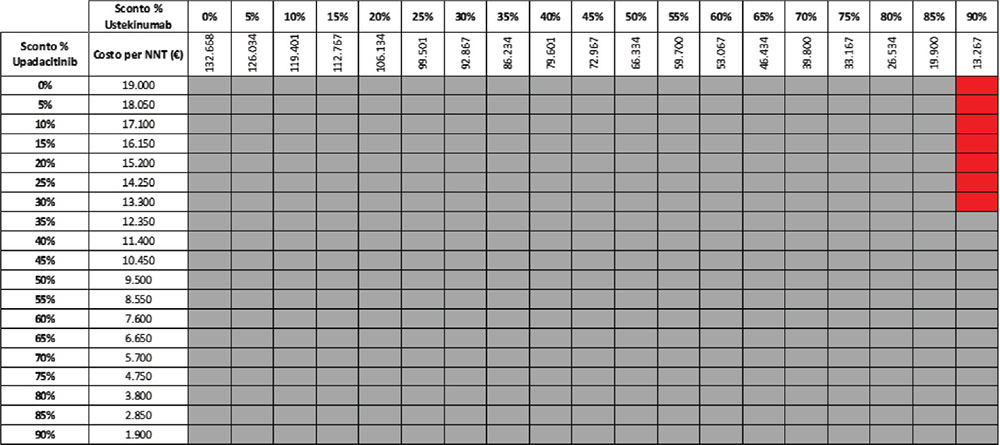
TABELLA 13 - Analisi di scenario: remissione clinica upa 15 mg vs UST 90 mg q8w (mantenimento)
Grigio = costo per NNT UPA 15 mg < costo per UST 90 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT UST 90 mg
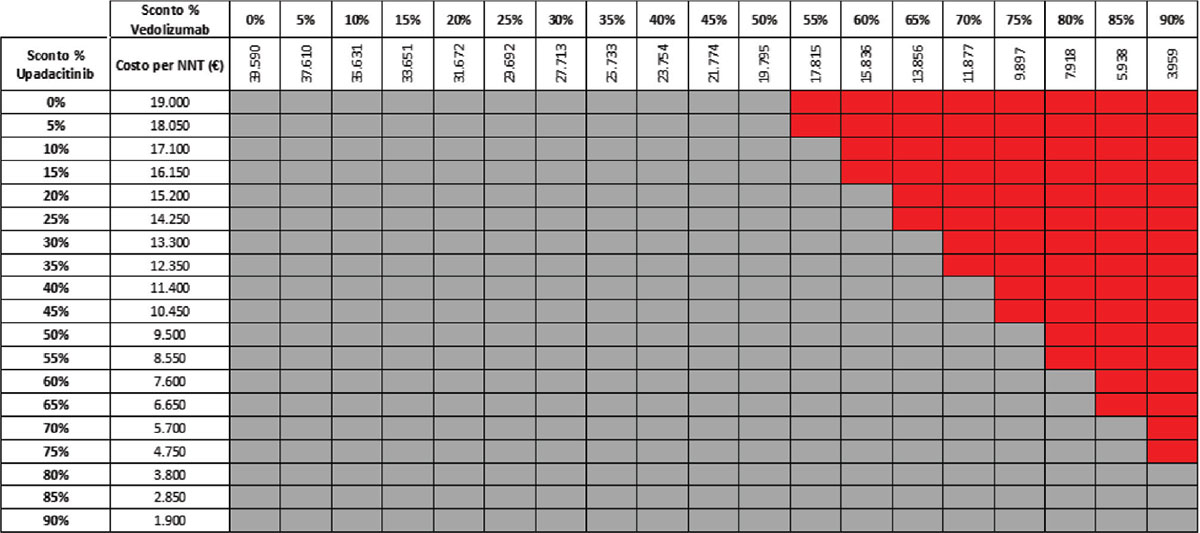
TABELLA 14 - Analisi di scenario: remissione clinica upa 15 mg vs VDZ 300 mg q8w (mantenimento)
Grigio = costo per NNT UPA 15 mg < costo per VDZ 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT VDZ 300 mg
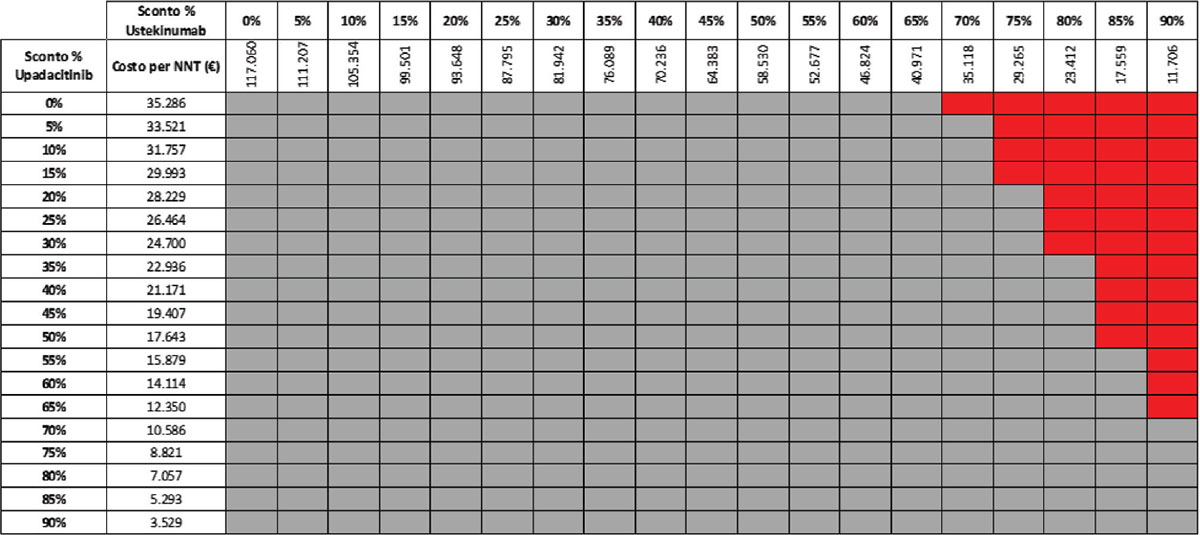
TABELLA 15 - Analisi di scenario: miglioramento endoscopico upa 30 mg vs UST 90 mg q8w (mantenimento)
Grigio = costo per NNT UPA 30 mg < costo per UST 90 mg; Rosso = costo per NNT UPA 30 mg > costo per NNT UST 90 mg
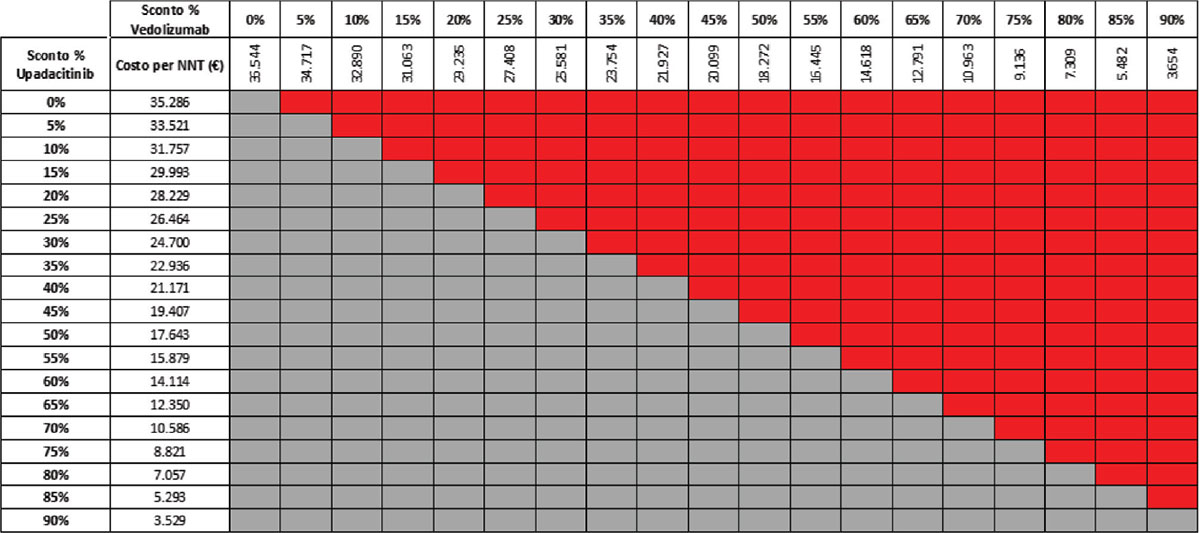
TABELLA 16 - Analisi di scenario: miglioramento endoscopico upa 30 mg vs VDZ 300 mg q8w (mantenimento)
Grigio = costo per NNT UPA 30 mg < costo per VDZ 300 mg; Rosso = costo per NNT UPA 30 mg > costo per NNT VDZ 300 mg
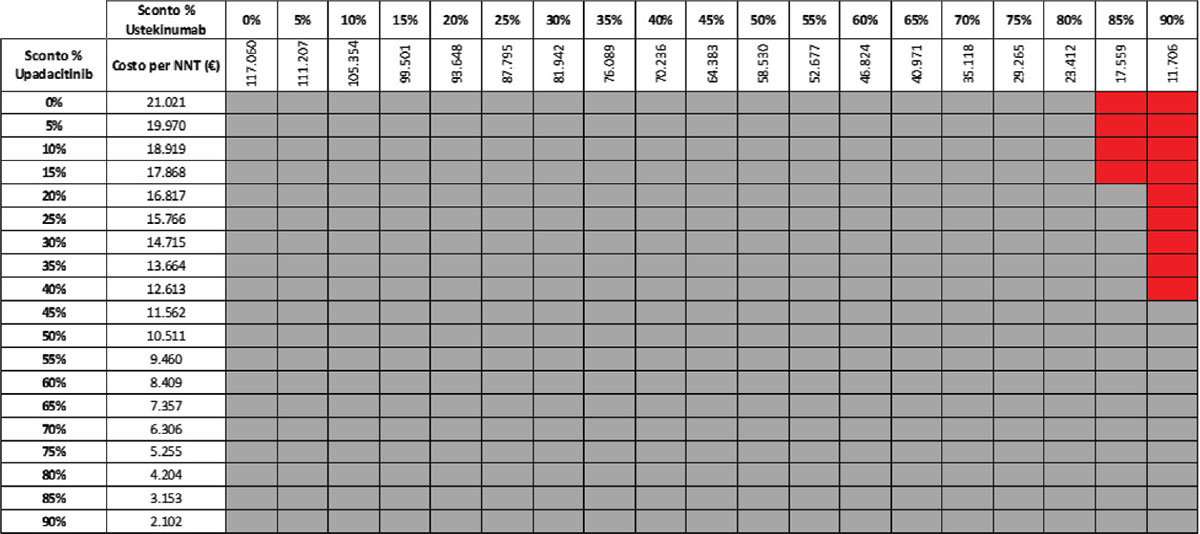
TABELLA 17 - Analisi di scenario: miglioramento endoscopico upa 15 mg vs UST 90 mg q8w (mantenimento)
Grigio = costo per NNT UPA 15 mg < costo per UST 90 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT UST 90 mg
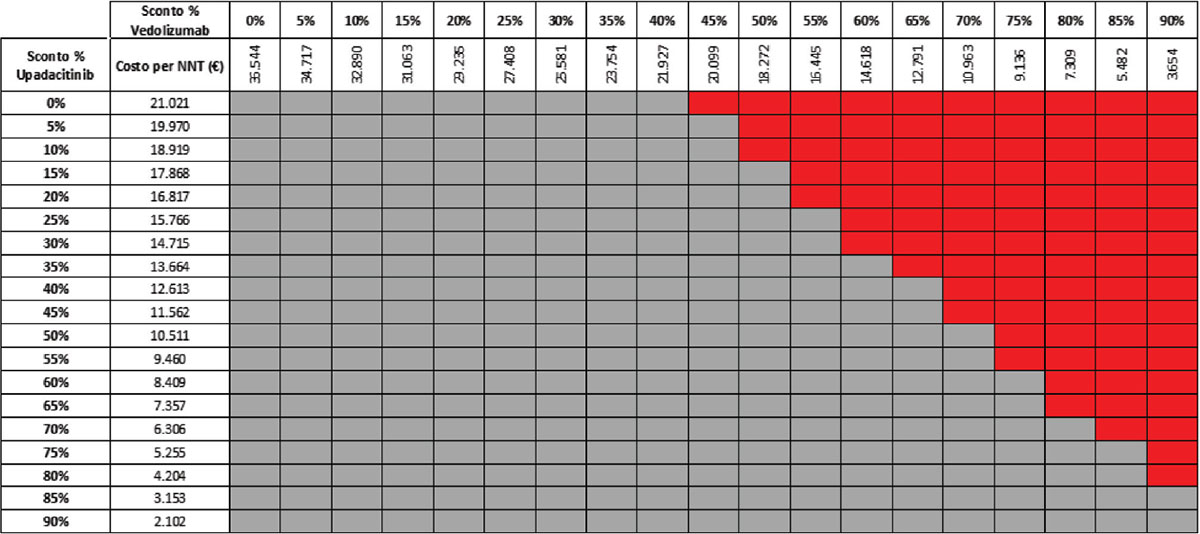
TABELLA 18 - Analisi di scenario: miglioramento endoscopico upa 15 mg vs VDZ 300 mg q8w (mantenimento)
Grigio = costo per NNT UPA 15 mg < costo per VDZ 300 mg; Rosso = costo per NNT UPA 15 mg > costo per NNT VDZ 300 mg
L’analisi economica condotta in questo studio si basa sui risultati di una NMA (19) nella quale si evidenzia la maggiore efficacia (risposta clinica, remissione clinica e miglioramento endoscopico) di UPA rispetto a una serie di alternative terapeutiche, tra cui UST e VDZ, anche queste ultime rimborsate in ambito nazionale nel trattamento della RCU con attività da moderata a grave.
La stima del costo per NNT, vale a dire la ponderazione della dimensione clinica (NNT) rispetto a quella economica (costo di trattamento), permette di determinare un preliminare ranking di efficienza delle tre alternative considerate (UPA, UST e VDZ) con riferimento alla popolazione bio-exposed nelle fasi di induzione e di mantenimento. Indipendentemente dal timepoint (induzione o mantenimento) o dall’endpoint considerato (risposta clinica, remissione clinica e miglioramento endoscopico), la nostra analisi ha mostrato un minor costo per UPA per NNT rispetto a UST e a VDZ.
Dal momento che l’analisi del caso base potrebbe non riflettere il reale prezzo di cessione dei farmaci praticato alle strutture sanitarie, è stata condotta un’analisi di scenario finalizzata a stimare l’impatto sul costo per NNT di alcune ipotesi di sconto (dallo 0% al 90%) applicate ai prezzi di UPA, UST e VDZ. Considerando tutte le possibili combinazioni degli scenari di sconto con riferimento alla fase di induzione, la probabilità che il costo per NNT di UPA 45 mg QD calcolato sulla risposta clinica sia inferiore a quello di UST 6 mg/kg e di VDZ 300 mg è del 92,2% e del 99,2%, rispettivamente. Le probabilità che il costo per NNT di UPA 30 mg QD o di UPA 15 mg QD calcolato sulla remissione clinica sia inferiore a quello di UST 90 mg Q8W e di VDZ 300 mg Q8W è del 92,2%, del 57,1%, del 98,1% e dell’80,1%, rispettivamente. Le probabilità che il costo per NNT di UPA 30 mg QD o di UPA 15 mg QD calcolato sul miglioramento endoscopico sia inferiore a quello di UST 90 mg Q8W e di VDZ 300 mg Q8W è dell’89,8%, del 52,6%, del 96,4% e dell’74,5%, rispettivamente. Nella maggior parte dei confronti si osserva come la probabilità che il costo per NNT di UPA sia inferiore a quello di UST o di VDZ è prossima o superiore all’80%.
In assenza di uno studio di confronto diretto dell’efficacia di UPA, UST e VDZ nella popolazione bio-exposed affetta da RCU con attività da moderata a grave, l’utilizzo della NMA costituisce un valido approccio statistico per determinare l’efficacia relativa dei singoli farmaci rapportata ai bracci placebo dei singoli studi, nonostante i noti limiti legati all’utilizzo di tale approccio (popolazioni non sovrapponibili, indicatori clinici non omogenei, ecc.) (29,30). La dimensione clinica dei risultati della NMA è stata valutata qualitativamente osservando quanto recentemente pubblicato in letteratura. A tal proposito di particolare interesse risultano i dati di tre recenti revisioni sistematiche della letteratura (SLR) e NMA. L’analisi di Lasa et al. (31) pubblicata nel 2021 ha confrontato l’efficacia e la sicurezza dei farmaci biologici e degli SMD nel trattamento di induzione dei pazienti con RCU con attività da moderata a grave. Upadacitinib è risultato significativamente superiore a tutti gli altri interventi per la remissione clinica durante la fase di induzione. La seconda analisi condotta da Burr et al. (32) e pubblicata nel 2021 ha valutato l’efficacia in base alla remissione clinica, al miglioramento endoscopico o alla risposta clinica distinguendo tra popolazione naïve o exposed alla terapia biologica con i farmaci anti-TNFα. In questo studio, upadacitinib 45 mg somministrato una volta al giorno si è posizionato al primo posto per quanto riguarda la remissione clinica considerando sia la popolazione overall sia quelle bio-naïve o bio-exposed ai farmaci anti-TNFα. La terza e ultima analisi è stata condotta da Ahuja et al. (33) e pubblicata nel 2023. Questa analisi è stata effettuata per valutare la remissione sintomatica precoce con le terapie approvate nel trattamento della RCU con attività da moderata a grave. Upadacitinib è stato, fra tutte le molecole considerate, quella più efficace nel raggiungere la remissione sintomatica alle settimane 2, 4 e 6. I risultati di tutte e tre le analisi sembrano in linea con quelli trovati dalla NMA di Panaccione et al. (19), identificando in upadacitinib un’opzione terapeutica efficace nel trattamento della RCU con attività da moderata a grave.
Infine, è necessario evidenziare che dalla presente analisi sono stati esclusi i costi correlati alla gestione di eventuali eventi avversi associati al trattamento somministrato, poiché la NMA di Panaccione et al. non ha evidenziato significative differenze tra le molecole considerate (19). Inoltre, in via conservativa, sono stati esclusi anche i costi associati alla somministrazione, sebbene i tre farmaci analizzati siano caratterizzati da diverse modalità di assunzione: orale nel caso di UPA, endovenosa e sottocutanea per UST ed endovenosa per VDZ. Presumibilmente l’inclusione dei costi di somministrazione avrebbe determinato un ulteriore vantaggio economico a favore di UPA, poiché si assume che la somministrazione orale, a differenza di quelle sottocutanee ed endovenose, non determini alcun costo a carico del SSN. Si è infine ritenuto opportuno non valorizzare l’attività di monitoraggio dei farmaci somministrati in quanto in letteratura non sono presenti analisi economiche che, nel trattamento della RCU con attività da moderata a grave, abbiano stimato consumi e costi associati, differenziando per via di somministrazione e molecola.
Conclusioni
Sulla base dell’analisi economica condotta nel presente studio, nella prospettiva del SSN, upadacitinib determina un costo per NNT inferiore rispetto a ustekinumab e a vedolizumab nel trattamento di induzione e di mantenimento dei pazienti adulti con RCU con attività da moderata a grave precedentemente esposti a una terapia biologica.
I risultati di queste valutazioni forniscono utili informazioni a supporto dei pagatori in ottica di ottimizzazione delle risorse disponibili. In futuro sarà auspicabile poter confermare i risultati ottenuti in questa sede grazie ad analisi di real world evidence (RWE) condotte nel contesto sanitario italiano. Queste analisi potrebbero fornire ulteriori elementi di interesse che non sono stati presi in considerazione in questa sede.
Acknowledgements
The Authors wish to thank Marzia Bonfanti, for providing editorial support on behalf of PharmaLex Italy S.p.A. formerly MA Provider, supported by AbbVie.
Disclosures
Conflict of interest: Caprioli F served as consultant to: AbbVie, MSD, Takeda, Janssen, Roche, Celgene, Bristol-Meyers Squibb, Galapagos, Gllead, Pfizer, Mundipharma, Galapagos, Biogen, Ferring, Eli-Lilly, Nestlé, Lionhealth; he received lecture fees from AbbVie, Ferring, Takeda, Allergy Therapeutics, Janssen, Pfizer, Biogen, Sandoz, Tillotts Pharma and unrestricted research grants from Giuliani, Sofar, MSD, Takeda, AbbVie, Celltrion, Pfizer. Fantini MC has acted as a consultant for: AbbVie, Celgene, Celltrion, Gilead, Pfizer, MSD, Bristol-Meyer, Takeda, Janssen-Cilag, Roche, Galapagos, Biogen, Sandoz; he has received financial support for research from Janssen-Cilag, Pfizer, Sandoz. Ravasio R is a consultant of PharmaLex Italy S.p.A. formerly MA Provider and he has no conflicts of interest in this research. Scaduto D and Marando F are AbbVie employees and may own AbbVie stocks/options.
Financial support: AbbVie funded the project and participated in the design of the manuscript and in the review of the data. No honoraria were made for the publication.
Bibliografia
- 1. Burr NE, Gracie DJ, Black CJ, Ford AC. Efficacy of biological therapies and small molecules in moderate to severe ulcerative colitis: systematic review and network meta-analysis. Gut. 2021 Dec 22:gutjnl-2021-326390. CrossRef PubMed
- 2. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel J-F. Ulcerative colitis. Lancet. 2017;389(10080):1756-1770. CrossRef PubMed
- 3. Lynch WD and Hsu R. Ulcerative Colitis. StatPearls. Last update June 5, 2023. Online
- 4. Cohen RD, Yu AP, Wu EQ, Xie J, Mulani PM, Chao J. Systematic review: the costs of ulcerative colitis in Western countries. Aliment Pharmacol Ther. 2010;31(7):693-707. CrossRef PubMed
- 5. Paschos P, Katsoula A, Salanti G, Giouleme O, Athanasiadou E, Tsapas A. Systematic review with network meta-analysis: the impact of medical interventions for moderate-to-severe ulcerative colitis on health-related quality of life. Aliment Pharmacol Ther. 2018;48(11-12):1174-1185. CrossRef PubMed
- 6. Gray JR, Leung E, Scales J. Treatment of ulcerative colitis from the patient’s perspective: a survey of preferences and satisfaction with therapy. Aliment Pharmacol Ther. 2009;29(10):1114-1120. CrossRef PubMed
- 7. Peyrin-Biroulet L, Van Assche G, Sturm A, et al. Treatment satisfaction, preferences and perception gaps between patients and physicians in the ulcerative colitis CARES study: A real world-based study. Dig Liver Dis. 2016;48(6):601-607. CrossRef PubMed
- 8. Turner D, Ricciuto A, Lewis A, et al; International Organization for the Study of IBD. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology. 2021 Apr;160(5):1570-1583. CrossRef PubMed
- 9. Yoon H, Jangi S, Dulai PS, et al. Incremental Benefit of Achieving Endoscopic and Histologic Remission in Patients With Ulcerative Colitis: A Systematic Review and Meta-Analysis. Gastroenterology. 2020;159(4):1262-1275.e7. CrossRef PubMed
- 10. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto Entyvio. Online
- 11. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto Stelara. Online
- 12. Roda G, Jharap B, Neeraj N, Colombel JF. Loss of response to anti-TNFs: definition, epidemiology, and management. Clin Transl Gastroenterol. 2016;7(1):e135. CrossRef PubMed
- 13. Harris C, Cummings JRF. JAK1 inhibition and inflammatory bowel disease. Rheumatology (Oxford). 2021;60(suppl 2):ii45-ii51. CrossRef PubMed
- 14. Agenzia Italiana del Farmaco (AIFA). Riassunto delle caratteristiche di prodotto Rinvoq. Online
- 15. Danese S, Vermeire S, Zhou W, et al. OP24 Efficacy and safety of upadacitinib induction therapy in patients with Moderately to Severely Active Ulcerative Colitis: results from the phase 3 U-ACHIEVE study. J Crohns Colitis. 2021;15(suppl 1):S022-S024. CrossRef
- 16. Danese S, Vermeire S, Zhou W, et al. Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: results from three phase 3, multicentre, double-blind, randomised trials. Lancet. 2022;399(10341):2113-2128. CrossRef PubMed
- 17. A Study to Evaluate the Long-Term Safety and Efficacy of Upadacitinib (ABT-494) in Participants With Ulcerative Colitis (UC). Online
- 18. Market Research. AbbVie Data on file
- 19. Panaccione R, Collins EB, Melmed GY, et al. Efficacy and Safety of Advanced Therapies for Moderately to Severely Active Ulcerative Colitis at Induction and Maintenance: An Indirect Treatment Comparison Using Bayesian Network Meta-analysis. Crohns Colitis 360. 2023;5(2):otad009. CrossRef PubMed
- 20. Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med. 1987;317(26):1625-1629. CrossRef PubMed
- 21. Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011;64(2):163-171. CrossRef PubMed
- 22. Agenzia Italiana del Farmaco (AIFA). Linee guida per la compilazione del Dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale. Online
- 23. Chiappetta MF, Viola A, Mastronardi M, et al. One-year effectiveness and safety of ustekinumab in ulcerative colitis: a multicenter real-world study from Italy. Expert Opin Biol Ther. 2021;21(11):1483-1489. CrossRef PubMed
- 24. Panaccione R, Lee WJ, Clark R, et al. Dose Escalation Patterns of Advanced Therapies in Crohn’s Disease and Ulcerative Colitis: A Systematic Literature Review. Adv Ther. 2023;40(5):2051-2081. CrossRef PubMed
- 25. Zingone F, Barberio B, Compostella F, et al. Good efficacy and safety of vedolizumab in Crohn’s disease and ulcerative colitis in a real-world scenario. Therap Adv Gastroenterol. 2020;13:1756284820936536. CrossRef PubMed
- 26. Macaluso FS, Fries W, Renna S, et al; Sicilian Network for Inflammatory Bowel Disease (SN-IBD). Effectiveness and safety of vedolizumab in biologically naïve patients: A real-world multi-centre study. United European Gastroenterol J. 2020;8(9):1045-1055. CrossRef PubMed
- 27. Elenco dei medicinali di classe a) rimborsabili dal Servizio sanitario nazionale (SSN) ai sensi dell’articolo 48, comma 5, lettera c), del decreto-legge 30 settembre 2003, n. 269, convertito, con modificazioni, nella legge 24 novembre 2006, n. 326. (Prontuario farmaceutico nazionale 2006). (GU Serie Generale n.156 del 07-07-2006 – Suppl. Ordinario n. 161) Online
- 28. G.U. serie generale n° 154 del 30 giugno 2021. Online
- 29. Greco T, Biondi-Zoccai G, Saleh O, et al. The attractiveness of network meta-analysis: a comprehensive systematic and narrative review. Heart Lung Vessel. 2015;7(2):133-142. PubMed
- 30. Greco T, Landoni G, Biondi-Zoccai G, D’Ascenzo F, Zangrillo A. A Bayesian network meta-analysis for binary outcome: how to do it. Stat Methods Med Res. 2016;25(5):1757-1773. CrossRef PubMed
- 31. Lasa JS, Olivera PA, Danese S, Peyrin-Biroulet L. Efficacy and safety of biologics and small molecule drugs for patients with moderate-to-severe ulcerative colitis: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol. 2022;7(2):161-170. CrossRef PubMed
- 32. Burr NE, Gracie DJ, Black CJ, Ford AC. Efficacy of biological therapies and small molecules in moderate to severe ulcerative colitis: systematic review and network meta-analysis. Gut. 2021 Dec 22:gutjnl-2021-326390. CrossRef PubMed
- 33. Ahuja D, Murad MH, Ma C, Jairath V, Singh S. Comparative Speed of Early Symptomatic Remission With Advanced Therapies for Moderate-to-Severe Ulcerative Colitis: A Systematic Review and Network Meta-Analysis. Am J Gastroenterol. 2023;118(9):1618-1625; Online ahead of print. CrossRef PubMed