 |
Glob Reg Health Technol Assess 2023; 10: 40-45 ISSN 2283-5733 | DOI: 10.33393/grhta.2023.2562 POINT OF VIEW |
 |
Prezzo e rimborso dei farmaci in caso di estensione delle indicazioni: i risultati di una survey sui soci di ISPOR Italy Rome Chapter
Price and reimbursement of medicines when new indications are approved: the results of a survey on ISPOR Italy Rome Chapter members
Multi-indication pricing models for medicines and some international impact evidence are available in the literature. Data on the Italian context are more limited. This paper illustrates the results of a study aimed at gathering the opinion on this topic of experts, members of the ISPOR Italy Rome Chapter.
The opinion was collected through a structured questionnaire, validated by two potential responders, and administered online in the period October/July 2022.
There were 45 responders (20% of the members); 67% of responders work in pharmaceutical companies and 13% in consultancy firms. The remainder belongs to regulators/payers and universities.
The survey highlighted a preference for (i) non-automatic models, as automatic approaches are mainly based on price cuts/discount increases in relation to an increase in volumes, (ii) an “indication-based-pricing” model (where prices are differentiated by indication through discounts/risk sharing agreements), since it is more consistent with a value-based approach, even if more complex to manage, (iii) a mix of discounts/agreements according to existing evidence.
The opinion collected is consistent with the opinions available in the literature, but not consistent with the Italian trend, where, compared to the past, a blended approach is prevailing. A blended pricing envisages a renegotiation of the single price for all indications, essentially based on a change in the discount. Our hope is that in the future the experts’ opinion will be taken into consideration and that a targeted indication-based-pricing will be adopted again.
Keywords: Indication, Italy, Medicines, Pricing
Received: January 15, 2023
Accepted: April 25, 2023
Published online: May 2, 2023
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La versatilità dei farmaci è aumentata nel tempo e sono sempre più numerosi i casi di estensione di indicazione e, conseguentemente, di farmaci approvati per diverse indicazioni (1). L’accesso a nuove indicazioni per i farmaci richiede che vengano affrontate tre problematiche: l’opportunità di differenziare le condizioni di accesso, in relazione al valore che il farmaco ha per ogni indicazione, la necessità, avvertita soprattutto dai soggetti pagatori, di ridurre i prezzi (o di aumentare gli sconti) per effetto dell’incremento della popolazione target e l’impatto che la rinegoziazione dei prezzi ha sul mercato relativo alle indicazioni già approvate.
La letteratura ha analizzato i modelli presenti nella pratica regolatoria/negoziale (2), rappresentati da:
• brand (e conseguente prezzo) differenziato per indicazione (modello “brand”);
• prezzo unico e sconti e/o Managed Entry Agreement (MEA) differenziati per indicazione (modello “prezzo effettivo differente per indicazione” o “Indication-Based-Pricing”, “IBP”);
• prezzo unico come media dei prezzi per indicazione (modello “blended price”).
Recentemente è stato pubblicato un Expert Consensus Report dall’Office of Health Economics (3). In tale documento, considerando le (scarse) evidenze di letteratura sull’impatto di tali modelli e le opinioni di esperti, si è in generale raccomandato un approccio flessibile alla negoziazione dei prezzi in caso di estensione di indicazione e che riconosca comunque il valore del farmaco per l’indicazione approvata. Questo produrrebbe un più rapido e diffuso accesso dei pazienti ai farmaci e incentiverebbe lo sviluppo di soluzioni terapeutiche innovative.
A un’analoga conclusione è giunta una recente revisione sistematica di letteratura (1). Tale revisione, oltre a ribadire la scarsità di dati di impatto, sottolinea come un approccio IBP abbia il vantaggio:
• di rendere coerente il prezzo con il valore del farmaco nell’indicazione specifica in cui è utilizzato;
• di dare segnali alle imprese sul riconoscimento del valore, indirizzandole a investire per produrre valore e ottimizzando quindi gli investimenti in Ricerca e Sviluppo (R&S);
• di favorire l’accesso dei pazienti ai trattamenti.
L’approccio IBP richiede però la presenza di sistemi adeguati di raccolta dati (in primis di tracciatura dell’utilizzo dei farmaci per indicazione) e può generare, a seconda della complessità degli accordi per indicazione, un carico amministrativo importante.
La stessa revisione sistematica evidenzia come l’approccio blended price risulti quello più utilizzato a livello internazionale, seguito dall’IBP, basato in gran parte su sconti confidenziali differenziati per indicazione, mentre il modello brand risulta poco diffuso, anche se formalmente possibile in tutti e cinque i principali Paesi Europei. La prevalenza del modello blended price su IBP è probabilmente motivata dalla maggiore facilità di applicazione. Nell’ambito degli approcci IBP è maggiore la frequenza di sconti per indicazione rispetto a MEA più complessi e ciò è giustificato da un generale ripensamento critico dei MEA, soprattutto outcome-based (4). Due recenti contributi, partendo da tali valutazioni critiche, hanno suggerito dei modelli che possono, almeno parzialmente, superare le problematicità degli accordi outcome-based, salvaguardando il loro obiettivo, che è quello di condivisione del rischio di impatto non favorevole dei farmaci e di raccolta di dati real-world (5,6).
D’altra parte con un approccio blended si rinuncia a determinare un prezzo effettivo sulla base del valore presunto del farmaco per indicazione. Inoltre si tende a ponderare artificialmente il valore per indicazione con il numero di pazienti in trattamento (logica di impatto sul budget). Peraltro, mentre, per le indicazioni già approvate, la popolazione target è nota, per la nuova indicazione i pazienti in trattamento vengono stimati sulla base delle quote di mercato presunte. L’approccio blended si basa poi di fatto su una rinegoziazione dei prezzi o degli sconti. Nel caso di prezzi o sconti trasparenti, questo comporterebbe un rischio di mancato lancio dell’estensione di indicazione nei paesi caratterizzati da politiche di pricing ispirate in prevalenza a logiche finanziarie e sarebbe, quindi, complesso da applicare (7).
Le evidenze di impatto di estensioni di indicazioni si sono arricchite grazie alla pubblicazione di una recente analisi sulle nuove indicazioni (100), approvate tra il 2009 e il 2019, di 25 farmaci oncologici in sette paesi (Australia, Canada, Francia, Germania, Inghilterra, Scozia e USA) (8). L’analisi evidenzia come le nuove indicazioni presentino:
• un impatto incrementale sulla salute minore, impatto espresso come differenziale, rispetto alle eventuali alternative terapeutiche, di sopravvivenza e Quality Adjusted Life Years saved (QALYs);
• un target di popolazione più ampio;
• una maggiore frequenza di raccomandazioni negative o restrittive sul rimborso e di accordi di rimborso condizionato.
Lo stesso studio mostra come i prezzi pubblici (non sono disponibili i prezzi effettivi di cessione) siano stati ridotti in Francia e in Germania e aumentati negli Stati Uniti a seguito dell’estensione di indicazione.
Il contesto italiano è attualmente caratterizzato:
• dalla necessità per le imprese di sottomettere un dossier completo per la negoziazione di P&R: l’estensione di indicazione è equiparata a un nuovo farmaco lanciato sul mercato;
• da una tradizione storica di uso di sconti differenziati/MEA per indicazione approvata, grazie anche alla possibilità di tracciare l’uso dei farmaci per indicazione attraverso i registri farmaci, tradizione già evidenziata dalla revisione di Preckler ed Espín (1);
• dalla più recente prevalenza di un approccio blended price sullo sconto, ovvero di rinegoziazione dello sconto (confidenziale) per tutte le indicazioni approvate;
• dall’applicazione, anche se non sistematica, dell’aumento dello sconto per effetto dell’estensione della popolazione target (trade-off prezzi/volumi).
Di recente pubblicazione è un Documento di Discussione prodotto da un gruppo di lavoro italiano (9). È emersa una sostanziale preferenza per l’uso di sconti e MEA come strumenti di gestione di prezzi differenti per indicazione rispetto al modello blended price, per le motivazioni già sopra specificate. Il modello di IBP produce una maggiore aderenza del prezzo al valore per indicazione; evita il rischio di mancato lancio per la nuova indicazione, generato da una riduzione complessiva dei prezzi effettivi per tutte le indicazioni; non richiede che venga individuato un sistema di ponderazione che spesso fa riferimento alla dimensione della popolazione target, che è stimata per la nuova indicazione.
Dalla letteratura e dal Documento di Discussione di cui sopra emerge un’incoerenza tra una preferenza per il modello IBP e un approccio sempre più prevalente ispirato alla logica blended, nonché un gap informativo sull’impatto delle estensioni di indicazioni sulla negoziazione di P&R in Italia.
Nel 2022 è stato costituito un gruppo di lavoro, nell’ambito dell’ISPOR Italy Rome Chapter (cfr. Sezione Ringraziamenti), finalizzato:
• ad ampliare la raccolta di opinioni sui diversi modelli di pricing in caso di estensione di indicazione;
• a produrre evidenze di impatto dell’estensione di indicazione sul processo negoziale (tempi) e sugli esiti (prezzo effettivo di cessione);
• a proporre un modello strutturato di blended pricing per l’Italia, nel caso in cui l’approccio blended dovesse prevalere anche in futuro.
Il presente contributo illustra i risultati relativi al primo punto.
Metodo
L’opinione di esperti è stata raccolta tramite un questionario strutturato, con una prevalenza di domande che impongono un ranking delle preferenze su soluzioni alternative. Il questionario è stato predisposto dagli Autori del presente paper e validato dal gruppo di lavoro ISPOR Italy Rome Chapter e da due potenziali responder. Il questionario è stato somministrato online, tramite piattaforma Survio (https://www.survio.com/survey/d/ispor0922) con tre round di recall nel periodo luglio/ottobre 2022. In Allegato 1 (Materiale Supplementare - Allegato 1) è riportato il testo del questionario.
Le domande proposte possono essere raggruppate in quattro macro-settori:
• quando è opportuna una rinegoziazione del prezzo (e/o dello sconto sul prezzo) e delle condizioni di accesso in presenza di estensione di indicazioni?
• È auspicabile un processo automatico di rinegoziazione del prezzo basato sull’aumento della popolazione target?
• Se un approccio automatico non è auspicabile, quale modello (blended price o IBP) è preferibile e come dovrebbe essere declinato?
• Quali variabili sono più rilevanti nella rinegoziazione dei prezzi e/o dello sconto?
L’invito alla partecipazione alla survey è stato trasmesso a tutti i soci di ISPOR Italy Rome Chapter e 229 hanno visitato il sito con questionario. I soci di ISPOR Italy Rome Chapter provengono da organizzazioni che svolgono attività di regolazione/valutazione dei farmaci ai fini dell’accesso, dall’industria e dal mondo della ricerca e della consulenza.
Risultati
Le risposte alla survey sono state 45 su 229 (20%) soci che hanno visitato il questionario. Il profilo dei rispondenti ha visto una maggiore partecipazione da parte di soci provenienti da imprese farmaceutiche (67%), seguiti da esperti del mondo della consulenza (13%), da soggetti pubblici (Agenzia Italiana del Farmaco, AIFA, e Regioni) (11%) e dall’Università (9%). Le funzioni aziendali più rappresentate sono quelle di Market Access, Prezzo e Rimborso, Health Economics & Outcome Research.
Con riferimento al primo argomento (quando è opportuna una rinegoziazione del prezzo e/o dello sconto sul prezzo e delle condizioni di accesso in presenza di estensione di indicazioni?), per il 36% dei responder il prezzo (e/o lo sconto sul prezzo) deve essere rinegoziato sempre e per il 16% in tutti i casi con l’eccezione dell’estensione di indicazione alla popolazione pediatrica. Per il 44% sarebbe opportuno prioritizzare la rinegoziazione ai casi di estensione importante della popolazione target e di differenziale rilevante del valore nella nuova indicazione approvata (Fig. 1).
La maggior parte dei rispondenti (69%) ritiene che le altre condizioni di accesso (registri, accordi di rimborso condizionato, centri e specialisti autorizzati alla prescrizione, ecc.) vadano rinegoziate, soprattutto se la nuova indicazione si riferisce ad aree terapeutiche diverse e se cambiano i prescrittori (Fig. 2).
Entrando nel merito della seconda area di analisi (è auspicabile un processo automatico di rinegoziazione del prezzo basato sull’aumento della popolazione target?), la maggior parte dei responder non è favorevole a tagli prezzo (e/o incremento sconti) automatici in caso di estensione di indicazione, soprattutto se ciò viene applicato a tutto il portafoglio indicazioni (63% nel caso di automatismi per la sola nuova indicazione e applicabile, quindi, solo con un modello di IBP; 94% dei responder in caso di applicazione a tutte le indicazioni approvate per il farmaco). Con un approccio di taglio prezzi automatico verrebbe trascurato il valore del farmaco nella nuova indicazione e sarebbe necessario, pur in presenza di automatismi, prevedere ex ante dei complessi meccanismi di taglio prezzi/aumento sconti per fasce di estensione della popolazione target (Fig. 3).
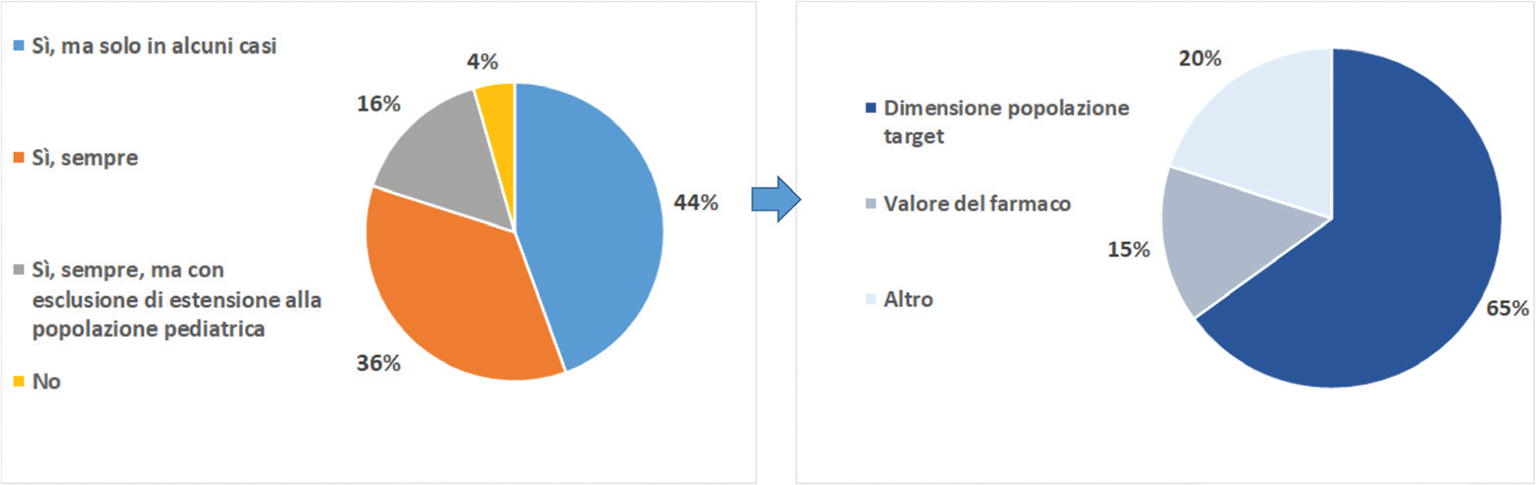
Fig. 1 - Necessità di rinegoziare il prezzo in caso di estensione dell’indicazione.
Fonte: Nostra elaborazione dati survey Ispor Italy Rome Chapter, 2022.

Fig. 2 - Necessità di rinegoziare le condizioni di accesso diverse da prezzo e sconto in caso di estensione dell’indicazione.
Fonte: Nostra elaborazione dati survey Ispor Italy Rome Chapter, 2022.
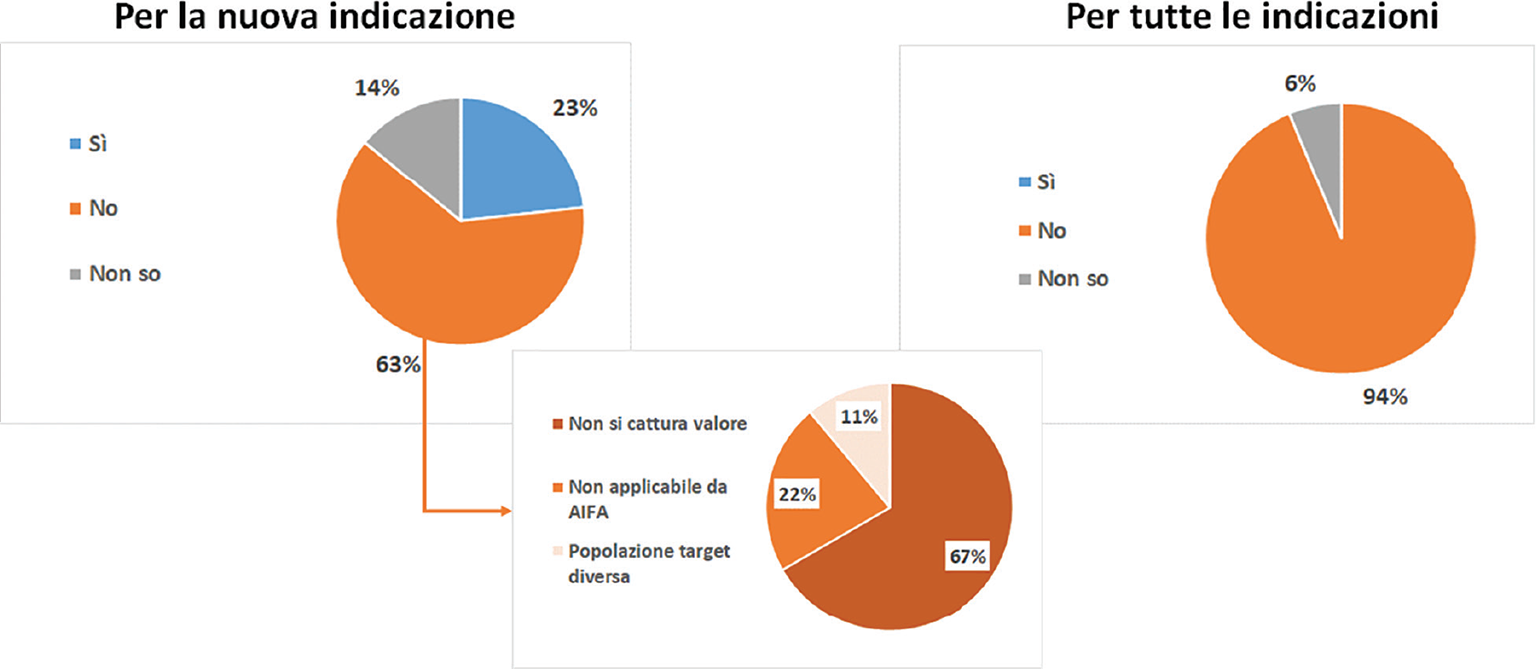
Fig. 3 - Opinione dei responders su taglio automatico dei prezzi (e/o aumento automatico degli sconti) in caso di estensione delle indicazioni.
Fonte: Nostra elaborazione dati survey Ispor Italy Rome Chapter, 2022.
Rispetto ai modelli di pricing non automatici (se un approccio automatico non è auspicabile, quale modello, blended price o IBP, è preferibile e come dovrebbe essere declinato?), i responder hanno espresso una chiara preferenza per l’IBP rispetto al blended price (37% contro il 12%), anche se il 51% ritiene più corretto ricorrere a un approccio misto. Per approccio misto si è inteso un approccio che adotta, a seconda delle esigenze, l’uno o l’altro modello o che combina i due modelli, prevedendo una revisione dei prezzi per tutte le indicazioni, ma mantenendo un prezzo effettivo diverso per indicazione. Sono diverse le motivazioni per cui un approccio IBP è preferito, confermando quanto espresso dalla letteratura sul tema. Tale approccio consente un migliore riconoscimento del valore per indicazione e una maggiore coerenza tra prezzo e valore, mentre la maggiore semplicità rappresenta l’aspetto più citato a favore di un approccio blended price (Fig. 4).
Con riferimento all’approccio IBP, è stato chiesto ai responder di esprimere un’opinione sull’uso di sconti o MEA differenziati per indicazione. Il 70% non ha dato una chiara indicazione di preferenza, specificando che sarebbe preferibile un approccio misto. Il 26% ha espresso una preferenza per i MEA e il 5% per lo sconto. Ai primi si riconosce il merito di affrontare in modo flessibile l’accesso al farmaco e di “assicurare” il pagatore sull’incertezza sull’esito clinico e/o economico e allo sconto il vantaggio di essere una soluzione più semplice da gestire.
Rispetto invece al modello blended price, è stato chiesto ai responder di esprimere un’opinione sul criterio di ponderazione delle indicazioni. La dimensione del valore terapeutico aggiunto è il criterio auspicato dal 65% dei responder, in quanto considerato più ancorato al valore (pari/diverso peso per pari/diverso valore). Il 33% ritiene preferibile la dimensione della popolazione target come fattore di ponderazione, in quanto più coerente con un approccio di impatto sulla spesa. Il rimanente 2% si è espresso a favore dell’utilizzo della gravità della patologia come criterio di ponderazione.

Fig. 4 - Vantaggi e svantaggi citati per modelli di pricing per estensione di indicazione.
Fonte: Nostra elaborazione dati survey Ispor Italy Rome Chapter, 2022.
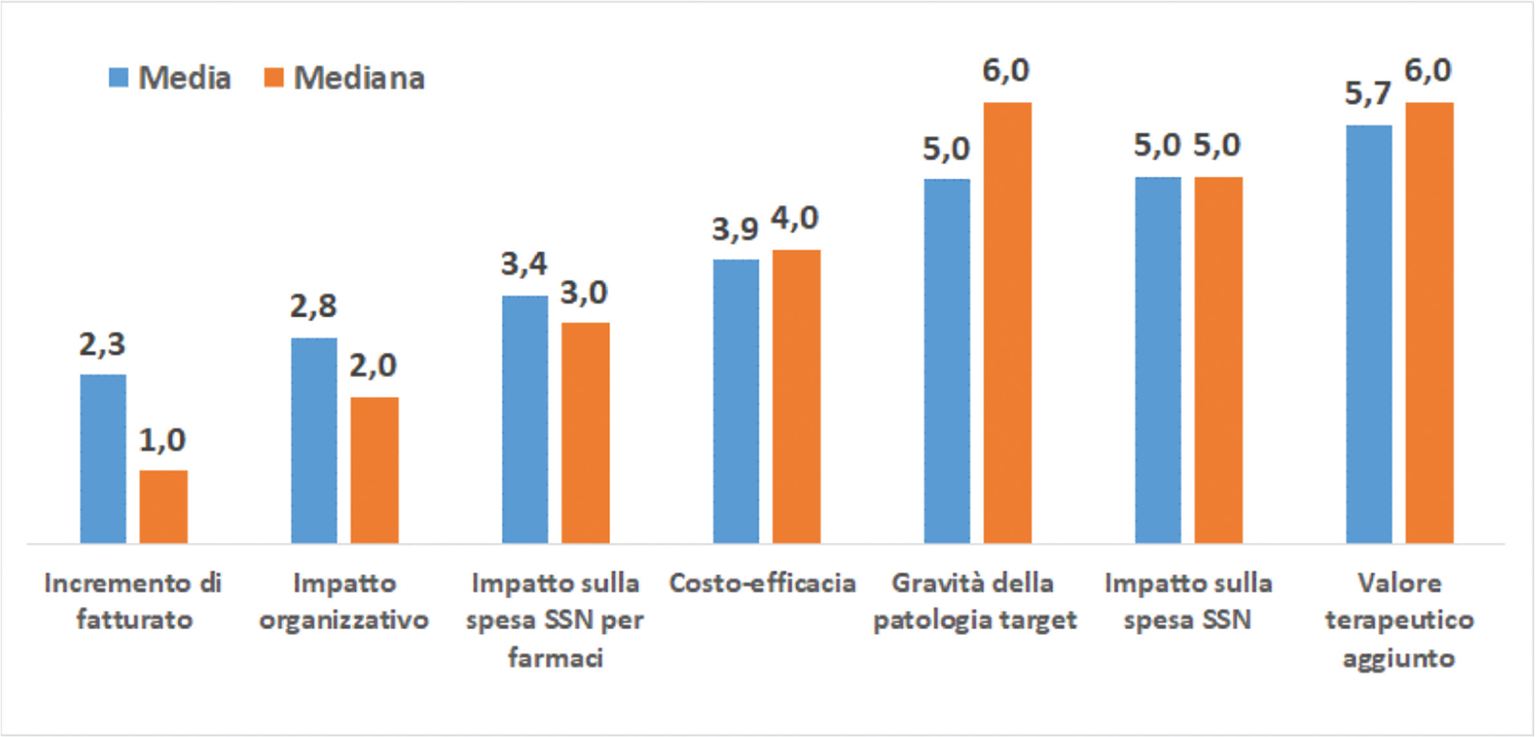
Fig. 5 - Ranking medio e mediano su aspetti da considerare nella ri-negoziazione del prezzo in caso di estensione di indicazione*.
*Classificati dal più importante (1) al meno importante (7).
Fonte: Nostra elaborazione dati survey Ispor Italy Rome Chapter, 2022.
Infine, è stato chiesto ai soci ISPOR Italy Rome Chapter di classificare in ordine di importanza (da 1, più importante, a 7, meno importante) gli attuali domini valutativi e negoziali del prezzo del farmaco con nuova indicazione:
• gravità della patologia target;
• valore terapeutico aggiunto rispetto ad alternative disponibili sul mercato;
• costo-efficacia rispetto ad alternative disponibili sul mercato;
• impatto sulla spesa del SSN;
• impatto sulla spesa del SSN per farmaci;
• incremento di fatturato dell’azienda generato dall’estensione di indicazione;
• impatto organizzativo.
Dall’analisi del ranking medio e mediano emerge come l’incremento del fatturato aziendale sia l’aspetto percepito come più rilevante, mentre il valore terapeutico aggiunto come quello meno importante (Fig. 5).
È evidente l’incongruenza tra i domini che oggi “pesano” sul processo di rinegoziazione (impatto sul fatturato dell’impresa interessata e sulla spesa del SSN per farmaci), rispetto all’insistenza sulla necessità di riconoscere nel sistema di pricing il valore terapeutico aggiunto nella nuova indicazione.
Un dato curioso è la rilevanza attribuita all’impatto organizzativo, seconda sola a quella assegnata all’incremento di fatturato per le imprese. Nella domanda per impatto organizzativo si intendeva l’effetto sull’organizzazione del percorso del paziente (p. es., somministrazioni meno impegnative), ma, di fatto, è stato interpretato come impatto sulla gestione amministrativa dell’accesso (p. es., complessità dei MEA e conseguente ripiego su sconto come soluzione più agevole).
Conclusioni
Il presente contributo ha illustrato i risultati di una survey sull’opinione di esperti membri di ISPOR Italy Chapter Rome (soggetti regolatori, industria, ricerca e consulenza) sul tema della rinegoziazione delle condizioni di accesso e in particolare del prezzo, in occasione di estensione delle indicazioni di un farmaco. La survey è stata condotta in un contesto caratterizzato da una chiara tendenza all’uso diffuso a livello internazionale di un approccio blended, con rinegoziazione del prezzo o dello sconto per tutte le indicazioni terapeutiche. Anche l’Italia è passata da un modello, riconosciuto come uno dei pochi a livello internazionale, di IBP basato su sconti e/o MEA differenziati per indicazione, a uno basato sul modello blended, con una prevalenza di sconto rinegoziato per tutte le indicazioni rispetto ai MEA (soprattutto outcome-based).
La survey ha indicato chiaramente come siano auspicabili un ribilanciamento a favore di un IBP, usato ovviamente laddove è opportuno farlo (sostanziale differenza del valore nelle diverse indicazioni), e un recupero dei MEA oltre che dello sconto come strumenti di differenziazione dei prezzi effettivi di cessione per indicazione, laddove si riscontra l’utilità di agganciare al contratto di accesso una raccolta dati per rispondere all’incertezza delle evidenze al lancio del prodotto sul mercato. Il rischio di un modello di tipo blended è che, in assenza di un approccio strutturato e che si richiami almeno in parte alla logica del prezzo commisurato al valore del farmaco (nella nuova indicazione e nelle indicazioni già lanciate sul mercato nel caso tale valore sia variato nel tempo), il prezzo sia rinegoziato solo o in prevalenza sulla base dell’incremento dei volumi attesi di vendita e che alteri le condizioni concorrenziali nelle indicazioni già approvate.
I principali limiti dell’analisi sono il basso tasso di risposta rispetto al target (solo il 20% dei potenziali responder ha risposto al questionario) e un’incidenza elevata di responder appartenenti all’industria (67%) e alla consulenza (13%). Ciò ha impedito di effettuare una sensata sottoanalisi per tipologia di responder e riduce il potenziale di rappresentatività del campione.
Malgrado ciò, le indicazioni della survey sono chiare e l’auspicio è che possano essere considerate in futuro. L’Italia ha il vantaggio di registri che consentono di tracciare l’uso dei farmaci per indicazione e, diversamente da altri paesi, ha la possibilità di applicare nuovamente un approccio di IBP. La complessità di tale approccio richiede che venga prioritizzato il suo utilizzo, vale a dire quando è sostanzialmente diverso il valore relativo del farmaco per indicazione rimborsata.
Ringraziamenti
Questo articolo è parte di un più ampio progetto di ricerca condotto nel 2022 da un Gruppo di Lavoro di ISPOR Italy Rome Chapter. Il gruppo di lavoro è formato, oltre che da Claudio Jommi (Università del Piemonte Orientale) e da Eugenio Di Brino (Università Cattolica), da Mario Calandriello (MSD), Carlotta Galeone (Università degli Studi di Milano, Bicocca), Adrian Hegenbarth, Lavinia Narici, Francesca Patarnello (AstraZeneca), Francesco Saverio Mennini (Università degli Studi di Roma “Tor Vergata”), Stefania Pulimeno (Teva), Elvio Rossini e Chiara Lucchetti (MA Provider), Marco Ratti e Luca Polastri (Kyowa Kirin) e Riccardo Samele e Luigi Zarrelli (GlaxoSmithKline). L’attività di ricerca è stata coordinata da Claudio Jommi.
Si ringrazia Mirella Mastrantonio (3P Solutions) per il supporto nella gestione del questionario per la survey e tutti i responder alla survey.
Disclosures
Conflict of interest: CJ reported serving as an advisory board member and a paid speaker for Abbvie, Amgen, AstraZeneca, Bristol Myers Squibb, CSL Behring, Gilead, Incyte, Merck Sharp & Dohme, Roche, Sanofi, Takeda, outside the submitted work. EDB declares no conflict of interest. Financial support: The Authors and the study group received no financial support for this article. ISPOR Italy Rome Chapter provided financial support for article processing charges.
Bibliografia
- 1. Preckler V, Espín J. The Role of Indication-Based Pricing in Future Pricing and Reimbursement Policies: A Systematic Review. Value Health. 2022;25(4):666-675. CrossRef PubMed
- 2. Campillo-Artero C, Puig-Junoy J, Segú-Tolsa JL, Trapero-Bertran M. Price Models for Multi-indication Drugs: A Systematic Review. Appl Health Econ Health Policy. 2020;18(1):47-56. CrossRef PubMed
- 3. Cole A, Neri M, Cookson G. Payment Models for Multi-Indication Therapies. Online. (Accessed July 2022).
- 4. Antonanzas F, Juárez-Castelló C, Lorente R, Rodríguez-Ibeas R. The Use of Risk-Sharing Contracts in Healthcare: Theoretical and Empirical Assessments. PharmacoEconomics. 2019;37(12):1469-1483. CrossRef PubMed
- 5. Whittal A, Jommi C, De Pouvourville G, et al. Facilitating More Efficient Negotiations for Innovative Therapies: A Value-Based Negotiation Framework - Corrigendum. Int J Technol Assess Health Care. 2022;38(1):e43. CrossRef PubMed
- 6. Xoxi E, Rumi F, Kanavos P, et al. A Proposal for Value-Based Managed Entry Agreements in an Environment of Technological Change and Economic Challenge for Publicly Funded Healthcare Systems. Front Med Technol. 2022;4:888404. CrossRef PubMed
- 7. Riccaboni M, Swoboda T, Van Dyck W. Pharmaceutical net price transparency across european markets: insights from a multi-agent simulation model. Health Policy. 2022;126(6):534-540. CrossRef PubMed
- 8. Michaeli DT, Mills M, Kanavos P. Value and Price of Multi-indication Cancer Drugs in the USA, Germany, France, England, Canada, Australia, and Scotland. Appl Health Econ Health Policy. 2022;20(5):757-768. CrossRef PubMed
- 9. Pani L, Cicchetti A, De Luca A, et al. Pricing for multi-indication medicines: a discussion with Italian experts. Pharmadvance 2022; 4 (2): 163-170. Online. (Accessed July 2022).