 |
Glob Reg Health Technol Assess 2022; 9: 123-132 ISSN 2283-5733 | DOI: 10.33393/grhta.2022.2470 ORIGINAL RESEARCH ARTICLE |
 |
La gestione del trattamento del paziente con diagnosi di Lupus Eritematoso Sistemico: un’analisi di consenso Delphi
Treatment management of patients with systemic lupus erythematosus: a delphi consensus analysis
Background: Systemic lupus erythematosus (SLE) is associated with clinical burden for the patient and organ damage. The development of therapies for SLE has been constrained by clinical and biologic heterogeneity. These represent challenges in clinical trial design and endpoint selection.
Objective: To identify the most relevant descriptors for efficacy, endpoints, disease activity, organ damage, quality of life (QoL), and Patient Reported Outcome Measures (PROMs) in the treatment of SLE.
Methods: A Delphi study was conducted using a national expert panel of clinicians in the treatment of SLE. A steering committee composed of 3 opinion leaders with deep expertise in SLE treatment was defined. The steering committee analyzed and appraised the evidence, designed the Delphi study, defined the statements, and analyzed the expert panel responses. A 2-round Delphi survey was conducted. Participants were asked to rate the statements using a five-point Likert scale.
Results: Nine experts participated in the Delphi survey. After the two rounds, the consensus was reached on 18 of the 23 statements: 2 statements were included in the “efficacy” domain, 2 in the “glucocorticoid-sparing” domain, 2 in the “endpoint evaluation” domain, 4 in the “score” domain, 1 in the “disease activity” domain, 1 in the “organ damage” domain, 1 in the “QoL” domain, 2 in the “PROMs” domain, 1 in the “AIFA monitoring” domain and 2 in the “extra” domain. No statements reached consensus within the “onset” domain.
Conclusion: In this Delphi study, 18 statements across 11 domains were agreed upon for the treatment of SLE.
Keywords: Anifrolumab, Consensus, Delphi, Efficacy, Likert scale, Systemic lupus erythematosus
Received: July 22, 2022
Accepted: August 30, 2022
Published online: October 10, 2022
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il Lupus Eritematoso Sistemico (LES) è una malattia infiammatoria cronica autoimmune, con sintomatologia e prognosi molto variabili. Si tratta di una malattia multifattoriale le cui manifestazioni cliniche sono estremamente eterogenee (1,2). I sintomi generali più frequenti sono rappresentati da febbre e stanchezza, mentre le più frequenti manifestazioni d’organo sono a carico di cute e mucose (rash al volto, lesioni eritematose nelle zone esposte al sole, alopecia e perdita diffusa di capelli, eritema e aftosi della mucosa orale e nasale, vasculite cutanea) e articolazioni (artrite, artralgie) (1,2,3,4,5,6). Il LES può coinvolgere anche rene (sindrome nefritica e sindrome nefrosica), sistema emopoietico (leucopenia, piastrinopenia, anemia emolitica), sistema nervoso (epilessia, psicosi, deficit di concentrazione, neuropatie periferiche) e sierose (pericarditi, pleuriti) (1,2,3,4,5,6).
A causa di questo complesso scenario la diagnosi di LES può talvolta essere caratterizzata da ritardi o da errori (7,8,9,10). Secondo quanto indicato dai dati più recenti, in Italia, si stima una prevalenza annua dello 0,04% nella popolazione adulta, di cui il 41% presenta una forma di malattia attiva (circa 21.000 soggetti) (11,12,13,14).
Il decorso della malattia risulta spesso imprevedibile e caratterizzato dall’alternanza di fasi di remissione e di riacutizzazione (flare). La persistenza di attività della malattia a livello degli organi/sistemi interessati è responsabile dell’accumulo di danno che, oltre ad avere una ripercussione sulla salute fisica del paziente, influisce negativamente anche sulla sfera sociale e sulla salute mentale, generando spesso ansia e depressione (15).
Sebbene l’esatta eziologia del LES rimanga ad oggi sconosciuta, alla base del processo fisiopatologico vi è un’iperreattività del sistema immunitario (2,16), in parte su base genetica, che, per un difetto nel processo di apoptosi, viene esposto ad auto-antigeni nucleari con conseguente produzioni di autoanticorpi (antinuclear-antibody, ANA). Gli anticorpi antinucleo si possono legare agli autoantigeni formando immunocomplessi che possono precipitare nei tessuti inducendo un processo infiammatorio e danno d’organo. Gli immunocomplessi, oltre ad avere l’azione pro-infiammatoria descritta, possono attivare i neutrofili e il sistema del complemento, alterando la funzione cellulare e attivando la produzione di citochine pro-infiammatorie che a loro volta contribuiscono all’amplificazione e al mantenimento del processo infiammatorio (17).
Le raccomandazioni dell’European League Against Rheumatism (EULAR) indicano come il trattamento del LES debba avere come obiettivo la remissione o una bassa attività di malattia e la prevenzione di possibili flare (18). Secondo Food and Drug Administration (FDA), EULAR e Outcome Measures in Rheumatology (OMERACT), l’endpoint ideale per un trial randomizzato controllato (RCT), per misurare l’efficacia di un trattamento farmacologico, dovrebbe tenere in considerazione sia il miglioramento che il peggioramento delle diverse manifestazioni e dovrebbe distinguere l’attività di malattia dal danno cronico e dalle comorbilità (19). Per superare alcuni limiti dei più comuni indici clinimetrici utilizzati per misurare l’attività di malattia, quali il Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) o il British Isles Lupus Assessment Group (BILAG) (20,21), sono stati proposti in alcuni trial clinici endpoint compositi quali il Systemic Lupus Erythematosus Responder Index (SRI) e il BILAG-based Combined Lupus Assessment (BICLA) che combinano gli score sopracitati (BILAG e SLEDAI) al Physicians Global Assessment (PGA) (22,23,24).
I farmaci attualmente impiegati nella terapia del LES sono: glucocorticoidi, idrossiclorochina, immunosoppressori (azatioprina, metotrexato, ciclosporina, tacrolimus, micofenolato mofetile e ciclofosfamide) e farmaci biologici quali belimumab e rituximab (quest’ultimo utilizzato off-label solo in un numero molto limitato di pazienti affetti dalle forme più gravi di LES). Queste strategie farmacologiche non sono tuttavia in grado di ridurre l’attività di malattia e il rischio di riacutizzazioni nella totalità dei pazienti. Circa il 40-50% dei pazienti non raggiunge, infatti, una condizione di remissione di malattia stabile e il 18,6% dei pazienti con LES attivo da moderato a severo (elevata attività di malattia e frequenti riacutizzazioni) presenta, già dopo 6 mesi, un danno d’organo irreversibile (25). In quest’ultima popolazione diviene inevitabile ricorrere a un uso continuativo di glucocorticoidi e di immunosoppressori/immunomodulatori, sebbene questi farmaci siano caratterizzati da elevata tossicità e scarsa tollerabilità (10,26).
Il bisogno (unmet need) quindi di nuove opzioni terapeutiche per quei pazienti che non rispondono, o che rispondono solo parzialmente, agli attuali trattamenti ha stimolato la ricerca all’identificazione e allo sviluppo di nuove molecole. Lo sviluppo di farmaci nel LES è molto difficile e un numero elevato di RCT non ha raggiunto l’endpoint primario ed è fallito (27,28).
Anifrolumab è il primo anticorpo monoclonale IgG1 completamente umano in grado di inibire gli interferoni di tipo 1 (IFNs-1), citochine che giocano un ruolo centrale nella patogenesi del LES. Gli IFNs-1 stimolano tutte le cellule del sistema immunitario, sia dell’immunità innata che acquisita, contribuendo all’iperreattività del sistema immunitario dei pazienti con LES. Anifrolumab, inibendo IFNs-1, è in grado di antagonizzare l’iperattivazione immunitaria indotta da queste citochine (29,30). L’efficacia e la sicurezza di anifrolumab sono state ampiamente valutate attraverso la conduzione di due studi clinici di fase III, TULIP-1 (31) e TULIP-2 (32). Rispetto al gruppo di controllo, anifrolumab è risultato efficace riducendo significativamente l’attività di malattia, la dose concomitante di glucocorticoidi orali e il tasso di flare e, in particolare, ha migliorato le manifestazioni cutanee e muscoloscheletriche, dimostrandosi una valida nuova opportunità terapeutica nel LES. Sebbene l’endpoint primario (risposta SRI-4 a 52 settimane) dello studio TULIP-1 (31) non sia stato raggiunto, il beneficio clinico di anifrolumab rispetto al placebo è stato dimostrato dal raggiungimento di endpoint secondari quali la riduzione della dose di corticosteroidi orali (anifrolumab 41% vs placebo 32%), la risposta CLASI (anifrolumab 42% vs placebo 25%) e la risposta BICLA (anifrolumab 37% vs placebo 27%). Lo studio TULIP-2 ha invece valutato come endpoint primario la risposta BICLA a 52 settimane, raggiunta dal 47,8% dei pazienti trattati con anifrolumab rispetto al 31,5% dei pazienti trattati con placebo (p = 0,001) (32).
Obiettivo
La gestione del LES è associata ad alcune criticità quali la complessità nella definizione di endpoint clinici idonei a valutare il miglioramento delle manifestazioni cliniche di malattia senza il contemporaneo peggioramento di altre o il processo di creazione e di validazione degli score su cui si basano gli stessi endpoint clinici. Queste criticità, in aggiunta ad altri aspetti che caratterizzano la risposta al trattamento quali l’efficacia e la rapidità d’azione, l’arresto della progressione del danno d’organo e la riduzione dell’attività di malattia, rappresentano una notevole fonte di incertezza per i clinici nella gestione della malattia. L’obiettivo della presente analisi è stato quello di condurre una prima indagine di consenso riguardante alcuni dei principali aspetti nel trattamento del LES.
Metodi
Premessa
È stato condotto un sondaggio via web (online survey) in due tornate (round) per valutare l’opinione di un gruppo di esperti italiani sull’attuale scenario nel trattamento del LES. Con l’impiego della tecnica Delphi, abbiamo valutato il grado di accordo o disaccordo su una serie di affermazioni (statement) riferite a specifiche tematiche nel trattamento del LES. L’utilizzo di questa tecnica ha consentito, in maniera progressiva, di costruire un consenso (accordo o disaccordo) attraverso un processo di analisi in grado, a sua volta, di tenere conto dei diversi punti di vista/opinioni delle figure coinvolte, delle evidenze scientifiche e dell’esperienza clinica acquisita.
Il processo di analisi è stato articolato in due fasi: preparatoria ed esecutiva. Nella fase preparatoria è stato chiesto a un gruppo ristretto di esperti nel trattamento del LES (Steering Committee) di definire e validare (sulla base della letteratura disponibile) una serie di statement (23 in totale) sulla gestione di questa malattia. Nella successiva fase esecutiva, tramite una survey online effettuata in due tornate (Round 1 e Round 2), è stato chiesto a un altro gruppo di esperti nel trattamento del LES (Expert Panel) di esprimere il proprio giudizio di consenso (accordo o disaccordo) sugli statement definiti dallo Steering Committee. La predisposizione di due round di sondaggio, approccio considerato metodologicamente ottimale per raggiungere il consenso, ha consentito all’Expert Panel un’approfondita e adeguata riflessione sulle risposte fornite nei due round. Le risposte fornite dall’Expert Panel nel primo round sono state raccolte e analizzate e il risultato aggregato è stato successivamente condiviso con lo Steering Committee per una prima valutazione. Gli statement per i quali lo Steering Committee ha ritenuto che il mancato raggiungimento dell’accordo o il disaccordo fossero dovuti a un problema di tipo sintattico/comunicativo, in linea con la tecnica Delphi, sono stati riformulati prima dell’invio del secondo e finale round della survey. L’anonimità delle risposte, così come quella di eventuali commenti fatti dall’Expert Panel al questionario, è stata mantenuta durante l’intero progetto.
Partecipanti
Il progetto è stato condotto dai tre differenti gruppi: i) Steering Committee, ii) Facilitatore e iii) Expert Panel. Lo Steering Committee, costituito da tre direttori di Unità di Reumatologia di comprovata esperienza nella gestione e nel trattamento dei pazienti affetti da LES, ha, sulla base delle evidenze scientifiche disponibili, definito e validato gli statement, condiviso la progettazione dello studio e analizzato le risposte fornite dall’Expert Panel. Il Facilitatore (metodologo) ha condiviso la progettazione dello studio e supervisionato il processo Delphi, gestendo le comunicazioni tra Steering Committee ed Expert Panel. Il facilitatore ha inoltre gestito la diffusione dei due round della survey tramite una piattaforma web, offrendo supporto all’Expert Panel e raccogliendo le relative risposte. La composizione dell’Expert Panel è stata definita dallo Steering Committee, mentre la numerosità è stata condivisa con il Facilitatore. Sono stati identificati nove clinici di comprovata esperienza nel trattamento del LES e con affiliazione a un’istituzione accademica o sanitaria quali componenti dell’Expert Panel. Ciascuno di essi ha avuto lo stesso contributo (uguale peso del voto) nel processo di valutazione degli statement. Al fine di completare il processo di analisi, è stato richiesto ai membri dell’Expert Panel di rispondere a tutti gli statement nei due round previsti. Coloro i quali non avessero risposto al primo round non sarebbero stati invitati a partecipare al round successivo.
Definizione del consenso
La valutazione del consenso sull’accordo o sul disaccordo degli statement è avvenuta utilizzando la scala Likert a 5 punti (33) dove:
– al punteggio 1 corrisponde il giudizio “Assolutamente in disaccordo”;
– al punteggio 2 corrisponde il giudizio “Disaccordo”;
– al punteggio 3 corrisponde il giudizio “Abbastanza in accordo”;
– al punteggio 4 corrisponde il giudizio “In accordo”;
– al punteggio 5 corrisponde il giudizio “Assolutamente d’accordo”.
Dal momento che non è disponibile alcuna definizione standard (34), sulla base della letteratura (35,36,37,38), nella presente analisi il consenso di accordo è stato raggiunto ogni volta che le risposte fornite dell’Expert Panel per ogni singolo statement hanno determinato contemporaneamente una frequenza (o percentuale) ≥ 70% nell’intervallo di punteggio 4-5 e una frequenza (o percentuale) ≤ 30% nell’intervallo di punteggio 1-2. Viceversa, la condizione di consenso sul disaccordo è stata raggiunta ogni volta che le risposte fornite dell’Expert Panel per ogni singolo statement hanno determinato contemporaneamente una frequenza (o percentuale) ≥ 70% nell’intervallo di punteggio 1-2 e una frequenza (o percentuale) ≤ 30% nell’intervallo di punteggio 4-5. Nessuna forma di consenso è stata invece raggiunta in presenza di una maggiore dispersione delle risposte, ovvero quando la frequenza (o percentuale) delle risposte fornite dell’Expert Panel non ha raggiunto il cut-off ≥ 70% né nell’intervallo di punteggio 1-2 né in quello 4-5.
Statement
Al fine di garantire al rispondente una maggiore facilità nella compilazione della survey e di presentare un flusso di domande logico e coerente, i 23 statement sono stati suddivisi nei seguenti 11 sottogruppi: efficacia, rapidità d’azione, risparmio di glucocorticoidi, valutazione degli endpoint, score, attività di malattia, danno d’organo, qualità di vita del paziente, patient reported outcome measures (PROM), registro di monitoraggio AIFA e domande extra. Di seguito vengono riportati gli interi elenco e testo di ognuno dei 23 statement sottoposti alla valutazione dell’Expert Panel e, quando presente, viene riportata anche l’eventuale revisione del testo adottata nel secondo round.
Efficacia:
• Statement 1 – Dato l’attuale scenario di trattamento del paziente con LES, l’accesso al mercato di anifrolumab costituirà, una volta disponibile, un efficace strumento a disposizione del clinico prescrittore.
• Statement 2 – È corretto affermare che anifrolumab possieda un effetto sistemico.
Rapidità d’azione:
• Statement 3 – La rapidità d’azione di anifrolumab potrà ridurre i tempi di valutazione dell’efficacia del trattamento.
• Statement 3 rivisto – Qualora i risultati emersi dai trial clinici dovessero essere confermati nel real world, potremmo affermare che la rapidità d’azione di anifrolumab ridurrà i tempi di valutazione dell’efficacia del trattamento.
• Statement 4 – I trial clinici di fase III (TULIP-1 e TULIP-2) hanno dimostrato che già dopo 8-12 settimane si può osservare una risposta alla terapia con anifrolumab e che tale risultato rimane sostenuto nel tempo. Tale rapidità di risposta dà la possibilità al clinico di valutare tempestivamente un’eventuale mancata risposta alla terapia.
• Statement 4 rivisto – I trial clinici di fase III (TULIP-1 e TULIP-2) hanno dimostrato che già dopo 8-12 settimane si può osservare una risposta alla terapia con anifrolumab e che tale risultato rimane sostenuto nel tempo. Se quanto emerso dai trial clinici venisse confermato dai risultati della real world evidence (RWE) tale rapidità di risposta darebbe la possibilità al clinico di valutare tempestivamente un’eventuale mancata risposta alla terapia.
• Statement 5 – Ipotizzando che le terapie biologiche approvate per il trattamento del LES siano 2, dopo le prime 24 settimane di trattamento, nel caso in cui non ci fosse risposta al primo farmaco biologico, si procederebbe con l’interruzione dello stesso e con lo switch al secondo farmaco biologico disponibile.
Risparmio di glucocorticoidi:
• Statement 6 – L’utilizzo di glucocorticoidi risulta ancora oggi una criticità terapeutica da non sottovalutare. Infatti, sebbene abbia un’efficacia dimostrata e una velocità della risposta, un utilizzo prolungato determina un importante e ingravescente danno multi-sistemico. Una riduzione dell’utilizzo di glucocorticoidi nella pratica clinica produrrà considerevoli benefici per il paziente con LES.
• Statement 7 – Il “risparmio di glucocorticoidi” indotto da medicinali quali anifrolumab rappresenta un driver nella scelta delle terapie per il LES.
Valutazione degli endpoint:
• Statement 8 – Il risultato in termini binari (risposta/non risposta) derivante dagli endpoint compositi BICLA e SRI-4 è uno strumento efficace a disposizione dei clinici per valutare, nei trial clinici, l’efficacia di un trattamento farmacologico per un paziente affetto da LES.
• Statement 9 – Gli endpoint compositi (BICLA e SRI-4) non hanno la sensibilità sufficiente per discriminare piccoli cambiamenti. Esistono infatti pazienti che, sebbene ottengano un beneficio clinico significativo, non sono in grado di soddisfare tutti i criteri stabiliti da tali endpoint.
Score:
• Statement 10 – Gli score (BILAG e SLEDAI), su cui si basano gli endpoint compositi (BICLA e SRI-4) utilizzati all’interno dei trial clinici, sono parametri complessi e poco sensibili alle variazioni di attività di malattia. Non esistono tuttavia criteri più efficienti (o efficaci) per la valutazione delle evidenze cliniche prodotte, per questo motivo gli score (BILAG e SLEDAI) sono i più idonei da utilizzare nel programma di sviluppo clinico di un farmaco.
• Statement 10 rivisto – Gli score (BILAG e SLEDAI), su cui si basano gli endpoint compositi (BICLA e SRI-4) utilizzati all’interno dei trial clinici, sono parametri complessi e poco sensibili alle variazioni di attività di malattia. Pur nella consapevolezza che non siano degli indici ideali, tuttavia al momento non esistono criteri più efficienti (o efficaci) per la valutazione delle evidenze cliniche prodotte, per questo motivo gli score (BILAG e SLEDAI) sono i più idonei da utilizzare nel programma di sviluppo clinico di un farmaco.
• Statement 11 – Il processo di creazione ad hoc e di successiva validazione di uno score di risposta alla terapia può essere considerato un processo metodologico valido per la valutazione dell’efficacia dei farmaci nei trial clinici sul LES.
• Statement 12 – Gli score utilizzati (BILAG e SLEDAI) sono strumenti largamente utilizzati/importanti al fine di garantire l’omogeneità e la riproducibilità dei risultati dei trial clinici.
• Statement 13 – Idealmente gli endpoint compositi (BICLA e SRI-4) potrebbero essere utilizzati nella pratica clinica e rappresentare pertanto un valido strumento per la gestione efficace del paziente.
• Statement 14 – Il BICLA è un endpoint composito in grado di valutare in modo olistico il miglioramento della condizione clinica del paziente; infatti, è in grado di esaminare tutti gli organi interessati dal LES e inoltre permette di rilevare anche miglioramenti parziali.
• Statement 14 rivisto – Il BICLA è un endpoint composito in grado di valutare il miglioramento della condizione clinica del paziente. Questo endpoint composito permette di esaminare tutti gli organi interessati dal LES e inoltre di rilevare anche miglioramenti parziali.
Attività di malattia:
• Statement 15 – La valutazione di una nuova molecola per il trattamento del LES viene fatta sulla base di diversi score per l’attività di malattia che comprendono global disease activity, organ-specific measures, flare measures e responder assessments. La macrocategoria, tra gli score indicati, che potrebbe essere più utile per la valutazione dell’efficacia e della sicurezza di un trattamento nei trial clinici sul LES in generale è il responder assessment (BICLA e SRI-4).
Danno d’organo:
• Statement 16 – Considerando la rapidità d’azione e il conseguente risparmio cortisonico, l’utilizzo di anifrolumab permette di ridurre il danno d’organo.
Qualità di vita del paziente:
• Statement 17 – Nei trial clinici, la qualità di vita del paziente è misurata utilizzando questionari aspecifici come SF-36 o EQ-5D. Punteggi specifici di malattia per valutare l’impatto del LES sulla qualità della vita del paziente (per esempio, LIT, LupusQoL) sono parametri utili e complementari agli score precedentemente elencati per valutare l’efficacia di un farmaco.
Patient Reported Outcome Measures (PROM):
• Statement 18 – Le patient reported outcome measures (PROM) rappresentano dei criteri di valutazione sempre più attenzionati sia nella pratica clinica sia all’interno dei trial clinici. Le PROM sono, infatti, importanti parametri di valutazione dello stato di salute generale del paziente.
• Statement 19 – Fatigue e dolore risultano caratteristiche del LES altamente invalidanti e particolarmente attenzionate per il paziente. È necessaria una valutazione specifica di tali parametri all’interno dei trial clinici.
Registro di monitoraggio AIFA:
• Statement 20 – Le nuove condizioni di rimborsabilità di belimumab, come indicato in Gazzetta Ufficiale e nel registro di monitoraggio AIFA, prevedono dei criteri per la definizione dell’attività di malattia (SELENA-SLEDAI ≥ 10 oppure SELENA-SLEDAI ≥ 8 E positività anticorpale [anti-dsDNA positivi] oppure basso complemento [riduzione C3 O riduzione C4]) che risultano essere troppo stringenti quando applicati alla pratica clinica.
• Statement 21 – Nel registro di monitoraggio AIFA di belimumab, il grado di attività della malattia è definito dal punteggio SELENA-SLEDAI e permette di rimborsare il costo del trattamento nei pazienti con SELENA-SLEDAI ≥ 10 oppure SELENA-SLEDAI ≥ 8 E positività anticorpale [anti-dsDNA positivi] oppure basso complemento [riduzione C3 O riduzione C4]. L’attribuzione di un punteggio chiaro e definito (cut-off) è un criterio necessario al fine di garantire l’appropriatezza terapeutica.
Extra:
• Statement 22 – A oggi, la presenza limitata di alternative terapeutiche valide e approvate per il trattamento del LES è in parte dovuta a una comprovata difficoltà nel raggiungere in modo statisticamente significativo gli endpoint compositi stabiliti (BICLA e SRI-4).
• Statement 23 – I dati dei trial clinici suggeriscono l’efficacia di anifrolumab sul controllo dell’attività di malattia e sulla prevenzione delle riacutizzazioni. Tale effetto risulta contestuale alla riduzione di cortisone.
Analisi dei dati
Le percentuali di accordo o disaccordo sono state calcolate per ogni round utilizzando le statistiche descrittive in Microsoft® Excel®. In particolare, per ogni statement è stata analizzata la distribuzione percentuale delle risposte in riferimento ai 5 punteggi previsti dalla scala Likert qui adottata. A tale misura sono state aggiunte statistiche descrittive di base quale media (± ds) e mediana.
Tra il primo e il secondo round, al fine di ridurre i possibili drop-out, i tempi di analisi dei dati e di preparazione del round successivo sono stati ridotti al minimo (circa due settimane). A prescindere dal risultato ottenuto a conclusione del primo round, tutti gli statement sono stati sottoposti a rivalutazione da parte dell’Expert Panel anche nel secondo e nel successivo round.
Risultati
Complessivamente, al termine dei due round, l’Expert Panel ha raggiunto un consenso sull’accordo per 18 dei 23 statement proposti (78,3%) (Fig. 1). Dal primo al secondo round, il numero di statement per il quale non è stato raggiunto alcun grado di consenso (Fig. 1) si è ridotto da 8 (34,8%) a 5 (21,7%). In nessuno dei 23 statement è stato invece raggiunto il consenso di disaccordo. Nessuno statement che nel primo round ha raggiunto il consenso di accordo lo ha successivamente perso nel secondo round (Fig. 1). Il tasso di adesione dei componenti dell’Expert Panel è stato del 100% (9 su 9) in entrambi i round della survey, determinando così un tasso di drop-out dello 0%.
Nella Tabella I, suddivisi per round, oltre alla concentrazione delle risposte con punteggio 4-5 fornite dall’Expert Panel, per ogni singolo statement vengono presentate media (± ds) e mediana delle singole valutazioni. Di seguito vengono commentati i risultati del secondo round della survey, quale risultato finale del processo Delphi.
Sulla base della valutazione fornita, l’Expert Panel ha raggiunto un consenso di accordo sull’efficacia di anifrolumab (statement 1 e 2), ritenendolo, una volta rimborsato, un’efficace alternativa terapeutica nel trattamento del LES, in virtù anche del suo effetto sistemico.
Nei successivi tre statement 3, 4 e 5, riguardanti la rapidità d’azione di anifrolumab, l’Expert Panel non ha raggiunto alcuna forma di consenso, ritenendo necessarie per anifrolumab maggiori evidenze di Real World Evidence (RWE) e di utilizzo nella pratica clinica.
Gli statement 6 e 7 riguardanti il risparmio cortisonico hanno ottenuto il pieno consenso di accordo; ciò sottolinea come i panelist (componenti dell’Expert Panel) siano concordi nell’affermare che l’utilizzo prolungato di una terapia a base di glucocorticoidi possa comportare un importante danno multi-sistemico e che quindi una contestuale riduzione nel suo utilizzo, derivante dall’utilizzo di anifrolumab, determini un considerevole beneficio per i pazienti.
Il consenso di accordo è stato raggiunto anche nei due successivi statement 8 e 9 relativi alla valutazione degli endpoint compositi BICLA e SRI-4, ritenuti uno strumento efficace, all’interno dei trial clinici, nel valutare la risposta di un paziente con LES al trattamento somministrato.
In 4 dei 5 statement (10,11,12,13 e 14) associati agli score BILAG e SLEDAI è stato raggiunto il consenso di accordo. I panelist concordano nell’affermare che, attualmente, questi score rappresentino i criteri più efficaci ed efficienti per la valutazione delle evidenze cliniche, tanto da essere largamente utilizzati nei trial clinici al fine di garantire l’omogeneità e la riproducibilità dei risultati. Gli stessi panelist non sono però in accordo sull’utilizzo nella pratica clinica di questi stessi score. L’Expert Panel è invece d’accordo nel ritenere che il processo di creazione ad hoc e successiva validazione di uno score di risposta alla terapia possa essere considerato un processo metodologico valido per la valutazione dell’efficacia dei farmaci nei trial clinici sul LES.
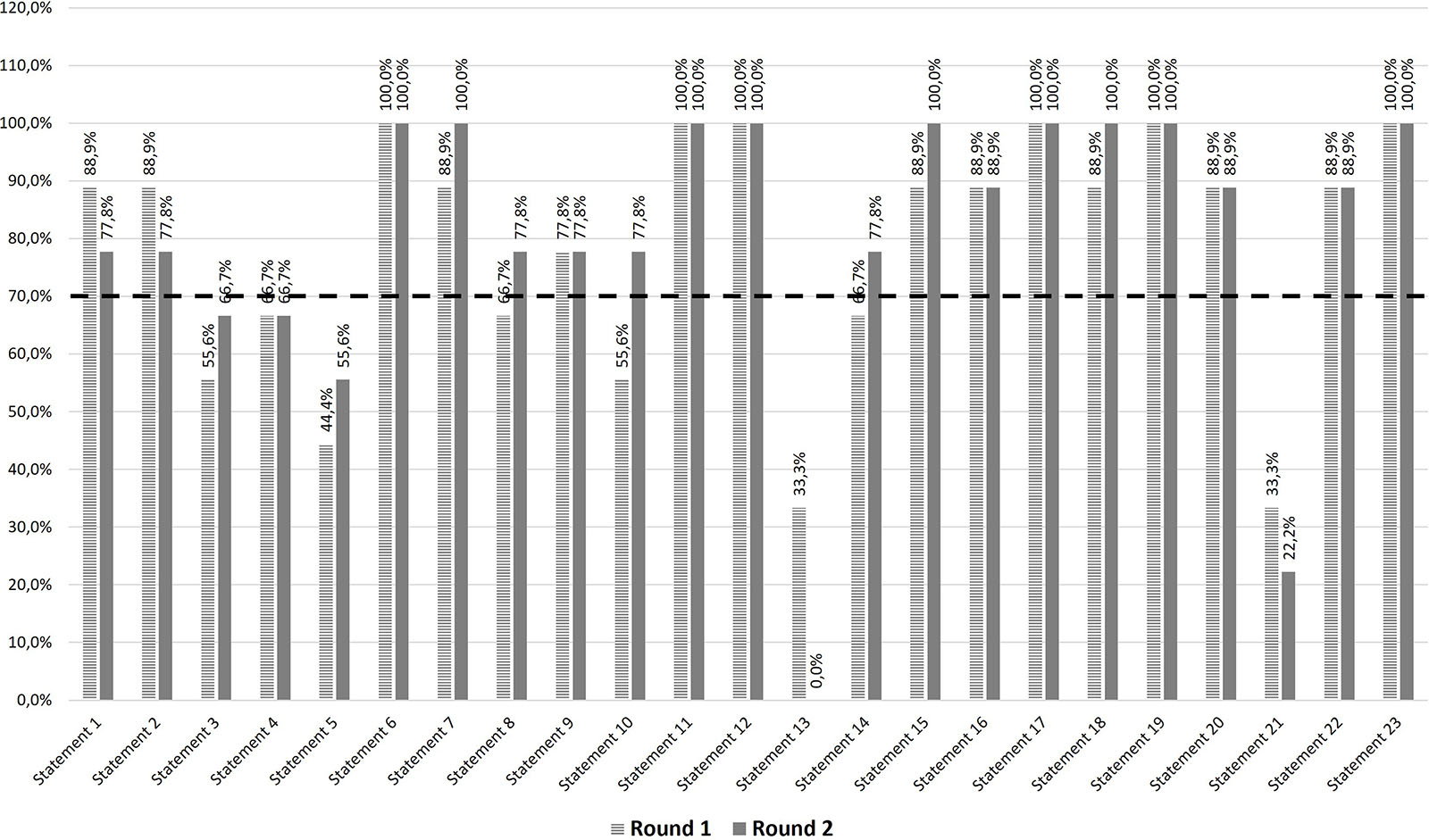
Fig. 1 - Risultati survey round 1 e round 2 (percentuale score 4-5), cut-off 70%.
Considerando l’attività di malattia (statement 15), i panelist sono concordi nel ritenere che tra le seguenti macrocategorie di score global disease activity, organ-specific measures, flare measures e responder assessments (BICLA e SRI-4), l’ultima sia la più utile da utilizzare in un trial clinico per la valutazione dell’efficacia e della sicurezza di un farmaco per il trattamento del LES.
L’Expert Panel ha raggiunto il consenso di accordo sullo statement 16, affermando che, considerando la rapidità d’azione e il conseguente risparmio cortisonico, l’utilizzo di anifrolumab permetta di ridurre il danno d’organo.
La totalità dei panelist è concorde nel ritenere che questionari specifici di malattia per valutare l’impatto del LES sulla qualità della vita del paziente (LIT, LupusQoL) siano parametri utili e complementari a questionari aspecifici come SF-36 o EQ-5D (statement 17).
Secondo l’opinione condivisa espressa dall’Expert Panel (statement 18 e 19) le PROM costituiscono, sia nei trial clinici che nella pratica clinica, importanti parametri idonei alla valutazione dello stato di salute generale del paziente (p. es., fatigue e dolore).
Solo nel primo dei due statement (20 e 21) riguardanti il registro di monitoraggio AIFA viene raggiunto il consenso di accordo. I panelist, infatti, concordano nel ritenere che le nuove condizioni di rimborsabilità di belimumab siano troppo stringenti quando applicate alla pratica clinica (statement 20). Gli stessi panelist non sono tuttavia concordi nel ritenere che l’attribuzione di un punteggio chiaro e definito (cut-off) rappresenti un criterio necessario al fine di garantire l’appropriatezza terapeutica nel trattamento del LES (statement 21).
Infine, l’Expert Panel concorda nell’affermare che (statement 22) la presenza limitata di alternative terapeutiche valide e approvate per il trattamento del LES sia, a oggi, in parte dovuta a una comprovata difficoltà nel raggiungere in modo statisticamente significativo gli endpoint compositi stabiliti (BICLA e SRI-4) e che (statement 23) i dati dei trial clinici mostrino l’efficacia di anifrolumab sul controllo dell’attività di malattia e sulla prevenzione delle riacutizzazioni.
Discussione
La presente analisi Delphi è stata condotta con lo scopo di ottenere informazioni sull’attuale scenario di gestione e trattamento dei pazienti affetti da LES in Italia e di verificare quali siano le eventuali barriere che i clinici si trovano a fronteggiare. I 23 statement definiti dallo Steering Committee e sottoposti alla valutazione dell’Expert Panel sono stati suddivisi in 11 sottogruppi (efficacia, rapidità d’azione, risparmio cortisonico, valutazione degli endpoint, score, attività di malattia, danno d’organo, qualità di vita del paziente, PROM, registro di monitoraggio AIFA e domande extra) ciascuno dei quali finalizzato a fornire un quadro d’insieme dell’attuale scenario di trattamento del LES e del valore clinico di anifrolumab. Sulla base dei due round di risposte fornite dall’Expert Panel e dei successivi commenti effettuati dallo Steering Committee, emerge che il trattamento del LES sia complesso, che richieda pertanto un giudizio clinico esperto e che, in presenza di una malattia attiva da moderata a severa, le opzioni terapeutiche attualmente disponibili non siano in grado di soddisfare pienamente il bisogno terapeutico del paziente.
| Sottogruppo | Variabile | Round 1 | Round 2 | ||||
|---|---|---|---|---|---|---|---|
| % score 4-5 | media (± ds) | mediana | % score 4-5 | media (± ds) | mediana | ||
| Efficacia | Statement 1 | 88,9% | 4,1 (± 0,60) | 4,0 | 77,8% | 3,9 (± 0,93) | 4,0 |
| Statement 2 | 88,9% | 4,1 (± 0,60) | 4,0 | 77,8% | 3,9 (± 0,93) | 4,0 | |
| Rapidità d’azione | Statement 3 | 55,6% | 3,4 (± 0,73) | 4,0 | 66,7% | 3,7 (± 0,50) | 4,0 |
| Statement 4 | 66,7% | 3,7 (± 0,50) | 4,0 | 66,7% | 3,7 (± 0,50) | 4,0 | |
| Statement 5 | 44,4% | 3,4 (± 0,88) | 3,0 | 55,6% | 3,7 (± 1,00) | 4,0 | |
| Risparmio di glucocorticoidi | Statement 6 | 100,0% | 5,0 (± 0,00) | 5,0 | 100,0% | 5,0 (± 0,00) | 5,0 |
| Statement 7 | 88,9% | 4,1 (± 0,60) | 4,0 | 100,0% | 4,3 (± 0,50) | 4,0 | |
| Valutazione endpoint | Statement 8 | 66,7% | 3,8 (± 0,97) | 4,0 | 77,8% | 3,8 (± 0,44) | 4,0 |
| Statement 9 | 77,8% | 3,8 (± 0,44) | 4,0 | 77,8% | 3,8 (± 0,44) | 4,0 | |
| Score | Statement 10 | 55,6% | 3,6 (± 0,53) | 4,0 | 77,8% | 3,8 (± 0,44) | 4,0 |
| Statement 11 | 100,0% | 4,1 (± 0,33) | 4,0 | 100,0% | 4,1 (± 0,33) | 4,0 | |
| Statement 12 | 100,0% | 4,1 (± 0,33) | 4,0 | 100,0% | 4,1 (± 0,33) | 4,0 | |
| Statement 13 | 33,3% | 2,9 (± 0,93) | 3,0 | 0,0% | 2,3 (± 0,50) | 2,0 | |
| Statement 14 | 66,7% | 3,9 (± 0,78) | 4,0 | 77,8% | 3,9 (± 0,60) | 4,0 | |
| Attività malattia | Statement 15 | 88,9% | 4,1 (± 0,60) | 4,0 | 100,0% | 4,2 (± 0,44) | 4,0 |
| Danno d’organo | Statement 16 | 88,9% | 3,9 (± 0,33) | 4,0 | 88,9% | 3,9 (± 0,33) | 4,0 |
| Qualità vita | Statement 17 | 100,0% | 4,2 (± 0,44) | 4,0 | 100,0% | 4,4 (± 0,53) | 4,0 |
| PROM | Statement 18 | 88,9% | 4,3 (± 0,71) | 4,0 | 100,0% | 4,4 (± 0,53) | 4,0 |
| Statement 19 | 100,0% | 4,6 (± 0,53) | 5,0 | 100,0% | 4,6 (± 0,53) | 5,0 | |
| Monitoraggio AIFA | Statement 20 | 88,9% | 4,1 (± 0,60) | 4,0 | 88,9% | 4,1 (± 0,60) | 4,0 |
| Statement 21 | 33,3% | 3,1 (± 0,78) | 3,0 | 22,2% | 3,0 (± 0,71) | 3,0 | |
| Extra | Statement 22 | 88,9% | 4,0 (± 0,87) | 4,0 | 88,9% | 4,1 (± 0,60) | 4,0 |
| Statement 23 | 100,0% | 4,2 (± 0,44) | 4,0 | 100,0% | 4,2 (± 0,44) | 4,0 | |
Al termine del secondo round è stato raggiunto un consenso di accordo su 18 dei 23 (78,3%) statement proposti. In generale, i panelist, sulla base delle attuali evidenze scientifiche, ritengono anifrolumab un’opzione terapeutica efficace nel trattamento del LES, in virtù anche dell’effetto sistemico e della riduzione dell’utilizzo concomitante della terapia cortisonica che esso determina. Anche se riferiti all’ambito dei trial clinici, gli endpoint compositi BICLA e SRI-4 e i corrispondenti score BILAG e SLEDAI costituiscono strumenti efficienti nel valutare l’efficacia di un farmaco somministrato nel trattamento del LES. Viene inoltre riconosciuto un importante valore anche alle PROM, quali parametri idonei a valutare lo stato di salute generale del paziente, e ai questionari sulla qualità di vita, quali indicatori dell’impatto del LES sulla vita del paziente. L’Expert Panel, infine, concorda nel ritenere che le attuali condizioni di rimborsabilità di belimumab siano troppo stringenti quando applicate alla pratica clinica.
Dei cinque statement per i quali non è stato raggiunto il consenso di accordo o disaccordo tre sono relativi alla rapidità d’azione di anifrolumab, uno agli score e uno al registro di monitoraggio AIFA. Con lo scopo di fornirne una corretta lettura, è stato chiesto allo Steering Committee di fornire una propria interpretazione a questo set di cinque risposte fornite dall’Expert Panel.
Con riferimento agli statement sulla rapidità d’azione di anifrolumab, lo Steering Committee ha sottolineato come, in caso di malattie croniche quali artrite reumatoide o, appunto, il LES, un giudizio basato sulle evidenze prodotte dai soli trial clinici registrativi non costituisca un razionale sufficientemente solido da essere direttamente trasferito alla pratica clinica, senza averne avuto prima un riscontro concreto. In quest’ottica, come riferito dallo Steering Committee, risulta comprensibile che i panelist non abbiano raggiunto un consenso di accordo sul fatto che la rapidità d’azione di anifrolumab emersa nei trial clinici potrà ridurre i tempi di valutazione dell’efficacia del trattamento anche nella pratica clinica, in quanto un’eventuale risposta di consenso sull’accordo avrebbe necessitato di un’esperienza (tuttora mancante) derivata dall’utilizzo della molecola nella pratica clinica. In merito alla risposta fornita dall’Expert Panel sul possibile switch dopo 24 settimane di trattamento da un primo a un secondo farmaco biologico, lo Steering Committee ritiene che, coerentemente, i panelist, in qualità di prescrittori, abbiano assunto un atteggiamento cautelativo al fine di non incorrere in una valutazione prematura della mancata o della ridotta efficacia del farmaco somministrato, tenendo conto anche dell’attuale limitata disponibilità di alternative terapeutiche.
Secondo il parere espresso dallo Steering Committee, il non raggiungimento di un consenso di accordo per lo statement 13 non rappresenta un risultato inatteso, in quanto è plausibile ritenere che la difficoltà nell’utilizzo degli endpoint compositi BICLA e SRI-4 ne pregiudichi un facile utilizzo nella pratica clinica, soprattutto in caso di pazienti con attività di malattia lieve o moderata.
In Italia, per poter accedere alla prescrizione di belimumab, unico farmaco biologico attualmente rimborsato per il trattamento del LES, è necessario che il clinico prescrittore compili il registro di monitoraggio AIFA. Sebbene il registro sia un utile strumento per gli Enti regolatori al fine di garantire e semplificare il controllo dell’appropriatezza terapeutica, dai risultati della presente analisi emerge come ciò costituisca al contempo un limite al trattamento del LES. La prescrivibilità di belimumab viene infatti definita valutando l’attività di malattia attraverso specifici criteri definiti sulla base di variazioni dello score SLEDAI, ritenuti, a volte, troppo stringenti quando applicati alla pratica clinica. A causa della complessa natura della patologia, l’Expert Panel non è concorde nell’affermare che l’attribuzione di un punteggio chiaro e definito (cut-off) rappresenti un criterio necessario al fine di garantirne l’appropriatezza terapeutica. Lo Steering Committee ritiene che tale risultato sia correlato al fatto che l’attuale cut-off (basato sull’attività della malattia) non sia in grado di ricomprendere la totalità delle manifestazioni correlate alla malattia, determinando pertanto la necessità della definizione di nuovi criteri (riduzione del tasso di flare, risparmio cortisonico indotto, comorbilità, compliance alla terapia, ecc.) in grado, invece, di garantire una maggiore flessibilità.
I risultati di questa analisi devono essere interpretati alla luce di alcune limitazioni. Una prima criticità riguarda il numero di panelist coinvolti. Anche se in letteratura non viene fornita alcuna indicazione su quali debbano essere i criteri di selezione e dimensionamento del campione (39,40,41), una limitata numerica del presente Expert Panel potrebbe aver prodotto una visione parziale e non complessiva dello scenario nazionale. Si sottolinea, tuttavia, come una limitata numerosità dei componenti dell’Expert Panel sia un elemento che caratterizza gran parte delle analisi Delphi e che, comunque, il campione dei panelist è stato qui selezionato al fine di essere il più rappresentativo possibile dei Centri di eccellenza presenti sul territorio italiano che, data la bassa prevalenza della malattia, non sono molti. Una seconda criticità riguarda l’anonimato dei panelist. Quest’ultima è stata mantenuta durante tutto lo studio al fine di evitare che alcuni panelist potessero influenzare e guidare il processo di valutazione degli statement. La scelta metodologica di aver mantenuto l’anonimato dei panelist assume che il peso della valutazione di ciascuno di essi sia uguale; ciò potrebbe però aver aumentato il rischio che panelist con meno esperienza possano aver risposto sulla base di una conoscenza meno approfondita della malattia. Con l’obiettivo di minimizzare tale rischio, i panelist sono stati selezionati in base alla loro riconosciuta competenza nell’area tematica trattata. Una terza limitazione risiede nella definizione del consenso. In letteratura, non sono presenti criteri standard che definiscono il consenso negli studi Delphi, il processo non è statisticamente rigoroso e, quando si raggiunge il consenso, non c’è garanzia che sia generalizzabile. Per questo motivo, al fine di garantire le maggiori trasparenza e replicabilità possibili, nella presente analisi è stata considerata la definizione di consenso (≥ 70%) più frequentemente utilizzata in questo tipo di analisi. Inoltre, la scelta della scala Likert a 5 punti rispetto a quella a 9 punti è stata fatta nell’ottica, visto il limitato numero di panelist, di ridurre al minimo la dispersione dei voti espressi dai componenti dell’Expert Panel. A tal proposito, i risultati dell’analisi Delphi sono stati presentati non solo come percentuale di concentrazione dei punteggi 4-5, ma anche sotto forma di statistiche descrittive di base quale media (± ds) e mediana del voto espresso dall’Expert Panel. Infine, dei 23 statement sottoposti alla valutazione dei panelist, sette riguardano anifrolumab e avevano l’obiettivo di indagarne aspetti quali efficacia, rapidità d’azione, risparmio di glucocorticoidi e danno d’organo nel trattamento del LES. Questi statement sono stati redatti sulla base delle indicazioni emerse dal programma di sviluppo clinico definito dagli studi clinici di fase III TULIP-1 (31) e TULIP-2 (32), in quanto a oggi non sono disponibili dati di real world evidence.
Conclusioni
La presente analisi Delphi, che ha coinvolto esperti nella gestione del LES, ha avuto come obiettivo l’analisi del consenso di statement riguardanti alcuni dei principali aspetti della gestione e del trattamento del LES, tra cui l’efficacia e la rapidità d’azione di anifrolumab. Questi risultati, infatti, hanno fornito delle prime indicazioni sul valore di anifrolumab, nonché sull’importanza dell’utilizzo degli endpoint compositi, delle PROM e dei questionari sulla qualità di vita nella gestione del paziente affetto da LES.
Acknowledgements
Si ringraziano, per la partecipazione all’Expert Panel:
Beretta Lorenzo, Direttore dello “Scleroderma Unit”, referente del centro di riferimento per le malattie autoimmuni sistemiche e dell’ambulatorio di reumatologia, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano; Conti Fabrizio, Professore associato di reumatologia, dipartimento di scienze cliniche internistiche, anestesiologiche e cardiovascolari, Sapienza Università di Roma; Direttore dell’Unità di Reumatologia, AOU Policlinico Umberto I; Dagna Lorenzo, Professore associato di medicina, direttore dell’Unità di Immunologia, Reumatologia, Allergologia e Malattie Rare, Istituto Scientifico IRCCS San Raffaele, Milano; Emmi Giacomo, Medico specialista in immunologia clinica; Dipartimento di medicina sperimentale e clinica, Università di Firenze; Franceschini Franco, Professore di Reumatologia, Direttore della Scuola di Specializzazione in Reumatologia e responsabile Unità di Reumatologia e Immunologia Clinica, ASST Spedali Civili – Brescia; Giacomelli Roberto, Professore Ordinario di Reumatologia, direttore U.O.C. di Immunoreumatologia, Policlinico Universitario Campus Bio-Medico, Roma; Govoni Marcello, Professore Ordinario, Azienda Ospedaliero Universitaria S. Anna – Ferrara Direttore di Unità Operativa Complessa di Reumatologia; Gremese Elisa, Professoressa Associata di reumatologia, U.O.C. di Reumatologia, Policlinico Universitario Agostino Gemelli, Università Cattolica del Sacro Cuore, Roma; Piga Matteo, Professore associato di reumatologia, Università degli Studi di Cagliari.
Disclosures
Conflict of interest: The Authors declare no conflicts of interest.
Financial support: This research was made possible by an educational grant from AstraZeneca S.p.A.
Bibliografia
- 1. Justiz Vaillant AA, Goyal A, Varacallo M. Systemic Lupus Erythematosus. 2022 Jul 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022. PubMed
- 2. Maidhof W, Hilas O. Lupus: an overview of the disease and management options. P&T. 2012;37(4):240-249. PubMed
- 3. Sebastiani GD, Spinelli FR, Bartoloni E, et al. Baseline characteristics of systemic lupus erythematosus patients included in the Lupus Italian Registry of the Italian Society for Rheumatology. Lupus. 2021;30(8):1233-1243. CrossRef PubMed
- 4. Sebastiani GD, Prevete I, Iuliano A, et al. Early Lupus Project: one-year follow-up of an Italian cohort of patients with systemic lupus erythematosus of recent onset. Lupus. 2018;27(9):1479-1488. CrossRef PubMed
- 5. Sebastiani GD, Prevete I, Piga M, et al. Early Lupus Project – A multicentre Italian study on systemic lupus erythematosus of recent onset. Lupus. 2015;24(12):1276-1282. CrossRef PubMed
- 6. Prevete I, Espinosa G, Bellisai F, et al; Gruppo di Studio SIR sul Lupus Eritematoso Sistemico di recente insorgenza-Early Lupus and Registro Español de pacientes con Lupus Eritematoso Sistémico (RELES), Autoimmune Diseases Study Group (GEAS). Comparative study between two European inception cohorts of patients with early systemic lupus erythematosus. Clin Exp Rheumatol. 2020;38(5):925-932. PubMed
- 7. Specchia ML, Cadeddu C, Di Pietro ML, et al. Health technology assessment of belimumab: a new monoclonal antibody for the treatment of systemic lupus erythematosus. BioMed Research International. 2014;2014:704207-704215. CrossRef PubMed
- 8. Thong B, Olsen NJ. Systemic lupus erythematosus diagnosis and management. Rheumatology (Oxford). 2017;56(suppl 1): i3-i13. PubMed
- 9. Lateef A, Petri M. Unmet medical needs in systemic lupus erythematosus. Arthritis Res Ther. 2012;14(suppl 4):S4. CrossRef PubMed
- 10. Gordon C, Amissah-Arthur MB, Gayed M, et al; British Society for Rheumatology Standards, Audit and Guidelines Working Group. The British Society for Rheumatology guideline for the management of systemic lupus erythematosus in adults. Rheumatology (Oxford). 2018;57(1):e1-e45. CrossRef PubMed
- 11. Tsioni V, Andreoli L, Meini A, et al. The prevalence and incidence of systemic lupus erythematosus in children and adults: a population-based study in a mountain community in northern Italy. Clin Exp Rheumatol. 2015;33(5):681-687. PubMed
- 12. AstraZeneca. Ricerca di mercato 2021. Data on file.
- 13. Epidemiology of Systemic Lupus Erythematosus pages in Systemic Lupus Erythematosus. A Companion to Rheumatology. Mosby. 2007;1-18. Online
- 14. Zen M, Bassi N, Nalotto L, et al. Disease activity patterns in a monocentric cohort of SLE patients: a seven-year follow-up study. Clin Exp Rheumatol. 2012;30(6):856-863. PubMed
- 15. Pons-Estel GJ, Alarcón GS, Scofield L, Reinlib L, Cooper GS. Understanding the epidemiology and progression of systemic lupus erythematosus. Semin Arthritis Rheum. 2010;39(4): 257-268. CrossRef PubMed
- 16. Deijns SJ, Broen JCA, Kruyt ND et al. The immunologic etiology of psychiatric manifestations in systemic lupus erythematosus: A narrative review on the role of the blood brain barrier, antibodies, cytokines and chemokines. Autoimmun Rev. 2020 Aug;19(8):102592. CrossRef PubMed
- 17. Hess EV, Farhey Y. Etiology, environmental relationships, epidemiology, and genetics of systemic lupus erythematosus. Curr Opin Rheumatol. 1995;7(5):371-375. CrossRef PubMed
- 18. Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheumatol. 2019;71(9):1400-1412. CrossRef PubMed
- 19. Furie RA, Petri MA, Wallace DJ, et al. Novel evidence-based systemic lupus erythematosus responder index. Arthritis Rheum. 2009;61(9):1143-1151. CrossRef PubMed
- 20. Mikdashi J, Nived O. Measuring disease activity in adults with systemic lupus erythematosus: the challenges of administrative burden and responsiveness to patient concerns in clinical research. Arthritis Res Ther. 2015;17(1):183. CrossRef PubMed
- 21. Tanaka Y, Mizukami A, Kobayashi A, Ito C, Matsuki T. Disease severity and economic burden in Japanese patients with systemic lupus erythematosus: A retrospective, observational study. Int J Rheum Dis. 2018;21(8):1609-1618. CrossRef PubMed
- 22. Navarra SV, Guzmán RM, Gallacher AE, et al; BLISS-52 Study Group. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet. 2011;377(9767):721-731. CrossRef PubMed
- 23. Furie R, Petri M, Zamani O, et al; BLISS-76 Study Group. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63(12):3918-3930. CrossRef PubMed
- 24. Wallace DJ, Kalunian K, Petri MA, et al. Efficacy and safety of epratuzumab in patients with moderate/severe active systemic lupus erythematosus: results from EMBLEM, a phase IIb, randomised, double-blind, placebo-controlled, multicentre study. Ann Rheum Dis. 2014;73(1):183-190. CrossRef PubMed
- 25. Piga M, Floris A, Sebastiani GD, et al. Risk factors of damage in early diagnosed systemic lupus erythematosus: results of the Italian multicentre Early Lupus Project inception cohort. Rheumatology (Oxford). 2020;59(9):2272-2281. CrossRef PubMed
- 26. Polachek A, Gladman DD, Su J, Urowitz MB. Defining Low Disease Activity in Systemic Lupus Erythematosus. Arthritis Care Res (Hoboken). 2017;69(7):997-1003. CrossRef PubMed
- 27. Mahieu MA, Strand V, Simon LS, Lipsky PE, Ramsey-Goldman R. A critical review of clinical trials in systemic lupus erythematosus. Lupus. 2016;25(10):1122-1140. CrossRef PubMed
- 28. Lupus Research Alliance. Baricitinib Development as a Lupus Treatment Discontinued. Online (Accessed January 2022).
- 29. Riggs JM, Hanna RN, Rajan B, et al. Characterisation of anifrolumab, a fully human anti-interferon receptor antagonist antibody for the treatment of systemic lupus erythematosus. Lupus Sci Med. 2018;5(1):e000261. CrossRef PubMed
- 30. Lichtman EI, Helfgott SM, Kriegel MA. Emerging therapies for systemic lupus erythematosus--focus on targeting interferon-alpha. Clin Immunol. 2012;143(3):210-221. CrossRef PubMed
- 31. Furie RA, Morand EF, Bruce IN et al. Type I interferon inhibitor anifrolumab in active systemic lupus erythematosus (TULIP-1): a randomised, controlled, phase 3 trial. The Lancet Rheumatology 2019;1(4):e219-e219. CrossRef
- 32. Morand EF, Furie R, Tanaka Y, et al; TULIP-2 Trial Investigators. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020;382(3):211-221. CrossRef PubMed
- 33. Preedy VR, Watson RR, eds. 5-Point Likert Scale. In: Handbook of Disease Burdens and Quality of Life Measures. Springer; 2010, CrossRef
- 34. Humphrey-Murto S, Varpio L, Wood TJ, et al. The use of the Delphi and other consensus group methods in medical education research: a review. Acad Med. 2017;92(10):1491-1498. CrossRef PubMed
- 35. Schneider P, Evaniew N, Rendon JS, et al; PARITY Investigators. Moving forward through consensus: protocol for a modified Delphi approach to determine the top research priorities in the field of orthopaedic oncology. BMJ Open. 2016;6(5):e011780. CrossRef PubMed
- 36. Vogel C, Zwolinsky S, Griffiths C, Hobbs M, Henderson E, Wilkins E. A Delphi study to build consensus on the definition and use of big data in obesity research. Int J Obes. 2019;43(12):2573-2586. CrossRef PubMed
- 37. Ab Latif R, Dahlan A, Ab Mulud Z, Mat Nor MZ. The Delphi technique as a method to obtain consensus in health care education research. Educ Med J. 2017;9(3):89-102. CrossRef
- 38. De Meyer D, Kottner J, Beele H, et al. Delphi procedure in core outcome set development: rating scale and consensus criteria determined outcome selection. J Clin Epidemiol. 2019;111:23-31. CrossRef PubMed
- 39. Avella JR. Delphi panels: research design, procedures, advantages, and challenges. Int J Dr Stud. 2016;11:305-321. CrossRef
- 40. Akins RB, Tolson H, Cole BR. Stability of response characteristics of a Delphi panel: application of bootstrap data expansion. BMC Med Res Methodol. 2005;5(1):37. CrossRef PubMed
- 41. Iqbal S, Pipon-Young L. The Delphi method. Psychologist. 2009;22(7):598-601.