 |
Glob Reg Health Technol Assess 2022; 9: 105-116 ISSN 2283-5733 | DOI: 10.33393/grhta.2022.2412 ORIGINAL RESEARCH ARTICLE |
 |
Valutazione economica di treosulfan in pazienti sottoposti a trapianto allogenico di cellule staminali ematopoietiche
Economic evaluation of treosulfan in patients undergoing allogeneic haematopoietic stem cell transplantation
Objective: To assess the cost-effectiveness and economic sustainability of treosulfan plus fludarabine compared with busulfan plus fludarabine as a conditioning treatment for malignant disease prior to allogeneic haematopoietic stem cell transplantation (alloHSCT) in adult patients in Italy.
Method: The two theoretical cohorts of patients aged ≥ 60 years with acute myeloid leukaemia (AML) and myelodysplastic syndrome (MDS) were pooled and followed over time using a partitioned survival model with cycles of 28 days. Patients can transition between a post-HSCT recovery/remission state (Event-Free Survival state, EFS state), a relapsed/progressed disease state, and a death state. A lifetime horizon for cost-effectiveness analysis and a 5-years’ time horizon for budget impact analysis were used. The perspective of the Italian National Health Service was adopted. Utility values were obtained from published sources. Costs included: drug acquisition, HSCT procedure, management and treatment of adverse reactions, graft-versus-host disease (GvHD) and health states, end of life treatment. Discounting of 3% per year was applied for both costs and outcomes according to Italian guidelines. Sensitivity was tested through both one-way and probabilistic analyses.
Results: Cost-effectiveness analysis showed that treosulfan is both more effective and less expensive compared with busulfan (+1.08 life-years, +0.95 quality-adjusted life-years per patient and –€ 41,388 per patient). On the side of economic sustainability, the introduction of treosulfan in the market could generate a cumulative decrement of the expense incurred by NHS of about –€ 212,063 over five years.
Conclusion: Treosulfan could represent a cost-effective and sustainable treatment alternative from the perspective of the NHS.
Keywords: Acute Myeloid Leukaemia, alloHSCT, Myelodysplastic syndrome, Treosulfan
Received: April 13, 2022
Accepted: September 6, 2022
Published online: October 5, 2022
This article includes supplementary material
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il trapianto con cellule staminali ematopoietiche (Haematopoietic Stem Cell Transplantation, HSCT) e le terapie di condizionamento comportano diverse procedure complesse che richiedono un alto livello di competenza e sono di conseguenza associati a costi complessivi elevati. La terapia di condizionamento contribuisce notevolmente al successo del trapianto allogenico di cellule staminali ematopoietiche (AlloTCSE) e, in quanto tale, può avere un impatto sui costi post-trapianto, come quelli relativi alla ricaduta post-TCSE, alla tossicità legata al trattamento e alle complicanze precoci e tardive legate al trattamento.
Dal momento che non risultano disponibili Linee Guida sulla scelta dei regimi di condizionamento ottimali, la pratica clinica risulta variabile tra i vari paesi. Ciò è dovuto principalmente alla mancanza di prove comparative derivanti da studi clinici controllati randomizzati di fase 3 (1-3). I dati del Center for International Blood and Marrow Transplant Research (CIBMTR) indicano l’irradiazione corporea totale, busulfano in combinazione con ciclofosfamide o fludarabina e fludarabina in combinazione con melfalan come i regimi di condizionamento più comunemente utilizzati per i pazienti con leucemia mieloide acuta (LMA) e sindrome mielodisplastica (SMD) sottoposti a TCSE mieloablativo o a intensità ridotta (4) (Fig. 1). La combinazione a dose ridotta di busulfano e fludarabina rappresenta uno dei regimi di condizionamento a intensità ridotta più frequentemente utilizzato e ampiamente accettato, in particolare per i pazienti con LMA e SMD (5-7). Di conseguenza, tale combinazione è risultata essere il competitor selezionato nello studio clinico di treosulfan più fludarabina MC-FludT.14/L (8,9).
Treosulfan rappresenta il primo farmaco con indicazione approvata nell’ambito del regime di condizionamento del trapianto di cellule staminali emopoietiche (CSE) del bambino e dell’adulto affetti da patologia oncologica e non oncologica ad alto rischio di tossicità.
A oggi non sono stati individuati specifici studi farmacoeconomici condotti in Italia o in altri paesi in riferimento al treosulfan. L’obiettivo dello studio farmaco-economico qui di seguito riportato è quello di valutare l’impatto in termini di costo-efficacia di treosulfan in combinazione con fludarabina come parte del trattamento di condizionamento prima del trapianto di cellule staminali ematopoietiche allogeniche (AlloTCSE) rispetto al trattamento di condizionamento con busulfano in combinazione con fludarabina in pazienti adulti con patologie maligne.
In particolare, nell’analisi sono state considerate la leucemia mieloide acuta (LMA) e la sindrome mielodisplastica (SMD). Al fine di valutare la sostenibilità economica dell’introduzione sul mercato di treosulfan in combinazione con fludarabina da parte del Servizio Sanitario Nazionale (SSN) è stata inoltre condotta un’analisi di impatto sul budget considerando non solo i costi di acquisizione dei farmaci ma anche il costo derivante dal percorso diagnostico terapeutico dei pazienti con LMA e SMD.
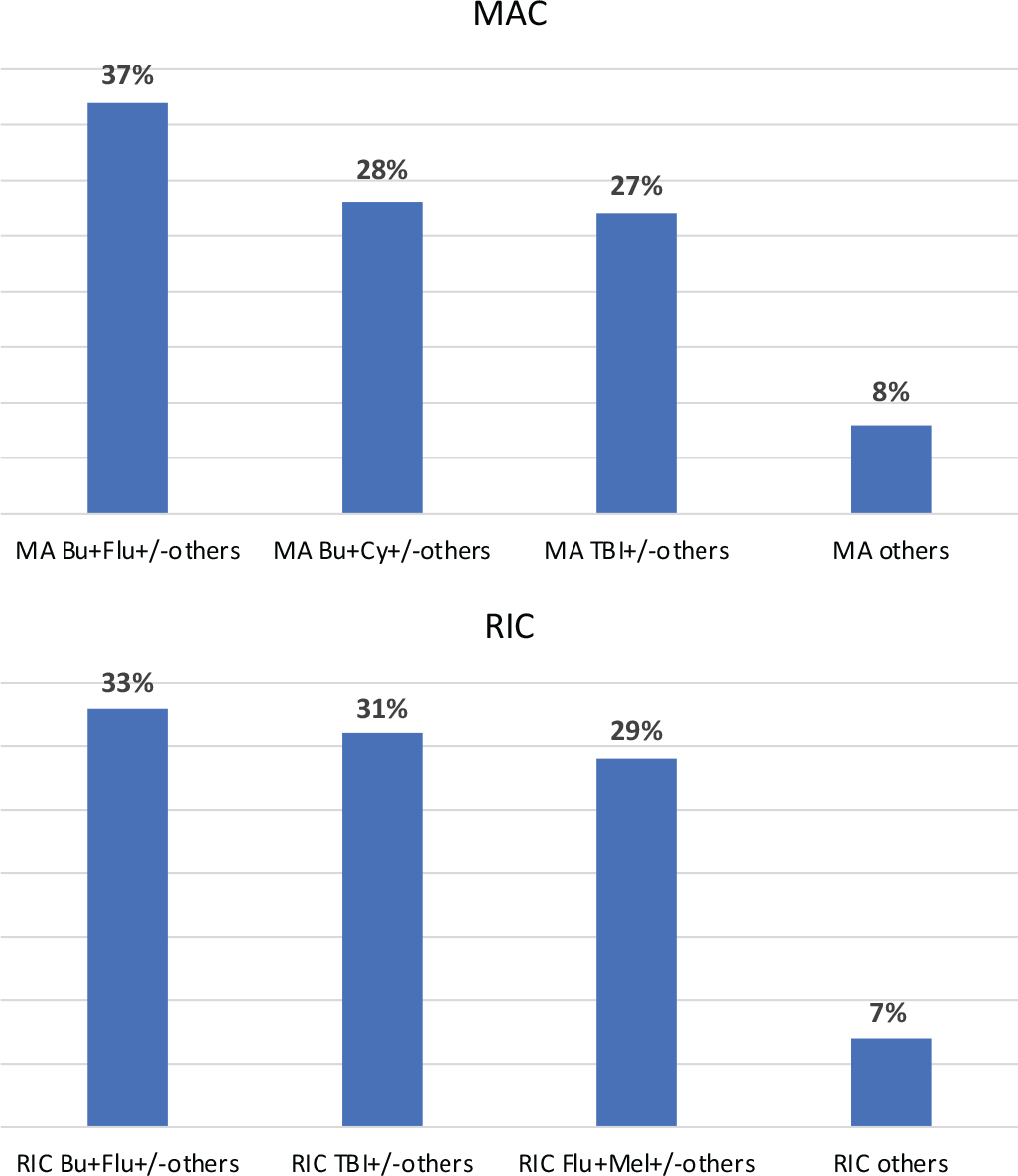
Fig. 1 - Regimi di condizionamento comunemente usati in LMA e SMD sottoposti a TCSE. Dati CIBMTR 2007-2017 (4).
Abbreviazioni: allo: allogeneic; bu: busulfan; cy: cyclophosphamide; flu: fludarabine; HSCT: haematopoietic stem cell transplantation; MAC: myeloablative conditioning; Mel: melphalan; RIC: reduced-intensity conditioning; TBI: total body irradiation.
Metodi
Entrambe le analisi, costo efficacia e impatto sul budget, sono state effettuate nella prospettiva del SSN, dunque considerando i soli costi diretti sanitari (costo visite, trattamenti, monitoraggio, gestione eventi avversi, ecc.). Al fine di intercettare costi e benefici di treosulfan in combinazione con fludarabina come parte del trattamento di condizionamento prima del TCSE e dal momento che il TCSE rappresenta un trattamento potenzialmente curativo, per l’analisi di costo-efficacia è stato ipotizzato un orizzonte temporale lifetime (40 anni).
Con riferimento all’analisi di impatto sul budget è stato considerato un orizzonte temporale pari a 5 anni. Vista l’incertezza sui cambiamenti futuri del mercato, non si è ritenuto necessario un orizzonte temporale più lungo. Sia i costi che gli outcome sono stati scontati a un tasso del 3% annuo come comunemente assunto in analisi di questo genere (10). L’analisi è stata condotta tenendo conto delle Linee Guida CHEERS 2022 (Consolidated Health Economic Evaluation Reporting Standards 2022) (11) (Materiale Supplementare).
Popolazione eleggibile e quote di mercato
Per il 2022 in Italia sono attesi circa 1.907 trapianti allogenici (GITMO, Gruppo Italiano per il trapianto di midollo osseo, cellule staminali emopoietiche e terapia cellulare (12)); di questi, i pazienti che sono eleggibili al trattamento con treosulfan e che quindi al momento risultano trattati con busulfano sono i pazienti con LMA (802), i pazienti con SMD (159) e i pazienti con ALL abitualmente trattati con terapia radiante, pari a circa un terzo dei pazienti con ALL (315/3 = 105) (Tab. I) (12). La popolazione eleggibile a treosulfan risulta in questo modo pari a 1.066 pazienti. Nello scenario attuale, la distribuzione di questi pazienti tra i regimi di condizionamento attualmente disponibili in Italia a base di busulfano è stata estrapolata attraverso i dati IQVIA (dati aggiornati a dicembre 2018). Con riferimento all scenario alternativo in cui si assume che una quota di pazienti con LMA e SMD verrà trattata con il nuovo farmaco è stato assunto che il 15% dei pazienti verrà trattato con treosulfan. Nella Tabella II sono riportate le quote di mercato associate a ciascun trattamento con riferimento al caso-base e allo scenario in cui si assume l’introduzione di treosulfan sul mercato.
| N | |
|---|---|
| ALL (eleggibili a treosulfan → circa un terzo) | 105 |
| LMA | 802 |
| SMD | 159 |
| ALL+LMA+SMD | 1.066 |
ALL: Leucemia linfoblastica acuta; LMA: Leucemia mieloide acuta; SMD: Sindrome mielodisplastica.
| Trattamento | Caso-base | Scenario |
|---|---|---|
| TREOSULFAN | 0% | 15% |
| BUSULFANO G1 | 31% | 26% |
| BUSULFANO G2 | 36% | 31% |
| BUSULFANO G3 | 33% | 28% |
| Totale | 100,0% | 100,0% |
G1: Generico 1; G2: Generico 2; G3: Generico 3.
Struttura del modello
L’analisi è stata condotta a partire dal modello impiegato per la valutazione di treosulfan in UK (13). Le due coorti teoriche di pazienti di età ≥ 60 anni con LMA e SMD sono state raggruppate e seguite nel tempo mediante un modello di sopravvivenza partizionato (partitioned survival model) con cicli di durata pari a 28 giorni (Fig. 2).
I pazienti entrano nel modello dopo aver ricevuto un TCSE e il passaggio tra i diversi stati di salute è determinato dalle curve di sopravvivenza libera da eventi (event-free survival, EFS) e di sopravvivenza globale (overall survival, OS). Nel modello di sopravvivenza partizionato la coorte teorica raggruppata di pazienti con LMA e SMD ha la possibilità di muoversi tra lo stato di recupero/remissione post-TCSE (stato EFS), lo stato di ricaduta di malattia o progressione di malattia e lo stato di morte. Il modello di sopravvivenza partizionato permette di modellizzare l’appartenenza a ciascuno stato di salute direttamente mediante le curve di sopravvivenza riportate negli studi clinici. Tale modello presenta il vantaggio di non dover sottostare a ipotesi più restrittive di norma presenti nei modelli markoviani, come, per esempio, la necessità di trasformare i dati osservati in probabilità di transizione.
Dal momento che il treosulfan rappresenta una terapia di codizionamento che influisce sull’efficacia del TCSE e che costituisce una procedura terapeutica con costi considerevoli e impatti a lungo termine, un modello ad albero decisionale non sarebbe stato in grado di catturarne con precisione i benefici a lungo termine.
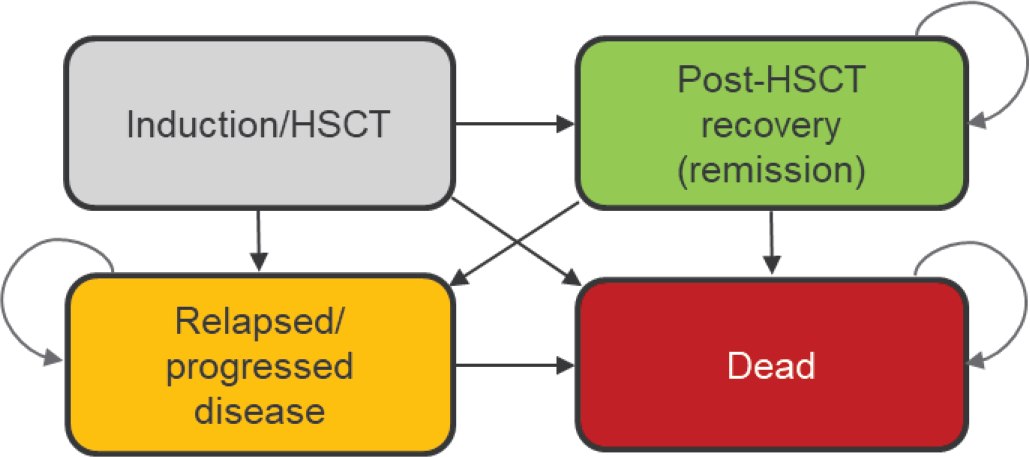
Fig. 2 - Schema di partitioned survival model per la coorte teorica di pazienti di età ≥ 60 anni con LMA e SMD post TCSE (13).
Dati di efficacia
Le evidenze di efficacia impiegate in questa analisi derivano dallo studio clinico MC-FludT.14/L (8,9). Lo studio clinico MC-FludT.14/L è uno studio di fase 3 randomizzato, multicentrico internazionale di non inferiorità per valutare l’efficacia e la sicurezza di treosulfan in combinazione con fludarabina rispetto a busulfano a dose ridotta in combinazione con fludarabina come terapia di condizionamento per il TCSE allogenico negli adulti con LMA e SDM considerati non ideonei alla terapia di condizionamento standard. Con un totale di 570 pazienti randomizzati, questo studio rappresenta il più grande RCT prospettico mai eseguito per il confronto di due regimi di condizionamento.
La popolazione di pazienti considerata nel modello conserva le caratteristiche della popolazione arruolata nello studio clinico MC-FludT.14/L. I dati di OS ed EFS provenienti dallo studio clinico MC-FludT.14/L rappresentano gli input chiave del modello.
I dati di sopravvivenza sono stati registrati per la durata della sperimentazione clinica (fino a 1.586 giorni); di conseguenza, al fine di fornire una stima della sopravvivenza per l’intero orizzonte temporale dell’analisi (lifetime), è risultato necessario adattare delle specifiche curve parametriche ai dati clinici. La modellizzazione delle curve di OS e EFS è stata effettuata sulla base di quanto emerso dall’analisi condotta dall’unità di supporto alle decisioni del NICE (13,14). In base alle raccomandazioni fornite dal NICE (13,14), per entrambi i bracci di trattamento e per entrambe le curve (EFS e OS) è stato considerato il modello di cura log-normale non misto (non-mixture-cure models, NMCM). L’approfondimento circa l’adattamento delle curve di EFS e OS ai diversi modelli è consultabile nella valutazione condotta in UK per treosulfan (13).
Mortalità
Dal momento che il TCSE rappresenta un trattamento potenzialmente curativo, in accordo con il team di clinici con esperienza nel trattamento della LMA e della SDM consultati ai fini dell’analisi, a 5 anni dal trapianto il modello considera un “punto di cura”. Questo dato è stato ulteriormente confermato da un secondo gruppo di esperti, il quale ha affermato che la mortalità a lungo termine risulta influenzata, oltre che dall’eziologia del TCSE, dalle complicanze o dagli esiti a lungo termine relativi al TCSE stesso. Prima del punto di cura la mortalità viene definita dalle curve parametriche di OS ed EFS e, dopo tale punto, questa viene determinata dalle tavole di mortalità della popolazione generale aggiustate per il tasso di mortalità standardizzato (SMR) per il TCSE.
Gli SMR per i pazienti con TCSE sono stati ottenuti dallo studio di Martin et al. 2010 (15), il quale ha stimato gli SMR per una coorte di pazienti sottoposti a TCSE per il trattamento di varie patologie, tra cui LMA e SDM (15). Dopo il confronto con il team di esperti clinici, all’interno dell’analisi è stato deciso di impiegare l’hazard ratio stimato dallo studio di Martin et al. e utilizzato dal NICE nella valutazione di una nuova tecnologia per la LMA (16) pari a 2,3.
Questo approccio di modellizzazione della mortalità a lungo termine è risultato appropriato per la popolazione LMA + SDM in quanto il team di esperti riteneva che la capacità da parte di una minoranza di pazienti con LMA o SDM di ricaduta molto tempo dopo la procedura di TCSE fosse importante da catturare poichè la maggior parte degli eventi di morte dopo 5 anni dal trapianto risulterebbe attribuibile al TCSE piuttosto che alla ricaduta da LMA o SDM. Al fine di tenere conto di questa piccola popolazione di pazienti con ricaduta tardiva, questo approccio è stato utilizzato sia per l’OS sia per l’EFS. L’approfondimento circa l’adattamento della mortalità nel lungo termine è consultabile nella valutazione condotta in UK per treosulfan (13).
Qualità di vita e stima delle utilità
I dati sulla qualità di vita non sono stati raccolti all’interno dello studio clinico MC-FludT.14/L, pertanto le stime di utilità sono state identificate attraverso una revisione sistematica della letteratura (17).
Per gli stati di salute di induzione/TCSE e recupero post-TCSE le stime di utilità sono state ottenute dal lavoro di Grulke et al. 2012 (18); dal momento che tale studio ha stimato la qualità di vita dei pazienti prima e dopo il trapianto di cellule staminali ematopoietiche mediante il questionario EORTC QLQ-C30, al fine di predire i dati EQ-5D si è resa necessaria una mappatura dei risultati del lavoro di Grulke et al. Al fine di effettuare tale mappatura sono stati raccolti diversi algoritmi (19,20); per questa analisi è stato scelto l’algoritmo di Proskorovsky et al. 2014 (19) in quanto è risultato essere l’algoritmo tale da produrre l’insieme più plausibile di valori EQ-5D mappati per lo studio QLQ-C30 (Grulke et al. 2012). Inoltre, tale algoritmo è stato utilizzato dal NICE nella valutazione di una nuova tecnologia per il trattamento della leucemia mieloide acuta con oltre il 30% di blasti nel midollo osseo (TA399 (21)); tale lavoro del NICE è stato identificato come riferimento per la stima dell’utilità associata alla ricaduta e alla disutilità degli eventi avversi.
Per la stima delle utilità associate allo stato di salute di ricaduta/progressione, sono state impiegate le valutazioni del NICE TA399 (21) e TA545 (20); anche in questo caso i dati EQ-5D sono stati ottenuti mediante l’applicazione dell’algoritmo di Proskorovsky et al. 2014.
Per ciascuna stima di utilità sono stati calcolati dei moltiplicatori di disutilità; tali moltiplicatori sono stati stimati tenendo conto della funzione di utilità della popolazione generale e dell’età media dei pazienti arruolati in ciascuno studio sulla qualità di vita impiegato nell’analisi (Grulke et al. 2012. e TA399 e TA545). I moltiplicatori sono stati successivamente applicati alla funzione di utilità generale della popolazione in modo tale da produrre funzioni di utilità per ciascuno stato di salute in corrispondenza di ciascuna età (da 0 a 100 anni). L’approccio del moltiplicatore è stato impiegato sia per produrre funzioni di utilità per ciascuno stato di salute sia per generare la curva di ricaduta/progressione relativamente al recupero post-TCSE a breve termine (≤ 6 mesi) (17).
Nella Tabella III sono riportate le stime di utilità impiegate nel modello per ciascuno stato di salute.
Al fine di ottenere stime sulla qualità della vita associata alla malattia da trapianto contro l’ospite (graft-versus-host disease, GvHD) è stata condotta una revisione delle letteratura (17). Sulla base dello studio di Kurosawa et al. 2016 (22) alla GVHD è stata associata una disutilità pari a 0,12 (Tab. IV).
Le disutilità associate agli altri eventi avversi di grado 3-4 inclusi nel modello, sono state ottenute dallo studio TA399 (21) sulla base delle diverse mappature dei dati QLQ-C30 (Tab. IV). Tali disutilità sono state distribuite in base alla durata media di ciascun evento avverso.
| Stime di utilità per lo stato di cura funzionale/TCSE | Utilità | Età media dei pazienti | Moltiplicatore di disutilità | Fonte |
|---|---|---|---|---|
| Induzione/TCSE | 0,558 | 42,5 | 0,623 | Grulke 2012 (18); Proskorovsky 2014 (19) |
| Recupero post-TCSE (breve termine) | ||||
| Dimissione | 0,660 | 42,5 | 0,738 | Grulke 2012 (18); Proskorovsky 2014 (19) |
| ≤ 6 mesi | 0,756 | 42,5 | 0,845 | |
| 7-12 mesi | 0,818 | 42,5 | 0,915 | |
| Recupero post-TCSE (lungo termine) | ||||
| Anno 2 | 0,822 | 42,5 | 0,919 | Grulke 2012 (18); Proskorovsky 2014 (19) |
| Anno 3 | 0,822 | 42,5 | 0,919 | |
| Anno 4+ | 0,870 | 42,5 | 0,973 | |
| Curato funzionalmente | 0,870 | 42,5 | 0,973 | Assunto uguale all’anno 4+ |
| Stime di utilità per lo stato di ricaduta/progressione | Utilità | Età media dei pazienti | Moltiplicatore di disutilità | Fonte |
| Ricaduta/progressione | ||||
| Ricaduta/progressione (LMA) | 0,623 | 75,0 | 0,809 | TA399/TA545 (20,21); Proskorovsky 2014 (19) |
| Ricaduta/progressione (SDM) | 0,623 | 75,0 | 0,809 | Assunto uguale a LMA |
| Disutilità associate a GvHD | Disutilità | Età media dei pazienti | Moltiplicatore di disutilità | Fonte |
|---|---|---|---|---|
| GvHD cronica estesa | –0,120 | 51,4 | –0,139 | Kurosawa 2016 (22) |
| GvHD acuta in stadio III-IV | –0,120 | 51,4 | –0,139 | Assunto uguale a GvHD cronica |
| Disutilità associate agli altri eventi avversi | Disutilità | Età media dei pazienti | Moltiplicatore di disutilità | Fonte |
| Eventi avversi di grado ≥ III | –0,024 | 75,0 | –0,032 | TA399/TA545 (20,21) |
| Infezione grave | –0,024 | 75,0 | –0,032 | Assunto uguale alla stima per gli eventi avversi di grado ≥ III |
| Diarrea grave | –0,024 | 75,0 | –0,032 | |
| Grave arrossamento/desquamazione della pelle | –0,024 | 75,0 | –0,032 | |
| Emocromo anormalmente basso | –0,024 | 75,0 | –0,032 |
Parametri di costo
All’interno dell’analisi sono stati considerati il costo di acquisizione dei farmaci e della procedura TCSE, i costi di gestione e trattamento relativi a ciascuno stato di salute ed evento avverso, il costo della GvHD e il costo associato alle cure di fine vita.
Con riferimento al costo di somministrazione, dal momento che nella sperimentazione clinica non vi è stata alcuna differenza nei tempi di somministrazione di treosulfan e busulfano (120 minuti), all’interno dell’analisi è stato assunto che tale costo sia catturato dalla stima del costo ospedaliero stimato per la procedura di TCSE.
Il costo di acquisizione per treosulfan e busulfano è stato calcolato considerando i regimi di somministrazione presenti nello studio clinico. Il costo del busulfano è stato stimato mediante una media dei costi relativi alle 3 confezioni generiche ponderata per le rispettive quote di mercato (Tabella A supplementare) e relativi all’anno 2018. I trattamenti concomitanti considerati nel modello per i pazienti trattati con busulfano sono risultati i seguenti: fenitoina, fludarabina, globulina anti-timociti (ATG) (solo per i pazienti con donatore abbinato non collegato, Matched unrelated donor), ciclosporina (e.v. e orale), metotrexato e calcio folinato. Tali trattamenti concomitanti sono stati considerati anche per il treosulfan a eccezione della fenitoina. Ciascun costo di acquisizione è stato calcolato considerando il peso o la superficie corporea (BSA). Il modello ha considerato il peso medio e il BSA medio presenti nello studio clinico e relativi alla popolazione totale (rispettivamente pari a 80,2 kg e a 1,931 m2). Per tutti i trattamenti concomitanti è stato considerato il costo al mg più basso. I costi associati allo spreco non sono stati considerati. La Tabella A supplementare riporta la modalità di somministrazione e il costo di acquisizione per ciascun trattamento considerato all’interno dell’analisi.
Il costo del TCSE è stato stimato mediante il flusso informativo delle Schede di Dimissione Ospedaliera (SDO) nazionale dal 2014 al 2016 mediante la selezione di tutti i ricoveri con intervento principale o secondario tra quelli presenti nella Tabella B supplementare.
Attraverso tale metodologia, il costo del ricovero per TCSE è risultato essere pari a € 37.401,81.
Tenendo conto dei costi di acquisizione sopra riportati e del costo del TCSE, il costo totale della terapia con treosulfan è risultato pari a € 53.817,14, mentre il costo totale della terapia con busulfano è risultato pari a € 44.870,29.
Le voci di costo impiegate per la valorizzazione degli stati di salute e la frequenza con cui ciascuna risorsa sanitaria viene impiegata per la gestione e il trattamento dei pazienti all’interno di ciascuno stato di salute sono riassunte rispettivamente nelle Tabelle V e VI. I costi associati a ciascuno stato di salute comprendono il costo delle giornate di ospedalizzazione, i costi di monitoraggio, il costo delle trasfusioni e il costo dei farmaci.
In particolare, con riferimento allo stato di salute di recupero post-TCSE, i costi sono stati considerati distinguendo tra recupero post-TCSE a breve termine (≤6 mesi e 7-12 mesi) e recupero post-TCSE a lungo termine (12-24 mesi e >24 mesi). I costi associati agli stati di recupero post-TCSE a breve termine e a lungo termine tra i 12 e i 24 mesi sono stati ottenuti dalla valutazione del NICE TA545 e convertiti in valori in euro, in quanto dalla letteratura non sono emersi dati relativi al contesto nazionale. Il costo associato al recupero post-TCSE a lungo termine oltre i 24 mesi è stato individuato mediante il supporto del team di esperti clinici e valorizzato mediante il tariffario nazionale delle prestazioni di assistenza specialistica (23). Il costo annuo relativo al monitoraggio dopo i 24 mesi è risultato pari a € 79,32 corrispondente a un costo per ciclo pari a € 6,10.
Con riferimento al costo dello stato di ricaduta/progressione, i costi sono stati stimati distinguendo tra ricaduta precoce (< 12 mesi) e tardiva (> 12 mesi). I costi associati alla ricaduta sono stati stimati considerando i costi delle giornate di degenza, i costi di monitoraggio, il costo delle trasfusioni (piastrine e globuli rossi) e i costi associati alla somministrazione dei farmaci.
In particolare, con riferimento ai costi dei farmaci, per le ricadute precoci sono stati considerati i costi di somministrazione dell’azacitidina, della chemioterapia di salvataggio (mitotraxone, etoposide, citarabina) e della chemioterapia palliativa (idrossicarbamide); per le ricadute tardive sono stati considerati i costi di somministrazione del regime Flag-IDA (fludarabina, citarabina, idarubicina e G-CSF) e il costo di un secondo TCSE, calcolato come costo medio tra il costo totale della terapia con treosulfan e il costo totale della terapia con busulfano. Per il calcolo dei costi dei farmaci somministrati per via endovenosa è stato considerato uno spreco del 100% della parte restante del farmaco.
| Recupero post-TCSE | |||
|---|---|---|---|
| Recupero post-TCSE a breve termine | Costo unitario | Fonte | |
| ≤ 6 mesi | € 5.673,56 | NICE TA545 (18) (valori convertiti in euro mediante il tasso di cambio) | |
| 7-12 mesi | € 3.897,60 | ||
| Recupero post-TCSE a lungo termine | Costo unitario | Fonte | |
| 12-24 mesi | € 1.405,92 | NICE TA545 (18) (valori convertiti in euro mediante il tasso di cambio) | |
| > 24 mesi | € 6,10 | KOL opinion + tariffario nazionale specialistica (21) | |
| Costi di monitoraggio per recupero post-TCSE a lungo termine > 24 mesi | Costo unitario | Fonte costo | |
| Analisi del sangue | € 5,78 | Tariffario nazionale specialistica codici 90.62.2 e 91.49.2 (21) | |
| Visita di ematologia | € 20,66 | Tariffario nazionale specialistica codice 89.7 (21) | |
| Ricaduta/Progressione | |||
| Risorsa | Costo unitario | Costo per ciclo | Fonte costo |
| Giorno di ricovero | € 674,00 | € 1.759,14 | Libro verde sulla spesa pubblica (costo medio per giornata di degenza a livello nazionale) (22) |
| Monitoraggio | Costo unitario | Costo per ciclo | Fonte costo |
| Biopsia del midollo osseo | € 48,86 | € 1,47 | Tariffario nazionale specialistica codice 41.31 (21) |
| Macchie di sangue periferico | € 3,42 | € 2,53 | Tariffario nazionale specialistica codice 90.63.4 (21) |
| Analisi del sangue | € 5,78 | € 48,15 | Tariffario nazionale specialistica codici 90.62.2 e 91.49.2 (21) |
| Estrazioni di DNA e RNA per test molecolari | € 59,05 | € 8,86 | Tariffario nazionale specialistica codice 91.36.5 (21) |
| Costo totale per ciclo | € 61,00 | ||
| Trasfusioni di sangue | Costo unitario | Costo per ciclo | Fonte costo |
| Globuli rossi | € 171,62 | € 820,32 | Lucioni et al. 2013 (23) (attualizzati al 2021) |
| Piastrine | € 725,91 | € 4.246,56 | |
| Costo totale per ciclo | € 5.066,88 | ||
Il costo dei trattamenti somministrati ai pazienti nello stato di salute di ricaduta/progressione sono riportati nella Tabella C supplementare.
All’interno di questa analisi è stato considerato anche il costo dell’innesto contro la malattia dell’ospite (graft versus host disease, GvHD) distinguendo la GvHD cronica estesa dalla GvHD acuta in stadio III-IV. Dal momento che dalla letteratura nazionale non è emerso alcuno studio di valutazione economica che riportasse il costo di questo evento, la valorizzazione di entrambe le GvHD è stata effettuata mediante lo studio francese di Robin et al. 2017 (24), impiegato anche nello studio di costo-efficacia condotto in UK dal NICE (17). Al fine di prevenire una potenziale sovrastima dei costi di GvHD, il costo della GvHD cronica è stato ottenuto come differenza di costo tra il gruppo con e senza GvHD cronica, mentre il costo della GvHD acuta è stato ottenuto come differenza di costo tra i pazienti con GvHD acuta in fase 0-1 e i pazienti con GvHD acuta in fase II-IV; tali costi così stimati sono risultati rispettivamente pari a € 6.877,20 e pari a € 17.469,13 (Tabella D supplementare).
Per la GvHD cronica e la GvHD estesa in stadio III-IV sono state utilizzate rispettivamente una durata media di 9 e 2,5 mesi sulla base dello studio TA545 e dell’opinione di clinici esperti. Dal momento che la GvHD cronica non può verificarsi fino al giorno 100, le stime di incidenza utilizzate riflettono gli eventi avvenuti tra il giorno 100 e il giorno 731, mentre le stime di incidenza degli eventi acuti fanno riferimento ai primi 100 giorni.
Oltre ai costi della GvHD sono stati considerati i costi degli eventi avversi di grado ≥ 3 per i quali risultava, da trial clinico, un’occorrenza pari almeno all’1% (Tab. VII). Le stime di incidenza per tali eventi avversi fanno riferimento ai primi 28 giorni. I costi per ciascun evento avverso sono stati ottenuti dalla letteratura nazionale o dal tariffario nazionale delle prestazioni di assistenza ospedaliera per acuti (25). Per tutti gli eventi avversi è stato considerato il costo del ricovero ad eccezione del rash, in quanto secondo l’opinione dei clinici esperti i pazienti con rash non richiedono una degenza in ospedale ma vengono trattati con terapie steroidee sistemiche.
| Recupero post-TCSE | ||
|---|---|---|
| Costi di monitoraggio per recupero post-TCSE a lungo termine > 24 mesi | Frequenza/ciclo | Fonte frequenza |
| Analisi del sangue | 0,25 | Expert opinion (1 volta ogni 4 mesi) |
| Visita di ematologia | 0,25 | |
| Ricaduta/Progressione | ||
| Risorsa | Frequenza/ciclo | Fonte frequenza |
| Giorno di ricovero | 2,61 | TA399 (19) |
| Monitoraggio | Frequenza/ciclo | Fonte frequenza |
| Biopsia del midollo osseo | 0,03 | TA399 (19)9 |
| Macchie di sangue periferico | 0,74 | |
| Analisi del sangue | 8,33 | |
| Estrazioni di DNA e RNA per test molecolari | 0,15 | |
| Trasfusioni di sangue | Frequenza/ciclo | Fonte frequenza |
| Globuli rossi | 4,78 | TA399 (19) |
| Piastrine | 5,85 | |
| Evento avverso | Busulfano | Treosulfan | Durata (giorni) | Costo per evento | Fonte durata | Fonte costo |
|---|---|---|---|---|---|---|
| GvHD cronica estesa | 26,70% | 19,70% | 273,9 | € 6.877,20 | Circa 9 mesi (TA545) | Robin et al. 2017 (24) |
| GvHD acuta in stadio III-IV | 8,10% | 6,40% | 76,1 | € 17.469,13 | Circa 2,5 mesi (TA545) | |
| Mucosite orale | 6,00% | 4,40% | 2,2 | € 310,00 | Analisi dei costi UK (NHS 2017/18) | Mickisch et al. 2010 (27) |
| Nausea | 4,90% | 2,60% | 3,3 | € 375,00 | ||
| Diarrea | 0,70% | 1,10% | 3,3 | € 2.465,00 | DRG 182 (25) | |
| Vomito | 1,40% | 0,40% | 3,3 | € 1.712,00 | Media DRG 182 e 183 (25) | |
| Aumento dell’alanina aminotransferasi | 2,80% | 4,80% | 15,1 | € 2.159,00 | Basato sull’analisi dei dati a livello di paziente dello studio di fase III | Wehler et al. 2017 (28) |
| Aumento dell’aspartato aminotransferasi | 2,10% | 4,10% | 8,7 | € 2.159,00 | ||
| Neutropenia febbrile | 4,90% | 4,40% | 4,1 | € 2.387,75 | Lazzaro et al. 2013 (29) | |
| Sepsi | 0,40% | 2,20% | 6,1 | € 5.493,00 | Analisi dei costi UK (NHS 2017/18) | DRG 576 (25) |
| Infezione polmonare | 0,70% | 1,10% | 5,4 | € 2.924,50 | Media DRG 89 e 90 (25) | |
| Anoressia | 1,40% | 1,50% | 3,2 | € 2.275,00 | Media DRG 296, 297 e 428 (25) | |
| Sincope | 1,40% | 0,00% | 2,0 | € 1.698,50 | Media DRG 141 e 142 (25) | |
| Rash maculo-papulare | 1,10% | 0,70% | 16,0 | € 15,93 | Basato sull’analisi dei dati a livello di paziente dello studio di fase III | Cetirizina (10 mg/die) + doxiciclina (100 mg/die) + desametasone (4 mg/die) per 7 giorni (Favaretto et al. 2017 (30)) |
Con riferimento al costo associato al trattamento di fine vita, non essendo emerso dalla letteratura alcuno studio specifico che abbia tentato di stimare tale costo per la popolazione di pazienti con LMA e SMD, è stato impiegato il costo ottenuto dal lavoro di Johnston et al. pubblicato nel 2012 (26) e riferito ai pazienti con melanoma arruolati nello studio MELODY in Italia, Francia e Regno Unito. Tale costo, attualizzato al 2021, è risultato pari a € 1.219,11.
Metodologia statistica e analisi di sensibilità
Al fine di considerare la variabilità intrinseca dei dati utilizzati nel modello, sono state condotte un’analisi di sensitività probabilistica (PSA) e un’analisi di sensitività deterministica (DSA). La prima è stata condotta secondo un approccio probabilistico (Probabilistic Sensitivity Analysis, PSA), facendo variare tutti i parametri contemporaneamente, ciascuno secondo una determinata distribuzione probabilistica (Tabella E supplementare). In particolare, sono state impiegate la distribuzione Gamma per i costi, l’età e la BSA, la distribuzione Normale per i coefficienti dell’algoritmo di Proskorovsky e la distribuzione Beta per il sesso, le utilità e per i punteggi associati alle dimensioni che compongono la QoL nel lavoro di Grulke. Inoltre, sono state effettuate 1.000 simulazioni Montecarlo al fine di rappresentare graficamente sia il piano di costo-efficacia sia la Cost Effectiveness Acceptability Curve (CEAC).
La seconda analisi prevede un approccio deterministico a una via in cui i risultati del modello sono ottenuti facendo variare un parametro del modello alla volta in funzione della variabilità riscontrata in letteratura o assunta dagli autori.
Per entrambe le analisi, con riferimento a ciascun parametro, è stata assunta una variabilità pari al 20%. In particolare, relativamente all’analisi di sensibilità deterministica, per alcuni parametri sono state assunte le seguenti variazioni:
– quota di mercato di treosulfan: Min = 5%, Max = 25%;
– numero pazienti eleggibili: Min = –20%, Max = caso-base + pazienti trattati grazie alla legge 648 del 23 dicembre 1996 (pari a circa 260 pazienti/anno);
– costo associato agli stati di salute: ±5%;
– costo associato alla gestione e al trattamento degli eventi avversi: ±5%.
È stata inoltre condotta un’analisi di scenario al fine di valutare l’impatto sui risultati dell’impiego di ulteriori distribuzioni parametriche per la modellizzazione delle curve di OS ed EFS.
Risultati
Nella Tabella VIII sono riportati i risultati dell’analisi di costo-efficacia condotta per il confronto di treosulfan in combinazione con fludarabina come parte del trattamento di condizionamento prima del trapianto di cellule staminali ematopoietiche allogeniche (AlloTCSE) rispetto al trattamento di condizionamento con busulfano in combinazione con fludarabina.
Rispetto al busulfano, il treosulfan rappresenta l’alternativa meno costosa (–€ 41.388) e più efficace (1,08 LYs e 0,95 QALYs incrementali rispetto al trattamento di confronto), risultando dunque dominante rispetto al busulfano.
L’ICER risultante è pari a –€ 38.167/LY, mentre, se si considera anche l’aggiustamento per la qualità della vita, il valore dell’ICUR risulta pari a –€ 43.728/QALY.
| Orizzonte temporale: Lifetime | ||
|---|---|---|
| Treosulfan | Busulfano | |
| Anni di vita (LYs) | 9,28 | 8,19 |
| Anni di vita aggiustati per la qualità (QALYs) | 6,83 | 5,89 |
| Sopravvivenza libera da eventi | € 115.411,67 | € 103.857,45 |
| Ricaduta/progressione (LMA) | € 36.465,98 | € 70.121,10 |
| Ricaduta/progressione (SDM) | € 20.615,71 | € 39.642,33 |
| Morte | € 1.225,51 | € 1.486,11 |
| Costi totali | € 173.718,86 | € 215.106,99 |
| Treosulfan vs Busulfano | ||
| LYs incrementali | 1,08 | |
| QALYs incrementali | 0,95 | |
| Sopravvivenza libera da eventi | € 11.554,22 | |
| Ricaduta/progressione (LMA) | –€ 33.655,13 | |
| Ricaduta/progressione (SDM) | –€ 19.026,62 | |
| Morte | –€ 260,61 | |
| Costi incrementali | –€ 41.388,13 | |
| Treosulfan vs Busulfano | ||
| ICER (LY) | Dominante | –€ 38.167,54 |
| ICUR (QALY) | Dominante | –€ 43.727,83 |
| Orizzonte temporale: 5 anni | ||
| Treosulfan | Busulfano | |
| Anni di vita (LYs) | 3,36 | 3,01 |
| Anni di vita aggiustati per la qualità (QALYs) | 2,47 | 2,18 |
| Costi totali | € 142.247,47 | € 142.567,19 |
| Treosulfan vs Busulfano | ||
| LYs incrementali | 0,35 | |
| QALYs incrementali | 0,30 | |
| Costi incrementali | –€ 319,72 | |
| Treosulfan vs Busulfano | ||
| ICER (LY) | Dominante | –€ 924,39 |
| ICUR (QALY) | Dominante | –€ 1.081,87 |
Tenendo conto di un orizzonte temporale pari a 5 anni, il treosulfan resta dominante rispetto al busulfano, con un ICER pari a –€ 924/LY e un ICUR pari a –€ 1.082/QALY.
Di seguito sono rappresentati i risultati dell’analisi di impatto sul budget confrontando lo scenario senza treosulfan con lo scenario in cui si ipotizza l’introduzione della nuova tecnologia per questo specifico setting di pazienti.
Nella Tabella IX sono riportati i risultati cumulati di budget impact considerando un numero di pazienti eleggibili al trattamento con treosulfan pari a 1.066. Il modello ha stimato una riduzione della spesa per il Servizio Sanitario Nazionale al quinto anno dall'introduzione di treosulfan sul mercato pari a –€ 212.063.
Le Figure 3 e 4 riportano gli impatti sul budget per voce di costo e totali.
L’analisi di sensitività deterministica mostra i valori assunti dall’ICUR al variare, volta per volta, di uno dei parametri considerati all’interno del modello. L’ICUR è risultato particolarmente sensibile a variazioni dei parametri logaritmici della distribuzione lognormale NMCM applicata all’OS di busulfano e treosulfan (Fig. 5).
La curva di accettabilità di costo-efficacia (Fig. 6) mostra come, con una disponibilità a pagare € 30.000/QALY, la probabilità che il treosulfan sia costo-efficace rispetto al busulfano sia pari a circa il 77,4%.
L’analisi di sensitività deterministica condotta per l'analisi di impatto sul budget mostra come il risultato a 5 anni risulti particolarmente sensibile alle variazioni delle quote di mercato di treosulfan: considerando una quota di mercato per il treosulfan pari al 5%, al quinto anno di analisi si otterrebbe una riduzione cumulata dei costi pari a –€ 70.688, mentre, considerando una quota pari al 25%, tale riduzione risulterebbe pari a –€ 353.438 (Fig. 7).

Fig. 3 - Impatti cumulati sul budget per voce di costo.
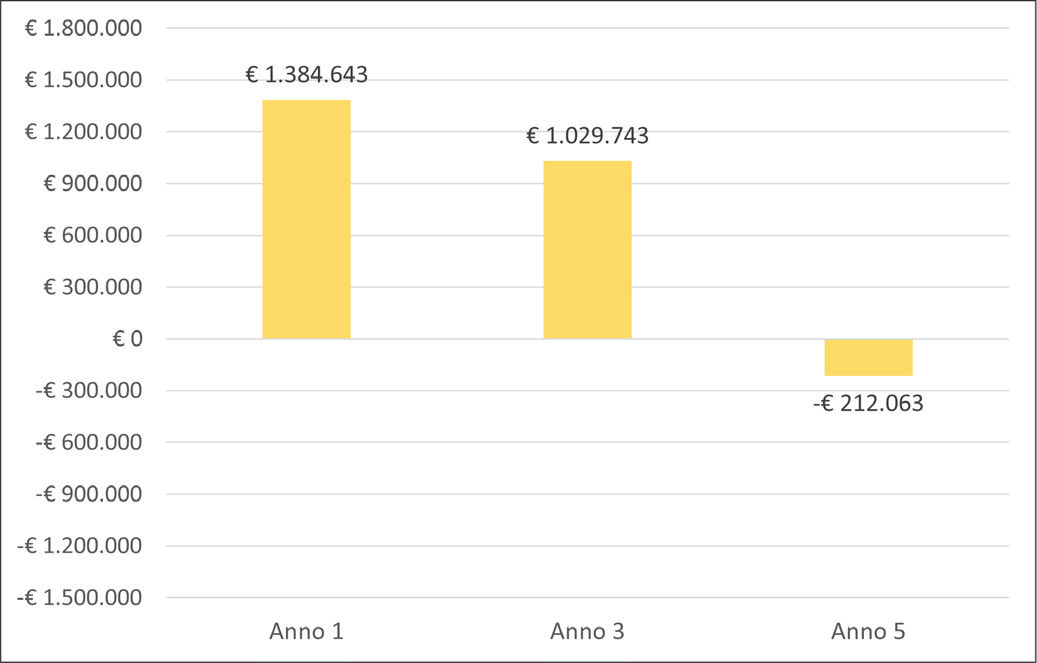
Fig. 4 - Impatti cumulati totali sul budget.
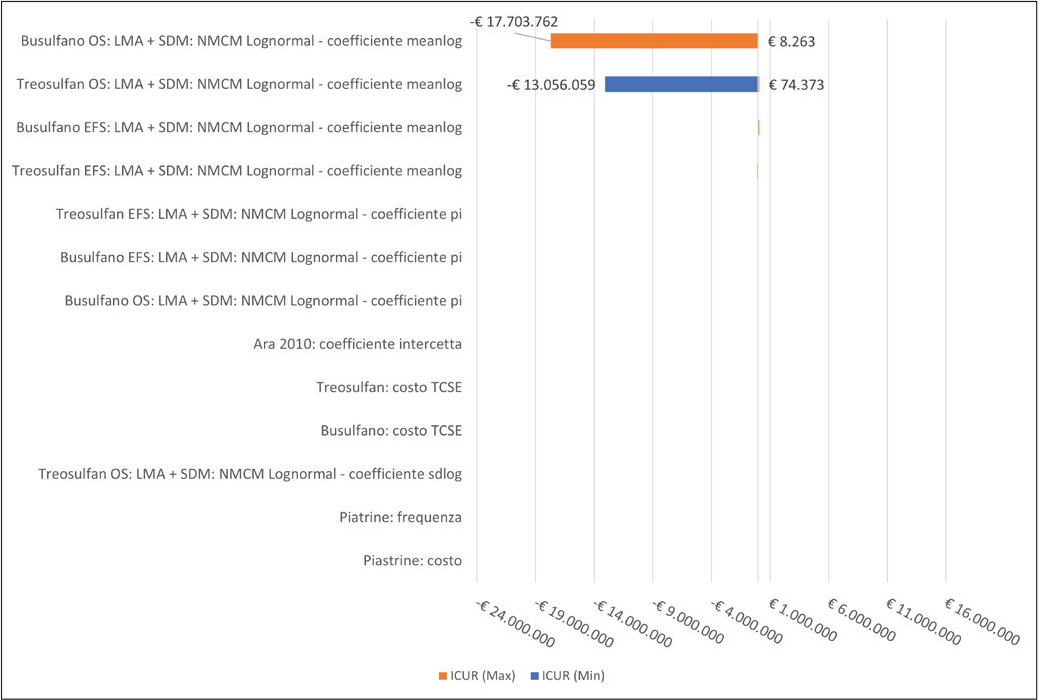
Fig. 5 - Grafico tornado: Analisi di costo-efficacia.
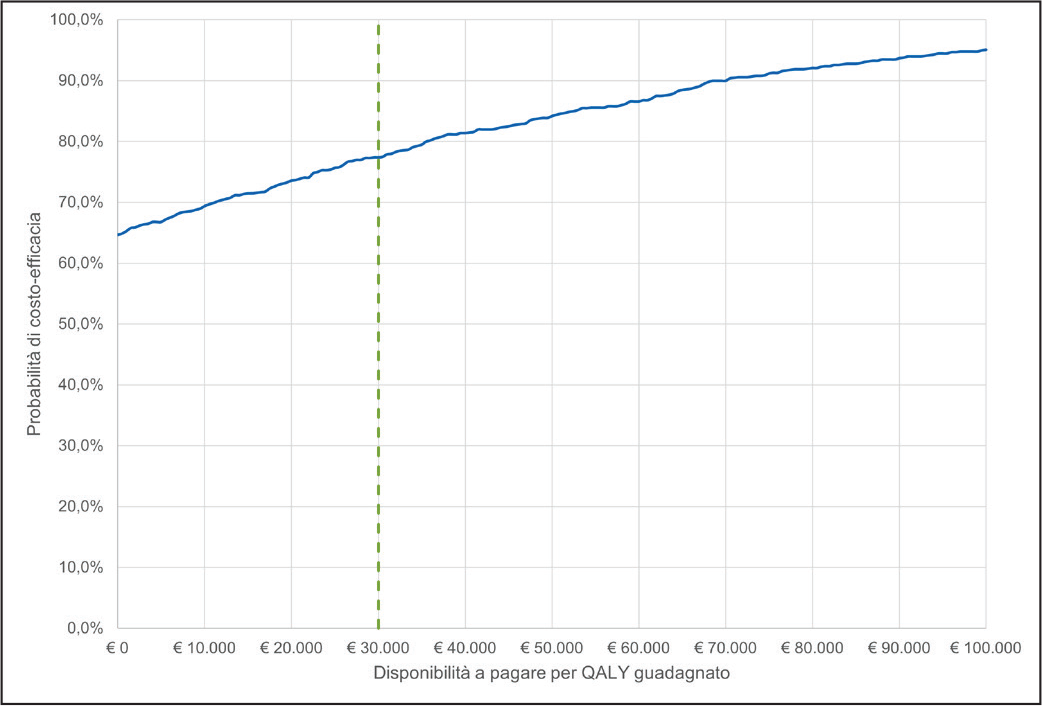
Fig. 6 - Curva di accettabilità di costo-efficacia.
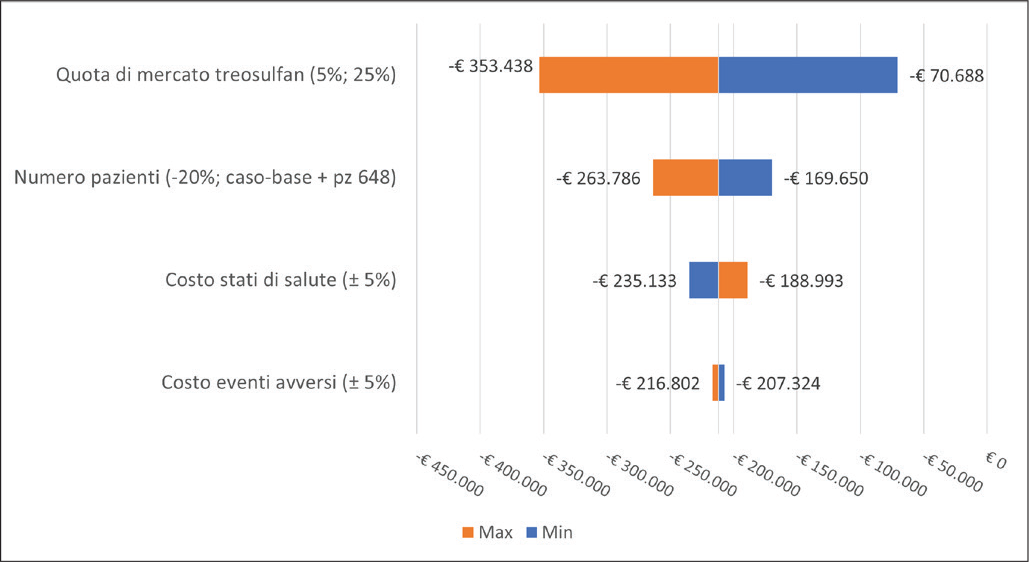
Fig. 7 - Grafico tornado: Analisi di impatto sul budget.
| Anno 1 | Caso-base | Scenario | Impatto sul budget |
|---|---|---|---|
| Costo del trattamento | € 47.833.610,5 | € 49.267.713,9 | € 1.434.103,4 |
| Costo associato agli stati di salute | € 59.745.112,7 | € 59.739.164,1 | –€ 5.948,6 |
| Costo eventi avversi | € 2.380.421,7 | € 2.336.910,0 | –€ 43.511,7 |
| Totale anno 1 | € 109.959.144,9 | € 111.343.788,0 | € 1.384.643,1 |
| Anno 3 (cumulati) | Caso-base | Scenario | Impatto sul budget |
| Costo del trattamento | € 47.833.610,5 | € 49.267.713,9 | € 1.434.103,4 |
| Costo associato agli stati di salute | € 88.278.799,6 | € 87.969.224,2 | –€ 309.575,4 |
| Costo eventi avversi | € 3.739.083,1 | € 3.644.298,1 | –€ 94.785,0 |
| Totale anno 3 | € 139.851.493,2 | € 140.881.236,2 | € 1.029.743,0 |
| Anno 5 (cumulati) | Caso-base | Scenario | Impatto sul budget |
| Costo del trattamento | € 47.833.610,5 | € 49.267.713,9 | € 1.434.103,4 |
| Costo associato agli stati di salute | € 104.744.541,9 | € 103.193.160,5 | –€ 1.551.381,4 |
| Costo eventi avversi | € 3.739.083,1 | € 3.644.298,1 | –€ 94.785,0 |
| Totale anno 5 | € 156.317.235,5 | € 156.105.172,5 | –€ 212.063,0 |
Infine, adottando la distribuzione Gompertz per la curva di OS (poiché vi sono risultati associati i valori minori di AIC e BIC) e il modello di cura log-normale misto per la curva di EFS, l’ICUR e l’impatto sul budget a 5 anni sono risultati rispettivamente pari a –€ 43.789/QALY e pari a –€ 236.149; adottando il modello di cura log-normale misto per entrambe le curve, l’ICUR e l’impatto sul budget a 5 anni sono risultati rispettivamente pari a –€ 46.082/QALY e pari a –€ 296.694.
Discussione
Il regime di condizionamento pre-trapianto ha l’obiettivo di eradicare la malattia di base e di raggiungere l’immunosoppressione per il paziente. Tale scopo si ottiene mediante l’associazione di farmaci chemioterapici o impiegando regimi di condizionamento che associno la chemioterapia a trattamenti radianti.
L’efficacia del trapianto allogenico dipende dal bilancio tra la capacità antitumorale del programma trapiantologico (intensità del regime di condizionamento ed effetto Graft-versus-Leukaemia, GvL) e la riduzione delle maggiori complicanze del trapianto medesimo (danno d’organo, infezioni, severità e durata della Malattia Graft-versus-Host, GvHD).
Le strategie TCSE emergenti che si concentrano sia sull’aumento dell’attività antitumorale del regime di condizionamento senza aumentarne la tossicità sia sull’aumento dell’effetto GVL promettono il successo finale del trapianto di CSE.
Un programma trapiantologico dovrebbe idealmente comprendere un regime di condizionamento dotato di una buona attività antineoplastica ma con scarsa o nulla tossicità sulle mucose e sugli organi e un livello di immunosoppressione adeguato a facilitare l’attecchimento delle stesse cellule staminali ematopoietiche (CSE).
Sono state sviluppate diverse alternative ai regimi di condizionamento standard con l’obiettivo di ridurre la tossicità senza compromettere gli effetti antitumorali.
La combinazione treosulfan/fludarabina, un regime di condizionamento mieloablativo a tossicità ridotta, ha dimostrato di migliorare significativamente i risultati di sopravvivenza in pazienti adulti con Leucemia mieloide acuta (LMA) o Sindrome mielodisplastica (SMD) rispetto a un condizionamento a intensità ridotta (RIC) busulfano/fludarabina, con una significativa riduzione della mortalità correlata al trapianto (TRM) e una migliore sopravvivenza in termini di Sopravvivenza libera da eventi (EFS) e di Sopravvivenza Globale (OS).
Il farmaco treosulfan presenta, quindi, caratteristiche di innovatività importanti quale trattamento di condizionamento prima del TCSE in pazienti adulti con condizioni di fragilità: in uno studio randomizzato di fase III, treosulfan ha dimostrato un vantaggio sulla sopravvivenza libera da malattia e globale in pazienti con leucemia acuta mieloide e mielodisplasia, anziani e con comorbilità. Il vantaggio sulla sopravvivenza si è realizzato attraverso una significativa riduzione della mortalità trapiantologica rispetto al controllo standard con dosi di busulfano a ridotta intensità.
Ovviamente, la modellizzazione effettuata in questo studio presenta dei limiti. In particolare, le utilità associate a ciascuno stato di salute e le disutilità relative agli eventi avversi ottenute dalla letteratura fanno riferimento a pazienti la cui età media non corrisponde all’età media della popolazione oggetto di studio; tali stime, come riportato in precedenza, sono state comunque applicate alle utilità della popolazione generale per età, dunque mediante queste ultime è stato possibile, anche se in maniera limitata, tenere conto dell’età media della popolazione oggetto di studio.
Un secondo limite dello studio fa riferimento alla stima dei costi associati allo stato di recupero post-TCSE poiché, dove non siano risultati presenti dati di costo a livello nazionale, sono stati convertiti in euro i valori pubblicati per altri paesi. Ovviamente le stime così ottenute potrebbero non risultare rappresentative dell’effettivo utilizzo di risorse sanitarie impiegate in Italia; per tale ragione, la variabilità associata al costo degli stati di salute è stata valutata all’interno delle analisi di sensibilità.
Oltre che da un punto di vista di sicurezza e di efficacia, le analisi condotte sul medicinale in relazione agli aspetti farmacoeconomici hanno permesso di stimare una probabilità di costo-efficacia di treosulfan rispetto al busulfano pari a circa il 77,4% e una riduzione cumulata della spesa a carico del SSN dopo 5 anni dalla sua introduzione pari a –€ 212.063. Alla luce di questi risultati, tenendo conto delle assunzioni alla base del modello e delle approssimazioni che si sono rese necessarie al fine si stimare alcuni parametri di input in assenza di dati provenienti dalla letteratura relativamente al contesto nazionale (come per esempio il costo degli stati di salute di recupero post-TCSE a breve termine e a lungo termine tra i 12 e i 24 mesi), è possibile affermare come il treosulfan possa rappresentare un’alternativa di trattamento meno costosa e più efficace rispetto ai trattamenti a base di busulfano.
Conclusioni
Le analisi condotte in questo studio hanno dimostrato come il treosulfan in combinazione con fludarabina, come parte del trattamento di condizionamento prima del trapianto di cellule staminali ematopoietiche allogeniche (AlloTCSE) in pazienti adulti con LMA o SMD, possa rappresentare un’alternativa di trattamento costo-efficace e sostenibile dal punto di vista del SSN. Secondo il parere dei clinici coinvolti nell’analisi, tali risultati possono ritenersi rilevanti anche per i pazienti con patologie maligne che non sono state coperte attraverso questo modello.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This study was supported by an unconditional grant from Medac pharma s.r.l.
Bibliografia
- 1. Gyurkocza B, Sandmaier BM. Conditioning regimens for hematopoietic cell transplantation: one size does not fit all. Blood. 2014;124(3):344-353. CrossRef PubMed
- 2. Kröger N, Solano C, Wolschke C, et al. Antilymphocyte Globulin for Prevention of Chronic Graft-versus-Host Disease. N Engl J Med. 2016;374(1):43-53. CrossRef PubMed
- 3. Gratwohl A. The EBMT risk score. Bone Marrow Transplant. 2012;47(6):749-756. CrossRef PubMed
- 4. D’Souza A, Fretham C. Current Uses and Outcomes of Hematopoietic Cell Transplantation (HCT): CIBMTR Summary Slides. 2018; Online (Accessed March 2022)
- 5. Kröger, N., D.W. Beelen, and D.A.f.K.-u.B.e.V. für die DAG-KBT. Conditioning. Allogeneic stem cell transplantation [In German]. 2018; Online (Accessed March 2022)
- 6. Gorin NC, Labopin M, Boiron JM, et al; Acute Leukemia Working Party of the European Cooperative Group for Blood and Marrow Transplantation. Results of genoidentical hemopoietic stem cell transplantation with reduced intensity conditioning for acute myelocytic leukemia: higher doses of stem cells infused benefit patients receiving transplants in second remission or beyond–the Acute Leukemia Working Party of the European Cooperative Group for Blood and Marrow Transplantation. J Clin Oncol. 2006;24(24):3959-3966. CrossRef PubMed
- 7. Kröger N, Bornhäuser M, Ehninger G, et al; German Cooperative Transplant Study Group. Allogeneic stem cell transplantation after a fludarabine/busulfan-based reduced-intensity conditioning in patients with myelodysplastic syndrome or secondary acute myeloid leukemia. Ann Hematol. 2003;82(6):336-342. CrossRef PubMed
- 8. Beelen DW, Trenschel R, Stelljes M, et al., Treosulfan or busulfan plus fludarabine as conditioning treatment before allogeneic haemopoietic stem cell transplantation for older patients with acute myeloid leukaemia or myelodysplastic syndrome (MC-FludT.14/L): a randomised, non-inferiority, phase 3 trial. Lancet Haematol, 2020. 7(1): e28-e39. CrossRef PubMed
- 9. Beelen DW, Trenschel R, Stelljes M, et al. Final Results of a Prospective Randomized Multicenter Phase III Trial Comparing Treosulfan/Fludarabine to Reduced Intensity Conditioning with Busulfan/Fludarabine Prior to Allogeneic Hematopoietic Stem Cell Transplantation in Elderly or Comorbid Patients with Acute Myeloid Leukemia or Myelodysplastic Syndrome. Blood 2017; 130 (S1): 521. CrossRef
- 10. Associazione Italiana di Economia Sanitaria. Proposta di Linee-Guida per la valutazione economica degli interventi sanitari. Poilitiche Sanitarie. 2009;10(2):91-99. Online (Accessed March 2022)
- 11. CHEERS 2022 Checklist, Online (Accessed March 2022)
- 12. Riunione Nazionale GITMO - Bologna 06 / 07 maggio 2019. Volume redatto dalla Segreteria Scientifica e di Presidenza con il contributo dei referenti delle attività GITMO, DataBase Nazionale, CNT e IBMDR. Online (Accessed March 2022)
- 13. National Institute fo Health and Care Excellence. Single Technology Appraisal Treosulfan with fludarabine for malignant disease before allogeneic stem cell transplant [ID1508]. Online (Accessed March 2022)
- 14. National Institute for Health and Care Excellence Decision Support Unit (NICE DSU), TSD 14: Survival analysis for economic evaluations alongside clinical trials – extrapolation with patient-level data. Online (Accessed March 2022)
- 15. Martin PJ, Counts GW Jr, Appelbaum FR, et al. Life expectancy in patients surviving more than 5 years after hematopoietic cell transplantation. J Clin Oncol. 2010;28(6):1011-1016. CrossRef PubMed
- 16. National Institute for Health and Care Excellence (NICE). TA552: Liposomal cytarabine–daunorubicin for untreated acute myeloid leukaemia. Technology Appraisal Guidance (2018). Online (Accessed March 2022)
- 17. NICE. Single technology appraisal. Treosulfan with fludarabine for malignant disease before allogeneic stem cell transplant [ID1508]. Document B. Company evidence submission. May 2019. Online (Accessed March 2022)
- 18. Grulke N, Albani C, Bailer H. Quality of life in patients before and after haematopoietic stem cell transplantation measured with the European Organization for Research and Treatment of Cancer (EORTC) Quality of Life Core Questionnaire QLQ-C30. Bone Marrow Transplant. 2012;47(4):473-482. CrossRef PubMed
- 19. Proskorovsky I, Lewis P, Williams CD, et al. Mapping EORTC QLQ-C30 and QLQ-MY20 to EQ-5D in patients with multiple myeloma. Health Qual Life Outcomes. 2014;12(1):35. CrossRef PubMed
- 20. National Institute for Health and Care Excellence (NICE). TA545: Gemtuzumab ozogamicin for untreated acute myeloid leukaemia. Online (Accessed March 2022)
- 21. National Institute for Health and Care Excellence (NICE). TA399: Azacitidine for treating acute myeloid leukaemia with more than 30% bone marrow blasts. 2016 [cited 2019 17th April ]; Online (Accessed Mach 2022)
- 22. Kurosawa S, Yamaguchi H, Yamaguchi T, et al. Decision Analysis of Postremission Therapy in Cytogenetically Intermediate-Risk Acute Myeloid Leukemia: The Impact of FLT3 Internal Tandem Duplication, Nucleophosmin, and CCAAT/Enhancer Binding Protein Alpha. Biol Blood Marrow Transplant. 2016;22(6):1125-1132. CrossRef PubMed
- 23. Decreto del Ministero della Salute 18 ottobre 2012, Tariffe delle prestazioni di assistenza specialistica ambulatoriale.; Online (Accessed March 2022)
- 24. Robin C, Hémery F, Dindorf C, et al. Economic burden of preemptive treatment of CMV infection after allogeneic stem cell transplantation: a retrospective study of 208 consecutive patients. BMC Infect Dis. 2017;17(1):747. CrossRef PubMed
- 25. Decreto del Ministero della Salute 18 ottobre 2012, Tariffe delle prestazioni di assistenza ospedaliera per acuti, per tipo di ricovero. Online (Accessed March 2022)
- 26. Johnston K, Levy AR, Lorigan P, et al. Economic impact of healthcare resource utilisation patterns among patients diagnosed with advanced melanoma in the United Kingdom, Italy, and France: results from a retrospective, longitudinal survey (MELODY study). Eur J Cancer. 2012;48(14):2175-2182. CrossRef PubMed
- 27. Mickisch G, Gore M, Escudier B, Procopio G, Walzer S, Nuijten M. Costs of managing adverse events in the treatment of first-line metastatic renal cell carcinoma: bevacizumab in combination with interferon-alpha2a compared with sunitinib. Br J Cancer. 2010;102(1):80-86. CrossRef PubMed
- 28. Wehler E, Zhao Z, Pinar Bilir S, Munakata J, Barber B. Economic burden of toxicities associated with treating metastatic melanoma in eight countries. Eur J Health Econ. 2017;18(1):49-58. CrossRef PubMed
- 29. Lazzaro C, Bordonaro R, Cognetti F, et al. An Italian cost-effectiveness analysis of paclitaxel albumin (nab-paclitaxel) versus conventional paclitaxel for metastatic breast cancer patients: the COSTANza study. Clinicoecon Outcomes Res. 2013;5:125-135. CrossRef PubMed
- 30. Favaretto A, Grossi F, Morabito A, Ravasio R. Il costo degli eventi avversi associati ad afatinib, erlotinib e gefitinib nel trattamento del tumore del polmone non a piccole cellule con mutazione EGFR. Glob Reg Health Technol Assess. 2017;4(1):e187-e196. CrossRef