 |
Glob Reg Health Technol Assess 2022; 9 (Suppl. 1): 2-13 ISSN 2283-5733 | DOI: 10.33393/grhta.2022.2389 REVIEW |
 |
Approccio diagnostico e terapeutico al paziente con sindrome coronarica acuta
Diagnostic and therapeutic approach to the ACS patient
The current management strategy of acute coronary syndromes aims at symptoms relief as well as at specifically antagonizing each of the different pathogenic components of myocardial ischemia, including the pro-thrombotic state, poor coronary flow and myocardial damage.
Different approaches are available, including revascularization procedures and pharmacological interventions. Various anti-anginal, anti-thrombotic and anti-coagulant drugs can be used according to individual features and needs, as well as secondary prevention measures based on statin use and ACE-inhibition. The appropriate use of available measures is crucial to reduce mortality and improve long-term prognosis in patients with acute coronary syndromes.
Keywords: Acute coronary syndrome, Diagnostic approach, Revascularization, Treatment
Received: March 1, 2022
Accepted: March 23, 2022
Published online: May 24, 2022
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il termine “sindrome coronarica acuta” (acute coronary syndrome, ACS) racchiude tutti i possibili quadri sindromici acuti della malattia aterosclerotica coronarica e comprende l’infarto miocardico e l’angina instabile (unstable angina, UA). Le manifestazioni cliniche delle ACS generalmente includono dolore toracico, dispnea, segni di attivazione autonomica, alterazioni elettrocardiografiche e perdita di funzione contrattile e/o vitalità di uno o più segmenti cardiaci (1). In questo articolo sono approfonditi l’eziopatogenesi, l’approccio diagnostico alle ACS e i possibili interventi terapeutici esistenti, la cui appropriatezza risulta cruciale nel poter ridurre la mortalità associata alle ACS e migliorare la prognosi a lungo termine dei pazienti (2,3).
Definizioni e approccio diagnostico
Si definisce “infarto miocardico” la necrosi cellulare del tessuto cardiaco che si verifica a seguito di uno stato di ischemia prolungato, superiore a 10-15 minuti. Tale evento causa la dismissione nel torrente circolatorio di elementi intracellulari come le isoforme cardiache (C) di troponina (Tn) I o T, o l’isoforma prevalentemente cardiaca della creatinchinasi (CK-MB). Le CTn vengono attualmente dosate con sempre maggiore sensibilità come marcatori laboratoristici di miocardiocitonecrosi. L’attuale definizione universale di infarto miocardico (1) distingue inoltre il “danno miocardico” dall’“infarto miocardico”. Il primo viene identificato solo sulla base di un valore di laboratorio, essendo infatti definito come un rialzo del valore di CTn al di sopra del 99° percentile del limite superiore di riferimento (upper reference limit, URL). Per soddisfare la definizione di infarto miocardico invece, è necessario che al danno miocardico si associ un’evidenza clinica o strumentale di ischemia miocardica acuta. Sulla base delle alterazioni elettrocardiografiche riscontrate, l’infarto miocardico è a sua volta classificato in infarto con sopraslivellamento del tratto ST (ST elevation myocardial infarction o STEMI), a evoluzione prevalentemente transmurale, e infarto subendocardico o senza sopraslivellamento del tratto ST (non-ST elevation myocardial infarction, o NSTEMI) (Fig. 1). Tale specifica nosologica ha sostanziali risvolti pratici e pone enfasi sulla necessità di ottenere un’immediata riperfusione miocardica nello STEMI. Di contro, NSTEMI e UA vengono congiuntamente riferite come non-ST elevation acute coronary syndromes (NSTE-ACS). L’UA, pur avendo in comune caratteristiche cliniche e possibili modifiche elettrocardiografiche e di cinetica segmentaria con l’infarto miocardico, si distingue da quest’ultimo per l’assenza di dismissione di marcatori di miocardiocitonecrosi nel circolo periferico, dosati dopo un congruo periodo di tempo dall’insorgenza dei sintomi (2,3). Nella Figura 1 è riportato un algoritmo diagnostico per il triage delle ACS.
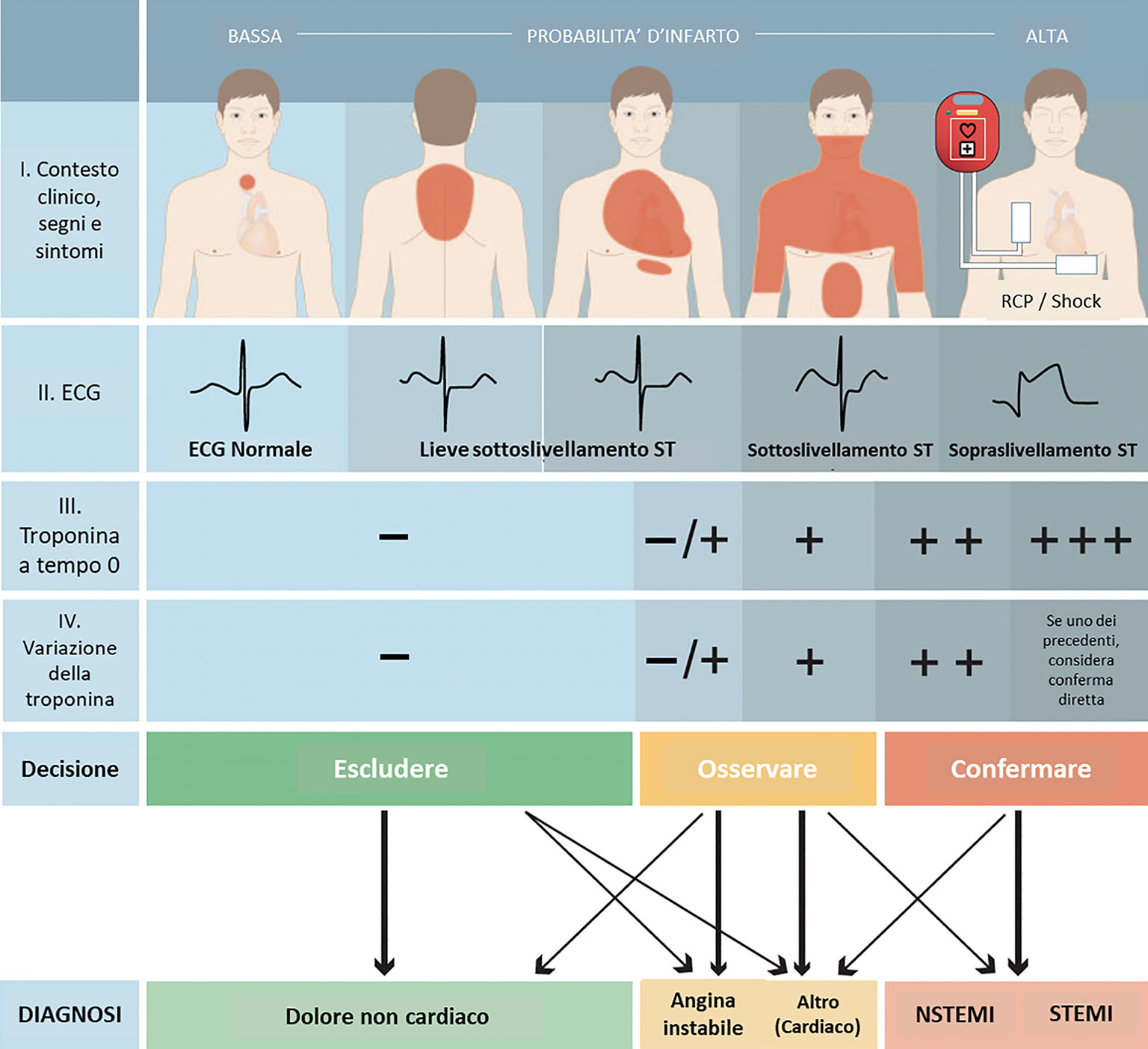
Fig. 1 - Algoritmo diagnostico per il triage delle sindromi coronariche acute. La valutazione iniziale si basa sull’integrazione di caratteristiche di bassa e alta probabilità diagnostica con la valutazione clinica, l’ECG a 12 derivazioni e le determinazioni seriate della troponina. Il termine “Altro (Cardiaco)” include miocarditi, la sindrome Takotsubo e lo scompenso cardiaco congestizio. “Dolore non cardiaco” include patologie extra-cardiache come polmoniti o pneumotorace. Le variazioni della troponina cardiaca durante i prelievi seriati dovrebbero essere interpretate come marcatori quantitativi: maggiore è il valore assoluto al tempo 0 o la variazione, maggiore è la probabilità di infarto miocardico. Nei pazienti che si presentano con arresto cardiaco o instabilità emodinamica di presunta genesi cardiaca dovrebbe essere eseguita una valutazione ecocardiografica immediata da un operatore esperto insieme a un ECG a 12 derivazioni. Se alla valutazione iniziale si pone il sospetto di dissezione aortica o embolia polmonare si raccomanda l’integrazione diagnostica con dosaggio di D-dimero e tomografia computerizzata.
ECG: elettrocardiogramma; NSTEMI: infarto miocardico senza sopraslivellamento del tratto ST; RCP: rianimazione cardiopolmonare; STEMI: infarto miocardico con sopraslivellamento del tratto ST.
Classificazione dell’infarto miocardico
Possono essere identificati 5 tipi di infarto miocardico (1):
• Tipo 1: determinazione di danno miocardico acuto con almeno uno tra i seguenti elementi:
– sintomi di ischemia miocardica,
– variazioni ECG suggestive di nuova ischemia miocardica,
– comparsa di nuove onde Q patologiche all’ECG,
– riscontro con tecniche di imaging di una nuova perdita di miocardio vitale o di nuove alterazioni della cinesi parietale regionale,
– identificazione di trombosi coronarica.
• Tipo 2: determinazione di danno miocardico acuto ed evidenza di uno sbilanciamento tra domanda e disponibilità di ossigeno a livello miocardico con meccanismo non aterotrombotico, e con almeno uno tra i seguenti elementi:
– sintomi di ischemia miocardica,
– variazioni ECG suggestive di nuova ischemia miocardica,
– comparsa di nuove onde Q patologiche all’ECG,
– riscontro con tecniche di imaging di una nuova perdita di miocardio vitale o di nuove alterazioni della cinesi parietale regionale.
• Tipo 3: morte improvvisa come prima presentazione clinica con sintomi suggestivi di ischemia miocardica associata ad alterazioni ECG ischemiche di nuova insorgenza o fibrillazione ventricolare: il paziente muore prima che sia evidente un rialzo della troponina cardiaca. Inserito in questa categoria è l’infarto miocardico diagnosticato dall’autopsia.
• Tipo 4a: infarto miocardico entro 48 ore post-angioplastica coronarica. Aumento dei valori di troponina cardiaca >5 volte l’URL in pazienti con valori basali normali o aumento sopra il 20% rispetto a un valore basale più alto della norma ma stabile o in calo (il valore assoluto deve comunque essere almeno >5 volte l’URL). A tutto ciò si deve aggiungere almeno uno tra i seguenti elementi:
– variazioni ECG suggestive di nuova ischemia miocardica,
– comparsa di nuove onde Q patologiche all’ECG,
– riscontro con tecniche di imaging di nuova perdita di miocardio vitale o di nuove alterazioni della cinesi parietale regionale,
– caratteristiche angiografiche compatibili con complicanza limitante il flusso (ad es., dissezione coronarica, occlusione coronarica…).
• Tipo 4b: infarto miocardico post-angioplastica coronarica con trombosi di stent (acuta: 0-24 ore; subacuta: 24 ore-30 giorni; tardiva: 30 giorni-1 anno; molto tardiva oltre l’anno).
• Tipo 4c: infarto miocardico post-angioplastica coronarica con ristenosi intrastent o ristenosi dopo angioplastica con solo palloncino.
• Tipo 5: infarto miocardico entro 48 ore post-bypass coronarico. Aumento dei valori di troponina cardiaca >10 volte l’URL in pazienti con valori basali normali o aumento sopra il 20% rispetto a un valore basale più alto della norma, ma stabile o in calo (il valore assoluto deve comunque essere almeno >10 volte l’URL). A tutto ciò si deve aggiungere almeno uno tra i seguenti elementi:
– comparsa di nuove onde Q patologiche all’ECG,
– occlusione del nuovo graft o nuova occlusione di arteria coronaria nativa,
– riscontro con tecniche di imaging di una nuova perdita di miocardio vitale o di nuove alterazioni della cinesi parietale regionale.
Eziopatogenesi
Il meccanismo più comune, che viene identificato con il termine “infarto di tipo 1”, è la formazione di un trombo, occlusivo oppure non occlusivo (murale), su una preesistente placca aterosclerotica andata incontro a rottura o erosione. Sebbene l’aterosclerosi coronarica sia una patologia cronica e con decorso generalmente indolente, soprattutto se opportunamente trattata con la terapia medica (4-6), alcune placche, definite “placche instabili”, possono presentare caratteristiche intrinseche che le rendono particolarmente prone a complicazioni. Le placche instabili, infatti, sono caratterizzate da un nucleo lipidico molto sviluppato, da un abbondante infiltrato di cellule infiammatorie (soprattutto macrofagi e linfociti T) e da un sottile cappuccio fibroso che riveste il core lipidico, il quale si trova quindi in stretta prossimità con il torrente circolatorio (7,8). Il cross-talk citochinico innescato dal processo infiammatorio all’interno della placca instabile determina dapprima una proliferazione delle cellule muscolari lisce e successivamente la proliferazione di macrofagi, con liberazione di enzimi (metalloproteinasi) in grado di degradare progressivamente il cappuccio fibroso. Con la rottura di quest’ultimo (o l’erosione, in una percentuale minore di casi) viene dunque esposto il core lipidico, il quale è altamente trombogenico per l’elevato contenuto di fattore tissutale. Insorge quindi rapidamente una trombosi, che determina il rapido aggravamento della stenosi fino a causare, in taluni casi, l’occlusione completa del vaso. Nel caso dello STEMI la trombosi è frequentemente occlusiva e con alta componente di propagazione (fibrina e globuli rossi, trombo “rosso”), mentre nel caso delle NSTE-ACS il trombo è di solito murale e con una componente piastrinica predominante (trombo “bianco”). Il trombo, ricco di piastrine, può a sua volta frammentarsi ed embolizzare, determinando l’occlusione di arteriole e capillari che perfondono distalmente il territorio miocardico a valle della lesione, rendendo talvolta tecnicamente impossibile un intervento di rivascolarizzazione meccanica. Evidenze cliniche e sperimentali dimostrano come nei pazienti che hanno sperimentato un evento di ACS, oltre la lesione responsabile dell’evento indice (culprit lesion), frequentemente anche altre placche esprimono un fenotipo di vulnerabilità. Tale teoria di “instabilità diffusa” o “paziente vulnerabile” sta progressivamente accumulando prove scientifiche e dimostrazioni pratiche, determinando anche importanti implicazioni terapeutiche: al di là di una procedura di rivascolarizzazione immediata, questi pazienti necessitano di terapie sistemiche nel breve e nel lungo termine per ridurne il profilo di rischio, mentre è dubbio il vantaggio di procedure di rivascolarizzazione preventiva (9,10).
Nell’“infarto di tipo 2”, l’evento ischemico è determinato invece da uno squilibrio tra le richieste metaboliche del tessuto miocardico e l’approvvigionamento di ossigeno e metaboliti forniti dal circolo coronarico con meccanismo non di aterotrombosi (1). Tale categoria riconosce una molteplicità di cause. Possibili cause coronariche comprendono lo spasmo coronarico macro- o microvascolare isolato, la disfunzione endoteliale, le arteriti, eventi traumatici, la dissezione coronarica spontanea, ematomi intramurali, anomalie congenite coinvolgenti l’origine o il decorso delle coronarie. Esistono inoltre meccanismi extracardiaci che possono causare necrosi cardiomiocitaria per un aumento critico del consumo miocardico di ossigeno oltre le possibilità di apporto di ossigeno al miocardio: ipotensione severa, scompenso cardiaco, stato settico e febbre, tireotossicosi, tachiaritmie, bradiaritmie, anemia, metaemoglobinemia, insufficienza respiratoria acuta e cronica, disturbi valvolari, interventi chirurgici extra-cardiaci o sforzi strenui.
Un’ACS può infine verificarsi per cause iatrogene, ad esempio a causa di un danno anatomico determinato in stretta prossimità con procedure di rivascolarizzazione percutanea (“tipo 4a”), per il fallimento a distanza di pregressi interventi di angioplastica coronarica con fenomeni di trombosi (“tipo 4b”) o ristenosi (“tipo 4c”) di stent precedentemente impiantati, oppure per un danno verificatosi nel contesto di un intervento di rivascolarizzazione chirurgica (“tipo 5”) (1).
Trattamento
In generale, la terapia delle ACS comprende una serie di strategie che mirano ad antagonizzare ciascuna delle diverse componenti fisiopatologiche sopra descritte. Pertanto, oltre al trattamento dei sintomi, la terapia in acuto verte sull’antagonismo dello stato protrombotico sistemico, sul ripristino del normale flusso coronarico e sulla limitazione del danno ischemico miocardico con l’interruzione di possibili stati patologici concorrenti. Sono disponibili differenti approcci che comprendono procedure di rivascolarizzazione e terapie farmacologiche.
La rivascolarizzazione miocardica
Rivascolarizzazione nello STEMI
Una rapida riperfusione coronarica nei pazienti affetti da STEMI è fondamentale al fine di preservare dalla necrosi quanto più tessuto miocardico possibile e la storica massima “time is muscle” (ovvero “il tempo è muscolo”), enunciata da Eugene Braunwald oltre vent’anni fa, riassume chiaramente gli intenti di questo principio. Il sistema dell’emergenza si è pertanto strutturato in modo tale da garantire ai pazienti con STEMI l’arrivo presso la più vicina sala di emodinamica e la riapertura della lesione responsabile mediante angioplastica coronarica (primary percutaneous coronary artery intervention, primary PCI) entro un tempo massimo di 120 minuti dalla diagnosi. Qualora tale rapidità di intervento non possa essere garantita, è indicata la somministrazione immediata di terapia fibrinolitica sistemica (entro 30 minuti) e quindi il trasporto presso la sala di emodinamica più vicina; l’esame coronarografico e l’angioplastica possono essere quindi eseguiti entro 24 ore, fatto salvo il caso in cui la fibrinolisi sia stata inefficace. In caso di fallimento della fibrinolisi l’angioplastica viene comunque eseguita appena possibile (e in questo caso è definita “angioplastica di salvataggio” o rescue PCI) (2).
L’angioplastica coronarica viene sempre più frequentemente eseguita attraverso un accesso arterioso radiale, che garantisce minori complicanze rispetto all’accesso femorale (11). Una volta superata la lesione responsabile con una guida metallica si procede all’impianto di uno stent medicato, rivascolarizzando la sola lesione responsabile (2). La rimozione mediante aspirazione del materiale trombotico presente all’interno della coronaria non è più raccomandata routinariamente, poiché potenzialmente dannosa e priva di chiare prove di efficacia (12,13). Nel caso in cui si identifichino altre lesioni coronariche ostruttive oltre alla lesione responsabile, queste dovrebbero essere sottoposte ad angioplastica preventiva (14), ma tale intervento di completamento viene generalmente procrastinato di alcuni giorni, per scongiurare che eventuali complicanze procedurali possano aggravare irrimediabilmente il precario equilibrio che si raggiunge nell’immediata prossimità dell’evento acuto.
La fibrinolisi rappresenta l’alternativa principale all’angioplastica primaria. È necessario valutare l’efficacia della fibrinolisi attraverso il monitoraggio di parametri clinico-strumentali di avvenuta riperfusione, al fine di poter ricorrere in tempo utile alla “PCI di salvataggio”. I farmaci fibrinolitici attualmente disponibili sono:
- streptochinasi (SK, 1.500.000 U in 60 minuti),
- alteplase (r-PA, 10 + 10 U in due boli a distanza di 30 minuti l’uno dall’altro),
- tenecteplase (TNK-tPA, 0,5 mg/kg in singolo bolo).
Essi in generale catalizzano la trasformazione del plasminogeno in plasmina, enzima che provvede alla degradazione della fibrina con conseguente dissoluzione del coagulo. Le controindicazioni assolute e relative alla terapia fibrinolitica sono riportate nella Tabella I.
Il bypass coronarico (coronary artery bypass graft, CABG) nella fase acuta dello STEMI ha oggi un’indicazione limitata: può essere utile quando la PCI non ha avuto un risultato favorevole o non è tecnicamente fattibile, o in presenza di complicanze strutturali come la rottura del setto interventricolare o la rottura dei muscoli papillari. La mortalità associata al CABG è estremamente elevata nei 3-7 giorni immediatamente seguenti lo STEMI, e il beneficio derivante dalla rivascolarizzazione deve essere dunque confrontato con l’aumento di rischio derivante dall’intervento. Nei casi con anatomia coronarica troppo complessa per la rivascolarizzazione percutanea è consigliabile, pertanto, dilazionare il CABG nel tentativo di ottenere una stabilizzazione clinica ed emodinamica del paziente.
| Controindicazioni Assolute |
|---|
| Ictus emorragico o ictus a eziologia ignota in qualsiasi momento |
| Ictus ischemico nei 6 mesi precedenti |
| Patologia o neoplasia del sistema nervoso centrale |
| Recenti traumi maggiori/chirurgia/traumi cranici (nelle 3 settimane precedenti) |
| Sanguinamenti gastrointestinali nell’ultimo mese |
| Alterazioni della coagulazione note |
| Dissezione aortica |
| Punture in sede non comprimibile (ad es. biopsia epatica, puntura lombare) |
| Controindicazioni Relative |
| Attacco ischemico transitorio nei 6 mesi precedenti |
| Terapia anticoagulante orale |
| Gravidanza o parto nell’ultima settimana |
| Ipertensione refrattaria (PA sistolica >180 mmHg e/o PA diastolica >110 mmHg) |
| Patologia epatica avanzata |
| Endocardite infettiva |
| Ulcera peptica attiva |
| Rianimazione refrattaria |
Rivascolarizzazione nell’NSTEMI e nell’UA
Nei pazienti affetti da NSTE-ACS le linee guida raccomandano una strategia invasiva precoce, con esame coronarografico entro 24 ore dalla diagnosi al fine di migliorare la prognosi (3,15,16). Una strategia invasiva precoce è particolarmente auspicabile nei pazienti che presentano un profilo di rischio elevato, identificato sulla base delle caratteristiche cliniche, della presentazione elettrocardiografica o di score per la stratificazione del rischio (come ad es. un GRACE score >140 punti). Nei pazienti con NSTE-ACS che presentano angor prolungato nonostante la terapia medica, instabilità emodinamica, shock cardiogeno, instabilità elettrica, complicanze meccaniche cardiache legate all’infarto o in cui si sospetti una grande estensione del territorio ischemico interessato, è raccomandata una strategia invasiva immediata (entro 2 ore) (Figg. 2 e 3).
Nei pazienti con NSTE-ACS è possibile eseguire un intervento di rivascolarizzazione sia di tipo percutaneo che chirurgico; l’approccio percutaneo viene preferito nei pazienti con malattia coronarica non particolarmente estesa e con caratteristiche anatomiche che non rendano l’intervento tecnicamente proibitivo, mentre nei pazienti con grande estensione di malattia, quadri anatomici particolarmente complessi, concomitanti patologie valvolari o dell’aorta, presenza di diabete mellito o severa disfunzione sistolica del ventricolo sinistro è da preferire una strategia di trattamento chirurgico (17).
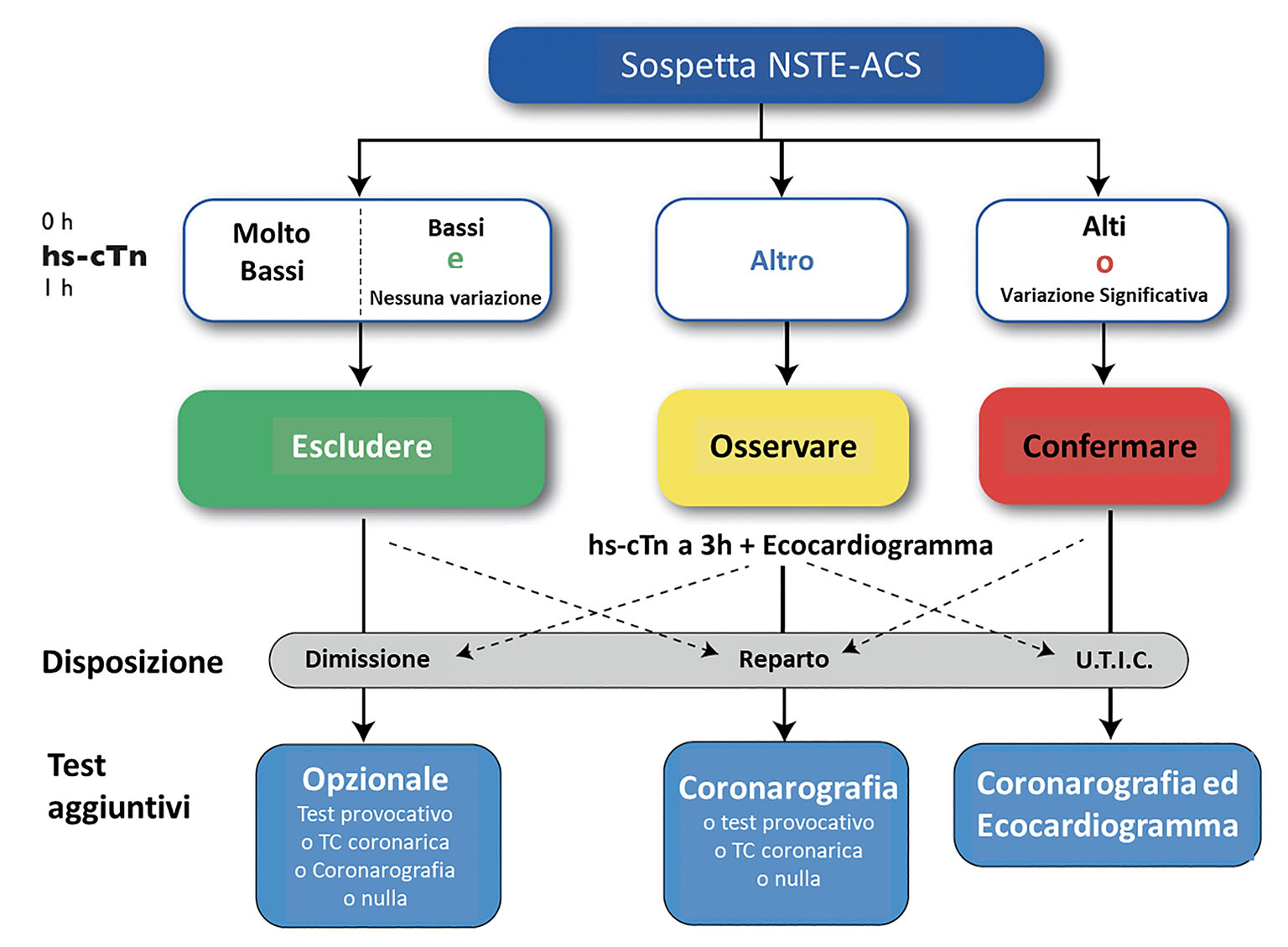
Fig. 2 - Algoritmo decisionale al tempo 0/1 h, basato sul dosaggio della troponina cardiaca ad alta sensibilità (hs-cTn) in pazienti emodinamicamente stabili che giungono in Pronto soccorso per sospetta sindrome coronarica acuta senza sopraslivellamento del tratto ST. I termini 0 h e 1 h fanno riferimento al tempo trascorso dal primo test su campione ematico. La diagnosi di NSTEMI può essere esclusa se la concentrazione di hs-cTn è molto bassa oppure in presenza di bassi livelli di hs-cTn e nessuna variazione significativa a 1 h. I pazienti hanno un’elevata probabilità di NSTEMI se la concentrazione di hs-cTn a 0 h è almeno moderatamente elevata oppure se la variazione della sua concentrazione mostra una chiara curva di incremento entro 1 h.
hs-cTn (high-sensitivity cardiac troponin): troponina cardiaca a elevata sensibilità; NSTE-ACS: sindrome coronarica acuta senza sopraslivellamento del tratto ST; TC: tomografia computerizzata; U.T.I.C.: unità di terapia intensiva coronarica.
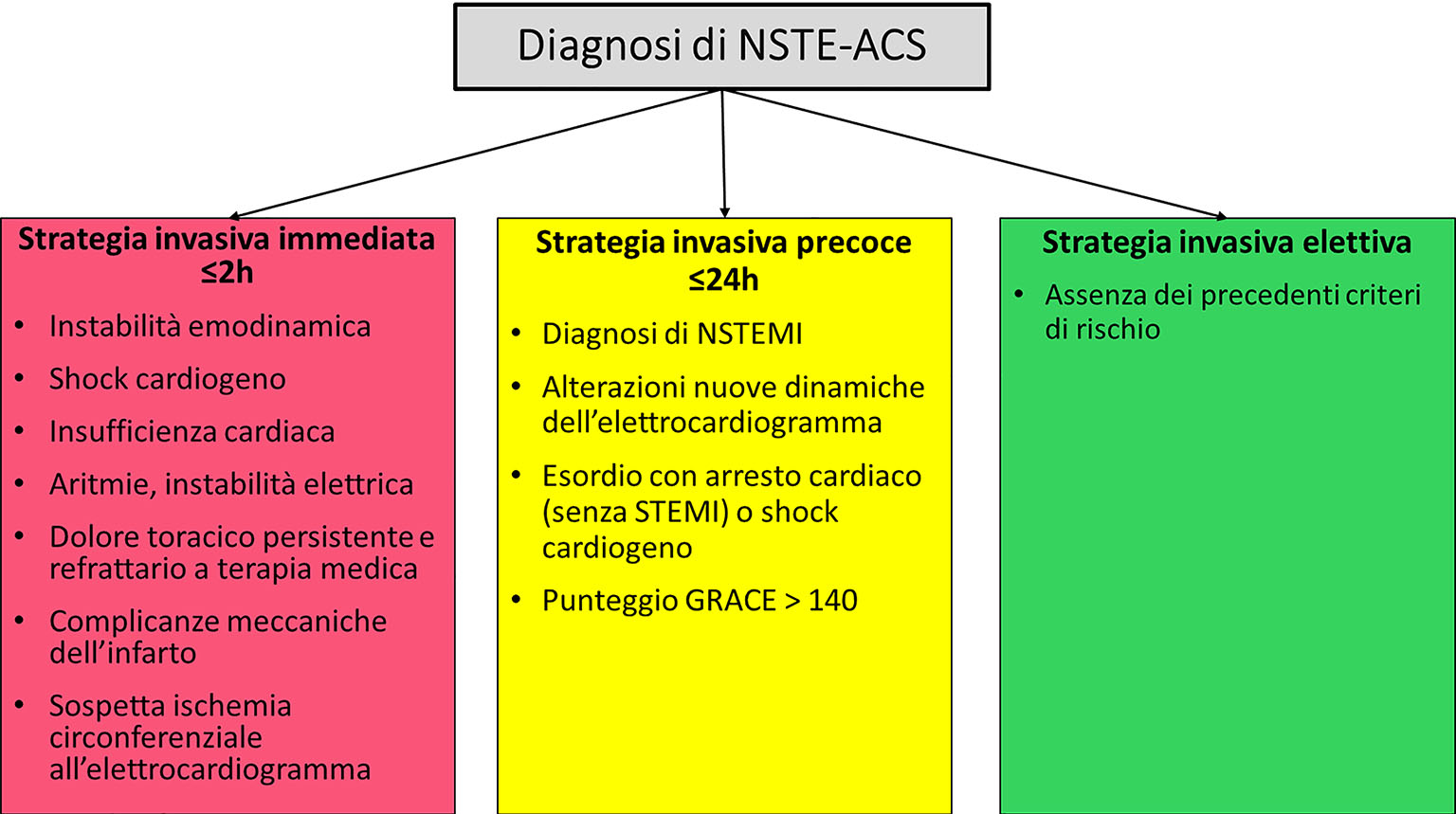
Fig. 3 - Selezione del timing per la strategia di trattamento delle sindromi coronariche acute secondo la stratificazione del rischio.
GRACE: Global Registry of Acute Coronary Events; NSTEMI: infarto miocardico acuto senza sopraslivellamento del tratto ST; NSTE-ACS: sindrome coronarica acuta senza sopraslivellamento del tratto ST; STEMI: infarto miocardico acuto con sopraslivellamento del tratto ST.
La terapia farmacologica
Sollievo del dolore
Morfina
La morfina solfato costituisce il trattamento di scelta del dolore toracico e dell’agitazione, responsabili dell’aumento del tono adrenergico con conseguente vasocostrizione e aumento del lavoro cardiaco: la dose iniziale di 4-8 mg per via endovenosa (ev) in 5 minuti può essere aumentata di 2 mg ogni 5-15 minuti, fino a risoluzione del dolore. Essa in particolare è raccomandata nei pazienti i cui sintomi persistono dopo tre somministrazioni di compresse sublinguali di nitroglicerina o recidivano nonostante adeguata terapia anti-ischemica. Gli effetti collaterali possono essere nausea, vomito, ipotensione, bradicardia e depressione respiratoria, antagonizzabili con l’uso di antiemetici, atropina, o naloxone. Se la morfina non dovesse risultare efficace, possono essere utili beta-bloccanti o nitrati ev (Tab. II).
Terapia anti-ischemica
Nitroderivati
I nitrati organici sono esteri dell’acido nitrico (HNO3). Quelli ad oggi più comunemente usati nella pratica clinica sono la nitroglicerina (NTG), l’isosorbide dinitrato (ISDN) e l’isosorbide mononitrato (ISMN). Essi sono disponibili in un’ampia varietà di formulazioni, con differenti vie di somministrazione. I benefici effetti dei nitrati nei pazienti con cardiopatia ischemica sono essenzialmente associati alla vasodilatazione delle vene di capacitanza e delle arterie di conduttanza. La dilatazione delle vene di capacitanza riduce il ritorno venoso, il precarico e la tensione di parete ventricolare. La dilatazione delle arterie sistemiche di conduttanza, al contrario riduce il post-carico, un altro determinante del consumo miocardico di ossigeno. I nitrati dilatano anche le arterie coronarie epicardiche e i vasi coronarici collaterali, aumentando ulteriormente l’apporto di ossigeno al miocardio. Inoltre, possono aumentare il flusso sanguigno alle aree ischemiche, in particolare al subendocardio, riducendo la pressione diastolica ventricolare e quindi attenuando la compressione del subendocardio.
In virtù di queste caratteristiche, la NTG sublinguale è indicata come terapia iniziale nella maggior parte dei pazienti sintomatici con ACS al dosaggio di 0,4 mg ripetibile ogni 5 minuti fino a un massimo di 3 dosi, dopo di che si dovrebbe passare alla somministrazione ev. Attualmente gli unici gruppi di pazienti con infarto miocardico in cui la NTG non deve essere somministrata sono quelli con sospetto infarto del ventricolo destro o con grave ipotensione (pressione sistolica <90 mmHg), specialmente se accompagnata da bradicardia (<50 bpm) e quelli che hanno assunto inibitori delle fosfodiesterasi nelle ultime 24 ore (48 ore nel caso di tadalafil). L’uso della NTG o dell’ISDN ev nelle prime 48 ore dello STEMI è indicato per il trattamento del dolore da ischemia persistente, della congestione polmonare e dell’ipertensione arteriosa, ma la decisione di somministrare questi farmaci e i dosaggi utilizzati non devono precludere la possibilità di somministrare altri farmaci di cui è stata dimostrata l’efficacia nel ridurre la mortalità (beta-bloccanti e ACE-inibitori). A tal proposito si ricorda che in trial clinici randomizzati non è mai stato dimostrato che l’uso sistematico di nitrati ev abbia alcun effetto sulla mortalità, pertanto non ne è raccomandato l’uso routinario (18). L’infusione ev di NTG dovrebbe essere iniziata al dosaggio di 5-10 µg/min e titolata in modo graduale fino ad ottenere la remissione dei sintomi o la riduzione della pressione arteriosa sistolica del 10-30%. La terapia infusionale dovrebbe essere poi progressivamente ridotta fino a sospenderla in 24-36 ore. Una limitazione all’uso continuo dei nitrati è il fenomeno della tolleranza, correlato sia alla dose somministrata sia alla durata del trattamento. Ottenuta la remissione dei sintomi, i nitrati in infusione possono essere sostituiti dalla terapia orale o transdermica, con opportune finestre di assunzione (Tab. II).
Beta-bloccanti
I beta-bloccanti inibiscono gli effetti delle catecolamine circolanti mediante il blocco competitivo dei recettori beta-adrenergici. Tale inibizione determina una riduzione della contrattilità miocardica, della frequenza cardiaca, della velocità di conduzione atrio-ventricolare e della pressione arteriosa sistemica, con conseguente riduzione del consumo miocardico di ossigeno. I beta-bloccanti di prima generazione, come il propranololo, bloccano i recettori beta in modo non selettivo (sia β1 che β2); quelli di seconda generazione come metoprololo, bisoprololo e atenololo sono relativamente selettivi per i recettori β1, localizzati prevalentemente nel cuore; quelli di terza generazione sono anche vasodilatatori ad attività anti-α-adrenergica, come nel caso del carvedilolo. La somministrazione ev precoce dei beta-bloccanti è consigliabile in presenza di tachicardia, ipertensione arteriosa, dolore resistente agli oppiacei, aritmie ventricolari e sopraventricolari, e in genere quando siano presenti segni di iperattività simpatica. Le principali controindicazioni sono la bradicardia marcata, il blocco atrio-ventricolare (BAV) di I grado con intervallo PR >0,24 secondi, il BAV di II o III grado, l’asma bronchiale, lo shock cardiogeno e l’ipotensione arteriosa persistente. In fase acuta le molecole di più comune utilizzo ev sono metoprololo (2,5-5 mg ev in 2 minuti fino a tre volte) e atenololo (5-10 mg ev fino a due dosi). Superata la fase acuta si passa alla somministrazione orale, che tuttavia è da posticipare qualora il paziente sia emodinamicamente instabile (classe Killip >2, frequenza cardiaca <55 bpm, BAV di II o III grado). Nei pazienti con segni clinici o strumentali di insufficienza ventricolare sinistra acuta è consigliabile iniziare la terapia orale a basso dosaggio, effettuando un attento monitoraggio dei parametri emodinamici. Nei pazienti con funzione ventricolare sinistra conservata la somministrazione orale inizia con 50 mg di metoprololo o atenololo due volte/die (19) (Tab. II).
Calcio-antagonisti
Attualmente non si raccomanda l’uso routinario dei calcio-antagonisti nei pazienti con STEMI. Per quanto riguarda verapamil e diltiazem, essi possono essere utili come anti-ischemici nei pazienti in cui i beta-bloccanti siano inefficaci o controindicati, quando la componente vasospastica coronarica sia prevalente, o quando vi sia una concomitante tachiaritmia sopraventricolare. Verapamil e diltiazem devono essere evitati in pazienti con alterazioni della conduzione atrio-ventricolare e con segni clinici di scompenso cardiaco (classe Killip ≥2) per il possibile effetto inotropo negativo. L’uso di calcio-antagonisti diidropiridinici a lunga durata d’azione (amlodipina) viene preso in considerazione nei pazienti infartuati con insoddisfacente controllo dei valori pressori dopo le prime 48 ore in associazione a beta-bloccanti e ACE-inibitori. È da evitare la somministrazione di calcio-antagonisti diidropiridinici a breve durata d’azione (nifedipina in gocce o compresse sublinguali) a un paziente ischemico con alti valori pressori poiché la brusca caduta pressoria e la tachicardia riflessa peggiorano ulteriormente l’ischemia miocardica in corso (Tab. II) (20).
| Farmaco | Indicazione | Posologia |
|---|---|---|
| Morfina | Dolore toracico e agitazione | 4-8 mg ev in 5 min, eventualmente aumentata di
2 mg ogni 5-15 min |
| Nitroglicerina | Pazienti sintomatici, con ischemia persistente, scompenso (Killip 2-3), o ipertensione arteriosa. Controindicata in caso di infarto inferiore o destro o di ipotensione | 0,4 mg sublinguale ogni 5 min fino a un massimo di 3 dosi; poi infusione ev dose iniziale 5-10 μg/min titolata fino a remissione sintomi o riduzione della pressione arteriosa del 10-30% |
| Beta-bloccanti | Infusione ev nei pazienti con segni di iperattività simpatica, poi al raggiungimento della stabilità clinica proseguire con somministrazione per os a vita in tutti i pazienti (salvo controindicazioni) indipendentemente dalla presenza o meno di scompenso | Da titolare in base a frequenza cardiaca (target 50-60 bpm) e pressione arteriosa |
| ACE-inibitori | In tutti i pazienti con NSTE-ACS entro 24 ore indipendentemente dai valori di pressione arteriosa, salvo instabilità emodinamica o intolleranza | Iniziare trattamento con basse dosi e aumentare il dosaggio progressivamente monitorando pressione arteriosa, creatininemia e potassiemia |
| Statine | In tutti i pazienti con NSTE-ACS indipendentemente dai valori di colesterolemia | Titolata al raggiungimento del valore target di LDL
(<55 mg/dl, <40 mg/dl in caso di recidiva di infarto entro 2 anni) |
| Acido acetilsalicilico | Il prima possibile in tutti i pazienti con sospetta NSTE-ACS | Dose iniziale 160-325 mg; poi 75-100 mg/die a vita |
| Clopidogrel | Prima dell’angioplastica coronarica | In caso di strategia invasiva: dose di carico di 300-600 mg; poi 75 mg/die.
In caso di strategia conservativa: 75 mg/die (senza dose di carico) |
| Ticagrelor | Prima dell’angioplastica coronarica | Dose di carico 180 mg; poi 90 mg bis in die |
| Prasugrel | Prima dell’angioplastica coronarica | Dose di carico 60 mg, poi 10 mg/die (o 5 mg/die). Generalmente non raccomandato nei pazienti >75 anni o <60 kg, oppure somministrato a dose ridotta di 5 mg/die |
| Cangrelor | Prima dell’angioplastica coronarica | Bolo ev di 30 μg/kg e infusione ev di 4 μg/kg/min |
| Abciximab | Bail-out | Bolo di 0,25 mg/kg (in sala di emodinamica) + 0,125 mg/kg/min in infusione ev per 12 ore |
| Tirofiban | Bail-out | Infusione di 0,4 mg/kg/min per 30 min + 0,1 mg/kg/min per 48-72 ore |
| Eptifibatide | Bail-out | Bolo di 180 mg/kg + 2,0 mg/kg/min in infusione ev |
| Eparina non frazionata (UFH) | Strategia routinaria per procedure invasive d’urgenza | Bolo 70-100 U/kg (o 60 U/kg se utilizzata in concomitanza di inibitori Gp IIb/IIIa) poi infusione aggiustata sull’ACT fino a fine procedura |
| Bivalirudina | Alternativa a UFH + inibitori Gp IIb/IIIa per procedure invasive d’urgenza | Bolo 0,75 mg/kg poi infusione 1,75 mg/kg fino a fine procedura |
| Enoxaparina | Pochi dati di efficacia per procedure invasive d’urgenza
Alternativa a fondaparinux in caso di strategia invasiva precoce o conservativa, se il rischio emorragico è basso |
Bolo ev 3000 U + infusione di 100 U/kg ogni 12 ore fino alla dimissione.
Pazienti >75 anni: infusione 75 U/kg senza bolo iniziale 1 mg/kg sc 2 volte/die fino a dimissione. In caso di PCI nuovo bolo (0,30 mg/kg ev di enoxaparina se ultima dose sc risale a più di 8-12 ore) |
| Fondaparinux | Prima scelta in caso di strategia invasiva precoce o conservativa, per migliore rapporto efficacia/sicurezza | 2,5 mg sc 1 volta/die fino a dimissione → in caso di PCI aggiungere dose standard di eparina non fraz. (85 U/kg o 60 U/kg se + inibitore Gp IIb/IIIa) |
Terapia antitrombotica
La rottura o l’erosione di una o più placche ateromasiche giocano un ruolo cardine nella fisiopatologia delle ACS. L’esposizione al torrente ematico di fattori protrombotici, quali il fattore tissutale e il collagene subendoteliale, provoca da un lato adesione e aggregazione piastrinica, dall’altro attivazione della cascata emocoagulativa con produzione di fibrina e stabilizzazione del trombo. Entrambi i meccanismi rappresentano, pertanto, importanti bersagli terapeutici, che possono essere efficacemente antagonizzati da una vasta gamma di farmaci oggi disponibili in commercio. Per tale motivo la terapia antitrombotica rappresenta una pietra miliare del trattamento di tutte le ACS, sebbene vada accuratamente individualizzata. Infatti la scelta dei farmaci e i relativi dosaggi sono guidati dalla modalità di presentazione del paziente (STEMI o NSTE-ACS) nonché dalla strategia riperfusiva adottata (PCI, fibrinolisi, trattamento conservativo).
Attualmente le tre principali classi di farmaci antitrombotici sono: l’acido acetilsalicilico, gli inibitori del recettore P2Y12 dell’ADP e gli inibitori della glicoproteina (GP) IIb/IIIa.
Acido acetilsalicilico
L’effetto antitrombotico dell’acido acetilsalicilico è dovuto all’inibizione della ciclossigenasi (COX)-1 piastrinica, che blocca la produzione di tromboxano (TX)A2, potente induttore di vasocostrizione e di aggregazione piastrinica. Al fine di accelerare il processo di inibizione della COX-1, l’acido acetilsalicilico deve essere somministrato il più presto possibile a ogni paziente con sospetta ACS, indipendentemente dalla strategia riperfusiva che verrà scelta e dalla somministrazione di altri farmaci antipiastrinici. La dose iniziale è compresa tra 150 e 300 mg per os (80-150 mg per via endovenosa in caso di impossibilità all’ingestione). Successivamente, l’acido acetilsalicilico dovrà essere somministrato indefinitamente alla dose di 75-100 mg/die a tutti i pazienti, a meno di reazioni da ipersensibilità che possono richiedere opportuna terapia desensibilizzante (2,3,21,22) (Tab. II).
Bloccanti del recettore P2Y12 piastrinico
Clopidogrel e ticlopidina
Clopidogrel e ticlopidina appartengono alla famiglia delle tienopiridine, farmaci che bloccano l’aggregazione piastrinica indotta dall’ADP attraverso l’antagonismo selettivo e irreversibile dei recettori piastrinici P2Y12. Il dosaggio di ticlopidina è di 250 mg due volte/die; tuttavia il suo impiego clinico è fortemente limitato da un potenziale grave effetto collaterale, l’agranulocitosi. Clopidogrel, apprezzabilmente privo di tale rischio, è attualmente la tienopiridina più utilizzata nella pratica clinica. Nei pazienti affetti da STEMI e NSTE-ACS da indirizzare a procedura invasiva o PCI è raccomandata la somministrazione orale di clopidogrel in singola dose di carico di 300-600 mg, seguita dalla dose di mantenimento di 75 mg/die per 12 mesi. Nei pazienti sottoposti a fibrinolisi la dose di carico di clopidogrel raccomandata varia in funzione dell’età: 300 mg nei pazienti con meno di 75 anni e 75 mg in quelli più anziani (Tab. II).
Ticagrelor
È un bloccante reversibile non tienopiridinico del recettore piastrinico P2Y12, che non necessita di attivazione metabolica. In virtù della sua potente e rapida azione antiaggregante si è dimostrato particolarmente adatto all’utilizzo in fase acuta in associazione all’acido acetilsalicilico in pazienti con ACS. Tuttavia ticagrelor può presentare, oltre a una maggiore percentuale di sanguinamento rispetto a clopidogrel, alcuni effetti collaterali come bradicardia asintomatica e dispnea transitoria, che comunque raramente richiedono l’interruzione del trattamento (Tab. II).
Prasugrel
Prasugrel, come clopidogrel, è un profarmaco tienopiridinico che, una volta metabolizzato in farmaco attivo, opera un blocco recettoriale irreversibile del recettore piastrinico per l’ADP. Rispetto al suo predecessore, prasugrel induce un’inibizione dell’aggregazione piastrinica più rapida, più potente e più prevedibile grazie a una minore dipendenza dai polimorfismi genetici del citocromo P450, enzima responsabile della sua biotrasformazione in metabolita attivo. Prasugrel si è rivelato superiore sia a clopidogrel che a ticagrelor nei pazienti con ACS da sottoporre a PCI, e dovrebbe attualmente essere scelto come farmaco di prima linea (23), fatti salvi i pazienti anziani, di peso inferiore a 60 kg e con anamnesi positiva per eventi cerebrovascolari, in cui un sostanziale incremento del rischio di sanguinamento ne controindica l’utilizzo (Tab. II).
Cangrelor
Cangrelor è un inibitore selettivo e reversibile del recettore piastrinico P2Y12 dell’ADP. Viene utilizzato per via ev con effetto dose-dipendente. Cangrelor determina inibizione dell’aggregazione piastrinica praticamente immediata (dopo 5 minuti dalla somministrazione della dose di carico) e possibilità di reversione completa del suo effetto in 30 minuti dalla sospensione dell’infusione. Diversamente dalle altre tienopiridine (che sono profarmaci), cangrelor è una molecola già attiva che non richiede trasformazioni da parte del fegato. Dalle evidenze fin qui disponibili, cangrelor per via ev, nonostante un aumento dei sanguinamenti di grado lieve e moderato, riduce significativamente l’incidenza di complicanze trombotiche durante e dopo PCI rispetto a placebo o clopidogrel, sia nelle ACS che nella coronaropatia stabile, e si candida pertanto come il farmaco di riferimento in presenza di alto carico trombotico e in setting clinici e anatomici complessi, o quando, in mancanza di pretrattamento con farmaci orali, si richieda l’immediata inibizione piastrinica pre-procedurale (24,25) (Tab. II).
Inibitori della glicoproteina IIb/IIIa
La GP IIb/IIIa è un recettore per il fibrinogeno costitutivamente espresso sulla superficie piastrinica. A seguito dell’attivazione piastrinica si assiste a un aumento del numero di tali recettori e a una variazione conformazionale che ne aumenta l’affinità di legame per il fibrinogeno, il fattore von Willebrand e altri ligandi. Una molecola di fibrinogeno funziona così da ponte tra due piastrine adiacenti, determinando l’aggregazione piastrinica. Gli antagonisti della GP IIb/IIIa occupano questo recettore, impedendone il legame con il fibrinogeno e di conseguenza l’aggregazione piastrinica. Gli inibitori glicoproteici di comune uso clinico sono:
- il derivato del frammento di anticorpo monoclonale 7E3, abciximab (non più disponibile in Italia),
- il peptide ciclico eptifibatide,
- l’inibitore a basso peso molecolare non peptidico tirofiban.
Tutti e tre gli antagonisti del recettore GP IIb/IIIa si sono rivelati efficaci nel ridurre gli eventi clinici trombotici in pazienti con ACS trattati con procedure interventistiche, pur determinando un significativo aumento dei sanguinamenti maggiori. Per le sue caratteristiche farmacocinetiche e farmacodinamiche abciximab è stato a lungo impiegato in via preferenziale, in sala di emodinamica, come strategia di emergenza (bail-out) per affrontare condizioni di elevato carico trombotico e ostruzione trombotica del microcircolo coronarico. Le modalità di somministrazione degli inibitori glicoproteici sono riportate nella Tabella II.
Terapia anticoagulante
I farmaci anticoagulanti indicati dalle attuali linee guida europee sono: eparina non frazionata, eparina a basso peso molecolare, fondaparinux e bivalirudina (Tab. II).
Eparina non frazionata (unfractionated heparin, UFH)
L’effetto anticoagulante dell’UFH richiede la presenza dell’antitrombina (AT): quando l’eparina si lega all’AT, ne determina un cambiamento conformazionale che trasforma l’AT in un inibitore rapido e molto potente. Il complesso eparina-AT inattiva la trombina e i fattori della coagulazione IXa, Xa, XIa e XIIa. L’inattivazione della trombina previene la formazione di fibrina e inibisce anche l’attivazione del fattore V e del fattore VIII. Le vie di somministrazione dell’UFH sono l’infusione ev continua (con eparina sodica), che determina un effetto anticoagulante immediato, e l’iniezione sottocutanea (con eparina sodica o calcica), che determina un effetto anticoagulante ritardato e prolungato. Una volta in circolo, l’UFH si lega a numerose proteine plasmatiche, alle cellule endoteliali e ai macrofagi, che ne riducono l’attività anticoagulante. Si rende pertanto indispensabile un monitoraggio di laboratorio periodico per correggere il dosaggio di farmaco da somministrare: i test comunemente usati sono il tempo di tromboplastina parziale attivata (activated partial thromboplastin time, aPTT) oppure il tempo di coagulazione attivato (activated clotting time, ACT), quest’ultimo preferibile con alti dosaggi di UFH.
L’obiettivo terapeutico è di mantenere l’aPTT (valore basale di circa 25-35 secondi) in un range tra 1,5 e 2 volte i valori di base (per l’uso al di fuori della PCI) o l’ACT in un range di 250-350 secondi (per la PCI). Una lieve trombocitopenia si verifica precocemente nel 10-20% dei pazienti in terapia con eparina, mentre una trombocitopenia grave e tardiva (5-15 giorni dopo l’inizio della terapia), su base immunologica, è complicanza più rara (1-2% dei casi) ma estremamente pericolosa, che richiede l’immediata sospensione della terapia eparinica. Il razionale dell’impiego di UHF durante fibrinolisi risiede nel controbilanciare l’effetto pro-coagulante degli agenti litici come alteplase e tenecteplase. In corso di fibrinolisi la dose standard di eparina consiste in un bolo di 60 U/kg (max 4000 U), seguito da infusione continua di 12 U/kg/ora (max 1000 U ora). La terapia con eparina ev viene mantenuta per 48 ore nei casi non complicati o a basso rischio di complicanze tromboemboliche. In caso di angiografia coronarica/PCI la somministrazione di eparina ev è limitata alla fase di esecuzione della procedura, al fine di ridurre il tasso di occlusione dell’arteria radiale dovuto all’incannulazione e contrastare l’effetto pro-trombotico dei materiali plastici e metallici introdotti nel circolo coronarico durante la PCI. Nella gestione di un sanguinamento, l’effetto anticoagulante dell’UFH viene efficacemente annullato dal solfato di protamina (1 mg di solfato di protamina neutralizza 5000 UI di eparina), un antidoto che neutralizza efficacemente l’attività antitrombinica (Tab. II).
Eparine a basso peso molecolare (low molecular weight heparins, LMWH)
Le LMWH sono frazioni della molecola di eparina con un peso molecolare medio di circa 5000 Dalton. Le LMWH determinano un’inibizione maggiore del fattore Xa rispetto alla trombina, con un rapporto di attività anti-Xa:anti-IIa che varia da 2:1 fino a 4:1. Il legame con l’antitrombina è essenziale affinché le LMWH abbiano attività anticoagulante, così come la presenza di una sequenza pentasaccaridica nella molecola. Un’emivita più lunga, una migliore biodisponibilità nella somministrazione sottocutanea e una maggiore prevedibilità della relazione dose-risposta rispetto all’UFH rendono le LMWH più maneggevoli dell’UFH, in particolare perché non richiedono il monitoraggio dell’aPTT. In presenza di un sanguinamento, a differenza dell’UFH, l’attività anti-fattore Xa delle LMWH non è significativamente antagonizzata dalla protamina solfato. Enoxaparina ha mostrato una maggiore efficacia rispetto all’UFH nel ridurre gli eventi vascolari maggiori in pazienti con STEMI trattati con trombolitici. Nei pazienti di età <75 anni le ultime linee guida raccomandano per il trattamento dello STEMI l’uso di enoxaparina in dosi standard [3000 U in bolo ev + infusione di 100 U (1 mg)/kg ogni 12 ore fino alla dimissione] associato a terapia trombolitica. Nei pazienti di età >75 anni, l’enoxaparina in infusione ev di 75 U/kg, senza necessità di bolo iniziale, può essere utilizzata in alternativa a UFH. In caso di NSTE-ACS enoxaparina è da preferire nei pazienti trattati conservativamente, mentre in quelli sottoposti a procedure invasive si raccomanda l’impiego di UFH (3) (Tab. II).
Fondaparinux
Fondaparinux è un pentasaccaride di sintesi che si lega selettivamente all’antitrombina e inibisce rapidamente il fattore Xa. Attualmente le linee guida ne consigliano l’uso in pazienti affetti da STEMI trattati con fibrinolisi o non riperfusi mediante PCI. In pazienti con NSTE-ACS trattati conservativamente, fondaparinux può essere considerato l’anticoagulante ideale. In caso di indicazione all’esame coronarografico si raccomanda la somministrazione aggiuntiva di dosi standard di UFH (85 U/kg), in quanto il blocco selettivo del fattore Xa non protegge dalla trombosi su catetere (Tab. II).
Bivalirudina
Bivalirudina, derivato sintetico dell’irudina, è un antagonista diretto e reversibile della trombina. Attualmente trova indicazione nei pazienti con ACS sottoposti a PCI elettivo o primario in alternativa all’associazione di UFH e anti-GP IIb/IIIa. Bivalirudina ha in questa situazione dimostrato una netta riduzione dei sanguinamenti e anche della mortalità a lungo termine (nello STEMI) rispetto a UFH + abciximab. Lo schema terapeutico validato prevede 0,75 mg/kg in bolo, seguito dall’infusione a una velocità di 1,75 mg/kg/h limitatamente alla fase della procedura. Il farmaco viene però oggi molto meno utilizzato in quanto dimostratosi meno efficace rispetto all’UFH in confronti diretti in assenza di inibitori della GP IIb/IIIa (Tab. II).
Terapia ipocolesterolemizzante
L’impiego di farmaci quali le statine, in grado di ridurre i livelli di colesterolemia attraverso l’inibizione della 3-idrossi-3-metil-glutaril-coenzima-A reduttasi, enzima coinvolto a monte nella sintesi epatica di colesterolo, migliora la sopravvivenza nei pazienti con malattia coronarica indipendentemente dai livelli di colesterolo sierico. Studi di confronto hanno documentato che la somministrazione di statine in pazienti con NSTE-ACS ne migliora la prognosi riducendo in maniera significativa l’incidenza combinata di morte, infarto o nuovi episodi di ischemia miocardica. Con tale terapia è anche possibile minimizzare a lungo termine la progressione delle lesioni aterosclerotiche nei distretti coronarici non direttamente responsabili dell’ischemia acuta. Per ottenere tali benefici è tuttavia necessario somministrare le statine in modo precoce e “aggressivo”, ovvero con l’obiettivo terapeutico di ridurre il colesterolo LDL a livelli <55 mg/dl o <40 mg/dl nei pazienti con recidiva precoce di eventi cardiovascolari (26) (Tab. II).
Nei pazienti in cui l’obiettivo di colesterolo LDL non venga raggiunto o in cui si verifichi intolleranza [nella maggior parte dei casi un effetto nocebo (27)] o reazione avversa alle dosi più alte di statine, è possibile associare l’inibitore dell’assorbimento intestinale del colesterolo ezetimibe, eventualmente riducendo la dose di statina (26).
Una nuova classe di farmaci, quella degli anticorpi monoclonali contro la subtilisina/kexina protein-convertasi (protein convertase subtilysin/kexin 9, PCSK9) sta recentemente emergendo nel panorama dei farmaci per il trattamento delle dislipidemie per la grande efficacia nel ridurre i livelli di LDL colesterolo. PCSK9 infatti, legando il recettore per le LDL, ne facilita il degradamento lisosomiale aumentando i livelli circolanti di colesterolo LDL. Gli anticorpi monoclonali anti-PCSK9 aumentano l’espressione sulla membrana cellulare dei recettori per l’internalizzazione dell’LDL colesterolo, determinandone una significativa riduzione della concentrazione nel circolo ematico. A causa dell’elevato costo e della somministrazione sottocutanea, l’utilizzo di questa nuova e potente classe di farmaci è attualmente riservato ai pazienti refrattari alle terapie di prima e seconda linea (23).
Terapia preventiva per il rimodellamento cardiaco
ACE-inibitori e sartani
Gli inibitori dell’enzima di conversione dell’angiotensina (ACE) inibiscono la conversione dell’angiotensina I in angiotensina II, impedendo così l’attività vasocostrittrice e sodio-ritentiva dell’angiotensina II, e inibiscono la degradazione delle chinine, peptidi capaci di stimolare la sintesi di prostaglandine e la liberazione del potente vasodilatatore nitrossido (NO). Pertanto, gli ACE-inibitori riducono le resistenze arteriolari sistemiche e aumentano la distensibilità delle grosse arterie, riducendo così la pressione arteriosa sia sistolica che diastolica. Inoltre sono in grado di interferire con i processi di crescita e di rimodellamento delle cellule muscolari lisce cardiache e vascolari stimolati dall’angiotensina II. Gli ACE-inibitori dovrebbero essere somministrati precocemente (entro 24 ore) in tutti i pazienti con STEMI in particolare quelli con necrosi in sede anteriore, segni di insufficienza cardiaca congestizia e riduzione della frazione di eiezione (<40%), indipendentemente dai valori pressori, a meno che non siano presenti instabilità emodinamica o intolleranza. Si raccomanda di iniziare il trattamento con basse dosi, soprattutto in caso di valori pressori ai limiti inferiori (ad es. ramipril 1,25-2,5 mg due volte/die, enalapril o lisinopril 2,5-5 mg due volte/die) e di aumentare il dosaggio facendo particolare attenzione all’andamento pressorio e ai valori di creatininemia e potassiemia (19) (Tab. II).
In caso di pazienti intolleranti agli ACE-inibitori, l’alternativa è costituita dagli inibitori dei recettori dell’angiotensina II (angiotensin receptor blockers, ARB), definiti comunemente sartani, quali valsartan e candesartan (28,29).
Altre misure di trattamento
Tra le misure generali, la somministrazione di ossigeno è raccomandata solo quando i livelli di saturazione arteriosa di O2 scendono sotto il 90%, mentre l’utilizzo routinario è sconsigliato (30).
Nella gestione dei pazienti che si presentano con edema polmonare acuto, particolarmente efficaci possono rivelarsi l’infusione endovenosa di furosemide (sia a boli refratti che in infusione continua), i nitroderivati e l’utilizzo della ventilazione meccanica non invasiva a pressione continua (continuous positive airway pressure, CPAP) (20).
Un controllo accurato della glicemia nei pazienti con ACS trattati in Unità di Terapia Intensiva sembra determinare un beneficio in termini di sopravvivenza. Tuttavia la terapia con insulina ev è gravata da un’incidenza non trascurabile di ipoglicemie, con valenza prognostica negativa simile all’iperglicemia all’ingresso. Pertanto la terapia infusionale con insulina andrebbe intrapresa solo se l’Unità di Terapia Intensiva Coronarica è in condizioni di poter assicurare un controllo glicemico frequente (31).
Conclusioni
Considerate l’elevata mortalità e morbilità associate alle ACS, la gestione clinica deve essere ottimizzata, sia nella fase acuta sia a lungo termine, tramite l’utilizzo appropriato di tutte le strategie disponibili (invasive, conservative e di prevenzione secondaria), che devono essere naturalmente adeguate alla storia clinica e alle caratteristiche del singolo paziente.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors. Editorial support was provided by Elena Sarugeri on behalf of Health Publishing & Services Srl and was funded by Sanofi.
Authors contribution: All authors contributed equally to this manuscript.
Bibliografia
- 1. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40(3):237-269. CrossRef
- 2. Ibanez B, James S, Agewall S, et al; ESC Scientific Document Group. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39(2):119-177. CrossRef PubMed
- 3. Collet J-P, Thiele H, Barbato E, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42(14):1289-1367. CrossRef PubMed
- 4. Maron DJ, Hochman JS, Reynolds HR, et al; ISCHEMIA Research Group. Initial Invasive or Conservative Strategy for Stable Coronary Disease. N Engl J Med. 2020;382(15):1395-1407. CrossRef PubMed
- 5. Boden WE, O’Rourke RA, Teo KK, et al; COURAGE Trial Research Group. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med. 2007;356(15):1503-1516. CrossRef PubMed
- 6. Al-Lamee R, Thompson D, Dehbi H-M, et al; ORBITA investigators. Percutaneous coronary intervention in stable angina (ORBITA): a double-blind, randomised controlled trial. Lancet. 2018;391(10115):31-40. CrossRef PubMed
- 7. Stone GW, Maehara A, Lansky AJ, et al; PROSPECT Investigators. A prospective natural-history study of coronary atherosclerosis. N Engl J Med. 2011;364(3):226-235. CrossRef PubMed
- 8. Stone GW, Maehara A, Ali ZA, et al; PROSPECT ABSORB Investigators. Percutaneous Coronary Intervention for Vulnerable Coronary Atherosclerotic Plaque. J Am Coll Cardiol. 2020;76(20):2289-2301. CrossRef PubMed
- 9. Gershlick AH, Khan JN, Kelly DJ, et al. Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol. 2015;65(10):963-972. CrossRef PubMed
- 10. Engstrøm T, Kelbæk H, Helqvist S, et al; DANAMI-3—PRIMULTI Investigators. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI): an open-label, randomised controlled trial. Lancet. 2015;386(9994):665-671. CrossRef PubMed
- 11. Valgimigli M, Gagnor A, Calabró P, et al; MATRIX Investigators. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet. 2015;385(9986):2465-2476. CrossRef PubMed
- 12. Jolly SS, Cairns JA, Yusuf S, et al; TOTAL Investigators. Randomized trial of primary PCI with or without routine manual thrombectomy. N Engl J Med. 2015;372(15):1389-1398. CrossRef PubMed
- 13. Fröbert O, Lagerqvist B, Olivecrona GK, et al; TASTE Trial. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369(17):1587-1597. CrossRef PubMed
- 14. Bainey KR, Engstrøm T, Smits PC, et al. Complete vs Culprit-Lesion-Only Revascularization for ST-Segment Elevation Myocardial Infarction: A Systematic Review and Meta-analysis. JAMA Cardiol. 2020;5(8):881-888. CrossRef PubMed
- 15. Mooney M, McKee G, Fealy G, O’ Brien F, O’Donnell S, Moser D. A randomized controlled trial to reduce prehospital delay time in patients with acute coronary syndrome (ACS). J Emerg Med. 2014;46(4):495-506. CrossRef PubMed
- 16. Kofoed KF, Kelbæk H, Hansen PR, et al. Early Versus Standard Care Invasive Examination and Treatment of Patients With Non-ST-Segment Elevation Acute Coronary Syndrome. Circulation. 2018;138(24):2741-2750. CrossRef PubMed
- 17. Neumann, Franz-Josef, Miguel Sousa-Uva, Anders Ahlsson, Fernando Alfonso, Adrian P. Banning, Umberto Benedetto, Robert A. Byrne, Jean-Philippe Collet, Volkmar Fal, Stuart J. Head PJ., Adnan Kastrati, Akos Koller SDK., Josef Niebauer, Dimitrios J. Richter PMS., Dirk Sibbing, Giulio G. Stefanini, Stephan Windecker, Rashmi Yadav MOZ. 2018 ESC / EACTS Guidelines on myocardial revascularization The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and European Association for 2019;40:87-165. CrossRef
- 18. Mahmarian JJ, Moyé LA, Chinoy DA, et al. Transdermal nitroglycerin patch therapy improves left ventricular function and prevents remodeling after acute myocardial infarction: results of a multicenter prospective randomized, double-blind, placebo-controlled trial. Circulation. 1998;97(20):2017-2024. PubMed
- 19. McDonagh TA, Metra M, Adamo M, et al; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726. PubMed
- 20. Held PH, Yusuf S. Effects of β-blockers and calcium channel blockers in acute myocardial infarction. Eur Heart J. 1993;14(suppl F):18-25. CrossRef PubMed
- 21. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Lancet. 1988;2(8607):349-360. PubMed
- 22. GUSTO investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med. 1993;329(10):673-682. CrossRef PubMed
- 23. Schüpke S, Neumann F-J, Menichelli M, et al; ISAR-REACT 5 Trial Investigators. Ticagrelor or Prasugrel in Patients with Acute Coronary Syndromes. N Engl J Med. 2019;381(16):1524-1534. CrossRef PubMed
- 24. Stone GW, Généreux P, Harrington RA, et al. Impact of lesion complexity on peri-procedural adverse events and the benefit of potent intravenous platelet adenosine diphosphate receptor inhibition after percutaneous coronary intervention: core laboratory analysis from 10 854 patients from the CHAMPION PHOENIX trial. Eur Heart J. 2018;39(46):4112-4121. CrossRef PubMed
- 25. Steg PG, Bhatt DL, Hamm CW, et al; CHAMPION Investigators. Effect of cangrelor on periprocedural outcomes in percutaneous coronary interventions: a pooled analysis of patient-level data. Lancet. 2013;382(9909):1981-1992. CrossRef PubMed
- 26. Mach F, Baigent C, Catapano AL, et al; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-188. CrossRef PubMed
- 27. Wood FA, Howard JP, Finegold JA, et al. N-of-1 Trial of a Statin, Placebo, or No Treatment to Assess Side Effects. N Engl J Med. 2020;383(22):2182-2184. CrossRef PubMed
- 28. Young JB, Dunlap ME, Pfeffer MA, et al; Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity (CHARM) Investigators and Committees. Mortality and morbidity reduction with Candesartan in patients with chronic heart failure and left ventricular systolic dysfunction: results of the CHARM low-left ventricular ejection fraction trials. Circulation. 2004;110(17):2618-2626. CrossRef PubMed
- 29. Cohn JN, Tognoni G; Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med. 2001;345(23):1667-1675. PubMed
- 30. Hofmann R, James SK, Jernberg T, et al; DETO2X–SWEDEHEART Investigators. Oxygen Therapy in Suspected Acute Myocardial Infarction. N Engl J Med. 2017;377(13):1240-1249. CrossRef PubMed
- 31. Ritsinger V, Malmberg K, Mårtensson A, Rydén L, Wedel H, Norhammar A. Intensified insulin-based glycaemic control after myocardial infarction: mortality during 20 year follow-up of the randomised Diabetes Mellitus Insulin Glucose Infusion in Acute Myocardial Infarction (DIGAMI 1) trial. Lancet Diabetes Endocrinol. 2014;2(8):627-633. CrossRef PubMed