 |
Glob Reg Health Technol Assess 2022; 9: 22-29 ISSN 2283-5733 | DOI: 10.33393/grhta.2022.2351 ORIGINAL RESEARCH ARTICLE |
 |
Budget Impact di afatinib per il trattamento in prima linea del Non Small Cell Lung Cancer (NSCLC) con mutazioni non comuni EGFR
Budget Impact Analysis of afatinib for first-line treatment of Non-Small Cell Lung Cancer (NSCLC) patients with uncommon EGFR mutations
Background: The current clinical practice for patients affected by Non-Small Cell Lung Cancer (NSCLC) with uncommon mutation is based on afatinib and osimertinib, second and third generation of Tyrosine Kinase Inhibitor (TKI) respectively. For uncommon EGFR mutations, it is still unclear which EGFR TKI is most effective, since there are few dedicated prospective studies and Next Generation Sequencing (NGS) techniques trace an increasingly large and sometimes little-known population of EGFR mutations.
Objective: To determine the economic impact associated to afatinib and osimertinib, a Budget Impact model considering a 3-year time horizon with two scenarios was developed: a first scenario, called AS IS, based on treatment with afatinib and osimertinib according to a distribution of market shares as emerged from clinical practice; a second suitable scenario, called TO BE, based on reviewed literature data, assuming for each year a 10%, 15% and 20% increase in afatinib use, respectively.
Methods: Budget Impact analysis was conducted using a dynamic cohort model, in which the annual number of patients with NSCLC and uncommon mutations was equally distributed over 12 months. Progression-free survival (PFS) data for afatinib and osimertinib were extrapolated up to 36 months from published Kaplan Meier curves, and then the number of patients was estimated for each treatment.
Results: The increase of 10% in afatinib use allowed a saving of drug acquisition costs for the Italian NHS, over the 3-year time horizon, of –€ 622,432. The univariate sensitivity analysis shows the market share of osimertinib to be the parameter significantly affecting the results achieved in the base case.
Conclusions: The potential increase in the use of afatinib in patients with NSCLC and uncommon mutations leads to lower drug acquisition costs, lower Budget Impact and a saving of money for the Italian NHS.
Keywords: Afatinib, Budget Impact, NSCLC, Osimertinib, Uncommon mutation
Received: October 26, 2021
Accepted: January 4, 2022
Published online: January 31, 2022
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il cancro del polmone, classificato secondo la diagnosi in carcinoma polmonare a piccole cellule (SCLC) e in carcinoma polmonare non a piccole cellule (NSCLC), è la causa più comune di morte per cancro, con una stima di 1,6 milioni di morti ogni anno in tutto il mondo (1); in Italia, nel 2020, sono 34.000 i decessi stimati (2). Secondo l’American Society of Clinical Oncology (ASCO), il NSCLC rappresenta l’84% di tutti i tumori diagnosticati al polmone (3), con una suddivisione in 3 principali sottotipi istologici: adenocarcinoma (circa il 60%), carcinoma a cellule squamose (circa il 35%) e carcinoma a grandi cellule (circa il 15%, sebbene questa tipologia sia in diminuzione) (4,5).
Il tasso di sopravvivenza globale a 60 mesi per NSCLC rimane basso, con una variazione legata allo stadio della malattia: dal 68% nei pazienti con malattia allo stadio IB allo 0%-15% nei pazienti con malattia allo stadio IVA-IVB (6).
Alcuni fattori ambientali e lo stile di vita sono stati associati all’aumento di rischio di sviluppo del cancro ai polmoni: tra questi fattori il fumo di sigaretta è il più importante. Si stima che l’abitudine al tabagismo comporti l’85%-90% dei tumori polmonari, mentre difficile da stimare è l’impatto del fumo passivo (second hand smoking exposure) (7,8).
Sebbene tutti i principali sottotipi istologici di NSCLC siano legati al fumo, l’associazione è più forte con il carcinoma polmonare a cellule squamose (LUSC) e lo SCLC rispetto all’adenocarcinoma polmonare (LUAD), essendo quest’ultima l’istologia più comune nei non fumatori (9).
Il cancro del polmone è una malattia genotipicamente eterogenea e la comprensione della sua biologia è fondamentale per lo sviluppo di terapie efficaci. Storicamente la prima categoria di pazienti affetti da neoplasia polmonare sostenuta da un’alterazione molecolare definita “driver” è quella dei pazienti con carcinoma polmonare NSCLC con una mutazione del recettore del fattore di crescita epidermico (EGFR). Questi sono un gruppo di pazienti con caratteristiche clinico-patologiche, prognosi e trattamento diversi rispetto ad altri pazienti con NSCLC e rappresentano circa il 13-15% dei pazienti affetti da adenocarcinoma nella popolazione caucasica (10).
A oggi, un approccio terapeutico personalizzato basato sulla rilevazione di mutazioni attivanti nel dominio chinasico dell’EGFR direttamente correlato con la sensibilità agli inibitori della tirosin-chinasi (TKI) dell’EGFR nei pazienti con NSCLC avanzato rappresenta lo standard di cura nel setting diagnostico dei pazienti con NSCLC (11,12).
I TKI dell’EGFR hanno significativamente prolungato la PFS nei pazienti con NSCLC avanzato con una mutazione dell’EGFR rispetto alla chemioterapia a base di platino (13).
La maggior parte delle mutazioni di EGFR è considerata un fattore predittivo di risposta ai TKI. Tra queste, il sottotipo più “comune” è la mutazione dell’esone 19 (~ 45% delle mutazioni EGFR), seguito dalla mutazione dell’esone 21 (~ 40% delle mutazioni EGFR) (11). Il restante 10% delle mutazioni EGFR comprende alterazioni molecolari eterogenee all’interno degli esoni 18-21 (cosiddette mutazioni “non comuni”), con risposte clinicamente variabili ai farmaci mirati e tassi di sopravvivenza generalmente più brevi rispetto alle mutazioni classiche (14,15).
Per le mutazioni EGFR non comuni, non è ancora chiaro quale sia il TKI EGFR più efficace: in particolare lo studio di queste mutazioni si è recentemente ampliato grazie all’introduzione delle tecniche di Next Generation Sequencing (NGS), per cui è possibile identificare questi sottotipi di alterazioni. Questa incertezza riflette il fatto che i tumori con mutazioni non comuni sono stati spesso esclusi dagli studi clinici. Gli studi clinici randomizzati controllati LUX-Lung 3 e LUX-Lung 6 hanno confrontato afatinib, un TKI di seconda generazione, con chemioterapia in tutti i tipi di mutazione EGFR ma in generale sono disponibili pochi dati clinici prospettici che hanno valutato i TKI dell’EGFR contro mutazioni non comuni (16).
Un’analisi post hoc dei dati raccolti in modo prospettico dagli studi LUX-Lung 3 e LUX-Lung 6 (identificatori ClinicalTrials.gov: NCT00949650 e NCT01121393) ha mostrato un’attività clinica di afatinib in pazienti con NSCLC e mutazioni di EGFR non comuni, in particolare Gly719X (G719X), Leu861Gln (L861Q) e Ser768Ile (S768I), ma una bassa attività verso la mutazione T790M e le inserzioni dell’esone 20 (15). In particolare, nell’analisi post hoc le mutazioni non comuni sono state suddivise in tre gruppi: 1) mutazioni puntiformi o duplicazioni degli esoni 18-21 da sole o in combinazione tra loro Gly719X (G719X), Leu861Gln (L861Q) e Ser768Ile (S768I), 2) mutazione T790M dell’esone 20, da sola o in combinazione con altre mutazioni, e 3) inserzione dell’esone 20. Afatinib ha mostrato di essere efficace soprattutto nel primo gruppo (RR 71,1%, PFS mediana 10,7 mesi) mentre osimertinib ha mostrato, nello studio di fase 2 a singolo braccio, un ORR e una PFS pari rispettivamente al 50% e a 8,2 mesi (15).
Osimertinib, un TKI di terza generazione, è stato valutato in uno studio multicentrico, in aperto, di fase due, a singolo braccio, in una popolazione con mutazioni non comuni (G719X, L861Q, S768I e altre): nell’analisi per sottogruppi sono state osservate risposte oggettive nel 78% dei pazienti con la mutazione L861Q, nel 53% dei pazienti con G719X e nel 38% dei pazienti con S768I. Di conseguenza, la PFS di pazienti con mutazioni L861Q, G719X o S768I era di 15,2 mesi (95% CI, 1,3-29,1 mesi), 8,2 mesi (95% CI, 6,2-10,2 mesi), e 12,3 mesi (95% CI, 0-28,8 mesi) rispettivamente (17). Recentemente, un poster presentato all’European Society for Medical Oncology (ESMO) su uno studio retrospettivo di osimertinib (46 pazienti) con NSCLC e mutazioni non comuni mostrava una PFS mediana di 9,1 mesi (95% CI 8,1-19,2) (18).
Oltre agli aspetti clinici citati precedentemente, va considerato che le malattie respiratorie gravano notevolmente sulla società in termini di disabilità e mortalità prematura, ma anche sui costi diretti del servizio sanitario, sulla spesa farmaceutica e sui costi indiretti legati alla perdita di produzione. L’European Respiratory Society ha calcolato che il valore medio degli anni di vita aggiustati per disabilità (DALY) persi da un paziente con cancro ai polmoni è di circa € 350.000 (19). Uno studio condotto sulla popolazione italiana ha provato a definire l’impatto economico sostenuto nella gestione in 191 pazienti con NSCLC arruolati nello studio LIFE. La popolazione presa in considerazione aveva un’età media di 64,2 anni (66% composto da individui di sesso maschile). Il costo sanitario complessivo nel periodo medio di osservazione (16,4 mesi) è stato di € 25.859 per paziente. Nel complesso, la terapia oncologica è stata il fattore di costo principale, sebbene i costi per farmaci concomitanti e cure palliative predominassero nella fase avanzata della malattia. Dai risultati di questo studio è emerso che l’onere economico del NSCLC è estremamente elevato durante il periodo complessivo di trattamento ed è richiesto un livello significativo di assistenza in ogni fase della malattia (20).
Per valutare l’impatto economico dei TKI in pazienti con NSCLC e mutazioni EGFR non comuni in prima linea di trattamento, sono stati stimati i dati di PFS osservati negli studi di afatinib (15) e di osimertinib (17), considerando per afatinib la prima coorte di pazienti riportata nell’analisi post hoc di Yang et al. (15), dato che è quella più simile in termini di mutazioni coinvolte a quella di osimertinib e per osimertinib i dati pubblicati nello studio di Cho et al. (17), poiché nel recente poster presentato all’ESMO non era stata pubblicata la curva di Kaplan Meier. La scelta di queste due opzioni terapeutiche è giustificata dal fatto che, come evidenziato dalle Linee Guida sul polmone AIOM (Associazione Italiana Oncologia Medica) 2020, le uniche evidenze prospettiche riguardo l’attività e l’efficacia degli inibitori di EGFR in presenza di mutazioni non comuni derivano proprio da studi clinici con afatinib e osimertinib (21). Le stesse Linee Guida riportano per afatinib (e per gli inibitori di EGFR di prima generazione gefitinib o erlotinib) una forza della raccomandazione “Positiva debole” per le mutazioni/delezioni degli esoni 18-21.
Il presente studio ha l’obiettivo di determinare l’impatto sul budget della strategia di trattamento in prima linea con afatinib rispetto a osimertinib nei pazienti affetti da NSCLC con mutazioni non comuni.
Metodi
Analisi di Budget Impact
L’analisi di Budget Impact è stata condotta utilizzando un modello di coorte dinamico, in cui il numero di pazienti annuo con NSCLC e mutazioni non comuni stimato dalla letteratura è stato distribuito equamente in 12 mesi e secondo le quote di utilizzo dei principi attivi in modo che ad ogni mese una nuova coorte di pazienti poteva entrare nel modello.
Ciascuna coorte è stata considerata fino al 36° mese e ponderata per i valori individuali a livello di paziente stimati a partire dalle curve di sopravvivenza della PFS pubblicate negli studi di afatinib e osimertinib: in ciascun mese quindi, a eccezione del mese 1, il numero di pazienti in terapia era costituito dalla somma dei pazienti della nuova coorte mensile e dei pazienti del mese precedente che non progredivano e che continuavano il trattamento.
Due scenari alternativi su un orizzonte temporale di tre anni sono stati considerati: • un primo scenario, denominato AS IS, basato sul trattamento con afatinib e osimertinib con una distribuzione della percentuale di utilizzo dei due principi attivi stimata da due Key Expert Opinion e • un secondo scenario, TO BE, basato sul trattamento con afatinib e osimertinib ipotizzando un incremento dell’utilizzo di afatanib del 10%.
Estrapolazioni dei dati di PFS
Il software WebPlotDigitizers (22) è stato utilizzato per estrarre le coordinate delle curve Kaplan Meier riportate negli studi di afatinib (15) e osimertinib (17), poiché i dati di PFS individuali non erano disponibili.
I dati Kaplan Meier grezzi digitalizzati sono stati così importati in Excel, arrontondati e ordinati dal valore X più basso a quello più alto. Qualsiasi incongruenza nei valori Y (cioè una diminuzione della probabilità di essere vivi seguita da un aumento incrementale nel tempo) è stata corretta per interpolazione.
I dati Kaplan Meier digitalizzati sono stati successivamente importati nel software R (versione 4.1.1) così come il numero di pazienti a rischio riportato nei due studi.
Il pacchetto statistico SurvHE (23), che racchiude strumenti analitici rilevanti per la modellazione economica, è stato utilizzato per generare dati pseudo individuali a livello di paziente (pIPD) seguendo i metodi delineati in Guyot 2012 (24).
I pIPD generati con SurvHE sono stati poi utilizzati per l’estrapolazione dei dati di sopravvivenza oltre l’orizzonte temporale considerato negli studi Yang et al. (15) e Cho et al. (17).
Per entrambi i principi attivi la valutazione della distribuzione statistica ottimale che meglio si adattava alla curva di Kaplan Meier è stata eseguita attraverso il calcolo del parametro Bayesian Information Criterion (BIC), preferendo il modello con il valore di BIC inferiore. Il BIC è un criterio per la selezione di un modello tra una classe di modelli parametrici con un diverso numero di parametri, che introduce un termine di penalizzazione per il numero di parametri presenti nel modello, superando i limiti della stima dei parametri del modello con il metodo della massima verosimiglianza (25). Le distribuzioni selezionate sono state quindi utilizzate per predire ed estrapolare i dati di PFS oltre a quelli osservati (fino a 36 mesi).
Popolazione target
La popolazione target è stata identificata attraverso fonti di letteratura scientifica. In particolare, per stimare il numero di pazienti con NSCLC in stadio localmente avanzato o metastatico con mutazioni non comuni di EGFR, si è partiti dalla stima di nuove diagnosi di tumore in Italia (377.000) a cui è stata applicata l’incidenza percentuale di persone con carcinoma polmonare pari al 10,9% (41.093), di cui l’85%, vale a dire 34.929 persone, presenta NSCLC con il 64% di individui affetto da carcinoma allo stadio IIIb o IV metastatico (22.354). Di questi pazienti, il 40% presenta un adenocarcinoma (8.942) di cui solo il 76% viene testato per valutare la presenza di positività alla mutazione EGFR. Considerando che, del 12,5% dei pazienti (850) che risultano positivi al test, il 10% (85 soggetti) mostra mutazioni del gene EGFR non comuni e che di questi l’89% viene trattato in prima linea con inibitori della tirosin-chinasi, otteniamo un numero di pazienti incidenti all’Anno 1 pari a 76 (Tab. I). Un incremento della capacità di testing con la NGS, per valutare la presenza della mutazione EGFR, nei successivi due anni, del 10,5% e del 22,3% è stato stimato da due Key Expert Opinion: in tal modo è possibile prevedere una popolazione target di 84 e 93 pazienti per l’Anno 2 e l’Anno 3.
| Valore | Fonte | |
|---|---|---|
| Nuove diagnosi di tumore in Italia | 377.000 | (2) |
| Pazienti incidenti in Italia tumore polmonare | 10,9%
(41.093) |
(2) |
| Percentuale tumori polmonari NSCLC | 85%
(34.929) |
(11) |
| Persone con NSCLC stadio IIIb-IV | 64%
(22.354) |
(26) |
| Pazienti con adenocarcinoma | 40%
(8.942) |
(21) |
| Pazienti che vengono testati per mutazione EGFR | 76%
(6.796) |
(27) |
| Pazienti positivi alla mutazione EGRF | 12,50%
(850) |
(2) (media tra range 10-15%) |
| Percentuale con mutazione EGFR non comune | 10%
(85) |
(11) |
| Percentuale pazienti trattati in prima linea | 89%
(76) |
(27) |
| Pazienti con NSCLC positivi alle mutazioni EGFR non comuni che iniziano la terapia di prima linea ogni anno | (76) |
Nello scenario AS IS, il tasso di utilizzo nella pratica clinica in prima linea di afatinib e osimertinib è stato stimato dagli esperti essere pari al 50% per ciascun principio attivo, mentre, nello scenario TO BE, è stato ipotizzato, considerando le raccomandazioni emerse dalle linee guida AIOM, un aumento dell’utilizzo di afatinib per ciascun anno pari rispettivamente al 10%, al 15% e al 20% (Tab. II).
| Anno 1 | Anno 2 | Anno 3 | Anno 1 | Anno 2 | Anno 3 | |
|---|---|---|---|---|---|---|
| Quote di mercato | Numero di trattamenti | |||||
| Scenario AS IS | ||||||
| Afatinib | 50% | 50% | 50% | 210 | 463 | 631 |
| Osimertinib | 50% | 50% | 50% | 204 | 441 | 581 |
| Totale | 100% | 100% | 100% | 414 | 904 | 1.212 |
| Scenario TO BE | ||||||
| Afatinib | 60% | 65% | 70% | 231 | 521 | 733 |
| Osimertinib | 40% | 35% | 30% | 183 | 386 | 486 |
| Totale | 100% | 100% | 100% | 414 | 907 | 1.219 |
Considerando per ciascuna opzione terapeutica la distribuzione mensile dei pazienti per la rispettiva quota di utilizzo e successivamente applicando i valori IPD per la PFS estrapolati, è stato possibile stimare per ciascun anno il numero di trattamenti per entrambi gli scenari. Come mostra la Tabella II, anche se nello scenario AS IS la quota di mercato è la stessa per i due principi attivi, quindi con un’equa distribuzione mensile dei pazienti all’ingresso di ciascuna coorte nel modello, il totale del numero di trattamenti annui tra afatinib e osimertinib varia poiché ciascuna coorte di pazienti è stata ponderata per i rispettivi valori di PFS estrapolati. Inoltre, nel calcolo dei costi per entrambi gli scenari sono stati considerati solo i pazienti la cui malattia non progrediva e che quindi restavano in trattamento (Tabelle Supplementari A e B disponibili online).
Consumo di risorse
Dato che la prospettiva considerata per l’analisi di Budget Impact è quella del Servizio Sanitario Nazionale, sono stati esclusi i costi indiretti (perdite di produttività del paziente, del caregiver, ecc.) e sono stati considerati solo i costi dei principi attivi. Per calcolare il costo mensile di afatinib e osimertinib, i costi dei farmaci ex-factory al netto degli sconti di legge riportati nella Lista di Trasparenza AIFA sono stati suddivisi per il rispettivo numero di unità posologiche moltiplicato per il numero di giorni medio presenti in un mese (Tab. III) (30,42). Nell’analisi di Budget Impact non è stato possibile valorizzare gli eventi avversi poiché l’analisi post hoc di afatinib non riportava le frequenze degli eventi avversi.
Risultati
Estrapolazione dei dati di sopravvivenza
Ai dati di sopravvivenza individuali ricostruiti per afatinib e osimertinib sono state adattate alcune distribuzioni statistiche al fine di selezionare quella che meglio si adattava ai dati. In particolare, prima attraverso una analisi visuale dei modelli delle diverse distribuzioni statistiche (Figg. 1, 2) e poi confrontando i rispettivi BIC (Tab. IV), sono state selezionate per afatinib la distribuzione log-Normal e per osimertinib la distribuzione esponenziale.
Analisi di Budget Impact
Sulla base della stima della popolazione eleggibile, delle quote di mercato previste per afatinib e osimertinib e dei valori di PFS estrapolati e considerando un orizzonte temporale di 3 anni, è stato possibile determinare l’assorbimento di risorse associato allo scenario AS IS e allo scenario TO BE. La Tabella V riporta l’impatto di spesa per anno di analisi associato allo scenario AS IS in cui, dal primo anno di analisi, è possibile constatare come il costo del trattamento con afatinib sia nettamente più basso (per ciascun anno pari rispettivamente a € 466.416, € 1.028.337 ed € 1.041.470) rispetto a quello di osimertinib (pari rispettivamente a € 1.222.137, € 2.641.974 ed € 3.480.695), pur avendo il primo un numero di trattamenti per ciascun anno ben superiore al secondo, mostrando quindi già di generare minori costi per il SSN (Tab. V).
Lo scenario TO BE, che prevede un aumento della percentuale di utilizzo di afatinib del 10%, del 15% e del 20% rispettivamente per l’Anno 1, l’Anno 2 e l’Anno 3 e una pari riduzione del consumo di osimertinib, mostra, rispetto allo scenario AS IS, un aumento dei costi associati ad afatinib (sempre inferiori a quelli di osimertinib) e una riduzione dei costi di osimertinib. Tuttavia, tale aumento è più che compensato dalla riduzione di costi di osimertinib: ciò si traduce, dal punto di vista del Budget Impact, per ciascun anno, in costi totali più bassi nello scenario TO BE rispetto allo scenario AS IS. In particolare, l’incremento dell’uso di afatinib nei tre anni considerati genera minori costi pari rispettivamente a –€ 79.167, –€ 200.678 e – € 342.588, per un totale di –€ 622.432 (Tab. VI).
| Principio attivo | Confezione | Posologia da RCP | Prezzo confezione | Prezzo trattamento mensile |
|---|---|---|---|---|
| Afatinib | 40 mg 28 unità uso orale | 40 mg una volta al giorno fino a progressione della malattia o a tossicità inaccettabile | € 2.044,34 | € 2.221,03 |
| Osimertinib | 80 mg 28 unità uso orale | 80 mg una volta al giorno fino a progressione della malattia o a tossicità inaccettabile | € 5.514,28 | € 5.990,87 |
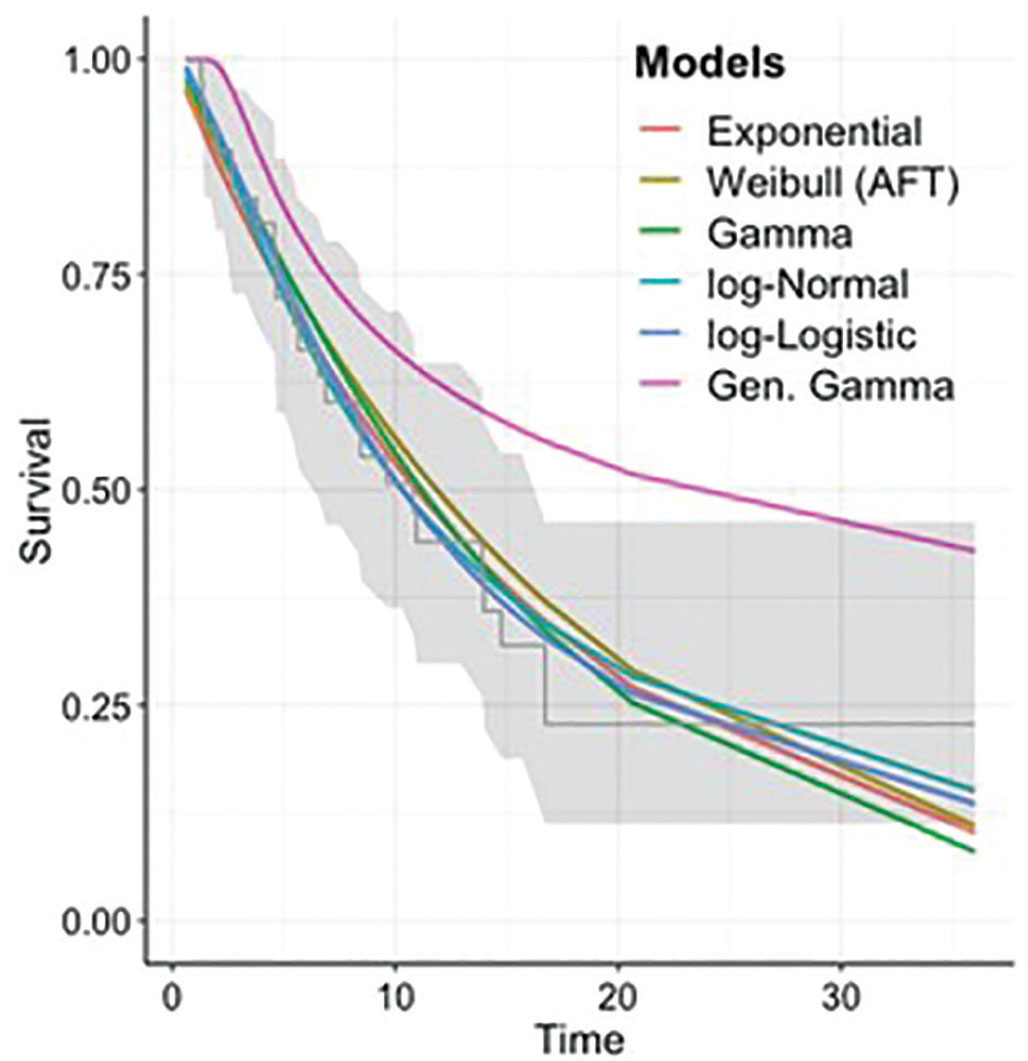
Fig. 1 - Adattamento distribuzioni statistiche curva PFS ricostruita afatinib.
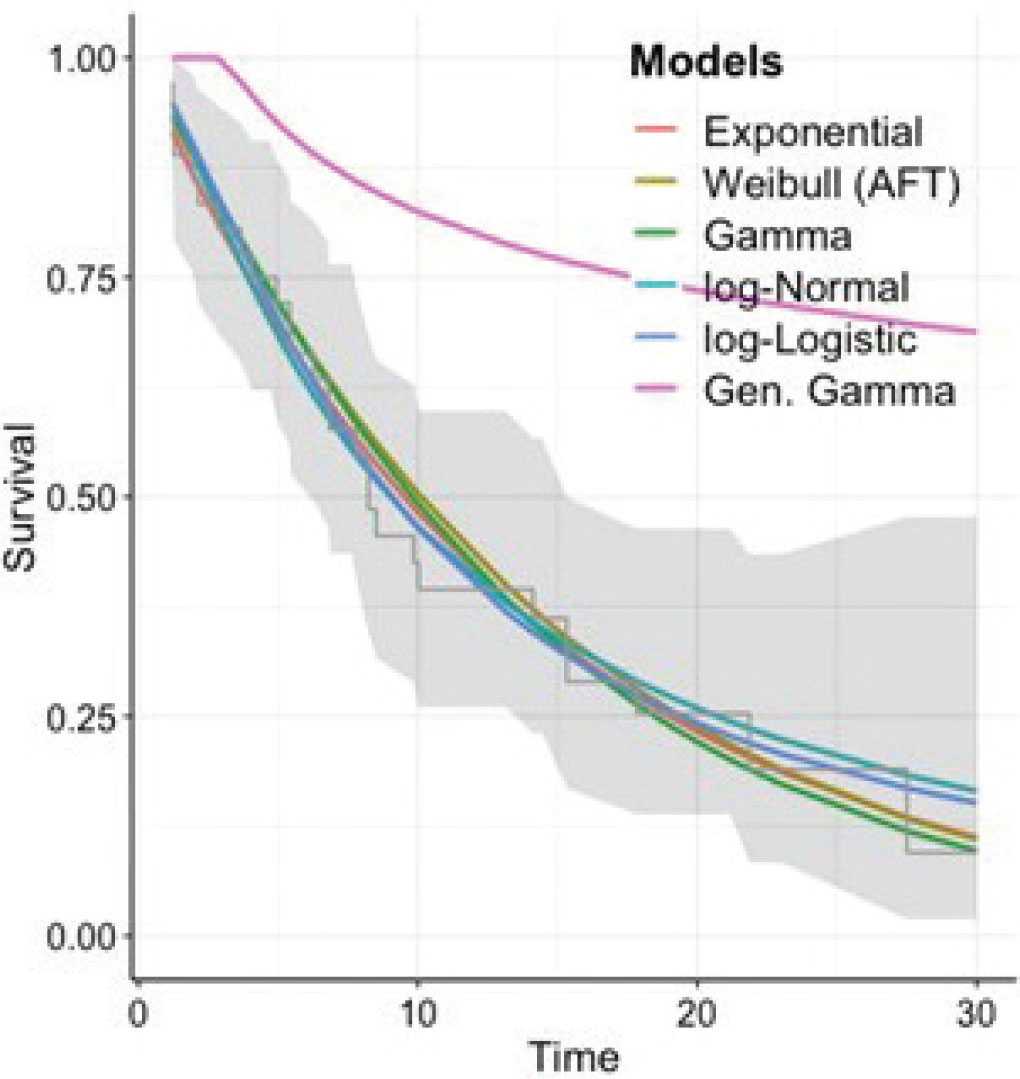
Fig. 2 - Adattamento distribuzioni statistiche curva PFS ricostruita osimertinib.
| Distribuzione statistica | Afatinib | Osimertinib |
|---|---|---|
| Weillbull | 191,66 | 206,34 |
| Log-Normal | 187,71 | 204,45 |
| Log-Logistic | 188,26 | 205,3 |
| Gen. Gamma | 190,89 | 242,22 |
| Gamma | 191,17 | 206,07 |
| Exponential | 188,17 | 203 |
| Scenario AS IS | ||||
|---|---|---|---|---|
| Anno 1 | Anno 2 | Anno 3 | Totale | |
| Afatinib | € 466.416 | € 1.028.337 | € 1.401.470 | € 2.896.223 |
| Osimertinib | € 1.222.137 | € 2.641.974 | € 3.480.695 | € 7.344.807 |
| Totale | € 1.688.554 | € 3.670.311 | € 4.882.165 | € 10.241.030 |
| Scenario TO BE | ||||
| Afatinib | € 513.058 | € 1.157.157 | € 1.628.015 | € 3.298.230 |
| Osimertinib | € 1.096.329 | € 2.312.476 | € 2.911.563 | € 6.320.368 |
| Totale | € 1.609.387 | € 3.469.632 | € 4.539.578 | € 9.618.597 |
| Budget Impact | ||||
|---|---|---|---|---|
| Anno 1 | Anno 2 | Anno 3 | Totale | |
| Scenario AS IS | € 1.688.554 | € 3.670.311 | € 4.882.165 | € 10.241.030 |
| Scenario TO BE | € 1.609.387 | € 3.469.632 | € 4.539.578 | € 9.618.597 |
| Totale | –€ 79.167 | –€ 200.678 | –€ 342.588 | –€ 622.432 |
Analisi di sensibilità univariata
L’impatto dell’incertezza sui risultati a tre anni dell’analisi di Budget Impact è stato valutato attraverso un’analisi di sensibilità univariata condotta sul caso base (- € 622.432), in cui ciascun parametro considerato nel modello (quote di mercato, prezzo dei principi attivi e dati di PFS estrapolati) è stato fatto variare singolarmente del ± 20% (High e Low riportati nella Figura 3) rispetto al proprio valore nel caso base.
Per facilitare la lettura della sensitivity analysis, il diagramma a tornado presenta la differenza in termini di aumento o diminuzione del valore del Budget Impact, ottenuto dalla variazione di ciascun parametro, rispetto al risultato che si è ottenuto nel caso base. Pertanto, la linea verticale del grafico posta in corrispondenza dello zero rappresenta l’impatto nullo sul caso base. Il costo di osimertinib rappresenta il parametro che più influenza il risultato del Budget Impact. Infatti, considerando un aumento del 20% del prezzo di osimertinib, il Budget Impact del caso base subisce una variazione, in termini di riduzione, pari a –€ 204.888, passando quindi da –€ 622.432 a –€ 827.320. Al contrario, una riduzione del prezzo di osimertinib del 20% genera un aumento del Budget Impact del caso base pari a € 204.887, passando quindi da –€ 622.432 a –€ 417.545. La PFS di osimertinib è il secondo parametro che più impatta sui risultati del Budget Impact, con una riduzione di –€ 143.781 e un aumento di € 179.726 del valore del caso base, che passa rispettivamente a –€ 766.213 e a – € 442.706 (Fig. 3).
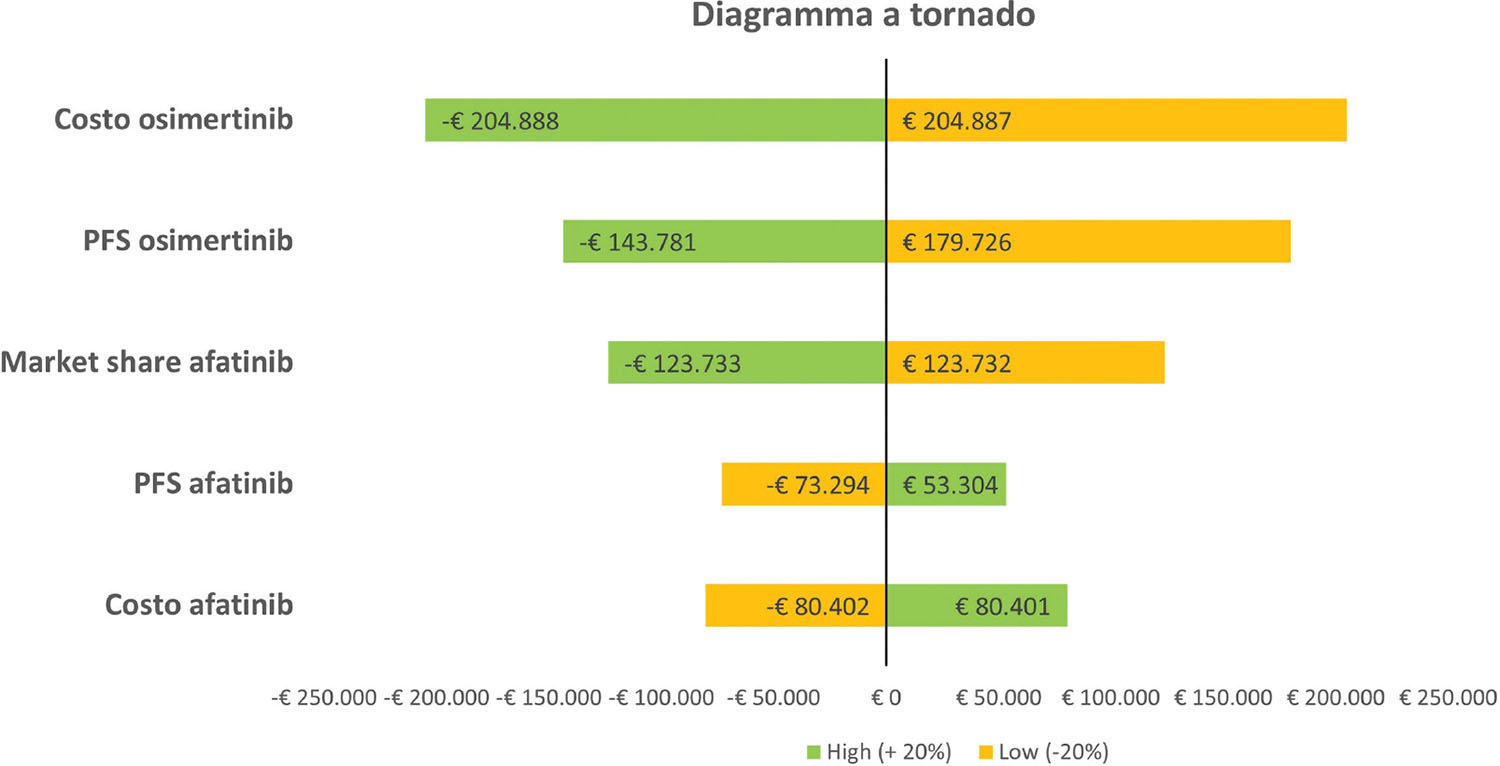
Fig. 3 - Analisi di sensibilità univariata.
La sensitivity analysis, infatti, mostra come un aumento del market share di afatinib sia in grado di generare un aumento crescente dei risparmi per il SSN, fino a –€ 4.448.584 nel caso di una completa sostituzione di osimertinib, come emerso dall’analisi di scenario condotta sulle quote crescenti di market share di afatinib (Fig. 4).
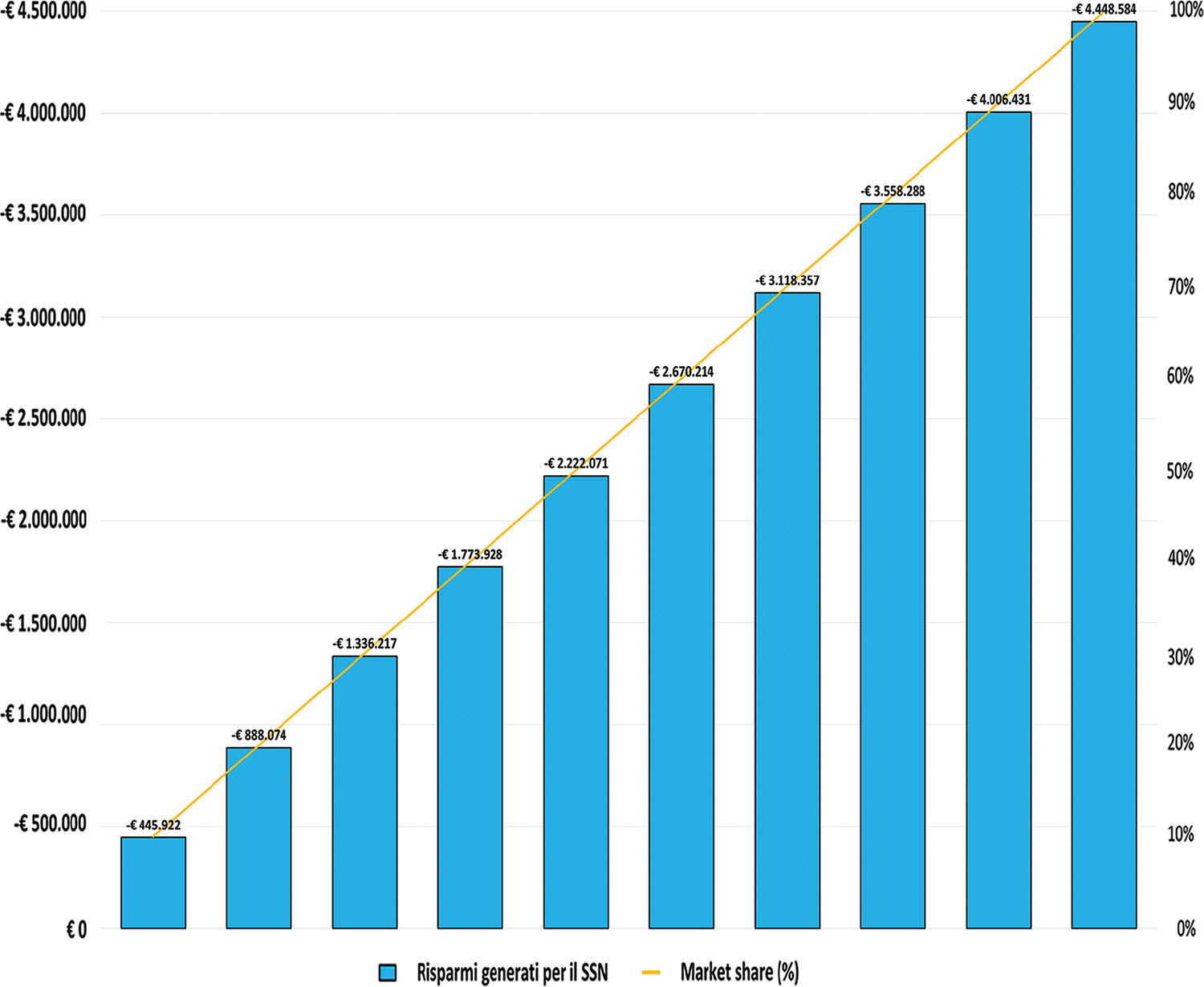
Fig. 4 - Analisi di scenario condotta facendo variare, per ciascun anno, il market share di afatinib della stessa percentuale.
Discussione
Per condurre l’analisi di Budget Impact, finalizzata a stimare l’impatto economico della sola spesa farmaceutica dei TKI (afatinib e osimertinib) utilizzati in prima intenzione di trattamento per i pazienti con NSCLC e mutazioni EGFR non comuni, è stato sviluppato un modello di coorte, la cui progressione era legata ai dati di PFS. Data la mancanza di dati dei pazienti a livello individuale, è stato necessario stimare i valori di PFS dalle curve di sopravvivenza di afatininib e osimertinib (15,17); ciò rappresenta un primo limite dello studio, associato al metodo di estrapolazione seguito e quindi all’incertezza della stima di PFS utilizzata nel modello di Budget Impact, comunque valutata nell’analisi di sensibilità. Un secondo limite riguarda l’assenza della stima dei costi degli eventi avversi, associati alle due strategie terapeutiche, dovuta alla mancanza nell’analisi post hoc di afatinib di dati aggregati sulla frequenza degli eventi avversi.
Inoltre, appare rilevante come l’introduzione più massiva nel nostro SSN della NGS come procedura diagnostica sia in grado di aumentare il potenziale di rilevamento delle mutazioni, con un impatto importante sulla diagnosi e sul trattamento del NSLC nonché sull’appropriatezza terapeutica, con conseguente impatto positivo sull’allocazione di risorse.
Conclusione
La disponibilità di diversi TKI ha inevitabilmente portato a interrogarsi su quale agente sia più efficace e tollerabile per i singoli pazienti. Recenti studi testa a testa prospettici hanno rivelato che i TKI di seconda e terza generazione sono più efficaci dei TKI di prima generazione (28-30).
Se le attuali Linee Guida individuano osimertinib come il farmaco di scelta per le mutazioni di EGFR sensibilizzanti comuni, afatinib possiede anche l’indicazione per l’impiego nelle mutazioni di EGFR attivanti non comuni. Oltre a studi osservazionali che hanno valutato afatinib in pazienti con mutazioni non comuni (31,32), l’efficacia e la sicurezza di afatinib nelle mutazioni non comuni è stata studiata in due studi clinici randomizzati controllati, LUX-Lung 3 e LUX-Lung 6, rispettivamente versus cisplatino/pemetrexed e versus cisplatino/gemcitabina. In mancanza di confronti testa a testa tra afatinib e osimertinib e di altre evidenze disponibili, l’analisi di Budget Impact condotta per afatinib sul primo gruppo di pazienti dell’analisi post hoc di Yang et al. (15) e per osimertinib sullo studio di fase 2 di Cho et al. (17) ha consentito, considerando un aumento delle quote di mercato di afatinib del 10%, del 15% e del 20% nei tre anni considerati, di stimare un potenziale risparmio per il SSN pari a –€ 622.432.
Disclosures
Conflict of interest: GP and AM declare no conflict of interest. DLC reports Speaker Bureau and Scientific Advisor for Roche, Astra Zeneca, Amgen, Novartis, BMS, MSD, and Boehringer Ingelheim. DI is the CEO of ISHEO srl and has received grants from Abbvie, Merck Serono, Bristol Myers Squibb, Pierre Fabre, Eli Lylli, Boehringer Ingelheim, Angelini, Fidia Pharma, and AlfaSigma.
Financial support: This study received unconditional funding from Boeheringer Ingelheim Italia S.p.A.
Bibliografia
- 1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87-108. CrossRef PubMed
- 2. AIOM, Airtum. I numeri del cancro in Italia 2020. Online
- 3. Cancer.net. Online (accessed October 2021)
- 4. Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of lung cancer in small biopsies and cytology: implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification. Arch Pathol Lab Med. 2013;137(5):668-684. CrossRef PubMed
- 5. Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of lung adenocarcinoma in resected specimens: implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification. Arch Pathol Lab Med. 2013;137(5):685-705. CrossRef PubMed
- 6. Goldstraw P, Chansky K, Crowley J, et al; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Boards, and Participating Institutions; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee Advisory Boards and Participating Institutions. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51. CrossRef PubMed
- 7. Alberg AJ, Samet JM. Epidemiology of lung cancer. Chest. 2003;123(1)(suppl):21S-49S. CrossRef PubMed
- 8. Alberg AJ, Brock MV, Ford JG, Samet JM, Spivack SD. Epidemiology of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(5)(suppl):e1S-e29S. CrossRef PubMed
- 9. Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer. Nature. 2018;553(7689):446-454. CrossRef PubMed
- 10. Eberhard DA, Johnson BE, Amler LC, et al. Mutations in the epidermal growth factor receptor and in KRAS are predictive and prognostic indicators in patients with non-small-cell lung cancer treated with chemotherapy alone and in combination with erlotinib. J Clin Oncol. 2005;23(25):5900-5909. CrossRef PubMed
- 11. Gristina V, Malapelle U, Galvano A, et al. The significance of epidermal growth factor receptor uncommon mutations in non-small cell lung cancer: A systematic review and critical appraisal. Cancer Treat Rev. 2020;85:101994. CrossRef PubMed
- 12. Masood A, Kancha RK, Subramanian J. Epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors in non-small cell lung cancer harboring uncommon EGFR mutations: focus on afatinib. Semin Oncol. 2019;46(3):271-283. CrossRef PubMed
- 13. Duma N, Santana-Davila R, Molina JR. Non-Small Cell Lung Cancer: Epidemiology, Screening, Diagnosis, and Treatment. Mayo Clin Proc. 2019;94(8):1623-1640. CrossRef PubMed
- 14. Evans M, O’Sullivan B, Smith M, et al. Large-Scale EGFR Mutation Testing in Clinical Practice: Analysis of a Series of 18,920 Non-Small Cell Lung Cancer Cases. Pathol Oncol Res. 2019;25(4):1401-1409. CrossRef PubMed
- 15. Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015;16(7):830-838. CrossRef PubMed
- 16. Passaro A, Mok T, Peters S, Popat S, Ahn MJ, de Marinis F. Recent Advances on the Role of EGFR Tyrosine Kinase Inhibitors in the Management of NSCLC With Uncommon, Non Exon 20 Insertions, EGFR Mutations. J Thorac Oncol. 2021;16(5):764-773. CrossRef PubMed
- 17. Cho JH, Lim SH, An HJ, et al. Osimertinib for Patients With Non-Small-Cell Lung Cancer Harboring Uncommon EGFR Mutations: A Multicenter, Open-Label, Phase II Trial (KCSG-LU15-09). J Clin Oncol. 2020;38(5):488-495. CrossRef PubMed
- 18. Bar J, Kian W, Wolner M, et al. 1206P UNcommon EGFR mutations: International Case series on efficacy of Osimertinib in Real-life practice in first-liNe setting (UNICORN) Annals of Oncology (2021) 32 (suppl_5): S961-S962 CrossRef
- 19. European Respiratory Society (ERS), The economic burden of lung disease in European Lung white book. Online (Accessed October 2021)
- 20. Migliorino MR, Santo A, Romano G, et al. Economic burden of patients affected by non-small cell lung cancer (NSCLC): the LIFE study. J Cancer Res Clin Oncol. 2017;143(5):783-791. CrossRef PubMed
- 21. AIOM.Linee guida neoplasia del polmone. Edizione 2020. Online (Accessed October 2020)
- 22. Rohatgi A. WebPlotDigitizer, Version 4.5. Online
- 23. Baio G. survHE: Survival Analysis for Health Economic Evaluation and Cost-Effectiveness Modeling. J Stat Softw. 2020;95(14):1-47. CrossRef
- 24. Guyot P, Ades AE, Ouwens MJ, Welton NJ. Enhanced secondary analysis of survival data: reconstructing the data from published Kaplan-Meier survival curves. BMC Med Res Methodol. 2012;12(1):9. CrossRef PubMed
- 25. Gideon E. Schwarz, Estimating the dimension of a model. Ann Stat. 1978;6(2):461-464.
- 26. Andreano A, Peake MD, Janes SM, et al. The Care and Outcomes of Older Persons with Lung Cancer in England and the United States, 2008-2012. J Thorac Oncol. 2018;13(7):904-914. CrossRef PubMed
- 27. Gobbini E, Galetta D, Tiseo M, et al; other Co-Authors. Molecular profiling in Italian patients with advanced non-small-cell lung cancer: an observational prospective study. Lung Cancer. 2017;111:30-37. CrossRef PubMed
- 28. Park K, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016;17(5):577-589. CrossRef PubMed
- 29. Soria JC, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer. N Engl J Med. 2018;378(2):113-125. CrossRef PubMed
- 30. Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol. 2017;18(11):1454-1466. CrossRef PubMed
- 31. Yang JC, Schuler M, Popat S, et al. Afatinib for the Treatment of NSCLC Harboring Uncommon EGFR Mutations: A Database of 693 Cases. J Thorac Oncol. 2020;15(5):803-815. CrossRef PubMed
- 32. Zöchbauer-Müller S, Kaserer B, Prosch H, et al. Case Report: Afatinib Treatment in a Patient With NSCLC Harboring a Rare EGFR Exon 20 Mutation. Front Oncol. 2021;10:593852. CrossRef PubMed