 |
Glob Reg Health Technol Assess 2022; 9: 45-57 ISSN 2283-5733 | DOI: 10.33393/grhta.2022.2287 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di costo-utilità di ceftolozano/tazobactam rispetto a meropenem in pazienti con polmonite acquisita in ospedale (HABP) o polmonite associata a ventilazione meccanica (VABP)
Cost-utility analysis of ceftolozane/tazobactam vs meropenem in patients with hospital-acquired pneumonia (HABP) or ventilator-associated pneumonia (VABP)
Objective: This study aims to evaluate the cost-effectiveness of ceftolozane/tazobactam compared to meropenem for the treatment of patients with hospital-acquired pneumonia (HABP) or ventilator-associated pneumonia (VABP) from the Italian National Health Service (NHS) and social perspective.
Method: A decision tree and a Markov model were developed in order to forecast long-term and short-term disease effects respectively. A hypothetical target population of 1,000 HABP/VABP patients was followed for a lifetime time horizon. In the short-term decision tree, two different settings were developed in order to evaluate the value of empirical therapy compared with the start of treatment after confirmation of the antibiogram. Treated and cured patients enter the long-term Markov model following the mortality of the general population. Direct and indirect costs were considered accordingly with the analysis perspective.
Results: The analysis showed that ceftolozane/tazobactam, in both treatment settings (empirical and confirmed), may be a cost-effective option compared to meropenem from the NHS and social perspective (ICER equal to € 1,913 and € 2,203 in the empirical treatment setting and € 6,163 and € 6,597 in the confirmed treatment setting for NHS and social perspective respectively).
Conclusions: Introduction of ceftolozane/tazobactam within the Italian healthcare context can represent a valid therapeutic solution both from an economic and an efficacy profile point of view.
Keywords: Antibiotic-resistance, Antibiotics, Cost-effectiveness analysis, Cost-utility analysis, Nosocomial infections
Received: June 16, 2021
Accepted: February 21, 2022
Published online: April 7, 2022
This article includes supplementary material
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Le polmoniti acquisite in ospedale (HABP) e le polmoniti associate a ventilazione meccanica (VABP) costituiscono un rilevante problema sanitario e hanno un forte impatto dal punto di vista epidemiologico ed economico, specialmente in termini di risorse assorbite nell’ambito del setting ospedaliero.
La gestione delle HABP e delle VABP ad oggi viene gestita attraverso regimi di terapia antibiotica empirico-ragionati come meropenem e piperacillina/tazobactam (1). Inoltre, indipendentemente dalla gravità della condizione patologica, la gestione è attualmente complicata dai problemi correlati all’antibiotico-resistenza. Gli ultimi dati pubblicati a livello nazionale e internazionale da parte dell’Organizzazione Mondiale della Sanità (OMS) e dell’European Centre for Disease Control and Prevention (ECDC) evidenziano come la diffusione delle antibiotico-resistenze, specialmente a livello nosocomiale, costituisca una delle principali minacce alla salute globale del ventunesimo secolo (2).
Oltre all’elevato peso epidemiologico associato alle potenziali resistenze agli antibiotici, occorre considerare anche che le HABP e le VABP sono associate a un elevato tasso di mortalità che oscilla tra il 20% e il 50%. Una recente analisi condotta da Talbot et al., effettuata su sette database di pazienti con polmonite nosocomiale e polmonite associata alla ventilazione meccanica, ha evidenziato come i tassi di mortalità raggiungano il 27,0% nelle VABP, il 21,7% nelle HABP non ventilate e tassi fino al 39,4% nelle VHABP (3).
Si evidenzia inoltre come un ritardo nella somministrazione di una terapia antibiotica appropriata aumenti drasticamente i tassi di mortalità, in particolare nel caso di pazienti affetti da VABP per cui la mortalità raggiunge tassi più elevati in presenza di un trattamento ritardato e/o inappropriato (4).
Oltre all’elevato burden epidemiologico e sociale delle polmoniti, occorre considerare anche il peso economico che esse comportano per i Sistemi Sanitari.
Uno studio condotto in Pennsylvania da Davis et al. su una coorte di 7.896 pazienti (5) evidenzia come, nonostante HABP e VABP abbiano fattori di rischio e complicanze simili, le HABP si presentino con più frequenza (5.597 vs 2.299 casi tra il 2009 e il 2011) e siano per questo associate a un maggiore onere economico ($ 156 milioni vs $ 86 milioni). Tuttavia, il costo medio/paziente è risultato essere superiore nei casi di VABP rispetto ai casi di HABP ($ 37.442 vs $ 28.008).
Un secondo studio condotto tra gennaio 2008 e marzo 2015 da Sun et al., su una coorte di 288.538 pazienti (6), riporta che le HABP/VABP sono associate a elevati costi dovuti alla degenza in terapia intensiva, alle ospedalizzazioni e alla perdita di produttività. Lo studio conferma che i pazienti con VABP presentano costi ospedalieri più elevati (mediana: $ 64.639, IQR: $ 36.979-$ 108.391) e degenze più lunghe (mediana: 21 giorni, IQR: 13-33 giorni) rispetto ai pazienti con HABP, che presentano un costo mediano pari a $ 27.422 (IQR: $ 15.075-$ 52.469) e una degenza ospedaliera con una mediana pari a 14 giorni (IQR: 9-22 giorni). La possibilità di ridurre le giornate di degenza rappresenta un vantaggio anche in termini di costi indiretti. In particolar modo, il paziente è in grado di tornare a lavorare in tempi più rapidi.
Occorre inoltre evidenziare che tale burden tende a crescere in maniera considerevole in caso di terapia antibiotica inappropriata e di infezione da germi multi-resistenti. Esistono infatti altri studi presenti in letteratura che mostrano come in particolare le antibiotico-resistenze generate da patogeni Gram negativi comportino un significativo incremento della durata della degenza e il conseguente aumento dei costi di ospedalizzazione (7).
Questo quadro evidenzia la necessità di investire in ricerca e sviluppo per poter trovare nuove opzioni terapeutiche per il trattamento delle infezioni nosocomiali e in particolare delle polmoniti (HABP e VABP) che restano ad oggi un’importante causa del prolungamento della degenza ospedaliera, con un significativo incremento tanto in termini di costi diretti sostenuti dal SSN quanto di costi indiretti a carico della società.
Da gennaio 2021 è disponibile anche ceftolozano/tazobactam per il trattamento di VABP e HABP. Sulla base dei dati emersi dal trial registrativo ASPECT-NP, l’obiettivo dello studio è stato quello di valutare i costi e gli outcome associati al trattamento con ceftolozano/tazobactam rispetto a meropenem per il trattamento di pazienti con HABP o VABP nel contesto nazionale.
Metodi
È stata sviluppata un’analisi di costo-utilità di ceftolozano/tazobactam per il trattamento di pazienti con HABP o VABP rispetto a meropenem, comparatore di riferimento del trial registrativo ASPECT-NP (8), sia secondo la prospettiva del Servizio Sanitario Nazionale (SSN) nell’ambito del setting ospedaliero sia secondo la prospettiva sociale, dunque considerando anche i costi indiretti. L’analisi è stata condotta simulando il percorso di una coorte teorica di 1.000 pazienti con HABP o VABP. Data l’evoluzione della patologia anche su outcome di lungo periodo, si è deciso di considerare un orizzonte temporale lifetime (40 anni), al fine di poter catturare tutti i costi e i benefici in termini di salute maturati a seguito del trattamento.
Per descrivere al meglio il percorso del paziente e la storia naturale di malattia, l’analisi economica è stata sviluppata attraverso lo sviluppo di due modelli integrati tra loro:
– un modello ad albero decisionale di breve termine;
– un modello di Markov di lungo termine per catturare tutti gli effetti associati anche nel lungo periodo.
In entrambi i modelli sono stati confrontati costi e outcomes per i due diversi trattamenti: ceftolozano/tazobactam e meropenem.
Il modello di Markov è risultato caratterizzato da cicli della durata di un anno; è stata inoltre applicata una correzione di mezzo ciclo al fine di minimizzare una sovrastima (o sottostima) dei QALYs cumulativi che può insorgere quando si considera, invece, che le transizioni si verifichino solo all’inizio (o alla fine) di ciascun ciclo.
Gli outcomes sono stati espressi in termini di anni di vita guadagnati pesati per la qualità di vita (QALYs) mentre i costi imputabili alla patologia oggetto di analisi fanno riferimento all’anno 2019. I risultati sono stati riportati in termini di costo incrementale per QALY guadagnato, sintetizzato nell’Incremental Cost-Effectiveness Ratio (ICER).Il modello è stato sviluppato con Microsoft Office Excel 2017. Sia i costi sia gli outcomes sono stati attualizzati applicando un tasso di sconto del 3%, come da Linee Guida nazionali (9).
Struttura del modello
L’analisi è stata condotta partendo da una simulazione patient level. Il modello, sviluppato su una coorte ipotetica di 1.000 pazienti, risulta alimentato da una selezione random di ceppi isolati dal database Program to Assess Ceftolozane/Tazobactam Susceptibility (PACTS) surveillance, assumendo che ogni patogeno isolato sia associato a un singolo paziente (10).
Con riferimento all’albero decisionale di breve termine sono stati sviluppati due diversi settings, al fine di valutare il valore della terapia empirica rispetto all’avvio del trattamento dopo la conferma dell’antibiogramma in questa specifica casistica di pazienti:
• SCENARIO 1. Setting di trattamento “iniziale” empirico: valuta l’uso di ceftolozano/tazobactam in pazienti ad alto rischio prima che sia noto il profilo di suscettibilità dell’agente patogeno. Questa è un’impostazione comune nella pratica real-life in cui i medici spesso somministrano il trattamento sulla base di un’“ipotesi plausibile” mentre attendono i risultati dei test (durata ipotizzata dall’esecuzione del test pari a 2 giorni). Infatti, in tale setting, i pazienti entrano nel modello al momento della diagnosi di HABP/VABP, concomitante con l’inizio della terapia empirica con ceftolozano/tazobactam, e continuano il trattamento empirico finché i risultati dell’antibiogramma sono disponibili. Una volta confermati i risultati del test, i pazienti con HABP/VABP vengono suddivisi in tre casistiche di trattamento (Fig. 1):
○ Caso 1 – Pazienti con ceppo sensibile a ceftolozano/tazobactam, ma non a un’alternativa meno costosa (o se il medico ha comunque una ragione alternativa per raccomandarne l’uso) rimangono in trattamento con ceftolozano/tazobactam dopo i risultati dei test. I pazienti che rimangono in vita ma non risultano guariti passano a un trattamento di seconda linea.
○ Caso 2 – Pazienti con ceppo sensibile a ceftolozano/tazobactam e a un’alternativa meno costosa iniziano il trattamento con ceftolozano/tazobactam, ma passano a un trattamento più economico dopo i risultati dei test.
○ Caso 3 – Pazienti con ceppo non sensibile a ceftolozano/tazobactam iniziano il trattamento empirico con ceftolozano/tazobactam, ma passano a un trattamento alternativo dopo i risultati del test.
• SCENARIO 2. Setting di trattamento “confermato” dopo i risultati dell’antibiogramma: valuta l’uso di ceftolozano/tazobactam come trattamento di prima linea quando il profilo di suscettibilità dell’agente patogeno è confermato dall’antibiogramma. In seguito al trattamento, i pazienti vengono classificati come “guariti” o “non guariti” o “morti”. I pazienti che non risultano guariti dopo il trattamento di prima linea, ricevono un trattamento di seconda linea sia nel braccio di intervento (ceftolozano/tazobactam) sia in quello del comparatore (Fig. 2).
Per entrambi i settings, il braccio di ceftolozano/tazobactam e quello del comparatore seguono lo stesso percorso all’interno del modello e i trattamenti successivi a cui i pazienti vengono sottoposti in caso di de-escalation/switch dipendono dal profilo di suscettibilità dell’agente patogeno causale.
I pazienti trattati e guariti entrano nel modello di Markov di lungo termine (Fig. 3) seguendo la mortalità generale della popolazione (sulla base di età e sesso). È stato assunto che i pazienti in vita ma non guariti dopo il periodo di trattamento muoiano entro un anno.
Popolazione e dati di suscettibilità
La popolazione oggetto di analisi risulta caratterizzata dai soggetti ricoverati in ospedale di età superiore ai 18 anni con infezione batterica da Gram negativi (HABP/VABP specificamente ventilate). Le caratteristiche generali dei pazienti e i dati di efficacia per i diversi trattamenti sono stati ricavati dal trial ASPECT-NP, uno studio di fase III, in doppio cieco, randomizzato, condotto con l’obiettivo di valutare l’efficacia e la sicurezza di ceftolozano/tazobactam rispetto a meropenem nel trattamento delle infezioni HABP e VABP (8). In particolare, l’analisi del caso base utilizza i dati dello studio clinico ASPECT-NP relativamente alla popolazione microbiologica intent-to-treat (mITT), ovvero la popolazione costituita dai soggetti randomizzati che hanno ricevuto una qualsiasi quantità del farmaco in studio che avevano almeno un patogeno respiratorio batterico isolato dalla coltura basale del tratto respiratorio inferiore (LRT) e che sono risultati suscettibili ad almeno uno dei farmaci in studio. Nella Tabella supplementare A sono riportate le caratteristiche generali della popolazione mITT all’interno dello studio clinico ASPECT-NP. I dati di suscettibilità sono stati ricavati dal programma di sorveglianza antimicrobica SENTRY (PACTS database) Antimicrobial Surveillance Program con riferimento al solo contesto nazionale. Nella Tabella supplementare B è riportata la distribuzione dei patogeni relativamente al campione italiano presente nel database PACTS.
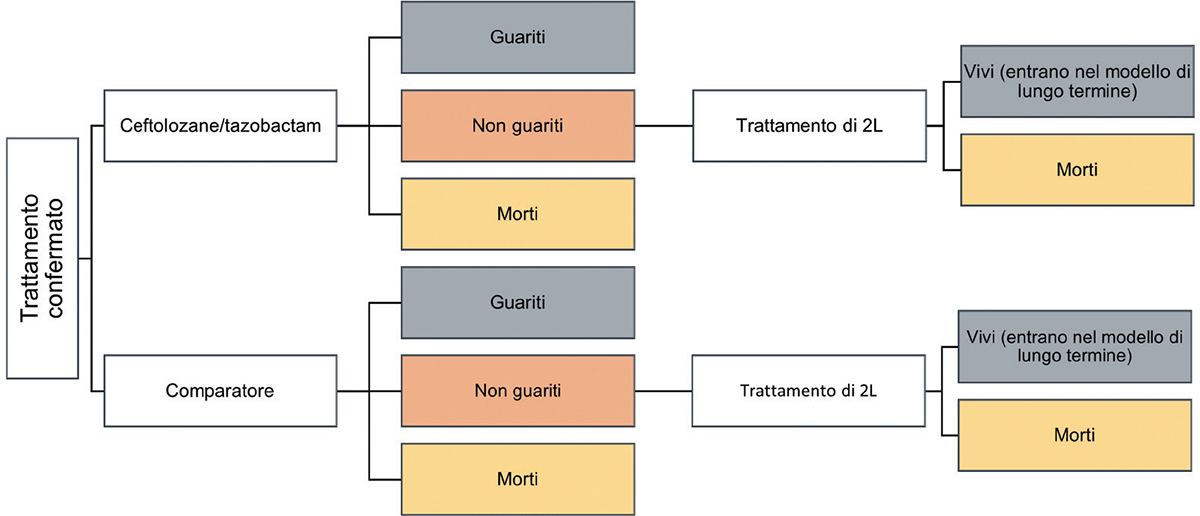
Fig. 1 - Setting di trattamento iniziale: terapia empirica.
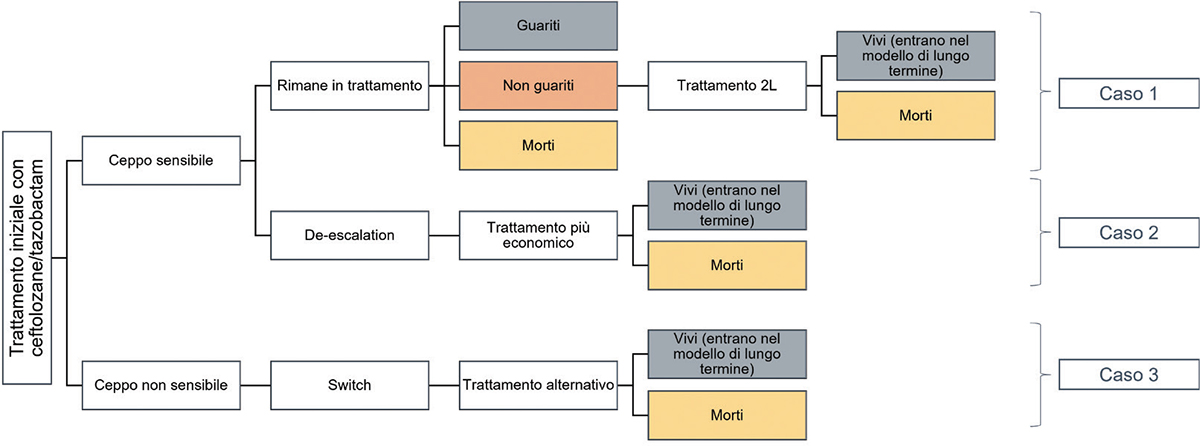
Fig. 2 - Setting di trattamento confermato dopo antibiogramma.
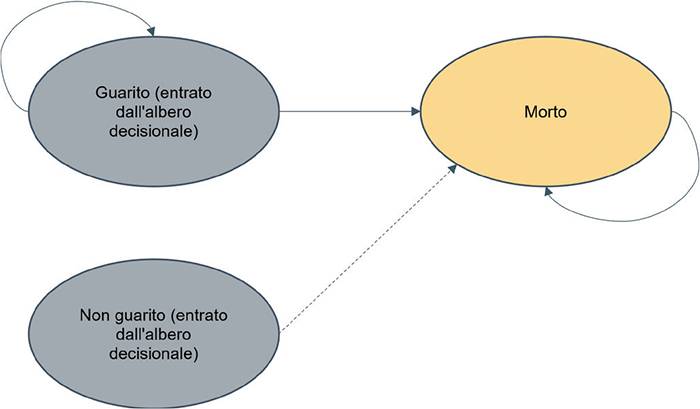
Fig. 3 - Struttura del modello di Markov.
In particolare, partendo dai dati specifici per l’Italia del PACTS database (10), sono stati replicati i profili di suscettibilità della coorte di pazienti inclusa all’interno del modello economico (Tab. I). Il profilo di suscettibilità è stato utilizzato per determinare il percorso del paziente (proporzione suscettibile al trattamento) e la scelta degli eventuali trattamenti successivi.
Efficacia
I dati di efficacia sono stati ricavati dal trial ASPECT-NP, il quale ha valutato il tasso di risposta di ceftolozano/tazobactam e meropenem pari rispettivamente al 60,6% e al 56,7% usando la risposta clinica alla visita TOC (Test-of-cure). Si rimanda alla Tabella supplementare C per ulteriori dettagli.
Si è assunto che, per ognuno dei trattamenti, il tasso di risposta utilizzato nel setting di trattamento iniziale (empirico, scenario 1) fosse lo stesso utilizzato nel setting di trattamento “confermato” (scenario 2). Questo approccio conservativo è stato adottato al fine di utilizzare i dati disponibili nello studio ASPECT-NP.
Il tasso di risposta del trattamento selezionato è stato applicato alla proporzione di pazienti che rimangono nel setting di trattamento “iniziale” empirico per determinare la proporzione di “guariti”, mentre, nel setting di trattamento “confermato”, è stato utilizzato per determinare la proporzione di pazienti guariti dal trattamento di prima linea.
Per quanto riguarda i trattamenti di switch e di de-escalation, i dati di efficacia e i tassi di risposta e di mortalità sono stati ricavati da un’analisi di confronto indiretto (Network Meta Analysis, dati interni MSD).
Il tasso di risposta è stato aggiustato per le linee di trattamento successive alla prima per tenere conto della probabilità che il paziente possa ricevere un trattamento ritardato e/o inappropriato. L’OR (Odds Ratio) applicato al tasso di risposta in questo specifico caso è di 4,55 (11). Ciò implica che la probabilità di una risposta positiva al trattamento per un paziente a cui è stata somministrata una terapia iniziale adeguata è di 4,55 volte superiore rispetto alla probabilità di risposta di un paziente che ha ricevuto un trattamento inizialmente inappropriato.
Dati di mortalità
Per determinare la proporzione di pazienti che rimane in trattamento empirico iniziale, il modello utilizza la mortalità per tutte le cause a 28 giorni riportata nel trial ASPECT-NP (8). I tassi di mortalità per ceftolozano/tazobactam e meropenem sono pari rispettivamente al 20,1% e al 25,5% (Tab. suppl. D).
In linea con quanto riportato per l’efficacia, anche il tasso di mortalità è stato aggiustato per le linee di trattamento successive per tenere conto della probabilità che l’evento di morte sia condizionato da un trattamento ritardato e/o inappropriato. Nel caso base è stato assunto che non vi sia alcun aggiustamento del tasso di mortalità per i pazienti sottoposti al trattamento di seconda linea (OR = 1).
| Dopo l’utilizzo di ceftolozano/tazobactam | Dopo l’utilizzo di meropenem | |||||
|---|---|---|---|---|---|---|
| % utilizzo nella 2a linea | % uso nel trattamento di de-escalation | % uso nel trattamento di switch | % utilizzo nella 2a linea | % uso nel trattamento di de-escalation | % uso nel trattamento di switch | |
| Meropenem | 0,0% | 62,1% | 0,0% | 0,0% | 0,0% | 0,0% |
| Piperacillina/tazobactam | 0,2% | 37,9% | 0,0% | 0,5% | 100,0% | 0,1% |
| Amikacin | 97,5% | 0,0% | 56,7% | 94,6% | 0,0% | 60,4% |
| Colistin | 2,3% | 0,0% | 43,3% | 4,9% | 0,0% | 39,5% |
L’aggiustamento del tasso di mortalità è stato invece applicato ai trattamenti di “switch” nel setting di trattamento empirico (scenario 1) in quanto è stato osservato un aumento del tasso di mortalità per i pazienti che hanno cambiato trattamento poiché non sensibili al trattamento iniziale. L’OR applicato in questo specifico caso è risultato pari a 2,92 (12), il che implica che la probabilità di morte per un paziente che ha ricevuto un trattamento iniziale inappropriato risulta 2,92 volte superiore rispetto alla probabilità di un paziente che ha ricevuto un trattamento inizialmente adeguato. Come per i trattamenti di switch e di de-escalation, anche i dati di mortalità sono stati ricavati da un’analisi di confronto indiretto (Network Meta Analysis, dati interni MSD).
Al termine dell’albero decisionale di breve termine, è stato assunto che i pazienti in vita ma non guariti muoiano entro un anno. I pazienti trattati e guariti entrano nel modello di Markov di lungo termine seguendo la mortalità generale della popolazione (13). Tuttavia, il rischio di mortalità nel lungo periodo, a seguito del trattamento, potrebbe essere influenzato da malattie, comorbidità e immunosoppressione (14). Pertanto, si è ritenuto necessario applicare al tasso di mortalità della popolazione generale, il tasso di mortalità standardizzato (SMR) mediante la seguente formula:
Mortality rate of cured patients = general population mortality x SMR
SMR: tasso di mortalità standardizzato.
Note: SMR = 1 (caso base), i pazienti “guariti” hanno lo stesso tasso di mortalità della popolazione generale; SMR > 1, il tasso di mortalità dei pazienti “guariti” è più alto di quello della popolazione generale.
Utilità
I valori di utilità associati a ciascuno stato di salute sono stati ottenuti dalla letteratura (Tab. II).
Trattandosi di una patologia acuta, nel modello di Markov è stato assunto che, dopo la guarigione, i valori di qualità di vita correlati alla salute (HRQL) dei pazienti tornino allo stesso livello di quelli della popolazione generale. All’interno del modello di Markov, le utilità associate ai pazienti guariti sono state assunte pari alle utilità della popolazione generale per il contesto nazionale ottenute dal lavoro di Scalone et al. 2015 (17) (Tab. suppl. E). I valori delle disutilità associate agli eventi avversi sono stati ottenuti dalla letteratura e da expert opinion (Tab. suppl. F).
| Stato di salute | Utilità | Fonte | Distribuzione |
|---|---|---|---|
| Pazienti sottoposti a ventilazione meccanica | 0,50 | Expert opinion | Beta (0,40; 0,60) |
| Pazienti trattati in terapia intensiva | 0,68 | Whittington et al. 2017 (15) | Beta (0,54; 0,81) |
| Pazienti trattati in degenza ordinaria | 0,73 | Lee et al. 2010 (16) | Beta (0,58; 0,86) |
Parametri di costo
All’interno dell’analisi sono stati considerati sia i costi diretti sia i costi indiretti, questi ultimi intesi in termini di perdita di produttività da parte del paziente a causa della malattia e da parte del caregiver a causa della prestazione di assistenza al paziente.
Costi diretti
Tra i costi diretti sono stati inclusi i costi dei trattamenti, di ospedalizzazione, delle visite specialistiche e di gestione degli eventi avversi.
Per i farmaci sono stati considerati i prezzi ex-factory al netto degli sconti previsti per legge. Tutti i costi provenienti dalla letteratura sono stati attualizzati all’anno 2019 utilizzando l’indice dei prezzi al consumo ove necessario (18). Nella Tabella III sono riportati rispettivamente le formulazioni, i prezzi, la posologia e la durata di ciascun trattamento considerato nell’analisi.
| Farmaco | Confezione
(N. flaconi) |
Dose per flacone | Prezzo ex-factory confezione | Prezzo ex-factory flacone | Dosaggio per somministrazione | Somministrazioni giornaliere | Durata media (giorni) e DS | Fonte durata del trattamento |
|---|---|---|---|---|---|---|---|---|
| Farmaci confrontati | ||||||||
| Ceftolozano/tazobactam | 10 | 1 g/500 mg | 827,31 € | 82,73 € | 2 g/1 g | 3 | 8,00 (3,53) | ASPECT-NP |
| Meropenem | 10 | 500 mg | 64,77 € | 6,48 € | 1.000 mg | 4 | 8,23 (3,61) | ASPECT-NP |
| 10 | 1.000 mg | 119,89 € | 11,99 € | |||||
| Farmaci impiegati in caso di switch/de-escalation | ||||||||
| Piperacillina/tazobactam | 1 | 2 g/250 mg | 3,54 € | 3,54 € | 4 g/0,5 g | 4 | 7,60 (0,76) | Joshi et al. 2006 (19) |
| 1 | 4 g/500 mg | 8,38 € | 8,38 € | |||||
| Amikacin | 10 | 500 mg | 29,94 € | 2,99 € | 5 g/0,5 g | 3 | 5,00 (2,00) | ASPECT-NP |
| 1 | 1.000 mg | 3,67 € | 3,67 € | |||||
| Colistin | 10 | 150 mg | 232,91 € | 23,29 € | 2,50 mg/kg | 3 | 10,50 (1,00) | ASPECT-NP |
Per quanto riguarda il costo delle ospedalizzazioni e delle visite specialistiche, Lucioni et al. (20) forniscono un costo della terapia intensiva pari a € 1.409,60 per giorno, mentre il Libro verde sulla spesa pubblica (21) fornisce un costo della degenza ordinaria pari a € 779,14 per giorno. Il costo giornaliero della ventilazione meccanica pari a € 3.898,75 è stato ottenuto dalla tariffa DRG 565 ricalibrata su base giornaliera (22). Il costo della visita specialistica ambulatoriale è stato ottenuto dal Tariffario Nazionale delle prestazioni di assistenza specialistica e ambulatoriale ed è risultato pari a € 20,66 (23). Nella Tabella IV sono riportati i costi per la gestione degli eventi avversi e le stime di incidenza associate a ciascun evento avverso ottenute dal trial ASPECT-NP (8).
I dati relativi alla durata di degenza in ricovero ordinario, terapia intensiva e con ventilazione meccanica sono stati ricavati dal trial ASPECT-NP (8). Il modello assume che tutti i pazienti inizino il trattamento con la ventilazione meccanica in terapia intensiva; successivamente rimangono in terapia intensiva senza ventilazione e infine vengono spostati nel reparto di degenza ordinaria. Relativamente a ciascun setting assistenziale sono state assunte differenti durate di degenza per pazienti “guariti”, “non guariti” e “deceduti” (Tab. suppl. G). In assenza di dati alternativi disponibili, per i farmaci impiegati nella seconda linea di trattamento (de-escalation/switch) è stata assunta la stessa durata di degenza associata a meropenem.
Nel setting di trattamento empirico (scenario 1), la durata di degenza è maggiore nel caso di pazienti che ricevono un trattamento di seconda linea o che passano a un altro trattamento a seguito del fallimento della terapia empirica (caso 3, switch). Nella Tabella supplementare H si riporta l’aumento della durata di degenza dovuto a una terapia iniziale inappropriata o a un’aggiuntiva linea di trattamento.
| Evento avverso | Costo | Incidenza (studio clinico ASPECT-NP) | |||||
|---|---|---|---|---|---|---|---|
| Valore (€) | Distribuzione | Fonte | Ceftolozano/
tazobactam |
Distribuzione | Meropenem | Distribuzione | |
| Anemia | 1.676,00 € | Normal (1.719,4; 171,9) | DRG 395 (22) | 8,86% | Beta (0,06; 0,12) | 10,58% | Beta (0,08; 0,14) |
| Diarrea | 959,00 € | Normal (983,9; 98,4) | DRG 183 (22) | 6,37% | Beta (0,04; 0,09) | 6,96% | Beta (0,05; 0,10) |
| Infezioni del tratto urinario | 1.883,00 € | Normal (1.931,8; 193,2) | DRG 321 (22) | 6,65% | Beta (0,04; 0,09) | 6,96% | Beta (0,05; 0,10) |
| Aumento dell’alanina aminotransferasi | 1.748,00 € | Normal (1.793,3; 179,3) | DRG 464 (22) | 5,82% | Beta (0,04; 0,08) | 3,90% | Beta (0,02; 0,06) |
| Aumento dell’aspartato aminotransferasi | 1.748,00 € | Normal (1.793,3; 179,3) | DRG 464 (22) | 5,26% | Beta (0,03; 0,08) | 3,90% | Beta (0,02; 0,06) |
| Idrotorace | 2.867,00 € | Normal (2.941,3; 294,1) | DRG 086 (22) | 4,43% | Beta (0,03; 0,07) | 5,57% | Beta (0,03; 0,08) |
| Ulcera da decubito | 457,00 € | Normal (468,8; 46,9) | DRG 470 (22) | 6,93% | Beta (0,05; 0,10) | 4,74% | Beta (0,03; 0,07) |
| Ipotensione | 2.097,00 € | Normal (2.151,4; 215,1) | DRG 145 (22) | 4,16% | Beta (0,02; 0,06) | 5,01% | Beta (0,03; 0,07) |
| Bradicardia | 974,00 € | Normal (999,2; 99,9) | DRG 139 (22) | 0,28% | Beta (0,00; 0,01) | 0,00% | Beta (0,00; 0,00) |
| Ileo | 1.732,00 € | Normal (1.776,9; 177,7) | DRG 181 (22) | 0,28% | Beta (0,00; 0,01) | 0,00% | Beta (0,00; 0,00) |
| Epatite colestatica | 4.013,00 € | Normal (4.117,0; 411,7) | DRG 202 (22) | 0,28% | Beta (0,00; 0,01) | 0,28% | Beta (0,00; 0,01) |
| Colite da clostridium difficile | 959,00 € | Normal (983,9; 98,4) | DRG 183 (22) | 0,55% | Beta (0,00; 0,02) | 0,00% | Beta (0,00; 0,00) |
| Infezione da clostridium difficile | 959,00 € | Normal (983,9; 98,4) | DRG 183 (22) | 0,00% | Beta (0,00; 0,00) | 0,28% | Beta (0,00; 0,01) |
| Enteremia batterica | 959,00 € | Normal (983,9; 98,4) | DRG 183 (22) | 0,28% | Beta (0,00; 0,01) | 0,00% | Beta (0,00; 0,00) |
| Encefalopatia settica | 2.549,00 € | Normal (2.615,1, 261,5) | DRG 017 (22) | 0,28% | Beta (0,00; 0,01) | 0,00% | Beta (0,00; 0,00) |
| Nefrotossicità | 5.493,00 € | Normal (5.493; 549,3) | DRG 576 (22) | 0,00% | Beta (0,00;0,00) | 0,00% | Beta (0,00;0,00) |
Costi indiretti
Al fine di ottenere risultati nella prospettiva sociale, sono stati inclusi nel modello i costi indiretti. È stato impiegato il Metodo del Capitale Umano (o Human Capital Approach): ciò equivale a misurare la mancata produttività, di un paziente o di un caregiver, in termini di deficit di guadagni dovuti alla perdita di produzione causata dalla malattia.
Nella Tabella V sono riportati i parametri impiegati per la stima dei costi indiretti.
Analisi di sensibilità
Per valutare la robustezza dei risultati del caso base, sono state condotte due tipologie di analisi di sensibilità, vale a dire un’analisi di sensibilità deterministica (DSA) e un’analisi di sensibilità probabilistica (PSA). La prima consiste nel far variare un parametro di interesse per volta, in modo da valutare come i singoli parametri di interesse vadano a influenzare i risultati del caso base. In questo caso sono stati fatti variare diversi parametri in base alla variabilità emersa dalla letteratura, laddove disponibile, oppure assumendo una variabilità del 10%. Nell’analisi di sensitività deterministica è stato considerato anche l’orizzonte temporale, assumendo una variabilità di ±10 anni. La seconda analisi consiste nel far variare in modo simultaneo tutti i parametri critici inseriti nel modello secondo una determinata distribuzione di probabilità. La PSA è stata condotta generando 1.000 simulazioni Monte Carlo. Tali simulazioni hanno permesso di generare la curva di accettabilità di costo-efficacia (CEAC) di ceftolozano/tazobactam rispetto a meropenem. La soglia di disponibilità a pagare considerata per la valutazione della costo-efficacia di ceftolozano/tazobactam è risultata compresa in un range tra € 25.000 ed € 40.000 come da Linee Guida AIES (9).
Risultati
Risultati nel setting di trattamento empirico – SCENARIO 1
In questo scenario viene valutato l’uso di ceftolozano/tazobactam su pazienti ad alto rischio prima che sia noto il profilo di suscettibilità dell’agente patogeno. Questa è un’impostazione comune nella pratica real-life in cui i medici spesso somministrano il trattamento sulla base di un’“ipotesi plausibile” mentre attendono i risultati dei test (durata ipotizzata dall’esecuzione del test pari a 2 giorni). L’analisi condotta nel setting di trattamento empirico mostra come cetfolozano/tazobactam risulti costo-efficace rispetto a meropenem sia nella prospettiva del SSN sia nella prospettiva sociale (Tab. VI). A fronte di un investimento incrementale rispettivamente pari a circa € 1,5 milioni e pari a circa € 1,7 milioni per 1.000 pazienti trattati, l’utilizzo di ceftolozano/tazobactam comporterebbe un incremento di circa 767 QALYs. Gli ICER per QALY corrispondenti sono risultati pari a € 1.913 e pari a € 2.203 rispettivamente nella prospettiva del SSN e nella prospettiva sociale.
| Ore di lavoro e salario medio | Stima | Fonte |
| Tasso di occupazione | 59% | ISTAT (24) |
| Salario medio giornaliero | € 118,69 | € 30.028 Salario medio annuale nel 2019 in Italia OECD (25) considerando 253 giorni lavorativi |
| Numero medio di ore lavorative (al giorno) | 6,75 | 37,1 Media delle ore lavorative settimanali nei principali lavori nel 2019 in Italia. OECD (25)
Ipotesi: 5,5 giorni di lavoro a settimana |
| Salario medio per ora | € 17,60 | Elaborazione |
| Assenteismo del paziente e del caregiver durante il ricovero | Stima | Fonte |
| Ore di lavoro perse dal paziente | 6,75 | Si presume che i pazienti perdano tutte le ore lavorative durante il ricovero |
| Ore di lavoro perse dall’assistente | 6,75 | Si presume che gli assistenti perdano tutte le ore lavorative durante il ricovero |
| % di pazienti con un assistente durante il ricovero | 100% | Expert opinion |
| Assenteismo del paziente e del caregiver per visita ambulatoriale dopo la dimissione | Stima | Fonte |
| Ore di lavoro perse dal paziente | 3,00 | Expert opinion |
| Ore di lavoro perse dall’assistente | 3,00 | Expert opinion |
| % di pazienti con un accompagnatore per visita ambulatoriale dopo la dimissione | 50% | Expert opinion |
| Trattamento | Costi totali | QALYs totali | Costi incrementali | QALYs incrementali | ICER per QALY |
|---|---|---|---|---|---|
| Prospettiva SSN | |||||
| Meropenem | € 86.889.748,8 | 7.862,4 | |||
| Ceftolozano/tazobactam | € 88.356.678,1 | 8.629,2 | € 1.466.929,3 | 766,9 | € 1.912,8 |
| Prospettiva sociale | |||||
| Meropenem | € 91.315.456,1 | 7.862,4 | |||
| Ceftolozano/tazobactam | € 93.004.568,7 | 8.629,2 | € 1.689.112,6 | 766,9 | € 2.202,6 |
Note: ICER = Incremental Cost-Effectiveness Ratio; QALYs = Quality-Adjusted Life Years.
Dall’analisi deterministica è emerso come il parametro che maggiormente è risultato impattare sui risultati sia caratterizzato dalle giornate in cui il paziente è sottoposto alla ventilazione meccanica (Fig. 4, 5).
La PSA ha confermato la robustezza dei risultati. In circa il 49% e il 48% delle simulazioni effettuate, considerando rispettivamente la prospettiva del SSN e la prospettiva sociale, l’opzione di trattamento con ceftolozano/tazobactam è risultata dominante, dunque meno costosa e più efficace rispetto a meropenem (Fig. 6, 7).
Risultati dell’analisi di costo-utilità nel setting di trattamento confermato (SCENARIO 2)
In questo secondo scenario, l’analisi ha fatto emergere come ceftolozano/tazobactam nel setting di trattamento confermato possa risultare un’opzione di trattamento costo-efficace rispetto a meropenem sia secondo la prospettiva del SSN sia secondo la prospettiva sociale in quanto genererebbe, a fronte di un investimento incrementale rispettivamente pari a € 4,3 milioni e € 4,6 milioni per 1.000 pazienti trattati, un incremento di circa 693 QALYs. Gli ICER per QALY corrispondenti sono risultati pari a € 6.163 e pari a € 6.597 rispettivamente nella prospettiva del SSN e nella prospettiva sociale (Tab. VII).
L’analisi di sensibilità deterministica ha mostrato come, anche in questo caso, il parametro che maggiormente risulta impattare sui risultati sia caratterizzato dalle giornate in cui il paziente è sottoposto alla ventilazione meccanica (Fig. 8, 9).
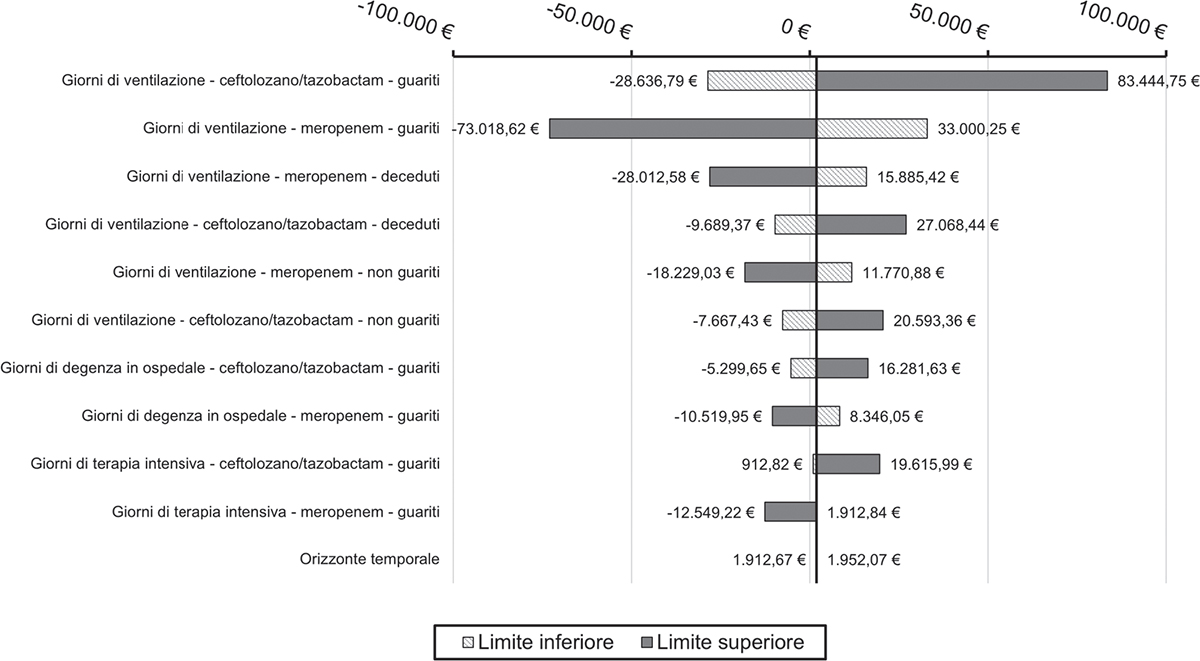
Fig. 4 - Grafico a tornado setting di trattamento empirico (prospettiva SSN).
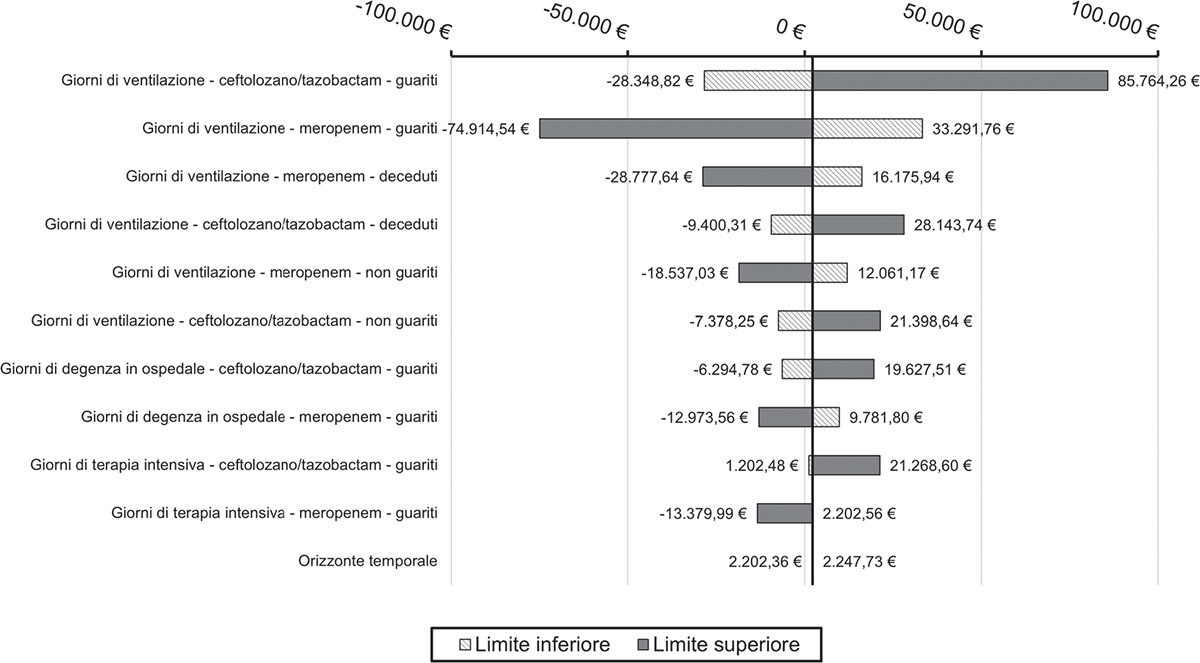
Fig. 5 - Grafico a tornado setting di trattamento empirico (prospettiva sociale).
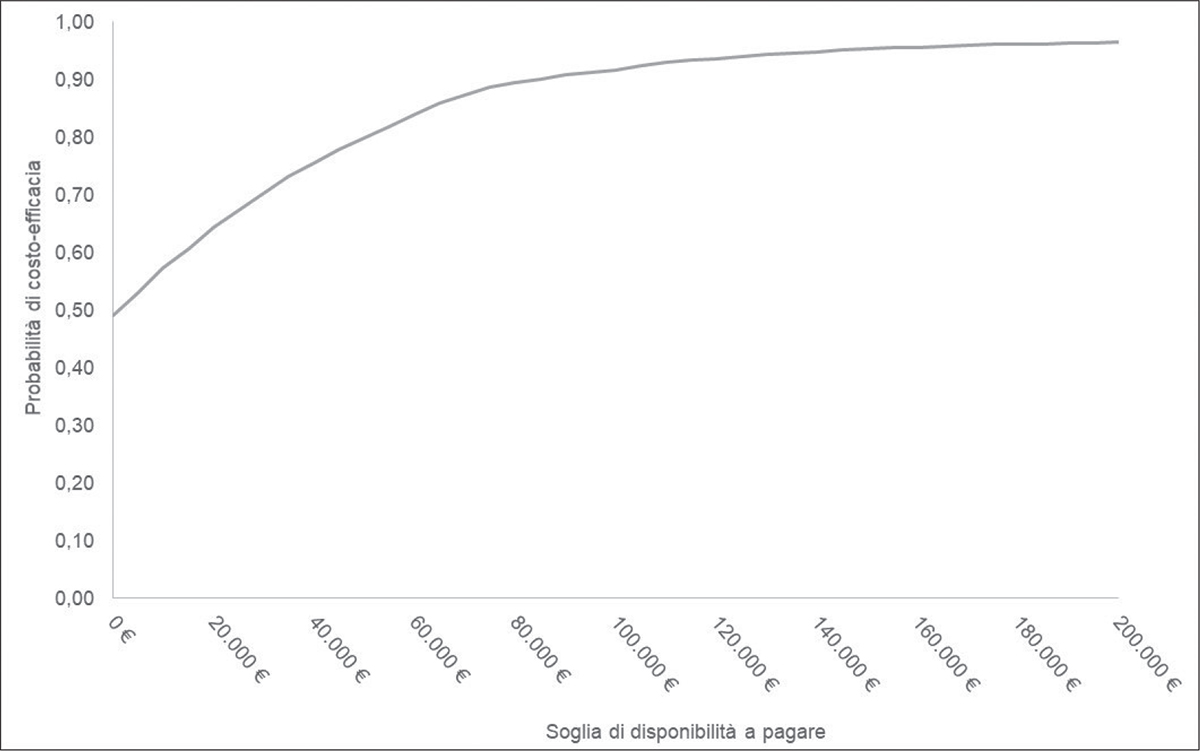
Fig. 6 - CEAC per ceftolozano/tazobactam nel setting di trattamento empirico (prospettiva SSN).
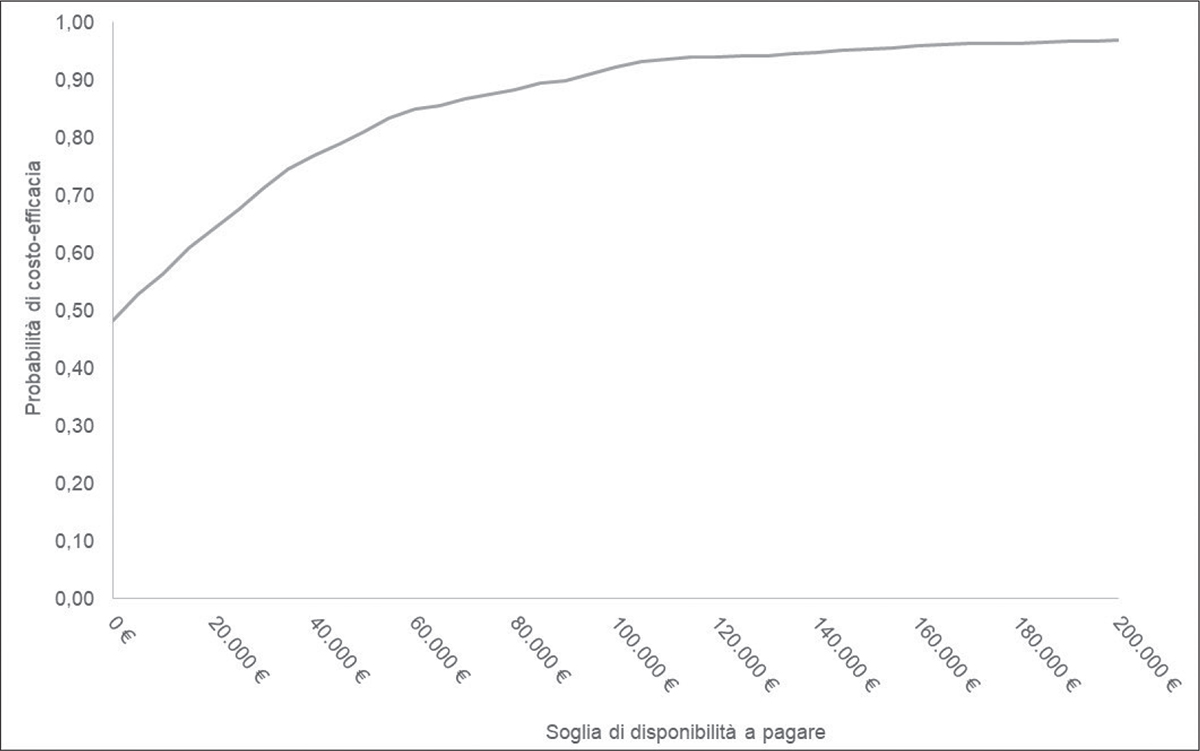
Fig. 7 - CEAC per ceftolozano/tazobactam nel setting di trattamento empirico (prospettiva sociale).
| Trattamento | Costi totali | QALYs totali | Costi incrementali | QALYs incrementali | ICER per QALY |
|---|---|---|---|---|---|
| Prospettiva SSN | |||||
| Meropenem | € 75.094.770,1 | 9.672,7 | |||
| Ceftolozano/tazobactam | € 79.366.569,1 | 10.365,8 | € 4.271.799,0 | 693,1 | € 6.163,1 |
| Prospettiva sociale | |||||
| Meropenem | € 79.021.740,9 | 9.672,7 | |||
| Ceftolozano/tazobactam | € 83.594.436,7 | 10.365,8 | € 4.572.695,8 | 693,1 | € 6.597,2 |
Note: ICER = Incremental Cost-Effectiveness Ratio; QALYs = Quality-Adjusted Life Years.
La PSA ha confermato la robustezza dei risultati del caso base. In circa il 42% e il 46% delle simulazioni effettuate, rispettivamente per la prospettiva del SSN e sociale, il trattamento con ceftolozano/tazobactam è risultato essere dominante rispetto a meropenem, dunque meno costoso e più efficace (Fig. 10, 11).
Conclusioni
Alla luce dei risultati emersi dall’analisi, è possibile notare come l’introduzione di ceftolozano/tazobactam all’interno del contesto sanitario italiano possa rappresentare una soluzione terapeutica valida sia sotto il profilo economico sia sotto il profilo di efficacia. Infatti, dall’analisi economica è emerso come ceftolozano/tazobactam rispetto a meropenem possa rappresentare un’alternativa costo-efficace sia nel setting di trattamento empirico (ICER: € 1.913/QALY nella prospettiva del SSN ed € 2.203/QALY nella prospettiva sociale) sia nel setting di trattamento confermato (ICER: € 6.163/QALY nella prospettiva del SSN ed € 6.597/QALY nella prospettiva sociale) in entrambe le prospettive di analisi.
In particolare, l’impiego di ceftolozano/tazobactam, nell’ambito della coorte ipotetica di 1.000 pazienti inclusa nell’analisi è risultato costo-efficace nel setting di trattamento empirico in quanto genererebbe, a fronte di un investimento incrementale pari a € 1,5 milioni e a € 1,7 rispettivamente per prospettiva del SSN e prospettiva sociale, un incremento di circa 767 QALYs. Con riferimento al setting di trattamento confermato, su pazienti ad alto rischio, l’opzione di trattamento ceftolozano/tazobactam è risultata essere costo-efficace rispetto a meropenem in quanto potrebbe generare, a fronte di un investimento incrementale pari a € 4,3 milioni e a € 4,6 rispettivamente per la prospettiva del SSN e la prospettiva sociale per 1.000 pazienti trattati, un incremento di circa 693 QALYs.
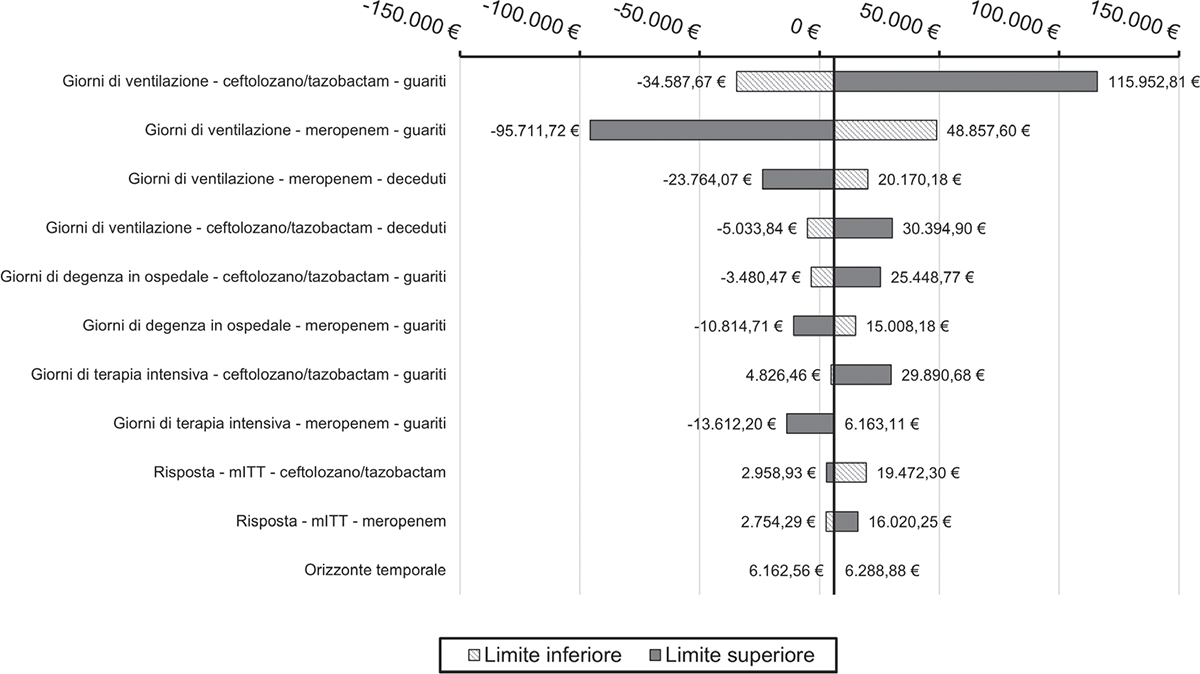
Fig. 8 - Grafico a tornado setting di trattamento confermato (prospettiva SSN).
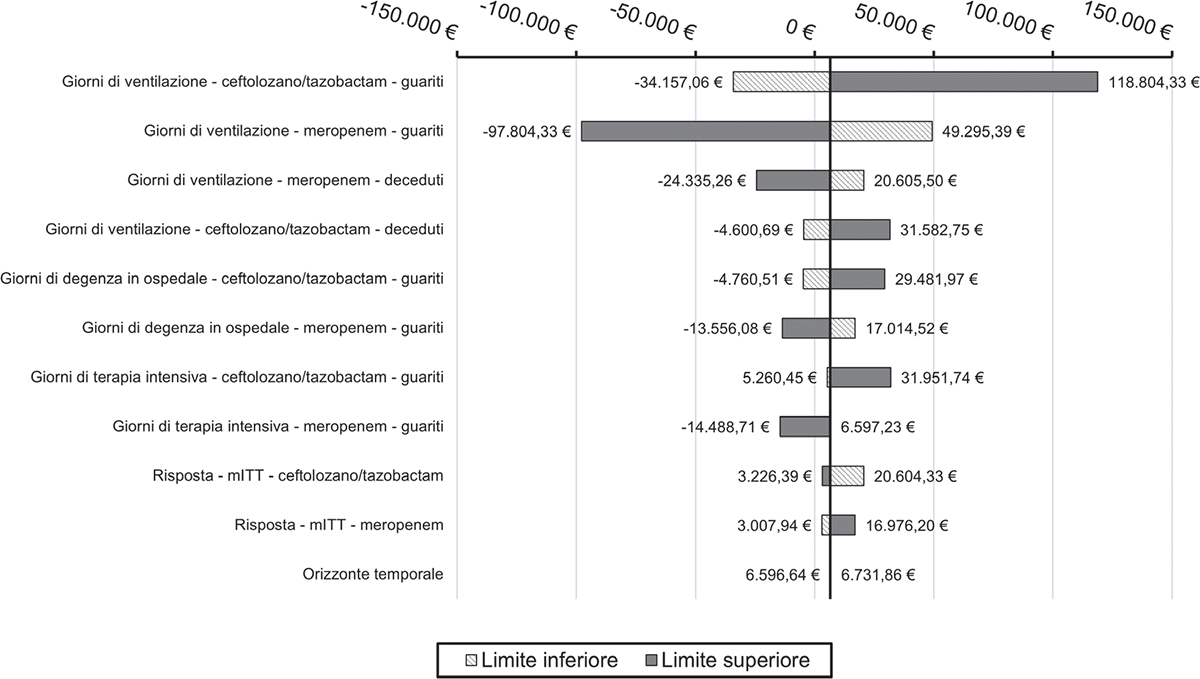
Fig. 9 - Grafico a tornado setting di trattamento confermato (prospettiva sociale).
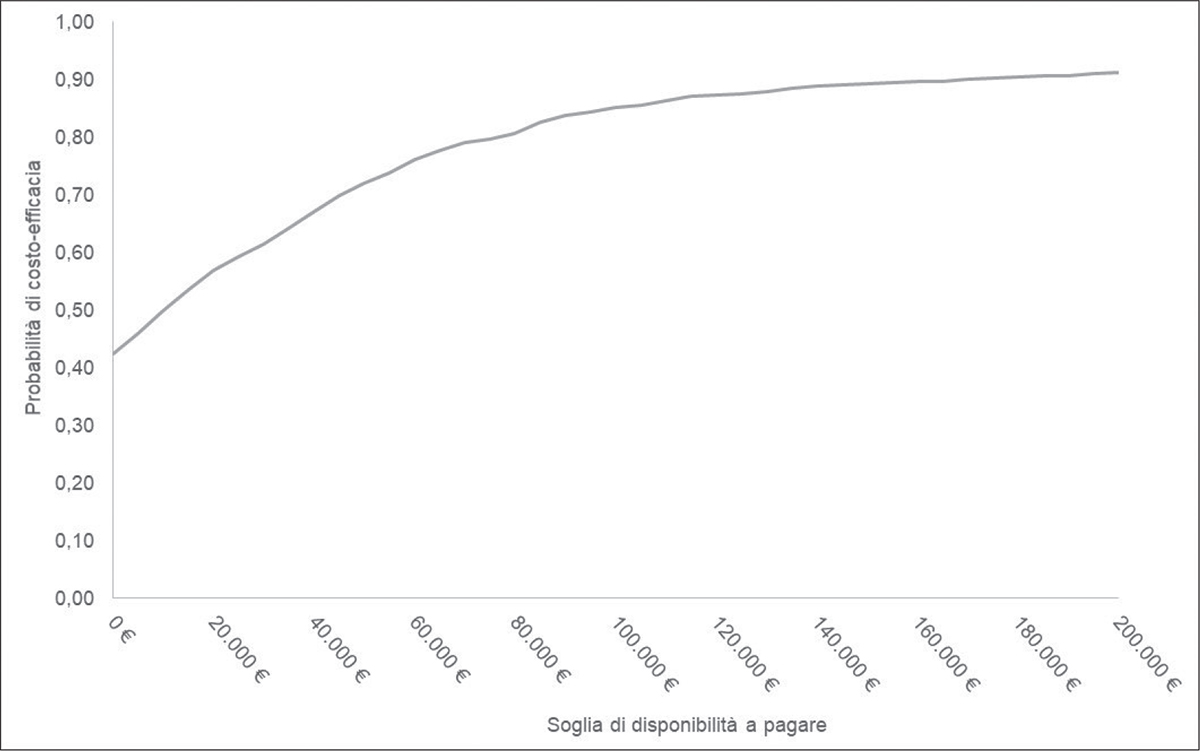
Fig. 10 - CEAC per ceftolozano/tazobactam nel setting di trattamento confermato (prospettiva SSN).
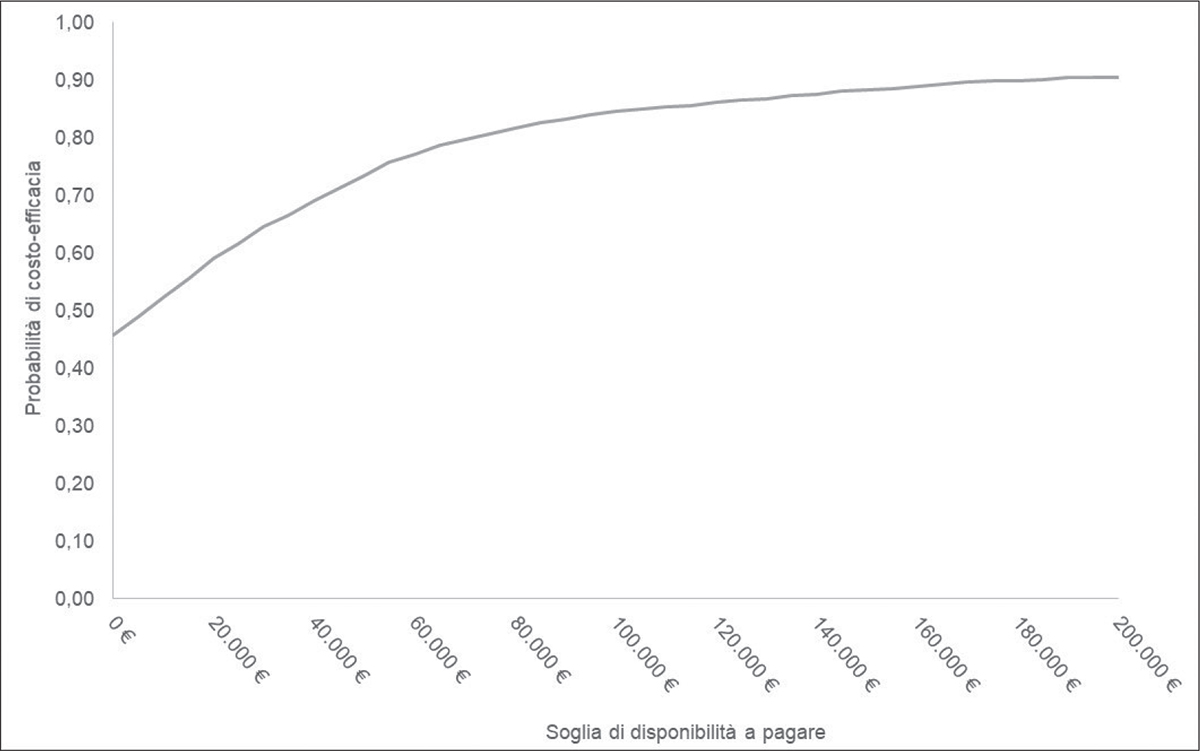
Fig. 11 - CEAC per ceftolozano/tazobactam nel setting di trattamento confermato (prospettiva sociale).
In entrambi gli scenari e le prospettive di analisi il parametro relativo ai giorni di ventilazione meccanica ha avuto il maggiore impatto sui risultati. Anche i giorni di terapia intensiva e di degenza in ospedale sono tra i parametri più influenti. L’importanza di questi parametri era prevedibile, poiché il numero di giorni in ospedale incide direttamente sui costi di utilizzo di risorse nel breve termine, vale a dire il periodo in cui viene sostenuta la maggior parte della spesa sanitaria per la cura del paziente. Confrontando i due scenari di analisi riportati sopra, si evince come l’impiego precoce di ceftolozano/tazobactam nei pazienti affetti da HABP/VABP possa generare un valore significativo sia per il SSN sia per la società, dunque un minore impiego di risorse sanitarie e un maggior numero di vite salvate (-54 decessi per 1.000 pazienti trattati in un anno per lo scenario empirico e -48 decessi per 1.000 pazienti trattati in un anno per lo scenario confermato) e di pazienti in buona salute. Occorre a tal proposito evidenziare come tali aspetti, specialmente in termini di riduzione della mortalità, siano fondamentali nel momento della scelta della terapia antibiotica iniziale più appropriata per questa particolare tipologia di pazienti che, se non trattati tempestivamente con antibiotici appropriati, presentano un elevato rischio di decesso (26).
I risultati di questa analisi sono confrontabili con quanto già presentato in un altro studio condotto secondo la prospettiva del sistema sanitario statunitense (27). Nonostante le differenze nei contesti di trattamento tra gli Stati Uniti e l’Italia, ceftolozano/tazobactam rimane costo-efficace rispetto a meropenem. Nello specifico, in entrambi gli scenari (empirico e confermato), l’ICER era inferiore alla disponibilità a pagare e lo scenario empirico è risultato più vantaggioso rispetto allo scenario confermato.
Come ogni approccio modellistico, questo lavoro presenta delle limitazioni. In primo luogo, le analisi di simulazione dell’efficacia sono basate sui dati provenienti da trial registrativi che hanno l’evidente limite di non rappresentare necessariamente quanto ottenibile nella real-practice nazionale. Tuttavia, non esistono ad oggi dati real-world sull’efficacia di ceftolozano/tazobactam né tantomeno dati nazionali sugli aspetti della qualità di vita dei pazienti italiani per la stima dei QALYs. Di conseguenza, l’approccio basato sull’efficacia teorica dei farmaci analizzati sulla storia naturale di malattia rappresenta l’unica alternativa in grado di fornire informazioni ed evidenze adeguate per la valutazione della costo-efficacia dei farmaci considerati rispetto all’attuale standard of care italiano.
Un secondo limite riguarda la popolazione considerata nell’analisi di costo-efficacia. Infatti, il trial registrativo ASPECT-NP comprende solo pazienti gravi in ventilazione meccanica. Pertanto, i risultati potrebbero non essere generalizzabili ai pazienti HABP/VABP in generale, in particolare ai pazienti HABP non ventilati. Per questa analisi si è tentato di tenere in considerazione l’incertezza relativa a questo aspetto attraverso le analisi di sensibilità probabilistica e deterministica. Un ultimo limite riguarda la stima dei costi associati agli stati di malattia e agli eventi avversi. Al fine di effettuare un adattamento al contesto nazionale, sono state utilizzate le tariffe nazionali associate alle giornate di ospedalizzazioni e prestazioni ambulatoriali. Nella realtà, le tariffe considerate rappresentano solo un proxy dei reali costi sostenuti dai sistemi sanitari regionali e sono eterogenee tra le differenti regioni.
Tali risultati vanno letti anche considerando l’allarmante e progressiva crescita del fenomeno delle antibiotico-resistenze che non ha un impatto in termini solo epidemiologici, ma anche sociali ed economici. A tal proposito, per ovviare alla crescita ulteriore di tale fenomeno, è stato messo in luce, a livello globale attraverso la diffusione del Piano d’Azione per la lotta alla resistenza antimicrobica (AMR) dell’OMS e a livello nazionale dal recente Piano Nazionale di Contrasto dell’Antimicrobico-Resistenza 2017-2020 (PiNCAR), come uno dei principali ambiti di intervento sia rappresentato dalla ricerca di nuove opportunità terapeutiche. Infatti, l’introduzione di nuove terapie antibiotiche rappresenta un valido strumento di sanità pubblica, in un’ottica di “antibiotic stewardship”, per la prevenzione dell’aumento dei casi di antibiotico-resistenza e dei decessi correlati che, si stima, tenderanno a crescere in maniera drastica attestandosi intorno a circa 10 milioni di decessi attesi nel 2050 (28).
In quest’ottica, l’introduzione di ceftolozano/tazobactam, per il trattamento delle HABP e delle VABP nell’ambito del panorama sanitario nazionale, appare una soluzione fondamentale per la lotta alle AMR, configurandosi, nel breve periodo, come una terapia costo-efficace e cost-saving per il SSN e, nel lungo periodo, come valido alleato per la prevenzione e il controllo delle AMR secondo l’approccio One Health promosso dall’OMS in un’ottica di sanità pubblica, in quanto consentirebbe potenzialmente di ridurre il fenomeno dell’AMR nel lungo periodo secondo una strategia carbapenem-sparing.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research was performed with the unconditional financial support from MSD Italia S.r.l.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Regione autonoma Friuli Venezia Giulia. Linee Guida Regionali per la Gestione delle Polmoniti Batteriche. Online (Accessed June 2021)
- 2. Ten threats to global health in 2019. Online
- 3. Talbot GH, Das A, Cush S, et al; Foundation for the National Institutes of Health Biomarkers Consortium HABP/VABP Project Team. Evidence-Based Study Design for Hospital-Acquired Bacterial Pneumonia and Ventilator-Associated Bacterial Pneumonia. J Infect Dis. 2019;219(10):1536-1544. CrossRef PubMed
- 4. Inchai J, Pothirat C, Liwsrisakun C, Deesomchok A, Kositsakulchai W, Chalermpanchai N. Ventilator-associated pneumonia: epidemiology and prognostic indicators of 30-day mortality. Jpn J Infect Dis. 2015;68(3):181-186. CrossRef PubMed
- 5. Davis J, Finley E. The breadth of Hospital-Acquired Pneumonia: Nonventilated versus Ventilated Patients in Pennsylvania. Pa Patient Saf Advis. 2012;9(3):99-105.
- 6. Sun D, Moorthy V, Chang S-C, et al. Economic Burden of Ventilator-Associated, Hospital-Acquired, Healthcare-Associated and Community-Acquired Pneumonia in the Hospital Setting. Open Forum Infect Dis. 2016;3(suppl 1):1494. Accessed June, 2021. CrossRef
- 7. De Angelis G, et al. Burden of Antibiotic Resistant Gram Negative Bacterial Infections: evidence and Limits. J Med Microbiol Diagn. 2014;3:1-6.
- 8. Cubist Pharmaceuticals LLC. A prospective, randomized, double-blind, multicenter, Phase 3 study to assess the safety and efficacy of intravenous ceftolozano/tazobactam compared with meropenem in adult patients with Ventilated Nosocomial Pneumonia. (Clinical Study Report: P008MK7625A) 17 October 2018.
- 9. Fattore G. Proposta di Linee-Guida per la valutazione economica degli interventi sanitari. PharmacoEcon Ital Res Artic. 2009;11(2):83-93. CrossRef
- 10. Merck & Co. Inc. Program to Assess Ceftolozano/Tazobactam Susceptibility (PACTS) database. 2019.
- 11. Raman G, Avendano E, Berger S, Menon V. Appropriate initial antibiotic therapy in hospitalized patients with gram-negative infections: systematic review and meta-analysis. BMC Infect Dis. 2015;15(1):395. CrossRef PubMed
- 12. Siempos II, Vardakas KZ, Kyriakopoulos CE, Ntaidou TK, Falagas ME. Predictors of mortality in adult patients with ventilator-associated pneumonia: a meta-analysis. Shock. 2010;33(6):590-601. CrossRef PubMed
- 13. ISTAT. 2017; Online (Accessed June 2021)
- 14. Merck & Co. Inc. IMI/REL model specification validation interviews. June–October 2017.
- 15. Whittington MD, Atherly AJ, Curtis DJ, Lindrooth RC, Bradley CJ, Campbell JD. Recommendations for Methicillin-Resistant Staphylococcus aureus Prevention in Adult ICUs: A Cost-Effectiveness Analysis. Crit Care Med. 2017;45(8):1304-1310. CrossRef PubMed
- 16. Lee BY, Wiringa AE, Bailey RR, et al. The economic effect of screening orthopedic surgery patients preoperatively for methicillin-resistant Staphylococcus aureus. Infect Control Hosp Epidemiol. 2010;31(11):1130-1138. CrossRef PubMed
- 17. Scalone L, Cortesi P, Ciampichini R et al. Health related quality of life norm data of the general population in Italy: results using the EQ-5D-3L and EQ-5D-5L instruments. Epidemiol Biostat Public Health. 2015; 12(3): e11457. CrossRef
- 18. ISTAT. Indice dei prezzi al consumo per famiglie, operai ed impiegati. Online (Accessed June 2021)
- 19. Joshi M, Metzler M, McCarthy M, Olvey S, Kassira W, Cooper A. Comparison of piperacillin/tazobactam and imipenem/cilastatin, both in combination with tobramycin, administered every 6 h for treatment of nosocomial pneumonia. Respir Med. 2006;100(9):1554-1565. CrossRef PubMed
- 20. Lucioni et al., Farmeconomia e percorsi terapeutici. 2001. 2(3).
- 21. Ministero dell’Economia e delle Finanze. Libro verde sulla spesa pubblica. Online (Accessed June 2021)
- 22. Tariffario nazionale. Remunerazione delle prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. 2013 Online (Accessed June 2021)
- 23. Tariffario delle prestazioni di assistenza specialistica ed ambulatoriale. Online (Accessed June 2021)
- 24. ISTAT. Tasso di occupazione 2019. Online (Accessed June 2021)
- 25. OECD. Average annual wages. Online (Accessed June 2021)
- 26. Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61-e111. CrossRef PubMed
- 27. Naik J, Puzniak L, Critchlow S, Elsea D, Dillon RJ, Yang J. Cost Effectiveness of Ceftolozane/Tazobactam Compared with Meropenem for the Treatment of Patients with Ventilated Hospital-Acquired Bacterial Pneumonia and Ventilator-Associated Bacterial Pneumonia. Infect Dis Ther. 2021;10(2):939-954. CrossRef PubMed
- 28. O’Neill J. Wellcome Trust and UK Government. Tackling Drug-Resistant Infections Globally: final report and recommendations. Maggio; 2016.