 |
Glob Reg Health Technol Assess 2021; 8: 147-154 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2279 ORIGINAL RESEARCH ARTICLE |
 |
Valutazione delle conseguenze epidemiologiche ed economiche generate dal ritardo di trattamento dei pazienti HIV-positivi causato dalla pandemia COVID-19
Evaluation of epidemiological and economic consequences due to the delay in treatment of hiv-positive patients caused by the covid-19 pandemic
Objective: To assess, from an epidemiological and economic point of view, the consequences of the reduction in the supply of antiretroviral drugs due to the COVID-19 pandemic.
Method: The analysis was conducted by adapting a Markov model previously published in literature. The simulations were conducted considering the possibility of continuous treatment for patients already diagnosed (no therapeutic interruptions are expected) and an immediate start of patients with new diagnosis during 2021. This analysis was compared with a scenario involving a therapeutic interruption or diagnostic delay caused by COVID-19.
Results: The analysis showed that the scenario characterized by a treatment delay, compared to the scenario of early resumption of therapy, could generate an increase in the number of patients with CD4 < 200 equal to 1,719 subjects (+16%) and a reduction in the number of patients with CD4 500 equal to 6,751 (−9%). A timely resumption of treatment for HIV+ patients could prevent 296, 454 and 687 deaths in the third, fifth and tenth years of analysis respectively with a potential cost reduction equal to 78,9 million at a 10 year time horizon.
Conclusions: These findings show that it is essential, especially in a pandemic situation such as the present one, to introduce technological, digital and organizational solutions, aimed at promoting timely diagnosis and at accelerating the therapeutic switch for patients who are no longer targeted.
Keywords: Acquired Immunodeficiency Syndrome Virus, Coronavirus Disease, COVID-19 Pandemic, Human Immunodeficiency Virus
Received: May 11, 2021
Accepted: August 30, 2021
Published online: October 25, 2021
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
I dati riportati dal Programma delle Nazioni Unite per l’AIDS/HIV (Joint United Nations Programme on HIV/AIDS – UNAIDS) per il 2019 riferiscono che dei 38,0 milioni di persone che vivono con l’infezione da HIV, 36,2 milioni sono adulti e 1,8 milioni sono bambini di meno di 15 anni (1).
Tuttavia, un’ampia percentuale della popolazione infetta non è a conoscenza del proprio stato. A livello globale, secondo i dati UNAIDS per il 2019, circa 7,1 milioni di persone erano inconsapevoli del proprio stato di infezione da HIV (1); in Italia, con riferimento a una prevalenza complessiva nel 2012 di circa 125.000-130.000 casi di infezioni da HIV, la popolazione infetta non diagnosticata risultava pari all’11-13% (2).
I dati sulla sorveglianza delle nuove diagnosi di infezione da HIV raccolti dal Centro operativo AIDS (COA) dell’Istituto Superiore di Sanità (ISS) hanno riportato, per il 2018 (ultimo dato disponibile), 2.847 nuove diagnosi di infezione da HIV, pari a 4,7 nuovi casi per 100.000 residenti (dato leggermente inferiore rispetto all’incidenza media osservata tra le nazioni dell’Unione Europea pari a 5,1 nuovi casi per 100.000) (3). I casi più numerosi sono risultati attribuibili a trasmissione eterosessuale (41%, specificamente: 23% maschi e 18% femmine), seguiti dai casi relativi ai maschi che fanno sesso con maschi (39%); le persone che usano sostanze stupefacenti rappresentano il 4% di tutte le segnalazioni.
Sempre con riferimento alle nuove diagnosi di infezione da HIV rilevate dal sistema di sorveglianza dell’ISS, è stato possibile osservare come, dal 2012, ci sia stata una riduzione dei casi per tutte le modalità di trasmissione, specialmente al Nord e al Centro (3).
Attraverso l’uso delle terapie HAART (Higly Active Anti-Retroviral Therapy), oggi, un soggetto HIV-positivo ha un’aspettativa di vita analoga a quella di un soggetto non infetto, con una buona qualità di vita (4).
Gli obiettivi della Global Aids Strategy per il periodo 2021-2026 sono i “target 95-95-95” (5). Secondo questa strategia, entro il 2026, il 95% della popolazione stimata con HIV deve avere consapevolezza della propria situazione, il 95% delle persone HIV-positive deve ricevere il sostegno della terapia antiretrovirale e il 95% dei pazienti in trattamento deve raggiungere la soppressione della carica virale. La nuova strategia globale 2021-2026, che supera i vecchi target 90-90-90 da raggiungere entro il 2020, mira, inoltre, a ridurre le disuguaglianze e dà priorità alle persone che ancora non accedono ai servizi salvavita contro l’HIV per porre fine all’AIDS come minaccia per la salute pubblica entro il 2030 (5).
L’Italia presenta tassi ancora inferiori ai target; infatti, al 2012, la proporzione di persone infette diagnosticate risultava pari all’88% e la proporzione di persone infette diagnosticate e in trattamento con ART risultava pari all’88%, mentre la proporzione di persone infette diagnosticate e in trattamento con ART con soppressione virale risultava pari all’87% (6).
Purtroppo, la pandemia COVID-19 non ha reso possibile il perseguimento dei 3 obiettivi sopra esposti e ha generato, al contrario di quanto ci si proponeva, da un lato la mancata diagnosi e il conseguente mancato trattamento tempestivo dei pazienti e, dall’altro, l’interruzione del trattamento con terapia antiretrovirale per molti pazienti, con un impatto negativo per i pazienti e per il sistema nel suo complesso. Uno studio osservazionale retrospettivo condotto a Brescia, una delle città italiane più colpite dall’emergenza sanitaria nei primi duri mesi della pandemia, presso il Dipartimento di malattie infettive e tropicali dell’Azienda Socio-Sanitaria Territoriale (ASST) Spedali Civili, ha confrontato i mesi di ottobre e novembre del 2019 con i mesi di marzo e aprile 2020, al fine di confrontare il numero di nuove diagnosi di HIV, il numero di soggetti con infezione da HIV ricoverati in ospedale durante la pandemia COVID-19 e il numero medio di ricoveri avvenuti nel corso dell’anno 2019 (7). Per il confronto con il 2020, sono stati scelti i mesi di ottobre e novembre, perché avevano quantità simili di festività, stesse disponibilità di terapie antiretrovirali e analoga gestione amministrativa. Dall’analisi, condotta su un totale di 3.875 soggetti con infezione da HIV, sono risultati un aumento delle visite perse dal 5% all’8% (p < 0,01), una riduzione del numero di nuove diagnosi di HIV da 6,4 nel 2019 a 2,5 al mese nel 2020 (p = 0,01), un calo della dispensazione delle terapie antiretrovirali e un aumento dei pazienti affetti da HIV ospedalizzati a causa di COVID-19.
Il presente studio è stato sviluppato al fine di valutare, da un punto di vista epidemiologico ed economico, le conseguenze generate dalla riduzione della dispensazione dei farmaci antiretrovirali a causa della pandemia COVID-19 e del ritardo nelle diagnosi e nell’arruolamento dei pazienti alle terapie e nella ripresa dei trattamenti, specialmente per i pazienti che necessitavano di switch ad altre terapie HIV.
Tale obiettivo è stato perseguito attraverso lo sviluppo di un modello epidemiologico in grado di quantificare le diagnosi e la progressione di malattia dei pazienti sottoposti a terapia antiretrovirale in Italia.
Metodi
L’analisi è stata condotta mediante l’adattamento di un modello di Markov precedentemente pubblicato in letteratura (8,9). Le simulazioni sono state condotte considerando la possibilità di un trattamento continuo per i pazienti già diagnosticati (non si prevedono interruzioni terapeutiche) e un inizio immediato dei pazienti con nuova diagnosi nel corso del 2021. Tale analisi è stata confrontata nell’ipotesi di un’interruzione terapeutica o di un ritardo diagnostico causato dal COVID-19. Al fine di rendere il modello il più aderente possibile alla situazione epidemiologica nazionale attuale, è stato costituito un board di esperti con elevata esperienza nell’ambito clinico oggetto di studio (co-autori del lavoro). L’analisi è stata condotta sia secondo la prospettiva del Servizio Sanitario Nazionale (SSN) sia secondo la prospettiva sociale e considerando un orizzonte temporale pari a 10 anni. Costi e outcome sono stati scontati a un tasso del 3% annuo, come comunemente assunto in analisi di questo genere (10).
Per la valutazione dell’impatto epidemiologico del ritardo di trattamento causato dalla pandemia COVID-19 sono state effettuate delle simulazioni, considerando un ritardo di trattamento per il 55% delle nuove diagnosi di infezione da HIV (Impatto COVID-19 su HIV, calo nuove diagnosi, ADN Kronos 2020) e per il 50% dei prevalenti (Quiros-Roldan et al. 2020 (7)). In particolare, dal momento che, come indicato dai clinici coinvolti nello studio, la durata del ritardo di trattamento può ritenersi associata alla gravità del paziente, per cui un paziente con livello di CD4 ≥ 500 molto probabilmente sarà caratterizzato da un ritardo di trattamento maggiore rispetto a un paziente con livello di CD4 < 200, nel modello è stato considerato un ritardo di trattamento pari a 12 mesi per i pazienti con livello di CD4 ≥ 500, un ritardo pari a 6 mesi per i pazienti con 350 ≤ CD4 < 500, un ritardo pari a 3 mesi per i pazienti con 200 ≤ CD4 < 350 e un ritardo pari ad 1 mese per i pazienti con CD4 < 200. Lo scenario caratterizzato dal ritardo di trattamento a causa della pandemia COVID-19 è stato confrontato con lo scenario caratterizzato dal trattamento tempestivo dei pazienti.
Struttura del modello
L’analisi ha previsto la simulazione della coorte dei pazienti affetti da HIV in Italia secondo un orizzonte temporale di 10 anni e il processo di Markov è stato simulato secondo la struttura a stati discreti già presentata in letteratura (Fig. 1) (8,9). In particolare, ciascuna coorte di pazienti con infezione da HIV risulta caratterizzata da una determinata stratificazione per livello di CD4 che ne definisce la gravità (Tab. I).
La distribuzione per livello di CD4 delle infezioni da HIV di nuova diagnosi e delle infezioni da HIV diagnosticate (pazienti già in trattamento) è stata ottenuta rispettivamente dal sistema di sorveglianza dell’Istituto Superiore di Sanità (ISS) (3) e dallo studio condotto dalla fondazione ICONA, considerando, per quest’ultimo, la distribuzione per livello di CD4 al 2014 della coorte di pazienti con infezione da HIV arruolati tra il 2004 e il 2014 (coorte aperta) (11). Con riferimento alle infezioni da HIV non diagnosticate, la distribuzione per livello di CD4 è stata ottenuta dallo studio di Mammone et al. del 2016 (2). In particolare, lo studio di Mammone et al. ha stimato, per il 2012, la distribuzione per livello di CD4 delle nuove diagnosi di HIV in pazienti asintomatici; i clinici sono risultati concordi nell’affermare che tale distribuzione potesse risultare assimilabile alla distribuzione per livello di CD4 dei pazienti con infezione da HIV non ancora diagnosticati.
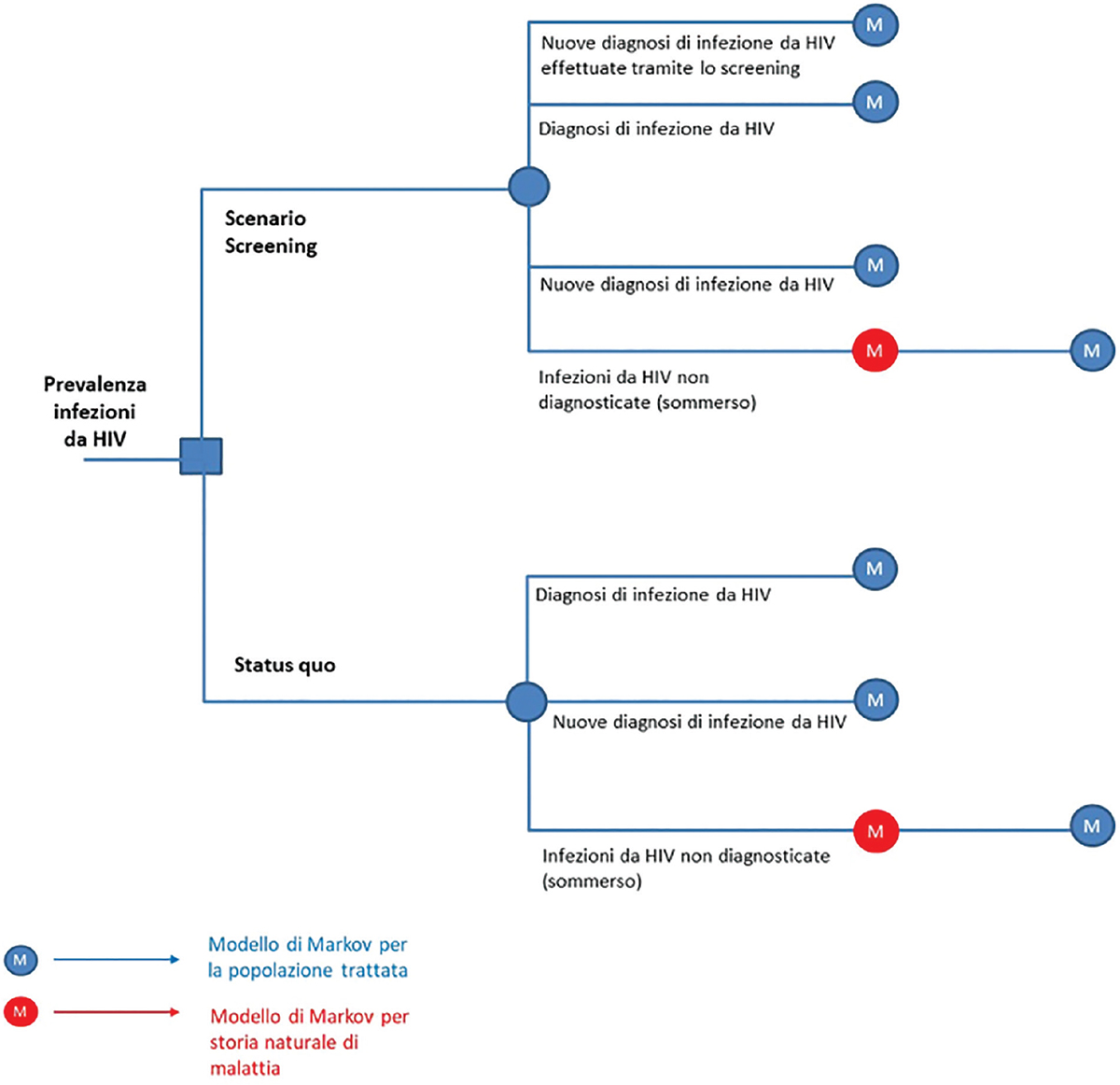
Fig. 1 - Struttura del modello.
| Infezioni da HIV di nuova diagnosi | ||
|---|---|---|
| Livello CD4 | Stima | Fonte |
| CD4 ≥ 500 | 24,90% | ISS (3) |
| 350 < CD4 < 499 | 18,00% | |
| 200 < CD4 < 349 | 19,30% | |
| CD4 < 200 | 37,80% | |
| Infezioni da HIV diagnosticate (pazienti già in trattamento) | ||
| Livello CD4 | Stima | Fonte |
| CD4 ≥ 500 | 43,00% | Fondazione ICONA (coorte aperta al 2014) (11) |
| 350 < CD4 < 499 | 43,00% | |
| 200 < CD4 < 349 | 9,00% | |
| CD4 < 200 | 5,00% | |
| Infezioni da HIV non diagnosticate o di nuova diagnosi | ||
| Livello CD4 | Stima | Fonte |
| CD4 ≥ 500 | 38,00% | Mammone et al. 2016 (2) |
| 350 < CD4 < 499 | 24,00% | |
| 200 < CD4 < 349 | 21,00% | |
| CD4 < 200 | 17,00% | |
Per le infezioni da HIV di nuova diagnosi nel corso dell’anno di inizio della simulazione, è stata assunta la stessa distribuzione per livello di CD4 considerata per le infezioni da HIV non diagnosticate.
I pazienti affetti da HIV diagnosticati, che siano prevalenti o di nuova diagnosi, entrano nel modello di Markov di simulazione del percorso diagnostico terapeutico dei pazienti affetti da HIV attualmente trattati in Italia (8); i pazienti affetti da HIV non diagnosticati entrano nel modello di Markov di simulazione della storia naturale di malattia (9). I pazienti non diagnosticati a causa del COVID-19 entreranno nel modello di Markov di simulazione del percorso diagnostico terapeutico dei pazienti trattati solamente dopo qualche anno, in relazione al loro livello di CD4; questo perché il modello assume che il tempo di diagnosi, dunque il tempo necessario affinché il paziente venga diagnosticato, sia correlato al suo livello di CD4. In particolare, il tempo di diagnosi è stato stimato, per i pazienti con livello di CD4 ≥ 500 e per i pazienti con 350 ≤ CD4 < 500, valutando il numero di anni di storia naturale della malattia che intercorrono per arrivare alla distribuzione delle nuove diagnosi di HIV con livello di CD4 < 350, mentre i tempi di diagnosi per i pazienti non diagnosticati con 200 ≤ CD4 < 350 e CD4 < 200 sono stati assunti dai clinici coinvolti nello studio. Mediante tale metodologia, è stato possibile stimare un tempo di diagnosi pari a 8 anni per i pazienti con livello di CD4 ≥ 500, pari a 3 anni per i pazienti con 350 ≤ CD4 < 500 e 200 ≤ CD4 < 350 e pari a 2 anni per i pazienti con livello di CD4 < 200.
I modelli di Markov ottenuti dalla letteratura e impiegati per la simulazione del percorso dei pazienti trattati e non trattati prevedevano una stratificazione per livello di CD4 non comparabile, in quanto il modello di storia naturale di malattia prevedeva un livello di dettaglio maggiore (presenza di un maggior numero di stati di salute in relazione con il livello di CD4); al fine di rendere confrontabili i due modelli, il modello di Markov di storia naturale della malattia è stato adattato a quello relativo ai soggetti trattati, aggregando gli stati di salute caratterizzati da una maggiore stratificazione (p. es., gli stati di salute 101-200, 51-100 e <50 sono stati aggregati secondo un unico stato di salute CD4 < 200). I dettagli della metodologia impiegata sono riportati in Appendice.
Infine, dal momento che le probabilità di morte per livello di CD4 associate ai pazienti trattati e non trattati presenti nei modelli di Markov ottenute dalla letteratura generavano un numero di decessi superiore rispetto a quanto accade nello status quo (661 decessi per HIV in Italia nel 2017 (12)), queste sono state ricalibrate al fine di ottenere un numero di decessi coerente con quanto avviene nella realtà. Anche in questo caso, i dettagli della metodologia sono riportati in Appendice.
Stima del numero di soggetti con infezione da HIV in Italia
Il numero di pazienti affetti da HIV in Italia è stato ottenuto dallo studio di Mammone et al. del 2016 (2), il quale ha stimato una prevalenza totale di infezioni da HIV in Italia nel 2012 pari a circa 125.951. La quota di pazienti non diagnosticati è risultata pari al 12% della prevalenza totale; tale stima è stata ottenuta come valore medio del range riportato dal lavoro di Mammone et al. e riferito al 2012 (11%-13%) (2).
Il numero di nuove diagnosi di infezione da HIV è stato ottenuto dal sistema di sorveglianza dell’ISS, il quale, per il 2018, ha segnalato 2.847 nuove diagnosi di infezione da HIV (Tab. II).
Eventi HIV-correlati
All’interno dell’analisi sono stati inclusi i rischi di contrarre le principali malattie che definiscono l’HIV. Mediante lo studio COHERE (13), nato dalla collaborazione di 33 coorti da tutta Europa e che unisce i dati di coorti già esistenti, è stato possibile ottenere i tassi di incidenza per 1.000 individui delle infezioni opportunistiche da HIV in relazione alla conta dei linfociti CD4. Le malattie che sono state incluse nell’analisi sono risultate le seguenti: candidosi esofagea, sarcoma di Kaposi, tubercolosi polmonare, linfoma non Hodgkin, tubercolosi extrapolmonare, polmonite batterica, polmonite da Pneumocystis jirovecii, herpes ricorrente, demenza correlata all’HIV, cancro cervicale, sindrome da deperimento, encefalopatia multifocale progressiva, toxoplasmosi da citomegalovirus, criptosporidiosi, Mycobacterium avium complex, retinite da citomegalovirus e criptococcosi. Nella Tabella III sono riportate le stime di incidenza totale per lo sviluppo di una delle malattie sopra indicate in relazione alla conta dei linfociti CD4 (13).
| Infezione opportunistica | Base Case | Min | Max | Fonte |
|---|---|---|---|---|
| CD4 ≥ 500 | 0,0057 | 0,0032 | 0,0067 | (13) |
| 350 ≤ CD4 < 500 | 0,0102 | 0,0099 | 0,0106 | |
| 200 ≤ CD4 < 350 | 0,0205 | 0,0200 | 0,0211 | |
| CD4 < 200 | 0,0205 | 0,0200 | 0,0211 |
Utilità
Al fine di quantificare gli impatti del ritardo diagnostico e dell’interruzione del trattamento anche sulla qualità di vita dei pazienti, sono stati stimati gli anni di vita aggiustati per la qualità (QALYs) nei due scenari di analisi considerati. Nella Tabella IV sono riportate le stime di utilità impiegate nell’analisi.
| Utilità | Base Case | Min | Max | Fonte |
|---|---|---|---|---|
| CD4 ≥ 500 | 0,87 | 0,79 | 0,96 | (14,15) |
| 350 ≤ CD4 < 500 | 0,86 | 0,77 | 0,94 | |
| 200 ≤ CD4 < 350 | 0,86 | 0,77 | 0,94 | |
| CD4 < 200 | 0,79 | 0,71 | 0,86 | |
| Morte | 0,00 | 0,00 | 0,00 |
Lo studio di Simpson et al. (14) ha stimato le utilità mediante la somministrazione del questionario EuroQol-5D (EQ-5D) a 21.000 pazienti arruolati in diversi studi clinici. Dal momento che un’ampia percentuale di questi pazienti aveva ricevuto il trattamento con ritonavir, all’interno dello studio era stato effettuato un aggiustamento dei pesi dei QALYs al fine di ridurre il potenziale bias derivante dalla qualità della vita condizionata dagli effetti collaterali comuni a tale trattamento.
Nello studio di Kauf et al. (15), la qualità della vita correlata alla salute è stata stimata a partire dai dati provenienti da cinque diversi studi randomizzati, condotti in aperto, di fase II, III, IV relativamente ai regimi di terapia HAART per il trattamento di soggetti adulti con infezioni da HIV tra il 1999 e il 2003. Tre di questi studi clinici erano stati condotti su pazienti naïve alle terapie antiretrovirali, mentre i rimanenti erano stati condotti su pazienti non-naïve. La qualità di vita è stata valutata attraverso il questionario di valutazione della qualità della vita SF-36 (Short-Form 36 Items Health Survey). I punteggi provenienti dai questionari completi sono stati convertiti in utilità attraverso il metodo proposto da Brazer et al. (16).
Parametri di costo
Con riferimento ai costi diretti, all’interno del modello sono stati considerati i costi delle terapie antiretrovirali, i costi associati agli stati di salute e il costo delle infezioni opportunistiche (Tab. V). Il costo medio annuo associato al trattamento è stato stimato pari a € 7.000, considerando le 20 principali terapie antiretrovirali e ricalibrandolo su dati di ricerca di mercato (PDTA Lombardia 2019 e Therapy knowledge, febbraio 2020).
Con riferimento ai costi indiretti, è stato considerato il costo associato alla perdita di produttività dei pazienti a causa della malattia. Tale costo è stato ottenuto dalla letteratura, in particolare da uno studio europeo condotto al fine di valutare l’impatto economico associato all’HIV/AIDS in 5 diversi Paesi europei, tra cui l’Italia (17). I costi presenti in tale studio facevano riferimento all’anno 2010, dunque il costo ottenuto per l’Italia è stato attualizzato al 2020; tale costo è stato, inoltre, stratificato per livello di CD4 in modo proporzionale rispetto alla distribuzione dei costi diretti per livello di CD4.
| Costi diretti sanitari | Costo | Fonte |
|---|---|---|
| Costo medio annuo del trattamento | € 7.000 | PDTA Lombardia e ricerca di mercato Therapy knowledge, febbraio 2020 |
| Test | € 5,00 | Assunzione |
| Costi annui delle risorse sanitarie per livello di CD4 | ||
| CD4 ≥ 500 | € 2.502 | (21,22) (Servizi sanitari + altri farmaci + ricovero ospedaliero) |
| 350 ≤ CD4 < 500 | € 3.409 | |
| 200 ≤ CD4 < 350 | € 3.816 | |
| CD4 < 200 | € 6.343 | |
| Infezione opportunistica | € 2.111 | (23) |
| Costi indiretti | Costo annuo per paziente | Fonte |
| Perdita di produttività a causa della malattia | € 1.484 | Attualizzato al 2020 (17) |
Risultati della valutazione dell’impatto epidemiologico ed economico del ritardo di trattamento causato dalla pandemia COVID-19
Lo scenario caratterizzato dalla presenza di un ritardo di trattamento a causa della pandemia COVID-19 è stato confrontato con uno scenario di tempestiva ripresa della terapia dei pazienti HIV+ naïve e in trattamento (sia controllati che non controllati e che necessiterebbero di switch ad altre terapie).
Da questo confronto è emerso come il ritardo di trattamento potrebbe generare un peggioramento della condizione clinica dei pazienti e un aumento della mortalità HIV-correlata. In particolare, lo scenario caratterizzato da un ritardo di trattamento rispetto allo scenario di tempestiva ripresa della terapia comporterebbe, al terzo anno di analisi, un incremento del numero di pazienti con CD4 < 200 pari a 1.719 (+16%) e una riduzione del numero di pazienti con CD4 ≥ 500 pari a 6.751 (−9%) (Fig. A in Appendice). Il peggioramento della condizione clinica dei soggetti con infezione da HIV potrebbe altresì generare un incremento del numero dei decessi. Una ripresa tempestiva del trattamento per i pazienti HIV+ potrebbe permettere di evitare 296, 454 e 687 decessi rispettivamente al terzo, al quinto e al decimo anno di analisi (Fig. 2A). Il peggioramento della condizione clinica si traduce, inoltre, in un peggioramento della qualità di vita dei pazienti. Una ripresa tempestiva della terapia rispetto al ritardo di trattamento potrebbe generare un aumento dei QALYs cumulati al quinto e al decimo anno di analisi, rispettivamente pari a 1.867 e a 4.321 (Fig. 2B).
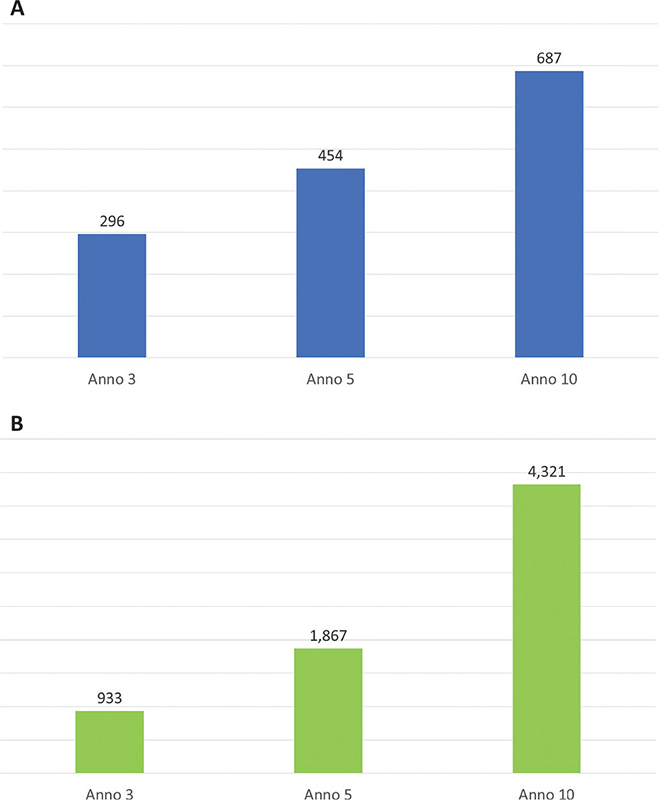
Fig. 2 - Decessi evitati e incremento cumulato dei QALYs per anno di analisi grazie a una ripresa tempestiva del trattamento. A: Decessi evitati (valori cumulati). B: Incremento cumulato dei QALYs.
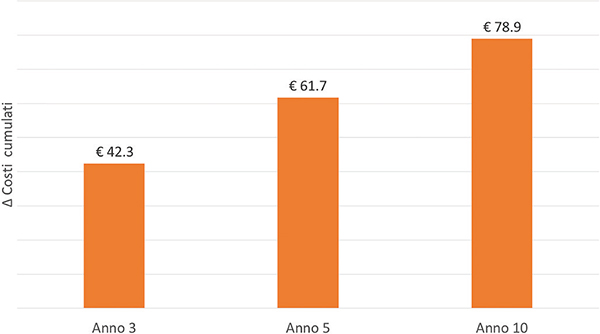
Fig. 3 - Risparmi in termini di costi diretti associati alla gestione della malattia e in termini di costi indiretti, ottenibili grazie a una ripresa tempestiva del trattamento.
Il modello ha, inoltre, stimato come il peggioramento della condizione clinica dei pazienti, oltre che comportare una riduzione della qualità di vita, possa generare, da un lato, una riduzione dei costi associati al trattamento e, dall’altro, un aumento delle risorse sanitarie impiegate per la gestione dei pazienti e della perdita di produttività del paziente a causa della malattia.
Il trattamento tempestivo dei pazienti HIV+ naïve e la ripresa dei trattamenti per i pazienti in switch rappresenterebbe un investimento tanto sotto il profilo economico quanto in termini di qualità di vita e complicanze evitate. Infatti, investire circa € 546,8 milioni, € 556,5 milioni ed € 577,6 milioni nel trattamento dei pazienti HIV+ rispettivamente al terzo, al quinto e al decimo anno di analisi genererebbe una riduzione dei costi cumulati associati alla gestione dei pazienti con HIV rispettivamente pari a circa € 42,3 milioni, € 61,7 milioni ed € 78,9 milioni (Fig. 3) e rappresenterebbe un investimento sostenibile rispetto a quella che è l’attuale spesa per i farmaci anti-HIV (661,2 milioni di euro nel 2019 (18)), con un impatto positivo tanto sul SSN quanto sulla società nel suo complesso.
Sotto il profilo clinico, la tempestiva ripresa dei trattamenti con farmaci nuovi e con elevato profilo clinico in termini di efficacia e sicurezza consentirebbe di migliorare la qualità di vita dei pazienti HIV+ con un guadagno di circa 4.321 QALYs e 687 decessi evitati al decimo anno di analisi.
Tali risultati evidenziano come sia fondamentale, specialmente in una situazione di pandemia, quale è quella attuale, introdurre soluzioni tecnologiche e organizzative che abbiano l’obiettivo di promuovere da un lato una tempestiva ripresa delle diagnosi e, quindi, degli arruolamenti dei pazienti naïve e, dall’altro, il monitoraggio DEI pazienti in trattamento che necessitano di switch a terapie più efficaci e sicure e che contribuiscano a migliorare la qualità di vita dei pazienti, evitando, così, la progressione della patologia a stati di salute più gravi. Ne consegue che un tempestivo trattamento dei pazienti HIV+ naïve e dei pazienti in switch costituisca un investimento fondamentale tanto per il SSN quanto per la società nel suo complesso.
Discussione
L’UNAIDS segnala, su un totale di 38 milioni di persone che convivono con l’HIV, la presenza di circa 12,6 milioni di persone che vivono con l’HIV e che non hanno ancora accesso alla terapia antiretrovirale.
A livello nazionale, la quota di persone che vivono con l’HIV senza esserne a conoscenza risulta pari a circa il 12% della prevalenza totale (circa 15.000 soggetti) (valore medio del range riportato dal lavoro di Mammone et al. e relativo al 2012 (2)).
L’analisi è partita dall’assunto di come la pandemia COVID-19 abbia avuto un impatto negativo sull’offerta dei sevizi di prevenzione e trattamento dell’HIV in tutto il mondo.
L’analisi dei dati mensili regolarmente riportati all’UNAIDS sulle interruzioni dei servizi di test e trattamento dell’HIV hanno fatto emergere riduzioni significative nei servizi di test dell’HIV in quasi tutti i paesi con dati disponibili. Dall’inizio della pandemia COVID-19, l’UNAIDS, l’Organizzazione Mondiale della Sanità e il Fondo delle Nazioni Unite per l’Infanzia hanno raccolto dati dai paesi attraverso una piattaforma online per identificare le interruzioni nazionali, regionali e globali dei servizi di routine per l’HIV causate dalla pandemia COVID-19 (19). La modellizzazione condotta dall’UNAIDS e dall’Organizzazione Mondiale della Sanità ha dimostrato che un’interruzione delle forniture mediche di sei mesi potrebbe tradursi in ulteriori 300.000 decessi correlati all’AIDS nella sola Africa subsahariana nell’arco di un anno, regione in cui 440.000 persone sono morte di malattie legate all’AIDS nel 2019, facendoci tornare ai livelli di mortalità correlata all’AIDS del 2011 (20). Allo stesso modo, un’interruzione dei servizi dei programmi di prevenzione della trasmissione dell’HIV da madre a figlio nei Paesi ad alto reddito potrebbe causare un aumento del 40-80% di nuove infezioni da HIV tra i bambini (21).
A livello nazionale, lo studio condotto presso il Dipartimento di malattie infettive e tropicali dell’Azienda Socio-Sanitaria Territoriale (ASST) Spedali Civili di Brescia (7) ha fatto emergere come la pandemia abbia generato un aumento delle visite perse, una riduzione del numero di nuove diagnosi di HIV, un calo della dispensazione delle terapie antiretrovirali e un aumento dei pazienti affetti da HIV ospedalizzati a causa di COVID-19.
L’analisi condotta al fine di valutare l’impatto epidemiologico del ritardo di trattamento dei pazienti con infezione da HIV a causa della pandemia ha fatto emergere un peggioramento della condizione clinica di questi pazienti, espressa mediante la conta dei linfociti CD4, un conseguente aumento della mortalità HIV-correlata (+296, +454 e +687 decessi rispettivamente al terzo, al quinto e al decimo anno di analisi) e un incremento dei costi diretti associati alla gestione della malattia e dei costi indiretti pari a circa € 42,3 milioni, € 61,7 milioni ed € 78,9 milioni rispettivamente al terzo, al quinto e al decimo anno di analisi, qualora non si intervenga tempestivamente con diagnosi e trattamento dei pazienti naïve e dei pazienti in trattamento che necessitano di switch a terapie più efficaci, ben tollerate e con un conseguente impatto positivo sulla QoL dei pazienti. L’analisi ha, infatti, mostrato che il peggioramento della condizione clinica si tradurrebbe in un conseguente peggioramento della qualità di vita dei pazienti. Una ripresa tempestiva della terapia rispetto al ritardo di trattamento potrebbe migliorare la qualità di vita dei pazienti HIV+ in trattamento, con un significativo aumento dei QALYs cumulati al quinto e al decimo anno di analisi rispettivamente pari a 1.867 e a 4.321.
In particolare, l’analisi ha mostrato come, nell’attuale scenario di riferimento, i pazienti perdano l’opportunità di essere trattati tempestivamente e in maniera appropriata con terapie nuove ed efficaci che presentano elevati profili di tollerabilità, con un conseguente impatto negativo tanto in termini di progressione della malattia verso stati di salute più gravi e, quindi, peggiore qualità di vita che di aumento delle complicanze e dei relativi costi per il SSN e la società. Tale scenario ha avuto un impatto non solo sui pazienti naïve, ma anche e soprattutto sui pazienti in trattamento che necessitavano di switch, in quanto la chiusura degli ambulatori HIV e la loro riconversione in ambulatori COVID-19 hanno generato un ritardo nel trattamento di questi pazienti, con un conseguente impatto tanto sotto il profilo clinico e sociale (QoL) quanto sotto il profilo economico e in termini di sostenibilità del sistema. Appare, quindi, fondamentale promuovere una ripresa tempestiva del trattamento per i pazienti HIV+, non solo considerando l’impatto economico per il SSN e la società, ma, soprattutto, tenendo conto che si eviterebbero circa 690 decessi al decimo anno.
L’analisi, ovviamente, risente di tutte le assunzioni effettuate e degli adattamenti che si sono resi necessari al fine di realizzare un modello quanto più possibile affine alla realtà. Le assunzioni effettuate circa i tempi di diagnosi per i pazienti non diagnosticati sono state effettuate mediante il supporto dei clinici coinvolti nello studio. L’adattamento della struttura del modello di Markov di storia naturale della malattia a quello relativo ai soggetti trattati in relazione alla stratificazione dei pazienti per livello di CD4 è stato effettuato al fine di rendere confrontabili i due modelli. I decessi generati dalle probabilità di morte presenti in entrambi i modelli di Markov superavano di gran lunga il numero di decessi associati all’HIV stimati in Italia; in assenza di stime relative alle probabilità di morte che potessero risultare più affini alla realtà, si è resa, dunque, necessaria una calibrazione delle probabilità di morte presenti nei modelli di Markov ottenuti dalla letteratura, al fine di ricondurre i risultati della simulazione quanto più possibile vicini a quanto accade nella realtà. I dettagli della metodologia impiegata per l’adattamento del modello di Markov di storia naturale della malattia a quello dei pazienti trattati e i dettagli della calibrazione sono riportati in Appendice.
Conclusioni
L’analisi ha evidenziato come sia necessario e urgente trattare in modo precoce e appropriato i pazienti HIV+, sotto il profilo clinico, economico e sociale, tanto per il SSN quanto per i pazienti e la società nel suo complesso, in virtù delle esternalità positive associate alla diagnosi precoce e alla ripresa dei trattamenti appropriati per i pazienti HIV+. Tali risultati evidenziano come sia fondamentale, specialmente in una situazione di pandemia, quale è quella attuale, introdurre soluzioni tecnologiche, digitali e organizzative che abbiano l’obiettivo di promuovere:
- da un lato, una tempestiva ripresa delle diagnosi e, quindi, degli arruolamenti dei pazienti naïve, ma anche la ripresa in carico dei pazienti in trattamento non adeguatamente gestiti;
- dall’altro, un supporto tempestivo dei pazienti non più a target per accelerare lo switch a trattamenti con un profilo clinico, di sicurezza, sociale ed economico unico per raggiungere gli obiettivi di sanità pubblica.
Ne consegue che un tempestivo trattamento dei pazienti HIV+ naïve e dei pazienti in switch costituisca un investimento fondamentale tanto per il SSN quanto per la società nel suo complesso, generando, al decimo anno di analisi, un risparmio pari a circa € 78,9 milioni in termini di costi diretti associati alla gestione della malattia e, in termini di costi indiretti, 687 decessi evitati e una migliore qualità di vita dei pazienti (4.321 QALYs guadagnati).
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. UNAIDS. Global HIV & AIDS statistics — 2020 fact sheet. Online (Access September 2021)
- 2. Mammone A, Pezzotti P, Regine V, et al. How many people are living with undiagnosed HIV infection? An estimate for Italy, based on surveillance data. AIDS. 2016;30(7):1131-1136. CrossRef PubMed
- 3. Istituto Superiore di Sanità, Aggiornamento delle nuove diagnosi di infezione da HIV e dei casi di AIDS in Italia al 31 dicembre 2018, in Notiziario dell’ISS. 2019. Online (Access September 2021).
- 4. Istituto Superiore di Sanità. Infezione da Hiv e Aids – Le terapie. Online (Access September 2021).
- 5. UNAIDS. End Inequalities. End Aids. Global Aids Strategy 2021-2026. 2021; Online (Access September 2021).
- 6. ECDC. Continuum of HIV care. Monitoring implementation of the Dublin Declaration on Partnership to Fight HIV/AIDS in Europe and Central Asia: 2017 progress report. Online (Access September 2021).
- 7. Quiros-Roldan E, Magro P, Carriero C, et al. Consequences of the COVID-19 pandemic on the continuum of care in a cohort of people living with HIV followed in a single center of Northern Italy. AIDS Res Ther. 2020;17(1):59. CrossRef PubMed
- 8. Marcellusi A, Viti R, Russo S, Andreoni M, Antinori A, Mennini FS. Early Treatment in HIV Patients: A Cost-Utility Analysis from the Italian Perspective. Clin Drug Investig. 2016;36(5):377-387. CrossRef PubMed
- 9. Mangal TD, Progression UWGC, Mortality Amongst HIVSCCE; UNAIDS Working Group on CD4 Progression and Mortality Amongst HIV Seroconverters including the CASCADE Collaboration in EuroCoord. Joint estimation of CD4+ cell progression and survival in untreated individuals with HIV-1 infection. AIDS. 2017;31(8):1073-1082. CrossRef PubMed
- 10. Associazione Italiana Economia Sanitaria (AIES). Proposta di Linee-Guida per la valutazione economica degli interventi sanitari. Poilitiche Sanitarie. 2009;10(2):91-99.
- 11. d’Arminio Monforte A, Diaz-Cuervo H, De Luca A, et al; ICONA Foundation Study Group. Evolution of major non-HIV-related comorbidities in HIV-infected patients in the Italian Cohort of Individuals, Naïve for Antiretrovirals (ICONA) Foundation Study cohort in the period 2004-2014. HIV Med. 2019;20(2):99-109. CrossRef PubMed
- 12. Frank TD, Carter A, Jahagirdar D, et al; GBD 2017 HIV collaborators. Global, regional, and national incidence, prevalence, and mortality of HIV, 1980-2017, and forecasts to 2030, for 195 countries and territories: a systematic analysis for the Global Burden of Diseases, Injuries, and Risk Factors Study 2017. Lancet HIV. 2019;6(12):e831-e859. CrossRef PubMed
- 13. Mocroft A, Furrer HJ, Miro JM, et al; Opportunistic Infections Working Group on behalf of the Collaboration of Observational HIV Epidemiological Research Europe (COHERE) study in EuroCOORD. The incidence of AIDS-defining illnesses at a current CD4 count ≥200 cells/μL in the post-combination antiretroviral therapy era. Clin Infect Dis. 2013;57(7):1038-1047. CrossRef PubMed
- 14. Simpson KN, Luo MP, Chumney E, Sun E, Brun S, Ashraf T. Cost-effectiveness of lopinavir/ritonavir versus nelfinavir as the first-line highly active antiretroviral therapy regimen for HIV infection. HIV Clin Trials. 2004;5(5):294-304. CrossRef PubMed
- 15. Kauf TL, Roskell N, Shearer A, et al. A predictive model of health state utilities for HIV patients in the modern era of highly active antiretroviral therapy. Value Health. 2008;11(7):1144-1153. CrossRef PubMed
- 16. Brazier J, Roberts J, Deverill M. The estimation of a preference-based measure of health from the SF-36. J Health Econ. 2002;21(2):271-292. CrossRef PubMed
- 17. Trapero-Bertran M, Oliva-Moreno J. Economic impact of HIV/AIDS: a systematic review in five European countries. Health Econ Rev. 2014;4(1):15. CrossRef PubMed
- 18. OSMED. L’uso dei farmaci in Italia. Rapporto nazionale. Anno 2019. Online (Access September 2021).
- 19. Hogan AB, Jewell BL, Sherrard-Smith E, et al. Potential impact of the COVID-19 pandemic on HIV, tuberculosis, and malaria in low-income and middle-income countries: a modelling study. Lancet Glob Health. 2020;8(9):e1132-e1141. CrossRef PubMed
- 20. Jewell BL, Mudimu E, Stover J, et al; HIV Modelling Consortium. Potential effects of disruption to HIV programmes in sub-Saharan Africa caused by COVID-19: results from multiple mathematical models. Lancet HIV. 2020;7(9):e629-e640. CrossRef PubMed
- 21. Rizzardini G, Restelli U, Bonfanti P, et al. The cost of HIV disease in Northern Italy: the payer’s perspective. J Acquir Immune Defic Syndr. 2011;57(3):211-217. CrossRef PubMed
- 22. Rizzardini G, Bonfanti P, Carenzi L, et al. Cost-effectiveness analysis of HIV treatment in the clinical practice of a public hospital in northern Italy. Ther Clin Risk Manag. 2012;8:377-384. PubMed
- 23. Foglia E, Bonfanti P, Rizzardini G, et al. Cost-utility analysis of lopinavir/ritonavir versus atazanavir + ritonavir administered as first-line therapy for the treatment of HIV infection in Italy: from randomised trial to real world. PLoS One. 2013;8(2):e57777. CrossRef PubMed