 |
Glob Reg Health Technol Assess 2021; 8: 120-130 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2258 ORIGINAL RESEARCH ARTICLE |
 |
Costo per responder di risankizumab e secukinumab nel trattamento della psoriasi a placche da moderata a grave in Italia
Cost per responder for risankizumab vs secukinumab in patients with moderate-to-severe plaque psoriasis in Italy
Purpose: The objective of this analysis was to compare the cost per responder between risankizumab and secukinumab among patients with moderate-to-severe plaque psoriasis in Italy.
Methods: The clinical efficacy was assessed based on IMMerge study of published efficacy data as measured by Psoriasis Area and Severity Index response (PASI 90 and PASI 100) for risankizumab and secukinumab. The treatment cost was based on the number of administrations dispensed in the first (induction plus maintenance period) and the second (maintenance period only) year of treatment and the ex-factory price of each treatment. The cost per responder was adopted as a cost-effectiveness indicator.
Results: Independently of the PASI response (PASI 90 and PASI 100) used and the year of treatment considered, the cost per responder was consistently lower for risankizumab compared to secukinumab in all clinical measures. For example, considering the first-year costs and PASI 100, the cost per responder for risankizumab was € 24,506.83 compared to € 38,000.00 for secukinumab. The differences in the cost per responder between risankizumab and secukinumab increased when higher PASI response levels were considered.
Conclusion: This economic evaluation suggested that the cost per responder is consistently lower for risankizumab compared to secukinumab from the perspective of the Italian National Health Service in the treatment of moderate-to-severe plaque psoriasis.
Keywords: Cost per responder, Plaque psoriasis, Risankizumab, Secukinumab, SSN
Received: April 7, 2021
Accepted: June 18, 2021
Published online: September 6, 2021
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La psoriasi è una malattia infiammatoria cutanea con decorso cronico-recidivante, caratterizzata da placche eritemato-squamose che coinvolgono aree di estensione variabile e dall’alternarsi di fasi di remissione e di esacerbazione di durata variabile (1-3). È una condizione complessa e multifattoriale in cui concorrono sia la predisposizione genetica che diversi trigger ambientali (4). Sono implicati nella patogenesi della malattia numerosi segnali di crescita e infiammatori, tra cui una serie di citochine di tipo T-helper (Th)1 e Th17, responsabili della proliferazione dei cheratinociti, della produzione di citochine infiammatorie e della migrazione di cellule infiammatorie nelle lesioni psoriasiche (5).
Le tipiche manifestazioni cutanee di questa malattia e il suo andamento cronico interferiscono significativamente sulla qualità di vita dei soggetti che ne sono affetti, con ripercussioni psicologiche e sociali talvolta invalidanti (2,3,6,7). Ansia, depressione e abuso di sostanze alcoliche hanno, infatti, una prevalenza elevata nei pazienti affetti da psoriasi (3). Queste comorbidità psichiatriche non sono le uniche riscontrate. Infatti, negli ultimi decenni, la psoriasi è stata sempre più delineata come una patologia sistemica, a causa dell’associazione con altre patologie, tra cui quelle cardiometaboliche. Nei pazienti con psoriasi severa si riscontra un maggior rischio di mortalità rispetto alla popolazione generale (HR 1,52; IC95% 1,35-1,71) (8,9).
Interessando circa il 2-3% della popolazione italiana, l’incidenza e la prevalenza della psoriasi mostrano notevoli variazioni a seconda dei Paesi osservati. Queste variazioni possono essere spiegate da diversi fattori, tra cui la diversità geografica, ambientale ed etnica, oppure, ancora, la manifestazione variabile della malattia e il suo decorso clinico. Un recente studio ha analizzato l’incidenza e la prevalenza in un campione rappresentativo della popolazione italiana (no = 14.705) (10). I dati raccolti hanno mostrato un andamento bimodale dell’incidenza, con picchi nelle classi di età a esordio precoce (35-44 anni) e a esordio tardivo (65-74 anni) (10). La prevalenza ha mostrato, invece, un tasso medio del 2,7% (IC95%: 2,5-3,0), in aumento nella classe di età 60-64 anni (3,5%) e in costante diminuzione nelle successive classi di età (1,7% nella popolazione ≥74 anni) (10). Riparametrando le stime di questa analisi alla popolazione italiana, la psoriasi conterebbe circa 1,6 milioni di casi, in linea con quanto riportato in precedenti studi (11).
La psoriasi a placche (PP), tra le diverse forme esistenti, è la più comune (80% dei pazienti con psoriasi) (2,3,12). La PP è caratterizzata dalla presenza di lesioni eritemato-desquamative a margini netti, localizzate prevalentemente alle sedi estensorie degli arti (ginocchia e gomiti), alla regione lombo-sacrale e al cuoio capelluto (7,12), spesso accompagnate da fastidiosi sintomi quali prurito e dolore (12,13). Circa il 20% dei soggetti con PP presenta una malattia da moderata a grave (14,15).
Differenti misure vengono utilizzate per valutare la gravità della PP e l’efficacia dei trattamenti somministrati; tra queste, il PASI (Psoriasis Area and Severity Index) è una di quelle più frequentemente utilizzate (15-17). Questo indice combina la valutazione della gravità delle lesioni (quali eritema, infiltrazione, desquamazione e ispessimento cutaneo) con quella dell’area del corpo interessata dalla malattia. Il punteggio PASI viene misurato per mezzo di una scala da 0 (assenza di malattia) a un massimo di 72 punti (massimo livello di gravità della malattia), mentre la risposta al trattamento è misurata in termini di riduzione percentuale del punteggio PASI, con valori del 75% (PASI 75), del 90% (PASI 90) e del 100% (PASI 100) (15-17). Un punteggio PASI >10 generalmente indica una malattia moderata-severa (15-17).
Sebbene, attualmente, non sia disponibile una cura definitiva della PP, varie strategie di trattamento ne consentono un controllo prolungato delle manifestazioni e dei sintomi. È, quindi, fondamentale predisporre una strategia terapeutica di lungo periodo, definendo un trattamento iniziale (terapia di induzione), finalizzato al raggiungimento della remissione della malattia, e uno successivo di mantenimento, finalizzato ad aumentare la durata del periodo di remissione.
Sebbene i farmaci biologici anti TNFα approvati (adalimumab, infliximab, etanercept e certolizumab) siano risultati efficaci per il trattamento della PP, è emerso il bisogno di poter disporre di trattamenti più efficaci nel raggiungere e nel mantenere i tassi di risposta nel lungo periodo (18-20). All’interno di questo scenario, è importante sottolineare come la scoperta del pathway immunologico dell’interleuchina (IL)‐23/IL‐17 sia stata la chiave per ampliare le conoscenze sulla patogenesi della psoriasi finalizzata allo sviluppo di target terapeutici (18,21). Il mantenimento della remissione clinica nel tempo e la riduzione degli intervalli di somministrazione costituiscono aspetti importanti per controllare la psoriasi e migliorare la qualità di vita dei pazienti.
Risankizumab è un anticorpo monoclonale umanizzato, costituito da un’immunoglobulina G1 (IgG1), che si lega selettivamente con elevata affinità alla subunità p19 della citochina umana IL-23, senza legarsi a IL-12, e inibisce la sua interazione con il complesso del recettore IL-23 (22). IL-23 è una citochina coinvolta nelle risposte infiammatorie e immunitarie. Bloccando il legame di IL-23 al suo recettore, risankizumab inibisce il segnale cellulare IL-23-dipendente e il rilascio di citochine proinfiammatorie. L’efficacia e la sicurezza di risankizumab nel trattamento della PP da moderata a grave sono state valutate all’interno di un ampio programma di ricerca clinica (studi multicentrici, randomizzati, in doppio cieco) (23-25), tra cui il recente studio IMMerge (1). In quest’ultimo studio, risankizumab ha dimostrato, rispetto a secukinumab, una maggiore efficacia (PASI 90) e un profilo di sicurezza simile, con un dosaggio meno frequente (1).
A fronte di questa comprovata maggiore efficacia, non sono, però, attualmente disponibili valutazioni economiche condotte in ambito nazionale che abbiamo confrontato questi due farmaci nel trattamento della PP da moderata a grave. Con l’obiettivo di colmare questa lacuna, è stata condotta un’analisi per stimare il costo per responder di risankizumab e di secukinumab nel trattamento della PP da moderata a grave, sulla base dei risultati clinici dello studio di confronto diretto IMMerge (1).
Metodi
Premessa
L’analisi di costo per responder di risankizumab e secukinumab è stata condotta considerando la prospettiva del Servizio Sanitario Nazionale (SSN) tramite lo sviluppo di un modello in ambiente Microsoft Excel®. Il costo totale per ciascun farmaco è stato calcolato considerando, nell’analisi principale, una durata di trattamento di 52 settimane e, nell’analisi secondaria, una durata di 16 settimane. Il costo per responder è stato calcolato dividendo il costo totale di trattamento a 52/16 settimane per il relativo dato di efficacia (PASI 90, PASI 100) raccolto nello studio IMMerge (1).
Sebbene risankizumab sia caratterizzato da un minor numero di somministrazioni, in via conservativa, dal momento che entrambi i farmaci vengono somministrati sottocute, non è stato considerato alcun costo incrementale per l’attività di somministrazione. Non sono stati, inoltre, considerati i costi per la gestione degli eventi avversi associati alla terapia farmacologica somministrata, in quanto lo studio IMMerge ha identificato un simile profilo di sicurezza per i due farmaci confrontati (1).
Popolazione
La valutazione economica, in linea con le caratteristiche della popolazione arruolata nello studio IMMerge (1), ha considerato i pazienti adulti che, alla visita al basale, avevano diagnosi di psoriasi a placche cronica da moderata a grave con o senza artrite psoriasica da almeno 6 mesi e che erano candidati alla terapia sistemica. I pazienti arruolati presentavano almeno il 10% di superficie corporea coperta da placche di psoriasi, un punteggio static Physician’s Global Assessment (sPGA) ≥3 e un PASI ≥12 allo screening e al basale.
Dati clinici
I dati di efficacia, su cui poggia la presente analisi, si riferiscono a quanto raccolto dallo studio multicentrico di fase III IMMerge, in cui 327 pazienti adulti con PP da moderata a grave sono stati randomizzati (rapporto 1:1) a ricevere risankizumab 150 mg (n = 164) o secukinumab 300 mg (n = 163) (1).
Lo studio ha valutato due endpoint primari di efficacia: i) la percentuale di pazienti che raggiungono un PASI 90 (miglioramento clinico ≥90%) rispetto al basale a 16 settimane per valutare la non inferiorità di risankizumab vs secukinumab e ii) la percentuale di pazienti che raggiungono un PASI 90 rispetto al basale a 52 settimane per valutare la superiorità di risankizumab vs secukinumab (1). Altri endpoint secondari sono stati valutati a 52 settimane. In ordine di importanza sono la percentuale di pazienti che raggiungono un PASI 100 rispetto al basale, la percentuale di pazienti che raggiungono un punteggio sPGA di 0 o 1 (tale punteggio valuta lo spessore medio, l’eritema e il ridimensionamento di tutte le lesioni psoriasiche, con valori che vanno da 0, pelle libera da lesioni, a 4, psoriasi grave) (26) e la percentuale di pazienti che raggiungono un PASI 75 rispetto al basale; tutti questi endpoint secondari sono stati valutati per misurare la superiorità di risankizumab vs secukinumab (1). La Tabella I riporta il dettaglio dei risultati dello studio IMMerge considerati nella presente analisi (1). Nello specifico, l’analisi principale ha considerato quali indicatori di efficacia il PASI 90 e il PASI 100 a 52 settimane, perché entrambi sono stati valutati nello studio IMMerge per misurare la superiorità di risankizumab vs secukinumab e perché entrambi rappresentano gli endpoint a cui l’esito di un trattamento farmacologico dovrebbe tendere nella PP. Per completezza, è stata condotta anche un’analisi secondaria valutando il PASI 90 a 16 settimane, sebbene quest’ultimo sia stato indagato nello studio IMMerge per valutare la non inferiorità di risankizumab vs secukinumab.
| Endpoint | Risankizumab
(no = 164) |
Secukinumab
(no = 163) |
p |
|---|---|---|---|
| Endpoint primari | |||
| – PASI 90 a 52 settimane | 86,60% | 57,10% | p < 0,001 |
| – PASI 90 a 16 settimane | 73,80% | 65,60% | n.v. |
| Endpoint secondari | |||
| – PASI 100 a 52 settimane | 65,90% | 39,90% | p < 0,001 |
n.v. = non valutato
Orizzonte temporale
In linea con la durata di trattamento osservata nello studio IMMerge (1), l’analisi principale del costo per responder è stata condotta lungo un orizzonte temporale di un anno (risultati a 52 settimane), ritenendolo più che sufficiente per rilevare le differenze più significative in termini sia di efficacia (PASI 90 e PASI 100) sia di costo di trattamento tra risankizumab e secukinumab. Dal momento che, sulla base di quanto indicato dai rispettivi riassunti delle caratteristiche di prodotto (RCP) (22,27), i due farmaci qui considerati presentano uno schema posologico che differisce tra periodo di induzione (inizio terapia) e mantenimento, è stato calcolato un duplice costo per responder: il primo riferito al primo anno di trattamento (induzione + mantenimento) e il secondo riferito, invece, al secondo anno di trattamento (mantenimento). Questo secondo scenario è sicuramente caratterizzato da un limite rispetto al primo, in quanto lo studio IMMerge non presenta dati oltre il primo anno di trattamento, per cui è stato necessario ipotizzare che i risultati di efficacia di risankizumab e secukinumab rimanessero costanti nel tempo e, quindi, uguali a quelli del primo anno di trattamento. Tale considerazione è stata fatta sulla base delle indicazioni di alcune analisi che hanno valutato il mantenimento della risposta clinica dei due farmaci (25,28,29). Ciò è stato fatto nell’ottica di fornire ai decisori un ulteriore elemento di supporto nei processi decisionali. Seguendo questa stessa logica, ovvero fornire più informazioni possibili ai decisori, l’analisi secondaria ha calcolato il costo per responder (PASI 90) a 16 settimane (fase di induzione).
Schema di somministrazione
In riferimento all’analisi principale e in linea con quanto riportato dal disegno dello studio IMMerge (1), lo schema di somministrazione adottato per i due trattamenti nel primo anno di osservazione prevede la fase di induzione seguita da quella di mantenimento. Nel secondo anno di osservazione è stata, invece, considerata per entrambi i farmaci la sola fase di mantenimento, ipotizzando, sulla base di quanto indicato dal disegno dello studio IMMerge (1), una somministrazione (150 mg) ogni 12 settimane per risankizumab e una somministrazione (300 mg) ogni 4 settimane per secukinumab.
Nell’analisi secondaria, sempre sulla base del disegno dello studio IMMerge (1), sono stati considerati i dosaggi e il numero di somministrazioni per la sola fase di induzione (16 settimane). La Tabella II riporta nel dettaglio gli schemi posologici considerati. In via conservativa, per ciascun farmaco, è stata considerata un’aderenza al trattamento del 100%.
Costo di acquisizione dei farmaci considerati
La valorizzazione dei consumi di secukinumab è stata fatta considerando il prezzo ex-factory al netto degli sconti temporanei di legge (Determinazione AIFA del 3 luglio 2006, GU no 156 del 7 luglio 2006, e successiva Determinazione AIFA del 9 febbraio 2007, GU no 57 del 9 marzo 2007 e proroghe), ma al lordo di eventuali sconti confidenziali o di scontistiche applicate in sede di gara regionale. Nell’analisi, è stato, quindi, utilizzato un prezzo di € 947,63 per la confezione di 2 penne da 150 mg (Determinazione del 25 maggio 2016, GU no 133 del 9 giugno 2016). La valorizzazione dei consumi di risankizumab è stata fatta considerando il prezzo ex-factory al netto di uno solo dei due sconti temporanei di legge (Determinazione AIFA del 3 luglio 2006, GU no 156 del 7 luglio 2006, e successiva Determinazione AIFA del 9 febbraio 2007, GU no 57 del 9 marzo 2007 e proroghe), poiché l’azienda titolare dell’AIC (Autorizzazione all’Immissione in Commercio) ha aderito all’istituto del pay-back 5% relativo alla spesa farmaceutica, che consente all’azienda farmaceutica di chiedere all’AIFA (Agenzia Italiana del Farmaco) la sospensione della riduzione del prezzo del 5% per le specialità medicinali di cui è titolare dietro versamento (pay-back) del relativo controvalore su appositi conti correnti indicati dalle Regioni (30). Tale prezzo ex-factory, come fatto per secukinumab, è, però, al lordo di eventuali sconti confidenziali o di scontistiche applicate in sede di gara regionale. Nell’analisi, è stato, quindi, utilizzato un prezzo di € 3.230,00 per la confezione di 2 siringhe da 75 mg.
| Farmaco | Posologia | No somministrazioni anno/16 settimane |
|---|---|---|
| Primo anno (induzione + mantenimento) (1) | ||
| Risankizumab | Dose iniziale di 150 mg da somministrare alla settimana 0 e alla settimana 4, seguita da una dose di mantenimento ogni 12 settimane. Ogni dose da 150 mg viene somministrata in due iniezioni sottocutanee da 75 mg | 5 |
| Secukinumab | Dose iniziale di 300 mg alle settimane 0, 1, 2, 3 e 4, seguita da un dosaggio di mantenimento di 300 mg ogni 4 settimane. Ogni dose da 300 mg viene somministrata in due iniezioni sottocutanee da 150 mg | 16 |
| Secondo anno (mantenimento) (1) | ||
| Risankizumab | Dose di 150 mg ogni 12 settimane. Ogni dose da 150 mg viene somministrata in due iniezioni sottocutanee da 75 mg | 4,3 |
| Secukinumab | Dose di 300 mg ogni 4 settimane. Ogni dose da 300 mg viene somministrata in due iniezioni sottocutanee da 150 mg | 13 |
| 16 settimane (induzione) (1) | ||
| Risankizumab | Dose iniziale di 150 mg da somministrare alla settimana 0 e alla settimana 4, seguita da una dose di mantenimento ogni 12 settimane. Ogni dose da 150 mg viene somministrata in due iniezioni sottocutanee da 75 mg | 2 |
| Secukinumab | Dose iniziale di 300 mg alle settimane 0, 1, 2, 3 e 4, seguita da un dosaggio di mantenimento di 300 mg ogni 4 settimane. Ogni dose da 300 mg viene somministrata in due iniezioni sottocutanee da 150 mg | 7 |
Analisi di sensibilità
Al fine di esplorare il grado di incertezza dei risultati dell’analisi principale (analisi a 52 settimane), nonché di validarne la robustezza, è stata condotta un’analisi di sensibilità deterministica (31), focalizzata sulla variabile chiave dell’analisi, ovvero i dati di efficacia stimati dallo studio IMMerge (1). Sono stati, così, ricalcolati i risultati dell’analisi principale per risankizumab e secukinumab, sostituendo i valori di efficacia a 52 settimane (PASI 90 e 100) stimati dallo studio IMMerge (1) con quelli calcolati, sempre a 52 settimane, da due recenti Network Meta-Analysis (NMA) condotte con l’obiettivo di valutare l’efficacia dei trattamenti nella PP da moderata a grave, di cui la Tabella III sintetizza i principali risultati (32,33).
| Endpoint a 52 settimane | Risankizumab | Secukinumab |
|---|---|---|
| Armstrong et al. (26) | ||
| – PASI 90 | 79,4% | 71,3% |
| – PASI 100 | 56,2% | 42,4% |
| Yasmeen et al. (27) | ||
| – PASI 90 | 82,8% | 66,8% |
| – PASI 100 | 61,1% | 40,9% |
Infine, dal momento che quello considerato nell’analisi potrebbe non riflettere l’attuale prezzo di cessione dei due farmaci alle strutture sanitarie, in quanto potrebbero essere praticati degli sconti confidenziali, è stata condotta un’analisi di scenario finalizzata a stimare l’impatto sul costo per responder di alcune ipotesi di sconto sul prezzo di risankizumab e secukinumab. Nello specifico, è stato ipotizzato che, per entrambi i farmaci, possano essere praticati degli ulteriori sconti compresi tra l’1% e il 35%. L’analisi di scenario, tramite tabelle a matrice, ha considerato tutte le possibili combinazioni di sconto per i due trattamenti in riferimento all’indice PASI 90 e 100, nel primo e nel secondo anno di trattamento, e all’indice PASI 90 a 16 settimane di trattamento.
Risultati
Analisi principale
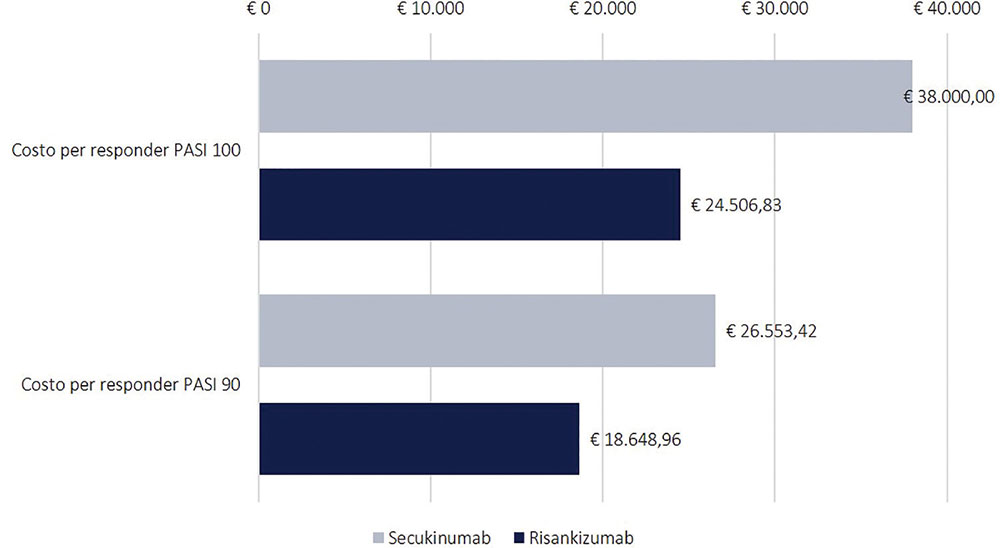
La Figura 1 mostra i risultati dell’analisi di costo per responder per il primo anno di trattamento, ovvero in riferimento allo schema posologico che prevede la fase di induzione seguita da quella di mantenimento. Il costo per responder calcolato rispetto all’indice PASI 90 è risultato di € 18.648,96 per risankizumab e di € 26.553,56 per secukinumab, con una differenza di € 7.904,45, mentre quello calcolato rispetto all’indice PASI 100 è risultato di € 24.506,83 per risankizumab e di € 38.000,00 per secukinumab, con una differenza di € 13.493,17 (Fig. 1).
La Figura 2 illustra, invece, i risultati dell’analisi per il secondo anno di trattamento, in questo caso riferita alla sola fase di mantenimento. Risankizumab determina in tutti i confronti il minor costo per responder. Rispetto all’indice PASI 90, il costo per responder di risankizumab è risultato di € 16.038,11 mentre quello di secukinumab di € 21.574,76, con una differenza di € 5.536,54. Il costo per responder calcolato rispetto all’indice PASI 100 è risultato di € 21.075,87 per risankizumab e di € 30.875,16 per secukinumab, con una differenza di € 9.799,13 (Fig. 2).
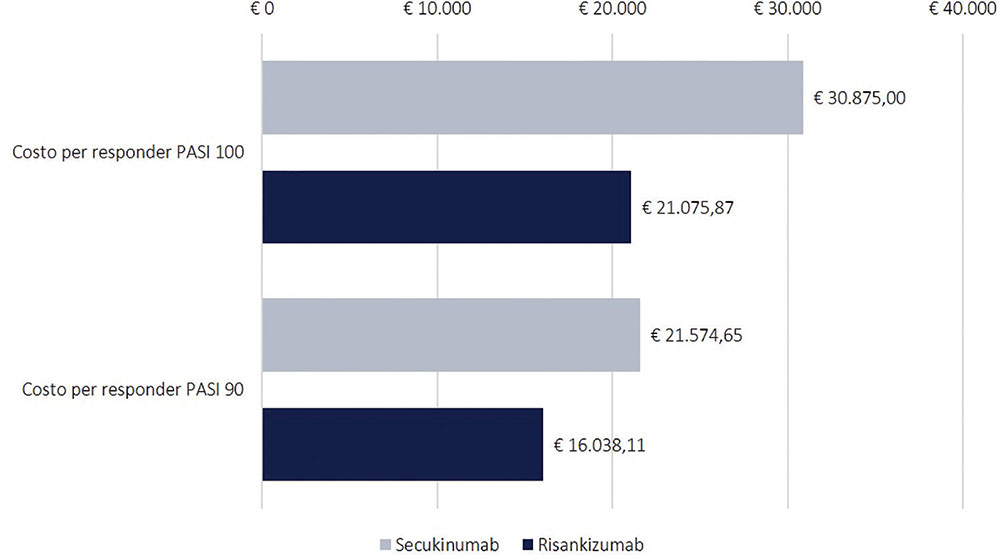
I risultati dell’analisi principale suggeriscono come, al raggiungimento di tassi di clearance cutanea maggiori, cresca anche la differenza del costo per responder a favore di risankizumab, in virtù di una maggiore efficacia evidenziata.
Analisi secondaria
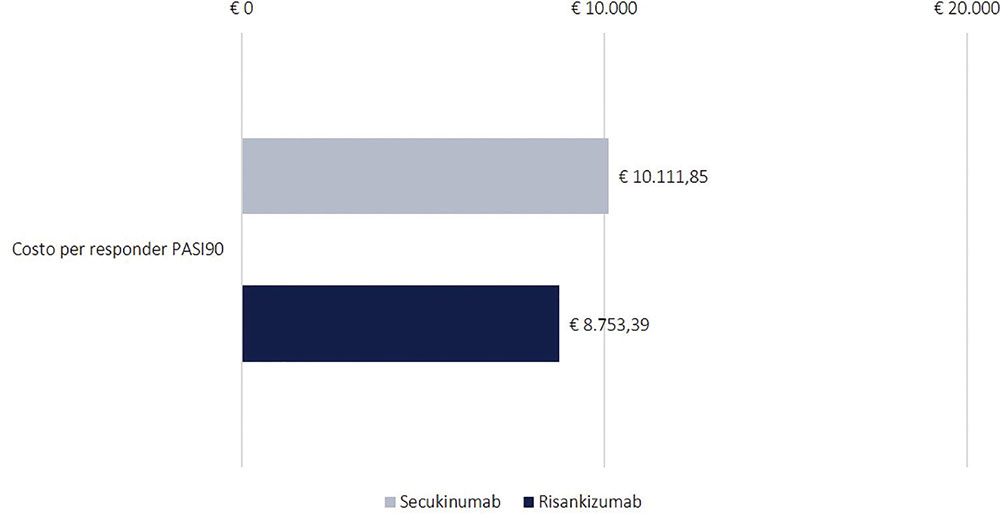
La Figura 3 mostra i risultati dell’analisi di costo per responder a 16 settimane, ovvero per la sola fase di induzione. Il costo per responder dei due farmaci è stato calcolato rispetto al solo indice PASI 90. Anche in questo confronto, risankizumab evidenzia il minor costo per responder (risankizumab: € 8.753,39; secukinumab: € 10.111,85) con una differenza di € 1.358,46 (Fig. 3).
Analisi di sensibilità
La Tabella IV riporta i risultati dell’analisi di sensibilità condotta utilizzando i dati di efficacia delle due NMA considerate (31,32). Fatta eccezione per il costo per responder PASI 90 riferito al secondo anno (induzione + mantenimento) calcolato sulla base dei dati della NMA condotta da Armstrong et al. (32), nella totalità dei confronti risankizumab rimane sempre l’alternativa con il minor costo per responder. Anche questi risultati suggeriscono come, all’aumentare della clearance clinica, cresca la differenza del costo per responder a favore di risankizumab.
I risultati dell’analisi di scenario, finalizzata a stimare l’impatto di alcune ipotesi di sconto adottate per il calcolo del costo per responder di risankizumab e secukinumab, sono riportati nelle Tabelle V-IX. Considerando l’indice PASI 90 e tutte le possibili combinazioni di sconto, nel primo e nel secondo anno di trattamento, la probabilità che il costo per responder di risankizumab sia inferiore a quello di secukinumab è del 97,9% (Tab. V) e del 94,6% (Tab. VI), rispettivamente. Considerando, invece, l’indice PASI 100 e tutte le possibili combinazioni di sconto, nel primo e nel secondo anno di trattamento, la probabilità che il costo per responder di risankizumab sia inferiore a quello di secukinumab è del 100% (Tab. VII) e del 99,1% (Tab. VIII), rispettivamente. Considerando, infine, l’indice PASI 90 e tutte le possibili combinazioni di sconto, a 16 settimane di trattamento la probabilità che il costo per responder di risankizumab sia inferiore a quello di secukinumab è del 77,5% (Tab. IX).
| Risankizumab | Secukinumab | Δ Risankizumab vs Secukinumab | |
|---|---|---|---|
| Armstrong et al. (26) | |||
| Primo anno (induzione + mantenimento) | |||
| Costo per responder PASI 90 | € 20.340,05 | € 21.265,19 | -€ 925,03 |
| Costo per responder PASI 100 | € 28.736,65 | € 35.759,62 | -€ 7.022,78 |
| Secondo anno (mantenimento) | |||
| Costo per responder PASI 90 | € 17.492,44 | € 17.277,97 | € 214,57 |
| Costo per responder PASI 100 | € 24.713,52 | € 29.054,69 | -€ 4.341,02 |
| Yasmeen et al. (27) | |||
| Primo anno (induzione + mantenimento) | |||
| Costo per responder PASI 90 | € 19.504,83 | € 22.697,72 | -€ 3.192,77 |
| Costo per responder PASI 100 | € 26.432,08 | € 37.070,90 | -€ 10.638,83 |
| Secondo anno (mantenimento) | |||
| Costo per responder PASI 90 | € 16.774,15 | € 18.441,80 | -€ 1.667,65 |
| Costo per responder PASI 100 | € 22.731,59 | € 30.120,11 | -€ 7.388,52 |
Discussione
I progressi ottenuti nella gestione della PP, dovuti allo sviluppo e all’approvazione di nuovi farmaci biologici, tra cui risankizumab (rimborsato dall’Agenzia Italiana del Farmaco a Marzo 2020, Determinazione AIFA del 21 Febbraio 2020, GU no 54 del 03 marzo 2020), hanno determinato, per i decisori, la necessità di disporre di analisi economiche comparative quali il costo per responder in grado di combinare la dimensione sia clinica sia economica del confronto. I risultati dell’analisi principale e secondaria hanno mostrato che, in virtù di una maggiore efficacia (PASI 90 e 100), risankizumab determina in tutti i confronti il minor costo per responder rispetto a secukinumab e come, all’aumentare della clearance clinica, cresca anche la differenza del costo per responder a favore di risankizumab.
L’analisi del costo per responder si è basata sui risultati clinici dello studio IMMerge, che ha valutato l’efficacia dei due farmaci nel trattamento della PP da moderata a grave (1). L’aver potuto utilizzare uno studio di confronto diretto costituisce, senza ombra di dubbio, un punto di forza della presente analisi, peccato, però, che non sia stato possibile riscontrare i nostri risultati con quelli di altre esperienze nazionali. In quest’ottica, ovvero di validazione dei risultati, sono state, perciò, condotte un’analisi di sensibilità e un’analisi di scenario; la prima finalizzata a riscontrare la dimensione clinica e la seconda quella economica.
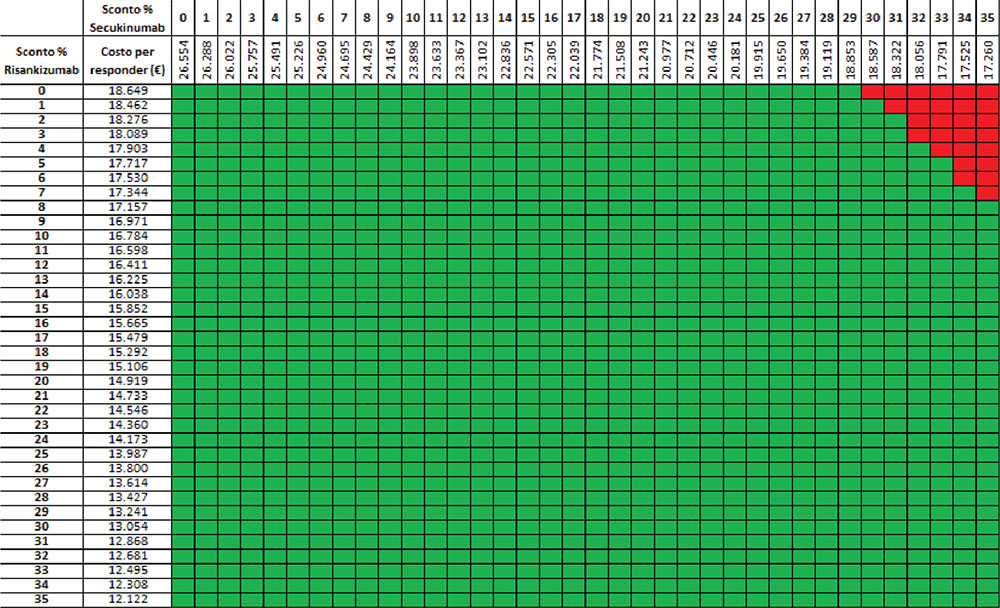
verde = costo per responder di risankizumab < costo per responder di secukinumab; rosso = costo per responder di risankizumab > costo per responder di secukinumab.
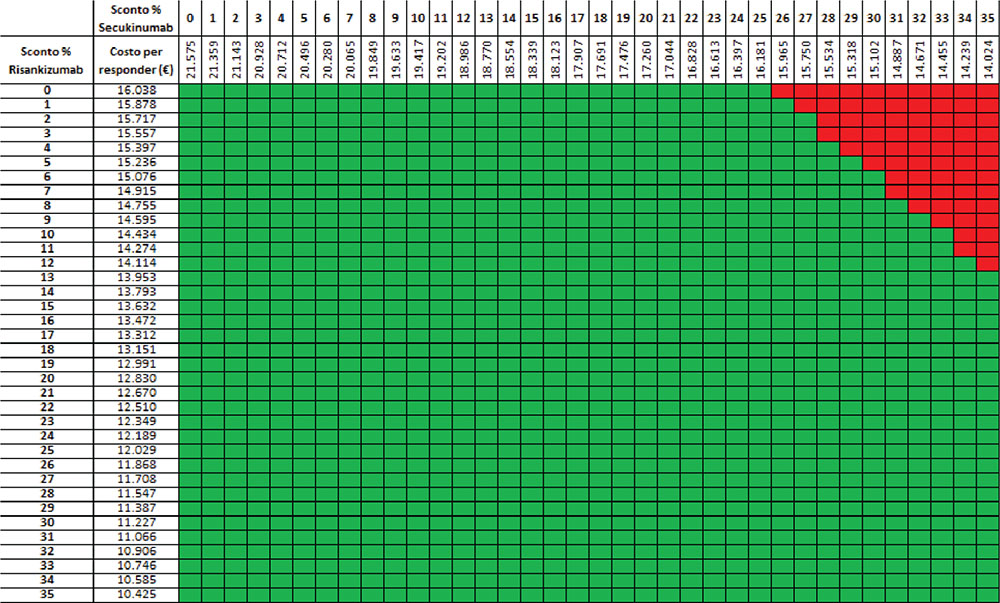
verde = costo per responder di risankizumab < costo per responder di secukinumab; rosso = costo per responder di risankizumab > costo per responder di secukinumab.

verde = costo per responder di risankizumab < costo per responder di secukinumab; rosso = costo per responder di risankizumab > costo per responder di secukinumab.

verde = costo per responder di risankizumab < costo per responder di secukinumab; rosso = costo per responder di risankizumab > costo per responder di secukinumab.

verde = costo per responder di risankizumab < costo per responder di secukinumab; rosso = costo per responder di risankizumab > costo per responder di secukinumab.
La dimensione clinica è stata esaminata sostituendo i dati di efficacia dello studio IMMerge con quelli di due NMA che hanno valutato l’efficacia di secukinumab e risankizumab nel trattamento di pazienti con PP da moderata a grave, confermando la maggiore efficacia di risankizumab. Fatta eccezione per il costo per responder PASI 90 riferito al secondo anno di trattamento, calcolato sulla base dei dati della NMA condotta da Armstrong et al. (32), in tutti i confronti dell’analisi di sensibilità risankizumab determina sempre il minor costo per responder, confermando anche la correlazione tra aumento della clearance e aumento della differenza di costo per responder. L’analisi di scenario è stata, invece, condotta cercando di valutare l’impatto di eventuali scontistiche applicate ai prezzi dei due farmaci, in quanto il prezzo ex-factory al netto delle riduzioni temporanee di legge potrebbe non riflettere l’attuale prezzo di cessione praticato alle strutture sanitarie. Così facendo, è stata ipotizzata per entrambi gli IL-I (inibitori delle interleuchine) una scontistica compresa tra l’1% e il 35%, in funzione della quale l’analisi di scenario ha valutato tutte le possibili combinazioni in termini di costo per responder. Nel primo e nel secondo anno di trattamento, la probabilità che il costo per responder di risankizumab calcolato sul PASI 90 sia inferiore a quello di secukinumab è del 97,9% e del 94,6%, rispettivamente, mentre, con riferimento al PASI 100, la probabilità che il costo per responder di risankizumab sia inferiore a quello di secukinumab è del 100% nel primo anno e del 99,1% nel secondo anno. Quindi, anche a fronte di significative riduzioni del prezzo di secukinumab, risankizumab rimarrebbe l’alternativa costo-efficace.
Un punto di debolezza della presente analisi è imputabile alla considerazione adottata per condurre il confronto nel secondo anno di trattamento, vale a dire l’ipotesi che i tassi di risposta stimati dallo studio IMMerge a 52 settimane rimanessero costanti nel tempo e, quindi, estrapolabili anche al secondo anno di trattamento. Tale considerazione è stata fatta sulla base delle indicazioni di alcune analisi che hanno valutato il mantenimento della risposta clinica dei due farmaci. Tutte le analisi riguardanti risankizumab ne hanno confermato il mantenimento del profilo di efficacia e di sicurezza nel lungo periodo (anche oltre i 3 anni di osservazione) (25,28,29), mentre quelle riferite a secukinumab non sempre hanno riportato risultati concordi, evidenziando, in alcuni casi, una riduzione dell’efficacia già dopo la fase di induzione (1,34-36). Sembrerebbe, quindi, possibile ritenere che l’estrapolazione a due anni dei risultati a 52 settimane dello studio IMMerge non abbia, di fatto, privilegiato risankizumab nel confronto con secukinumab. Si ricorda, infine, che tale considerazione è stata fatta non con una specifica finalità clinica, ma con l’obiettivo di fornire un dato economico comparativo che non fosse limitato al solo primo anno (induzione più mantenimento), ma che coprisse anche il secondo anno di trattamento (mantenimento), così da supportare al meglio i decisori nella definizione dei budget di spesa con un orizzonte temporale più ampio. È, tuttavia, auspicabile poter confermare i risultati del secondo anno di trattamento grazie a future evidenze di confronto diretto provenienti da analisi di real world condotte nel contesto sanitario italiano. Queste analisi potrebbero fornire anche indicazioni su aspetti che non sono stati presi in considerazione in questa sede, quali compliance, persistenza al trattamento e riduzione o aumento dei dosaggi.
Dalla presente analisi sono stati esclusi i costi correlati alla gestione di eventuali eventi avversi associati al trattamento somministrato, poiché lo studio di riferimento non ha evidenziato significative differenze tra i due farmaci (1). In via conservativa, sono stati esclusi anche i costi associati alla somministrazione; rimane, però, da sottolineare come, sia nel primo che nel secondo anno di trattamento, il numero di somministrazioni di risankizumab sia sensibilmente inferiore a quello di secukinumab, aspetto che, oltre a determinare un minor consumo di risorse sanitarie (anche se minimo), determina anche un minor impatto organizzativo a carico della struttura ospedaliera erogante la prestazione, impatto che si riflette anche sui pazienti. Infatti, secondo un recente studio condotto somministrando a 426 pazienti con PP da moderata a grave (di cui 163 soggetti naive al trattamento con biologico e 263 soggetti già trattati o in trattamento con biologico) un questionario sull’esperienza con i trattamenti farmacologici e sulla preferenza per le diverse frequenze di somministrazione, circa il 70% del campione ha espresso una preferenza verso uno schema posologico con un intervallo di somministrazione di 12 settimane tra una dose e la successiva, rispetto alle somministrazioni settimanali o bisettimanali (37).
Conclusioni
I risultati della presente analisi suggeriscono come, nella prospettiva del SSN, risankizumab presenti un costo per responder inferiore rispetto a secukinumab nel trattamento di pazienti adulti con PP da moderata a grave. Analisi di questo tipo possono essere utili per i decisori al fine di comprendere come ottimizzare il trattamento di questi pazienti, riducendo al minimo eventuali sprechi di budget.
Disclosures
Conflict of interest: Gisondi P, Loconsole F, Raimondo P and Ravasio R declare that they have no conflicts of interest in this research. Gisondi P is an advisory board member and speaker for and/or has received honoraria or grants from Abbvie, Almirall, Amgen, Janssen, Leo-pharma, Eli Lilly, Novartis, Pierre Fabre, Sandoz, Sanofi, UCB.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Warren RB, Blauvelt A, Poulin Y, et al. Efficacy and safety of risankizumab vs. secukinumab in patients with moderate-to-severe plaque psoriasis (IMMerge): results from a phase III, randomized, open-label, efficacy-assessor-blinded clinical trial. Br J Dermatol. 2021;184(1):50-59. CrossRef PubMed
- 2. Di Meglio P, Villanova F, Nestle FO. Psoriasis. Cold Spring Harb Perspect Med. 2014;4(8):a015354. CrossRef PubMed
- 3. Boehncke WH, Schön MP. Psoriasis. Lancet. 2015;386(9997):983-994. CrossRef PubMed
- 4. Nair RP, Stuart PE, Nistor I, et al. Sequence and haplotype analysis supports HLA-C as the psoriasis susceptibility 1 gene. Am J Hum Genet. 2006;78(5):827-851. CrossRef PubMed
- 5. Mui UN, Patel RR, Vangipuram R, Tyring SK. Tildrakizumab for Moderate-to-Severe Plaque Psoriasis. Skin Therapy Lett. 2019;24(6):1-4. PubMed
- 6. Kurd SK, Troxel AB, Crits-Christoph P, Gelfand JM. The risk of depression, anxiety, and suicidality in patients with psoriasis: a population-based cohort study. Arch Dermatol. 2010;146(8):891-895. PubMed
- 7. Ni C, Chiu MW. Psoriasis and comorbidities: links and risks. Clin Cosmet Investig Dermatol. 2014;7:119-132. PubMed
- 8. Parisi R, Symmons DP, Griffiths CE, Ashcroft DM; Identification and Management of Psoriasis and Associated ComorbidiTy (IMPACT) project team. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol. 2013;133(2):377-385. CrossRef PubMed
- 9. Gelfand JM, Troxel AB, Lewis JD, et al. The risk of mortality in patients with psoriasis: results from a population-based study. Arch Dermatol. 2007;143(12):1493-1499. CrossRef PubMed
- 10. Pezzolo E, Cazzaniga S, Colombo P, Chatenoud L, Naldi L. Psoriasis Incidence and Lifetime Prevalence: Suggestion for a Higher Mortality Rate in Older Age-classes among Psoriatic Patients Compared to the General Population in Italy. Acta Derm Venereol. 2019;99(4):400-403. CrossRef PubMed
- 11. Vena GA, Altomare G, Ayala F, et al. Incidence of psoriasis and association with comorbidities in Italy: a 5-year observational study from a national primary care database. Eur J Dermatol. 2010;20(5):593-598. PubMed
- 12. Menter A, Gottlieb A, Feldman SR, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics. J Am Acad Dermatol. 2008;58(5):826-850. CrossRef PubMed
- 13. Icen M, Crowson CS, McEvoy MT, Dann FJ, Gabriel SE, Maradit Kremers H. Trends in incidence of adult-onset psoriasis over three decades: a population-based study. J Am Acad Dermatol. 2009;60(3):394-401. CrossRef PubMed
- 14. Pathirana D, Ormerod AD, Saiag P, et al. European S3-guidelines on the systemic treatment of psoriasis vulgaris. J Eur Acad Dermatol Venereol. 2009;23(suppl 2):1-70. CrossRef PubMed
- 15. Gisondi P, Altomare G, Ayala F, et al. Italian guidelines on the systemic treatments of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 2017;31(5):774-790. CrossRef PubMed
- 16. Naldi L. Scoring and monitoring the severity of psoriasis. What is the preferred method? What is the ideal method? Is PASI passé? facts and controversies. Clin Dermatol. 2010;28(1):67-72. CrossRef PubMed
- 17. Spuls PI, Lecluse LL, Poulsen ML, Bos JD, Stern RS, Nijsten T. How good are clinical severity and outcome measures for psoriasis?: quantitative evaluation in a systematic review. J Invest Dermatol. 2010;130(4):933-943. CrossRef PubMed
- 18. de Carvalho AVE, Duquia RP, Horta BL, Bonamigo RR. Efficacy of immunobiologic and small molecule inhibitor drugs for psoriasis: a systematic review and meta-analysis of randomized clinical trials. Drugs R D. 2017;17(1):29-51. CrossRef PubMed
- 19. Boehncke W-H, Brembilla NC. Unmet needs in the field of psoriasis: pathogenesis and treatment. Clin Rev Allergy Immunol. 2018;55(3):295-311. CrossRef PubMed
- 20. Puig L, Thom H, Mollon P, Tian H, Ramakrishna GS. Clear or almost clear skin improves the quality of life in patients with moderate-to-severe psoriasis: a systematic review and meta-analysis. J Eur Acad Dermatol Venereol. 2017;31(2):213-220. CrossRef PubMed
- 21. Hawkes JE, Chan TC, Krueger JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol. 2017;140(3):645-653. CrossRef PubMed
- 22. Risankizumab RCP. Accesso Marzo 2020. Disponibile su: Online
- 23. Gordon KB, Strober B, Lebwohl M, et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet. 2018;392(10148):650-661. CrossRef PubMed
- 24. Reddy V, Yang EJ, Myers B, Liao W. Clinical evaluation of risankizumab-rzaa in the treatment of plaque psoriasis. J Inflamm Res. 2020;13:53-60. CrossRef PubMed
- 25. Blauvelt A, Leonardi CL, Gooderham M, et al. Efficacy and safety of continuous risankizumab therapy versus treatment withdrawal in patients with moderate to severe plaque psoriasis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156(6):649-658. CrossRef PubMed
- 26. CADTH Common Drug Review. Clinical Review Report: Risankizumab (Skyrizi) (AbbVie) Indication: For the treatment of adult patients with moderate to severe plaque psoriasis who are candidates for systemic therapy or phototherapy. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health. 2019.
- 27. Secukinumab RCP. Accesso Marzo 2020. Disponibile su: Online
- 28. Gooderham M, Pinter A, Zheng J, Zhao Y, Kaufmann C, Strober B. Long-Term, Durable, Absolute Psoriasis Area and Severity Index Improvement of Risankizumab Treatment: An Interim Integrated Analysis of Patients with Moderate-to-Severe Plaque Psoriasis. Abstract 29th European Academy of Dermatology and Venereology 29-31 Oct.
- 29. Elewski B, Rich P, Crowley J, et al. Efficacy and Safety of Long-Term Risankizumab Treatment for Nail, Scalp, and Palmoplantar Psoriasis: An Interim Analysis from the Open-Label Extension LIMMitless Trial. Abstract 29th European Academy of Dermatology and Venereology 29-31 Oct.
- 30. G.U. serie generale n° 154 del 30 giugno 2021.
- 31. AIES. Associazione Italiana di Economia Sanitaria. Proposte di linee guida per la valutazione economica degli interventi sanitari. PharmacoEcon Ital Res Artic. 2009;11(2):89-93.
- 32. Armstrong AW, Puig L, Joshi A, et al. Comparison of biologics and oral treatments for plaque psoriasis. A meta-analysis. JAMA Dermatol. 2020;156(3):258-269. CrossRef PubMed
- 33. Yasmeen N, Sawyer LM, Malottki K, Levin L-A, Apol ED, Jemec GB. Targeted therapies for patients with moderate-to severe psoriasis: a systematic review and network meta-analysis of PASI response at 1 year. J Dermatolog Treat. 2020;1-15. CrossRef PubMed
- 34. Megna M, Di Costanzo L, Argenziano G, et al. Effectiveness and safety of secukinumab in Italian patients with psoriasis: an 84 week, multicenter, retrospective real-world study. Expert Opin Biol Ther. 2019;19(8):855-861. CrossRef PubMed
- 35. Bissonnette R, Luger T, Thaçi D, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate-to-severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol. 2018;32(9):1507-1514. CrossRef PubMed
- 36. Reich K, Armstrong AW, Langley RG, et al. Guselkumab versus secukinumab for the treatment of moderate-to-severe psoriasis (ECLIPSE): results from a phase 3, randomised controlled trial. Lancet. 2019;394(10201):831-839. CrossRef PubMed
- 37. Zhang M, Carter C, Olson WH, et al. Patient Preference for Dosing Frequency Based on Prior Biologic Experience. J Drugs Dermatol. 2017;16(3):220-226. PubMed