 |
Glob Reg Health Technol Assess 2021; 8: 155-167 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2255 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di costo-utilità di evolocumab in pazienti con ASCVD in Italia
Cost-utility analysis of evolocumab in patients with ASCVD in Italy
Objective: The aim of this work was to evaluate the cost-effectiveness of evolocumab in addition to standard statin therapy with or without ezetimibe in the treatment of patients with clinically evident atherosclerotic cardiovascular disease (ASCVD) with levels of LDL-C above 100 mg/dL.
Method: A theoretical cohort of patients was forecast by a Markov model that includes 11 health states for a lifetime horizon. In the base-case, the standard therapy was characterized by statins with or without ezetimibe. Two sub-populations have been considered, Recent MI (Myocardial Infarction in the last year) and Multiple events (population with multiple MI). The results were also presented for a subset of the Multiple events populations consisting of patients who have experienced a myocardial infarction (MI) in the last year.
Results: For the Recent MI and Multiple events populations, ICER values of € 39,547 and € 35,744 respectively were estimated. The value of ICER was lower for the Multiple events with MI < 1 year population (€ 29,949). Considering statins with ezetimibe as standard therapy, ICER values were found to be equal to € 39,781, € 35,986 and € 30,190 respectively for the populations Recent MI, Multiple events and Multiple events with MI < 1 year.
Conclusions: The estimated ICER values for the Recent MI, Multiple events and Multiple events populations with MI < 1 year were below the cost-effectiveness threshold of € 40,000, suggesting therefore how the treatment with evolocumab in addition to the standard therapy can be a cost-effective treatment both compared to standard therapy with statins and standard therapy with statins + ezetimibe.
Keywords: Cardiovascular disease, PCSK9 inhibitors
Received: March 4, 2021
Accepted: July 20, 2021
Published online: November 2, 2021
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’ipercolesterolemia è una malattia del metabolismo lipidico caratterizzata da un aumento anomalo di colesterolo, trigliceridi e lipoproteine nel sangue. Un livello elevato di colesterolo lipoproteico a bassa densità (LDL-C) è stato stabilito come uno dei più importanti fattori di rischio modificabili per la malattia cardiovascolare aterosclerotica (Atherosclerotic Cardiovascular Disease, ASCVD) (1-6).
Nonostante il raggiungimento di notevoli progressi nel trattamento dei pazienti con ASCVD, il burden della malattia risulta elevato a causa del rischio di eventi cardiaci ricorrenti, eventi di ictus e morte cardiovascolare che influiscono sulla qualità della vita del paziente e sui costi (7-13). La riduzione del livello di colesterolo LDL mediante terapie ipolipemizzanti, incluse le statine, permette di ridurre gli eventi cardiovascolari (14,15). Ciononostante, molti pazienti con ASCVD accertata necessitano di un ulteriore abbassamento del livello di colesterolo LDL e rimangono a rischio di eventi cardiovascolari nonostante la terapia ottimale con statine (7,10,15).
Nei pazienti con colesterolo totale o LDL-C non adeguatamente controllati mediante la terapia con sole statine alla dose massimamente tollerata, si utilizza in combinazione ezetimibe. Ezetimibe in monoterapia viene impiegato nei pazienti nei quali le statine non sono tollerate o risultano controindicate. Le riduzioni dei livelli di LDL-C con ezetimibe rispetto al placebo sono modeste e vanno dal 18% al 25% rispettivamente per ezetimibe in monoterapia ed ezetimibe in aggiunta alla terapia con statine (16,17).
L’abbassamento precoce dei livelli di LDL-C risulta particolarmente importante per le persone che sono ad alto rischio di sperimentare un evento cardiovascolare (3,18,19). Tra i soggetti a più alto rischio vi sono i pazienti con un precedente evento cardiovascolare (CV) e i pazienti con ipercolesterolemia familiare (FH), una condizione ereditaria che porta a livelli LDL-C elevati per tutta la vita (20).
Tuttavia, molti pazienti con ASCVD non ottengono un’adeguata riduzione dei livelli di LDL-C nonostante la cura con statine con o senza ezetimibe, rimanendo comunque esposti a un alto rischio di eventi CV fatali e non fatali. Gli anticorpi monoclonali che inibiscono la Proproteina Convertasi Subtilisina/Kexina di tipo 9 (PCSK9) rappresentano un’ulteriore opportunità di trattamento per questi pazienti, in quanto hanno dimostrato riduzioni marcate del livello di colesterolo LDL. Evolocumab e alirocumab rappresentano gli inibitori della PCSK9 a oggi approvati in Italia per il trattamento dell’ipercolesterolemia e per la riduzione del rischio cardiovascolare, specialmente per quei pazienti che non risultano adeguatamente controllati con l’attuale standard di cura o con la dose massima tollerata di statine con o senza ezetimibe. Entrambi gli inibitori della PCSK9 hanno dimostrato riduzioni significative del LDL-C nei pazienti ad alto rischio CV (21-23) e rappresentano opzioni efficaci come terapie aggiuntive alle statine o come monoterapie in coloro che non sono in grado di tollerare le statine.
Evolocumab è un anticorpo monoclonale immunoglobulinico G2 completamente umano, che fornisce un’ulteriore opzione di trattamento per i pazienti che non sono in grado di controllare il loro colesterolo alto nonostante le terapie attualmente disponibili; agisce bloccando la proteina PCSK9, che riduce il numero di recettori LDL nel fegato e, attraverso questa azione, ne riduce la capacità di rimuovere il colesterolo LDL dal sangue.
Lo studio clinico FOURIER ha recentemente dimostrato come un ulteriore abbassamento di LDL-C con evolocumab, se usato in aggiunta a statine a elevata o moderata intensità, possa ridurre l’incidenza di eventi CV in pazienti con ASCVD clinicamente evidente (24).
L’obiettivo di questo studio è stato quello di valutare la costo-efficacia di evolocumab in aggiunta alla terapia standard con statine ed ezetimibe nel trattamento di pazienti con malattia cardiovascolare aterosclerotica (ASCVD) clinicamente evidente con livelli di LDL-C superiori a 100 mg/dL non controllati mediante le terapie ipolipemizzanti convenzionali.
Metodi
Struttura del modello
Il modello è stato sviluppato adattando al contesto nazionale un modello di costo-utilità precedentemente pubblicato in letteratura (13,25-31).
Al fine di tenere conto delle differenze nei rischi, nelle utilità e nei costi, il modello di Markov ha previsto i seguenti 11 stati di salute:
stati di salute acuti:
- infarto miocardico (Myocardial Infarction, MI): l’infarto miocardico rappresenta il principale endpoint influenzato dalle terapie ipolipemizzanti (Lipid-Lowering Therapies, LLTs); tale stato di salute copre il primo anno successivo all’evento (fino al 365° giorno successivo all’evento indice);
- ictus ischemico (Ischemic Stroke, IS): in questo stato di salute, che copre il primo anno successivo all’evento (fino al 365° giorno successivo all’evento indice), è stato incluso solo l’ictus ischemico, in quanto la riduzione del livello LDL-C mediante il trattamento con statine ha mostrato una riduzione significativa del rischio di ictus ischemico e un aumento non significativo degli ictus emorragici. Dal momento che è stato affermato che gli eventi clinici che non differiscono statisticamente possono essere trascurati (32), l’ictus emorragico in questo stato di salute non è stato incluso;
- MI 2+ e IS 2+: i pazienti passano a questi stati di salute dopo aver sperimentato due o più MI/IS consecutivi; a questi stati di salute è associato un rischio più elevato di eventi CV;
- altra ASCVD: comprende eventi CV meno gravi (malattia dell’arteria periferica (PAD), angina, attacco ischemico transitorio (TIA), stenosi carotidea, rivascolarizzazione elettiva); stati di salute post-evento:
- post-MI e post-IS: rappresentano gli effetti ongoing di un evento CV dal secondo anno successivo all’evento (dal 366° giorno successivo all’evento indice in poi). Agli stati post-evento corrispondono rischi di ulteriori eventi CV e costi più bassi rispetto agli stati MI e IS (33,34);
- post-MI 2+ e post-IS 2+: rappresentano gli effetti ongoing di un evento CV dal secondo anno dopo l’evento per quei pazienti che hanno avuto due o più MI o IS consecutivi. Come per gli stati acuti MI 2+ e IS 2+, a questi stati è associato un rischio di eventi CV più elevato; mortalità:
- morte CV: morte per qualsiasi causa cardiovascolare;
- morte non CV: morte per altre cause.
Inoltre, al fine di attenuare la caratteristica del modello di Markov che, per sua natura, non conserva la memoria degli eventi precedenti, il modello ha incluso stati di salute compositi, vale a dire stati di salute caratterizzati da una combinazione di due o tre stati di salute post-evento. Trascurare la cronologia degli eventi CV comporterebbe la modellazione di scenari clinicamente non plausibili (per esempio, un paziente con storia di IS avrebbe un valore di utilità aumentato dopo aver sperimentato un infarto miocardico successivo e il passaggio al rispettivo stato di salute post-evento).
Relativamente agli stati di salute compositi, sono state formulate alcune ipotesi:
- il costo dello stato di salute composito è risultato caratterizzato dal costo massimo dei singoli stati di salute che lo compongono;
- l’utilità di uno stato di salute composito è stata definita considerando il valore più basso delle utilità associate ai singoli stati di salute;
- il tasso di eventi CV al baseline è stato aggiustato sulla base della cronologia degli eventi CV sperimentati.
La Figura 1 mostra una rappresentazione semplificata del modello (senza gli stati di salute compositi).
Il modello considera cicli della durata di un anno e questo risulta in linea con la durata del ciclo più spesso riportata nelle valutazioni economiche condotte sulle terapie ipolipemizzanti (20). Ciascun paziente durante l’anno può effettuare una sola transizione da uno stato all’altro, dunque non può sperimentare più di un evento CV all’anno. Tuttavia, non vi è alcun limite al numero di eventi che è possibile sperimentare nel corso della vita. Il tracciato di Markov è stato, inoltre, corretto a metà ciclo (Half-Cycle Correction) (35); si è considerato, dunque, che gli eventi CV che si verificano in qualsiasi ciclo annuale avvengano a metà anno.
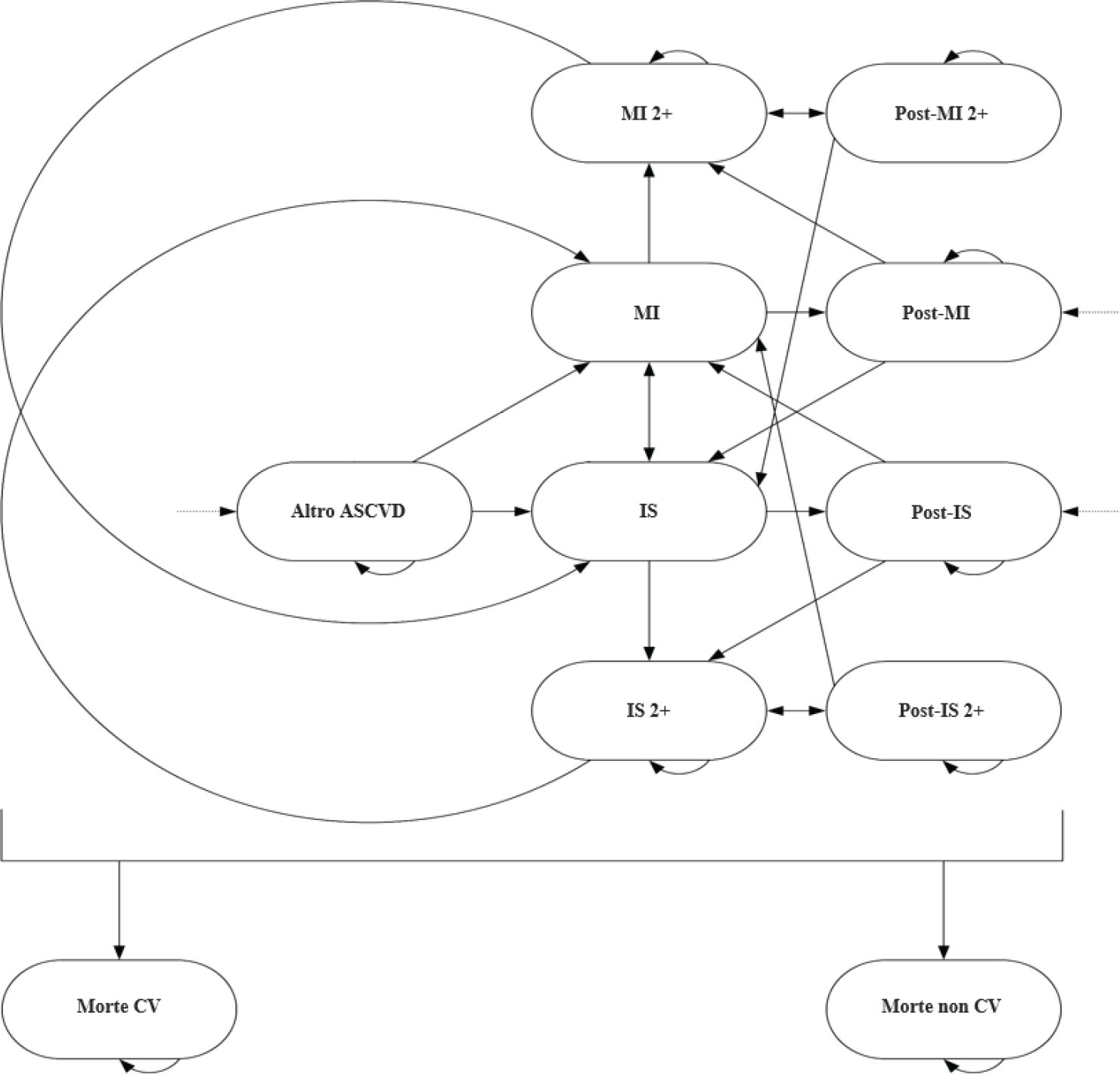
Fig. 1 - Struttura del modello. ASCVD: atherosclerotic cardiovascular disease; CV: cardiovascular disease; IS: ischemic stroke; MI: myocardial infarction; RV: revascularization.
Durante qualsiasi ciclo, a seguito di un evento CV, i pazienti possono transitare allo stato di salute post-evento corrispondente, a meno che non si verifichino eventi CV uguali o diversi. I pazienti non possono tornare allo stato di salute “altra ASCVD” dopo un MI o un IS. La transizione a morte per evento CV e a morte per altre cause è possibile da ogni stato di salute.
Popolazione e parametri epidemiologici
La popolazione inclusa nell’analisi è costituita da pazienti a rischio molto elevato di eventi CV, quindi con un livello di LDL-C non controllato dalla dose massima tollerata di statine con o senza ezetimibe. Il controllo è definito come concentrazioni di LDL-C a digiuno ≥ 100 mg/dL.
Nello specifico, sono stati considerati due popolazioni e un sottogruppo:
- Recent MI: pazienti che hanno sperimentato un evento recente di infarto del miocardio nell’ultimo anno; tutti i pazienti appartenenti a questa popolazione entrano nel modello a partire dallo stato di salute “Recent MI”;
- Multiple events (popolazione con MI multipli): pazienti che hanno sperimentato più di un evento cardiovascolare tra quelli presenti nel modello di Markov precedentemente descritto. Tutti i pazienti appartenenti a questa popolazione entrano nel modello a partire dallo stato di salute “Post-MI 2+”, al fine di prendere in considerazione il maggior rischio a cui sono sottoposti i pazienti che hanno sperimentato eventi multipli;
- Multiple events con MI < 1 anno: pazienti che hanno sperimentato più di un evento cardiovascolare e un infarto del miocardio nell’ultimo anno. Al fine di considerare un aumento del rischio per i pazienti che hanno sperimentato più eventi, tutti i pazienti appartenenti a questa popolazione entrano nel modello a partire dallo stato di salute “Post-MI 2+”; a questi pazienti è stato applicato un tasso più alto al primo anno, al fine di considerare un rischio aumentato per l’anno successivo all’evento.
Nei pazienti con ipercolesterolemia, le Linee Guida raccomandano l’utilizzo di statine come terapia di prima linea; le statine possono essere somministrate in dosaggi variabili, secondo la gravità dell’ipercolesterolemia da cui è affetto il paziente, fino alla dose massima tollerata (Maximally Tolerated Dose, MTD) (3,18). Per i pazienti ad alto rischio di eventi CV è raccomandata la prescrizione di statine ad alta intensità (19). La terapia con statine viene, dunque, definita terapia ipolipemizzante (LLT) di base, alla quale può essere aggiunta la terapia con evolocumab.
All’interno della presente analisi, tutti i pazienti ricevono statine in background. Secondo la distribuzione riportata da Sciattella et al., il 49,4% dei pazienti riceve statine ad alta intensità, mentre il rimanente 50,6% riceve statine da bassa a moderata intensità. Nell’analisi del caso base, la terapia standard è stata caratterizzata dalle statine con o senza ezetimibe, considerando che ezetimibe venga somministrato al 4,4% dei pazienti; nell’analisi di scenario, la terapia standard è stata caratterizzata dalle statine con ezetimibe, considerando, dunque, che ezetimibe venga somministrato al 100% dei pazienti (25) (Tab. I).
I dati epidemiologici inseriti nel modello sono stati selezionati in parte dalla letteratura, in particolare dal lavoro di Sciattella et al. (36), nel quale, attraverso un’analisi condotta sui database amministrativi della regione Marche e dell’ASL 2 della regione Umbria, è stata selezionata una popolazione con età compresa tra i 18 e gli 80 anni con uno o più ricoveri per sindrome coronarica acuta (SCA), ictus ischemico (IS)/attacco ischemico transitorio o malattia dell’arteria periferica (Peripheral Arterial Disease, PAD), che è stata dimessa tra il 2009 e il 2012 (Marche) o tra il 2011 e il 2014 (ASL Umbria 2).
Il modello considera un’età media pari a 67,1 anni e una proporzione di pazienti di sesso femminile pari al 28,5% (stime ottenute dal lavoro di Sciattella et al. (36)). Il livello medio di LDL-C presente nel lavoro di Sciattella et al. non era applicabile alla popolazione oggetto di studio, in quanto prendeva in considerazione anche pazienti con un livello di LDL-C inferiore a 70 e compreso tra 70 e 100, con solo il 22,8% dei pazienti che presentava un livello di LDL-C superiore a 100. Il livello medio di LDL-C è stato, dunque, reperito in letteratura, in particolare dallo studio di Degli Esposti et al. (37), che riportava un livello medio di LDL-C pari a 123,6 mg/dL per i pazienti con LDL-C superiore a 100 mg/dL.
Per quanto riguarda il tasso annuale di ASCVD al baseline, al fine di considerare il maggior rischio associato al primo anno, il modello ha considerato diversi tassi per il primo anno e per gli anni successivi. Per la popolazione Recent MI, tali tassi sono stati stimati aggiustando le stime effettuate nel lavoro di Sciattella et al., al fine di includere la mortalità per evento CV; l’aggiustamento è stato effettuato considerando la mortalità per evento CV stimata nel lavoro di Lindh et al. per la coorte di pazienti con MI (30) e risultata pari al 42%. A seguito dell’aggiustamento, i tassi annuali di eventi cardiovascolari sono risultati pari al 24,2 per 100 anni-paziente il primo anno e pari al 5,9 per 100 anni-paziente per gli anni successivi (Tab. I) per una coorte di pazienti con età media pari a 68,4 e un livello medio di LDL-C pari a 123,61 mg/dL.
Relativamente alla popolazione Multiple events, i tassi di evento cardiovascolare maggiore al primo anno e per gli anni successivi sono stati ottenuti dal lavoro di Hagström et al. (38) e sono risultati rispettivamente pari al 47,1 per 100 anni-paziente e al 10,6 per 100 anni-paziente (Tab. I) per una coorte di pazienti con età media pari a 72,05 e un livello medio di LDL-C pari a 96,67 mg/dL. Il tasso più elevato e relativo al primo anno (47,1) è stato applicato solo al sottogruppo di pazienti con eventi multipli, uno dei quali avvenuto nell’ultimo anno.
| Recent MI, LDL-C > 100 | Multiple events, LDL-C > 100 | Fonte | |
|---|---|---|---|
| Caratteristiche popolazione | |||
| Età (media, anni) | 67,1 | 67,1 | (36) |
| Femmine | 28,5% | 28,5% | (36) |
| LDL-c (mg/dL) (media) | 123,607 | 123,607 | (37) |
| Definizione dello standard di cura | |||
| Statine ad alta intensità | 49,4% | 49,4% | (36) |
| Statine a media intensità | 50,6% | 50,6% | (36) |
| Ezetimibe (caso base) | 4,4% | 4,4% | (36) |
| Ezetimibe (analisi di scenario) | 100% | 100% | Stima |
| Tasso di eventi cardiovascolari al baselineb | |||
| Tasso annuale per 100 anni-paziente (primo anno) | 24,2 | 47,1a | (30, 36), (38) |
| Tasso annuale per 100 anni-paziente (anni successivi) | 5,94 | 10,6 | (30, 36), (38) |
| Riduzione LDL-C | |||
| Evolocumab | 59% | 59% | (24) |
aIl tasso più elevato e relativo al primo anno è stato applicato solamente al sottogruppo di pazienti con Multiple events e MI nell’ultimo anno.
bTassi di eventi cardiovascolari al baseline sono stati aggiustati per l’età e per il livello di LDL-C.
Le caratteristiche della popolazione oggetto di analisi sono riassunte nella Tabella I.
Il tasso annuo di eventi cardiovascolari è stato successivamente aggiustato per l’età e per il livello di LDL-C, utilizzando gli hazard ratios (HRs) riportati nella Tabella II e il rischio relativo (RR) per mmol/L di riduzione pari a 0,78 e ottenuto dalla CTTC (14). Per tenere conto del gradiente di rischio crescente generato dagli eventi cardiovascolari singoli e ricorrenti, il tasso di ASCVD aggiustato per età e livello di LDL-C è stato, inoltre, aggiustato per l’effetto della presenza di eventi cardiovascolari singoli o ricorrenti mediante gli hazard ratios riportati nella Tabella II.
| HR (64) | |
|---|---|
| MACE nell’ultimo anno | 1,29 |
| 1 precedente MI | 1,13 |
| 1 precedente IS | 1,13 |
| 2+ precedenti MI | 1,19 |
| 2+ precedenti IS | 1,36 |
| Precedente MI e oASCVD | 1,31 |
| Precedente IS e oASCVD | 1,40 |
| Precedente MI e IS | 1,94 |
| Precedente MI, IS e oASCVD | 1,94 |
| Età | 1,06 |
MACE: major adverse cardiovascular events.
Mortalità
È stato considerato che la mortalità per cause diverse da malattia cardiovascolare sia la stessa di quella della popolazione generale (Tavole di mortalità nazionali anno 2019 (39)). La mortalità dovuta a malattia cardiovascolare è stata modellata separatamente come conseguenza di eventi CV incidenti, utilizzando la percentuale di decessi attribuibile a malattia cardiovascolare dai dati spagnoli (40) applicati alla mortalità della popolazione generale italiana per ottenere la mortalità per evento CV a livello nazionale.
Riduzione degli eventi cardiovascolari
L’associazione tra la riduzione degli eventi CV e l’abbassamento dei livelli di LDL-C è stata dimostrata in numerosi studi (14,41,42); questo risultato è stato riscontrato sia per le statine (43,44) sia per le non-statine (15, 45-48). La recente dichiarazione di consenso dell’European Atherosclerosis Society (EAS) ha stabilito che il LDL-C non è semplicemente un biomarcatore di rischio aumentato ma un fattore causale nella fisiopatologia della CVD (6).
Le meta-analisi condotte dalla Cholesterol Treatment Trialists’ Collaboration (CTTC) (14) forniscono misure relative che sono espressione del cambiamento nei tassi di eventi CV in relazione a una riduzione assoluta dei livelli di LDL-C.
Raggruppando i 26 studi condotti sulle statine (per un totale di 169.138 individui con un follow-up mediano di 4,9 anni), il rischio relativo per qualsiasi evento cardiovascolare maggiore (definito come morte per Coronary Heart Disease (CHD), MI non fatale, ictus, rivascolarizzazione) per 1 mmol/L di riduzione di LDL-C è risultato pari a 0,78 (IC al 95%: da 0,76 a 0,80) (14).
Per quanto riguarda la riduzione dei livelli di LDL-C, lo studio FOURIER condotto su 27.564 pazienti ha dimostrato che il trattamento con evolocumab ha comportato una riduzione significativamente maggiore del LDL-C rispetto al placebo e questa riduzione è stata mantenuta nel tempo (24). A 48 settimane, la riduzione percentuale media nei livelli di LDL-C con evolocumab, rispetto al placebo, è risultata pari al 59% (IC al 95%: dal 58% al 60%; p < 0,001) (24). Allo stesso modo, nello studio di estensione randomizzato in aperto OSLER-1 (49) sono state osservate riduzioni sostenute di LDL-C a 5 anni dal trattamento con evolocumab, suggerendo, dunque, che gli effetti positivi di evolocumab persistono nel trattamento a lungo termine. A fronte di questo risultato, nel modello è stato dunque assunto che la riduzione del tasso di eventi CV e l’abbassamento del livello di LDL-C alla settimana 48 potessero rimanere costanti nell’orizzonte temporale considerato nel modello.
Dal momento che i risultati dello studio FOURIER (dopo aver tenuto conto della riduzione di LDL-C e della durata dello studio) risultano coerenti con i risultati degli studi CTTC, per le analisi del caso base sono stati considerati, per l’effetto del trattamento, i tassi osservati nelle meta-analisi condotte dalla CTTC (14).
La Tabella III illustra la riduzione degli eventi CV per 1 mmol/L di riduzione del livello di LDL-C.
Valori di utilità
I valori di utilità associati a ciascuno stato di salute derivano da uno studio condotto nel Regno Unito (50), nel quale sono stati intervistati 200 pazienti che avevano avuto uno o più eventi di ictus, sindrome coronarica acuta (SCA) o insufficienza cardiaca. Attraverso le interviste ai pazienti, sono state stimate le utilità associate all’evento e al suo impatto immediato e le utilità associate al post evento. Nel presente studio, i valori associati all’evento acuto sono da intendersi come riferiti all’arco temporale che va dall’evento sino a un anno dopo (esattamente fino al 365° giorno dopo l’evento), mentre i valori associati al post evento si riferiscono al periodo dopo il primo anno dall’evento, dunque dal 366° giorno in poi.
Le utilità ottenute da Matza et al. (50) risultano coerenti con le utilità presenti in studi precedentemente pubblicati. Per esempio, un’utilità di 0,52 che rappresenta gli effetti post evento di un ictus moderato si trova approssimativamente nel mezzo dell’intervallo di utilità (0,12-0,81) per l’ictus moderato riportato in uno studio precedente (51).
In letteratura, non sono presenti dati di utilità riferiti al contesto italiano e, quindi, idonei alla nostra analisi, ma i dati presenti nello studio di Cesaro et al. (52) sull’impatto degli inibitori del PCSK9 sulla qualità di vita dei pazienti ad alto rischio cardiovascolare sono coerenti con quelli di Matza et al.; il lavoro di Cesaro et al. ha stimato un’utilità associata all’evento cardiovascolare di 0,49 e un’utilità pari a 0,85 per il post evento. Tuttavia, i valori stimati facevano riferimento al paziente con evento cardiovascolare senza specificare quali eventi avessero sperimentato i pazienti, dunque le stime di Cesaro et al. sono state ricalibrate a partire da quelle presenti in Matza et al., al fine di ottenere un valore di utilità per l’infarto miocardico e un valore di utilità per l’ictus ischemico. Nella Tabella IV sono riportati i valori di utilità associati a ciascuno stato di salute.
Costi
I costi degli eventi cardiovascolari impiegati nel modello sono riportati nella Tabella V. Per alcune voci di costo, è stata effettuata una stima relativa al contesto nazionale a partire dal lavoro di Sciattella et al.; in particolare, il costo associato allo stato IS è stato ottenuto considerando la somma del costo dell’ictus ischemico e del costo relativo al primo anno successivo all’evento indice; il costo associato allo stato MI è stato ottenuto considerando la somma del costo dell’evento indice e del costo dell’anno successivo associato ad ACS, mentre il costo associato allo stato other ASCVD è stato ottenuto considerando il costo relativo all’anno successivo all’evento indice stimato per la PAD.
| Evento | Utilità | Fonte |
|---|---|---|
| MI | 0,66 | (50, 52) |
| IS | 0,32 | (50, 52) |
| Post-MI | 0,82 | (50) |
| Post-IS | 0,52 | (50) |
| oASCVD | 0,82 | Assunto uguale allo stato di Post-MI |
| Post-IS+Post-MI | 0,52 | Assunto uguale allo stato Post-IS |
| oASCVD+Post-MI | 0,82 | Assunto uguale allo stato Post-MI |
| oASCVD+Post-IS | 0,52 | Assunto uguale allo stato Post-IS |
| oASCVD+Post-IS+Post-MI | 0,52 | Assunto uguale allo stato Post-IS |
| MI+Post-IS | 0,66 | Assunto uguale allo stato MI |
| IS+Post-MI | 0,32 | Assunto uguale allo stato IS |
| MI+oASCVD | 0,66 | Assunto uguale allo stato MI |
| IS+oASCVD | 0,32 | Assunto uguale allo stato IS |
| MI2+ | 0,66 | Assunto uguale allo stato MI |
| Post-MI2+ | 0,82 | Assunto uguale allo stato Post-MI |
| IS2+ | 0,32 | Assunto uguale allo stato IS |
| Post-IS2+ | 0,52 | Assunto uguale allo stato Post-IS |
| MI+Post-IS+oASCVD | 0,66 | Assunto uguale allo stato MI |
| Post-MI+IS+oASCVD | 0,32 | Assunto uguale allo stato IS |
Per gli stati di salute post MI e post IS è stato, invece, considerato il costo relativo al secondo anno dopo l’evento indice, inteso come costo dal 366° giorno dopo l’evento.
| Stato di salute | Costo | Note | Fonte |
|---|---|---|---|
| MI | € 14.005 | Costo ACS da Sciattella et al. (evento indice + 1 anno dopo evento indice) | (36) |
| IS | € 8.178 | Costo IS da Sciattella et al. (evento indice + 1 anno dopo evento indice) | |
| Post-MI | € 3.470 | Costo ACS da Sciattella et al. (2° anno dopo evento indice) | |
| Post-IS | € 3.377 | Costo IS da Sciattella et al. (2° anno dopo evento indice) | |
| oASCVD | € 4.726 | Costo PAD da Sciattella et al. 2019 (2° anno dopo evento indice) | |
| MI2+ | € 14.005 | Stimato uguale a MI | Stima |
| IS2+ | € 8.178 | Stimato uguale a IS | |
| Post-MI2+ | € 3.470 | Stimato uguale a post-MI | Stima |
| Post-IS2+ | € 3.377 | Stimato uguale a post-IS | |
| Post-IS+Post-MI | € 3.470 | Calcolato considerando il costo massimo tra post-MI e post-IS | Calcolato |
| oASCVD+Post-MI | € 4.726 | Calcolato considerando il costo massimo tra oASCVD e post-MI | |
| oASCVD+Post-IS | € 4.726 | Calcolato considerando il costo massimo tra oASCVD e post-IS | |
| oASCVD+Post-IS+Post-MI | € 4.726 | Calcolato considerando il costo massimo tra oASCVD, post-IS e post-MI | |
| Morte cardiovascolare | € 4.018 | DRG 123 Malattia cardiovascolare con infarto miocardico acuto, morti | DRG |
Per le rimanenti voci di costo è stata effettuata un’analisi del database amministrativo delle Schede di Dimissione Ospedaliera (SDO) della regione Marche e dell’ASL 2 della regione Umbria, selezionando la stessa popolazione considerata in Sciattella et al., quindi pazienti con età compresa tra i 18 e gli 80 anni, con uno o più ricoveri per sindrome coronarica acuta (SCA), ictus ischemico (IS)/attacco ischemico transitorio o malattia dell’arteria periferica (PAD), che sono stati dimessi tra il 2009 e il 2012 (Marche) o tra il 2011 e il 2014 (Umbria 2), al fine di ottenere, anche in questo caso, dati relativi al contesto nazionale.
Allo stato Morte è stato associato il costo relativo al DRG 123 (malattia cardiovascolare con infarto miocardico acuto, morti).
Infine, il costo degli stati di salute compositi è stato calcolato come media tra i costi riferiti a ciascun singolo stato.
I costi relativi ai trattamenti sono stati stimati attraverso le liste di trasparenza e rimborsabilità AIFA al 15.05.2018 (53) e attraverso Farmadati Italia (54); i prezzi dei trattamenti considerati nell’analisi risultano al netto delle riduzioni di legge e al netto degli sconti confidenziali. Nella Tabella VI è riportato il costo annuo per paziente trattato con evolocumab, con ezetimibe e con le statine (da bassa a moderata intensità e alta intensità).
Analisi economica
L’analisi è stata condotta secondo la prospettiva del Servizio Sanitario Nazionale (SSN); non sono stati inclusi i costi indiretti, in quanto l’età media della popolazione considerata ai fini dell’analisi è pari a 67 anni (36), dunque superiore all’età pensionabile. Dal momento che l’ipercolesterolemia è una condizione cronica, al fine di cogliere pienamente l’impatto dei decessi per eventi CV e le conseguenze a lungo termine di eventi CV non fatali, costi e outcome sono stati valutati considerando un orizzonte temporale lifetime a partire dall’età media della popolazione. Sia i costi che gli outcome sono stati scontati a un tasso del 3% annuo, come comunemente considerato in analisi di questo genere (55).
All’interno del modello, la durata del trattamento è stata considerata lifetime, mentre i tassi di persistenza della terapia con evolocumab nel tempo sono stati basati su quelli osservati nello studio clinico FOURIER per i primi 3 anni di follow-up (24).
Analisi di sensibilità
Al fine di considerare la variabilità intrinseca dei dati utilizzati nel modello, è stata condotta un’analisi di sensitività deterministica a una via (One-way Deterministic Sensitivity Analysis, DSA), con la quale viene fatto variare un parametro di input alla volta in funzione della variabilità presente in letteratura o, laddove non disponibile, stabilita dagli autori, al fine di valutare l’impatto di ciascun parametro sui risultati dell’analisi. Per i parametri per i quali non fosse presente in letteratura una misura della variabilità, è stata considerata una variabilità del 10%. I risultati della DSA sono stati rappresentati mediante il grafico tornado.
È stata, inoltre, condotta un’analisi di sensitività probabilistica (Probabilistic Sensitivity Analysis, PSA), nella quale, a differenza della DSA, tutti i parametri di input vengono fatti variare contemporaneamente. Infine, sono state condotte 1.000 simulazioni Montecarlo, al fine di generare la curva di accettabilità di costo-efficacia (Cost Effectiveness Acceptability Curve, CEAC), la quale esprime la probabilità di costo-efficacia di evolocumab (rispetto alla SoC) in base alla disponibilità a pagare del SSN. Le simulazioni effettuate sono rappresentate nel piano di costo-efficacia. L’analisi ha tenuto conto di una soglia di disponibilità a pagare pari a € 40.000 (55) e del seguente intervallo di confidenza relativamente alle probabilità di costo-efficacia: (2,5%, 97,5%).
Sono state, inoltre, condotte delle analisi di scenario per il confronto di evolocumab con le statine ed ezetimibe.
Risultati
In entrambe le popolazioni considerate nell’analisi del caso base, il trattamento con evolocumab in aggiunta allo standard di cura rispetto alla Standard of Care con statine con o senza ezetimibe ha comportato un incremento dei costi (pari a € 38.277 per la popolazione Recent MI e pari a € 33.432 per la popolazione Multiple events) e dei QALYs (pari a 0,97 QALYs per la popolazione Recent MI e pari a 0,94 QALYs per la popolazione Multiple events); tali incrementi hanno restituito un valore dell’ICER pari a € 39.547 per la popolazione Recent MI (Tab. VII) e pari a € 35.744 per la popolazione Multiple events (Tab. VIII).
| SoC [A] | Evolocumab + SoC [B] | Differenza [∆ = B-A] | ICER | |
|---|---|---|---|---|
| Costi totali | € 38.277 | – | ||
| QALYs | 6,58 | 7,55 | 0,97 | € 39.547 |
| SoC [A] | Evolocumab + SoC [B] | Differenza [∆ = B-A] | ICER | |
|---|---|---|---|---|
| Costi totali | € 33.432 | |||
| QALYs | 5,65 | 6,58 | 0,94 | € 35.744 |
Considerando il sottogruppo della popolazione Multiple events costituito dai pazienti che hanno sperimentato un infarto miocardico nell’ultimo anno, l’analisi ha restituito un ICER pari a € 29.949 (Tab. IX), dunque più basso rispetto alla popolazione di cui il sottogruppo fa parte, in quanto corrispondente a un minore incremento dei costi (€ 31.322) e a un maggiore incremento dei QALYs (+1,05).
| SoC [A] | Evolocumab + SoC [B] | Differenza [∆ = B-A] | ICER | |
|---|---|---|---|---|
| Costi totali | € 31.322 | |||
| QALYs | 4,97 | 6,01 | 1,05 | € 29.949 |
La Tabella X riporta i risultati delle analisi di scenario condotte per la valutazione dell’analisi di costo-efficacia di evolocumab in aggiunta a statine ed ezetimibe. Anche in questo caso, tutti i valori di ICER stimati sono risultati al di sotto della soglia di disponibilità a pagare pari a € 40.000, con il sottogruppo della popolazione Multiple events costituito dai pazienti che hanno sperimentato un infarto miocardico nell’ultimo anno a cui corrisponde il valore di ICER più basso.
| Recent MI | Multiple events | Multiple events (MI <1 anno) | |
|---|---|---|---|
| ICER per QALY | € 39.781 | € 35.986 | € 30.190 |
Osservando i risultati dell’analisi di sensibilità deterministica condotta per ciascuna popolazione oggetto di analisi (Fig. 2), è possibile osservare come il parametro che maggiormente è risultato impattare sui risultati sia stato caratterizzato dall’effetto della riduzione dei livelli di LDL-C, ottenuta grazie al trattamento con evolocumab, sui tassi di IS per le popolazioni Recent MI e Multiple events MI < 1 anno e dall’utilità associata allo stato di salute Post-MI per la popolazione Multiple events.
La curva di accettabilità di costo-efficacia (CEAC) generata dall’analisi di sensibilità probabilistica mostra come, considerando una soglia di disponibilità a pagare pari a € 40.000, la probabilità di costo-efficacia di evolocumab in aggiunta alla terapia standard con o senza ezetimibe sia risultata pari a circa il 51%, l’84% e il 99% rispettivamente per la popolazione Recent MI, Multiple events e Multiple events MI < 1 anno (Fig. 3).
Considerando una probabilità del 95% di essere costo-efficaci, la disponibilità a pagare si stima in un range pari a circa € 33.600-49.600, € 30.400-44.800 ed € 25.600-36.800 rispettivamente per la popolazione Recent MI, Multiple events e Multiple events MI < 1 anno.
Discussione
A seguito della notifica di esistenza di una correlazione positiva tra elevato livello di colesterolo e malattie cardiovascolari, la riduzione del livello di colesterolo lipoproteico a bassa densità (LDL-C) nei pazienti ad alto rischio cardiovascolare ha dimostrato di essere un’importante strategia terapeutica al fine di ridurre il rischio di eventi cardiovascolari (56).
Accanto alle modifiche dello stile di vita e delle abitudini alimentari, sono molteplici i farmaci mirati al raggiungimento di livelli inferiori di LDL-C nella prevenzione sia primaria che secondaria, come le statine e i sequestranti degli acidi biliari (57-59).
L’efficacia delle statine nel ridurre il livello di LDL-C risulta spesso incompiuta, a causa della mancata aderenza al trattamento, fattore che contribuisce a interrompere la terapia (60,61).
La non aderenza a seguito della terapia con le statine risulta indotta da molteplici fattori, tra cui i più rilevanti risultano essere caratterizzati dalle preoccupazioni circa gli eventi avversi associati al farmaco, l’intolleranza alle statine e la presenza di insufficienza cardiaca e di emodialisi renale (60). Gli inibitori del PCSK9 rappresentano una nuova opportunità per i pazienti per i quali il livello di LDL-C non risulta adeguatamente controllato mediante la terapia con statine alla dose massimamente tollerata. In questo studio, si è tentato di adattare al contesto nazionale un modello economico precedentemente pubblicato (13, 25-31), basato sulla riduzione del rischio di eventi cardiovascolari associata a evolocumab, emersa dallo studio clinico FOURIER, al fine di indagare la costo-efficacia di evolocumab in pazienti con ASCVD clinicamente evidente nel contesto italiano. L’ICER stimato per evolocumab in aggiunta alla terapia standard per le popolazioni Recent MI, Multiple events e Multiple events MI < 1 anno è risultato inferiore rispetto a una soglia di accettabilità di costo-efficacia pari a € 40.000 (rispettivamente pari a € 39.547, a € 35.744 e a € 29.949, quando la terapia standard risulta caratterizzata da statine con o senza ezetimibe, e pari a € 39.781, a € 35.986 e a € 30.190, quando la terapia standard risulta caratterizzata da statine con ezetimibe). Considerando una soglia di accettabilità di costo-efficacia pari a € 40.000 e sulla base delle considerazioni effettuate all’interno del modello, evolocumab in aggiunta alla terapia standard è risultato un’opzione di trattamento costo-efficace in tutte le popolazioni di pazienti considerate sia rispetto alla terapia standard con statine sia rispetto alla terapia standard con statine ed ezetimibe.
Una recente revisione pubblicata nel 2018 che aveva tra gli obiettivi quello di valutare anche il rapporto costo-efficacia di evolocumab in pazienti adulti ad alto rischio cardiovascolare in diversi Paesi europei e negli Stati Uniti ha fatto emergere come le stime di ICER emerse nelle analisi effettuate nei vari Paesi europei risultino un po’ borderline rispetto alle soglie di disponibilità a pagare stabilite in ciascun Paese (60).
Per la Spagna, l’analisi condotta da Villa et al. (26) ha fatto emergere come evolocumab in associazione con lo standard di cura possa rappresentare un’opzione costo-efficace rispetto allo standard di cura quando impiegato nella prevenzione secondaria di pazienti ad alto rischio cardiovascolare; anche in questo caso, il valore stimato dell’ICER era risultato pari a € 45.340 euro, quindi leggermente al di sopra delle soglie di accettabilità di costo-efficacia presenti in Spagna (€ 30.000-45.000).

Fig. 2 - Grafico tornado. Popolazioni Recent MI (A), Multiple events (B), Multiple events MI < 1 anno (C).
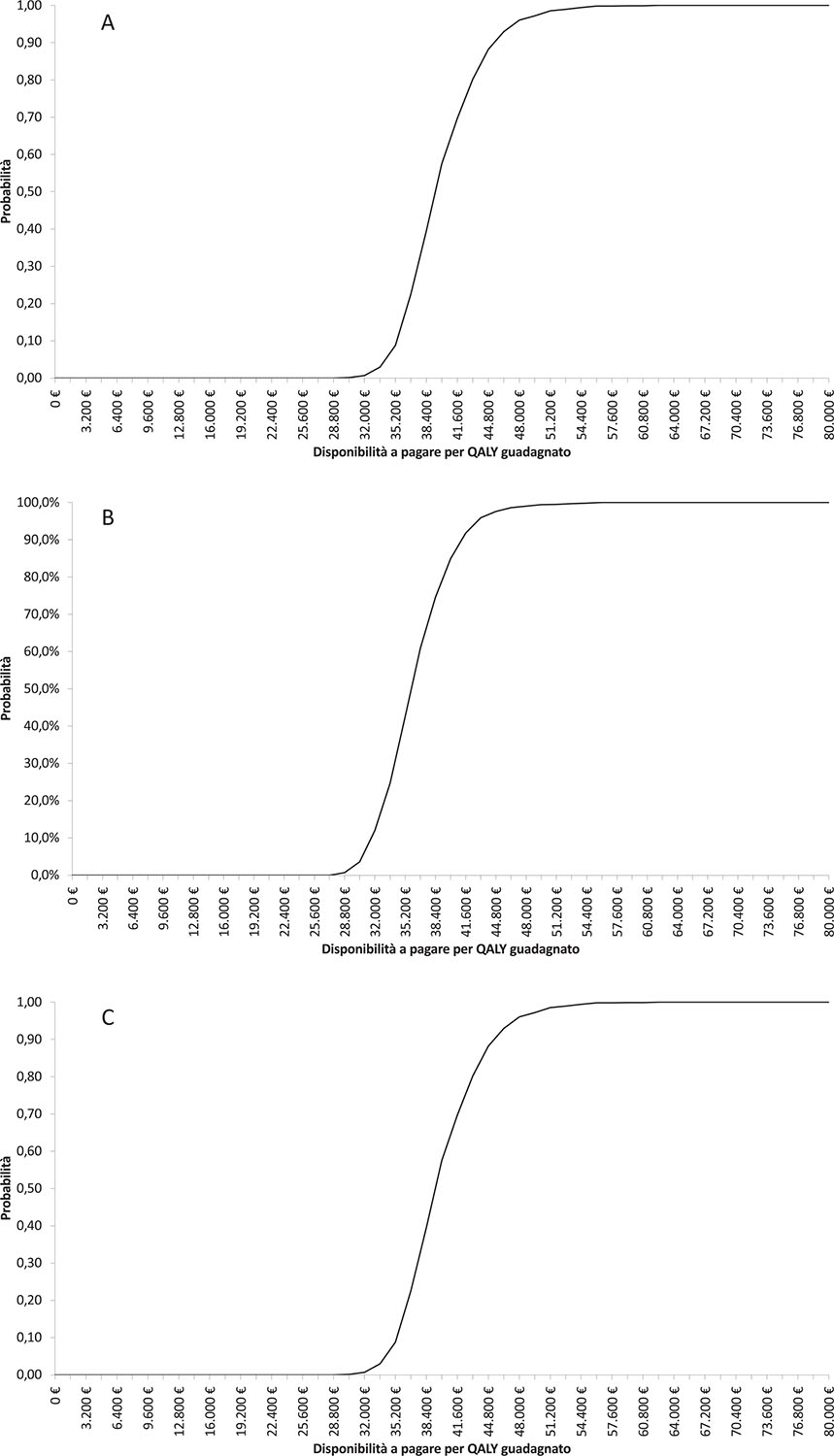
Fig. 3 - Curva di accettabilità di costo-efficacia (CEAC). Popolazioni Recent MI (A), Multiple events (B), Multiple events MI < 1 anno (C).
I risultati di questo studio devono essere interpretati considerando il contesto dei dati di input e le ipotesi impiegate per la modellazione. Gli esiti clinici emersi dallo studio FOURIER erano limitati a un follow-up mediano di 26 mesi, mentre le previsioni di questo modello si basano sul presupposto che i benefici clinici si estendono oltre tale follow-up. Se i livelli di persistenza e di aderenza alla terapia con evolocumab nella pratica clinica differiscono da quelli dello studio FOURIER, questo, ovviamente, potrà avere un impatto sui costi e sull’efficacia di evolocumab. I risultati di questa analisi risultano applicabili solo per i pazienti con ASCVD accertata a livello nazionale e non sono generalizzabili a popolazioni con un rischio di eventi cardiovascolari inferiore o a pazienti al di fuori del contesto nazionale.
Alcune informazioni impiegate ai fini dell’implementazione del modello provengono da studi europei, in quanto, a livello nazionale, non risultavano disponibili (mortalità per evento CV (30), tassi di evento cardiovascolare maggiore al primo anno e per gli anni successivi per la popolazione Multiple events (38), percentuale di decessi attribuibile a malattia cardiovascolare (40), alcuni valori di utilità associati agli stati di salute (50)).
Infine, non esistono, a oggi, valori ufficiali di willingness to pay per QALY guadagnato in Italia. Questo fattore limita la possibilità di individuare le alternative maggiormente costo-efficaci nel contesto nazionale. Tuttavia, alcuni studi propongono valori soglia pari a € 40.000 per QALY (55,62,63), in linea con quanto proposto in altri Paesi.
Conclusioni
Evolocumab ha dimostrato di ridurre significativamente gli eventi cardiovascolari in pazienti con ASVCD clinicamente evidente attraverso l’abbassamento costante e durevole dei livelli di LDL-C. L’analisi ha mostrato come, sulla base di tutte le considerazioni effettuate all’interno del modello, evolocumab, in aggiunta alla terapia standard per le popolazioni Recent MI, Multiple events e Multiple events MI < 1 anno, possa risultare un’opzione di trattamento costo-efficace sia rispetto alla terapia standard con statine sia rispetto alla terapia standard con statine ed ezetimibe.
Disclosures
Conflict of interest: AM, CB, MAR and FSM have no conflict of interest. EA, LM, FS are employees of AMGEN.
Financial support: This paper was supported by an unrestricted grant from AMGEN Italy.
Bibliografia
- 1. Bhatnagar D, Soran H, Durrington PN. Hypercholesterolaemia and its management. BMJ. 2008;337(aug21 1):a993. CrossRef PubMed
- 2. Roth GA, Fihn SD, Mokdad AH, Aekplakorn W, Hasegawa T, Lim SS. High total serum cholesterol, medication coverage and therapeutic control: an analysis of national health examination survey data from eight countries. Bull World Health Organ. 2011;89(2):92-101. CrossRef PubMed
- 3. Catapano AL, Graham I, De Backer G, et al; ESC Scientific Document Group. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J. 2016;37(39):2999-3058. CrossRef PubMed
- 4. Landmesser U, Chapman MJ, Farnier M, et al; European Society of Cardiology (ESC); European Atherosclerosis Society (EAS). European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk. Eur Heart J. 2017;38(29):2245-2255. PubMed
- 5. Goldstein JL, Brown MS. A century of cholesterol and coronaries: from plaques to genes to statins. Cell. 2015;161(1):161-172. CrossRef PubMed
- 6. Ference BA, Ginsberg HN, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459-2472. CrossRef PubMed
- 7. Benjamin EJ, Blaha MJ, Chiuve SE, et al; American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 2017;135(10):e146-e603. CrossRef PubMed
- 8. Davis KL, Meyers J, Zhao Z, McCollam PL, Murakami M. High-Risk Atherosclerotic Cardiovascular Disease in a Real-World Employed Japanese Population: Prevalence, Cardiovascular Event Rates, and Costs. J Atheroscler Thromb. 2015;22(12):1287-1304. CrossRef PubMed
- 9. Henk HJ, Paoli CJ, Gandra SR. A Retrospective Study to Examine Healthcare Costs Related to Cardiovascular Events in Individuals with Hyperlipidemia. Adv Ther. 2015;32(11):1104-1116. CrossRef PubMed
- 10. Jernberg T, Hasvold P, Henriksson M, Hjelm H, Thuresson M, Janzon M. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur Heart J. 2015;36(19):1163-1170. CrossRef PubMed
- 11. Punekar RS, Fox KM, Richhariya A, et al. Burden of First and Recurrent Cardiovascular Events Among Patients With Hyperlipidemia. Clin Cardiol. 2015;38(8):483-491. CrossRef PubMed
- 12. Hallberg S, Gandra SR, Fox KM, et al. Healthcare costs associated with cardiovascular events in patients with hyperlipidemia or prior cardiovascular events: estimates from Swedish population-based register data. Eur J Health Econ. 2016;17(5):591-601. CrossRef PubMed
- 13. Toth PP, Danese M, Villa G, et al. Estimated burden of cardiovascular disease and value-based price range for evolocumab in a high-risk, secondary-prevention population in the US payer context. J Med Econ. 2017;20(6):555-564. CrossRef PubMed
- 14. Baigent C, Blackwell L, Emberson J, et al; Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-1681. CrossRef PubMed
- 15. Cannon CP, Blazing MA, Giugliano RP, et al; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-2397. CrossRef PubMed
- 16. Zetia US Prescribing information. May 16, 2015; Online (Accessed July 2021)
- 17. Merck Sharp and Dohme Limited. Ezetrol 10 mg Tablets. Summary of product characteristics 2012. May 16, 2017]; Online. (Accessed July 2021)
- 18. Stone NJ, Robinson JG, Lichtenstein AH, et al; American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(25)(suppl 2):S1-S45. CrossRef PubMed
- 19. Mach F, Baigent C, Catapano AL, et al; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-188. CrossRef PubMed
- 20. Wei CY, Quek RGW, Villa G, et al. A systematic review of cardiovascular outcomes-based cost-effectiveness analyses of lipid-lowering therapies. Pharmacoeconomics. 2017;35(3):297-318. CrossRef. PubMed.
- 21. Peng W, Qiang F, Peng W, et al. Therapeutic efficacy of PCSK9 monoclonal antibodies in statin-nonresponsive patients with hypercholesterolemia and dyslipidemia: A systematic review and meta-analysis. Int J Cardiol. 2016;222:119-129. CrossRef PubMed
- 22. Gouni-Berthold I, Descamps OS, Fraass U, et al. Systematic review of published Phase 3 data on anti-PCSK9 monoclonal antibodies in patients with hypercholesterolaemia. Br J Clin Pharmacol. 2016;82(6):1412-1443. CrossRef PubMed
- 23. Navarese EP, Kolodziejczak M, Schulze V, et al. Effects of proprotein convertase subtilisin/kexin type 9 antibodies in adults with hypercholesterolemia: A systematic review and meta-analysis. Ann Intern Med. 2015;163(1):40-51. CrossRef PubMed
- 24. Sabatine MS, Giugliano RP, Keech A, et al. Rationale and design of the Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk trial. Am Heart J. 2016;173:94-101. CrossRef PubMed
- 25. Gandra SR, Villa G, Fonarow GC, et al. Cost-Effectiveness of LDL-C Lowering With Evolocumab in Patients With High Cardiovascular Risk in the United States. Clin Cardiol. 2016;39(6):313-320. CrossRef PubMed
- 26. Villa G, Lothgren M, Kutikova L, et al. Cost-effectiveness of Evolocumab in Patients With High Cardiovascular Risk in Spain. Clin Ther. 2017;39(4):771-786.e3. CrossRef PubMed
- 27. Fonarow GC, Keech AC, Pedersen TR, et al. Cost-effectiveness of Evolocumab Therapy for Reducing Cardiovascular Events in Patients With Atherosclerotic Cardiovascular Disease. JAMA Cardiol. 2017;2(10):1069-1078. CrossRef PubMed
- 28. Borissov B, Urbich M, Georgieva B, Tsenov S, Villa G. Cost-effectiveness of evolocumab in treatment of heterozygous familial hypercholesterolaemia in Bulgaria: measuring health benefit by effectively treated patient-years. J Mark Access Health Policy. 2017;5(1):1412753. CrossRef PubMed
- 29. Fonarow GC, van Hout B, Villa G, Arellano J, Lindgren P. Updated Cost-effectiveness Analysis of Evolocumab in Patients With Very High-risk Atherosclerotic Cardiovascular Disease. JAMA Cardiol. 2019;4(7):691-695. CrossRef PubMed
- 30. Lindh M, Banefelt J, Fox KM, et al. Cardiovascular event rates in a high atherosclerotic cardiovascular disease risk population: estimates from Swedish population-based register data. Eur Heart J Qual Care Clin Outcomes. 2019;5(3):225-232. CrossRef PubMed
- 31. Landmesser U, Lindgren P, Hagström E, et al. Cost-effectiveness of PCSK9 inhibition with evolocumab in patients with a history of myocardial infarction in Sweden. Eur Heart J Qual Care Clin Outcomes. 2020;qcaa072. CrossRef PubMed
- 32. Nuijten MJ, Pronk MH, Brorens MJ, et al. Reporting format for economic evaluation. Part II: focus on modelling studies. PharmacoEconomics. 1998;14(3):259-268. CrossRef PubMed
- 33. Ara R, Basarir H, Ward SE. Principles of health economic evaluations of lipid-lowering strategies. Curr Opin Lipidol. 2012;23(4):271-281. CrossRef PubMed
- 34. Ara R and Brazier J. Health related quality of life by age, gender and history of cardiovascular disease: results from the Health Survey for England. HEDS Discussion Paper. (2017). Online.
- 35. Gray AM. Applied Methods of Cost-effectiveness Analysis in Healthcare. Oxford. Oxford University Press; 2010.
- 36. Sciattella P, et al. Rehospitalization due to Cardiovascular Events in Secondary Prevention Patients Treated with Lipid-Lowering Therapies in Italy. In: ISPOR Europe. Denmark: Copenaghen; 2019. CrossRef
- 37. Degli Esposti et al. Ipercolesterolemie familiari e pazienti a rischio cardiovascolare molto alto: analisi dei Real World Data. GIHTAD; 2016;9:2. Online (Accessed July 2021)
- 38. Hagström E et al., Rates of major cardiovascular events in patients with a history of myocardial infarction and additional cardiovascular risk factors: evidence from a Swedish nationwide register-based study. Value in Health, 23, S488–S489. CrossRef
- 39. ISTAT. Tavole di mortalità 2019. Online. (Accessed July 2021)
- 40. Instituto Nacional de Estadística. Tablas de mortalidad. Madrid; 2015. Online (Accessed July 2021)
- 41. LaRosa JC, Grundy SM, Waters DD, et al; Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352(14):1425-1435. CrossRef PubMed
- 42. Law MR, Wald NJ, Thompson SG. By how much and how quickly does reduction in serum cholesterol concentration lower risk of ischaemic heart disease? BMJ. 1994;308(6925):367-372. CrossRef PubMed
- 43. Gould AL, Rossouw JE, Santanello NC, Heyse JF, Furberg CD. Cholesterol reduction yields clinical benefit: impact of statin trials. Circulation. 1998;97(10):946-952. CrossRef PubMed
- 44. Robinson JG, Smith B, Maheshwari N, Schrott H. Pleiotropic effects of statins: benefit beyond cholesterol reduction? A meta-regression analysis. J Am Coll Cardiol. 2005;46(10):1855-1862. CrossRef PubMed
- 45. Collins R, Reith C, Emberson J, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet. 2016;388(10059):2532-2561. CrossRef PubMed
- 46. Buchwald H, Varco RL, Matts JP, et al. Effect of partial ileal bypass surgery on mortality and morbidity from coronary heart disease in patients with hypercholesterolemia. Report of the Program on the Surgical Control of the Hyperlipidemias (POSCH). N Engl J Med. 1990;323(14):946-955. CrossRef PubMed
- 47. Frick MH, Elo O, Haapa K, et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987;317(20):1237-1245. CrossRef PubMed
- 48. Ference BA, Robinson JG, Brook RD, et al. Variation in PCSK9 and HMGCR and Risk of Cardiovascular Disease and Diabetes. N Engl J Med. 2016;375(22):2144-2153. CrossRef PubMed
- 49. Koren, MJ et al., Final report of the OSLER-1 study. Long-term evoloculab for the treatment of hypercholesterolemia. Journal of the American College of Cardiology, 2019;74(17): 2132–2146. CrossRef
- 50. Matza LS, Stewart KD, Gandra SR, et al. Acute and chronic impact of cardiovascular events on health state utilities. BMC Health Serv Res. 2015;15(1):173. CrossRef PubMed
- 51. Tengs TO, Yu M, Luistro E. Health-related quality of life after stroke a comprehensive review. Stroke. 2001;32(4):964-972. CrossRef PubMed
- 52. Cesaro A, Gragnano F, Fimiani F, et al. Impact of PCSK9 inhibitors on the quality of life of patients at high cardiovascular risk. Eur J Prev Cardiol. 2020;27(5):556-558. CrossRef PubMed
- 53. AIFA. Liste di trasparenza. 2018; Online.
- 54. Farmadati Italia S.R.L. 2018; Online.
- 55. Associazione Italiana Economia Sanitaria (AIES). Proposta di Linee-Guida per la valutazione economica degli interventi sanitari. Poilitiche Sanitarie. 2009;10(2):91-99.
- 56. Henry CA, Lyon RA, Ling H. Clinical efficacy and safety of evolocumab for low-density lipoprotein cholesterol reduction. Vasc Health Risk Manag. 2016;12:163-169. PubMed
- 57. Krähenbühl S, Pavik-Mezzour I, von Eckardstein A. Unmet Needs in LDL-C Lowering: When Statins Won’t Do! Drugs. 2016;76(12):1175-1190. CrossRef PubMed
- 58. AIM-HIGH Investigators, Boden WE, Probstfield JL, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365(24):2255-67. CrossRef. PubMed
- 59. Brugts JJ, Yetgin T, Hoeks SE, et al. The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials. BMJ. 2009;338(jun30 1):b2376. CrossRef PubMed
- 60. Janković SM, Tešić D, Anđelković J, Kostić M. Profile of evolocumab and its cost-effectiveness in patients with high cardiovascular risk: literature review. Expert Rev Pharmacoecon Outcomes Res. 2018;18(5):461-474. CrossRef PubMed
- 61. Kiortsis DN, Giral P, Bruckert E, Turpin G. Factors associated with low compliance with lipid-lowering drugs in hyperlipidemic patients. J Clin Pharm Ther. 2000;25(6):445-451. CrossRef PubMed
- 62. Mennini FS, Bianic F, Baio G, et al. Estimating The Cost-Effectiveness Profile Of A Vaccination Programme With A Nine-Valent Hpv Vaccine In Italy. Value Health. 2015;18(7):A457. CrossRef
- 63. Mennini FS, Costa S, Favato G, Picardo M. Anti-HPV vaccination: a review of recent economic data for Italy. Vaccine. 2009;27(suppl 1):A54-A61. CrossRef PubMed
- 64. Danese MD, Permbergon-Ross P, Catterick D, Villa G. Estimation of the increased risk associated with recurrent events or polyvascular atherosclerotic cardiovascular disease in the United Kingdom. Eur J Prev Cardiol. 2020;28(3):335-343. CrossRef PubMed
- 65. Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373(2):123-35. CrossRef. PubMed