 |
Glob Reg Health Technol Assess 2021; 8: 87-95 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2238 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di Budget Impact di ponatinib per il management di pazienti affetti da leucemia mieloide cronica
Budget Impact analysis of ponatinib for the management of patients with chronic myeloid leukemia
Background: The current clinical practice for patients affected by chronic myeloid leukemia (CML) is based on the evaluation of second generation alternatives following therapeutic failure that leads to a lengthening of patients’ management times and a consequent negative impact in terms of quality of life.
Objective: To determine the economic absorption of resources associated to the management of patients with CML in a scenario in which an early recourse to ponatinib is considered as compared with a scenario based on the current Italian clinical practice characterized by a cyclical recourse to the available therapies.
Methods: A Budget Impact model was developed to compare the resources absorbed in the scenarios under assessment considering a 3-year time horizon and the perspective of the Italian National Health Service. Results are expressed in terms of differential resources absorbed in the alternative scenarios.
Results: The increase in the recourse to ponatinib allowed a saving of resources for the Italian NHS over the 3-year time horizon of –€ 1,979,322 (€ 825,104,350 vs € 823,125,028). The parameter affecting the most of the results achieved in the base-case is the monthly cost of bosutinib used as a third-line treatment.
Conclusions: The increase in the recourse to ponatinib in patients affected by CML that failed to respond to a previous pharmacological therapy resulted to be associated to a lower level of resources’ absorption in the Italian NHS allowing to re-allocate health founds to other fields of the care sector ensuring greater sustainability of the system.
Keywords: Budget Impact analysis, Chronic myeloid leukemia, Disease management, Economic evaluation, Ponatinib, TKI
Received: January 31, 2021
Accepted: June 28, 2021
Published online: July 17, 2021
This article includes supplementary material
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Background
La leucemia mieloide cronica (LMC) è una condizione clinica patologica determinata dalla proliferazione monoclonale incontrollata di una sola cellula multipotente colpita dall’evento leucemogeno (1-3). La LMC è una malattia tipicamente multifasica, che esordisce con una fase cronica, spesso asintomatica, durante la quale la marcata proliferazione delle cellule mieloidi si accompagna al mantenimento di una capacità maturativa pressoché intatta. L’incidenza annuale della LMC è pari allo 0,0015% ed è responsabile del 15-20% delle leucemie nell’adulto (1-3). Oltre il 90% dei casi è diagnosticato in fase cronica e ben il 50% delle diagnosi è occasionale. All’esordio, oltre la metà dei pazienti non riferisce sintomi e la patologia viene diagnosticata semplicemente attraverso un emocromo, che evidenzia leucocitosi, eosinofilia e basofilia di grado variabile. In circa un 30% dei casi, si evidenziano trombocitosi e, molto raramente, anemia (1-3). Nel 30-40% dei pazienti affetti, la crisi blastica presenta blasti con caratteristiche fenotipiche linfoidi (4).
Negli ultimi decenni la terapia della LMC ha subito momenti di grande trasformazione, dovuti prima all’introduzione del trapianto di midollo allogenico e, più recentemente, dell’imatinib, inibitore della tirosin-chinasi BCR/ABL, che è considerato il capostipite dei farmaci della cosiddetta target therapy (3). La terapia con imatinib e con gli altri farmaci inibitori delle tirosin-chinasi (TKI) di seconda e terza generazione successivamente sviluppati ha permesso di cambiare radicalmente la prognosi dei pazienti e di portare le aspettative di vita molto vicine a quelle della popolazione generale di pari età (5). L’introduzione dell’imatinib e di altri inibitori di BCR/ABL nella terapia della LMC ha, di fatto, grandemente limitato l’impiego del trapianto di midollo, riservandolo unicamente ai pochi pazienti resistenti a più inibitori o in fase avanzata di malattia (6-8). Nonostante l’indubbia efficacia dell’imatinib, una percentuale significativa di pazienti (30-40%) si dimostra resistente o intollerante (9,10). Nilotinib, dasatinib e bosutinib (i cosiddetti TKI di seconda generazione) si sono dimostrati efficaci nell’indurre una risposta citogenetica completa (CCyR, Complete Cytogenetic Response) in circa il 50% dei pazienti in cui l’imatinib si era dimostrato inefficace. Il ponatinib, considerato un TKI di terza generazione, è il primo TKI attivo nei pazienti LMC che presentano la mutazione T315I (11). Il nilotinib è circa 30 volte più potente di imatinib nell’inibizione di BCR-ABL ed è attivo contro la maggior parte delle mutazioni, a parte la T315I. Le differenze tra nilotinib e imatinib sono state statisticamente significative a tutti i time-point stabiliti, dimostrando che nilotinib anticipa il raggiungimento della remissione molecolare maggiore (MCyR, Major Cytogenetic Response) (12,13). Il dasatinib è un duplice inibitore di SRC/ABL, potente e attivo anche su molte altre chinasi, che si distingue da imatinib e nilotinib per la breve emivita e per la sua capacità di agire sulla forma attivata della proteina BCR-ABL (14-17). Il bosutinib è un doppio inibitore SRC/ABL, che si è dimostrato attivo come seconda, terza o quarta linea in pazienti precedentemente trattati con TKI e che inibisce la maggior parte delle mutazioni resistenti a imatinib, con l’eccezione di T315I e V229L (18). La sua attività su pazienti resistenti o intolleranti a imatinib è stata dimostrata in uno studio di fase II che ha portato, nel 2012, a una sua approvazione per il trattamento della LMC in tutte le fasi in pazienti che abbiano fallito una precedente terapia con TKI (19). Infine, il ponatinib è considerato un inibitore di terza generazione, in quanto è il primo TKI a mostrare attività contro i casi di LMC che presentano la mutazione T315I (20) ed è indicato in pazienti adulti affetti da leucemia mieloide cronica (LMC) in fase cronica, accelerata o blastica resistenti o intolleranti a dasatinib o nilotinib e per i quali il successivo trattamento con imatinib non è clinicamente appropriato o nei quali è stata identificata la mutazione T315I (21). Il dosaggio iniziale di 45 mg/die è consigliato fino al raggiungimento della MCyR e, in seguito, il dosaggio può essere ridotto a 15 mg/die con dose escalation in caso di perdita della risposta (22).
Un’attenta vigilanza del paziente fa sì che i fallimenti terapeutici e le risposte non ottimali vengano identificati precocemente (23). In particolare, è emersa l’importanza prognostica della risposta citogenetica e molecolare a 3 mesi (24-26). L’indicazione a cambiare terapia riguarda tutti i pazienti a cui si adatta la definizione di fallimento terapeutico secondo le raccomandazioni dell’European Leukemia Net (ELN) e, in questo caso, è bene farlo il prima possibile al fine di aumentare le probabilità di successo terapeutico della nuova strategia (11). Le attuali raccomandazioni prevedono un controllo della risposta molecolare ogni tre mesi, fino al raggiungimento della risposta citogenetica, poi ogni 3-6 mesi. Attualmente, tre farmaci (imatinib, nilotinib e dasatinib) sono approvati per il trattamento di prima linea della LMC in fase cronica, mentre bosutinib e ponatinib sono disponibili per il trattamento dei pazienti resistenti e/o intolleranti al trattamento di prima linea.
La scelta dell’inibitore da usare in prima linea è basata sulla valutazione clinica del paziente e include la definizione del rischio alla diagnosi, una valutazione accurata delle comorbidità e la valutazione dell’obiettivo praticabile nel singolo paziente. Quando impiegati come terapia di prima linea, gli inibitori di seconda generazione inducono risposte più precoci e profonde rispetto a imatinib e sono in grado di prevenire una quota consistente di quegli episodi di progressione precoce che possono ancora verificarsi nei primi mesi di trattamento. La maggiore efficacia si accompagna, tuttavia, a un certo aumento delle possibili tossicità a lungo termine (27,28).
Il problema dell’eradicazione completa del clone leucemico e, quindi, della guarigione definitiva è un problema molto attuale e aperto (29,30). La possibilità di usare diversi TKI, capaci di ottenere una risposta molecolare più rapida e profonda, potrebbe permettere in futuro di rendere questa prospettiva reale in una percentuale più elevata di pazienti, con importanti vantaggi in termini di sostenibilità economica, tossicità a lungo termine e qualità di vita.
Sebbene, dunque, a oggi, il panorama delle cure farmacologiche per la gestione della LMC sia contraddistinto da una ricchezza di alternative, ciascuna caratterizzata da peculiarità specifiche, la mancanza di consapevolezza e la scarsa sensibilizzazione da parte dei clinici coinvolti nella definizione della strategia terapeutica fanno sì che spesso si ricorra al cosiddetto cycling terapeutico, in cui si utilizza un principio attivo per cui si è già sperimentata una perdita o mancanza di risposta nelle linee terapeutiche precedenti in caso di fallimento alle alternative farmacologiche utilizzate nelle linee successive.
Il presente studio mira a determinare l’impatto in termini di riduzione del costo medio di gestione dei pazienti affetti da LMC nello scenario in cui questi siano trattati mediante ricorso anticipato al farmaco ponatinib, confrontando tale scenario con l’attuale pratica clinica italiana in cui, dalle indagini condotte, si riscontra un cycling tra le terapie attualmente disponibili a seguito del fallimento della precedente linea terapeutica prima di tentare la gestione del paziente mediante ponatinib.
Metodi
Analisi di Budget Impact
L’analisi ha previsto il confronto tra due scenari alternativi:
- un primo scenario, basato sulla real practice italiana, definita mediante ricorso alle indagini di mercato condotte da MediMix international (31) e mediante il tool per survey epidemiologiche KnowlEDGE (32), che hanno consentito di definire l’effettivo ricorso alle alternative farmacologiche disponibili per la gestione della LMC (as is). Tali indagini sono rivolte ai professionisti sanitari operanti nel setting assistenziale italiano, che vi partecipano su base volontaria e hanno, dunque, come bacino di riferimento, l’intero setting nazionale e si occupano di delineare la storia naturale e il decorso della malattia (p. es., incidenza, prevalenza, standard di cura), di determinare i bisogni clinici e umanistici insoddisfatti caratterizzando il peso della malattia, di raccogliere e analizzare dati robusti da popolazioni di malattie rare, di quantificare la sicurezza, l’efficacia, i modelli di trattamento, l’aderenza e altri risultati specifici di un particolare prodotto nel mondo reale e/o comparativo, di valutare i modelli di trattamento specifici per paese e di valutare la sicurezza e il profilo rischio-beneficio di una terapia per supportare il processo decisionale normativo. I tassi di ricorso alle alternative farmacologiche sono stimati negli anni di analisi dal secondo al quinto, tenendo conto del loro trend di variazione storico registrato nei quattro trimestri dell’anno di estrapolazione dei dati di consumo;
- un secondo scenario, basato sulla considerazione di un maggiore ricorso (incremento del 6% in seconda linea e del 60% in terza) a ponatinib nelle linee terapeutiche dove ne è prevista l’indicazione da Linee Guida European LeukemiaNet (ELN) 2020 (33), ricorrendo a tale farmaco al termine del periodo di trattamento con le terapie usate nelle precedenti linee terapeutiche (to be). In tale scenario, si ipotizza, dunque, il superamento di quel cycling terapeutico che si è, invece, constatato nella pratica clinica corrente.
Le alternative farmacologiche considerate sono: bosutinib, dasatinib, imatinib, nilotinib e ponatinib. È stato, altresì, considerato il ricorso al trapianto di cellule staminali allogenico (SCT allo) come strategia terapeutica per la LMC.
Ai fini della realizzazione dell’analisi economica, è stato necessario ricorrere alle seguenti considerazioni:
- dal momento che non è stato possibile reperire un riferimento in merito al follow-up medio dei pazienti in trattamento farmacologico previo passaggio ad altra terapia in caso di fallimento, è stato considerato un periodo di gestione medio pari a 12 mesi per tutte le alternative. Tale approccio è conservativo, in quanto permette di pesare il costo delle alternative per il medesimo periodo di assunzione;
- si è considerato che il 50% dei pazienti in trattamento con un’alternativa farmacologica nella linea terapeutica precedente rimangono in trattamento con tale terapia anche nella linea terapeutica successiva, coerentemente con quanto avviene nella pratica clinica corrente.
Popolazione target
La popolazione target è stata identificata basandosi su studi epidemiologici reperiti nella letteratura scientifica (34,35), mediante utilizzo dei dati di incidenza/prevalenza pesati per la popolazione italiana. Mediante tale analisi, è stato possibile individuare una popolazione eleggibile pari a 10.474 individui affetti dalla patologia in analisi (Tab. I). Sono stati successivamente determinati i pazienti nella fase cronica della LMC (93,81%) (30), che trarrebbero maggiormente beneficio da una risposta positiva ai trattamenti. L’analisi ha preso, dunque, in considerazione un pool iniziale di 9.826 pazienti affetti da LMC in fase cronica.
| Pazienti affetti da LMC | % | Totale | |
|---|---|---|---|
| Popolazione italiana (2016) | 100,00% | 60.244.639 (36) | |
| Popolazione italiana tra I 20 e i 60 anni | 53,50% | 32.230.882 (36) | |
| Popolazione italiana sopra i 60 anni | 28,10% | 16.928.744 (36) | |
| Incidenza LMC (20-60 anni) | 0,0011% (15,34,35) | 355 | 10.474 |
| Incidenza LMC (>60 anni) | 0,0017% (15,34,35) | 288 | |
| Prevalenza LMC (20-60 anni) | 0,0200% (15,34,35) | 6.446 | |
| Prevalenza LMC (>60 anni) | 0,0200% (15,34,35) | 3.386 | |
| Pazienti in LMC cronica | 93,81% (30) | 9.826 | |
LMC = leucemia mieloide cronica.
La stima del tasso di adozione di un farmaco, come il ponatinib, in seconda linea a seguito di fallimento della precedente terapia farmacologica è spesso di difficile definizione: ai fini della realizzazione dell’analisi economica, è stato ipotizzato un tasso di ricorso a tale alternativa nell’orizzonte temporale di 3 anni, pari, in media, all’11% in seconda linea, considerando un incremento del 6% rispetto alle quote di mercato attuali e del 60% in terza linea.
Nella Tabella II, per ciascun anno dell’orizzonte temporale considerato, viene riportata la distribuzione delle quote di utilizzo nello as is, riguardante l’utilizzo delle alternative terapeutiche, così come emerso da un’indagine della real practice, e nello scenario to be, riguardante proiezioni di mercato basate sulla considerazione che, a seguito del fallimento della prima o della seconda linea terapeutica, i pazienti vengano trattati con ponatinib con un incremento delle quote di mercato di tale farmaco (Tabb. Supplementari A e B).
| Anno1 | Anno 2 | Anno 3 | Anno1 | Anno 2 | Anno 3 | |
|---|---|---|---|---|---|---|
| Quote di mercato | Pazienti | |||||
| Scenario AS IS | ||||||
| Bosutinib | 0,00% | 6,27% | 16,20% | 0 | 616 | 1.592 |
| Dasatinib | 11,77% | 28,63% | 10,70% | 1.157 | 2.814 | 1.051 |
| Imatinib | 64,99% | 34,96% | 33,73% | 6.386 | 3.435 | 3.315 |
| Nilotinib | 23,24% | 26,29% | 20,81% | 2.284 | 2.583 | 2.045 |
| Ponatinib | 0,00% | 3,40% | 17,93% | 0 | 334 | 1.762 |
| SCT allo | 0,00% | 0,44% | 0,63% | 0 | 44 | 61 |
| Totale | 100% | 100% | 100% | 9.826 | 9.826 | 9.826 |
| Scenario TO BE | ||||||
| Bosutinib | 0,00% | 6,21% | 9,91% | 0 | 610 | 974 |
| Dasatinib | 11,77% | 28,58% | 8,92% | 1.157 | 2.808 | 876 |
| Imatinib | 64,99% | 34,93% | 33,26% | 6.386 | 3.432 | 3.268 |
| Nilotinib | 23,24% | 26,23% | 17,37% | 2.284 | 2.578 | 1.707 |
| Ponatinib | 0,00% | 3,61% | 29,91% | 0 | 355 | 2.939 |
| SCT allo | 0,00% | 0,44% | 0,63% | 0 | 44 | 61 |
| Totale | 100% | 100% | 100% | 9.826 | 9.826 | 9.826 |
Consumo di risorse
Trattamento farmacologico
I parametri di costo sono stati estrapolati sia dalla letteratura esistente riguardante il setting sanitario italiano sia dai tariffari DRG (37) e dalle prestazioni di assistenza sanitaria ambulatoriale (38) per la misurazione dell’effettivo Budget Impact associato all’erogazione delle alternative terapeutiche oggetto di analisi. L’intervallo temporale considerato nell’analisi è pari a 3 anni. La prospettiva considerata è quella del Servizio Sanitario Nazionale, per cui sono stati esclusi i costi indiretti (perdite di produttività del paziente, del caregiver, ecc.). Dalla Lista di Trasparenza AIFA (Farmaci di classe H e di classe A per il solo imatinib) (39) è stato individuato il costo ex-factory/mg di acquisizione delle alternative farmacologiche considerate (Tab. III).
Di ciascun principio attivo, è stato, poi, pesato il costo di acquisizione per il tasso di ricorso a ciascuna posologia disponibile per linea terapeutica, determinato mediante indagine di mercato, per la stima dell’effettiva spesa farmacologica (Tab. II).
Dall’incrocio dei dati di costo/mg delle alternative terapeutiche, delle unità posologiche/die e dei tassi di utilizzo di ciascuna posologia, è stato possibile determinare i costi mensili di erogazione (Tab. III).
| % Utilizzo | ||||||
|---|---|---|---|---|---|---|
| Tablet (mg) | Costo/mg | Compresse (mg) | I linea | II linea | III linea | |
| Bosutinib | 100 | € 0,25 | 100 | 91,00% | 91,00% | 91,00% |
| 500 | € 0,20 | 500 | 9,00% | 9,00% | 9,00% | |
| Dasatinib | 50 | € 0,92 | 50 | 11,00% | 11,00% | 11,00% |
| 80 | € 1,46 | 80 | 14,00% | 14,00% | 14,00% | |
| 100 | € 1,17 | 100 | 70,00% | 70,00% | 70,00% | |
| 140 | € 0,84 | 140 | 5,00% | 5,00% | 5,00% | |
| Imatinib | 100 | € 0,07 | 100 | 14,15% | 14,15% | 14,15% |
| 400 | € 0,04 | 400 | 85,85% | 85,85% | 85,85% | |
| Nilotinib | 150 | € 0,15 | 150 | 38,00% | 38,00% | 38,00% |
| 200 | € 0,16 | 200 | 62,00% | 62,00% | 62,00% | |
| Ponatinib | 15 | € 5,97 | 15 | 76,00% | 76,00% | 76,00% |
| 30 | € 3,58 | 30 | 12,00% | 12,00% | 12,00% | |
| 45 | € 2,39 | 45 | 12,00% | 12,00% | 12,00% | |
| Costo mensile | ||||||
| Bosutinib | € 3.011,41 | € 2.326,32 | € 2.326,32 | |||
| Dasatinib | € 5.827,57 | € 5.827,57 | € 5.827,57 | |||
| Imatinib | € 532,49 | € 532,49 | € 532,49 | |||
| Nilotinib | € 2.267,24 | € 3.022,98 | € 3.022,98 | |||
| Ponatinib | € 2.860,71 | € 2.860,71 | € 2.860,71 | |||
Follow-up
Lo studio considera i costi associati al follow-up del paziente durante la somministrazione della terapia: a tal fine, è stato fatto riferimento allo studio di Lucioni et al. (2015) (40), nel quale si differenzia la frequenza con cui i pazienti si sottopongono a visita ambulatoriale, test diagnostici e interventi durante il periodo di somministrazione della terapia. Tale frequenza è stata stratificata per la probabilità di ottenere una risposta citogenetica (Tab. Supplementare C).
Indipendentemente dalla terapia seguita, si rileva che il paziente che non ha ottenuto una risposta citogenetica viene sottoposto a un numero medio maggiore di visite ambulatoriali, esami e interventi rispetto a un paziente che ha avuto una CCyR: per esempio, i pazienti che ottengono una CCyR grazie alla terapia si sottopongono mediamente a 3,60 visite mediche su base annuale, a differenza dei pazienti che non raggiungono una CCyR, che saranno sottoposti mediamente a 9,20 visite mediche su base annuale (Tab. Supplementare C).
Trapianto allogenico di cellule staminali
Tra le alternative terapeutiche considerate nello studio, oltre a quelle farmacologiche, l’analisi ha anche preso in considerazione la possibilità di ricorrere al trapianto allogenico di cellule staminali. Il costo di erogazione totale associato a tale strategia è pari a € 81.144,25 (40). L’analisi ha incluso anche i costi associati alla gestione di un possibile rigetto (GvHD, Graft Versus Host Disease) a cui il paziente può andare incontro a seguito del trapianto, pari a € 128/mese. Inoltre, sono stati considerati i costi di follow-up sostenuti dai pazienti sottoposti a trapianto e relativi agli anni successivi a quello di realizzazione dell’intervento (Tab. Supplementare D).
Eventi avversi
L’analisi considera il costo di gestione degli eventi avversi a cui il paziente potrebbe andare incontro durante la somministrazione della terapia. Per la determinazione della frequenza di insorgenza degli eventi avversi di grado 3-4 inclusi nell’analisi e dei relativi costi di gestione, è stato fatto riferimento allo studio di Lucioni et al. (2015) (40). Per il solo imatinib, è stato preso come riferimento lo studio di Mughal et al. (2010) (41). Nella Tabella Supplementare E sono riportati i tassi di insorgenza e i costi totali di gestione degli eventi avversi per ciascun farmaco considerato.
Risultati
Analisi di Budget Impact
Sulla base della stima della popolazione eleggibile e delle quote di mercato previste per ponatinib nell’intervallo temporale considerato nell’analisi (3 anni), è stato possibile determinare l’assorbimento di risorse associato ai due scenari. La Tabella IV riporta l’impatto per macrovoce di spesa e anno di analisi associato allo scenario as is in cui, dal primo anno di analisi, è possibile constatare come la voce associata al consumo di risorse maggiore sia quella relativa all’acquisizione delle alternative farmacologiche, con una spesa media per anno di analisi pari a € 258.477.869, che raggiunge il picco al secondo anno di analisi, con una spesa pari a € 328.173.866. In particolare, il farmaco associato alla maggiore spesa risulta essere il dasatinib, con un assorbimento complessivo di risorse pari a € 351.145.315. Con un costo medio di € 7.781.570, la macrovoce di spesa associata al secondo ammontare più alto di risorse assorbite è quella relativa ai costi di follow-up, che subisce un lieve incremento annuale, assestandosi su un ammontare complessivo pari a € 23.344.710 nel triennio. Gli eventi avversi si configurano come il driver associato alla spesa più esigua, con un trend decrescente e pari a € 4.893.253 al primo anno e a € 3.928.162 all’ultimo anno di analisi. L’impatto complessivo di tale scenario risulta pari a € 825.104.350.
La Tabella IV mostra il consumo di risorse per macrovoce di spesa e anno di analisi associato allo scenario to be, che prevede il ricorso alle alternative disponibili, così come stimato considerando un aumento del 6% del ricorso a ponatinib in seconda linea terapeutica e del 60% in terza linea. Anche in tale scenario, dal primo anno di analisi, è possibile constatare come la voce associata al consumo di risorse maggiore sia quella relativa all’acquisizione delle alternative farmacologiche, con una spesa media per anno di analisi pari a € 257.910.713 e che raggiunge il picco al secondo anno di analisi, con una spesa pari a € 328.091.863. In particolare, il farmaco associato alla maggiore spesa risulta essere il dasatinib, con un assorbimento complessivo di risorse pari a € 338.566.173. Con un costo medio di € 7.698.570, la macrovoce di spesa associata al secondo ammontare più alto di risorse assorbite è quella relativa ai costi di follow-up, che subisce un lieve incremento annuale, assestandosi su un ammontare complessivo pari a € 23.095.710 nel triennio. Gli eventi avversi si configurano anche in questo scenario come i driver associati alla spesa più esigua, con un trend decrescente e pari a € 4.893.253 il primo anno e a € 3.903.391 l’ultimo anno di analisi. L’impatto complessivo di tale scenario risulta pari a € 823.125.028 nell’orizzonte temporale considerato di 3 anni (Tab. IV).
Dal confronto tra i due scenari emerge come l’estensione del ricorso a ponatinib comporti una complessiva riduzione della spesa assistenziale pari a € 1.979.322. Analizzando le macrovoci di costo considerate nell’analisi, emerge come il risparmio maggiore sia quello associato al costo di acquisizione delle alternative terapeutiche, pari, complessivamente, a € 1.701.466. Significativa si dimostra anche la contrazione nella spesa di follow-up dei pazienti con LMC, pari, complessivamente, a € 249.000. La riduzione della spesa per gestione degli aventi avversi (€ 25.574) è coerente con il minor tasso di insorgenza di tali eventi associato all’assunzione di ponatinib nel confronto con le alternative considerate (Tab. IV e Fig. 1).
Analisi di sensibilità univariata
Al fine di valutare l’impatto dell’incertezza sui risultati dell’analisi di Budget Impact, è stata realizzata un’analisi di sensibilità univariata, in cui è stato ipotizzato un grado di incertezza per i parametri considerati all’interno del modello di valutazione economica pari al 25% del loro valore nel base-case. Tale analisi ha lo scopo di individuare i parametri la cui variazione all’interno del proprio range di variazione comporta lo scostamento maggiore rispetto ai risultati ottenuti nel base-case. Da tale analisi è emerso come il parametro la cui variazione influenza significativamente il risultato di Budget Impact è il costo mensile di bosutinib, relativo alla terza linea terapeutica (Fig. 2), con un andamento direttamente correlato a quello del Budget Impact: un aumento nel valore assoluto di tale parametro comporta, infatti, un aumento del risparmio dato dal confronto tra i due scenari e pari a € 6.166.522,27, mentre una sua riduzione comporta una maggiore spesa per il SSN pari a € 2.207.877,65.
Conclusioni
In Italia, i pazienti affetti da LMC curati con TKI sono approssimativamente 10.000. A oggi, le alternative a disposizione dei medici per la cura di un paziente affetto da questa patologia consistono nella somministrazione di imatinib, un TKI di prima generazione e, a seguito del fallimento di questa terapia, nel ricorso a un TKI di seconda generazione. La pratica clinica corrente è basata sulla ciclicità del ricorso alle alternative di seconda generazione, in caso di fallimento terapeutico. Tale pratica porta ad allungare i tempi di cura del paziente e, conseguentemente, a un peggioramento della qualità di vita associato a un accumulo di tossicità per gli eventi avversi dovuto a un uso prolungato delle alternative terapeutiche. Ponatinib, unico TKI di terza generazione al momento disponibile per la cura della LMC in caso di fallimento delle strategie farmacologiche precedenti, è attualmente usato come ultima alternativa dopo il ricorso al cycling terapeutico e risponde al bisogno di cura di quel sottogruppo di pazienti che non rispondono alle terapie attualmente in uso. In questo studio, si è analizzato uno scenario in cui è stato considerato, dove previsto dalle Linee Guida European LeukemiaNet (ELN) 2020 (33) di riferimento, un incremento nel ricorso a ponatinib. Il confronto tra tale scenario e quello basato sulla pratica italiana corrente ha rilevato un risparmio significativo di risorse che il Servizio Sanitario Nazionale potrebbe ottenere in caso di un ricorso anticipato a ponatinib. In particolare, tale risparmio è stato stimato pari a € 1.979.322 nell’arco dell’orizzonte temporale considerato pari a 3 anni (€ 823.125.028 vs € 825.104.350). Il maggior risparmio è quello determinato dalla riduzione dei costi di acquisizione delle alternative farmacologiche (€ 1.701.466), mentre la riduzione nel tasso di insorgenza degli eventi avversi comporta una riduzione più marginale della spesa pari a -€ 25.574. L’analisi di sensibilità deterministica, condotta al fine di stimare l’impatto dell’incertezza che caratterizza i parametri considerati nell’analisi, ha individuato nel costo mensile associato alla terapia basata su bosutinib utilizzato come terza linea terapeutica il parametro la cui variazione comporta lo scostamento maggiore rispetto ai risultati ottenuti nel base-case.
| Scenario 1 | Scenario 2 | Analisi differenziale | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Anno 1 | Anno 2 | Anno 3 | Totale | Anno 1 | Anno 2 | Anno 3 | TOTALE | Anno 1 | Anno 2 | Anno 3 | Totale | |
| Trattamento farmacologico | € 183.817.003 | € 328.173.866 | € 263.442.738 | € 775.433.607 | € 183.817.003 | € 328.091.863 | € 261.823.275 | € 773.732.141 | € 0 | –€ 82.003 | –€ 1.619.463 | –€ 1.701.466 |
| Bosutinib | € 0 | € 17.200.083 | € 44.447.592 | € 61.647.675 | € 0 | € 17.037.628 | € 27.194.744 | € 44.232.372 | € 0 | –€ 162.455 | –€ 17.252.848 | –€ 17.415.303 |
| Dasatinib | € 80.879.338 | € 196.769.162 | € 73.496.815 | € 351.145.315 | € 80.879.338 | € 196.394.639 | € 61.292.196 | € 338.566.173 | € 0 | –€ 374.523 | –€ 12.204.619 | –€ 12.579.142 |
| Imatinib | € 40.806.854 | € 21.948.777 | € 21.180.102 | € 83.935.733 | € 40.806.854 | € 21.929.951 | € 20.885.367 | € 83.622.172 | € 0 | –€ 18.826 | –€ 294.735 | –€ 313.561 |
| Nilotinib | € 62.130.811 | € 80.773.805 | € 63.821.091 | € 206.725.707 | € 62.130.811 | € 80.560.160 | € 51.553.423 | € 194.244.394 | € 0 | –€ 213.645 | –€ 12.267.668 | –€ 12.481.313 |
| Ponatinib | € 0 | € 11.482.040 | € 60.497.137 | € 71.979.177 | € 0 | € 12.169.485 | € 100.897.545 | € 113.067.030 | € 0 | € 687.445 | € 40.400.408 | € 41.087.853 |
| SCT allo | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Costo eventi avversi | € 4.893.253 | € 3.821.647 | € 3.928.162 | € 12.643.062 | € 4.893.253 | € 3.820.844 | € 3.903.391 | € 12.617.488 | € 0 | –€ 803 | –€ 24.771 | –€ 25.574 |
| Bosutinib | € 0 | € 204.689 | € 528.946 | € 733.635 | € 0 | € 202.755 | € 323.629 | € 526.384 | € 0 | –€ 1.934 | –€ 205.317 | –€ 207.251 |
| Dasatinib | € 269.080 | € 654.637 | € 244.519 | € 1.168.236 | € 269.080 | € 653.391 | € 203.915 | € 1.126.386 | € 0 | –€ 1.246 | –€ 40.604 | –€ 41.850 |
| Imatinib | € 3.988.342 | € 2.145.209 | € 2.070.081 | € 8.203.632 | € 3.988.342 | € 2.143.369 | € 2.041.274 | € 8.172.985 | € 0 | –€ 1.840 | –€ 28.807 | –€ 30.647 |
| Nilotinib | € 635.832 | € 719.313 | € 569.326 | € 1.924.471 | € 635.832 | € 717.674 | € 475.168 | € 1.828.674 | € 0 | –€ 1.639 | –€ 94.158 | –€ 95.797 |
| Ponatinib | € 0 | € 97.799 | € 515.290 | € 613.089 | € 0 | € 103.655 | € 859.404 | € 963.059 | € 0 | € 5.856 | € 344.114 | € 349.970 |
| SCT allo | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| SCT Allo | € 0 | € 9.701.943 | € 3.981.027 | € 13.682.970 | € 0 | € 9.698.662 | € 3.981.027 | € 13.679.689 | € 0 | –€ 3.281 | € 0 | –€ 3.281 |
| Bosutinib | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Dasatinib | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Imatinib | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Nilotinib | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Ponatinib | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| SCT allo | € 0 | € 9.701.943 | € 3.981.027 | € 13.682.970 | € 0 | € 9.698.662 | € 3.981.027 | € 13.679.689 | € 0 | –€ 3.281 | € 0 | –€ 3.281 |
| Costo follow–up | € 7.618.983 | € 7.801.374 | € 7.924.353 | € 23.344.710 | € 7.618.983 | € 7.798.294 | € 7.678.433 | € 23.095.710 | € 0 | –€ 3.080 | –€ 245.920 | –€ 249.000 |
| Bosutinib | € 0 | € 617.380 | € 1.595.402 | € 2.212.782 | € 0 | € 611.549 | € 976.128 | € 1.587.677 | € 0 | –€ 5.831 | –€ 619.274 | –€ 625.105 |
| Dasatinib | € 918.299 | € 2.234.104 | € 834.478 | € 3.986.881 | € 918.299 | € 2.229.852 | € 695.908 | € 3.844.059 | € 0 | –€ 4.252 | –€ 138.570 | –€ 142.822 |
| Imatinib | € 4.695.681 | € 2.525.665 | € 2.437.213 | € 9.658.559 | € 4.695.681 | € 2.523.499 | € 2.403.298 | € 9.622.478 | € 0 | –€ 2.166 | –€ 33.915 | –€ 36.081 |
| Nilotinib | € 2.005.003 | € 2.184.709 | € 1.795.288 | € 5.985.000 | € 2.005.003 | € 2.179.538 | € 1.498.373 | € 5.682.914 | € 0 | –€ 5.171 | –€ 296.915 | –€ 302.086 |
| Ponatinib | € 0 | € 239.516 | € 1.261.972 | € 1.501.488 | € 0 | € 253.856 | € 2.104.726 | € 2.358.582 | € 0 | € 14.340 | € 842.754 | € 857.094 |
| SCT allo | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 | € 0 |
| Costi Totali | € 196.329.239 | € 349.498.831 | € 279.276.280 | € 825.104.350 | € 196.329.239 | € 349.409.663 | € 277.386.126 | € 823.125.028 | € 0 | –€ 89.168 | –€ 1.890.154 | –€ 1.979.322 |
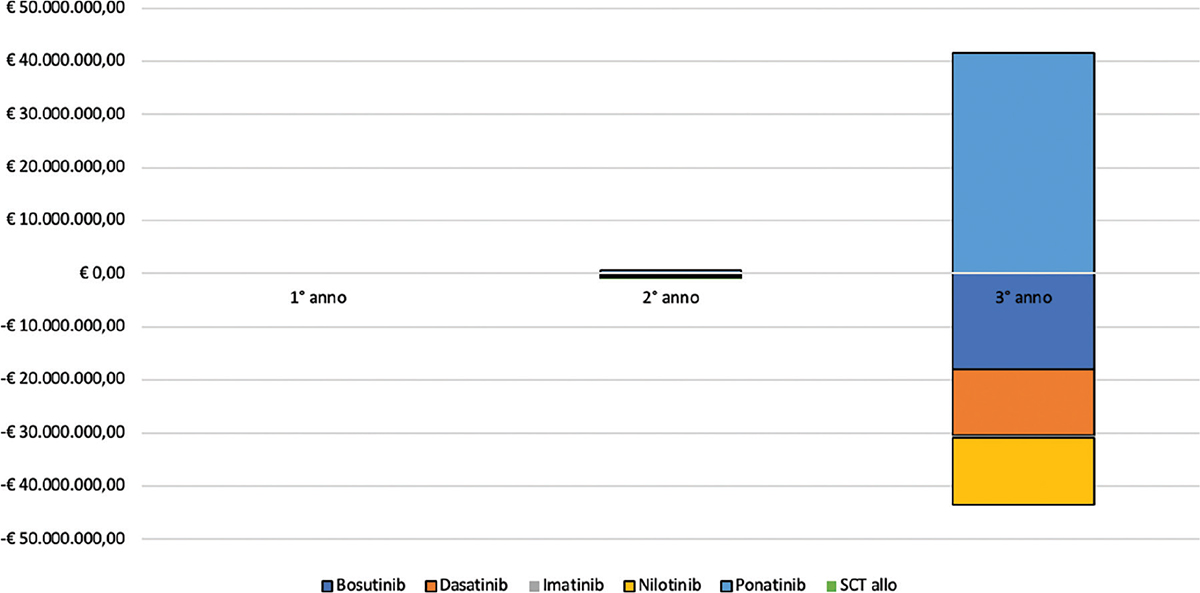
Fig. 1 - Analisi differenziale dello scenario con (to be) e senza (as is) un ricorso anticipato a ponatinib.
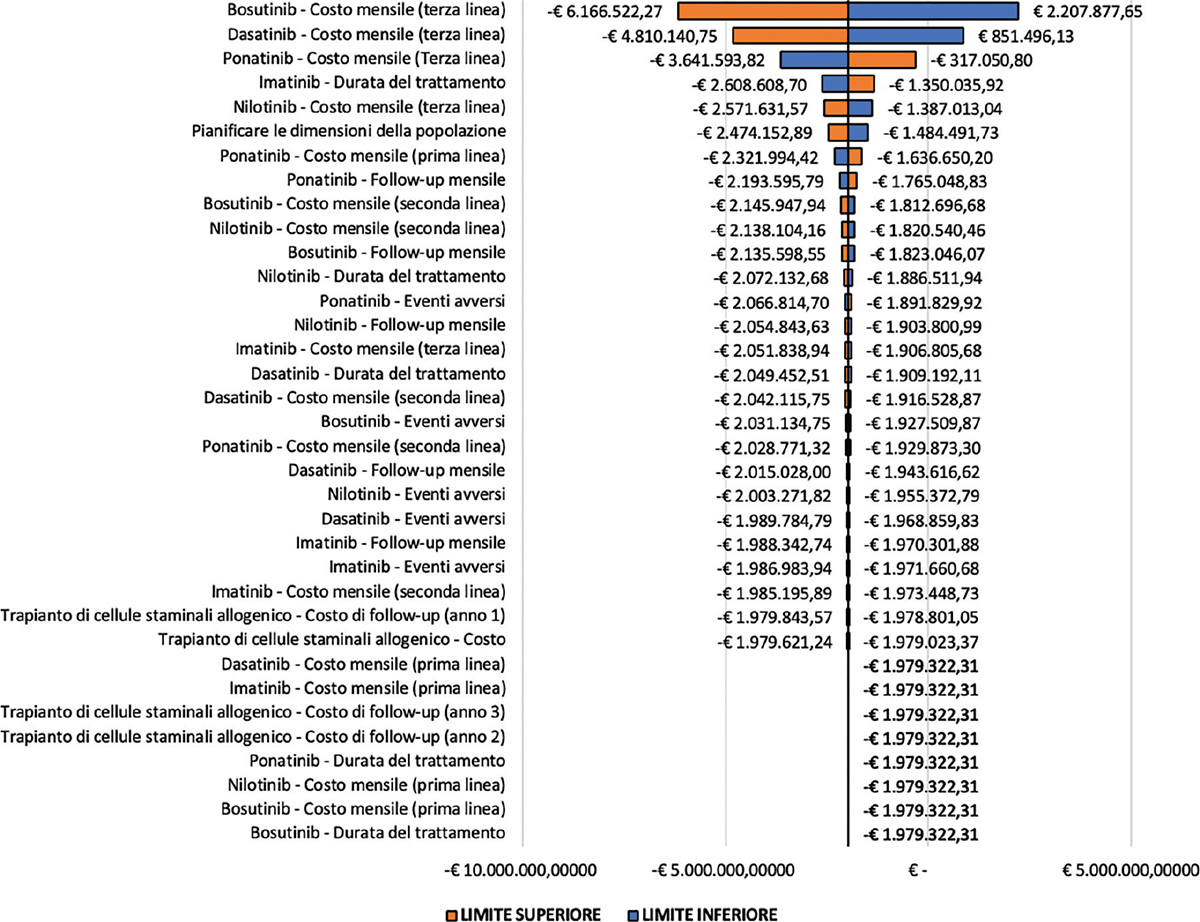
Fig. 2 - Analisi di sensibilità univariata.
Lo studio presenta una serie di criticità associate alle considerazioni, che è stato necessario realizzare per la determinazione degli scenari di riferimento. In particolare, è stato considerato che la durata media delle terapie farmacologiche fosse pari a 12 mesi per tutte le alternative considerate. Tale considerazione è, altresì, conservativa, in quanto, applicando la medesima durata media a tutte le strategie, tale parametro non comporta un vantaggio/svantaggio strutturale per uno specifico approccio terapeutico sugli altri. Un’altra importante considerazione necessaria per la definizione degli scenari oggetto di analisi è quella relativa alla percentuale di pazienti che continuano il trattamento utilizzato nella linea terapeutica precedente: la base informativa sulla quale si è basata la definizione degli scenari indicava, infatti, la distribuzione dei pazienti nelle varie linee terapeutiche, mentre non si disponeva di un’indicazione in merito alla percentuale di pazienti che continuavano la somministrazione della terapia di prima linea fino alla fine dell’intervallo considerato nell’analisi. Per tale motivo, è stato considerato che tale percentuale di pazienti corrispondesse al 50% (Tabb. Supplementari A, B) dei pazienti in trattamento nella linea terapeutica precedente, riparametrando gli indici di ricorso alle strategie farmacologiche per quella specifica linea terapeutica sulla percentuale residua. Tale considerazione è stata conservativamente applicata a tutte le strategie considerate nell’analisi. Infine, si segnala che la determinazione dei due scenari di confronto è stata basata sul ricorso a dati provenienti da indagini di mercato di cui si disponeva, per la determinazione dei tassi di ricorso alle varie alternative terapeutiche, del valore medio. Di tali dati non è stato, dunque, possibile considerare il grado di errore statistico e il margine di confidenza delle stime.
Questi risultati, insieme alle evidenze che certificano una maggiore efficacia di ponatinib in termini di outcome sperimentato dal paziente rispetto alle alternative farmacologiche considerate (39) e a un minore impatto in termini di tasso di insorgenza degli eventi avversi, porta a suggerire il ricorso a tale farmaco in tutti i casi in cui questa alternativa venga adoperata nel rispetto delle Linee Guida ufficiali (33), in quanto un aumento del ricorso a ponatinib risulta associato a un risparmio di risorse per il Servizio Sanitario Nazionale, consentendone, dunque, una riallocazione in altri ambiti di assistenza.
Acknowledgments
The analysis was developed with the unconditioned support of Incyte Biosciences Italy Srl. The views expressed here are those of the authors and not necessarily those of the funders.
Disclosures
Conflict of interest: None of the authors has any potential conflict of interest related to this manuscript.
Financial support: The present analysis was funded by Incyte Biosciences Italy Srl. The views expressed by the authors in the manuscript are not necessarily those of the Company.
Bibliografia
- 1. Tura S, Baccarani M, Zaccaria A. Chronic myeloid leukemia. Haematologica. 1986;71(3):169-176. PubMed
- 2. Melo JV, Hughes TP, Apperley JF. Chronic myeloid leukemia. Hematology (Am Soc Hematol Educ Program). 2003;2003(1):132-152. CrossRef PubMed
- 3. Cortes JE, Talpaz M, Kantarjian H. Chronic myelogenous leukemia: a review. Am J Med. 1996;100(5):555-570. CrossRef PubMed
- 4. Cortes J, Kantarjian H. Advanced-phase chronic myeloid leukemia. Semin Hematol. 2003;40(1):79-86. CrossRef PubMed
- 5. Deininger M, O’Brien SG, Guilhot F, et al. International Randomized Study of Interferon Vs STI571 (IRIS) 8-Year Follow up: Sustained Survival and Low Risk for Progression or Events in Patients with Newly Diagnosed Chronic Myeloid Leukemia in Chronic Phase (CML-CP) Treated with Imatinib. ASH Annual Meeting Abstracts. 2009;114:1126. Online
- 6. Radich J. Stem cell transplant for chronic myeloid leukemia in the imatinib era. Semin Hematol. 2010;47(4):354-361. CrossRef PubMed
- 7. Druker BJ. Perspectives on the development of imatinib and the future of cancer research. Nat Med. 2009;15(10):1149-1152. CrossRef PubMed
- 8. O’Brien SG, Guilhot F, Larson RA, et al; IRIS Investigators. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2003;348(11):994-1004. CrossRef PubMed
- 9. O’Hare T, Eide CA, Deininger MW. Bcr-Abl kinase domain mutations, drug resistance, and the road to a cure for chronic myeloid leukemia. Blood. 2007;110(7):2242-2249. CrossRef PubMed
- 10. Radich JP. The Biology of CML blast crisis. Hematology (Am Soc Hematol Educ Program). 2007;2007(1):384-391. CrossRef PubMed
- 11. Fava C, Kantarjian HM, Jabbour E, et al. Failure to achieve a complete hematologic response at the time of a major cytogenetic response with second-generation tyrosine kinase inhibitors is associated with a poor prognosis among patients with chronic myeloid leukemia in accelerated or blast phase. Blood. 2009;113(21):5058-5063. CrossRef PubMed
- 12. Kantarjian H, Giles F, Wunderle L, et al. Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL. N Engl J Med. 2006;354(24):2542-2551. CrossRef PubMed
- 13. le Coutre PD, Giles FJ, Hochhaus A, et al. Nilotinib in patients with Ph+ chronic myeloid leukemia in accelerated phase following imatinib resistance or intolerance: 24-month follow-up results. Leukemia. 2012;26(6):1189-1194. CrossRef PubMed
- 14. Doggrell SA. BMS-354825: a novel drug with potential for the treatment of imatinib-resistant chronic myeloid leukaemia. Expert Opin Investig Drugs. 2005;14(1):89-91. CrossRef PubMed
- 15. Talpaz M, Shah NP, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med. 2006;354(24):2531-2541. CrossRef PubMed
- 16. Shah NP, Kantarjian HM, Kim DW, et al. Intermittent target inhibition with dasatinib 100 mg once daily preserves efficacy and improves tolerability in imatinib-resistant and -intolerant chronic-phase chronic myeloid leukemia. J Clin Oncol. 2008;26(19):3204-3212. CrossRef PubMed
- 17. Kantarjian H, Shah NP, Hochhaus A, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2010;362(24):2260-2270. CrossRef PubMed
- 18. Cortes JE, Khoury HJ, Kantarjian HM, et al. Long-term bosutinib for chronic phase chronic myeloid leukemia after failure of imatinib plus dasatinib and/or nilotinib. Am J Hematol. 2016;91(12):1206-1214. CrossRef PubMed
- 19. Kantarjian HM, Cortes JE, Kim DW, et al. Bosutinib safety and management of toxicity in leukemia patients with resistance or intolerance to imatinib and other tyrosine kinase inhibitors. Blood. 2014;123(9):1309-1318. CrossRef PubMed
- 20. O’Hare T, Shakespeare WC, Zhu X, et al. AP24534, a pan-BCR-ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation-based resistance. Cancer Cell. 2009;16(5):401-412. CrossRef PubMed
- 21. Cortes JE, Kim DW, Pinilla-Ibarz J, et al; PACE Investigators. A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. N Engl J Med. 2013;369(19):1783-1796. CrossRef PubMed
- 22. Dorer DJ, Knickerbocker RK, Baccarani M, et al. Impact of dose intensity of ponatinib on selected adverse events: multivariate analyses from a pooled population of clinical trial patients. Leuk Res. 2016;48:84-91. CrossRef PubMed
- 23. Jabbour E, Cortes JE, Kantarjian HM. Suboptimal response to or failure of imatinib treatment for chronic myeloid leukemia: what is the optimal strategy? Mayo Clin Proc. 2009;84(2):161-169. CrossRef PubMed
- 24. Hanfstein B, Muller MC, Hehlmann R, et al; SAKK; German CML Study Group. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML). Leukemia. 2012;26(9):2096-2102. CrossRef PubMed
- 25. Marin D, Ibrahim AR, Lucas C, et al. Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol. 2012;30(3):232-238. CrossRef PubMed
- 26. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013;122(6):872-884. CrossRef PubMed
- 27. Jabbour E, Kantarjian H, Cortes J. Chronic myeloid leukemia and second-generation tyrosine kinase inhibitors: when, how, and which one? Semin Hematol. 2010;47(4):344-353. CrossRef PubMed
- 28. Rosti G, Castagnetti F, Gugliotta G, Baccarani M. Tyrosine kinase inhibitors in chronic myeloid leukaemia: which, when, for whom? Nat Rev Clin Oncol. 2017;14(3):141-154. CrossRef PubMed
- 29. Mahon FX, Rea D, Guilhot J, et al; Intergroupe Francais des Leucemies Myeloides Chroniques. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol. 2010;11(11):1029-1035. CrossRef PubMed
- 30. Hoffmann VS, Baccarani M, Hasford J, et al. Treatment and outcome of 2904 CML patients from the EUTOS population-based registry. Leukemia. 2017;31(3):593-601. CrossRef PubMed
- 31. J Live Tracker – CML & ALL – MediMix Database.
- 32. Therapy KnowlEDGE: International Epidemiological Tool.
- 33. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020;34(4):966-984. CrossRef PubMed
- 34. Bassan R, Rossi G, Pogliani EM, et al. Chemotherapy-phased imatinib pulses improve long-term outcome of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: Northern Italy Leukemia Group protocol 09/00. J Clin Oncol. 2010;28(22):3644-3652. CrossRef PubMed
- 35. Ravandi F, Othus M, O’Brien SM, et al. US intergroup study of chemotherapy plus dasatinib and allogeneic stem cell transplant in Philadelphia chromosome positive ALL. Blood Adv. 2016;1(3):250-259. CrossRef PubMed
- 36. Istituto Italiano di Statistica (ISTAT); Disponibile Online
- 37. Ministero della Salute – Tariffario delle prestazioni di assistenza per acuti. Disponibile Online
- 38. Ministero della Salute. Disponibile Online
- 39. Agenzia Italiana del Farmaco (AIFA) – Liste di trasparenza Agenzia Italiana del Farmaco (AIFA). Disponibile Online
- 40. Lucioni C, Iannazzo S. Mazzi S, Saporiti G, Chiroli S. Cost-effectiveness of ponatinib in chronic myeloid leukemia in Italy. Global & Regional Health Technology Assessment, 2015; 2(1):1-16. CrossRef
- 41. Mughal TI, Schrieber A. Principal long-term adverse effects of imatinib in patients with chronic myeloid leukemia in chronic phase. Biologics. 2010;4:315-323. CrossRef PubMed