 |
Glob Reg Health Technol Assess 2021; 8: 96-104 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2237 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di Budget Impact della formulazione depot di buprenorfina a rilascio prolungato per la gestione di pazienti affetti da disturbo da uso di oppiacei
Budget Impact Analysis of prolonged-release buprenorphine depot-formulation for the management of patients affected by opioid use disorder
Background: Opioid use disorder (OUD) is a disorder associated with significant rate of morbidity and mortality. Frequent clinic attendance for supervised consumption of sublingual buprenorphine is common. Prolonged-release buprenorphine (PRB) allows a management based on weekly or monthly subcutaneous injections, thus limiting the burdens of clinic attendance and the risks associated with sublingual formulations.
Objective: To determine the price level of PRB that allows to obtain a neutral impact from the point of view of the economic resources absorbed, in comparison with the alternatives currently available in the Italian context for the management of patients suffering from OUD.
Methods: The analysis assumes a daily PRB cost of € 8.526 (neutral cost). The analysis aims to determine the economic impact associated with the introduction of PRB in the Italian context for the management of OUD patients. Results are expressed in terms of differential resources absorbed in the alternative scenarios. A one-way sensitivity analysis was also carried out to test the robustness of the results.
Results: The introduction of PRB implies an increase in the drug acquisition costs over the 5-year time horizon of € 23,016,194.61: such costs are fully compensated by the other cost driver considered in the analysis (drug tests provided, health professionals’ time destined to the provision of the treatment, indirect costs, for savings equal to € 7,255,602.59, € 10,714,320.08 and € 5,046,271.94 respectively) demonstrating its effectiveness in particular by an organizational point of view. Lower price levels for PRB would imply significant savings for the SSN.
Conclusions: PRB resulted to be associated to a lower level of resources’ absorption in the Italian sector as compared with the available alternatives thus allowing to re-allocate health founds to other fields of the care sector ensuring greater safety for patients and a decreased misuse and diversion rate.
Keywords: Budget impact analysis, Disease management, Economic evaluation, Opioid use disorder, Prolonged-release buprenorphine
Received: January 29, 2021
Accepted: July 6, 2021
Published online: July 22, 2021
This article includes supplementary material
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Background
Il disturbo da uso di oppioidi (Opioid Use Disorder, OUD) è tra le 25 principali cause di rischio di morte nel mondo (1,2). Diversi studi su coorti di consumatori di oppiacei ad alto rischio riportano tassi di mortalità totali compresi tra l’1% e il 2% all’anno. Il loro utilizzo, infatti, può portare non solo allo sviluppo di fenomeni di tolleranza adattativa fisiologici, ma anche allo sviluppo di dipendenza con episodi di intossicazione acuta (3-5). L’OUD è una malattia cronica cerebrale e dei meccanismi di ricompensa, motivazione, memoria e interconnessione, la cui disfunzione conduce a caratteristiche manifestazioni biologiche, psicologiche, sociali e spirituali. Tale condizione si manifesta attraverso una spinta individuale patologica alla gratificazione attraverso l’uso di sostanze o altri comportamenti (definizione American Society of Addiction Medicine, ASAM (6)). L’OUD è associato a un elevato tasso di morbidità e mortalità, quest’ultima circa 6-20 volte superiore rispetto a quella della popolazione generale (7,8). L’OUD, laddove non adeguatamente trattato, può, dunque, comportare un importante aumento dei costi sanitari e sociali (9-11). Tale patologia impatta, inoltre, significativamente anche sulla qualità della vita dei pazienti e dei loro familiari (caregiver) (12-16). Secondo i dati della “Relazione annuale al Parlamento sullo stato delle tossicodipendenze in Italia” (17), elaborata annualmente dal Dipartimento Politiche Antidroga della Presidenza del Consiglio dei Ministri, in Italia, nel 2019, il totale degli utenti in carico presso i Ser.D (Servizi per le Dipendenze) è stato pari a 136.320, di cui il 58,3% ha ricevuto trattamenti farmacologici. Il numero dei pazienti in trattamento nei Ser.D per OUD come sostanza primaria (eroina) è stato pari a 89.460 unità (17). Sul territorio italiano sono presenti oltre 550 Ser.D a cui afferiscono pazienti con disturbo sia da uso di sostanze che da comportamenti. Il personale dei Ser.D è composto da diverse figure professionali (medici, psicologi, infermieri professionali, educatori professionali, assistenti sociali e personale amministrativo). Le attività di maggior rilievo, intendendole in termini di risorse umane ed economiche, sono quelle sanitarie relativamente alla gestione e all’erogazione dei trattamenti farmacologici. Il trattamento dell’OUD (dipendenza da oppioidi) richiede un approccio multiprofessionale integrato, che combina la terapia farmacologica e interventi psico-socio-riabilitativi (11,16,18). Gli obiettivi principali di tale trattamento sono la riduzione del craving (desiderio improvviso e incontrollabile di assumere una sostanza psicoattiva), della mortalità e della morbilità (p. es., malattie infettive, malattie psichiatriche), il miglioramento della salute fisica e psicologica, la prevenzione e la riduzione dei comportamenti criminali e la reintegrazione dei pazienti in ambito lavorativo e sociale (11). Per quanto concerne il trattamento farmacologico dell’OUD, i farmaci a oggi disponibili e considerati di prima scelta secondo lo standard of care a livello europeo sono rappresentati dalla terapia con metadone e buprenorfina e l’associazione di buprenorfina con naloxone (19-25). Il metadone è un farmaco agonista dei recettori oppioidi sia di tipo mu che di tipo kappa ed è il farmaco più utilizzato nei trattamenti per l’OUD sia a lungo termine che a breve termine (26). La buprenorfina è un agonista parziale dei recettori mu e antagonista dei recettori kappa degli oppioidi. Il suo peculiare profilo famacodinamico ne aumenta sia la sicurezza di impiego rispetto al metadone che il suo utilizzo come farmaco di prima scelta in particolari condizioni cliniche (11,27). Infatti, studi clinici hanno evidenziato un minor rischio di overdose grazie al ceiling effect (effetto tetto) sulla depressione respiratoria (9,28,29). Le attuali formulazioni dei farmaci disponibili per il trattamento farmacologico dell’OUD in Italia, metadone in sciroppo e buprenorfina in compresse, presentano alcune significative limitazioni. In particolare, assumono particolare importanza le necessarie frequenti (a volte anche quotidiane) assunzioni dei farmaci presso gli ambulatori dei Ser.D, i rischi connessi con i fenomeni di diversione e di misuso (10,30-43,45) e la non sempre totale aderenza da parte dei pazienti ai regimi posologici impostati, specialmente per i pazienti con affidamento domiciliare del trattamento farmacologico. Tutti questi aspetti impattano in modo negativo sia sull’esito dei trattamenti stessi che sulla qualità di vita dei pazienti, alimentando ulteriormente lo stigma nei confronti dei trattamenti, generando anche discriminazioni e una perdita percepita di equità sociale (9-11,13,31,43-50).
Una formulazione di buprenorfina a rilascio prolungato, Buvidal®, è stata recentemente approvata da AIFA è disponibile come soluzione iniettabile sottocutanea (siringa pre riempita) con diversi dosaggi e con formulazioni a rilascio prolungato di durata fino a una settimana e fino a un mese. Le formulazioni attualmente approvate e i dosaggi di conversione dalle compresse sublinguali consentono di ottenere lo spettro completo di possibili indicazioni per far fronte alle specifiche necessità del paziente (51). Trovano indicazione nel trattamento del disturbo da uso da oppioidi nell’ambito di un trattamento clinico medico, sociale e psicologico. Il trattamento è indicato negli adulti e negli adolescenti di età superiore e/o uguale ai 16 anni. Gli studi clinici registrativi, incluso il confronto con il trattamento sublinguale con buprenorfina, dimostrano una migliorata efficacia e sicurezza nel trattamento dei pazienti con OUD (52). Il prodotto ha il potenziale per superare i limiti, gli oneri e i rischi associati alle formulazioni di buprenorfina attualmente in uso e può essere utilizzato anche in integrazione ai trattamenti già in presenti (27).
La presente analisi mira a determinare il livello di prezzo di buprenorfina a rilascio prolungato (prolonged release buprenorphine, PRB) che consenta di ottenere un impatto neutro dal punto di vista delle risorse economiche assorbite dal Servizio Sanitario Nazionale (SSN), rispetto alle alternative attualmente disponibili nel contesto italiano per la gestione dei pazienti affetti da OUD.
Metodi
Budget Impact Analysis
La presente analisi è basata sulla realizzazione di un’analisi di Budget Impact finalizzata alla determinazione dell’impatto in termini di risorse assorbite associato all’introduzione di PRB rispetto alle alternative attualmente disponibili nell’orizzonte temporale considerato pari a 5 anni. L’analisi ha previsto il confronto tra due scenari alternativi:
- un primo scenario, basato sull’attuale real practice clinica e, dunque, sull’effettivo ricorso alle alternative terapeutiche disponibili nel setting assistenziale italiano;
- uno scenario alternativo, che prevede l’introduzione della strategia terapeutica basata sul ricorso a PRB nel contesto sanitario italiano per il trattamento dei pazienti affetti da OUD.
I risultati dell’analisi sono espressi in termini di assorbimento di risorse associato ai due scenari oggetto di analisi, nonché in termini di differenziale di spesa, dato dal confronto tra gli stessi. Al fine di valutare l’impatto dell’incertezza sui risultati dell’analisi di Budget Impact è stata realizzata un’analisi di sensibilità univariata in cui è stato ipotizzato un grado di incertezza per i parametri considerati all’interno del modello di valutazione economica, pari al 25% del loro valore medio considerato nello scenario base per determinare i driver che comportano il maggiore scostamento dai risultati ottenuti nello scenario di riferimento.
Strategie terapeutiche
La presente analisi ha individuato come strategie terapeutiche di confronto alla PBR le compresse sublinguali contenenti buprenorfina sia nella mono formulazione che in associazione con il naloxone. Da un punto di vista farmacologico infatti, entrambe le formulazioni contenenti buprenorfina sono considerate farmacologicamente sovrapponibili e con simili profili di impiego clinico anche rispetto alle nuove PBR. Sono state escluse dal confronto le diverse formulazioni di metadone, dal momento che queste ultime, pur avendo la stessa indicazione clinica rispetto a quelle contenenti buprenorfina, presentano non solo un differente profilo farmacologico e meccanismo d’azione, ma anche una modalità di impiego clinico differente.
Popolazione eleggibile
Lo studio prende in considerazione una popolazione di riferimento per l’Italia pari a 298.562 pazienti, derivante dalla stima realizzata nella Relazione annuale al parlamento sul fenomeno delle tossicodipendenze in Italia (17), assumendo un tasso di crescita annuale della popolazione pari a –0,20% (53) e una percentuale di pazienti in trattamento con oppioidi pari al 15,88% (Tab. I). Inoltre, è stato considerato un tasso di pazienti in trattamento con buprenorfina pari al 20,00%.
| Pazienti affetti da OUD in Italia | 298.541 (17) | |
|---|---|---|
| % pz in trattamento | 30,00% (17) | 89.562 |
| % pz in trattamento con buprenorfina | 20,00% (17) | 17.912 |
| % pz in trattamento con buprenorfina (ecl. pz ETW o superiore) | 73,00%* | 13.076 |
| % crescita annuale della popolazione | –0,20% (53) |
OUD = disturbo da uso di oppioidi (OUD, opioid use disorder); pz = pazienti. *Expert Opinion: Dottor Lorenzo Somaini
Regimi di affido
La Tabella II riporta l’impatto organizzativo in termini di ore associato all’erogazione della terapia basata sull’assunzione di compresse sublinguali di buprenorfina da parte dei professionisti sanitari coinvolti (medico, infermiere). Il management del paziente basato su tale terapia può articolarsi su diverse strategie, basata ciascuna su una frequenza di assunzione differente. In particolare, il paziente può essere associato a una gestione caratterizzata da assunzione del farmaco giornaliera con necessità di presentarsi giornalmente presso la struttura preposta all’erogazione della terapia o a una gestione basata sull’affido della terapia al paziente per un certo numero di giorni. In questo caso, al paziente verrà fornito il quantitativo di farmaco sufficiente a coprire le giornate di affido. Al fine di poter modellizzare i vari schemi di assunzione della terapia con affido si sono definiti quattro possibili scenari:
- affido giornaliero: il paziente si reca presso la struttura preposta con cadenza giornaliera;
- affido settimanale: il paziente si reca presso la struttura preposta con cadenza settimanale;
- affido quindicinale: il paziente si reca presso la struttura di erogazione ogni 14 giorni;
- affido oltre le tre settimane: il paziente si reca in struttura per la fornitura del farmaco con frequenza superiore alle tre settimane.
A seconda dello schema utilizzato, l’erogazione della terapia impatta in maniera differente sul tempo destinato dai professionisti sanitari alla gestione e all’erogazione dei trattamenti farmacologici. Dall’esperienza di erogazione delle terapie per OUD condotta nel setting assistenziale italiano (Expert Opinion: Dottor Lorenzo Somaini), emerge come il format di erogazione giornaliero impegni il medico per circa 8 ore su base annuale e 39 ore l’infermiere, come l’affido settimanale impegni il medico per circa 8 ore annualmente e l’infermiere per 13 ore per paziente trattato e come l’affido quindicinale impegni il medico per circa 8 ore annualmente e l’infermiere 6 ore e mezzo; infine, la gestione mediante affido di tre settimane e oltre risulta la strategia associata all’impatto organizzativo più modesto, con un impegno per il medico pari a 5,77 ore e per l’infermiere pari a 4,33 ore (Tabb. Supplementari A-D). Tali tempistiche sono state individuate sulla base della survey condotta standardizzando i colloqui di follow-up del paziente a una durata di 20 minuti. In particolare, ai fini della presente analisi, si è scelto di escludere il ricorso a quest’ultima metodica di affido (Tab. Supplementare D) associata, infatti, a un tasso di ricorso nullo, in quanto si è considerato che i pazienti gestibili mediante strategie di affido lunghe e prossimi a una frequenza mensile non fossero tra quelli eleggibili a un possibile passaggio a PRB. Per quanto riguarda la distribuzione dei pazienti in trattamento con compresse sublinguali tra le strategie di affido residue, si è determinato che il 49,32% sia in affido quindicinale, il 36,99% in affido settimanale e il restante 13,70% in gestione giornaliera: tale distribuzione è basata sul grado di risposta clinica alle terapie così come determinata nella survey condotta (Expert Opinion: Dottor Lorenzo Somaini). La Tabella II riporta anche l’impatto organizzativo stimato per il ricorso a Buvidal®: tale strategia comporta un impegno annuale per il medico pari a 4 ore e a 3 per l’infermiere.
| Buprenorfina sublinguale | Buvidal | ||||
| Refill ETW o maggiore | Refill EOW | Refill settimanale | Refill giornaliero | ||
| Medico (ore/anno) | 5,77 | 8,66 | 8,66 | 8,66 | 4,00 |
| Infermiere (ore/anno) | 4,33 | 6,50 | 13,00 | 39,00 | 3,00 |
| Drug test/anno | 42,5 | 63,75 | 127,5 | 127,5 | 24 |
| Distribuzione tra le frequenze | 0,00% | 49,32% | 36,99% | 13,70% | N/A |
| Frequenza somministrazione/anno | 26 | 26 | 52 | 365 | 12 |
ETW = ogni tre settimane; EOW = cadenza quindicinale (14 giorni).
Al fine di definire lo scenario che prevede il ricorso a PRB, sono stati considerati un tasso di uptake di tale strategia assistenziale pari al 5% nel primo anno di analisi e un andamento progressivamente crescente per una percentuale di pazienti in trattamento con PRB al termine dell’orizzonte temporale considerato di 5 anni pari al 48% (Tab. III), coerentemente con quanto stimato in un’indagine di mercato appositamente condotta (Elma Research Milan for Camurus September 2019: “Landscape Depot Buprenorphine Italy – Assessment of Buvidal potential impact on current treatment: source for Buvidal of current Buprenorphine sublingual”. Internal data on file).
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Totale | |
| Scenario senza PRB | ||||||
| SoC | 13.076 | 13.050 | 13.024 | 12.998 | 12.972 | 65.119 |
| Scenario con PRB | ||||||
| % uptake annuale PRB | 5,00% | 15,00% | 23,00% | 34,00% | 48,00% | |
| SoC | 12.422 | 11.092 | 10.028 | 8.579 | 6.745 | 48.867 |
| PRB | 654 | 1.957 | 2.995 | 4.419 | 6.226 | 16.252 |
SoC = standard of Care; PRB = prolonged-release buprenorphine.
Valorizzazione delle risorse
Al fine di valorizzare economicamente le risorse necessarie all’erogazione delle terapie, riferimento è stato fatto, relativamente alle alternative farmacologiche, alle Liste di Trasparenza dell’Agenzia Italiana del Farmaco (AIFA) (54), considerando, per ciascun principio attivo, il relativo costo ex-factory, da cui è stato reperito il costo/mg pesato per la dose media giornaliera prescritta al paziente per la determinazione del costo giornaliero della terapia farmacologica. È stato, infine, determinato, pesando tale costo giornaliero per il tasso di ricorso di ciascun principio attivo, il costo giornaliero medio della terapia farmacologica a oggi in uso nella real practice clinica (Standard of Care, SoC). Da tale estrapolazione, è emerso come il farmaco associato al costo di acquisizione più alto risulti essere il buprenorfina naloxone originator (€ 0,31), mentre la buprenorfina è il farmaco caratterizzato dal costo più basso (€ 0,16). Per tutti i comparatori è stata assunta, coerentemente al valore medio estrapolato dagli studi clinici inerenti all’efficacia clinica di PRB (55,56), una posologia giornaliera pari a 18,72 mg: infatti, dosaggi superiori a 16 mg garantiscono una saturazione dei recettori oppioidi cerebrali superiore al 96% (57), che si correla non solo con la riduzione dei sintomi astinenziali della patologia, ma anche con una riduzione del craving e delle ricadute. Si è, inoltre, considerato, sulla base dei risultati di vendita a dicembre 2020 per l’Italia, che il 93% dei pazienti in trattamento con buprenorfina naloxone faccia ricorso al farmaco originator e che il 7% sia in trattamento con la versione generica dello stesso principio attivo.
Per quanto concerne lo scenario associato all’introduzione di PRB, si è ipotizzato, con il fine di individuare uno scenario isocosto rispetto a quello di riferimento della real practice clinica e alla luce dei risultati ottenuti nell’analisi, un costo di acquisizione giornaliero della PRB di € 8,526, come prezzo che consente di ottenere un impatto neutro nel confronto tra le risorse assorbite nei due scenari. Tale costo tiene conto della prospettiva sociale considerata nell’analisi, che include sia i costi diretti sanitari che i costi sostenuti dal paziente in termini di perdite di produttività associate alla patologia. Si è, altresì, individuato il costo giornaliero della PRB, che consentirebbe un impatto neutrale, qualora si escludessero i costi indiretti, pari a € 5,869 (Tab. IV).
| Alternative farmacologiche | |||||
| Costo/mg | Tasso di utilizzo | Dose giornaliera media (mg) | Costo giornaliero | ||
| Buprenorfina | € 0,16 | 38,00% | 18,72 | € 2,9651 | |
| Buprenorfina naloxone – originator | € 0,31 | 57,66% | 18,72 | € 5,8712 | |
| Buprenorfina naloxone – generico | € 0,17 | 4,34% | 18,72 | € 3,0974 | |
| Prolongued Release Buprenorfine° | € 0,53 | N/A | 16 | € 8,5260 | |
| Costo medio giornaliero | € 4,6465 | ||||
| Professionisti sanitari e test diagnostici | |||||
| Costo unitario | |||||
| Medico/ora | € 82,80 (58) | ||||
| Infermiere/ora | € 26,40 (58) | ||||
| Drug test | € 6,20 (59) | ||||
(°)Buvidal.
| Classe lavorativa | Guadagno annuale | Guadagno orario | % pz per classe lavorativa |
|---|---|---|---|
| Dirigenti | € 101.096,00 | € 48,60 | 1,30% |
| Manager (livello intermedio) | € 54.136,00 | € 26,03 | 4,40% |
| Impiegato | € 30.770,00 | € 14,79 | 36,00% |
| Lavoratore/Apprendista | € 24.780,00 | € 11,91 | 58,30% |
| Perdita salariale oraria media | € 14,05 |
Pz = pazienti.
Per quanto concerne la realizzazione dei drug test, ossia valutazioni della presenza nelle urine di oppiacei sia terapeutici (buprenorfina), al fine di verificarne la corretta assunzione durante l’affido, sia di abuso, riferimento è stato fatto al Tariffario delle Prestazioni Specialistiche Ambulatoriali (59), da cui è stata reperita la tariffa di riferimento pari a € 6,20 per ciascuno dei farmaci dosati; in particolare, per il PRB questo dato è rilevante, poiché, dal momento che il farmaco è somministrato dall’operatore sanitario sottocute, si ha la certezza della corretta somministrazione e, conseguentemente, si rende superflua la verifica dell’assunzione della buprenorfina.
Dal momento che l’analisi ha assunto anche la prospettiva sociale, si è cercato di stimare i costi indiretti del paziente associati all’erogazione della terapia. A tale scopo, riferimento è stato fatto al Report Job Pricing 2019 (60), che indica la distribuzione dei lavoratori per classi di reddito. Su questa base è stato possibile stimare la perdita di produttività media oraria (€ 14,05, Tab. V) per il sottogruppo di pazienti attivi dal punto di vista lavorativo, assumendo un numero di ore lavorative settimanali pari a 40 e un’ora sottratta all’attività lavorativa per ogni volta che il paziente si reca presso la struttura preposta all’erogazione della terapia. Per la determinazione della percentuale di pazienti con dipendenza attiva dal punto di vista lavorativo, si è considerato il dato del Rapporto Tossicodipendenze 2018 – Analisi dei dati del Sistema Informativo Nazionale delle Dipendenze (31,55%) (61). Si è considerato che la perdita di produttività da parte del paziente fosse pari a un’ora per ciascuna somministrazione del farmaco presso la struttura preposta. Tale perdita è stata pesato per il numero di somministrazioni associate alle varie strategie di affido, nonché per la distribuzione dei pazienti tra le stesse (Tab. II).
Dal momento che l’aspetto più rilevante del ricorso alla strategia PRB è il suo impatto in termini organizzativi, al fine di individuarne l’effetto dal punto di vista della spesa sanitaria riallocabile alla luce del minor impegno richiesto da parte del personale coinvolto nonché dello stesso paziente e di un eventuale caregiver, si è derogato, per alcuni parametri, al ricorso ai tariffari di riferimento nazionali ed è stata condotta un’analisi di microcosting, metodo di stima dei costi che consente di valutare con precisione le risorse necessarie per l’erogazione degli interventi sanitari, particolarmente utile per stimare i costi reali delle strategie assistenziali dalla prospettiva del sistema sanitario e della società (62). In particolare, nel novero di tale analisi, il costo dei professionisti sanitari è stato reperito dallo studio di Ruggeri et al. (2017) (58), da cui è stato determinato un costo orario per il medico e per l’infermiere pari, rispettivamente, a € 82,80 e a € 26,40. Conseguentemente, è stato reperito il costo/minuto delle figure professionali, e tale costo è stato pesato per le tempistiche di erogazione delle terapie, così come individuate nell’esperienza di erogazione delle terapie per OUD condotta nel setting assistenziale italiano (Expert Opinion: Dottor Lorenzo Somaini).
Risultati
Sulla base della popolazione eleggibile e del tasso di uptake considerato per ciascun anno di analisi per PRB nell’intervallo temporale considerato nell’analisi (5 anni), è stato possibile determinare l’assorbimento di risorse associato ai due scenari messi a confronto. La Tabella VI mostra il consumo di risorse per macrovoce di spesa e anno di analisi associato a tali scenari. In particolare, per quanto concerne lo scenario che non prevede l’introduzione di PRB nel setting assistenziale italiano, dal primo anno di analisi, è possibile constatare come la voce associata al consumo di risorse maggiore sia quella relativa all’acquisizione delle alternative farmacologiche, pari a € 22.176.690,35.
Tale voce di spesa rimane quella associata all’assorbimento di costi maggiore per tutto il periodo considerato, con un impatto, nell’ultimo anno di analisi, pari a €21.999.276,82. Con una spesa di €13.986.846,18 nell’anno 1, la macrovoce associata al secondo maggiore assorbimento di risorse è quella relativa ai professionisti sanitari coinvolti nell’erogazione della terapia, che si assesta su un ammontare complessivo pari a € 85.326.755,09 nell’ultimo anno di analisi. Le perdite di produttività del paziente (costi indiretti) si configurano come il driver associato alla spesa più esigua, con un assorbimento di risorse pari a € 4.755.547,91 nel primo anno e a € 4.717.503,53 nell’ultimo anno di analisi. L’impatto complessivo di tale scenario risulta pari a € 242.530.679,63, in un orizzonte temporale di 5 anni (Tab. VI).
Per quanto concerne l’assorbimento di risorse associato allo scenario che prevede il ricorso a PRB, la Tabella VI riporta le medesime macrovoci di costo, distinguendo le spese relative alla gestione dei pazienti mediante ricorso alle strategie convenzionali (Standard of Care, SoC) e quelle associate al ricorso alla PRB. Dall’analisi dei costi associati allo scenario che prevede il ricorso a PRB emerge come vi sia un impatto significativo in termini di spesa associato all’acquisizione delle alternative farmacologiche: tale voce di spesa risulta, infatti, pari a € 23.102.597,28 nel primo anno di analisi, con un trend crescente nell’orizzonte temporale considerato, per un impatto, nel quinto anno, di € 30.816.873,76, coerentemente con l’incremento nel tasso di ricorso a PRB. In questo secondo scenario, la seconda macrovoce di costo in termini di impatto sulle risorse risulta nuovamente essere quella relativa al coinvolgimento dei professionisti sanitari che intervengono nell’erogazione della terapia, pari a € 13.555.825,17 e € 9.770.252,19 nel primo e nell’ultimo anno di analisi, rispettivamente. Anche in questo caso, i costi associati alle perdite di produttività dei pazienti sono quelli che riportano l’impatto più modesto sulle risorse assorbite, pari a € 4.552.543,97 e a € 2.784.256,41 rispettivamente nel primo e nel quinto anno di analisi. L’impatto complessivo di tale scenario risulta pari a € 242.530.679,63 in un orizzonte temporale di 5 anni, equivalente all’assorbimento di risorse associato allo scenario senza PRB (Tab. VI).
| Scenario senza PRB | ||||||
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Totale | |
| Acquisizione farmaco | € 22.176.690,35 | € 22.132.336,97 | € 22.087.983,59 | € 22.043.630,21 | € 21.999.276,82 | € 110.439.917,93 |
| Drug test | € 7.781.855,25 | € 7.766.291,54 | € 7.750.727,83 | € 7.735.164,12 | € 7.719.600,41 | € 38.753.639,14 |
| Professionisti sanitari | € 13.986.846,18 | € 13.958.872,48 | € 13.930.898,79 | € 13.902.925,10 | € 13.874.951,41 | € 69.654.493,95 |
| Costi indiretti | € 4.755.547,91 | € 4.746.036,82 | € 4.736.525,72 | € 4.727.014,63 | € 4.717.503,53 | € 23.682.628,61 |
| Totale/Anno | € 48.700.939,68 | € 48.603.537,81 | € 48.506.135,93 | € 48.408.734,05 | € 48.311.332,17 | € 242.530.679,63 |
| Totale/Cumulativo | € 48.700.939,68 | € 97.304.477,49 | € 145.810.613,42 | € 194.219.347,46 | € 242.530.679,63 | |
| Scenario con PRB | ||||||
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Totale | |
| Acquisizione farmaco | € 23.102.597,28 | € 24.904.502,33 | € 26.330.118,80 | € 28.302.020,37 | € 30.816.873,76 | € 133.456.112,54 |
| PRB | € 2.034.741 | € 6.092.016 | € 9.322.371 | € 13.753.224 | € 19.377.250 | € 50.579.603 |
| SoC | € 21.067.856 | € 18.812.486 | € 17.007.747 | € 14.548.796 | € 11.439.624 | € 82.876.509 |
| Drug test | € 7.489.973,26 | € 6.892.396,85 | € 6.413.441,29 | € 5.762.275,35 | € 4.939.949,81 | € 31.498.036,56 |
| PRB | € 97.211 | € 291.049 | € 445.381 | € 657.067 | € 925.758 | € 2.416.465 |
| SoC | € 7.392.762 | € 6.601.348 | € 5.968.060 | € 5.105.208 | € 4.014.192 | € 29.081.571 |
| Professionisti sanitari | € 13.555.825,17 | € 12.668.395,60 | € 11.956.132,96 | € 10.989.567,94 | € 9.770.252,19 | € 58.940.173,87 |
| PRB | € 268.321 | € 803.354 | € 1.229.341 | € 1.813.637 | € 2.555.277 | € 6.669.931 |
| SoC | € 13.287.504 | € 11.865.042 | € 10.726.792 | € 9.175.931 | € 7.214.975 | € 52.270.243 |
| Costi indiretti | € 4.552.543,97 | € 4.138.243,02 | € 3.806.442,87 | € 3.354.870,39 | € 2.784.256,41 | € 18.636.356,66 |
| PRB | € 34.773 | € 104.112 | € 159.318 | € 235.041 | € 331.155 | € 864.399 |
| SoC | € 4.517.771 | € 4.034.131 | € 3.647.125 | € 3.119.830 | € 2.453.102 | € 17.771.958 |
| Totale/Anno | € 48.700.939,68 | € 48.603.537,81 | € 48.506.135,93 | € 48.408.734,05 | € 48.311.332,17 | € 242.530.679,63 |
| Totale/Cumulativo | € 48.700.939,68 | € 97.304.477,49 | € 145.810.613,42 | € 194.219.347,46 | € 242.530.679,63 | |
| Analisi differenziale | ||||||
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Totale | |
| Acquisizione farmaco | € 925.906,94 | € 2.772.165,37 | € 4.242.135,22 | € 6.258.390,16 | € 8.817.596,93 | € 23.016.194,61 |
| Drug test | –€ 291.881,99 | –€ 873.894,69 | –€ 1.337.286,54 | –€ 1.972.888,77 | –€ 2.779.650,60 | –€ 7.255.602,59 |
| Professionisti sanitari | –€ 431.021,00 | –€ 1.290.476,88 | –€ 1.974.765,83 | –€ 2.913.357,16 | –€ 4.104.699,21 | –€ 10.714.320,08 |
| Costi indiretti | –€ 203.003,94 | –€ 607.793,80 | –€ 930.082,85 | –€ 1.372.144,23 | –€ 1.933.247,12 | –€ 5.046.271,94 |
| Totale/Anno | –€ 0,00 | –€ 0,00 | –€ 0,00 | –€ 0,00 | –€ 0,00 | –€ 0,00 |
| Totale/Cumulativo | –€ 0,00 | –€ 0,00 | –€ 0,00 | –€ 0,00 | –€ 0,00 | |
PRB = prolonged-release buprenorphine; SoC = standard of care.
Dal confronto tra i due scenari sui quali si basa l’analisi di impatto sul budget sanitario associato all’introduzione di PRB nel setting italiano, emerge come tale introduzione, assumendo un costo giornaliero pari a € 8,526, non comporti alcun aggravio di risorse relativamente alla spesa assistenziale per pazienti con OUD nell’orizzonte di analisi (Tab. VI e Fig. 1). A fronte dell’aumento delle risorse associate all’introduzione di PRB in termini di costi di acquisizione delle alternative farmacologiche, emerge come tale introduzione comporti, infatti, un risparmio in termini di altri costi sanitari diretti relativi alla diagnostica (numero di drug test effettuati), al tempo dedicato dai professionisti sanitari all’erogazione della terapia e alle perdite di produttività del paziente. Tale risparmio raggiunge il suo apice nel quinto anno, dimostrando come l’introduzione di PRB generi un complessivo aumento della salute generale, per cui i pazienti fanno meno ricorso a visite di monitoraggio e si sottopongono meno frequentemente a esami diagnostici. Questo trend è coerente con il fatto che il tasso di recidiva con PRB sia più modesto rispetto a quello associato alle alternative terapeutiche attualmente disponibili.
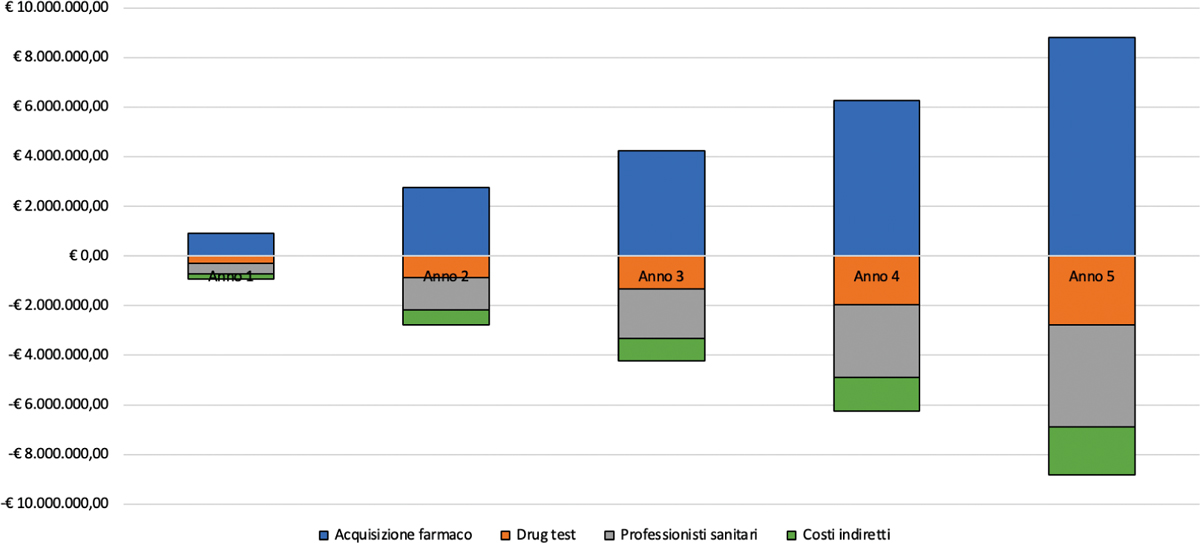
Fig. 1 - Rappresentazione grafica dell’analisi differenziale per voce di spesa “Scenario senza PRB” vs “Scenario con PRB”.
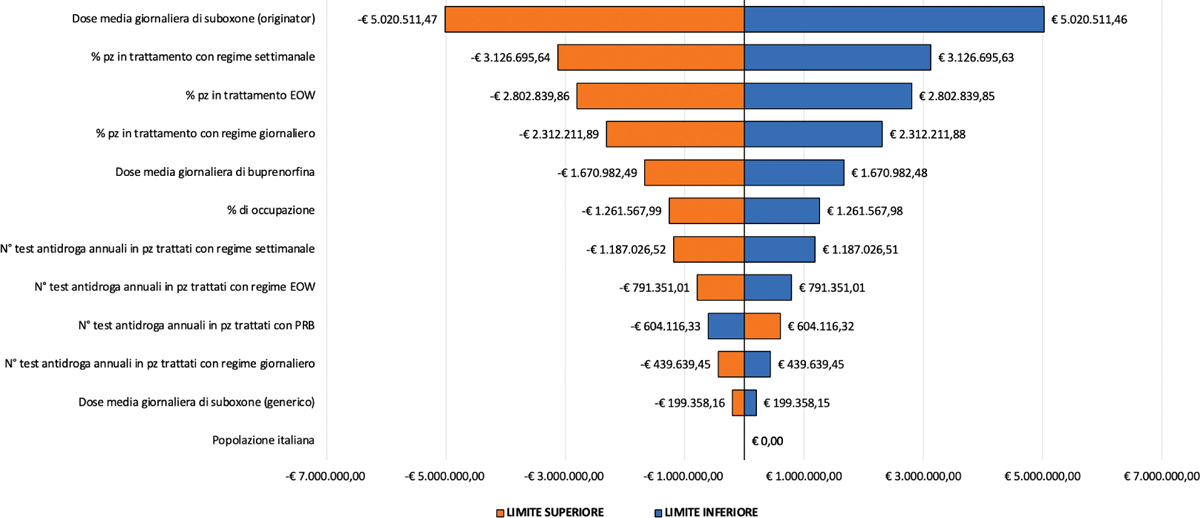
Fig. 2 - Analisi di sensibilità univariata.
Dall’analisi di sensibilità univariata, condotta sul risultato aggregato sui 5 anni, è emerso come il parametro la cui variazione influenza significativamente il risultato di Budget Impact sia la dose giornaliera media di buprenorfina naloxone originator (Fig. 2), con un andamento direttamente correlato a quello del Budget Impact: un aumento nel valore assoluto di tale parametro comporta, infatti, un incremento del risparmio fino a -€5.020.511,47, mentre una sua riduzione comporta un maggiore impatto sulle risorse impiegate della stessa entità.
Tra i parametri la cui variazione influenza in maniera più modesta il risultato del base-case, vi è il numero annuale di drug test eseguiti su pazienti in trattamento con PRB. L’andamento di tale parametro è, inoltre, inverso rispetto a quello del differenziale di budget ottenuto dal confronto tra i due scenari: all’aumentare del valore assoluto della frequenza, il differenziale di budget indica un aggravio di risorse pari a € 604.116,33, mentre una sua diminuzione comporta un risparmio della stessa entità. Tra i parametri che influenzano maggiormente i risultati ottenuti nel base-case dell’analisi si annoverano anche i tassi di ricorso alle varie strategie terapeutiche considerate: le percentuali di pazienti in regime di somministrazione settimanale, con frequenza ogni tre settimane e quindicinale risultano, rispettivamente, i fattori con il secondo, il terzo e il quarto maggior impatto sui risultati finali. Anche la dose giornaliera di buprenorfina naloxone generico è associata a una variazione marginale sul risultato finale e presenta una correlazione proporzionale all’andamento del risultato di budget.
Conclusioni e discussione
La presente analisi è volta a determinare, al livello più alto di accuratezza, a partire dalla definizione dell’attuale pratica clinica italiana e attraverso la conduzione di un’analisi economica integrata, i costi associati alla gestione dei pazienti affetti da OUD.
A tale scopo, è stato realizzato un modello di Budget Impact basato su uno scenario che assume la progressiva introduzione della strategia basata su PRB per la gestione dei pazienti eleggibili. Dal confronto tra gli scenari definiti nel modello, è emerso che l’introduzione di PRB nel setting italiano comporterebbe un aumento dei costi farmacologici di acquisizione pari a € 23.016.194,61 compensati da un significativo impatto organizzativo, che consentirebbe di alleggerire il burden dei professionisti sanitari preposti all’erogazione della terapia: considerando inoltre gli ulteriori risparmi sulla frequenza dei drug test e sulle perdite di produttività, l’introduzione di PRB non comporterebbe alcun aggravio di risorse assorbite per il Servizio Sanitario Nazionale nei 5 anni in oggetto e un costo-opportunità pari a –€ 10.714.320,08; tale è, infatti, il valore dell’efficientamento in termini di professionisti sanitari coinvolti di una gestione ottimale del paziente basata su una frequenza di erogazione della terapia mensile piuttosto che caratterizzata da frequenze di erogazione maggiori.
Tra i principali limiti dello studio si annovera il fatto che, per la determinazione delle tempistiche di erogazione delle terapie qui considerate, è stato fatto riferimento ai dati raccolti all’interno di un singolo servizio di cura che ha raccolto tali dati e, in particolare, a un singolo clinico.
Per ovviare alla mancanza di robustezza associata ad alcuni dei valori considerati nella presente analisi, come, per esempio, le appena citate tempistiche di erogazione delle terapie, è stata condotta un’analisi di sensitività univariata che ha evidenziato come la dose giornaliera di buprenorfina naloxone originator sia il parametro associato alla maggiore sensibilità rispetto ai risultati ottenuti nello scenario base. Da notare che una riduzione del 25% della dose giornaliera di buprenorfina naloxone rispetto a quella considerata nello scenario base porterebbe a considerare un dosaggio (ca. 14 mg) inferiore rispetto a quello necessario a garantire la piena efficienza del farmaco. Tale scenario si configura, dunque, in una dinamica limite nella pratica clinica, e questo aspetto è rilevante nell’interpretazione dei risultati dell’analisi di sensitività.
Il ricorso a PRB per la gestione dei pazienti affetti da OUD è risultato associato alla riduzione delle tempistiche destinate dai professionisti all’erogazione della terapia e dei costi indiretti per il paziente e, in definitiva, a un risparmio di risorse per il Sistema Sanitario Nazionale.
In un contesto, come quello attuale, caratterizzato dalla necessità di efficientamento della gestione delle risorse economiche del Servizio Sanitario Nazionale, risulta cruciale il ricorso ad alternative terapeutiche che, a parità di impatto clinico sul paziente, consentano di ridurre i costi. Ciò considerato, è auspicabile, alla luce dei risultati ottenuti nella presente analisi, un sempre maggior ricorso alla strategia basata su PRB nel setting assistenziale italiano, con l’auspicio che ulteriori analisi su larga scala in tale ambito vadano a irrobustire l’evidenza scientifica disponibile in letteratura.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: The present analysis was funded by Camurus AB. The views expressed by the authors in the manuscript are not necessarily those of the Company.
Bibliografia
- 1. Wermeling DP. Review of naloxone safety for opioid overdose: practical considerations for new technology and expanded public access. Ther Adv Drug Saf. 2015;6(1):20-31. CrossRef PubMed
- 2. Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380(9859):2095-2128. CrossRef PubMed
- 3. Fischer B, Rehm J, Patra J, Cruz MF. Changes in illicit opioid use across Canada. CMAJ. 2006;175(11):1385-1385. CrossRef PubMed
- 4. Fischer B, Cruz MF, Rehm J. Illicit opioid use and its key characteristics: a select overview and evidence from a Canadian multisite cohort of illicit opioid users (OPICAN). Can J Psychiatry. 2006;51(10):624-634. CrossRef PubMed
- 5. Dhalla IA, Mamdani MM, Sivilotti ML, Kopp A, Qureshi O, Juurlink DN. Prescribing of opioid analgesics and related mortality before and after the introduction of long-acting oxycodone. CMAJ. 2009;181(12):891-896. CrossRef PubMed
- 6. American Society of Addiction Medicine (ASAM), Definition of addiction. Online (Ultimo accesso: 6/7/2021).
- 7. American Addition Center. The effects of opiates on the body. Online (Ultimo accesso: 6/7/2021).
- 8. Alho H, Dematteis M, Lembo D, Maremmani I, Roncero C, Somaini L. Opioid-related deaths in Europe: strategies for a comprehensive approach to address a major public health concern. Int J Drug Policy. 2020;76:102616. CrossRef PubMed
- 9. Connock M, Juarez-Garcia A, Jowett S, et al. Methadone and buprenorphine for the management of opioid dependence: a systematic review and economic evaluation. In: NIHR Health Technology Assessment programme: Executive Summaries. NIHR Journals Library; 2007. CrossRef
- 10. Fischer G, Nava F, Stöver H. Outcomes of opioid-dependence treatment across Europe: identifying opportunities for improvement. 2012. Heroin Addict Relat Clin Probl. 2012; 14(4):39-50 Online (Ultimo accesso: 15/7/21)
- 11. World Health Organization. Guidelines for the Psychosocially Assisted Pharmacological Treatment of Opioid Dependence. 2009. Online (Ultimo accesso: 6/7/2021).
- 12. De Maeyer J, Vanderplasschen W, Broekaert E. Quality of life among opiate-dependent individuals: A review of the literature. Int J Drug Policy. 2010;21(5):364-380. CrossRef PubMed
- 13. United Nations Office on Drugs and Crime. World Drug Report. 2016. Online (Ultimo accesso: 6/7/2021).
- 14. Fischer JA, Conrad S, Clavarino AM, Kemp R, Najman JM. Quality of life of people who inject drugs: characteristics and comparisons with other population samples. Qual Life Res. 2013;22(8):2113-2121. CrossRef PubMed
- 15. Srivastava, S., Bhatia, M. S., Rajender, G., & Angad, S. Quality of life in substance use disorders. Delhi Psychiatry Journal. 2009;12(1), 114-120.
- 16. FDA News Release: FDA approves first buprenorphine implant for treatment of opioid dependence. Online
- 17. Istituto Superiore di Sanita (ISS) – Relazione annuale al parlamento sul fenomeno delle tossicodipendenze in Italia anno 2020 (dati 2019). Online
- 18. Schottenfeld RS. Opioid maintenance treatment. In: Galanter M, Kleber Hd, eds. The American Psychiatric Publishing Textbook of substance abuse treatment. Arlington, VA: American Psychiatric Publishing, Inc; 2008:289308.
- 19. National Institute for Health and Care Excellence. Drug misuse in over 16s: opioid detoxifification. Clinical guideline 2007. Online
- 20. National Institute for Health and Care Excellence. Drug use disorders in adults. Quality standard 2012. Online
- 21. National Institute for Health and Care Excellence. Tackling drug use, 2014 Online
- 22. Dennis BB, Naji L, Bawor M, et al. The effectiveness of opioid substitution treatments for patients with opioid dependence: a systematic review and multiple treatment comparison protocol. Syst Rev. 2014;3(1):105. CrossRef PubMed
- 23. Benyamina A. The current status of opioid maintenance treatment in France: a survey of physicians, patients, and out-
of-treatment opioid users. Int J Gen Med. 2014;7:449-457. CrossRef PubMed - 24. Guillou Landreat M, Rozaire C, Guillet JY, Victorri Vigneau C, Le Reste JY, Grall Bronnec M. French experience with buprenorphine: do physicians follow the guidelines? PLoS One. 2015;10(10):e0137708. CrossRef PubMed
- 25. Istituto Superiore di Sanità (ISS). The ASAM National Practice Guideline for the Treatment of Opioid Use Disorder: 2020 Focused Update. Online (Ultimo accesso: 6/7/2021).
- 26. Istituto Superiore di Sanità (ISS). Oppiacei: trattamenti di mantenimento. Online (Ultimo accesso: 6/7/2021).
- 27. Dematteis M, Auriacombe M, D’Agnone O, et al. Recommendations for buprenorphine and methadone therapy in opioid use disorder: a European consensus. Expert Opin Pharmacother. 2017;18(18):1987-1999. CrossRef PubMed
- 28. Bonhomme J, Shim RS, Gooden R, Tyus D, Rust G. Opioid addiction and abuse in primary care practice: a comparison of methadone and buprenorphine as treatment options. J Natl Med Assoc. 2012;104(7-8):342-350. CrossRef PubMed
- 29. Mégarbane B, Hreiche R, Pirnay S, Marie N, Baud FJ. Does high-dose buprenorphine cause respiratory depression?: possible mechanisms and therapeutic consequences. Toxicol Rev. 2006;25(2):79-85. CrossRef PubMed
- 30. Wolff K. Substance Misuse: Substitution Drugs. In Encyclopedia of Forensic and Legal Medicine: Second Edition. Elsevier Inc. 2015;436-441.
- 31. Whelan PJ, Remski K. Buprenorphine vs methadone treatment: A review of evidence in both developed and developing worlds. J Neurosci Rural Pract. 2012;3(1):45-50. CrossRef PubMed
- 32. Gowing LR, Farrell M, Bornemann R, Sullivan LE, Ali RL. Brief report: methadone treatment of injecting opioid users for prevention of HIV infection. J Gen Intern Med. 2006;21(2):193-195. CrossRef PubMed
- 33. Gronbladh L, Ohlund LS, Gunne LM. Mortality in heroin addiction: impact of methadone treatment. Acta Psychiatr Scand. 1990;82(3):223-227. CrossRef PubMed
- 34. Mattick RP, Ali R, White JM, O’Brien S, Wolk S, Danz C. Buprenorphine versus methadone maintenance therapy: a randomized double-blind trial with 405 opioid-dependent patients. Addiction. 2003;98(4):441-452. CrossRef PubMed
- 35. European Monitoring Centre for Drugs and Drug Addiction. Perspectives on drugs. Strategies to prevent diversion of opioid substitution treatment medications. 2016. Online (Ultimo accesso: 6/7/2021).
- 36. Strang J, Hall W, Hickman M, Bird SM. Impact of supervision of methadone consumption on deaths related to methadone overdose (1993-2008): analyses using OD4 index in England and Scotland. BMJ. 2010;341(sep16 2):c4851. CrossRef PubMed
- 37. Auriacombe M, Fatseas M, Franques-Reneric P, Daulouede JP, Tignol J. Substitution therapy in drug addictions. Rev Prat. 2003;53(12):1327-1334. PubMed
- 38. Cook C, Bridge J, McLean S, et al. The funding crisis for harm reduction: Donor retreat, government neglect and the way forward. London: International Harm Reduction Association; 2014.
- 39. Adfam. Medications in drug treatment: tackling the risks to children; 2014. Online
- 40. Frauger E, Nordmann S, Orleans V, et al; reseau des CEIPs. Which psychoactive prescription drugs are illegally obtained and through which ways of acquisition? About OPPIDUM survey. Fundam Clin Pharmacol. 2012;26(4):549-556. CrossRef PubMed
- 41. Hansen RN, Oster G, Edelsberg J, Woody GE, Sullivan SD. Economic costs of nonmedical use of prescription opioids. Clin J Pain. 2011;27(3):194-202. CrossRef PubMed
- 42. European Monitoring Centre for Drugs and Drug Addiction. European Drug Report: Trends and Developments, 2017. Online
- 43. Dale-Perera A, Goulao J, Stover H. Quality of care provided to patients receiving opioid maintenance treatment in Europe: results from the EQUATOR analysis. Heroin Addict Relat Clin Probl. 2012;14(4). 23-38.
- 44. European Medicine Agency (EPAR). Buvidal – Assessment report. Online (Ultimo accesso: 6/7/2021).
- 45. Advisory Council on the Misuse of Drugs. How can opioid substitution therapy (and drug treatment and recovery systems) be optimised to maximise recovery outcomes for service users? 2015. Online
- 46. National Institute for Health and Care Excellence. Methadone and buprenorphine for the management of opioid dependence. Technology appraisal guidance, 2007. Online
- 47. Faggiano F, Vigna-Taglianti F, Versino E, Lemma P. Methadone maintenance at different dosages for opioid dependence. Cochrane Database Syst Rev. 2003;2003(3):CD002208. CrossRef PubMed
- 48. Stöver H. Assessing the current state of public-health-related outcomes in opioid dependence across Europe: data from the EQUATOR analysis. Heroin Addict Relat Clin Probl. 2012;14(4):51-64.
- 49. Benyamina A, Stöver H. Barriers to treatment access and informed patient choice in the treatment of opioid dependence in Europe. Heroin Addict Relat Clin Probl. 2012;14(4):65-80.
- 50. Bacha J, Reast S, Pearlstone A. Treatment practices and perceived challenges for European physicians treating opioid dependence. Heroin Addict Relat Clin Probl. 2010;12(3):9-19.
- 51. Riassunto delle Caratteristiche del Prodotto (RCP). European Medicine Agency (EMA). Online (Ultimo accesso: 6/7/2021).
- 52. Lofwall MR, Walsh SL, Nunes EV, et al. Weekly and monthly subcutaneous buprenorphine depot formulations vs daily sublingual buprenorphine with naloxone for treatment of opioid use disorder: a randomized clinical trial. JAMA Intern Med. 2018;178(6):764-773. CrossRef PubMed
- 53. Istituto Italiano di Statistica (ISTAT). Popolazione e famiglie. Online (Ultimo accesso: 6/7/2021).
- 54. Liste di Trasparenza dell’Agenzia Italiana del Farmaco (AIFA). Online (Ultimo accesso: 6/7/2021).
- 55. Parsons G, Ragbir C, D’Agnone O, Gibbs A, Littlewood R, Hard B. Patient-Reported Outcomes, Experiences and Satisfaction with Weekly and Monthly Injectable Prolonged-Release Buprenorphine. Subst Abuse Rehabil. 2020;11:41-47. CrossRef PubMed
- 56. D’Agnone O. Successful Treatment of opioid dependence with flexible doses of injectable prolonged release buprenorphine. Case Rep Psychiatry. 2019;2019:9381346. CrossRef PubMed
- 57. Comer S., Cunningham C., Fishman MJ et al. National practice guideline for the use of medications in the treatment of addiction involving opioid use. Am Soc Addicit Med, 2015; 66.
- 58. Ruggeri M, Basile M, Armuzzi A, Cicchetti A. Activity-based costing and budget analysis of vedolizumab versus conventional treatments in ulcerative colitis and Crohn’s disease. Global & Regional Health Technology Assessment. 2017;4(1):88-99.
- 59. Ministero della Salute – Tariffario delle Prestazioni Specialistiche Ambulatoriali; Online
- 60. Job Pricing: All About Rewards – Salary Outlook 2019: L’analisi del mercato retributivo Italiano – dati aggiornati al secondo semestre 2018;. Online
- 61. Ministero della Salute (MdS). Rapporto Tossicodipendenze. Analisi dei dati del Sistema Informativo Nazionale delle Dipendenze. 2018. Online
- 62. Xu X, Grossetta Nardini HK, Ruger JP. Micro-costing studies in the health and medical literature: protocol for a systematic review. Syst Rev. 2014;3(1):47. CrossRef PubMed