 |
Glob Reg Health Technol Assess 2021; 8: 22-28 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2219 ORIGINAL RESEARCH ARTICLE |
 |
Il futuro dei Fondi per Farmaci Innovativi: risultati di uno studio basato su Delphi panel
The future of Funds for Innovative Medicines: results from a Delphi Study
Introduction: Dedicated Funds for Innovative Medicines were introduced in 2017 for cancer and non-cancer drugs in Italy. After three years, their impact on patient access to the relevant treatments and critical issues about their management has been poorly investigated.
Aims and scope. This paper aims at bridging the literature gap and providing possible reforms scenarios.
Methods: Our analysis relied on a qualitative approach. The personal opinions of twelve Italian experts coming from the Ministry of Economy and Finance, the Scientific Committee of the Italian Medicines Agency, the Regions and Patient Associations, the Oncologists’ Scientific Societies and Hospital Pharmacists were elicited through a Delphi approach. A consensus on final recommendations was reached in two rounds.
Results: Experts were in favour of maintaining dedicated Funds for Innovative Medicines and had a distinct preference for a single Fund. Most of them suggested to extend access to Funds to more than three years, if, for the relevant indication, there are no alternatives to the innovative drug and provided that this does not represent a barrier to new entries. Responders advocated for Funds being covered by on top resources and the production of more evidence on their impact. They finally claimed a speeder flow of information to the regions on expenditure for innovative treatments and an enhancement of controls on prescribing behaviour, to avoid prescriptions be dependent on Funds capacity.
Conclusions: The consensus document provides for eight recommendations that could be taken into account for possible reforms and future research on this topic.
Keywords: Dedicated Funds, Delphi Study, Innovative medicines, Pharmaceutical policy
Received: December 12, 2020
Accepted: February 8, 2021
Published online: March 15, 2021
This article includes supplementary material
Corresponding author:
Claudio Jommi
Cergas, Centro di Ricerche sulla Gestione dell’Assistenza Sanitaria e Sociale
SDA Bocconi School of Management
Università Bocconi
Via Sarfatti 25
20136 Milano - Italy
claudio.jommi@unibocconi.it
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Premessa e obiettivo dell’analisi
Istituzione e regolazione dei Fondi per Farmaci Innovativi
La Legge 232/2016 ha istituito due Fondi, con una dotazione di 500 milioni ciascuno, dedicati ai farmaci innovativi oncologici e non oncologici. Successivamente, la Determina dell’Agenzia Italiana del Farmaco (Aifa) 519/2017 (poi modificata dalla Determina Aifa 1535/2017) ha stabilito i criteri per la classificazione dei farmaci innovativi, la procedura di valutazione e la durata di validità dell’innovatività piena (massimo tre anni) e condizionata o potenziale (18 mesi). A oggi (1) sono 77 i farmaci/indicazioni valutati, di cui il 34%, il 27% e il 39% sono stati, rispettivamente, considerati innovativi, innovativi potenziali e non innovativi.
I Fondi per Farmaci Innovativi (FFI) sono destinati alla copertura della spesa per le sole regioni a statuto ordinario, ad eccezione della Sicilia, che attinge ai due FFI per il 50% della quota di riparto. La Legge 232/2016 ha stabilito che, in caso di sfondamento dei due FFI, la differenza viene ribaltata sulla spesa per farmaci acquistati direttamente dalle aziende sanitarie pubbliche, gravata da un tetto specifico (come la spesa per farmaci acquistati e dispensati a carico del Servizio Sanitario Nazionale, SSN, dalle farmacie aperte al pubblico).
Il DM 16/2/2018 ha definito le modalità operative per l’allocazione dei FFI (Fig. 1). Formalmente, i FFI dovrebbero essere allocati alle regioni a rimborso della spesa sostenuta per residenti, fino a una capienza complessiva dei FFI stessi. In sostanza, a inizio anno, viene erogato alle regioni un acconto proporzionale alla quota di accesso al fabbisogno sanitario standard regionale. L’anno successivo, sulla base dei dati di acquisto (riferiti all’anno precedente) per farmaci innovativi da parte delle regioni e del saldo dell’eventuale mobilità interregionale (dati comunicati dall’Aifa al Ministero della Salute entro il 31 gennaio), vale a dire del saldo tra spesa sostenuta dalla regione per pazienti non residenti (flusso attivo) e spesa sostenuta per pazienti residenti trattati in altre regioni (flusso passivo), viene erogato l’eventuale conguaglio contestualmente all’allocazione dei FFI per l’anno corrente. Eventuali scostamenti interregionali (tra regioni che accedono ai FFI) vengono regolati attraverso il sistema di ridistribuzione delle eccedenze tra regioni debitrici (regioni che hanno speso di meno rispetto all’assegnato) e regioni creditrici (regioni che hanno speso di più rispetto all’assegnato), sempre nei limiti delle risorse totali stanziate per ciascun FFI. Viene, infine, previsto che le strutture private accreditate, al fine di beneficiare del finanziamento dai FFI, debbano acquistare il farmaco tramite una struttura pubblica della stessa regione, che lo acquista per conto dell’ente privato.
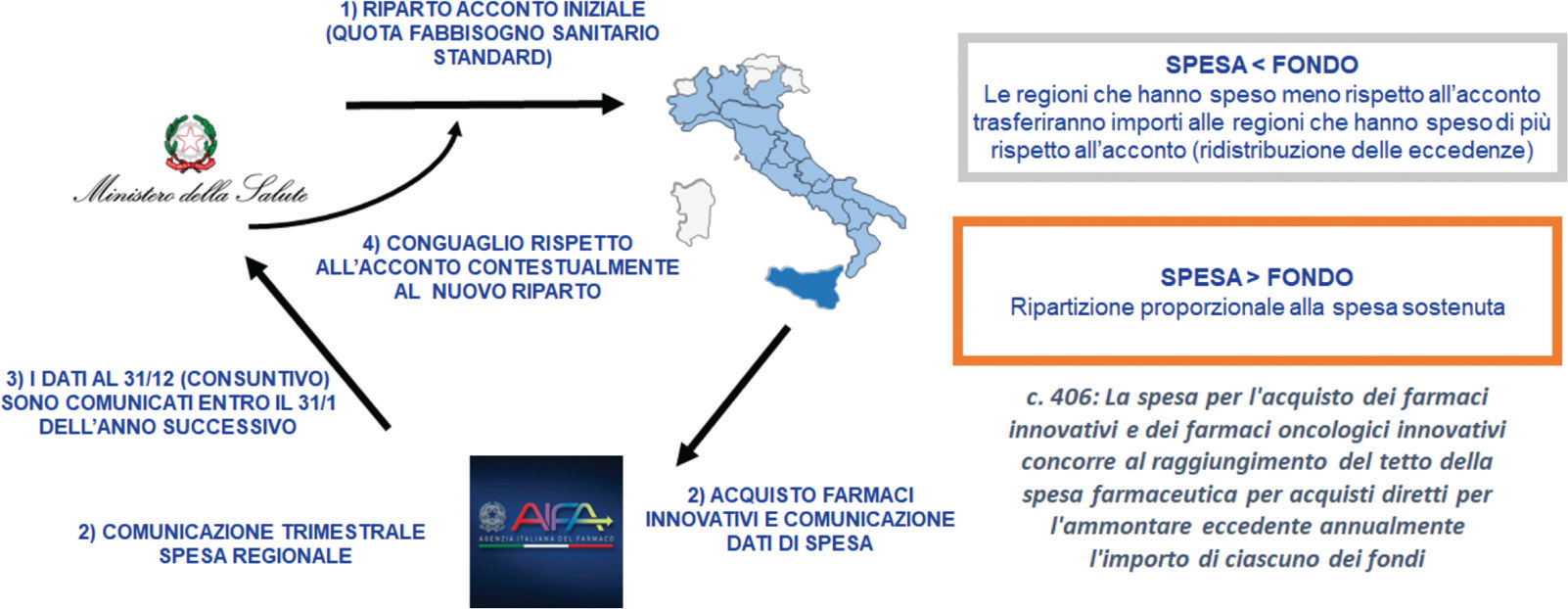
Nota: c. 406 = comma 406.
I dati sulla spesa per farmaci innovativi vengono pubblicati sui documenti di Monitoraggio della Spesa Farmaceutica Nazionale e Regionale e progressivamente aggiornati sulla base dei dati di spesa a prezzi effettivi di cessione (dati tracciabilità) e dell’entità dei payback collegati ad accordi di rimborso condizionato di tipo finanziario o outcome-based. Nel triennio 2017-2019, con riferimento alle sole regioni che accedono ai due FFI, non si sono verificati sfondamenti. I dati a consuntivo 2019 mostrano una spesa di 376 e 373 milioni di euro rispettivamente per i farmaci con indicazioni oncologiche e non oncologiche (Fig. 2).
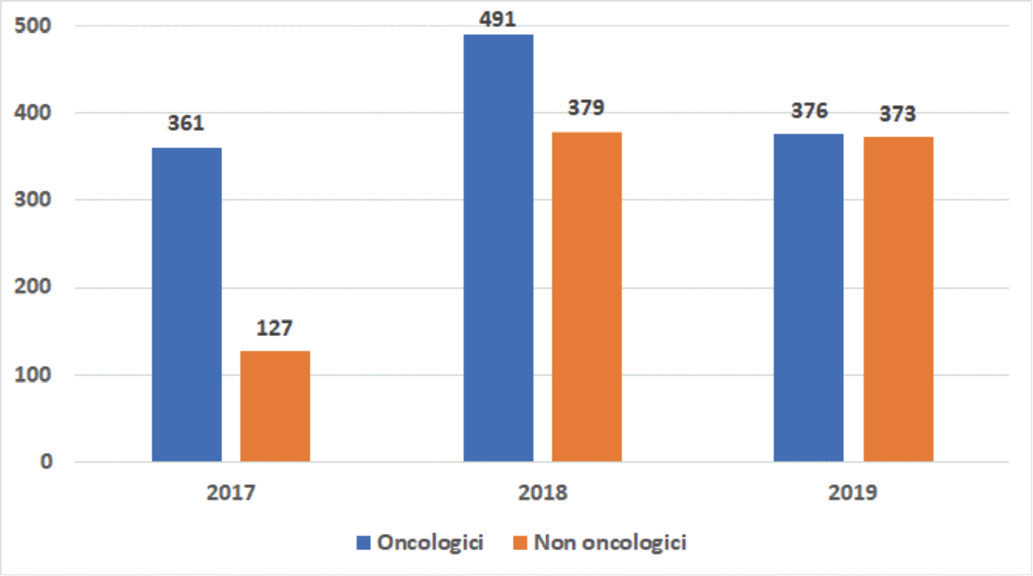
Fonte: Monitoraggio della Spesa Farmaceutica Nazionale e Regionale (dati a consuntivo) (2).
La Legge 232/2016 ha previsto anche che il Ministero della Salute, di concerto con il Ministero dell’Economia e delle Finanze (MEF), avvii un monitoraggio degli effetti dell’utilizzo dei farmaci innovativi e innovativi oncologici sul costo del percorso terapeutico-assistenziale dei pazienti, sulla base dei dati di real world e delle informazioni ricavate dai Registri Farmaci. L’obiettivo dichiarato è quello di “migliorare l’allocazione delle risorse programmate per il SSN, ricomprendendo la valutazione della congruità dei Fondi per Farmaci Innovativi e per Farmaci Innovativi Oncologici”. A novembre 2020 non sono state rese pubbliche le azioni conseguenti a tale obiettivo e le evidenze derivanti da tale azione di monitoraggio.
Razionale dei Fondi per Farmaci Innovativi ed evidenze di impatto
La costituzione di FFI ha rappresentato un importante segnale di attenzione nei confronti dei farmaci per i quali il SSN attribuisce priorità nell’accesso per la natura del target (patologia rilevante per la quale non esistono valide alternative terapeutiche) e l’importante valore terapeutico aggiunto. La necessità di creare FFI non nasce solo dall’esigenza di finanziare in modo specifico/vincolato i farmaci innovativi, ma anche dall’attuale incapienza del tetto di spesa con cui, in assenza dei FFI, tali farmaci dovrebbero essere finanziati, vale a dire il tetto per farmaci acquistati da aziende sanitarie pubbliche. La successiva definizione di criteri, inclusa la qualità delle evidenze e delle procedure di valutazione dell’innovatività, mostra la chiara intenzione di rendere il sistema di valutazione dell’innovatività il più possibile trasparente e riproducibile.
Sono, a oggi, molto limitate le evidenze (i) sull’efficacia delle misure adottate per i farmaci innovativi (oltre ai FFI, l’accesso immediato nei diversi contesti regionali e locali) e non è chiaro in che misura esse abbiano generato effettivamente un accesso più rapido alle terapie innovative per i pazienti e (ii) relative alle criticità associate alla gestione dei flussi finanziari collegati a tali FFI a livello regionale e di aziende sanitarie.
A conoscenza degli autori e al momento della redazione di questo manoscritto, è stata pubblicata solo un’indagine condotta da Cittadinanzattiva (3), avente come target i medici prescrittori e i farmacisti del SSN. Da tale indagine emerge che circa il 50% dei rispondenti ritiene l’inserimento dei farmaci innovativi nel Prontuario Terapeutico Regionale o Aziendale vincolante ai fini della loro prescrizione ed erogazione, quando, in base alla normativa, i farmaci innovativi (anche se potenziali) dovrebbero essere immediatamente accessibili, indipendentemente dal loro inserimento nei Prontuari Regionali e Locali. Nella stessa indagine vengono rilevate delle criticità sul funzionamento delle Commissioni Terapeutiche Regionali e Aziendali (tempistiche di valutazione da parte delle Commissioni e frequenza/periodicità delle riunioni nelle quali si esprimono sulle richieste di inserimento dei farmaci nei Prontuari stessi) e nella fase post-inserimento nei Prontuari Regionali (se esistenti), generate dalle procedure di acquisto.
Sono, poi, rintracciabili osservazioni aneddotiche che sembrano sostenere gli effetti positivi della scelta adottata. Con riferimento ai tempi di negoziazione dei farmaci, un contributo ha evidenziato come i tempi di valutazione e negoziazione del prezzo e rimborso dei farmaci (dall’inizio della valutazione da parte della Commissione Tecnico-Scientifica, CTS, alla pubblicazione in GU della Determina di Prezzo e Rimborso) siano stati, nel 2015-2017 (vale a dire prima della definizione dei due FFI e dei nuovi criteri per la definizione dell’innovatività), inferiori per gli innovativi rispetto ai non innovativi (4). Nella prospettiva dei pazienti, Cittadinanzattiva valuta positivamente l’istituzione dei FFI e auspica un pieno utilizzo dei FFI istituiti per garantire la disponibilità dei farmaci innovativi (3). Nella prospettiva dei clinici, l’Associazione Italiana di Oncologia Medica (AIOM), in occasione del Congresso Annuale 2019, ha esplicitamente richiesto la conferma dei FFI per il triennio 2020-2022, auspicando un incremento delle risorse allocate (5). In occasione del Convegno della Società Europea di Oncologia Medica ESMO, il Presidente AIOM, Dottor Giordano Beretta, ha dichiarato che “Il Fondo è la valvola di sicurezza, vale a dire che offre la possibilità di garantire le cure più innovative a un maggior numero di pazienti” (6).
Obiettivo della ricerca
Obiettivo del presente studio è colmare i gap di letteratura, valutando l’impatto dell’esistenza dei FFI nella prospettiva dei diversi portatori di interesse, con riferimento, nello specifico:
1. all’effetto sull’accesso dei farmaci innovativi;
2. ai vantaggi e alle criticità generate dalla loro gestione;
3. alle possibili azioni per migliorarne il funzionamento in futuro.
Metodi
L’analisi si è basata sulla raccolta strutturata dell’opinione di esperti. Per esperti si intendono i soggetti che hanno compartecipato alla definizione dei FFI, ai requisiti per l’accesso dei farmaci a tali FFI, alla loro allocazione, alla loro gestione e all’utilizzo dei farmaci innovativi (Ministero della Salute, MEF, Aifa, Regioni, Farmacisti del SSN, Clinici Oncologi e Pazienti).
Il ricorso alla valutazione percettiva di un panel ha due motivazioni. Con riferimento al primo obiettivo (colmare i gap informativi di letteratura analizzando l’effetto sull’accesso dei farmaci innovativi), una valutazione di tipo qualitativo integra eventuali approcci di tipo quantitativo per i quali le informazioni sono incomplete. Sono, infatti, disponibili i dati di proxy di tale accesso (primo acquisto), ma non quelli effettivi di penetrazione del mercato derivanti dai dati dei Registri Farmaci. L’assenza di tali informazioni è dovuta, soprattutto, al fatto che i) l’innovatività è definita per indicazione e non per principio attivo e ii) i dati dei Registri Farmaci relativi alla popolazione target (per comprendere il grado di copertura di tale popolazione nel tempo) non sono disponibili. Rispetto agli altri due obiettivi (vantaggi e criticità generati dalla gestione dei FFI e possibili azioni per migliorarne il funzionamento in futuro), l’opinione di esperti rappresenta l’evidenza più robusta, data l’eterogeneità dell’oggetto specifico della ricerca, la difficoltà di individuare indicatori omogenei e le importanti problematiche di raccolta dati nelle aziende sanitarie.
La raccolta dell’opinione di esperti è avvenuta per tramite del Metodo Delphi. Il Metodo Delphi (7,8,9) prevede un’interazione tra ricercatori e intervistati a partire da un documento predisposto dai ricercatori. I panelist operano in cieco tra di loro e il consenso su una rappresentazione finale delle valutazioni avviene attraverso step successivi (in genere, massimo tre). In questo caso, il Metodo Delphi è stato scelto per tre motivi: i) rispetto a interviste semistrutturate, tale tecnica fornisce un percorso strutturato per far convergere i partecipanti verso un documento condiviso; ii) tale tecnica ha il vantaggio di consentire un contributo paritario da parte degli esperti, essendo il parere espresso in cieco, con successivo confronto/mediazione da parte del ricercatore negli step successivi al primo; iii) altri metodi (per esempio, il Focus Group) sono più complessi da gestire in presenza di un elevato contenuto tecnico delle domande rivolte dal ricercatore, considerando anche la necessità di organizzare Focus Group in remoto (data l’attuale situazione di emergenza sanitaria).
Le fasi dello Studio Delphi sono state le seguenti:
• costruzione e validazione del questionario dello Studio Delphi da parte di un potenziale responder (febbraio-aprile 2020) (cfr. Allegato, materiale supplementare);
• reclutamento degli esperti (maggio 2020);
• primo round, vale a dire risposta alle domande del questionario (luglio 2020);
• secondo round, vale a dire sintesi delle risposte da parte dei ricercatori e condivisione del report di sintesi (settembre 2020);
• condivisione del documento finale (ottobre 2020).
L’individuazione degli esperti è avvenuta sulla base dell’interesse da parte dei candidati a partecipare al progetto di ricerca (sample of convenience) (10).
Hanno partecipato 12 esperti sui 14 contattati: un referente del MEF, due referenti delle Commissioni Aifa (i due Presidenti di CTS e Comitato Prezzi-Rimborso, CPR), due referenti dei Servizi Farmaceutici Regionali, tre referenti clinici oncologi di Società Scientifiche, due referenti di Associazioni Pazienti/Associazioni di Tutela dei Diritti dei Cittadini e due farmacisti di aziende sanitarie. Non ha partecipato il Ministero della Salute, per motivi di indisponibilità di tempo. Tutti i responder, elencati nei Ringraziamenti, hanno partecipato a titolo personale.
Il testo delle undici domande rivolte agli esperti è riportato nell’Allegato (cfr. Allegato, materiale supplementare). Una delle undici domande è risultata ostica per i responder (Domanda 11) e, per tale ragione, non ne vengono riportati i risultati, in quanto pochi hanno risposto.
Le domande prevedono risposte multiple (con una o più opzioni di risposta) o sono poste in termini di classificazione (ranking) di rilevanza. Il grado di concordanza sul ranking è stato valutato sulla base dell’Indice W di Kendall, indice compreso tra lo 0% (concordanza nulla) e il 100% (concordanza assoluta) (11). L’indice W di Kendall è calcolato come:
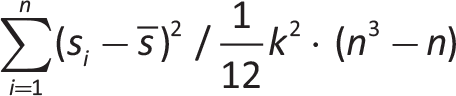
dove si è la posizione attribuita all’elemento dal responder i, s soprassegnato rappresenta il ranking medio attribuito all’elemento s, k è il numero degli elementi oggetto di ranking e n è il numero di responder.
A partire dalle risposte degli esperti sono state condivise e validate otto raccomandazioni. Su due domande il livello di accordo è risultato troppo basso per poter generare delle raccomandazioni condivise.
Risultati
Quasi tutti gli esperti ritengono positiva l’introduzione dei FFI (Domanda 1). Le principali motivazioni di tale orientamento sono la possibilità di avere un Fondo certo a cui attingere per il finanziamento di farmaci valutati sulla base di criteri specifici e selettivi e la necessità di mantenere un segnale di attenzione da parte della politica nei confronti di tali farmaci.
Gli esperti non hanno espresso una visione concorde sulla rilevanza dei vantaggi dell’innovatività e, in particolare, dei FFI (Domanda 2). Tali vantaggi sono stati ricondotti all’accelerazione dei tempi necessari ai pazienti per accedere alle terapie giudicate innovative, all’agevolazione della prescrivibilità di terapie innovative da parte dei medici, all’incremento delle risorse dedicate a patologie di particolare severità e alla potenziale riduzione della disomogeneità di accesso a livello regionale. Ne derivano un ranking medio molto simile e un indice di concordanza estremamente basso, segni di un notevole disaccordo tra esperti o di incertezza nell’attribuire un ranking agli elementi individuati (Fig. 3). Alcuni esperti hanno introdotto ulteriori elementi di valore, come la possibilità di ottimizzare la gestione delle risorse avendo Fondi dedicati ai farmaci innovativi o fattori collegati all’innovatività più che ai FFI: per esempio, il fatto che il farmaco a indicazione innovativa sia immediatamente disponibile per il paziente a valle della pubblicazione della Determina di Prezzo e Rimborso di Aifa.

Nota: il ranking varia da 1 (più importante) a 4 (meno importante). L’indice di concordanza di Kendall è pari allo 0,4%. Un esperto non ha risposto, in quanto non ha ritenuto utile il mantenimento dei FFI. Un esperto ha indicato come non rilevanti i fattori suggeriti sopra e ha, invece, sottolineato come il valore nasca dalla natura dei FFI stessi (risorse dedicate e vincolate ai farmaci innovativi) e dal fatto che gli stessi farmaci non siano soggetti a payback da parte delle imprese, fino a capienza di ciascuno dei due FFI.
Due domande hanno avuto per oggetto le prospettive di riforma dei FFI.
Nella prima (Domanda 3), si è chiesto quali fossero i cambiamenti desiderati. Otto esperti hanno proposto una riforma rappresentata (i) dall’adozione di un Fondo unico, vista la difficoltà di prevedere i fabbisogni per i due FFI separatamente e l’attuale impossibilità di effettuare compensazioni tra eventuale sfondamento di un Fondo e capienza residua dell’altro (cfr. infra), e/o (ii) dalla programmazione dei FFI anche sulla base dei nuovi ingressi e delle uscite previste dallo status di innovatività (Fig. 4). Un responder ha indicato l’opportunità di riallocare i FFI sul relativo tetto di spesa (acquisti di farmaci da parte di aziende sanitarie pubbliche). Tre esperti non ritengono auspicabile o praticabile una variazione dell’assetto attuale dei FFI. Tra questi uno ha sottolineato come l’idea di un Fondo modulabile in base alla disponibilità di farmaci innovativi sia interessante, ma di difficile realizzazione e che sarebbe molto più importante prevedere che eventuali quote inutilizzate dei FFI rimanessero vincolate al finanziamento dell’assistenza farmaceutica pubblica. Un secondo esperto ha indicato l’opportunità di parametrare i FFI ai vincoli di bilancio e alle politiche sull’innovazione, vale a dire alla maggiore/minore volontà politica di mantenere (o modificare) i FFI.
La seconda domanda ha riguardato più nello specifico la presenza di due FFI separati (Domanda 8). Cinque responder si sono detti favorevoli a una compensazione tra eventuale sfondamento di un Fondo e capienza residua sull’altro (peraltro, mai avvenuta finora) e due a una compensazione, ma solo se non fosse possibile arrivare a un Fondo unico. Due, invece, hanno ribadito la necessità di procedere comunque verso un Fondo unico. Tra gli esperti non favorevoli a una riforma, uno ha espresso dubbi sulla praticabilità della compensazione in relazione agli equilibri di finanza pubblica e ha ricordato la norma (L. 232/2016) che prevede che la quota di risorse non impiegata per farmaci innovativi venga attribuita alle regioni.
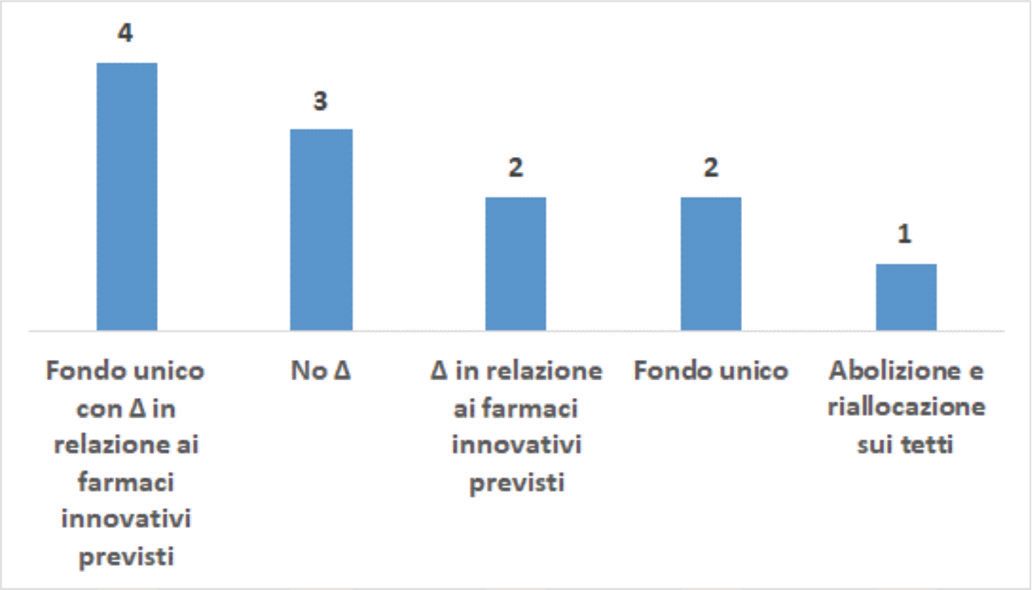
Nota: oltre al mantenimento della situazione attuale (No Δ), le ipotesi di riforma qui individuate e diversamente combinate tra di loro sono la creazione di un Fondo unico, la variazione del Fondo unico o dei Fondi attuali in relazione alle dinamiche di entrata nei Fondi e di uscita (farmaci innovativi previsti) o l’abolizione dei Fondi e la riallocazione delle relative risorse sui tetti di spesa per i farmaci.
La riflessione sull’impatto dei FFI sull’accesso ai farmaci innovativi (Domanda 4) si è basata più su una valutazione di tipo percettivo, visto che quasi tutti gli esperti hanno affermato di non essere a conoscenza di evidenze a tale proposito. Il 50% e il 33% degli esperti, rispettivamente, ritiene che i FFI abbiano/non abbiano accelerato l’accesso ai farmaci innovativi, mentre il restante 17% non è in grado di affermarlo, non essendo a conoscenza di evidenze in tal senso. Solo un esperto ha fatto riferimento a dati internazionali (W.A.I.T. Indicator di IQVIA-EFPIA) (12), che, però, non riguardano nello specifico i tempi di accesso per i farmaci giudicati innovativi in Italia in termini comparativi rispetto ad altri paesi. Quasi tutti i responder hanno, quindi, sottolineato l’opportunità di verificare quanto sia effettivamente rapido l’accesso ai farmaci innovativi e, in particolare, la presenza di eventuali differenze importanti tra regioni. Un esperto ha anche sottolineato la necessità di tracciare l’allocazione delle risorse dalle regioni alle aziende sanitarie pubbliche, per verificare la presenza di eventuali ritardi. Un responder, infine, ha richiamato il fatto che i FFI non coprano l’innovatività potenziale, mentre, per i farmaci a innovazione potenziale, viene previsto l’accesso immediato ai mercati regionali. Secondo tale esperto, si dovrebbero applicare ai farmaci a innovazione potenziale le stesse regole degli altri farmaci non innovativi o, al contrario, comprendere anch’essi nel FFI.

Nota: il ranking varia da 1 (più importante) a 5 (meno importante). L’indice di concordanza di Kendall è pari al 7,8%.
Secondo sette esperti, il monitoraggio dell’accesso ai farmaci innovativi dovrebbe avvenire sulla base dei dati dei Registri Farmaci, in cui i consumi sono distinti per indicazione (dato necessario, considerato che, per alcuni farmaci, l’innovatività non è riconosciuta per tutte le indicazioni). Data, però, la difficile accessibilità ai dati dei Registri Farmaci (attualmente disponibili nella loro completezza solo per Aifa), sarebbe utile, secondo quattro responder, ricorrere a dati regionali di consumo, che, però, risultano più aggregati, non comprendendo informazioni specifiche per indicazione. Un esperto ha richiamato l’opportunità che Aifa definisca tempi prestabiliti per l’accesso al farmaco in Determina di Prezzo e Rimborso, il che consentirebbe alle regioni di chiedere ai provveditorati (regionali e aziendali) di creare percorsi dedicati per le procedure di acquisto con verifica trimestrale dei percorsi.
Gli esperti sono stati, poi, interrogati sui problemi riscontrati nella gestione dei FFI. Le problematiche considerate più importanti sono il ritardo nella disponibilità dei dati Aifa relativi ai consumi e alla spesa per farmaci innovativi riferiti alla popolazione residente, nonché la differente attività di monitoraggio a livello regionale sull’uso di farmaci innovativi, aspetto che aumenta il rischio di scelte prescrittive basate sulla capienza dei FFI. Minore importanza è stata, invece, attribuita alle differenze interregionali sulla gestione della mobilità dei pazienti e ai ritardi nella disponibilità dei farmaci innovativi in alcune regioni, e questo può essere interpretato nel senso che tali fenomeni non sono stati riscontrati in modo sistematico (Fig. 5). Anche su questo aspetto, però, l’incertezza è molto elevata, con ranking medi non particolarmente diversi e un indice di concordanza ancora molto basso (7,8%).
La permanenza massima di un farmaco nei FFI è pari a tre anni. Otto responder si sono detti favorevoli a un’eventuale estensione per i farmaci per i quali non siano disponibili sul mercato alternative terapeutiche (Domanda 6). Due responder si sono dichiarati contrari e due non hanno preso posizione. È stato, comunque, sottolineato come:
• questa possibilità debba essere prevista solo in caso di assenza di alternative terapeutiche;
• sia importante definire in modo il più possibile specifico le condizioni per (e la durata di) un’estensione dell’innovatività;
• sia necessario affrontare il tema dell’innovatività di classe: un’estensione dell’innovatività del first in class potrebbe comportare la permanenza nel Fondo di un numero consistente di molecole;
• dal momento che la permanenza nel Fondo avviene potenzialmente a discapito dell’ingresso di altri farmaci, la fattibilità dipende dalle modalità gestionali della dotazione finanziaria del Fondo stesso (cifra fissa o modulabile) e dalle risorse disponibili.
Le risorse per il finanziamento dei FFI non oncologici derivano in parte da quelle per la realizzazione di obiettivi di piano sanitario. Si tratta di un aspetto non particolarmente critico secondo i responder, ma sette hanno comunque concordano che i FFI non debbano erodere le risorse storicamente assegnate per obiettivi di piano (Domanda 7) e due esperti non si sono pronunciati. Uno di questi ha sottolineato come le fonti di copertura dei FFI (risorse on top o destinate a obiettivi di piano) risiedono comunque nel finanziamento del SSN.
Con la Domanda 9 si è chiesto ai responder di esprimere un’opinione sull’attuale processo di allocazione dei FFI. Il 50% degli esperti si è espresso a favore di un cambiamento di tali modalità di riparto, ma con proposte molto differenti. Un responder ha proposto un finanziamento diretto alle strutture erogatrici, che richiederebbe, tuttavia, una stima dell’effettivo impegno finanziario per struttura. Un altro esperto ha proposto dei meccanismi correttivi più significativi rispetto alla distribuzione attesa dei casi, per ridurre la mobilità dei pazienti. Altri hanno sottolineato come il criterio di riparto più rilevante, più che la domanda potenziale, sia la capacità di offerta e che, quindi, i sistemi di ponderazione della quota capitaria dovrebbero ispirarsi maggiormente alla struttura dell’offerta. Un esperto ha evidenziato come, comunque, il sistema debba essere modificato, in quanto i tempi di erogazione del saldo alle regioni sono troppo lunghi e, spesso, il computo non è corretto. Tra gli esperti che si sono detti contrari a una riforma del processo di riparto delle risorse per farmaci innovativi, alcuni hanno sottolineato che, per quanto ci possano essere spazi di miglioramento, tale sistema è sufficientemente equilibrato e semplice da gestire. Un esperto ha sottolineato come tale sistema di riparto sia il frutto di un’Intesa Stato-Regioni su proposta del Ministero della Salute e del MEF e che se, a tre anni di distanza, non si è sentita l’esigenza di modificarlo, si può desumere che il sistema abbia funzionato.
Infine, cinque esperti (provenienti da regioni dove il privato accreditato ha un peso rilevante) hanno riferito di aver avuto problemi nella gestione della normativa che prevede la fatturazione dei farmaci innovativi solo da parte di enti pubblici. Due esperti, invece, non ritengono ci siano stati problemi e cinque non hanno dato risposta. Le principali problematiche riportate sono, in un primo momento, il parziale mancato utilizzo dei FFI e il ricorso, di conseguenza, ai fondi ordinari per la gestione dei Livelli Essenziali di Assistenza (LEA) e, in un secondo momento, ritardi nella disponibilità dei farmaci. Sono stati evidenziati anche i costi sostenuti dalle strutture pubbliche, che acquistano per conto dei privati accreditati ed erogano il farmaco a tali strutture, e le responsabilità economico-finanziarie delle prime per un bene che viene gestito da altri soggetti.
Le soluzioni operative proposte dai responder sono essenzialmente due:
• mantenere l’acquisto da parte dell’ente pubblico per conto del privato, posto che tale procedura sia gestita in modo ottimale. Un responder ha rilevato come, nella sua regione, il farmaco venga assegnato per competenza al privato accreditato, a partire da una previsione di impiego su base annuale, e fornito al momento dell’impiego. Questo può creare rigidità del sistema e ritardi nell’accesso;
• consentire alle regioni di individuare le strutture private accreditate autorizzate all’acquisto di farmaci innovativi, compatibilmente con la normativa di riferimento.
Raccomandazioni finali
Sulla base delle indicazioni degli esperti sono state redatte e validate dagli stessi otto raccomandazioni riferite a otto delle dieci domande, per le quali è stato raggiunto un maggiore accordo tra i panelist. Le risposte che non hanno determinato una raccomandazione specifica sono quelle relative alla Domanda 2 (valore/vantaggi percepiti dei FFI) e alla Domanda 9 (riparto ed erogazione del FFI Oncologici).
Qui di seguito vengono specificate le otto raccomandazioni che possono essere un utile spunto per una riforma dei FFI e per possibili priorità di ricerca future sul tema.
Raccomandazione 1 (Domanda 1)
Per quanto i FFI rappresentino silos nel silos, è opportuno mantenere risorse dedicate a tali farmaci, vale a dire FFI non contendibili per farmaci che siano stati valutati sulla base di criteri specifici e selettivi rispetto al loro posizionamento/utilità per il SSN. Il mantenimento dei FFI rappresenta anche un segnale di attenzione da parte della politica rispetto all’accesso di tali farmaci.
Raccomandazione 2 (Domanda 3)
È auspicabile che il sistema dei FFI venga semplificato, prevedendo, per esempio, un Fondo unico, e che ci sia una maggiore flessibilità nella loro programmazione, tenendo conto dei nuovi prodotti prossimi a diventare innovativi e di quelli prossimi a uscire dallo status di innovatività, ma in considerazione, in ogni caso, dei vincoli di finanza pubblica.
Raccomandazione 3 (Domanda 8)
Qualora non fosse possibile unificare i due FFI, sarebbe opportuno pensare a una forma di compensazione tra sfondamento di un Fondo ed eventuale differenza tra Fondo e spesa sull’altro Fondo.
Raccomandazione 4 (Domanda 4)
È importante verificare, tramite i Registri Farmaci o, se questo non è possibile, attraverso i dati regionali di consumo, i tempi e, soprattutto, l’omogeneità di accesso ai farmaci innovativi tra regioni.
Raccomandazione 5 (Domanda 5)
È auspicabile che venga migliorata la tempestività dei flussi informativi alle regioni sulla spesa per farmaci innovativi al netto dei payback. È, inoltre, rilevante effettuare un controllo sistematico dei consumi di farmaci innovativi per comprendere se esistono potenziali fenomeni di scelta tra farmaci innovativi e altri eventuali farmaci non innovativi aventi la stessa indicazione per meri obiettivi di natura finanziaria.
Raccomandazione 6 (Domanda 6)
È auspicabile che venga valutata l’opportunità di un’estensione dell’innovatività per i farmaci per i quali non siano disponibili alternative terapeutiche al momento della perdita dello status di innovatività, purché (i) le condizioni che determinano il rinnovo dell’innovatività (e la relativa durata) siano ben specificate, (ii) vengano valutate le conseguenze, qualora esistano più farmaci che si siano avvantaggiati dell’innovatività di classe, e (iii) sia valutata la sostenibilità rispetto all’ingresso di nuovi farmaci nei FFI.
Raccomandazione 7 (Domanda 7)
È preferibile, compatibilmente con i vincoli di finanza pubblica, che le risorse destinate ai farmaci innovativi non incidano su quelle storicamente previste per obiettivi di piano, con la conseguente riallocazione delle risorse per tali obiettivi a favore dei farmaci innovativi. È, quindi, auspicabile che le risorse per i farmaci innovativi vengano assegnate on top rispetto a quelle per l’erogazione dei LEA e per obiettivi di piano.
Raccomandazione 8 (Domanda 10)
Per quanto il tema assuma un rilievo diverso a seconda dell’importanza del privato accreditato a livello regionale, sarebbe opportuno riflettere se la norma che consente solo al pubblico di acquistare i farmaci innovativi vada modificata. Se vi fosse un impatto sull’accesso, sarebbe opportuno modificarla, prevedendo, per esempio, che le regioni autorizzino eventuali erogatori privati accreditati ad acquistare farmaci innovativi.
Ringraziamenti
Il progetto di ricerca è stato condotto da Cergas Bocconi in partnership con l’Associazione Italiana di Oncologia Medica (AIOM). Tale progetto è stato finanziato nell’ambito del Programma “Independent grant request – MSD Oncology Policy Grant Program: realizing the full benefit of innovative cancer treatment”, al quale Cergas Bocconi e AIOM hanno partecipato, vincendo un grant sul tema dei Fondi per Farmaci Innovativi.
Si ringraziano per la loro partecipazione: Angela Adduce (MEF), Giordano Beretta (AIOM), Roberta Di Turi (ASL Roma D), Gianpiero Fasola (past CIPOMO, Collegio Italiano Primari Oncologi Medici Ospedalieri), Ida Fortino (Regione Lombardia), Antonio Gaudioso (Cittadinanzattiva), Elisabetta Iannelli (FAVO, Federazione italiana delle Associazioni di Volontariato in Oncologia, e AIMAC, Associazione Italiana Malati di Cancro), Vito Ladisa (IRCCS Istituto Nazionale dei Tumori), Carmine Pinto (FICOG, Federation of Italian Cooperative Oncology Groups), Patrizia Popoli (Istituto Superiore di Sanità/CTS Aifa), Giovanna Scroccaro (Regione Veneto/CPR Aifa) e Ugo Trama (Regione Campania). La partecipazione è avvenuta a titolo personale e i panelist non hanno ricevuto una fee per la partecipazione allo studio.
Disclosures
Conflict of interest: CJ, PA, AB, FC and MO report grants from MSD during the conduct of the study, but no interferences occurred in carrying out the research project and in writing the manuscript for which the authors have the sole responsibility; CJ reports personal fees from BMS, Celgene, Dephaforum, Gilead, Incyte, MA Provider, MSD, Roche, Sanofi, Takeda, Wellmera (now Alira Health) outside of the submitted work.
Financial support: This project was funded by MSD within the Program “Independent grant request – MSD Oncology Policy Grant Program: realizing the full benefit of innovative cancer treatment”. Cergas Bocconi and AIOM (Associazione Italiana di Oncologia Medica) won a grant with a project on the Impact of the Fund for Innovative Cancer Medicines.
Bibliografia
- 1. Aifa, Report di valutazione dell’innovatività. Online (accessed march 5, 2021).
- 2. Aifa, Monitoraggio della Spesa Farmaceutica Nazionale e Regionale. Online (accessed november 20, 2020).
- 3. Cittadinanzattiva, Indagine civica sul grado di accesso ai farmaci innovativi. Online (accessed november 20, 2020).
- 4. Lidonnici D, Ronco V, Isernia M, et al. Tempi di accesso ai farmaci in Italia nel periodo 2015-2017: Analisi delle tempistiche di valutazione dell’Agenzia Italiana del Farmaco. Glob Reg Health Technol Assess 2018; 5:1-9
- 5. Congresso Nazionale AIOM, Il Fondo per Farmaci Innovativi sia confermato. Serve più impegno sugli screening, obiettivo +10% in cinque anni. Online (accessed may 14, 2020).
- 6. La Repubblica, Tumori: aumenta la spesa per i farmaci, +659 milioni in un anno. Online (accessed may 14, 2020).
- 7. Linstone HA, Turoff M, eds. The delphi method. Reading, MA: Addison-Wesley; 1975:3-12.
- 8. Trevelyan EG, Robinson N. Delphi methodology in health research: how to do it? Eur J Integr Med. 2015;7(4):423-428. CrossRef
- 9. Avella JR. Delphi panels: research design, procedures, advantages, and challenges. Int J Dr Stud. 2016;11:305-321. CrossRef
- 10. Lohr S. Sampling: Design and Analysis. 2nd ed. Boston, MA: Brooks/Cole; 2010.
- 11. Kendall MG, Babington Smith B. The Problem of m Rankings. Ann Math Stat. 1939;10(3):275-287. CrossRef
- 12. EFPIA, Patients W.A.I.T. Indicator 2019 Survey – May 2020. Online (accesssed january 11, 2021).