 |
Glob Reg Health Technol Assess 2021; 8: 1-7 ISSN 2283-5733 | DOI: 10.33393/grhta.2021.2178 ORIGINAL RESEARCH ARTICLE |
 |
Carcinoma a cellule renali metastatico: evidenze real-world da un ampio database amministrativo italiano
Metastatic renal cancer: real-world evidence from a large Italian claims database
Purpose: To assess the healthcare resources’ consumption and integrated costs of patients with renal cancer and new metastasis (mRCC), in the perspective of the Italian National Health System (NHS).
Methods: From the ReS database, through the administrative data record linkage, adults with a primary/secondary hospital (ordinary/daily admissions) diagnosis (ICD9-CM code) of renal cancer and lymph node and/or distant metastases in the same hospital discharge (index date) were selected in 2015. Metastases were defined new if they were absent in the 2 previous years. Patients were described in terms of gender, age (mean ± SD) and comorbidities of interest. The 2-year survival and annual pharmacological treatments, hospitalization, outpatient specialist services and costs were analysed.
Results: Out of >6 million adults in the 2015 ReS database, 133 (2.1 × 100,000) were hospitalized with a diagnosis of RCC and metastasis. Patients with new metastases were 63.2% (1.4 × 100,000; 73.8% males; mean age 68 ± 13). Hypertension was the most common comorbidity (70.2% of mRCC patients). The 2-year survival of mRCC patients was 26.2%. During 1-year follow-up, at least a drug was prescribed to 88.1% of mRCC patients (on average € 12,095/patient), 91.7% were hospitalized (€ 8,897/patient) and 82.1% entrusted the outpatient specialist care (€ 1,075/patient). The mean overall expenditure for the NHS was € 22,067 per capita.
Conclusions: This study shows the mRCC burden on the Italian real clinical practice and its economic impact in the perspective of the NHS. Real-world analyses prove to be useful to concretely estimate the overall healthcare responsibility on patients affected by mRCC.
Keywords: Big Data, Health Care Costs, Italian National Health Service, Public Health Practice, Renal Neoplasms
Received: August 6, 2020
Accepted: December 15, 2020
Published online: February 5, 2021
This article includes supplementary materials
Global & Regional Health Technology Assessment - ISSN 2283-5733 - www.aboutscience.eu/grhta
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il carcinoma a cellule renali (RCC) rappresenta la forma più comune di tumore maligno del rene, costituendo oltre il 90% di tutte le neoplasie renali nella popolazione adulta (1-8). In Italia, nel 2018, sono stati riscontrati 11.500 nuovi casi di tumore del rene, pari a 19 casi per 100.000 abitanti, con una crescita, per il 2020, stimata a +47% rispetto al 2010, a fronte di una riduzione della mortalità (9,10). Si manifesta prevalentemente nei maschi e, in media, intorno ai 60 anni (1,4-6,9,10). Alcuni fattori di rischio, come fumo di sigaretta, grasso addominale e ipertensione, sono stati associati all’insorgenza di neoplasie (1,9-13). Nonostante i grandi progressi nelle tecniche diagnostiche (prevalentemente di imaging), la malattia viene identificata ancora spesso in modo occasionale (9,10). La sopravvivenza a 5 anni per tutti gli stadi è pari al 71% (7,9,14). Circa il 30% dei pazienti si presenta già in stato avanzato/metastatico, mentre un ulteriore 20-30% sviluppa metastasi successivamente all’escissione del tumore primitivo (1,3,9), che si diffondono soprattutto a polmoni, ossa, linfonodi, ghiandole surrenali, fegato e cervello (5,6, 15-17). La sopravvivenza dei pazienti affetti da carcinoma renale metastatico (mRCC) è in continuo aumento e gli anni 2000, rispetto agli anni ’90, hanno registrato un incremento assoluto di 25 e 11 punti percentuali, rispettivamente negli Stati Uniti e in Italia (9,10). La scelta del migliore approccio per la cura e la sopravvivenza della malattia avanzata si basa su diversi modelli integrati di rischio prognostico, che valutano in uno score vari parametri (anatomici, istologici, clinici e laboratoristici). I più utilizzati sono il Memorial Sloan Kettering Cancer Center Prognostic Model (MSKCC) e l’International Metastatic Renal Cell Carcinoma Database Consortium (IMDC), che risultano abbastanza sovrapponibili (4,6,8,9, 18-20). Frequenti rimodellamenti dell’approccio terapeutico si sono succeduti al fine di massimizzare i benefici in condizioni di minima tossicità e farmacoresistenza. In assenza di biomarker predittivi utilizzabili in clinica, stanno emergendo il ruolo dell’immunoterapia e diverse strategie terapeutiche di combinazione e sequenza (3,4,6,8,21).
A fronte dell’evoluzione verso una medicina sempre più personalizzata, che può accompagnarsi a un incremento del costo immediato, i cui obiettivi sono la cura, l’aumento della sopravvivenza e una migliore qualità di vita dei pazienti con mRCC, diventa inevitabile una maggiore richiesta di follow-up clinico e a lungo termine in carico al sistema sanitario (3,5,7,20). Risulta necessario comprenderne l’impatto nell’insieme delle complessità del paziente con mRCC e, quindi, sui sistemi di assistenza sanitaria. Tuttavia, i clinical trial arruolano una popolazione di pazienti selezionata e, ancora, in quest’ambito, gli studi di real-world sono limitati (5,6,14). L’analisi dei dati amministrativi sanitari italiani contenuti nell’ampio database di Fondazione Ricerca e Salute (ReS) può fornire un valido strumento per fotografare la popolazione con mRCC in Italia e valutarne l’incremento del carico assistenziale per il Sistema Sanitario Nazionale italiano (SSN) nella reale pratica clinica.
Metodi
Fonte dei dati
Ricerca e Salute (ReS) è una Fondazione no profit il cui principale scopo è di creare strumenti utili alla pianificazione e al monitoraggio dell’assistenza sanitaria, a differenti livelli e per diversi stakeholder, sulla base dei real-world data sanitari. Tra i vari flussi amministrativi correnti di prestazioni sanitarie a carico del SSN, quelli della farmaceutica, delle ospedalizzazioni (ordinarie e day hospital) e della specialistica ambulatoriale, con le relative spese, sono stati resi disponibili per la creazione del database ReS da parte di alcune Regioni e Aziende Sanitarie Locali italiane, a seguito di specifici accordi. La locazione fisica del database presso Cineca (Consorzio Interuniversitario, sede di Bologna), grazie a una duratura collaborazione, assicura il rispetto degli standard internazionali di qualità e sicurezza dei dati. Ai fini di specifici scopi istituzionali con ritorno di informazioni unicamente in forma aggregata, ReS raccoglie e integra i dati sanitari con le informazioni anagrafiche (compresi i codici esenzione per patologie croniche), basandosi sul riutilizzo di dati anonimizzati alla fonte per ogni singolo paziente, come da disposizioni in materia di protezione della privacy (22-24). Per questo motivo, l’approvazione del Comitato Etico non risulta necessaria. Il database della farmaceutica contiene tutti i farmaci distribuiti in convenzione, per conto (farmacie territoriali) e in diretta (farmacie ospedaliere). I dati vengono interrogati sulla base del codice AIC (Autorizzazione all’Immissione in Commercio) e della classificazione ATC (Anatomical Therapeutic Chemical classification dell’OMS) (25) e forniscono informazioni anche riguardanti la dose, il numero di confezioni, la data di dispensazione e il costo a carico del SSN. Il database delle dimissioni ospedaliere raccoglie le diagnosi e le procedure effettuate in ospedale, in accordo con la versione italiana dell’ICD9-CM (International Classification of Diseases – 9th revision – Clinical Modification, Classificazione delle malattie, dei traumatismi, degli interventi chirurgici e delle procedure diagnostiche e terapeutiche, versione italiana 2007) (26), utilizzando le schede di dimissione ospedaliera (SDO) erogate in regime sia di ricovero ordinario che di day hospital. Vengono valutate le prestazioni specialistiche ambulatoriali, che riguardano visite specialistiche e procedure di diagnostica strumentale e di interventistica invasiva e non, secondo il Nomenclatore Tariffario Nazionale in vigore (27), erogate nelle strutture ospedaliere, territoriali pubbliche o private accreditate.
Selezione della coorte
Dal 1° gennaio al 31 dicembre 2015 (accrual) sono stati selezionati tutti i soggetti con diagnosi ospedaliera primaria e/o secondaria di carcinoma a cellule renali (RCC) e con metastasi linfonodali e/o a distanza nella stessa SDO (Tab. I Supplementare). Al fine di individuare esclusivamente i pazienti con RCC che avevano ricevuto per la prima volta una diagnosi ospedaliera di metastasi nell’anno di accrual, sono stati esclusi coloro che presentavano un ricovero ospedaliero con diagnosi di metastasi in un periodo pregresso di due anni. La minima data di ricovero ospedaliero per carcinoma renale metastatico dei pazienti con nuove metastasi (mRCC) ha rappresentato la data indice, a partire dalla quale ciascun soggetto è stato osservato per due anni di pregresso e due di follow-up (fino al 31/12/2017, termine dell’osservazione, o fino all’uscita del paziente dal database per cambio di residenza verso regioni non comprese nel database o per assistenza da parte di strutture private non convenzionate o in regioni non comprese).
| Pazienti con mRCC (n = 84) | |
| Sesso (%) | |
| colspan="2">Uomini 74% | |
| Donne 26% | |
| Età (anni) | |
| Mediana (Q1; Q3) | 67 (59; 78) |
| Fasce d’età (anni), incidenza di metastasi ¥ 100.000 | |
| 18-39 | 0,1 |
| 40-49 | 0,3 |
| 50-59 | 1,7 |
| 60-69 | 2,7 |
| 70-79 | 2,8 |
| 80-89 | 4,3 |
| ≥90 | 2,0 |
| Comorbidità, % pazienti sulla coorte | |
| Ipertensione arteriosa | 70,2 |
| Malattie polmonari croniche | 23,8 |
| Diabete | 22,6 |
| Dislipidemia | 20,2 |
| Cardiopatie ischemiche | 8,3 |
| Epatopatie | 4,8 |
La Tabella I descrive le principali caratteristiche epidemiologiche della coorte di pazienti con carcinoma a cellule renali e nuova diagnosi di metastasi (mRCC) nel 2015. Le caratteristiche cliniche derivano dall’analisi dei due anni di pregresso, oltre che del periodo di accrual.
Caratteristiche epidemiologiche e cliniche
L’anno di accrual è stato analizzato al fine di descrivere il profilo epidemiologico della coorte di pazienti con mRCC, in termini di incidenza di metastasi (x100.000), sesso ed età.
Inoltre, il periodo di accrual e i due anni prima della data indice sono stati analizzati con lo scopo di illustrare la coorte con mRCC, in merito ad alcune comorbidità di interesse (Tab. II Supplementare): diabete, dislipidemie, ipertensione arteriosa, cardiopatie ischemiche, epatopatie e malattie polmonari croniche.
Analisi del consumo di risorse e dei costi
I consumi di risorse sanitarie e i costi sono stati analizzati nei 365 giorni successivi alla data indice. Il trattamento farmacologico specifico, inteso come terapia antineoplastica, è stato individuato mediante il database della farmaceutica, le SDO e le prestazioni specialistiche ambulatoriali; inoltre, in base alla diversa modalità di erogazione (Tab. III Supplementare), ne è stato valutato il costo sui singoli flussi amministrativi e sul totale a carico del SSN. L’uso delle terapie concomitanti è stato definito a partire dal sottogruppo terapeutico (ATC II livello). La farmaceutica è stata analizzata in termini di distribuzione assoluta e di percentuale dei trattati per classe terapeutica, spesa media in euro e numero medio di confezioni per trattato. I ricoveri ospedalieri sono stati descritti per Diagnosis Related Group (DRG) indicato nella scheda di dimissione, come tasso di ricoverati sulla coorte e spesa media per ricovero. Le prestazioni specialistiche ambulatoriali sono state definite in termini di utilizzatori sulla coorte, spesa media per paziente e numero medio di prestazioni. Infine, i costi assistenziali sono stati analizzati come valore medio del dato complessivo derivante dall’integrazione di tutti i flussi amministrativi e delle singole voci di costo, con relativa incidenza di spesa percentuale sul totale. L’impatto economico diretto per il SSN delle diverse forme di assistenza è stato valutato in termini di: spesa farmaceutica, desunta dalla spesa lorda convenzionata e dalla spesa valorizzata al prezzo ospedaliero reale comprensivo di IVA per distribuzione diretta e per conto, costi dell’assistenza ospedaliera da tariffe DRG (Diagnosis Related Group) e spesa per le prestazioni specialistiche ambulatoriali da tariffario nazionale in vigore.
| Database amministrativo | Spesa media pro capite (€) | % sulla spesa totale (% sul totale del database specifico) |
|---|---|---|
| Farmaceutica | 12.095 | 54,8 |
| terapia antineoplastica | 10.831 | (89,6) |
| Ricoveri ospedalieri | 8.897 | 40,3 |
| Day hospital | 864 | (9,7) |
| terapia antineoplastica/radioterapia | 543 | (6,1) |
| Regime ordinario | 8.032 | (90,3) |
| terapia antineoplastica/radioterapia | 1.017 | (11,4) |
| Prestazioni specialistiche ambulatoriali | 1.075 | 4,9 |
| terapia antineoplastica/radioterapia | 290 | (26,9) |
| Totale | 22.067 | 100,0 |
La Tabella II descrive i costi assistenziali a carico del SSN per i pazienti con mRCC nell’anno di follow-up. Le spese sono analizzate per singole voci di costo e come totale derivante dall’integrazione dei vari flussi amministrativi.
| Cause di ricovero in regime ordinario secondo DRG | Ricoverati sui pazienti con mRCC (%) | Spesa media per ricovero (€) |
|---|---|---|
| Neoplasie del rene e delle vie urinarie con cc | 47,6 | 3.645 |
| Interventi su rene e uretere per neoplasia | 14,3 | 7.805 |
| Neoplasie dell’apparato respiratorio | 11,9 | 3.641 |
| Segni e sintomi con cc | 8,3 | 2.735 |
| Fratture patologiche e neoplasie maligne del sistema muscolo-scheletrico e del tessuto connettivo | 7,1 | 3.407 |
| Edema polmonare e insufficienza respiratoria | 6,0 | 3.668 |
| Chemioterapia non associata a diagnosi secondaria di leucemia acuta | 6,0 | 1.906 |
| Anomalie dei globuli rossi, età >17 anni | 4,8 | 2.784 |
| Neoplasie del sistema nervoso con cc | 4,8 | 4.578 |
| Setticemia senza ventilazione meccanica ≥96 ore, età >17 anni | 3,6 | 4.902 |
| Neoplasie maligne dell’apparato genitale maschile con c | 3,6 | 4.041 |
| Altri fattori che influenzano lo stato di salute | 3,6 | 776 |
| Bronchite e asma, età >17 anni con c | 2,4 | 1.899 |
| Malattie degenerative del sistema nervoso | 2,4 | 2.839 |
| Arresto cardiaco senza causa apparente | 2,4 | 4.000 |
La Tabella III descrive le prime 15 cause di ricovero ospedaliero in regime ordinario nell’anno successivo alla data indice, attraverso le descrizioni dei codici Diagnosis Related Group (DRG), in ordine decrescente di ricoverati sulla coorte di pazienti con carcinoma renale e nuova diagnosi di metastasi (mRCC). cc = complicanze.
Analisi della sopravvivenza
La coorte di pazienti con mRCC è stata osservata per i due anni successivi alla data indice, al fine di valutare la probabilità di sopravvivenza. Il metodo Kaplan-Meier è stato utilizzato per produrre le curve di sopravvivenza che mostrano la percentuale dei pazienti sopravvissuti al decesso sui soggetti a rischio, per mese di osservazione. L’evento decesso è stato individuato dalla dichiarazione di morte presente sulla scheda di dimissione oppure da un proxy di assenza di ulteriori accessi al SSN oltre 30 giorni dall’ultima prestazione registrata. I criteri di censura sono il decesso e l’uscita dal database. Tutte le analisi sono state sviluppate con Oracle SQL Developer versione 17.
Risultati
A partire dalla popolazione del database ReS, per la quale erano disponibili dati completi dal 2013 al 2017 (7.365.716 abitanti), sono stati selezionati (Fig. 1) più di 6 milioni di pazienti adulti nel 2015, di cui 133 (prevalenza: 2,1 × 100.000) sono stati ricoverati almeno una volta nell’anno di accrual, con diagnosi principale e/o secondaria di RCC e di metastasi linfonodale e/o a distanza nella stessa SDO. Di questi, 84 erano nuovi alle metastasi (incidenza: 1,4 × 100.000 adulti) rispetto ai due anni precedenti (coorte mRCC). Sebbene questo dato risulti discretamente sottostimato rispetto a quanto si possa ricavare dalla letteratura, la popolazione di partenza è ampiamente rappresentativa di quella italiana, secondo quanto testimoniato dalla quasi totale sovrapponibilità con i dati ISTAT per fasce d’età per l’anno 2015 (Fig. 1 Supplementare) (28). La sottostima attraverso i database amministrativi è spesso frequente, poiché sono assenti i dati clinici ambulatoriali (specialistici o di medicina generale) e tutte le prestazioni private, andando a identificare quei pazienti che, usufruendo del SSN, rientrano tra le categorie con maggiori necessità. In particolare, è stato possibile ricercare la coorte mRCC esclusivamente tramite le ospedalizzazioni, dunque selezionando a priori una popolazione più grave. La coorte con mRCC era prevalentemente maschile (74%) e l’incidenza annuale di metastasi negli uomini (2,1 × 100.000) è risultata tre volte quella nelle donne (0,7 × 100.000), in linea con la letteratura (1,2,5-7,10). L’età media (± deviazione standard, DS) era pari a 68 ± 13, senza differenze per sesso (Tab. I). Circa la metà delle nuove diagnosi di RCC, infatti, si riscontra intorno ai 65 anni (1,9) e, successivamente, si inizia un trattamento di prima linea indicato per lo stadio avanzato (6). L’incidenza di metastasi aumenta con l’età, raggiungendo un picco nell’ottava decade (4,3 × 100.000) (Tab. I). La maggior parte dei pazienti con mRCC presenta almeno una comorbidità (6), con ipertensione arteriosa evidenziata nel 70,2% dei pazienti, seguita dalle malattie polmonari croniche (23,8%) (Tab. I). La probabilità di sopravvivenza a 1 anno dalla data indice della coorte con mRCC è del 45,2%, diminuendo nell’anno successivo al 26,2% (Fig. 2). Per definizione, i database amministrativi sanitari non permettono di individuare i decessi avvenuti fuori dall’ambiente ospedaliero e neppure di correlare con certezza l’assenza nel database di un’attività SSN con la morte del paziente. Tuttavia, nonostante la sopravvivenza possa essere stata sovrastimata, questi risultati sono in linea con quanto riportato da Goebell et al. (6) per i pazienti a maggior rischio prognostico. Inoltre, la riduzione della sopravvivenza tra il primo e il secondo anno, con la tendenza a ridursi ulteriormente nel tempo, è simile a quanto descritto in letteratura (8%-12%) a 5 anni dalla diagnosi di metastasi (14,29). L’analisi, infine, suggerisce una maggiore probabilità di sopravvivenza a due anni tra gli uomini (29,0%) rispetto alle donne (18,2%). Le variabili previste dai modelli prognostici non sono recuperabili dai soli database amministrativi, ma l’integrazione con dati clinici potrebbe permettere una stratificazione del rischio e una definizione più accurata della prognosi anche in questo tipo di studi. Infatti, i modelli integrati, tra cui i più usati sono il MSKCC e l’IMDC, sono stati sviluppati per predire la sopravvivenza e il rischio di recidiva, analizzando fattori clinici, patologici e parametri di laboratorio nella loro globalità (9). Inoltre, questi sono nati e sviluppati per i clinical trial e la sovrapponibilità dei loro risultati con quelli provenienti dagli studi osservazionali, valutando popolazioni diverse per definizione, è controversa (5,6). Anche se la prognosi del paziente con RCC è direttamente correlata alla disseminazione del tumore, non ci sono ancora studi che confermino un aumento della sopravvivenza globale quando le metastasi vengono identificate o trattate precocemente (3,9,12). Un ulteriore aspetto da considerare per una più completa analisi della sopravvivenza è quello della struttura che ha fornito l’assistenza ai pazienti. È noto quanto il livello di specializzazione dell’ospedale faccia la differenza in termini di prognosi, soprattutto dei pazienti oncologici (30). Un’analisi ad hoc su questo aspetto sarà in futuro necessaria per permettere una più approfondita interpretazione dei risultati di sopravvivenza.
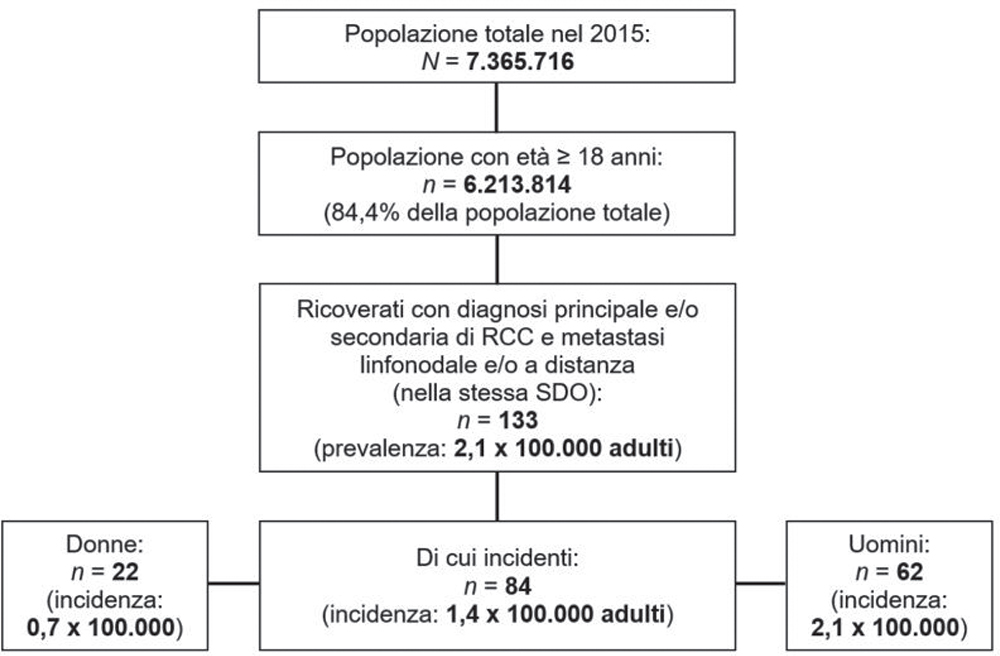
Fig. 1 - Selezione dei pazienti con RCC e nuova diagnosi di metastasi, dal database ReS.
La Figura 1 descrive la creazione della coorte dei pazienti con carcinoma a cellule renali e nuova metastasi (mRCC), a partire dalla popolazione del database ReS per l’anno 2015.
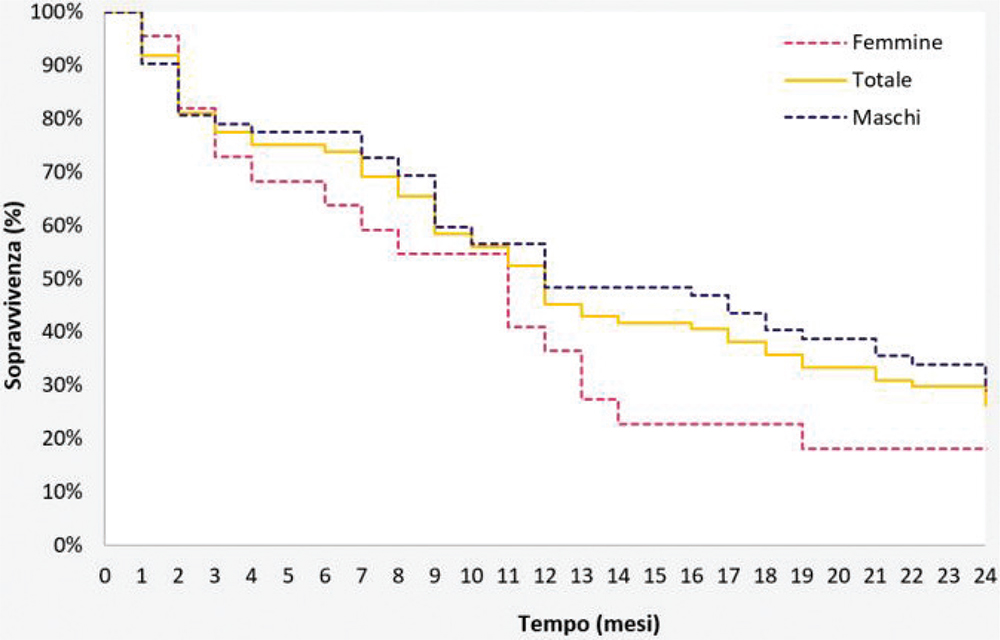
Fig. 2 - Probabilità di sopravvivenza (curve di Kaplan-Meier) nei due anni di osservazione nei pazienti con mRCC.
La Figura 2 descrive la percentuale di pazienti con carcinoma a cellule renali e nuova metastasi (mRCC) sopravvissuti al decesso sul totale dei pazienti a rischio per ogni mese dei due anni di osservazione dopo la data indice. Le curve prodotte tramite il metodo Kaplan Meier mostrano le probabilità di sopravvivenza per la coorte totale e suddivisa per sesso.
Nell’anno dopo il ricovero indice, per ogni paziente della coorte, la spesa per il SSN è stata in media di € 22.067 (Tab. II). Più della metà del costo totale è dovuta al consumo di farmaci in cui le terapie antineoplastiche (Tab. III Supplementare) hanno influito per quasi il 90%. Seguono i ricoveri ospedalieri (regime ordinario e day hospital), con una spesa media pro capite di € 8.897, e le prestazioni specialistiche ambulatoriali, che hanno contribuito solo per il 4,9% della spesa totale, di cui il 26,9% per terapia antineoplastica. Tutti i costi presentati sono da ascriversi all’assistenza unicamente a carico del SSN, rendendo inevitabile la perdita di una piccola percentuale di spesa dovuta alle cure private (31). Inoltre, i dati relativi alla terapia sistemica risultano sottostimati rispetto alla pratica clinica attuale, sia nel database della farmaceutica sia in quello della specialistica ambulatoriale. Tra le terapie analizzate mancano alcuni farmaci che, nel periodo in studio, potevano essere già in uso. Infatti, gli studi basati sui flussi amministrativi farmaceutici correnti inevitabilmente non riescono a tracciare i farmaci per via endovenosa (p. es., temsirolimus, bevacizumab), che sono somministrati soprattutto in ambiente ambulatoriale e la cui specifica classe di rimborsabilità non viene registrata nei database amministrativi. Allo stesso modo, per motivi di regime di rimborsabilità, alcuni farmaci orali non rientrano in tali flussi (p. es., cabozantinib è entrato in fascia H, erogabile al paziente, dal dicembre 2017).
Un’analisi più dettagliata del consumo di risorse e dei costi a carico del SSN per i pazienti con mRCC nei 365 giorni successivi alla data indice è stata fatta per singolo flusso amministrativo. All’88,1% della coorte è stato erogato almeno un trattamento farmacologico. Il 39,3% (n = 33) dei soggetti è stato trattato con almeno un farmaco antineoplastico, precisamente 8,7 confezioni medie per paziente, per una spesa media pro capite di € 10.831. Di questi 33 pazienti, il 21,4% ha ricevuto almeno una prescrizione di sunitinib (spesa media per paziente di € 6.500), seguito da pazopanib erogato all’11,9% della coorte (€ 1.588), quindi da axitinib (9,5%; € 1.484), everolimus (6,0%; € 712) e sorafenib (2,4%; € 420). Nonostante oggi lo scenario terapeutico del mRCC sia cambiato sensibilmente rispetto al periodo in analisi, alcuni nuovi trattamenti sistemici per la malattia avanzata o metastatica (4,5,20,21,29) non sarebbero comunque tracciabili tramite i flussi amministrativi della farmaceutica (p. es., nivolumab). La tendenza prescrittiva dei farmaci erogati ai pazienti visibili tramite database amministrativi è coerente con la letteratura e le Linee Guida per il periodo 2015-2016 (3,6,14). Infatti, sunitinib e pazopanib, raccomandati in prima e in seconda linea, sono stati prescritti maggiormente, seguiti da axitinib ed everolimus (tra le principali opzioni per la seconda linea). Un altro dato assente nei flussi amministrativi sanitari che non permette la completezza delle informazioni sulla farmaceutica di questi pazienti è la linea di terapia che, in mancanza di elementi clinici, non è stata prevista in questa analisi. L’introduzione dell’immunoterapia tra le possibilità terapeutiche ha determinato un importante cambio di paradigma, facendo procedere in parallelo evidenze cliniche, raccomandazioni degli esperti e Linee Guida (14). Risulta, però, necessario considerare, insieme ai modelli prognostici clinico-laboratoristici (9,12,17,32) e ai fattori di rischio secondo MSKCC e IMDC, anche le comorbidità proprie del singolo paziente e la valutazione di costi, rimborsabilità e accessibilità, auspicando a una medicina sempre più personalizzata (3,8,12). I costi delle terapie farmacologiche per mRCC determinano un contesto di tensione a livello del budget sanitario, che sarebbe auspicabile ridurre, con una strategia globale e integrata nell’assistenza e nella cura, quindi dalla diagnostica, ai trattamenti e fino alle fasi terminali di malattia (2,7). A tal fine, un aiuto può essere fornito dalle analisi real-world. Nello specifico, tramite i database amministrativi è possibile valutare il peso sul SSN di alcune prestazioni che possono individuare eventi collaterali imputabili o meno al trattamento specifico, ma questo tipo di studi non permette di definire un nesso di causalità tra le prestazioni erogate (p. es., tra l’erogazione di un farmaco e un’ospedalizzazione). Di seguito, si descrive l’impatto delle prestazioni sanitarie collaterali al trattamento specifico per i pazienti con mRCC all’interno del database ReS.
In generale, le terapie concomitanti impattano con percentuali di trattamento maggiori rispetto a quelle specifiche, a fronte di spese pro capite molto più basse. I più prescritti nell’anno di osservazione sono i farmaci per i disturbi correlati all’acidità, erogati nel 76,2% della coorte, per una spesa media a paziente di € 60, seguiti da antibatterici (60,7%; € 34) e antitrombotici (56,0%; € 126). L’analisi dei co-trattamenti mostra condizioni cliniche che possono avere differenti correlazioni. Alcune comorbidità possono essere determinate dall’elevata età media dei pazienti in studio ed essere già presenti prima dell’insorgenza del tumore stesso, come, per esempio, il diabete (antidiabetici erogati al 20% dei pazienti) o l’ipertensione (antipertensivi prescritti tra il 44% e il 20% dei soggetti) (1,2). Oppure, ancora, possono essere riferibili agli effetti avversi/tossicità conosciuti delle terapie antineoplastiche, come diarrea (antidiarroici al 26,2%), ipertensione (antipertensivi) o anemia (antianemici al 23%) (1,4,8,14). Infatti, come le caratteristiche intrinseche alla diagnosi, così anche gli effetti avversi e le complicanze devono essere parte integrante della cura del paziente con mRCC (1).
Il 91,7% della coorte è stato ricoverato almeno una volta nell’anno di studio in regime ordinario, generando una spesa media a paziente di € 9.305 e un costo medio per ricovero di € 3.947. La Tabella III mostra che i soggetti con mRCC sono stati prevalentemente ospedalizzati con DRG relativi a neoplasie/interventi a rene e vie urinarie (circa il 50% della coorte) e correlati a neoplasie dell’apparato respiratorio e muscolo-scheletrico/tessuto connettivo. I DRG che hanno determinato una spesa per ricovero superiore a € 10.000, anche se imputati a pazienti singoli, erano dovuti a linfoma e leucemia con interventi chirurgici maggiori (€ 13.006), interventi su pancreas e fegato (€ 12.993), interventi maggiori su intestino crasso e tenue (€ 11.318), resezione rettale (€ 11.203) e infezioni e infiammazioni respiratorie (€ 10.712) (Tab. IV Supplementare). Il 32,1% dei pazienti è stato ricoverato in regime di day hospital, con una spesa media per ricovero pari a € 864, principalmente per chemioterapia (10,7% pazienti) e neoplasie del rene e delle vie urinarie (4-7%) (Tab. V Supplementare). Le ospedalizzazioni hanno sicuramente individuato pazienti con malattia avanzata o fragilità e un’analisi delle cause specifiche potrebbe ricondurre anche a eventi avversi severi da farmaco (1). Tuttavia, non è possibile fornire dati certi di correlazione tra cause di ospedalizzazione e tossicità tramite i dati amministrativi.
L’82,1% della coorte si è affidato all’assistenza specialistica ambulatoriale di strutture ospedaliere, pubbliche o convenzionate. In particolare, il 44,0% dei pazienti è stato sottoposto a diagnostica per immagini di torace e addome (€ 102 medi pro capite). Questa pratica è in linea con quanto indicato nelle Linee Guida dei pazienti con mRCC in terapia sistemica (12), tuttavia il dato potrebbe risultare sottostimato, a causa dell’uso di prestazioni ambulatoriali private. Il 10,7% è stato trattato con radioterapia (24,3 prestazioni medie per utilizzatore nell’anno) e/o terapia antineoplastica (5,6 prestazioni), a fronte di una spesa media pro capite pari a € 284 e a € 6, rispettivamente.
Conclusioni
I dati a oggi disponibili su mRCC provengono da studi che si focalizzano su popolazioni selezionate e sottoposte a specifici trattamenti, esulando dalla visione complessiva dei pazienti con le loro comorbidità e i bisogni assistenziali (1,5,7,14,29). Nonostante gli enormi avanzamenti degli ultimi 15 anni nel campo della ricerca farmacologica e un altissimo grado di aderenza alle Linee Guida costantemente aggiornate e adottate dai clinici nella loro pratica quotidiana, una parte di pazienti trae ancora benefici limitati dalle terapie, a causa dei fenomeni di resistenza e tossicità (3,5,14). Inoltre, sono ancora molto poco studiati i pazienti più complicati (anziani e con fragilità) (6,8,20).
La disponibilità di dati relativi al carico assistenziale dei pazienti con mRCC, che siano registri o studi osservazionali retrospettivi o prospettici, può integrare e completare i risultati dei clinical trial con informazioni su popolazioni più eterogenee e sui costi (6,8,29), fornendo, così, ai clinici gli strumenti per scegliere il trattamento, le modalità e le tempistiche di somministrazione più opportune (3,8,10).
Il burden a carico del SSN individuato da questa analisi è da ascriversi non solo alla patologia neoplastica, ma anche all’età, al sesso e alle condizioni cliniche e alle comorbidità dei pazienti, sia al momento della diagnosi sia dopo l’inizio della terapia. Al fine di fornire una misura reale dell’impatto del paziente con mRCC e di rispondere ai bisogni di questa specifica popolazione, la real-world evidence può tenere conto dell’utilizzo eterogeneo delle terapie specifiche, ma anche dei ricoveri ospedalieri, delle prestazioni ambulatoriali e degli esami specialistici a carico del SSN, correlati o meno alla neoplasia (5-7).
Disclosures
Conflict of interest: The authros declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Porta C, D’Attino R. Epidemiologia e standard di cura attuale del carcinoma renale metastatico in Italia. Ital J Public Health. 2011;8(3)(suppl 2):S7-S16.
- 2. Ljungberg B, Campbell SC, Choi HY, et al. The epidemiology of renal cell carcinoma. Eur Urol. 2011;60(4):615-621. CrossRef PubMed
- 3. Unverzagt S, Moldenhauer I, Nothacker M, et al. Immunotherapy for metastatic renal cell carcinoma. Cochrane Database Syst Rev. 2017;5(5):CD011673. PubMed
- 4. Zerdes I, Tolia M, Tsoukalas N, et al. Systemic therapy of metastatic renal cell carcinoma: review of the current literature. Urologia. 2019;86(1):3-8. CrossRef PubMed
- 5. Nazha S, Tanguay S, Kapoor A, et al. Use of targeted therapy in patients with metastatic renal cell carcinoma: clinical and economic impact in a Canadian real-life setting. Curr Oncol. 2018;25(6):e576-e584. CrossRef PubMed
- 6. Goebell PJ, Staehler M, Müller L, et al; RCC-Registry Group (Tumour Registry of Advanced Renal Cell Carcinoma). Changes in Treatment Reality and Survival of Patients With Advanced Clear Cell Renal Cell Carcinoma – Analyses From the German Clinical RCC-Registry. Clin Genitourin Cancer. 2018;16(6):e1101-e1115. CrossRef PubMed
- 7. de Groot S, Redekop WK, Versteegh MM, et al. Health-related quality of life and its determinants in patients with metastatic renal cell carcinoma. Qual Life Res. 2018;27(1):115-124. CrossRef PubMed
- 8. Atkins MB, Tannir NM. Current and emerging therapies for first-line treatment of metastatic clear cell renal cell carcinoma. Cancer Treat Rev. 2018;70:127-137. CrossRef PubMed
- 9. Associazione Italiana di Oncologia Medica. Linee Guida. Tumori del rene. 2018. Online
- 10. Associazione Italiana dei Registri Tumori. I numeri del cancro in Italia. 2019. Online
- 11. Lipworth L, Morgans AK, Edwards TL, et al. Renal cell cancer histological subtype distribution differs by race and sex. BJU Int. 2016;117(2):260-265. CrossRef PubMed
- 12. Escudier B, Porta C, Schmidinger M, et al; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019;30(5):706-720. CrossRef PubMed
- 13. Manola J, Royston P, Elson P, et al; International Kidney Cancer Working Group. Prognostic model for survival in patients with metastatic renal cell carcinoma: results from the international kidney cancer working group. Clin Cancer Res. 2011;17(16):5443-5450. CrossRef PubMed
- 14. Pal S, Gong J, Mhatre SK, et al. Real-world treatment patterns and adverse events in metastatic renal cell carcinoma from a large US claims database. BMC Cancer. 2019;19(1):548. CrossRef PubMed
- 15. Posadas EM, Limvorasak S, Figlin RA. Targeted therapies for renal cell carcinoma. Nat Rev Nephrol. 2017;13(8):496-511. CrossRef PubMed
- 16. Choueiri TK, Motzer RJ. Systemic Therapy for Metastatic Renal-Cell Carcinoma. N Engl J Med. 2017;376(4):354-366. CrossRef PubMed
- 17. Network NCC. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Kidney Cancer. Version 1.2020-June 7, 2019. 2020. Online
- 18. Dickman PW, Hakulinen T, Luostarinen T, et al. Survival of cancer patients in Finland 1955-1994. Acta Oncol. 1999;38(suppl 12):1-103. CrossRef PubMed
- 19. Motzer RJ, Mazumdar M, Bacik J, Berg W, Amsterdam A, Ferrara J. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol. 1999;17(8):2530-2540. CrossRef PubMed
- 20. Tenold M, Ravi P, Kumar M, et al. Current Approaches to the Treatment of Advanced or Metastatic Renal Cell Carcinoma. Am Soc Clin Oncol Educ Book. 2020;40:1-10. CrossRef PubMed
- 21. Dutcher JP, Flippot R, Fallah J, Escudier B. On the Shoulders of Giants: The Evolution of Renal Cell Carcinoma Treatment-Cytokines, Targeted Therapy, and Immunotherapy. Am Soc Clin Oncol Educ Book. 2020;40:1-18. CrossRef PubMed
- 22. Calabria S, Forcesi E, Dondi L, Pedrini A, Maggioni AP, Martini N. Target Population of Non-deferrable Surgery and Uncontrolled Severe Bleeding Related to Dabigatran. Cardiovasc Drugs Ther. 2018;32(3):281-286. CrossRef PubMed
- 23. Cimminiello C, Dondi L, Pedrini A, et al. Patterns of treatment with antiplatelet therapy after an acute coronary syndrome: data from a large database in a community setting. Eur J Prev Cardiol. 2019;26(8):836-846. CrossRef PubMed
- 24. Piccinni C, Ronconi G, Calabria S, et al. Healthcare resources utilisation in primary progressive multiple sclerosis. Neurol Sci. 2018;39(7):1169-1174. CrossRef PubMed
- 25. Collaborating Center for Drug Statistics Methodology (WHO). ATC/DDD Index 2020. Online
- 26. Ministero del Lavoro, della Salute e delle Politiche Sociali. Classificazione delle malattie, dei traumatismi, degli interventi chirurgici e delle procedure dagnostiche e terapeutiche. Versione italiana dell’ICD9-CM. 2007. Online
- 27. Ministero del Lavoro, della Salute e delle Politiche Sociali. Nomenclatore prestazioni di assistenza specialistica ambulatoriale. Allegato 4. DPCM 12 gennaio 2017. 2017. Online
- 28. Istituto Nazionale di Statistica, ISTAT. Resident population by age, sex and marital status. 2015. Online
- 29. Edwards SJ, Wakefield V, Cain P, et al. Axitinib, cabozantinib, everolimus, nivolumab, sunitinib and best supportive care in previously treated renal cell carcinoma: a systematic review and economic evaluation. Health Technol Assess. 2018;22(6): 1-278. CrossRef PubMed
- 30. Boffa DJ, Mallin K, Herrin J, et al. Survival After Cancer Treatment at Top-Ranked US Cancer Hospitals vs Affiliates of Top-Ranked Cancer Hospitals. JAMA Netw Open. 2020;3(5):e203942. CrossRef PubMed
- 31. Agenzia Italiana del Farmaco. L’uso dei farmaci in Italia. Rapporto Nazionale Anno 2018 [The use of drugs in Italy. National Report Year 2018]. 2018. Online
- 32. Ljungberg B, Albiges L, Bensalah K, et al. EAU Renal Cell Carcinoma Guidelines 2020. Online