 |
Glob Reg Health Technol Assess 2020; 7(1): 109-114 DOI: 10.33393/grhta.2020.2173 ORIGINAL RESEARCH ARTICLE |
 |
Le tempistiche autorizzative di AIFA: un confronto tra le due commissioni consultive e tecnico-scientifiche succedutesi nel periodo 2015-2020
AIFA time-to-reimbursement: a comparison between the last two committees from 2015 to 2020
Objective. To compare the time-to-reimbursement of the last two committees of the Italian Medicines Agency (AIFA), respectively appointed in 2015 and in 2018.
Methods. The analysis was run through a specific internal database created by MA-Provider. The database was populated with information regarding European Medicines Agency (EMA) approved new drugs, including each step of the Italian Price and Reimbursement (P&R) process reported in the monthly outcomes of Technical Scientific Committee (CTS) and Price and Reimbursement Committee (CPR) meetings from September 2015 to April 2020.
Results. The 2015 and the 2018 committees have reimbursed respectively 39 and 28 drugs by comparing their initial 19 months of activity. Significant differences have been observed in negotiated economic conditions, in particular an increase in the number of drugs with confidential discount (2018-committee: 96.4% vs 2015-committee: 64.1%; p = 0.003) and a reduction in the application of Managed Entry Agreements (MEAs) (2018-committee: 10.7% vs 2015-committee: 33.3%; p = 0.036). The average duration of the P&R procedure managed by the 2018-committee has increased by 45 days compared to the 2015-committee (287 days vs 242 days; p = 0.071) and this trend of delay is associated to the active scientific/economic assessment phase by CTS and CPR (particularly by the latter) and not to administrative phases (e.g. Official Journal publications).
Conclusions. The observed differences between committees may be explained by the higher number of oncological and/or innovative drugs assessed by the 2018-committee (regarding the time delay, probably linked to greater difficulties in finding a win-win agreement able to satisfy both AIFA and Pharmaceutical Company).
Keywords: AIFA, Drugs access, Price and Reimbursement, Time-to-reimbursement
Received: July 9, 2020
Accepted: October 29, 2020
Published online: December 14, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Garantire una rapida immissione in commercio dei farmaci costituisce una sfida di primaria importanza che vede coinvolte sia l’agenzia europea dei medicinali (European Medicines Agency, EMA) sia le agenzie competenti di ogni singolo Paese (1).
L’EMA, sulla base di un favorevole profilo di rischio-beneficio, approva un farmaco a livello sovranazionale europeo, ma non ha competenza in termini di definizione del prezzo e dei regimi di rimborso, ai quali provvederanno, invece, le autorità regolatorie a livello nazionale (2).
Dal momento che, in ogni Paese, le tempistiche di immissione in commercio di un farmaco dipendono da diversi fattori, come, per esempio, la tipologia di procedure di rimborso in essere e/o eventuali vincoli economici di bilancio (3), il processo autorizzativo, inteso come il tempo che trascorre dall’approvazione dell’EMA alla disponibilità del farmaco per i cittadini, è caratterizzato da tempistiche che possono variare, anche sensibilmente, tra Paesi (4). Infatti, secondo quanto pubblicato dal rapporto dell’European Federation of the Pharmaceutical Industries and Associations (EFPIA) sugli indicatori Patients WAIT riferiti al periodo 2015-2017, l’Italia, in termini di tempo di accesso a un farmaco (misurato come il tempo che intercorre dalla pubblicazione della Gazzetta Ufficiale Europea, GUUE, alla reale disponibilità del farmaco per il paziente), si trova al quattordicesimo posto, con 402 giorni, rispetto alla Germania, che, invece, si posiziona al primo posto, con 119 giorni. Lo stesso rapporto mostra come, confrontando questi dati con quelli del precedente triennio, i tempi di accesso in Italia siano, anche se di poco, aumentati da 383 a 402 giorni (4).
In Italia, il processo autorizzativo dei farmaci rimborsati dal Servizio Sanitario Nazionale (SSN) è di competenza dell’Agenzia Italiana del Farmaco (AIFA) ed è svolto secondo le modalità e i criteri indicati nella deliberazione CIPE n. 3/2001 (5). Nel processo di determinazione del prezzo e della classe di rimborsabilità dei farmaci, l’AIFA viene supportata dal Comitato Tecnico-Scientifico (CTS) e dal Comitato Prezzi e Rimborso (CPR) (breviter commissioni) (6). Per il dettaglio della procedura negoziale, che, per legge, prevede passaggi (step) sia valutativi che amministrativi, si rimanda a una precedente pubblicazione, condotta con l’obiettivo di stimare le tempistiche medie autorizzative dei farmaci rimborsati in Italia nel periodo 2015-2017 (1). Secondo i risultati di questa precedente analisi, la durata media della procedura negoziale di prezzo e rimborso, dall’apertura della procedura in CTS alla data di pubblicazione della determina di prezzo e rimborso (P&R) in Gazzetta Ufficiale (GU), è stata, su un campione di 85 farmaci, di 258 giorni, di cui 167 giorni per la valutazione delle commissioni CTS e CPR (1). La durata media della procedura autorizzativa ha richiesto tempistiche minori per i farmaci innovativi rispetto a quelli non innovativi (196 vs 272 giorni, p = 0,03), mentre i farmaci oncologici-oncoematologici, rispetto a quelli con indicazione per altre aree terapeutiche, hanno determinato tempistiche maggiori (326 vs 234, p = 0,0004) (1). Nonostante la differenza non sia statisticamente significativa, ai farmaci orfani è stata associata una maggiore tempistica autorizzativa rispetto a quelli non orfani (280 vs 251, p = 0,66) (1).
Costituendo un ampliamento e un aggiornamento della precedente (1), la presente analisi è stata condotta con l’obiettivo principale di confrontare, rispetto alle due ultime commissioni consultive e tecnico scientifiche succedutesi durante l’arco temporale 2015-2020, le tempistiche autorizzative di AIFA, dall’apertura in CTS alla pubblicazione in GU, per i farmaci di nuova registrazione con procedura centralizzata rimborsati in Italia. Sono state, inoltre, (obiettivo secondario) aggiornate e confrontate anno per anno le stime delle tempistiche autorizzative di AIFA dal 2016 al 2019.
Metodi
Database
L’analisi delle tempistiche autorizzative di AIFA è stata effettuata grazie alla consultazione di uno specifico database realizzato ad hoc da MA Provider Srl. Il database, costruito in ambiente Microsoft Excel®, è stato popolato con una serie di informazioni riguardanti i farmaci di nuova registrazione (prima indicazione di nuove entità terapeutiche) riportati negli esiti dell’Ufficio Procedure Centralizzate di AIFA da gennaio 2015 ad aprile 2020 (data dell’ultimo aggiornamento del database). Nel database, per ogni farmaco, quando disponibili, sono state tracciate le seguenti informazioni:
– nome commerciale (7)
– principio attivo (7)
– azienda titolare dell’AIC (7)
– data del parere del CHMP (tracciata dal sito dell’EMA) (7)
– data della Marketing Authorisation UE (tracciata dal sito dell’EMA) (7)
– data della pubblicazione in GUUE (8)
– data di apertura e di chiusura (parere) del processo valutativo di CTS e CPR (9)
– data di tutte le riunioni effettuate da CTS e CPR (10)
– data della determina AIFA (9)
– data della ratifica dell’accordo da parte del CdA (9)
– data di pubblicazione in GU (9)
– data di efficacia e validità della GU (9)
– indicazione rimborsata e classe di rimborsabilità del farmaco (9)
– se il medicinale è stato collocato nella classe Cnn (9)
– regime di fornitura del farmaco (9)
– se il farmaco ha indicazione per il trattamento di malattie rare (tracciato dal report di orphanet contenente la lista dei medicinali per malattie rare in Europa) (11)
– se ha ottenuto lo status di farmaco orfano (tracciato dal sito dell’EMA) (7)
– se ha ottenuto lo status di farmaco innovativo (tracciato dall’elenco AIFA dei farmaci innovativi e dalle rispettive Gazzette Ufficiali) (9,12)
– se, nel processo di valutazione del farmaco, è stato negoziato un Managed Entry Agreement (MEA) e quale (9)
– se, nel processo di valutazione del farmaco, è stato negoziato uno sconto confidenziale (9).
Processo negoziale
L’analisi delle tempistiche autorizzative è stata effettuata suddividendo la procedura negoziale di ogni farmaco in 5 distinti periodi, dove il punto di partenza coincide con l’apertura della procedura in CTS e il punto di conclusione con la pubblicazione della relativa determina in GU. La Figura 1 illustra la successione logico-formale dei 5 periodi. Il periodo 1 copre il tempo che intercorre tra l’apertura della procedura in CTS e il parere della stessa commissione, mentre il successivo periodo 2 riguarda il tempo necessario al CPR per raggiungere l’accordo negoziale. Questi due primi periodi (1-2) determinano la fase di assessment (valutazione) di un farmaco. Il periodo 3 determina il tempo necessario al Consiglio di Amministrazione (CdA) di AIFA per ratificare l’accordo negoziale, mentre i periodi 4 e 5 coprono, rispettivamente, il tempo necessario per istruire la determina da parte di AIFA e la relativa pubblicazione in GU. Nel loro insieme, questi ultimi 3 periodi (3-5) determinano la fase di post-assessment del farmaco, dove le attività di ratifica, istruzione e pubblicazione determinano la tempistica amministrativa del processo negoziale.
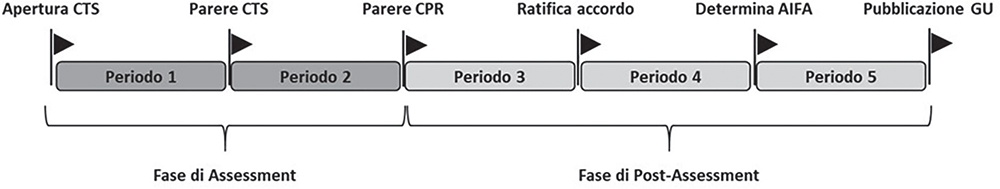
Fig. 1- Periodi della procedura negoziale.
CTS: Comitato Tecnico-Scientifico; CPR: Comitato Prezzi e Rimborso; AIFA: Agenzia Italiana del Farmaco; GU: Gazzetta Ufficiale.
Di fatto, la definizione e la successione logico-formale dei 5 periodi riflettono la metodologia adottata nella precedente pubblicazione, escludendo, però, rispetto a quest’ultima, la stima delle tempistiche che intercorrono dalla pubblicazione dell’Autorizzazione In Commercio (AIC) europea in GUUE alla sottomissione del dossier da parte dell’azienda e da quest’ultima all’apertura della pratica in CTS (1). Ciò è stato fatto in quanto, per i farmaci di ultima approvazione, non viene più riportata la data di ricezione della documentazione cartacea da parte di AIFA, rendendo, di fatto, impossibile la corretta stima di queste tempistiche.
Endpoint primario
L’analisi dell’endpoint primario è finalizzata a verificare la presenza di eventuali differenze delle tempistiche autorizzative di AIFA rispetto alle due ultime commissioni consultive e tecnico-scientifiche succedutesi nel periodo 2015-2020. Di fatto, sono state confrontate le tempistiche autorizzative delle commissioni consultive insediatesi a settembre 2015 e che hanno concluso il loro mandato a settembre 2018 (breviter commissione 2015-2018) rispetto a quelle delle commissioni consultive insediatesi a settembre 2018 e ancora in attività (breviter commissione 2018-2020).
Dato che, al momento dell’analisi dei dati, la commissione 2018-2020 era in carica da 19 mesi, al fine di rendere omogeneo il confronto, sono stati considerati anche per la commissione 2015-2018 i primi 19 mesi di attività. Così facendo, per la commissione 2015-2018 sono stati considerati i farmaci la cui procedura in CTS è stata aperta da settembre 2015 e si è conclusa (pubblicazione in GU) entro marzo 2017, mentre, per la commissione 2018-2020, sono stati considerati i farmaci la cui procedura in CTS è stata aperta da ottobre 2018 e si è conclusa (pubblicazione in GU) entro aprile 2020.
L’analisi è riferita ai soli farmaci di nuova registrazione con procedura centralizzata che hanno ottenuto il rimborso in classe A o H.
Endpoint secondario
La valutazione dell’endpoint secondario è riferita, invece, al trend delle tempistiche autorizzative di AIFA nel quadriennio 2016-2019 per i farmaci di nuova registrazione con procedura centralizzata che hanno ottenuto il rimborso in classe A o H.
Per i farmaci che hanno concluso il processo negoziale nel quadriennio, ma la cui apertura in CTS è avvenuta prima del 2016, sono state ricercate a ritroso nel tempo tutte le informazioni necessarie per definire i 5 periodi di analisi. Viceversa, sono stati esclusi dall’analisi tutti i farmaci la cui apertura in CTS è avvenuta nel quadriennio, ma che non hanno concluso il processo negoziale in tale periodo.
Analisi statistica
I dati riportati nel testo e nelle Tabelle sono presentati come media (± deviazione standard) o come valore percentuale, a seconda dei casi. La significatività delle differenze tra gruppi è stata valutata col Mann-Whitney test. I valori con p<0,05 sono stati considerati statisticamente significativi.
Risultati
Endpoint primario
Nei rispettivi primi 19 mesi di attività, la commissione 2015-2018 ha autorizzato 39 farmaci, mentre quella 2018-2020 ne ha autorizzati 28. La Tabella I descrive le principali caratteristiche dei farmaci rimborsati. Tra le due commissioni si osserva un aumento delle autorizzazioni per i farmaci oncologici, sebbene la differenza non sia statisticamente significativa (35,7% vs 20,5%; p = 0,171). Si registra, invece, un significativo cambiamento delle condizioni negoziali contrattate. Rispetto alla commissione 2015-2018, si evidenziano, per la commissione 2018-2020, un aumento degli sconti negoziali (96,4% vs 64,1%; p = 0,003) e una riduzione dei MEA (10,7% vs 33,3%; p = 0,036) applicati.
La Tabella II mostra nel dettaglio le tempistiche autorizzative per le due commissioni. Complessivamente (periodo 1-5) la durata della procedura negoziale gestita dalla commissione 2018-2020 è aumentata in media di 45 giorni (+19%) rispetto a quella associata alla commissione 2015-2018 (287 giorni vs 242 giorni; p = 0,071). Tale aumento, anche se in parte controbilanciato dalla riduzione delle tempistiche della fase di post-assessment (periodo 3-5) (79 vs 97; p = 0,024), è determinato da un significativo aumento dei tempi (+63 giorni) assorbiti dalla fase di assessment (periodo 1-2) della commissione 2018-2020 (208 giorni vs 145 giorni; p = 0,016).
| Periodi | Commissione 2018-2020(n = 28) | Commissione 2015-2018 (n = 39) | p |
|---|---|---|---|
| Classe di rimborso | |||
| – classe A | 32,1% | 48,7% | 0,179 |
| – classe H | 67,9% | 51,3% | 0,179 |
| Malattia rara | 42,9% | 46,2% | 0,789 |
| – di cui farmaco orfano | 58,3% | 55,6% | 0,827 |
| Farmaci oncologici | 35,7% | 20,5% | 0,171 |
| Innovatività | 25,0% | 15,4% | 0,331 |
| Sconto confidenziale | 96,4% | 64,1% | 0,003 |
| MEA | 10,7% | 33,3% | 0,036 |
| Registro monitoraggio | 35,7% | 30,8% | 0,675 |
| Periodi | A – Commissione 2018-2020 (n = 28) | B – Commissione 2015-2018 (n = 39) | Differenza | p | ||
|---|---|---|---|---|---|---|
| media | ds* | media | ds* | A – B | ||
| Periodo 1-5 | 287 | 100 | 242 | 94 | 45 | 0,071 |
| Periodo 1-2 | 208 | 101 | 145 | 85 | 63 | 0,010 |
| Apertura CTS – Parere CTS | 33 | 55 | 58 | 72 | −25 | 0,118 |
| Parere CTS – Parere CPR | 175 | 82 | 87 | 53 | 88 | <0,001 |
| Periodo 3-5 | 79 | 27 | 97 | 36 | −18 | 0,024 |
| Parere CPR – CdA | 36 | 23 | 48 | 27 | −12 | 0,058 |
| CdA – determina AIFA | 28 | 14 | 30 | 13 | −2 | 0,561 |
| Determina AIFA – GU | 15 | 5 | 19 | 5 | −4 | 0,002 |
È, infine, interessante notare come, rispetto alla commissione 2015-2018, si siano allungate per la commissione 2018-2020 le tempistiche medie per il parere del CPR (175 giorni vs 87 giorni; p<0,001) e, invece, si siano ridotte quelle per il parere del CTS (33 giorni vs 58 giorni; p = 0,118).
Endpoint secondario
Dei 298 farmaci presenti nel database, 133 hanno soddisfatto i requisiti per il calcolo dell’endpoint secondario. Di questi, 76 (57,1%) sono farmaci rimborsati in classe H e 57 (42,9%) in classe A. I farmaci oncoematologici rappresentano circa un terzo del campione (n = 40). Sono 54 (40,6%) i farmaci con indicazione per il trattamento di una malattia rara, di cui due terzi (66,7%) orfani. A 31 farmaci (23,3%) è stata riconosciuta l’innovatività, di cui oltre la metà (61%) con indicazione per il trattamento di malattie oncologiche. Alla luce delle condizioni negoziali riportate in GU per quasi il 90% dei farmaci (n = 117), sono stati negoziati uno sconto confidenziale per le strutture pubbliche e/o un MEA (payment by results, capping, budget cap, cost sharing, accordo prezzo-volume, ecc.). Infine, a 56 farmaci (42,1%) è stato applicato un registro di monitoraggio web-based.
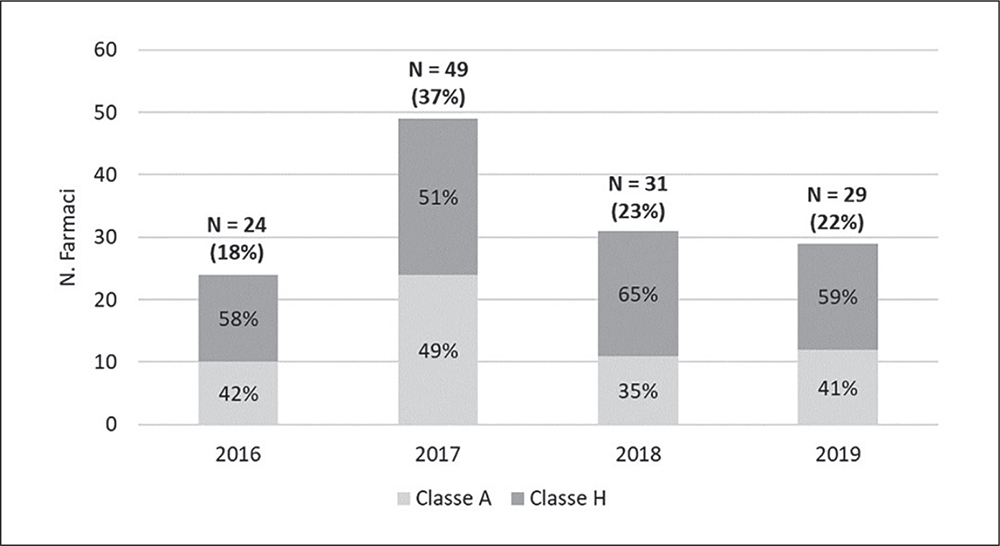
Nel quadriennio vengono mediamente rimborsati circa 33 farmaci all’anno, con un picco di 49 nel 2017 e un minimo di 24 nel 2016 (Fig. 2). La durata media delle tempistiche autorizzative (periodo 1-5) aumenta nei 4 anni, con un tasso medio annuo del 16,8%, passando da 228 (ds±86) giorni nel 2016 a 363 (ds±199) giorni nel 2019 (p = 0,002) (Tab. III). L’andamento mostra una lieve flessione nel 2018, per, poi, riprendere a salire nel 2019 (Tab. III). Dal momento che le tempistiche associate alla fase di post-assessment rimangono quasi invariate nei quattro anni, l’aumento del tempo assorbito dalla procedura autorizzativa è determinato esclusivamente dalla fase di assessment. Quest’ultima, infatti, mostra un tasso medio di crescita annuo del 24,6%, passando da 139 (ds±73) giorni nel 2016 a 281 (ds±188) giorni nel 2019 (p = 0,001) (Tab. III).
| Periodi | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|
| (24 farmaci) | (49 farmaci) | (31 farmaci) | (29 farmaci) | |
| Periodo 1-5 | ||||
| – media | 228 | 293 | 274 | 363 |
| – dev. std. | ±86 | ±167 | ±81 | ±199 |
| Periodo 1-2 (assessment) | ||||
| – media | 139 | 200 | 169 | 281 |
| – dev. std. | ±73 | ±160 | ±78 | ±188 |
| Periodo 3-5 (post-assessment) | ||||
| – media | 89 | 94 | 104 | 82 |
| – dev. std. | ±29 | ±37 | ±50 | ±33 |
| Periodi | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|
| (24 farmaci) | (49 farmaci) | (31 farmaci) | (29 farmaci) | |
| CTS (periodo 1) | ||||
| – media | 51 | 96 | 30 | 48 |
| – dev. std. | ±58 | ±147 | ±55 | ±127 |
| CPR (periodo 2) | ||||
| – media | 88 | 103 | 139 | 233 |
| – dev. std. | ±58 | ±65 | ±70 | ±147 |
Scomponendo, infine, la fase di assessment in funzione dei tempi assorbiti dal CTS (periodo 1) e dal CPR (periodo 2), si osserva come sia quest’ultimo ad aver determinato l’allungamento delle tempistiche autorizzative (Tab. IV). Infatti, dagli 88 giorni del 2016 si passa ai 233 giorni del 2019 (tasso medio annuo del 38,3%). Invece, i tempi associati al CTS, salvo un picco nel 2017, rimango quasi invariati.
Discussione
Come già indicato nel testo, il presente lavoro costituisce un ampliamento e un aggiornamento di una precedente analisi pubblicata nel 2018, anch’essa finalizzata a esaminare le tempistiche autorizzative di AIFA (1).
In questa sede, a differenza di quanto fatto precedentemente, si è cercato, con tutti i limiti del caso, di confrontare le tempistiche autorizzative di AIFA associate alle due ultime commissioni consultive e tecnico-scientifiche succedutesi durante l’arco temporale 2015-2020. La commissione 2018-2020 ha evidenziato un aumento di 45 giorni (p = 0,071) del processo negoziale rispetto alla commissione 2015-2018. Tale differenza è spiegata principalmente dal maggiore tempo assorbito dalla fase di assessment, caratterizzata da un incremento di 63 giorni (208 giorni vs 145 giorni; p = 0,016). Inoltre, se si focalizza l’attenzione sui due periodi che compongono la fase di assessment, si può notare come sia aumentato il divario tra i tempi assorbiti da CTS e CPR 2018-2020 rispetto a quelli assorbiti da CTS e CPR 2015-2018. Per questi ultimi, la differenza era di 29 giorni, a fronte di una attività del CPR di 87 giorni e del CTS di 58 giorni, mentre, per la commissione 2018-2020, la differenza tra tempi assorbiti da CPR (175 giorni) e CTS (33 giorni) aumenta a 142 giorni. Questa significativa differenza potrebbe trovare parte della sua spiegazione nella crescita percentuale del numero di farmaci oncologici e/o innovativi sul totale dei farmaci rimborsati dalla commissione 2018-2020 rispetto alla commissione 2015-2018. Parte dell’aumento delle tempistiche autorizzative potrebbe essere determinato anche da una maggiore difficoltà di trovare un accordo negoziale in grado di soddisfare, da una parte, il contenimento dei costi promosso da AIFA e, dall’altra, il ritorno dell’investimento economico in ricerca e sviluppo promosso dalle aziende farmaceutiche. Questa maggiore difficoltà nel trovare un accordo negoziale può essere letta alla luce di un maggiore ricorso agli sconti negoziali rispetto ai MEA da parte della commissione 2018-2020, che, probabilmente, ha preferito promuovere una politica di sconti ex-ante piuttosto che di sconti ex-post e potenziali come i MEA. In tale scenario, potrebbe, però, avvenire che le scontistiche richieste dalla commissione siano superiori al margine di trattativa che l’azienda farmaceutica capogruppo concede all’affiliata italiana, innescando una serie di lunghi colloqui intra-gruppo e di vari appuntamenti in CPR, allungando, di conseguenza, le tempistiche negoziali.
L’analisi secondaria mostra, nel quadriennio, un costante trend di crescita del tempo medio del processo di negoziazione, che passa da 228 giorni nel 2016 a 363 giorni nel 2019. La fase di post-assessment (periodo 3-5), dal momento che è caratterizzata da attività di natura amministrativa (ratifica dell’accordo negoziale e pubblicazione della determina), non mostra particolari scostamenti nel quadriennio, mentre l’aumento delle tempistiche è da attribuirsi alla fase di assessment, vale a dire alla fase in cui vengono svolte le attività valutative e negoziali da parte del CTS prima e del CPR poi. Realisticamente, l’aumento di queste tempistiche dovrebbe essere correlato alla crescente complessità dello scenario che CTS e CPR si trovano a fronteggiare; uno scenario caratterizzato da nuove terapie che arrivano sul mercato, dalla valutazione del loro corretto place in therapy, dalla valutazione della presenza o meno di un valore terapeutico aggiunto oppure dall’eccessiva distanza tra prezzo proposto dall’azienda farmaceutica in relazione al valore terapeutico attribuito al farmaco (13). Se così fosse, tutti questi elementi che determinano la complessità dello scenario dovrebbero agire simultaneamente sull’aumento delle tempistiche negoziali; in realtà, ciò sembrerebbe avvenire solo in parte. Infatti, se si focalizza l’attenzione sulle tempistiche assorbite mediamente nei 4 anni dal CTS e dal CPR, si osserva come solo quest’ultimo sia caratterizzato da un costante aumento (tasso medio annuo del 38,3%), quasi a sottintendere che sia principalmente la crescente complessità del processo di definizione dell’accordo sul prezzo e/o sulle condizioni generali di rimborso dei farmaci tra AIFA e le aziende farmaceutiche ad allungare le tempistiche autorizzative.
I risultati dell’analisi qui proposta devono essere letti alla luce di alcune osservazioni. Le tempistiche autorizzative, come indicato nella sezione Metodi, sono state calcolate in riferimento alla successione di 5 periodi, dall’apertura della procedura in CTS (periodo 1) alla pubblicazione della relativa determina in GU (periodo 5). A differenza della precedente pubblicazione, non è stato volutamente considerato, nell’analisi, il tempo che intercorre dalla data di pubblicazione della GUUE, successiva al parere favorevole del CHMP, alla data di apertura della procedura in CTS, perché, attualmente, non è più possibile tracciare la data di sottomissione della domanda di rimborsabilità e prezzo da parte dell’azienda farmaceutica. Senza questa informazione, il tempo che intercorre tra pubblicazione in GUUE e apertura in CTS potrebbe risentire di bias non rilevabili, dovuti a specifiche scelte o a ritardi delle stesse aziende farmaceutiche nel sottomettere la domanda di P&R.
Dal momento che, dalle fonti informative utilizzate, non è stato possibile identificare eventuali periodi in cui il processo di assessment è stato momentaneamente sospeso da parte del CTS o del CPR, in attesa di ricevere informazioni dall’azienda farmaceutica oppure per richiesta della stessa, è stato assunto che i tempi che intercorrono tra i primi due periodi fossero interamente attribuiti a CTS e CPR. Questa scelta potrebbe aver aumentato la stima delle tempistiche a carico di AIFA, ma, nell’ipotesi che tale bias si possa presentare per ogni farmaco esaminato, si ritiene che tale errore di fatto non modificherebbe il trend di aumento delle tempistiche autorizzative osservate nel quadriennio e i risultati del confronto tra le commissioni attuali e precedenti.
L’analisi degli andamenti temporali potrebbe essere, inoltre, influenzata da elementi straordinari come, per esempio, la sospensione delle attività di CTS e CPR nel 2018 a causa della nomina e dell’insediamento delle nuove commissioni oppure, ancora, la mancanza del Presidente del CdA per un periodo di circa 5 mesi tra novembre 2016 e marzo 2017.
Infine, da un punto di vista esclusivamente metodologico, il non aver potuto includere nell’analisi il differenziale tra prezzo negoziato e prezzo richiesto potrebbe aver escluso un importante parametro per spiegare la variabilità e l’aumento dei tempi assorbiti dal CPR.
Conclusioni
La sfida che fronteggia AIFA è riuscire a coniugare innovazione e sostenibilità, garantendo ai cittadini farmaci innovativi, valutandone contestualmente l’efficacia terapeutica e il rapporto costo/beneficio (14,15). Questa attività richiede un investimento di tempo che si è cercato di misurare in questa sede. Analizzare ogni periodo di una procedura lunga e complessa, come quella che porta alla rimborsabilità di un farmaco, ha permesso di mettere in evidenza quali attività specifiche determinino, in maniera più o meno significativa, variazioni sulla durata del processo stesso.
Si ritiene, infine, che tali misurazioni siano utili a tutti gli attori del SSN, ad AIFA per efficientare il processo di autorizzazione, alle aziende farmaceutiche per pianificare le proprie strategie di accesso al mercato, alle strutture ospedaliere e ai cittadini per essere consapevoli delle tempistiche di disponibilità di un nuovo farmaco.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Lidonnici D, Ronco V, Isernia M, et al. Tempi di accesso ai farmaci in Italia nel periodo 2015-2017: analisi delle tempistiche di valutazione dell’Agenzia Italiana del Farmaco. Global & Regional Health Technology Assessment. 2018:1-9. DOI: CrossRef
- 2. European Commission. Authorisation procedures – The centralised procedure. Online (Data ultimo accesso: maggio 2020).
- 3. European Medicines Agency (EMA). Il sistema normativo europeo per i medicinali. Un approccio unitario alla regolamentazione dei medicinali in tutta l’Unione Europea. Online (Data ultimo accesso: maggio 2020).
- 4. European Federation of the Pharmaceutical Industries and Associations (EFPIA) Patient W.A.I.T. Indicator 2018 survey. Online (Data ultimo accesso: maggio 2020).
- 5. Agenzia Italiana del Farmaco (AIFA). Negoziazione e rimborsabilità. Online (Data ultimo accesso: maggio 2020).
- 6. Data G, Mariani P. Market Access nel settore Healthcare. Strategie, attori, attività e processi. Franco Angeli. 2015:130.
- 7. European Medicines Agency (EMA). Online
- 8. Gazzetta Ufficiale Europea. Online
- 9. Gazzetta Ufficiale della Repubblica Italiana. Online (Data ultimo accesso: maggio 2020).
- 10. Agenzia Italiana del Farmaco (AIFA). Online (Data ultimo accesso: maggio 2020).
- 11. Orphanet Report Series. Lists of medicinal products for rare diseases in Europe. Online (Data ultimo accesso: maggio 2020).
- 12. Agenzia Italiana del Farmaco (AIFA). Farmaci innovativi. Online (Data ultimo accesso: maggio 2020).
- 13. Health Industry. Sistemi sanitari e Market Access. Un dialogo difficile. SICS Editore. Online (Data ultimo accesso: maggio 2020).
- 14. Agenzia Italiana del Farmaco (AIFA). Approfondimento sui Registri di Monitoraggio. Online (Data ultimo accesso: maggio 2020).
- 15. Morina M, Canti G, Damele F, et al. Nuovi criteri dell’Agenzia Italiana del Farmaco per l’attribuzione dell’innovatività terapeutica. Giornale Italiano di Farmacoeconomia e Farmacoutilizzazione. 2018;10:11-14.