 |
Glob Reg Health Technol Assess 2020; 7(1): 72-80 DOI: 10.33393/grhta.2020.2140 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di budget impact di anakinra nel trattamento della Malattia di Still in Italia
Budget Impact Analysis of anakinra in the treatment of patients with Still’s Disease
Background: Anakinra, canakinumab and tocilizumab are all effective alternative treatment choice in patients with Still’s disease including both systemic juvenile idiopathic arthritis (SJIA) and adult onset Still’s disease (AOSD).
Objective: Aim of this study was to estimate the budget impact of the use of anakinra compared to canakinumab and tocilizumab in the treatment of patients with AOSD or SJIA.
Methods: Considering the perspective of the Italian National Health Service (iNHS), a budget impact model (BIM) was developed to estimate the drug costs of anakinra, canakinumab and tocilizumab up to 12 months. The BIM showed the difference of drug expenditure generated by the base case calculated for current prescription volumes, and for different prescription volume scenarios with increased anakinra prescription. Key variables were tested in the sensitivity analysis.
Results: Compared to the current scenario for SJIA, an increase in the market share of anakinra (40% or 50%) would lead to a reduction in the drug expenditure sustained by iNHS (–€1,087,494 [–12.4%] or –€2,023,990 [–23.1%]). Compared to the current scenario for AOSD, an increase in the market share of anakinra (40% or 50%) would lead to a reduction in the drug expenditure sustained by iNHS (–€4,024,585 [–13.5%] or –€8,049,169 [–27.0%]).
Conclusion: According to the present analysis, the use of anakinra, as an alternative to canakinumab or tocilizumab in patients with AOSD or SJIA, could represent a cost-saving option for the iNHS.
Keywords: Anakinra, Still’s disease, Systemic juvenile idiopathic arthritis, Adult onset Still’s disease, Budget impact, Italian National Health Service
Received: April 26, 2020
Accepted: July 14, 2020
Published online: September 29, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La Malattia di Still è una grave patologia infiammatoria che si può presentare nell’adulto (adult-onset Still’s disease, AOSD) (1,2,3) o nel soggetto di età inferiore o uguale a 16 anni (systemic juvenile idiopathic arthritis, SJIA) (4). L’eziologia e la patogenesi sono in gran parte sconosciute (1,2,3,4). Sia nell’adulto che nel bambino (età ≤ 16 anni) la Malattia di Still presenta sintomi eterogenei non specifici come febbre, rash cutanei e disturbi ematologici (1,2,3,4). A entrambe le forme sono associati disabilità a lungo termine, aumento della morbilità e mortalità e riduzione della qualità della vita (1,2,3,4). L’analisi dell’espressione genica suggerisce che AOSD e SJIA rappresentino un “continuum” della stessa malattia, differendo tra loro per il tempo di insorgenza (5).
Sulla base della sintomatologia, i soggetti con Malattia di Still possono manifestare una forma sistemica [associata a febbre alta, alti livelli di proteina C-reattiva, enzimi epatici, ferritina e interleuchina (IL)-1 e IL-18, elevata velocità di eritrosedimentazione (VES)] o una forma cronica articolare (associata ad artrite, ad alti livelli di TNF-α, IL-6 e IL-17) (1,3,6,7).
Sia la AOSD sia la SJIA sono associate a gravi complicanze polmonari (ipertensione arteriosa polmonare, insufficienza respiratoria acuta, pneumopatia interstiziale ecc.), cardiache (miocarditi), coagulazione intravascolare disseminata, porpora trombotica trombocitopenica e sindrome da attivazione macrofagica (MAS) (8,9,10,11,12).
Un primo approccio empirico nel trattamento di AOSD e SJIA è stato caratterizzato dall’utilizzo di corticosteroidi e DMARDs (disease-modifying anti-rheumatic drugs) quali metotrexato, ciclosporina, azatioprina, sulfasalazina, leflunomide e immunoglobulina endovenosa (1,2,3,6,7,13,14). Successivamente, grazie alla scoperta dei mediatori dell’infiammazione alla base della Malattia di Still e allo sviluppo dei farmaci biologici (bDMARDs), tra i quali anakinra, canakinumab e tocilizumab, è stato possibile utilizzare un trattamento mirato (target treatment) contro le principali citochine infiammatorie coinvolte.
Anakinra è un antagonista umano del recettore dell’IL-1 prodotto in cellule di Escherichia coli mediante la tecnologia del DNA ricombinante. Anakinra inibisce il legame di IL-1α e IL-1β con il recettore IL-1 di tipo I, neutralizzandone l’attività (1,7,15). Di fatto anakinra, legandosi ai recettori a cui normalmente si legherebbe l’IL-1, blocca i processi infiammatori contribuendo ad alleviare i sintomi della malattia. Secondo i risultati di una recente revisione della letteratura che ha analizzato studi clinici e studi osservazionali (real-world) in soggetti con diagnosi di AOSD o SJIA, anakinra ha dimostrato di determinare il raggiungimento della remissione/risposta clinica, fornendo evidenze di un miglioramento rapido e duraturo nel tempo delle manifestazioni sistemiche, e consentendo la riduzione o l’interruzione di corticosteroidi/DMARDs (16).
Canakinumab è un anticorpo monoclonale completamente umano anti-IL-1β umana delle IgG1 isotipo K. Canakinumab si lega con alta affinità in modo specifico all’IL-1β umana neutralizzandone l’attività biologica mediante il blocco delle sue interazioni con i recettori IL-1, prevenendo pertanto l’attivazione del gene induttore dell’IL-1β e la produzione dei mediatori infiammatori (17).
Tocilizumab si lega in modo specifico ai recettori di IL-6 sia solubili che di membrana (sIL-6R e mIL-6R). Tocilizumab ha dimostrato di inibire i segnali mediati da sIL-6R e mIL-6R. IL-6 è una citochina proinfiammatoria pleiotropica prodotta da diverse tipologie cellulari, tra cui cellule T e B, monociti e fibroblasti. IL-6 è coinvolta in diversi processi fisiologici, quali l’attivazione delle cellule T, l’induzione della secrezione delle immunoglobuline, l’induzione della sintesi epatica delle proteine di fase acuta e la stimolazione dell’emopoiesi. IL-6 è coinvolta nella patogenesi di malattie, tra cui malattie infiammatorie, osteoporosi e neoplasie (18).
Obiettivo
Data la comprovata efficacia di multiple opzioni terapeutiche biologiche, in particolare anakinra, canakinumab e tocilizumab, è chiaramente emersa la necessità di valutarne anche l’impatto economico a carico del Servizio Sanitario Nazionale (SSN) nel trattamento dei pazienti con AOSD o SJIA con caratteristiche sistemiche attive e attività di malattia da moderata a elevata, oppure dei pazienti con attività di malattia persistente dopo trattamento con farmaci antinfiammatori non steroidei (FANS) o glucocorticoidi. È stata quindi condotta un’analisi di budget impact (Budget Impact Analysis, BIA) finalizzata a determinare l’impatto finanziario di un eventuale maggiore utilizzo di anakinra rispetto a canakinumab nel trattamento della AOSD e rispetto a canakinumab e tocilizumab nel trattamento della SJIA.
Metodi
La BIA è stata condotta tramite la creazione ad hoc di uno specifico modello di budget impact (Budget Impact Model, BIM). Il BIM, sviluppato nella prospettiva del SSN, ha considerato il solo costo di trattamento farmacologico per i soggetti con AOSD o SJIA. Non sono stati considerati altri costi diretti sanitari (es. visite, esami di laboratorio ecc.) o costi indiretti (es. perdita di produttività), in quanto non ritenuti differenzianti per le terapie considerate. La BIA ha coperto un orizzonte temporale di 1 anno. La Figura 1 illustra schematicamente la struttura del BIM. L’analisi è stata condotta osservando quanto indicato dalle Linee Guida dell’International Society for Pharmacoeconomics and Outcomes Research (ISPOR) per la conduzione di BIA (19,20).
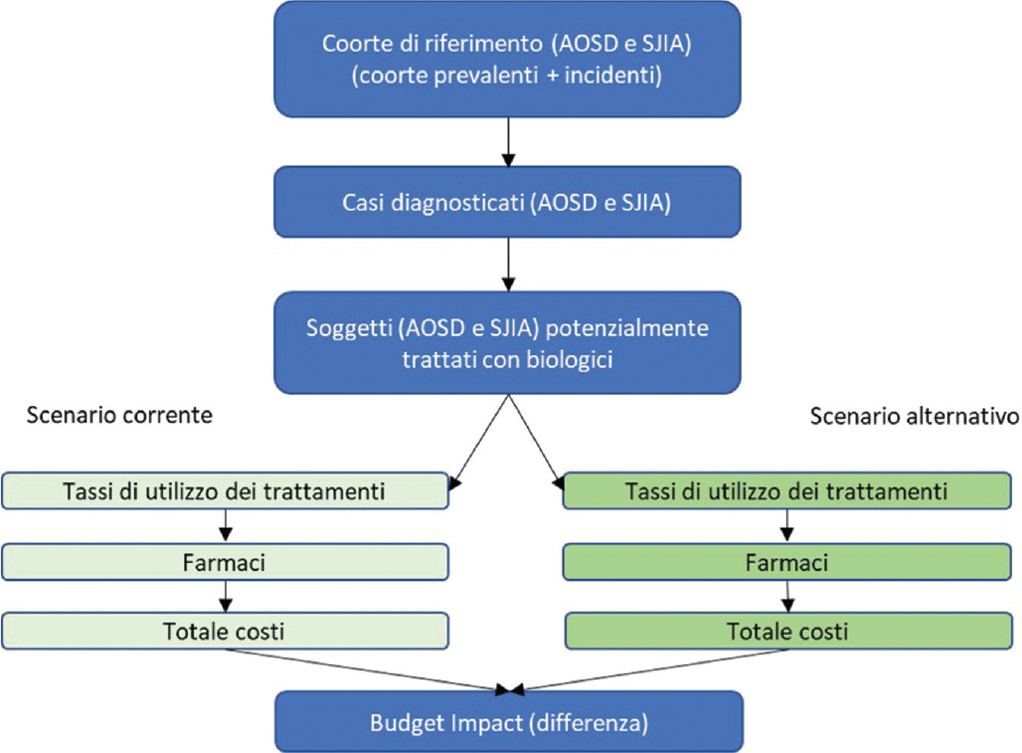
Assunzioni del modello
La stima del numero di pazienti con AOSD (3,10,21,22,23,24) e SJIA (22,23,24,25,26,27) oggetto della BIA è stata effettuata sulla base dei dati di letteratura, di mercato e di parere esperto.
La scelta di confrontare anakinra rispetto al solo canakinumab nella AOSD e rispetto a canakinumab e tocilizumab nella SJIA è basata sul setting dei pazienti oggetto di indagine (pazienti con caratteristiche sistemiche attive e attività di malattia da moderata a elevata, o pazienti con attività di malattia persistente dopo trattamento con FANS o glucocorticoidi) e sulle rispettive indicazioni terapeutiche dei tre farmaci considerati. Nello specifico, il Riassunto delle Caratteristiche del Prodotto (RCP) di anakinra stabilisce che è indicato negli adulti, negli adolescenti, nei bambini e nei lattanti di età ≥8 mesi con un peso corporeo ≥ 10 kg per il trattamento della Malattia di Still (AOSD e SJIA), con caratteristiche sistemiche attive e attività di malattia da moderata a elevata, o nei pazienti con attività di malattia persistente dopo trattamento con FANS o glucocorticoidi (28). Canakinumab è indicato per il trattamento della Malattia di Still in fase attiva (AOSD e SJIA) in pazienti a partire dai 2 anni di età, che hanno risposto in modo non adeguato alla precedente terapia con FANS e corticosteroidi sistemici (17). Tocilizumab è invece indicato per il trattamento della SJIA attiva in pazienti di età ≥2 anni che non hanno risposto adeguatamente a precedente terapia con FANS e corticosteroidi sistemici (18).
Poiché in letteratura non esistono studi clinici di confronto diretto, in via conservativa, sulla base dei rispettivi studi registrativi che hanno dimostrato una maggiore efficacia rispetto a DMARDs e/o placebo nel trattamento della AOSD (29,30) e della SJIA (31,32,33), è stata assunta una sovrapponibilità in termini di efficacia e sicurezza tra anakinra, canakinumab e tocilizumab. Anche i risultati di una recente revisione sistematica della letteratura effettuata su studi clinici nel trattamento della SJIA vanno in questa direzione (34). Nel confronto indiretto tra anakinra, canakinumab e tocilizumab gli autori affermano che non ci sono differenze in termine di efficacia e di sicurezza tra i tre trattamenti considerati. Gli stessi autori concludono che per ora il reumatologo pediatrico deve fare affidamento su dati di real-life, sulla sicurezza e sull’impatto economico dei trattamenti. Anakinra e canakinumab mostrano un favorevole profilo di sicurezza e tollerabilità (35). Anakinra è caratterizzato dalla più breve emivita (4-6 ore) (28,36), risultando così maneggevole nella pratica clinica. A differenza di anakinra, canakinumab e tocilizumab evidenziano un lieve incremento di infezioni non serie del tratto respiratorio superiore (18,37). Si ricorda infine che per tocilizumab è stata emanata la nota AIFA del 27 giugno 2019, riguardante il raro rischio di grave danno epatico (38). Differente è invece la modalità di somministrazione. Anakinra viene somministrato tramite iniezione sottocutanea giornaliera effettuata dal paziente stesso. Anche canakinumab viene somministrato dal paziente tramite iniezione sottocutanea, però a intervalli di 4 settimane. Tocilizumab è invece somministrato in ambito ospedaliero/ambulatoriale ogni 2 settimane per via parenterale. Il presupposto di sovrapponibilità delle caratteristiche di efficacia e tollerabilità dei tre farmaci hanno di fatto indirizzato e focalizzato in questa sede l’attenzione unicamente sui costi associati al trattamento farmacologico della AOSD e della SJIA.
| Parametri | AOSD | Fonte | SJIA | Fonte | Malattia di Still |
|---|---|---|---|---|---|
| Prevalenti | 941 | (22-24,27) | 296 | (22-25,27) | 1.237 |
| Incidenti | 141 | (22-24,27) | 42 | (22-25,27) | 183 |
| Totale | 1.082 | 338 | 1.420 | ||
| % diagnosticati | 50% | (3,10,21-23) | 60% | (22,23,26) | 52% |
| Diagnosticati | 541 | (3,10,21-23) | 203 | (22,23,26) | 744 |
| - % di cui trattati con biologici | 30% | (3,10,21-23) | 47% | (22,23,26) | 35% |
| - di cui trattati con biologici | 162 | (3,10,21-23) | 95 | (22,23,26) | 257 |
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
Oltre al caso base, che è servito a dare una dimensione della spesa farmaceutica generata dall’utilizzo dei tre biologici nel trattamento dei pazienti con AOSD o SJIA, la BIA ha valutato altri eventuali scenari in cui si possa verificare un incremento delle quote di mercato di anakinra.
Dati di input del modello
Popolazione
La coorte di riferimento del modello è costituita da pazienti in label con le indicazioni dei tre biologici per il trattamento della AOSD e SJIA (17,18,28). I dati di input utilizzati per la stima della numerosità dei pazienti oggetto della presente BIA sono riportati in dettaglio nella Tabella I. I dati di prevalenza, di incidenza, delle percentuali di pazienti diagnosticati e trattati con biologici sono stati stimati basandosi sulla letteratura (3,10,21,24,25,27) e su una ricerca di mercato (22), successivamente validati dal parere di esperti (23). Complessivamente, su base annua, si stimano circa 1.400 soggetti (prevalenti più incidenti) con Malattia di Still, di cui il 76% con esordio in età adulta e il 26% in età giovanile (Tabella I). Da questa coorte è stato poi definito il numero di pazienti diagnosticati e trattati con farmaci biologici per un totale annuo di 162 soggetti con AOSD e 95 con SJIA (Tabella I) (22).
Farmaci
Le strategie terapeutiche prevedono la somministrazione di anakinra e canakinumab nel trattamento della AOSD e di anakinra, canakinumab e tocilizumab nel trattamento della SJIA. Poiché per entrambe le malattie la posologia dei tre biologici è peso-dipendente (anakinra: se il peso corporeo è <50 kg allora 1 mg/kg una volta al giorno, se invece il peso corporeo è ≥ 50 kg allora 100 mg una volta al giorno; canakinumab: 4 mg/kg ogni 28 giorni se il peso corporeo è ≥ 7,5 kg; tocilizumab: 8 mg/kg ogni 14 giorni se il peso corporeo è ≥30 kg, 12 mg/kg ogni 14 giorni se invece il peso corporeo è <30 kg), la Tabella II ne descrive i rispettivi schemi di somministrazione stimati rispetto al peso atteso dei pazienti e adottati in questa sede (17,18,28,39).
La Tabella III riporta il costo medio per ciclo e per anno, associato a ciascun farmaco, per il trattamento della SJIA e dell’AOSD. Tali costi sono stati calcolati sulla base dei dosaggi medi di somministrazione (peso-dipendente), di un ciclo di 28 giorni, di un numero medio annuo di 13 cicli (365 giorni/28 giorni) e del costo ex-factory al netto delle riduzioni obbligatorie di legge. Non disponendo della distribuzione per età dei pazienti con SJIA, il relativo costo medio per ciclo o per anno riflette la media semplice dei costi di trattamento per singola fascia di età.
Market share
Le quote di mercato considerate nel caso base sono riportate nella Tabella IV e rappresentano la percentuale di utilizzo di anakinra, canakinumab e tocilizumab nel trattamento dei pazienti con AOSD o con SJIA. Tali percentuali sono state stimate sulla base di parere esperto e riscontrate con gli attuali dati di mercato. Oltre al caso base, la BIA ha valutato anche altri scenari nei quali è stato ipotizzato, su indicazione di parere esperto, un eventuale aumento delle quote di mercato di anakinra (Tabella IV).
| Età | Peso medio (kg) | Dosaggio per somministrazione (mg) | |||
|---|---|---|---|---|---|
| Anakinra* | Canakinumab** | Tocilizumab*** | |||
| 8 | mesi | 8,5 | 8,5 | n.a. | n.a. |
| 1 | anno | 10,0 | 10,0 | n.a. | n.a. |
| 2 | anni | 12,3 | 12,3 | 49,2 | 148 |
| 3 | anni | 14,1 | 14,1 | 56,2 | 169 |
| 4 | anni | 16,0 | 16,0 | 64,0 | 192 |
| 5 | anni | 18,0 | 18,0 | 72,0 | 216 |
| 6 | anni | 20,5 | 20,5 | 82,0 | 246 |
| 7 | anni | 23,0 | 23,0 | 92,0 | 276 |
| 8 | anni | 26,0 | 26,0 | 104,0 | 312 |
| 9 | anni | 28,8 | 28,8 | 115,0 | 345 |
| 10 | anni | 32,5 | 32,5 | 130,0 | 260 |
| 11 | anni | 36,5 | 36,5 | 146,0 | 292 |
| 12 | anni | 40,8 | 40,8 | 163,0 | 326 |
| 13 | anni | 45,5 | 45,5 | 182,0 | 364 |
| 14 | anni | 50,0 | 100,0 | 200,0 | 400 |
| 15 | anni | 54,0 | 100,0 | 216,0 | 432 |
| 16 | anni | 57,5 | 100,0 | 230,0 | 460 |
| 17 | anni | 60,0 | 100,0 | 240,0 | 480 |
| 18+ | anni | ≥61,5 | 100,0 | 246,0 | 492 |
n.a. = non applicabile.
*Anakinra: se peso <50 kg allora 1 mg/kg una volta al giorno, se peso ≥50 kg allora 100 mg una volta al giorno.
**Canakinumab: se peso ≥7,5 kg allora 4 mg/kg ogni 28 giorni.
***Tocilizumab: se peso ≥30 kg allora 8 mg/kg ogni 14 giorni, se peso <30 kg allora 12 mg/kg ogni 14 giorni.
| Costo medio trattamento | |||
|---|---|---|---|
| Anakinra | Canakinumab | Tocilizumab | |
| Costo medio ciclo SJIA (≤16 anni) | € 797 | € 13.237 | € 1.044 |
| Costo medio annuo SJIA (≤16 anni) | € 10.393 | € 172.549 | € 13.605 |
| Costo medio ciclo AOSD (>17 anni) | € 797 | € 19.855 | n.a. |
| Costo medio annuo AOSD (>17 anni) | € 10.393 | € 258.824 | n.a. |
n.a. = non applicabile.
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease. Ciclo = 28 giorni di trattamento.
| Quote di mercato | |||
|---|---|---|---|
| Anakinra | Canakinumab | Tocilizumab | |
| SJIA | |||
| Scenario base | 30% | 50% | 20% |
| Primo scenario alternativo | 40% | 43% | 17% |
| Secondo scenario alternativo | 50% | 37% | 13% |
| AOSD | |||
| Scenario base | 30% | 70% | n.a. |
| Primo scenario alternativo | 40% | 60% | n.a. |
| Secondo scenario alternativo | 50% | 50% | n.a. |
n.a. = non applicabile.
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
Dati di output del modello
Budget Impact
La BIA, sulla base della popolazione trattabile e del costo medio annuo stimato per il paziente in terapia con biologico, fornisce lungo un orizzonte temporale di un anno la differenza di spesa generata dal mercato corrente (caso base) rispetto a due eventuali scenari nei quali è stato ipotizzato un aumento delle quote di mercato di anakinra nel trattamento della AOSD o della SJIA. L’adozione per condurre l’analisi di budget impact di un orizzonte temporale di un anno è stata effettuata con l’obiettivo di definire l’attuale impatto della spesa farmaceutica per la terapia biologica nel trattamento della Malattia di Still. La successiva scelta di presentare differenti scenari, rispetto a quello base, riguardanti l’incremento di utilizzo di anakinra rispettando il vincolo dei 12 mesi di osservazione, è stata attuata con l’intento di riprodurre un effetto similare a quello che si sarebbe ottenuto facendo variare (di anno in anno) le quote di mercato di anakinra lungo un orizzonte temporale maggiore (es. tre, quattro o cinque anni).
Analisi di sensibilità
Poiché oltre alle riduzioni obbligatorie di legge (–5% e –5%) gli accordi negoziali dei tre biologici prevedono la presenza di ulteriori sconti confidenziali non quantificabili (in quanto non indicati in Gazzetta Ufficiale), è stata condotta un’analisi deterministica (a una via) per stimare la sensibilità del modello alla variazione dei costi farmacologici considerati nel caso base. Nello specifico, la BIA è stata riproposta considerando, in via conservativa, per anakinra lo stesso prezzo del caso base, mentre per canakinumab e tocilizumab è stato applicato un ulteriore sconto del 10% o del 20% al prezzo del caso base.
Non disponendo della distribuzione per classe di età dei pazienti con SJIA, si è cercato infine di indagarne la variabilità sulla spesa complessiva. Con questo obiettivo è stata condotta un’ulteriore analisi di sensibilità in virtù della quale sono stati ipotizzati dei casi limite in cui tutti i pazienti trattati abbiano 2, 8 o 17 anni di età.
Infine, poiché calcolata sulla base della letteratura e di una ricerca di mercato validata dal parere di esperti, la popolazione con SJIA o AOSD eleggibile al trattamento farmacologico è stata fatta variare del ±10% rispetto al caso base. Nello specifico, sono stati fatti variare del ±10% il numero dei pazienti incidenti e prevalenti, la percentuale dei pazienti diagnosticati e di quelli trattati con biologici.
Risultati
Budget impact SJIA
La spesa corrente annuale a carico del SSN, calcolata sul numero stimato dal BIM di pazienti in trattamento con i tre biologici (canakinumab: n = 48; tocilizumab: n = 19; anakinra: n = 29), è risultata pari a €8.750.786, di cui €8.196.097 generata da canakinumab, €258.489 da tocilizumab e €296.199 da anakinra (Tabella V). A fronte di tali numeriche e spesa, il costo medio annuo per paziente trattato è pari a €92.114 (Tabella V e Figura 2).
| Scenario corrente | Primo scenario alternativo | Secondo scenario alternativo | ||||
|---|---|---|---|---|---|---|
| SJIA | ||||||
| Canakinumab | 48 | € 8.196.097 | 41 | € 7.048.643 | 35 | € 6.065.112 |
| Tocilizumab | 19 | € 258.489 | 16 | € 219.716 | 12 | € 168.018 |
| Anakinra | 29 | € 296.199 | 38 | € 394.933 | 48 | € 493.666 |
| Totale | 95 | € 8.750.786 | 95 | € 7.663.292 | 95 | € 6.726.795 |
| Differenza scenari | –€ 1.087.494 | –€ 2.023.990 | ||||
| Costo medio paziente trattato | € 92.114 | € 80.666 | € 70.808 | |||
| AOSD | ||||||
| Canakinumab | 113 | € 29.350.654 | 97 | € 25.157.703 | 81 | € 20.964.753 |
| Anakinra | 49 | € 505.098 | 65 | € 673.464 | 81 | € 841.830 |
| Totale | 162 | € 29.855.752 | 162 | € 25.831.167 | 162 | € 21.806.583 |
| Differenza scenari | –€ 4.024.585 | –€ 8.049.169 | ||||
| Costo medio paziente trattato | € 184.295 | € 159.452 | € 134.609 | |||
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
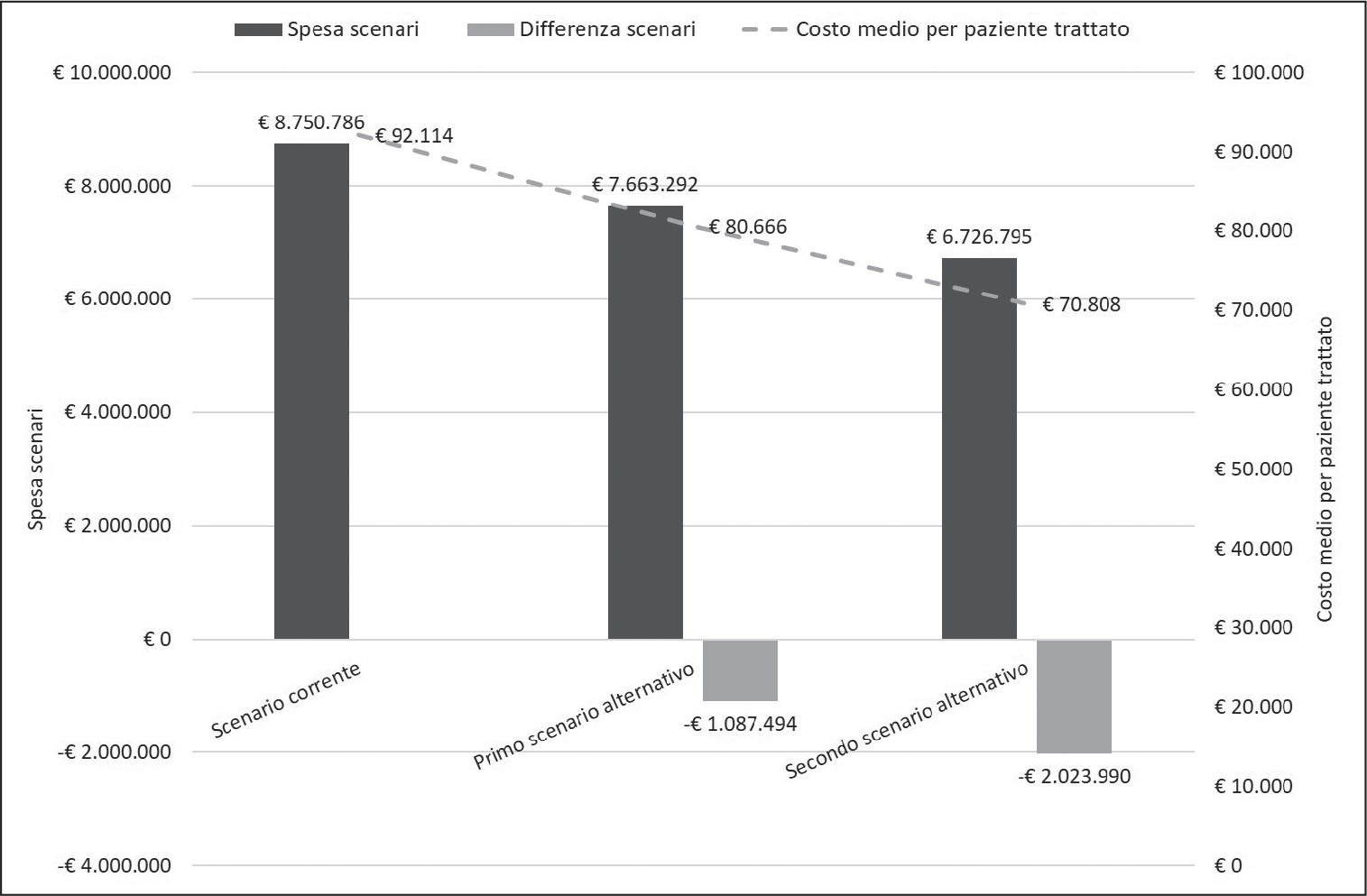
In corrispondenza di un aumento delle quote di mercato di anakinra che, rispetto allo scenario corrente (30%; n = 29), porterebbe a trattare il 40% (n = 38) o il 50% (n = 48) dei pazienti con SJIA, si avrebbe una riduzione della spesa a carico del SSN di €1.087.494 (–12,4%) o di €2.023.990 (–23,1%) (Tabella V e Figura 2). Corrispondentemente, il costo medio annuo per paziente trattato scenderebbe a €80.666 o a €70.808 (Tabella V e Figura 2).
Budget impact AOSD
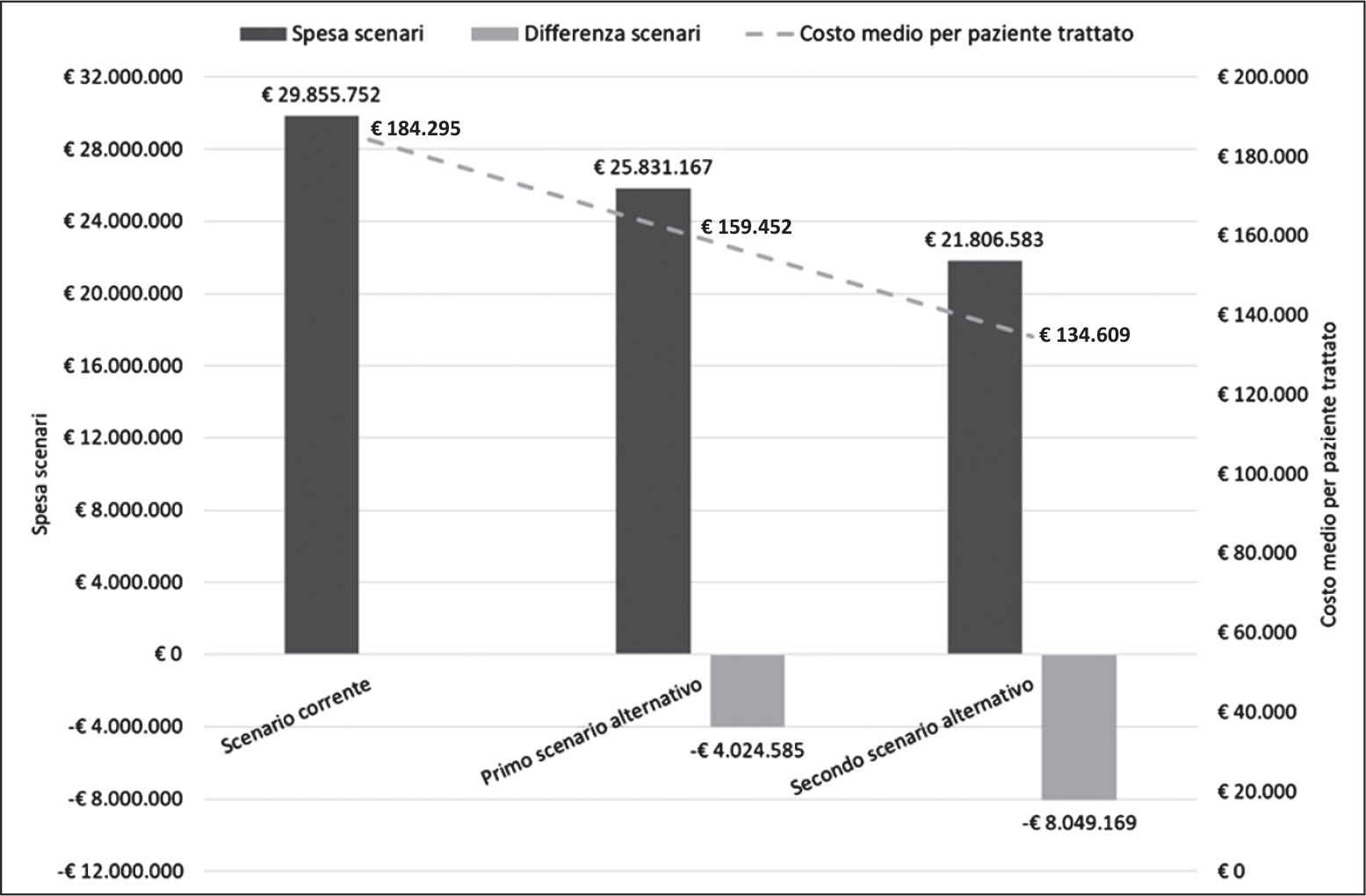
La spesa corrente annuale a carico del SSN, calcolata sul numero stimato dal BIM di pazienti in trattamento con i due biologici (canakinumab: n = 113; anakinra: n = 49), è risultata pari a €29.855.752, di cui €29.350.654 generata da canakinumab e €505.098 da anakinra (Tabella V). A fronte di tali numeriche e spesa, il costo medio annuo per paziente trattato è pari a €184.295 (Tabella V e Figura 3).
In corrispondenza di un aumento delle quote di mercato di anakinra che, rispetto allo scenario corrente (30%; n = 49), porterebbe a trattare il 40% (n = 65) o il 50% (n = 81) dei pazienti con AOSD, si avrebbe una riduzione della spesa a carico del SSN di €4.024.585 (–13,5%) o di €8.049.169 (–27%) (Tabella V e Figura 3). Corrispondentemente, il costo medio annuo per paziente trattato scenderebbe a €159.452 o a €134.609 (Tabella V e Figura 3).
Analisi di sensibilità
Le Tabelle VI e VII riportano i risultati dell’analisi di sensibilità nell’ipotesi di riduzione dei prezzi (–10% o –20%) di canakinumab e tocilizumab. In entrambi le ipotesi, anche a fronte di tali riduzioni, l’incremento di utilizzo di anakinra continuerebbe a determinare una significativa riduzione della spesa farmaceutica (SJIA e AOSD) a carico del SSN, confermando di fatto i risultati del caso base.
| Scenario corrente | Primo scenario alternativo | Secondo scenario alternativo | ||||
|---|---|---|---|---|---|---|
| SJIA | ||||||
| Canakinumab | 48 | € 7.376.487 | 41 | € 6.343.779 | 35 | € 5.458.600 |
| Tocilizumab | 19 | € 232.640 | 16 | € 197.744 | 12 | € 151.216 |
| Anakinra | 29 | € 296.199 | 38 | € 394.933 | 48 | € 493.666 |
| Totale | 95 | € 7.905.327 | 95 | € 6.936.456 | 95 | € 6.103.483 |
| Differenza scenari | –€ 968.871 | –€ 1.801.844 | ||||
| Costo medio paziente trattato | € 83.214 | € 73.015 | € 64.247 | |||
| AOSD | ||||||
| Canakinumab | 113 | € 26.415.588 | 97 | € 22.641.933 | 81 | € 18.868.277 |
| Anakinra | 49 | € 505.098 | 65 | € 673.464 | 81 | € 841.830 |
| Totale | 162 | € 26.920.686 | 162 | € 23.315.397 | 162 | € 19.710.108 |
| Differenza scenari | –€ 3.605.289 | –€ 7.210.579 | ||||
| Costo medio paziente trattato | € 166.177 | € 143.922 | € 121.667 | |||
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
| Scenario corrente | Primo scenario alternativo | Secondo scenario alternativo | ||||
|---|---|---|---|---|---|---|
| SJIA | ||||||
| Canakinumab | 48 | € 6.556.877 | 41 | € 5.638.915 | 35 | € 4.852.089 |
| Tocilizumab | 19 | € 206.792 | 16 | € 175.773 | 12 | € 134.414 |
| Anakinra | 29 | € 296.199 | 38 | € 394.933 | 48 | € 493.666 |
| Totale | 95 | € 7.059.868 | 95 | € 6.209.620 | 95 | € 5.480.170 |
| Differenza scenari | –€ 850.248 | –€ 1.579.699 | ||||
| Costo medio paziente trattato | € 74.314 | € 65.364 | € 57.686 | |||
| AOSD | ||||||
| Canakinumab | 113 | € 23.480.523 | 97 | € 20.126.163 | 81 | € 16.771.802 |
| Anakinra | 49 | € 505.098 | 65 | € 673.464 | 81 | € 841.830 |
| Totale | 162 | € 23.985.621 | 162 | € 20.799.627 | 162 | € 17.613.632 |
| Differenza scenari | –€ 3.185.994 | –€ 6.371.989 | ||||
| Costo medio paziente trattato | € 148.059 | € 128.393 | € 108.726 | |||
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
| Scenario corrente | Primo scenario alternativo | Secondo scenario alternativo | |
|---|---|---|---|
| SJIA | |||
| Anni 2 | € 6.570.398 | € 5.789.472 | € 5.125.131 |
| - differenza scenario | –€ 780.926 | –€ 1.445.267 | |
| Anni 8 | € 6.729.305 | € 5.924.543 | € 5.228.421 |
| - differenza scenario | –€ 804.762 | –€ 1.500.884 | |
| Anni 17 | € 12.971.722 | € 11.292.069 | € 9.839.229 |
| - differenza scenario | –€ 1.679.654 | –€ 3.132.494 |
SJIA = systemic juvenile idiopathic arthritis.
La Tabella VIII mostra come la distribuzione dei pazienti per classe di età non modifichi i risultati della BIA, confermando di fatto il risparmio associato all’incremento di utilizzo di anakinra. La Tabella IX invece mostra la variazione della spesa a carico del SSN in funzione della riduzione o dell’aumento della popolazione con SJIA o con AOSD in trattamento con farmaci biologici. Nel trattamento della SJIA, a fronte di una riduzione del 10% dei dati epidemiologici si registrerebbe una variazione della spesa a carico del SSN di –€2.394.952, mentre in caso di un aumento del 10% delle stime epidemiologiche la spesa a carico del SSN aumenterebbe di €2.947.633. Nel trattamento della AOSD, con una riduzione del 10% dei dati epidemiologici si registrerebbe una riduzione della spesa a carico del SSN di –€8.108.970, viceversa in caso di un aumento del 10% delle stime epidemiologiche la spesa a carico del SSN aumenterebbe di €9.951.917.
| Scenario corrente | –10% | +10% | |
|---|---|---|---|
| SJIA | € 8.750.786 | € 6.355.834 | € 11.698.419 |
| - differenza scenario | –€ 2.394.952 | € 2.947.633 | |
| AOSD | € 29.855.752 | € 21.746.782 | € 39.807.669 |
| - differenza scenario | –€ 8.108.970 | € 9.951.917 |
SJIA = systemic juvenile idiopathic arthritis; AOSD = adult-onset Still’s disease.
Discussione
È stata condotta una BIA finalizzata a stimare l’impatto economico per il SSN conseguente all’utilizzo di anakinra nel trattamento della Malattia di Still a esordio nell’adulto (AOSD) e dell’artrite idiopatica giovanile a esordio sistemico (SJIA). Le ipotesi di uptake (penetrazione di anakinra) e il minore costo medio annuo per paziente trattato associato ad anakinra hanno determinato, in caso sia di SJIA sia di AOSD, una sensibile riduzione della spesa farmaceutica a carico del SSN. Nell’ipotesi di maggiore penetrazione di anakinra, si registrerebbe una riduzione del 23,1% e del 27,0% della spesa, pari a circa 2 e 8 milioni di euro, rispettivamente per SJIA e AOSD. Rispetto allo scenario corrente, nell’ipotesi di una totale sostituzione di anakinra rispetto a canakinumab e tocilizumab la spesa a carico del SSN per il trattamento della SJIA si ridurrebbe del 90% circa, passando da 8,7 milioni di euro a circa 1 milione di euro. Anche nel caso della AOSD la riduzione della spesa farmaceutica sarebbe estremamente significativa (–94%), passando da 29,3 milioni di euro a 1,6 milioni di euro.
Poiché finalizzato a stimare l’impatto economico della sola spesa farmaceutica, il modello di simulazione qui utilizzato è caratterizzato da una struttura di analisi incentrata sulle quote di mercato e sui costi dei biologici. Il grado di incertezza associato a queste due variabili è stato indagato dall’analisi di sensibilità e da scenari alternativi che hanno confermato la validità dei risultati del caso base.
Purtroppo, in assenza di altre simili esperienze condotte in ambito nazionale o internazionale, non è stato possibile confrontare i presenti risultati con analoghi studi.
Come accade in presenza di un modello di simulazione, è opportuno leggere i risultati alla luce di alcune osservazioni. Tra queste, probabilmente, la più significativa è rappresentata dall’assenza di un confronto dell’efficacia tra le strategie farmacologiche considerate. Purtroppo, non essendo disponibili in letteratura studi clinici di confronto diretto che abbiano indagato l’efficacia di anakinra, canakinumab e tocilizumab nel trattamento della SJIA o della AOSD, basandoci sui risultati dei rispettivi studi clinici condotti rispetto a DMARDs e a placebo (29,30,31,32,33) e della revisione di Otten et al. (34), è stata considerata per tutti, in via conservativa, un’efficacia e una sicurezza sovrapponibile. Tale scelta è sicuramente cautelativa, nell’attesa che in futuro possano essere condotte analisi in grado di fornire un razionale clinico per decidere la migliore scelta terapeutica. Nel modello è stato inoltre ipotizzato di considerare i soli costi farmacologici, escludendo eventuali altri costi sanitari associati alla gestione della SJIA o della AOSD. Ciò è stato fatto nell’ipotesi che, a fronte di un’efficacia e sicurezza sovrapponibile, non vi siano sensibili differenze nei consumi sanitari (es. visite, esami) associati ai trattamenti farmacologici confrontati nella gestione della SJIA o della AOSD.
Nell’analisi del caso base sono stati considerati i prezzi ex-factory dei farmaci confrontati, senza tener conto di ulteriori sconti concessi al SSN. Quindi, poiché il prezzo ex-factory potrebbe di fatto non riflettere il reale prezzo di cessione al SSN (es. sconti confidenziali) che le aziende farmaceutiche negoziano con l’Agenzia Regolatoria, l’analisi di sensibilità ha riproposto la stima dello scenario base alla luce però di una sensibile riduzione del prezzo di canakinumab e tocilizumab (–10% e –20%), lasciando invece invariato il prezzo di anakinra. Anche a fronte di tali ipotesi, l’aumento dei pazienti trattati con anakinra continuerebbe a determinare una significativa riduzione della spesa farmaceutica per il trattamento della SJIA e della AOSD.
Il modello di simulazione fornisce lungo un orizzonte temporale di un anno la differenza di spesa generata dal mercato corrente rispetto a due differenti scenari nei quali viene ipotizzato un aumento delle quote di mercato di anakinra. Tutto ciò viene fatto assumendo che la popolazione oggetto di analisi sia statica durante l’anno di osservazione e non dinamica, ovvero non è stata considerata un’eventuale riduzione della numerosità della popolazione a causa della mortalità. Si ricorda inoltre che il numero di soggetti con SJIA o con AOSD potenzialmente trattabili con biologici si basa su una combinazione di dati di letteratura, di mercato ed expert opinion. Proprio per questo motivo è stata condotta un’analisi di sensibilità finalizzata a valutare l’impatto della variazione della popolazione trattata sulla spesa a carico del SSN.
Il costo medio annuo di trattamento associato alle tre alternative biologiche considerate è stato calcolato nell’ipotesi di una totale compliance (100%) del paziente alla terapia somministrata. Ciò probabilmente non riproduce fedelmente quanto potrebbe accadere nella pratica clinica, in virtù di possibili aggiustamenti terapeutici.
Conclusioni
La presente analisi rappresenta un primo tentativo di presentare uno scenario economico derivante dall’utilizzo di anakinra, canakinumab e tocilizumab nella gestione della Malattia di Still, evidenziando i potenziali risultati che si potrebbero ottenere in termini di risparmio della spesa farmaceutica in caso di un aumento di utilizzo di anakinra. Eventuali risparmi potrebbero generare un vantaggio per il sistema salute offrendo, a parità di efficacia, una soluzione economicamente vantaggiosa in grado di favorire il successivo re-investimento delle risorse a favore di un miglioramento dell’accesso dei pazienti ad altre cure primarie.
Acknowledgment
This is the final version of record of this article as stated in DOI 10.33393/grhta.2020.2187
Disclosures
Financial support: This research was made possible by an educational grant from SOBI.
Conflict of interest: The Authors declare that they have no conflicts of interest in this research.
Bibliografia
- 1. Sfriso P, Bindoli S, Galozzi P. Adult-onset Still’s disease: molecular pathophysiology and therapeutic advances. Drugs. 2018;78(12):1187-95.
- 2. Zhou S, Qiao J, Bai J et al. Biological therapy of traditional therapy-resistant adult-onset Still’s disease: an evidence-based review. Ther Clin Risk Manag. 2018;14: 167-71.
- 3. Sfriso P, Priori R, Valesini G et al. Adult onset Still’s disease: an Italian multicenter retrospective observational study of manifestations and treatments in 245 patients. Clin Rheumatol. 2016;35(7):1683-9.
- 4. Arthur VL, Shuldiner E, Remmers EF et al. IL1RN variation influences both disease susceptibility and response to recombinant human interleukin-1 receptor antagonist therapy in systemic juvenile idiopathic arthritis. Arthritis Rheumatol. 2018;70(8):1319-30.
- 5. Nirmala N, Brachat A, Feist E et al. Gene-expression analysis of adult-onset Still’s disease and systemic juvenile idiopathic arthritis is consistent with a continuum of a single disease entity. Pediatr Rheumatol Online J. 2015;13:50.
- 6. Castañeda S, Blanco R, González-Gay MA. Adult-onset Still’s disease: advances in the treatment. Best Pract Res Clin Rheumatol. 2016;30(2):222-38.
- 7. Pascual V, Allantaz F, Arce E et al. Role of interleukin-1 (IL-1) in the pathogenesis of systemic onset juvenile idiopathic arthritis and clinical response to IL-1 blockade. J Exp Med. 2005;201(9):1479-86.
- 8. Kimura Y, Weiss JE, Haroldson KL et al. Pulmonary hypertension and other potentially fatal pulmonary complications in systemic juvenile idiopathic arthritis. Arthritis Care Res (Hoboken). 2013;65(5):745-52.
- 9. Néel A, Wahbi A, Tessoulin B et al. Diagnostic and management of life-threatening adult-onset Still disease: a French nationwide multicenter study and systematic literature review. Crit Care. 2018;22(1):88.
- 10. Ruscitti P, Cipriani P, Masedu F et al. Adult-onset Still’s disease: evaluation of prognostic tools and validation of the systemic score by analysis of 100 cases from three centers. BMC Med. 2016;14(1):194.
- 11. Schulert GS, Grom AA. Pathogenesis of macrophage activation syndrome and potential for cytokine-directed therapies. Annu Rev Med. 2015;66:145-59.
- 12. Bracaglia C, Prencipe G, De Benedetti F. Macrophage activation syndrome: different mechanisms leading to a one clinical syndrome. Pediatr Rheumatol. 2017;15(1):5.
- 13. Ringold S, Weiss PF, Beukelman T et al. 2013 update of the 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: recommendations for the medical therapy of children with systemic juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications. Arthritis Rheum. 2013;65(10):2499-512.
- 14. Mimura T, Kondo Y, Ohta A et al. Evidence-based clinical practice guideline for adult Still’s disease. Mod Rheumatol. 2018 Sep;28(5):736-57.
- 15. Ter Haar NM, Tak T, Mokry M et al. Reversal of sepsis-like features of neutrophils by interleukin-1 blockade in patients with systemic-onset juvenile idiopathic arthritis. Arthritis Rheumatol. 2018;70(6):943-56.
- 16. Lyseng-Williamson KA. Anakinra in Still’s disease: a profile of its use. Drugs Ther Perspect. 2018;34(12):543-53.
- 17. Canakinumab RCP. https://ec.europa.eu/health/documents/community-register/2016/20160801135455/anx_135455_it.pdf Accesso Marzo 2020.
- 18. Tocilizumab RCP. https://www.ema.europa.eu/en/documents/product-information/roactemra-epar-product-information_it.pdf Accesso Marzo 2020.
- 19. Mauskopf JA, Sullivan SD, Annemans L et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on Good Research Practices—budget impact analysis. Value Health. 2007;10(5):336-47.
- 20. Sullivan SD, Mauskopf JA, Augustovski F et al. Budget impact analysis principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value Health. 2014;17(1):5-14.
- 21. Gerfaud-Valentin M, Jamilloux Y, Iwaz J et al. Adult-onset Still’s disease. Autoimmunity Reviews. 2014;13:708-22.
- 22. Data on file SOBI. Kineret Mapping Research.
- 23. Data on file SOBI. Expert Opinion from national Advisory Board.
- 24. ISTAT Popolazione 2016. http://dati.istat.it/Index.aspx?DataSetCode=DCIS_POPRES1 Accesso Agosto 2016.
- 25. Modesto C, Rodriguez B, Bou R et al. Incidence and prevalence of juvenile idiopathic arthritis in Catalonia (Spain). Scand J Rheumatol. 2010;39(6):472-9.
- 26. Vitale A, Insalaco I, Sfriso P et al. A snapshot on the on-label and off-label use of the interleukin-1 inhibitors in Italy among rheumatologists and pediatric rheumatologists: a nationwide multi-center retrospective observational study. Front Pharmacol. 2016 Oct 24;7:380.
- 27. Jamilloux Y, Gerfaud-Valentin M, Martinon F et al. Pathogenesis of adult-onset Still’s disease: new insights from the juvenile counterpart. Immunol Res. 2015;61:53-62.
- 28. Anakinra RCP. https://www.ema.europa.eu/en/documents/product-information/kineret-epar-product-information_it.pdf. Accesso Dicembre 2019.
- 29. Nordström D1, Knight A, Luukkainen R et al. Beneficial effect of interleukin 1 inhibition with anakinra in adult-onset Still’s disease. An open, randomized, multicenter study. J Rheumatol. 2012 Oct;39(10):2008-11.
- 30. Kontzias A, Efthimiou P. The use of Canakinumab, a novel IL-1β long-acting inhibitor, in refractory adult-onset Still’s disease. Semin Arthritis Rheum. 2012 Oct;42(2):201-5.
- 31. Quartier P, Allantaz F, Cimaz R et al. A multicentre, randomised, double-blind, placebo-controlled trial with the interleukin-1 receptor antagonist anakinra in patients with systemic-onset juvenile idiopathic arthritis (ANAJIS trial). Ann Rheum Dis. 2011;70:747-54.
- 32. Ruperto N, Brunner HI, Quartier P et al. Two randomized trials of canakinumab in systemic juvenile idiopathic arthritis. N Engl J Med. 2012;367:2396-406.
- 33. De Benedetti F, Brunner HI, Ruperto N et al. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis. N Engl J Med. 2012 Dec 20;367(25):2385-95.
- 34. Otten MH, Anink J, Spronk S, van Suijlekom-Smit LW. Efficacy of biological agents in juvenile idiopathic arthritis: a systematic review using indirect comparisons. Ann Rheum Dis. 2013 Nov;72(11):1806-12.
- 35. Sota J, Vitale A, Insalaco I et al. Safety profile of the interleukin-1 inhibitors anakinra and canakinumab in real-life clinical practice: a nationwide multicenter retrospective observational study. Clin Rheumatol. 2018 Aug;37(8):2233-40.
- 36. Donath MY, Dinarello CA, Mandrup-Poulsen T. targeting innate immune mediators in type 1 and type 2 diabetes. Nat Rev Immunol. 2019 Dec;19(12):734-46.
- 37. Bettiol A, Lopalco G, Emmi G et al. Unveiling the efficacy, safety, and tolerability of anti-interleukin-1 treatment in monogenic and multifactorial autoinflammatory diseases. Int J Mol Sci. 2019 Apr 17;20(8):1898.
- 38. Nota AIFA RoActemra, 27 giugno 2019. http://www.agenziafarmaco.gov.it/content/nota-informativa-importante-su-roactemra%C2%AE-tocilizumab-27062019
- 39. Center for Disease Control and Prevention (CDC). https://www.cdc.gov/growthcharts/clinical_charts.htm Accesso Dicembre 2019.