 |
G Clin Nefrol Dial 2024; 36: 87-92 ISSN 2705-0076 | DOI: 10.33393/gcnd.2024.3362 SHORT COMMUNICATION |
 |
Neoplasie de novo post-trapianto renale
De novo malignancies after kidney transplantation
Cancer is the second cause of death in kidney transplant patients in most Western countries. The excess risk of cancer after kidney transplantation is two to three times higher than in the age and sex matched general population. Once cancer develops, the outcome is generally poor, particularly for melanoma, renal cell carcinoma and post-transplant lymphoproliferative disorder.
A multidisciplinary approach for screening, prevention, diagnosis and treatment of neoplastic disease after kidney transplantation is necessary.
Keywords: Cancer, Immunosuppressive therapy, Kidney transplantation
Received: October 29, 2024
Accepted: October 31, 2024
Published online: November 25, 2024
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Sappiamo ormai come il trapianto di rene rappresenti l’opzione terapeutica più efficace in termini di qualità della vita, sopravvivenza e rapporto costo-beneficio nei pazienti affetti da malattia renale cronica (1,2). Tuttavia, come tutte le terapie, non è privo di effetti collaterali e complicanze. Una delle più temute, legata allo stato di immunosoppressione cronica, è quella neoplastica (3) che rappresenta la seconda causa di morte dopo la malattia cardiovascolare nei pazienti che ricevono un trapianto renale (4).
Si evince, dunque, quanto sia essenziale, dove possibile, applicare tutte le misure a disposizione in ambito di prevenzione, diagnosi precoce e trattamento.
Epidemiologia
Incidenza
L’incidenza cumulativa di cancro negli organi solidi oscilla tra il 10% e il 15% a distanza di circa 15 anni dal trapianto (5) raggiungendo oltre il 60% in Europa, Australia e Nuova Zelanda per quanto riguarda i tumori cutanei, con un rischio cumulativo pari al doppio o al triplo rispetto alla popolazione generale aggiustata per età e sesso. In particolare il rischio è aumentato per tumori con eziologia virale, malattie linfoproliferative post-trapianto (PTLD), carcinoma anogenitale e sarcoma di Kaposi (6,7). Al contrario non si riscontra un aumento di rischio rispetto alla popolazione generale per quanto riguarda le neoplasie mammaria e prostatica (Fig. 1).
Mortalità
Una volta sviluppatasi, i tassi di mortalità standard per tutti i tipi di neoplasia sono almeno 1,8-1,9 volte più alti che nella popolazione generale con un ulteriore aumento del rischio fino a 5-10 volte per i soggetti affetti da melanoma, tumore urogenitale e linfoma non-Hodgkin (8).
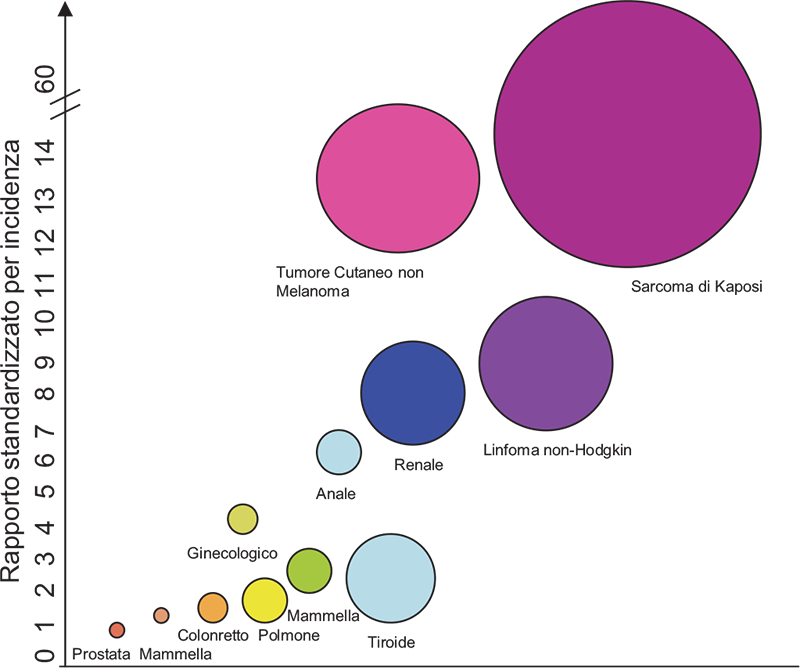
Figura 1 - Rapporti standardizzati per incidenza dei diversi tipi di neoplasia nei riceventi di trapianto di rene. La dimensione del cerchio rappresenta il rischio assoluto di sviluppare neoplasia rispetto alla popolazione generale.
Fattori di rischio
I fattori di rischio per lo sviluppo di una neoplasia de novo possono essere quelli in comune con la popolazione generale (età avanzata, sesso maschile, fumo, esposizione prolungata al sole) e i fattori propri della popolazione con malattia renale e trapiantata.
In particolare questi ultimi sono:
– una terapia immunosoppressiva che determina una deplezione dell’immunità cellulo-mediata (linfociti T) e quindi una ridotta immunizzazione nei confronti degli antigeni virali e tumorali;
– eventi di rigetto acuto (9);
– uno stato di sensibilizzazione (10);
– durata della dialisi prima del trapianto (11) (soprattutto per quanto riguarda lo sviluppo del carcinoma a cellule renali e del mieloma multiplo).
Il rischio di sviluppare un tumore diventa ancora più elevato nei soggetti con storia di neoplasia maligna prima del trapianto (12,13).
Esistono, poi, dei fattori ambientali e geografici (14).
Meccanismi di sviluppo di neoplasia dopo trapianto renale
I meccanismi che portano allo sviluppo di un tumore dopo trapianto renale non sono ancora ben chiari.
Un ruolo fondamentale è certamente svolto dalla depressione del sistema immunitario che determina:
– scarso controllo dei virus oncogeni, per esempio: herpes virus umano 8 (HHV8) e sarcoma di Kaposi, Epstein-Barr virus (EBV) e PTLD, papillomavirus umano (HPV) e tumori delle grandi labbra e dell’ano (15);
– sviluppo di mutazioni che in assenza di immunosoppressione verrebbero riconosciute dal sistema immunitario (neoplasie cutanee e danno da radiazioni ultraviolette [UV]) (16).
Attualmente, non ci sono prove che un tipo di immunosoppressione sia più oncogeno di altri (17), tuttavia alcuni studi sperimentali hanno individuato un ruolo fondamentale del tacrolimus nella progressione di carcinoma epatocellulare, adenocarcinoma polmonare e carcinoma a cellule renali, tramite l’aumento dei livelli di TGF-β.
L’azatioprina, invece, sensibilizza la pelle alle radiazioni UVA e provoca l’accumulo di 6-tioguanina nel DNA, portando a un rischio maggiore di tumori cutanei non-melanoma (Non-Melanoma Skin Cancer, NMSC) (18).
Al contrario, gli inibitori del bersaglio dei mammiferi della rapamicina (mTOR) possono avere potenziali effetti antitumorali inibendo la crescita del cancro attraverso l’arresto del ciclo cellulare e l’inizio dell’apoptosi.
La terapia di induzione con agenti che riducono le cellule T (compresi agenti policlonali, come la globulina anti-timociti, e agenti monoclonali, come anti-CD52 e Ortho Kung T3 [muromonab-CD3]) aumenta il rischio di tumori, come PTLD e melanoma (19).
Tumori comuni dopo trapianto
Alcuni tipi di neoplasia come carcinoma a cellule renali, tumori cutanei e PTLD, hanno un rischio di sviluppo più elevato dopo trapianto rispetto ad altri.
Carcinoma a cellule renali
Il rischio di sviluppare un carcinoma a cellule renali nei pazienti trapiantati di rene è fino a sette volte maggiore che nella popolazione generale (20,21). Nel 90% dei casi coinvolge i reni nativi e per il 75-80% dei casi si tratta di carcinomi a cellule renali e con un rischio di metastasi < 2% grazie allo stretto follow-up a cui sono sottoposti questi pazienti (22-24).
I fattori di rischio per lo sviluppo di carcinomi a cellule renali post-trapianto comprendono:
– sesso maschile (hazard ratio [HR] nelle donne, 0,56; IC al 95%, da 0,47 a 0,66);
– età (oltre 60 anni; HR, 6,59; IC al 95%, da 4,29 a 10,15);
– razza africana (HR, 1,50; IC al 95%, da 1,24 a 1,80);
– durata della dialisi (3+ anni; HR, 2,23; IC al 95%, da 1,58 a 3,13) (25).
Per quanto riguarda la causa di ESRD (End Stage Renal Disease), malattie glomerulari (HR, 1,24; IC al 95%, da 1,05 a 1,47), nefrosclerosi ipertensiva (HR, 1,55; IC al 95%, da 1,29 a 1,86) e malattia vascolare (HR, 1,53; IC al 95%, da 1,15 a 2,03) sembrano avere il rischio associato maggiore; al contrario, i pazienti con insufficienza renale secondaria al diabete (HR, 0,77; IC al 95%, da 0,62 a 0,94) o malattia renale policistica autosomica dominante (HR, 0,81; IC al 95%, da 0,62 a 1,06) hanno un rischio inferiore di carcinomi a cellule renali.
I carcinomi a cellule renali de novo dovrebbero essere gestiti secondo le Linee Guida urologiche sulla base della stratificazione del rischio e della stadiazione (26,27), in combinazione con i fattori di rischio del paziente (età, comorbilità, stato funzionale) e con le caratteristiche della massa renale (dimensioni, esame istologico del campione bioptico, cinetica di crescita).
L’outcome dei carcinomi a cellule renali dopo il trattamento radicale nella popolazione trapiantata è paragonabile a quello della popolazione generale, con tassi di sopravvivenza a 5 anni, specifici per la malattia e globali, rispettivamente del 68-97% e del 69-88% (28,29). I fattori prognostici negativi includono la presenza di sintomi alla diagnosi, un grado Fuhrman più elevato (> 2), l’assenza di trapianto e la malattia a uno stadio avanzato (28,29). La durata complessiva e l’intensità dell’immunosoppressione, piuttosto che i singoli componenti del regime farmacologico, influenzano il rischio di carcinoma a cellule renali.
La gestione di queste neoplasie dovrebbe essere individualizzata e basata sull’utilizzo di un approccio centrato sul paziente per garantire una cura ottimale (30).
Tumori della pelle
Il cancro della pelle è il tipo di cancro più comune nei riceventi di trapianti di rene con un andamento più aggressivo che nella popolazione generale.
In questi pazienti i tumori della pelle più comunemente riportati comprendono il carcinoma cutaneo a cellule squamose (SCC), il carcinoma basocellulare (BCC), il sarcoma di Kaposi e il melanoma maligno, con i carcinomi cheratinocitari che rappresentano il 90-95% (31,32).
Alla base della patogenesi del carcinoma cutaneo vi è la complessa interazione di fattori di rischio, tra cui l’esposizione alle radiazioni UV, l’HPV, il cancro della pelle pre-trapianto, l’età avanzata, la razza e il sesso (i maschi sono a maggior rischio rispetto alle femmine). Inoltre, i farmaci immunosoppressori aumentano gli effetti cancerogeni (principalmente ciclosporina e azatioprina) (33,34). Il sarcoma di Kaposi è più comunemente riscontrato in alcuni gruppi etnici, compresi i pazienti provenienti dal Mediterraneo, dall’Africa e dall’Europa centrale. Sebbene il sarcoma di Kaposi sia un tumore raro, la sua incidenza nei riceventi di trapianto supera 100 volte quella della popolazione generale.
Rispetto alla popolazione generale, i riceventi di trapianto presentano un rischio di carcinoma a cellule squamose di circa 250 volte superiore (31). Nei pazienti con cheratosi attinica e carcinoma a cellule squamose in situ, le terapie topiche o di escissione chirurgica con dimostrazione istologica di margini negativi offrono tassi di guarigione del 95-100% (31). Nei casi inoperabili, la radioterapia primaria può determinare una guarigione locale. I pazienti che sviluppano più di cinque SCC/anno e quelli che hanno SCC aggressivi o a esordio precoce possono essere presi in considerazione per la chemioprofilassi con retinoidi (35) e nicotinamide (36). Nei pazienti con carcinoma cutaneo a cellule squamose metastatico, si raccomandano la chemioterapia sistemica e/o l’immunoterapia (31).
Il trattamento con inibitori della calcineurina espone a un rischio elevato di sviluppo di sarcoma di Kaposi. In questo caso il trattamento principale è rappresentato dalla riduzione dell’immunosoppressione o dal passaggio a mTOR inibitori che portano a un ripristino dell’attività immunitaria delle cellule T effettrici e della memoria contro l’HHV 8 (37).
Per quanto riguarda il melanoma maligno, il rischio di svilupparlo arriva fino a circa cinque-otto volte nei riceventi di trapianto con esiti molto peggiori rispetto alla popolazione generale (31) e i fattori di rischio sono: anamnesi positiva per melanoma pre-trapianto, razza bianca ed età avanzata (> 50 anni). Il trattamento primario è chirurgico con ampia escissione e margini adeguati, sulla base dello spessore di Breslow, come previsto dalle Linee Guida del National Comprehensive Cancer Network (31). La regolazione dell’immunosoppressione è adattata a ciascun paziente sulla base dell’entità del melanoma e della funzione del trapianto.
Malattia linfoproliferativa post-trapianto (PTLD)
La PTLD è una complicanza ben nota dopo il trapianto di rene, sebbene sia una malattia rara. In circa il 90% dei casi la PTLD è associata all’Epstein-Barr virus (EBV), la cui infezione viene comunemente contratta durante l’infanzia procurando nella maggior parte dei casi sintomi lievi o minimi. Il virus, però, può infettare le cellule B e rimanere dormiente durante la fase di latenza e riattivarsi dopo il trapianto, a causa della depressione funzionale delle cellule T e del mancato controllo sulla proliferazione delle cellule B. La maggior parte delle PTLD è di tipo a cellule B, con circa il 5% dei pazienti che hanno il tipo a cellule T.
L’incidenza cumulativa della PTLD nei primi 10 anni dopo il trapianto di rene è di circa l’1-2% nei riceventi adulti e di circa il 3% nei riceventi pediatrici di trapianto (38). Il rischio di PTLD sembra essere più alto nei primi 12 mesi post-trapianto, per poi diminuire fino al quinto anno dopo il trapianto. La sieronegatività da EBV pre-trapianto e l’infezione primaria da EBV sono importanti fattori di rischio per la PTLD precoce EBV-positiva, in particolare nei riceventi più giovani, e possono spiegare il rischio più elevato di malattia subito dopo il trapianto. Al contrario, una percentuale significativa (circa il 40-50%) di PTLD tardive a cellule B è EBV-negativa (39).
Oltre alla sierologia per EBV-negativa del ricevente (con donatore positivo) e all’età più giovane, altri fattori di rischio di sviluppo di PTLD sono il sesso maschile, l’uso di agenti che depletano le cellule T, Ortho Kung T3 (muromonab-CD3) e tacrolimus ad alte dosi (38). È stato inoltre riscontrato che l’uso del blocco costimolatorio, come belatacept, è associato a un rischio più elevato di PTLD, in particolare di PTLD cerebrale in pazienti che sono EBV-negativi e quando utilizzato a dosi più elevate (40).
Il cardine del trattamento della PTLD è la riduzione dell’immunosoppressione con una risposta che, tuttavia, varia considerevolmente da individuo a individuo. In alcuni lavori è riportato che l’uso di rituximab e chemioterapia (doxorubicina, ciclofosfamide, vincristina, prednisone) ha migliorato la sopravvivenza globale, con una sopravvivenza a 5 anni pari a circa il 60% (41). Inoltre, il rituximab è generalmente ben tollerato con effetti collaterali minimi (41).
Screening del cancro nei riceventi di trapianto
Nonostante la mancanza di evidenze sperimentali a supporto nei pazienti con malattia renale (considerati comunque ad alto rischio), lo screening di routine per il cancro al seno, al colon-retto e al collo dell’utero è raccomandato e dovrebbe essere allineato alle Linee Guida della popolazione generale (42) (Tab. 1). Alcune Linee Guida suggeriscono anche controlli cutanei di routine da parte di dermatologi nei riceventi di trapianto ad alto rischio; ecografie addominali e livelli sierici di α -fetoproteina dovrebbero essere controllati ogni 6 mesi per quelli con malattia epatica sottostante e infezioni croniche da HBV. Per i pazienti che sono a rischio di sviluppare carcinoma a cellule renali (come quelli con una storia di malattia cistica acquisita, quelli con una storia familiare, i forti fumatori e quelli che usano analgesici a lungo termine), uno screening ecografico (annuale oppure ogni due anni) dei reni nativi può essere preso in considerazione per individuare tumori maligni occulti (43).
Vaccinazione contro il papillomavirus umano (HPV) nei destinatari di trapianto renale
L’incidenza del cancro anogenitale correlato all’HPV è almeno 10-15 volte più elevata nei riceventi di trapianto di rene che nella popolazione generale di pari età e sesso. I vaccini quadrivalenti (contro i genotipi 6, 11, 16 e 18) e, più recentemente, i vaccini HPV 9-valenti (contro cinque ulteriori genotipi 31, 33, 45, 52 e 58) in studi clinici randomizzati sono risultati avere un’efficacia complessiva del 99-100% per la prevenzione della neoplasia intraepiteliale cervicale. La vaccinazione HPV è indicata sia nei maschi che nelle femmine di età compresa tra i 9 e i 25 anni nella popolazione generale per la prevenzione delle neoplasie maligne correlate all’HPV. Alcuni dati recenti hanno dimostrato che è efficace anche nelle donne fino ai 45 anni. Nella popolazione trapiantata, i vaccini HPV sono generalmente sicuri. Tuttavia, la sieropositività è stata rilevata solo in circa il 50-60% dei pazienti, a seconda dei genotipi (44). Sebbene la vaccinazione HPV sia raccomandata per le donne dopo il trapianto, potrebbe essere più efficace vaccinare prima del trapianto.
| Cancri | Raccomandazioni | Prova |
|---|---|---|
| Seno | Per le donne di età compresa tra i 50 e i 74 anni, screening mammografico una volta ogni 2 anni. Per le donne < 50 anni, la decisione di avviare uno screening regolare dovrebbe essere individuale. | Estrapolazione dalla popolazione generale. |
| Prostata | Per gli uomini di età compresa tra i 55 e i 69 anni, le decisioni di screening dovrebbero essere individualizzate dopo una conversazione con il proprio medico sui potenziali benefici e rischi. Per gli uomini di età ≥70 anni, i potenziali benefici potrebbero non superare i danni attesi e questi uomini non dovrebbero essere sottoposti a screening di routine per il cancro alla prostata. | Estrapolazione dalla popolazione generale. |
| Cervicale | Pap test annuale o test HPV ogni 3-5 anni a partire dall’età di 25 anni fino ai 74 anni. | In considerazione del rischio più elevato di malattia, alcuni suggeriscono Pap test più frequenti. Tuttavia, nessuna prova suggerisce un aumento della frequenza dei test HPV. |
| Intestino | Per gli adulti di età compresa tra i 45 e i 75 anni, test immunochimici fecali ogni due anni, sigmoidoscopia ogni 5 anni o colonscopia ogni 5-10 anni. | Lo screening mediante test immunochimici fecali è accurato nei riceventi di trapianti di rene. Tuttavia, può essere associato a un rischio più elevato di complicanze associate alle colonscopie diagnostiche |
| Polmone | Per gli adulti di età compresa tra i 55 e i 79 anni, scansioni annuali di tomografia computerizzata a basso dosaggio per coloro che hanno fumato un pacchetto al giorno per 30 anni o equivalente (due pacchetti al giorno per 15 anni). | Estrapolazione dalla popolazione generale. |
| Pelle | Autoesame mensile della pelle ed esame completo della pelle del corpo ogni 6-12 mesi da parte di medici e dermatologi esperti. | Opinioni di esperti. |
| Cellula renale | Lo screening di routine per il carcinoma a cellule renali mediante ecografia non è raccomandato per tutti i riceventi di trapianti, a eccezione dei soggetti ad alto rischio. | Lo screening basato sulla popolazione che utilizza gli ultrasuoni per tutti i riceventi di trapianti di rene non è economicamente vantaggioso. |
| Fegato | Screening di routine mediante ecografia, con e senza α -fetoproteina, ogni 6 mesi in pazienti con cirrosi. | Estrapolazione dalla popolazione generale. |
| PTLD | Monitoraggio di routine dei pazienti ad alto rischio (donatore EBV sieropositivo/ricevente sieronegativo) per EBV mediante DNA PCR. Una volta nella prima settimana dopo il trapianto, mensilmente per i primi 3-6 mesi ed ogni 3 mesi fino alla fine del primo anno post-trapianto. | Opinioni di esperti. |
Pap: Papanicolaou; HPV: papillomavirus umano; US: ecografia; PTLD: malattia linfoproliferativa post-trapianto; EBV: Epstein-Barr virus; NAT: tecniche di amplificazione degli acidi nucleici.
Gestione e trattamento dell’immunosoppressione nei riceventi di trapianto affetti da neoplasia
La gestione dell’immunosoppressione nei riceventi di trapianto neoplastici è complessa e impegnativa. È quindi necessario un approccio congiunto tra professionisti dei trapianti, oncologi e operatori sanitari dedicati ai fini di garantire cure ottimali ai nostri pazienti. È necessaria una comprensione meticolosa del rischio immunologico sottostante e della gravità del tumore per ottimizzare la dose di immunosoppressione e prevenire il rischio di rigetto acuto, bilanciando al contempo la necessità di indurre la regressione della lesione maligna e di prevenirne la progressione futura. In assenza di evidenze di qualità, una riduzione giudiziosa del carico immunosoppressivo complessivo per i pazienti con neoplasie maligne a uno stadio da precoce a moderato può essere un primo passo ragionevole e questo dovrebbe essere condotto in accordo con i pazienti, informandoli sui potenziali effetti avversi. Per i pazienti con carcinoma a cellule squamose, esistono ora prove basate su studi che suggeriscono che la conversione a un inibitore di mTOR può ridurre il rischio di cancro a lungo termine (45,46). Tuttavia, l’uso di inibitori di mTOR può anche essere associato a un rischio più elevato di morte (47,48). Pertanto, non ci sono dati sufficienti per considerare gli inibitori di mTOR come protettivi contro altri tipi di cancro oltre al carcinoma a cellule squamose e al sarcoma di Kaposi (49).
Immunoterapia
L’uso di inibitori del checkpoint immunitario (ICI), vale a dire anticorpi monoclonali che hanno come bersaglio l’antigene 4 associato ai linfociti T citotossici (CTLA-4) o la proteina 1 della morte cellulare programmata o il suo ligando (PD-1/PD-L1), ha rivoluzionato il trattamento di una varietà di tumori maligni attraverso attivazione del sistema immunitario contro il cancro (50,51), e questo soprattutto in caso di melanoma, di carcinoma polmonare non a piccole cellule e di carcinoma a cellule renali. Tuttavia, il loro uso è limitato nei riceventi di trapianto dato il rischio di rigetto (52,53) e richiede ulteriori indagini.
Mettere le prospettive dei pazienti al centro della gestione della neoplasia
I pazienti affetti da neoplasia e sottoposti a trapianto possono manifestare molteplici sintomi a causa delle molteplici morbilità. È, dunque, necessario un approccio multidisciplinare e personalizzato, piuttosto che un approccio unico per tutti.
Conclusioni
Il tumore è la principale causa di morbilità e mortalità nei pazienti sottoposti a trapianto di rene. Avere un tumore è un evento devastante per i pazienti e le loro famiglie. La gestione dell’immunosoppressione diventa complessa e impegnativa per la necessità da una parte di combattere la neoplasia e di ridurne il rischio di recidiva e, dall’altra, di mantenere basso il rischio di perdita dell’allotrapianto a causa di un rigetto. Attualmente, non ci sono delle linee di indirizzo standard di riduzione della quantità di immunosoppressione in sicurezza.
È necessario aderire quanto più possibile ai programmi di prevenzione primaria e di screening nei riceventi di trapianto anche se non sempre i risultati potrebbero corrispondere a quelli della popolazione generale.
Sono necessari sforzi di collaborazione tra professionisti sanitari, ricercatori e pazienti per individuare linee di indirizzo per supportare l’assistenza a lungo termine dei nostri pazienti.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Laupacis A, Keown P, Pus N, et al. A study of the quality of life and cost-utility of renal transplantation. Kidney Int. 1996;50(1):235-242. CrossRef PubMed
- 2. Wolfe RA, Ashby VB, Milford EL, et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 1999;341(23):1725-1730. CrossRef PubMed
- 3. Wong G, Howard K, Chapman JR, et al. Comparative survival and economic benefits of deceased donor kidney transplantation and dialysis in people with varying ages and co-morbidities. PLoS One. 2012;7(1):e29591. PMCID: PMC3261160. CrossRef PubMed
- 4. Tong A, Budde K, Gill J, et al. Standardized outcomes in nephrology-transplantation: A global initiative to develop a core outcome set for trials in kidney transplantation. Transplant Direct. 2016;2(6):e79. PMCID: PMC4946524. CrossRef PubMed
- 5. Krynitz B, Edgren G, Lindelöf B, et al. Risk of skin cancer and other malignancies in kidney, liver, heart and lung transplant recipients 1970 to 2008--a Swedish population-based study. Int J Cancer. 2013;132(6):1429-1438. CrossRef PubMed
- 6. Webster AC, Craig JC, Simpson JM, Jones MP, Chapman JR. Identifying high risk groups and quantifying absolute risk of cancer after kidney transplantation: a cohort study of 15,183 recipients. Am J Transplant. 2007;7(9):2140-2151. CrossRef PubMed
- 7. Webster AC, Wong G, Craig JC, Chapman JR. Managing cancer risk and decision making after kidney transplantation. Am J Transplant. 2008;8(11):2185-2191. CrossRef PubMed
- 8. Au EH, Chapman JR, Craig JC, et al. Overall and site-specific cancer mortality in patients on dialysis and after kidney transplant. J Am Soc Nephrol. 2019;30(3):471-480. PMCID: PMC6405152. CrossRef PubMed
- 9. Lim WH, Turner RM, Chapman JR, et al. Acute rejection, T-cell-depleting antibodies, and cancer after transplantation. Transplantation. 2014;97(8):817-825. CrossRef PubMed
- 10. Lim WH, Chapman JR, Wong G. Peak panel reactive antibody, cancer, graft, and patient outcomes in kidney transplant recipients. Transplantation. 2015;99(5):1043-1050. CrossRef PubMed
- 11. Wong G, Turner RM, Chapman JR, et al. Time on dialysis and cancer risk after kidney transplantation. Transplantation. 2013;95(1):114-121. PubMed: 23222892. CrossRef PubMed
- 12. Penn I. Evaluation of the candidate with a previous malignancy. Liver Transpl Surg. 1996;2(5)(suppl 1):109-113. PubMed
- 13. Acuna SA, Sutradhar R, Kim SJ, Baxter NN. Solid organ transplantation in patients with preexisting malignancies in remission: A propensity score matched cohort study. Transplantation. 2018;102(7):1156-1164. PMCID: PMC7228636. CrossRef PubMed
- 14. Lai MN, Wang SM, Chen PC, Chen YY, Wang JD. Population-based case-control study of Chinese herbal products containing aristolochic acid and urinary tract cancer risk. J Natl Cancer Inst. 2010;102(3):179-186. PMCID: PMC2815723. CrossRef PubMed
- 15. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet. 2007;370(9581):59-67. CrossRef PubMed
- 16. Kuschal C, Thoms KM, Boeckmann L, et al. Cyclosporin A inhibits nucleotide excision repair via downregulation of the xeroderma pigmentosum group A and G proteins, which is mediated by calcineurin inhibition. Exp Dermatol. 2011;20(10):795-799. CrossRef PubMed
- 17. Gallagher MP, Kelly PJ, Jardine M, et al. Long-term cancer risk of immunosuppressive regimens after kidney transplantation. J Am Soc Nephrol. 2010;21(5):852-858. PMCID: PMC2865745. CrossRef PubMed
- 18. McGurgan IJ, McGuigan C. Nonmelanoma skin cancer risk awareness in azathioprine-treated myasthenia gravis patients. Brain Behav. 2015;5(10):e00396. PMCID: PMC4614050. CrossRef PubMed
- 19. Cherikh WS, Kauffman HM, McBride MA, Maghirang J, Swinnen LJ, Hanto DW. Association of the type of induction immunosuppression with posttransplant lymphoproliferative disorder, graft survival, and patient survival after primary kidney transplantation. Transplantation. 2003;76(9):1289-1293. CrossRef PubMed
- 20. Kasiske BL, Ramos EL, Gaston RS, et al; Patient Care and Education Committee of the American Society of Transplant Physicians. The evaluation of renal transplant candidates: clinical practice guidelines. J Am Soc Nephrol. 1995;6(1):1-34. CrossRef PubMed
- 21. Einollahi B, Simforoosh N, Lessan-Pezeshki M, et al. Genitourinary tumor following kidney transplantation: a multicenter study. Transplant Proc. 2009;41(7):2848-2849. CrossRef PubMed
- 22. Miao Y, Everly JJ, Gross TG, et al. De novo cancers arising in organ transplant recipients are associated with adverse outcomes compared with the general population. Transplantation. 2009;87(9):1347-1359. CrossRef PubMed
- 23. Finelli A, Ismaila N, Bro B, et al. Management of small renal masses: american Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2017;35(6):668-680. CrossRef PubMed
- 24. Umbreit EC, Shimko MS, Childs MA, et al. Metastatic potential of a renal mass according to original tumour size at presentation. BJU Int. 2012;109(2):190-194. CrossRef PubMed
- 25. Karami S, Yanik EL, Moore LE, et al. Risk of renal cell carcinoma among kidney transplant recipients in the United States. Am J Transplant. 2016;16(12):3479-3489. PMCID: PMC5104677. CrossRef PubMed
- 26. Campbell S, Uzzo RG, Allaf ME, et al. Renal mass and localized renal cancer: AUA guideline. J Urol. 2017;198(3):520-529. CrossRef PubMed
- 27. Ljungberg B, Albiges L, Abu-Ghanem Y, et al. European Association of Urology guidelines on renal cell carcinoma: The 2019 update. Eur Urol. 2019;75(5):799-810. CrossRef PubMed
- 28. Frascà GM, Brigante F, Volpe A, Cosmai L, Gallieni M, Porta C. Kidney transplantation in patients with previous renal cancer: a critical appraisal of current evidence and guidelines. J Nephrol. 2019;32(1):57-64. CrossRef PubMed
- 29. Tillou X, Guleryuz K, Doerfler A, et al; members of the Renal Transplantation Committee of the French Urological Association (CTAFU). Nephron sparing surgery for De Novo kidney graft tumor: results from a multicenter national study. Am J Transplant. 2014;14(9):2120-2125. CrossRef PubMed
- 30. Yanik EL, Siddiqui K, Engels EA. Sirolimus effects on cancer incidence after kidney transplantation: a meta-analysis. Cancer Med. 2015;4(9):1448-1459. PMCID: PMC4567030. CrossRef PubMed
- 31. Mittal A, Colegio OR. Skin cancers in organ transplant recipients. Am J Transplant. 2017;17(10):2509-2530. CrossRef PubMed
- 32. Greenberg JN, Zwald FO. Management of skin cancer in solid-organ transplant recipients: A multidisciplinary approach. Dermatol Clin 29: 231–241, ix, 2011 CrossRef PubMed
- 33. Walsh SB, Xu J, Xu H, et al. Cyclosporine a mediates pathogenesis of aggressive cutaneous squamous cell carcinoma by augmenting epithelial-mesenchymal transition: role of TGFβ signaling pathway. Mol Carcinog. 2011;50(7):516-527. PMCID: PMC3110643. CrossRef PubMed
- 34. Brem R, Li F, Karran P. Reactive oxygen species generated by thiopurine/UVA cause irreparable transcription-blocking DNA lesions. Nucleic Acids Res. 2009;37(6):1951-1961. PMCID: PMC2665240. CrossRef PubMed
- 35. Chen K, Craig JC, Shumack S: Oral retinoids for the prevention of skin cancers in solid organ transplant recipients: A systematic review of randomized controlled trials. Br J Dermatol 152: 518–523, 2005. CrossRef PubMed
- 36. Chen AC, Martin AJ, Dalziell RA, et al. A phase II randomized controlled trial of nicotinamide for skin cancer chemoprevention in renal transplant recipients. Br J Dermatol. 2016;175(5):1073-1075. CrossRef PubMed
- 37. Sunil M, Reid E, Lechowicz MJ. Update on HHV-8-associated malignancies. Curr Infect Dis Rep. 2010;12(2):147-154. PMCID: PMC2860558. CrossRef PubMed
- 38. Francis A, Johnson DW, Teixeira-Pinto A, Craig JC, Wong G. Incidence and predictors of post-transplant lymphoproliferative disease after kidney transplantation during adulthood and childhood: a registry study. Nephrol Dial Transplant. 2018;33(5):881-889. CrossRef PubMed
- 39. Luskin MR, Heil DS, Tan KS, et al. The impact of EBV status on characteristics and outcomes of posttransplantation lymphoproliferative disorder. Am J Transplant. 2015;15(10):2665-2673. PMCID: PMC5726526. CrossRef PubMed
- 40. Larsen CP, Grinyó J, Medina-Pestana J, et al. Belatacept-based regimens versus a cyclosporine A-based regimen in kidney transplant recipients: 2-year results from the BENEFIT and BENEFIT-EXT studies. Transplantation. 2010;90(12):1528-1535. CrossRef PubMed
- 41. Elstrom RL, Andreadis C, Aqui NA, et al. Treatment of PTLD with rituximab or chemotherapy. Am J Transplant. 2006;6(3):569-576. CrossRef PubMed
- 42. Wong G, Chapman JR, Craig JC. Cancer screening in renal transplant recipients: what is the evidence? Clin J Am Soc Nephrol. 2008;3(Suppl 2)(suppl 2):S87-S100. PMCID: PMC3152279. CrossRef PubMed
- 43. Wong G, Howard K, Webster AC, Chapman JR, Craig JC. Screening for renal cancer in recipients of kidney transplants. Nephrol Dial Transplant. 2011;26(5):1729-1739. CrossRef PubMed
- 44. Kumar D, Unger ER, Panicker G, Medvedev P, Wilson L, Humar A. Immunogenicity of quadrivalent human papillomavirus vaccine in organ transplant recipients. Am J Transplant. 2013;13(9):2411-2417. PMCID: PMC4583130. CrossRef PubMed
- 45. Lim WH, Russ GR, Wong G, Pilmore H, Kanellis J, Chadban SJ. The risk of cancer in kidney transplant recipients may be reduced in those maintained on everolimus and reduced cyclosporine. Kidney Int. 2017;91(4):954-963. CrossRef PubMed
- 46. Ying T, Wong G, Lim WH, et al. Everolimus and long-term clinical outcomes in kidney transplant recipients: A registry-based 10-year follow-up of 5 randomized trials. Transplantation. 2019;103(8):1705-1713. CrossRef PubMed
- 47. Badve SV, Pascoe EM, Burke M, et al. Mammalian target of rapamycin inhibitors and clinical outcomes in adult kidney transplant recipients. Clin J Am Soc Nephrol. 2016;11(10):1845-1855. PMCID: PMC5053777. CrossRef PubMed
- 48. Knoll GA, Kokolo MB, Mallick R, et al. Effect of sirolimus on malignancy and survival after kidney transplantation: systematic review and meta-analysis of individual patient data. BMJ. 2014;349(nov24 1):g6679. PMCID: PMC4241732. CrossRef PubMed
- 49. de Fijter JW. Cancer and mTOR inhibitors in transplant recipients. Transplantation. 2017;101(1):45-55. CrossRef PubMed
- 50. Bhatia S, Tykodi SS, Lee SM, Thompson JA. Systemic therapy of metastatic melanoma: on the road to cure. Oncology (Williston Park). 2015;29(2):126-135. PubMed
- 51. Motzer RJ, Escudier B, McDermott DF, et al; CheckMate 025 Investigators. CheckMate 025 Investigators : nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med. 2015;373(19):1803-1813. PMCID: PMC5719487. CrossRef PubMed
- 52. Abdel-Wahab N, Safa H, Abudayyeh A, et al. Checkpoint inhibitor therapy for cancer in solid organ transplantation recipients: an institutional experience and a systematic review of the literature. J Immunother Cancer. 2019;7(1):106. PMCID: PMC6469201. CrossRef PubMed
- 53. d’Izarny-Gargas T, Durrbach A, Zaidan M. Efficacy and tolerance of immune checkpoint inhibitors in transplant patients with cancer: A systematic review. Am J Transplant. 2020;20(9):2457-2465. CrossRef PubMed