 |
G Clin Nefrol Dial 2024; 36: 49-58 ISSN 2705-0076 | DOI: 10.33393/gcnd.2024.3077 CONGRESS PROCEEDINGS |
 |
Selected proceedings
Percorsi diagnostico-terapeutici condivisi nel territorio sardo in nefrologia e dialisi
Oristano, 29-30 Novembre-1 Dicembre 2023
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
NOVITÀ TECNOLOGICHE DEI MONITOR PER EMODIALISI
Francesco Carta1, Anna Mudoni2, Francesco Logias3
1ASSL Ospedale S Francesco U.O. di Nefrologia e Dialisi Nuoro, Nuoro - Italia
2U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
3ASL Ogliastra, Lanusei (OG) - Italia
Descriviamo le principali funzioni di alcuni monitor utilizzati nell’Unità Operativa di Nefrologia e Dialisi dell’Ospedale San Francesco di Nuoro con un approccio tecnico-scientifico e pratico.
È utile fare un cenno di storia. Il termine “dialisi” è stato introdotto nel 1854 dal chimico Thomas Graham per descrivere il fenomeno del movimento di vari soluti attraverso una membrana semipermeabile grazie alla pressione osmotica.
Nel 1924 questo processo artificiale di rimozione di scorie e liquidi in eccesso fu utilizzato sull’uomo, ma solo negli anni ‘40 del secolo scorso sono state registrate importanti innovazioni con risvolti sul miglioramento dell’aspettativa di vita dei pazienti emodializzati.
Infatti, il vivace confronto tra scienza medica e tecnologia si è evoluto nel tempo e ha conosciuto importanti momenti di crescita nel tentativo di migliorare le soluzioni terapeutiche in risposta alle principali problematiche che insorgono durante un trattamento dialitico.
In primo luogo, l’operatore sanitario che prescrive ed esegue un trattamento emodialitico deve avere come obiettivo tre parole chiave: depurare, equilibrare e correggere.
Inoltre è opportuno focalizzare le complicanze più frequenti durante la seduta emodialitica, prima fra tutte l’instabilità cardiovascolare, con sintomi più o meno transitori, tenendo conto di tutti i fattori che ostacolano la rimozione dei fluidi con conseguente stato di “sotto-dialisi”.
Le nuove apparecchiature offrono una risposta alle macrotematiche evidenziate attraverso molteplici funzionalità e applicazioni al fine di ridurre le complicanze cliniche.
L’applicazione Diascan del monitor Artis rileva la conduttività plasmatica durante il trattamento, con la possibilità di modificare la prescrizione di sodio. Tale funzione, connessa con Hemoscan, permette di calcolare la variazione di volume ematico e fornisce la percentuale del volume ematico in base al tempo. Il sistema HemoControl utilizza il biofeedback per modulare in tempo reale l’ultrafiltrazione in funzione delle variazioni del volume ematico riducendo l’incidenza delle ipotensioni intradialitiche. L’integrazione di sensori specifici nella macchina per emodialisi, volti alla misurazione continua e non invasiva, ha reso possibile un sostanziale miglioramento nella personalizzazione e nell’efficacia della terapia dialitica. La metodica AFB/AFBK, tecnica volta al benessere del paziente, totalmente priva di acetato, caratterizza il monitor ARTIS. È una metodica che consente la correzione dell’equilibrio acido-base nella maniera più precisa possibile e garantisce una depurazione dialitica mista convettivo-diffusiva, con eliminazione di sostanze sia a basso che a medio-alto peso molecolare.
Il monitor 6008 di Fresenius presenta importanti novità: l’introduzione di un sistema di linee a cassetta, che permette di passare con un semplice tasto funzione dalla metodica standard alla HDF pre- o post-diluizione, nonché da un doppio ago a un ago singolo. Inoltre presenta una riduzione dei punti di contatto critici per l’igiene, la riduzione delle procedure manuali, la reinfusione online a circuito chiuso e lo svuotamento automatico del sistema ematico. Un’altra caratteristica utile è quella di verificare il volume del sangue del paziente e di selezionare la variazione oraria di temperatura corporea desiderata attraverso l’attivazione della funzione “controllo temperatura”. La temperatura del dialisato viene adattata automaticamente dal BTM. In particolare, in base alla risposta termica del paziente misurata sulla linea arteriosa, il BTM modifica in modo continuo e automatico la temperatura del dialisato.
Il monitor B-BRAUN utilizza un sistema di monitoraggio denominato Dialog iQ che, attraverso due biosensori, è in grado di fornire maggiori informazioni sullo stato emodinamico del paziente.
Il biofeedback automatico Fusion, attraverso la misurazione della variazione del volume ematico relativo e l’andamento della pressione sistolica, è in grado di agire sul calo del peso del paziente, evidenziando l’indice percentuale di rischio ipotensivo in tempo reale.
Un altro monitor in dotazione alla nostra Unità Operativa è della ditta BELLCO, dotato del sensore della saturazione sulla linea di aspirazione del sangue del paziente, proprio per l’importanza che tale dato ha durante un trattamento dialitico.
In secondo luogo, il calcolo del rischio ipotensivo è reso possibile anche con Adimea, spettrofotometro di massa per la misurazione della rimozione di urea. In particolare, lo spettrofotometro di massa a ultravioletti garantisce in tempo reale e senza soluzione di continuità la misura diretta nel liquido di dialisi della rimozione di urea.
Un ulteriore monitor utilizzato è il NIPRO con specificità proprie che lo distinguono. Presenta la funzione CTS-Clean Treatment Start, che consente di scaricare la soluzione di priming in modo pulito senza somministrarla al paziente all’avvio della seduta.
La nuova tecnologia dialitica sembra ottenere migliori efficienza e sicurezza del trattamento, percepite pienamente dai pazienti. Da un lato il lavoro infermieristico è facilitato e dall’altro richiede conoscenze ed esperienza più approfondite.
SPECIFICITÀ DELLE MEMBRANE PER EMODIALISI
Anna Mudoni1, Annalisa Noce2, Giulia Marrone2, Carlo Mura3, Massimo Belluardo4, Salvatore Mancuso5, Francesco Logias6
1U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
2UOSD Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata - Italia
3UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
4UOC Nefrologia, Dialisi e Trapianti, AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
5Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
6ASL Ogliastra, Lanusei (OG) - Italia
La membrana per emodialisi interagisce con il sangue e il liquido per dialisi; al suo interno si svolgono fenomeni biofisici in grado di rimuovere l’acqua in eccesso e le tossine uremiche del paziente con insufficienza renale.
La scelta della membrana deve tenere conto delle caratteristiche tecniche e dei materiali che ne determinano la performance nonché delle esigenze dialitiche del paziente da trattare.
La Tabella 1 raggruppa proprietà, definizioni e termini in relazione alla funzione della membrana.
In relazione alla composizione distinguiamo membrane di origine naturale come la cellulosa o il cuprofan (ormai in disuso da anni), membrane semisintetiche come i triacetati, simmetrico (CTA) e asimmetrico (ATA), e membrane sintetiche (non cellulosiche) come polisulfone/famiglia di polisulfoni (PS), polieteresulfone (PES), polimetilmetacrilato (PMMA), polietilene polivinilalcol (EVAL), poliestere polimero alloy (PEPA), poliacrilonitrile (PAN), policarbonato (PC), poliamide (PA) e poliamideetersulfone (PAES).
Oggi si tende verso una classificazione delle membrane con un approccio multidimensionale: composizione e struttura (cellulosica/non cellulosica, permeabilità all’acqua, spessore della parete, distribuzione e dimensioni dei pori), modifica della superficie (idrofila/idrofoba, rugosità, carica elettrica, additivi) e performance (permeabilità, selettività, ritenzione, filtrazione interna).
Le tossine verso le quali c’è maggiore interesse sono le molecole con PM > 20-25 KDa e le tossine legate alle proteine. La tossicità uremica agisce negativamente sui vari apparati e sulle vie metaboliche. Danno cardiovascolare, aumentata suscettibilità alle infezioni e manifestazioni nutrizionali, neurologiche ed ematologiche peggiorano la qualità di vita e determinano un’elevata mortalità nel paziente in dialisi. La funzionalità renale residua può contribuire in modo significativo alla rimozione dei soluti per i quali il legame proteico limita la clearance mediante emodialisi. La rimozione efficiente di alcune molecole medio-grandi può essere associata alla riduzione della sintomatologia e al miglioramento della qualità di vita con aumento della sopravvivenza dei pazienti.
L’interazione tra sangue e membrana durante il trattamento dialitico innesca l’attivazione del complemento, delle chinine, della coagulazione e della fibrinolisi. L’intensità di questi fenomeni di attivazione, sia plasmatica che cellulare, può essere considerata un indice di biocompatibilità membrana-dipendente. L’attivazione del complemento determina conseguenze a breve termine, reazioni allergiche, infiammazione e coagulazione, e conseguenze a lungo termine, malnutrizione, infezione ed eventi cardiovascolari avversi.
Le membrane definite a medium cut-off (MCO) offrono una permeabilità significativamente più alta delle membrane ad alto flusso (HF), sono in grado di rimuovere le tossine uremiche medio-alte (β2-microglobulina, leptina, catene leggere libere k e λ, mioglobina e altre tossine associate a infiammazione e a eventi cardiovascolari) e permettono di ampliare la depurazione anche in emodialisi massimizzando il fenomeno della retrofiltrazione. La rimozione efficiente di alcune molecole medio-grandi può essere associata alla riduzione della sintomatologia e al miglioramento della qualità di vita con un aumento della sopravvivenza dei pazienti. Il recente sviluppo di membrane a medio cut-off e HD expanded (trattamento in cui la diffusione e la convezione sono convenientemente combinate nel dializzatore a fibra cava con membrana MCO) rappresenta un passo avanti negli approcci personalizzati in emodialisi. La terapia HDx è resa possibile grazie alla combinazione di 4 principi in un unico dializzatore (maggiore permeabilità, selettività effettiva, ritenzione delle endotossine, filtrazione interna potenziata). Abbiamo a disposizione svariate terapie che permettono di spaziare dalla diffusione semplice alla convezione pura ai trattamenti misti (convettivo-diffusivi), a quelli con alto grado di filtrazione interna e a quelli adsorbitivi.
In conclusione le membrane non sono tutte uguali e non esiste una perfetta membrana dialitica in grado di rimuovere tutti i tipi di soluti uremici senza disperdere molecole utili; le membrane sono strumenti per personalizzare la dialisi al fine di migliorare la qualità di vita.
Bisogna avere chiari gli obiettivi e conoscere le varie opportunità che il mercato offre. L’interazione tra nefrologi e bioingegneri indicherà la direzione per nuove scoperte rivoluzionarie nel campo della terapia sostitutiva renale tenendo come obiettivo principale il benessere del paziente.
| Proprieta’ e definizione | Termini in relazione alla funzione della membrana | ||
|---|---|---|---|
| Flusso (ml/min) | Clearance della β2MG
Low flow: <20 High flow: >20 |
Sieving Coefficient
Cuf = concentrazione soluto nell’ultrafiltrato
|
Rapporto fra concentrazione di un certo soluto nell’ultrafiltrato e quella nel plasma (0-1)
S = 1 il 100% delle volte una molecola attraversa la membrana S = 0 la molecola non attraversa la membrana |
| Biocompatibilità
(o bio-incompatibilità) |
Reazioni specifiche per interazione sangue/membrana* | Cut off di peso molecolare | Quel peso molecolare dei soluti, oltre il quale i soluti avranno un SC = 0.1 (cioè non vengono più persi se non in minima quantità) |
| Coefficiente di trasferimento di massa (KoA) | Permeabilità della barriera di membrana fra sangue e dialisato al passaggio di soluti per diffusione | URR = urea reduction ratio
Indice di adeguatezza del trattamento dialitico: concentrazione dell’urea nel plasma prima e dopo |
Rapporto di riduzione: Concentrazione di un soluto a inizio dialisi meno quella di fine dialisi, diviso la concentrazione iniziale |
| Permeabilità idraulica (KUF)
(ml/min/mmHg) |
Caratteristica intrinseca che regola velocità e volume dei fluidi in grado di attraversare la membrana | Estrazione di un soluto da parte di una membrana | Concentrazione di un soluto nel sangue in ingresso al filtro meno quella nel sangue in uscita dal filtro, diviso la concentrazione in ingresso |
*Reazioni specifiche per interazione sangue/membrana
■ Attivazione piastrinica
■ Attivazione cascata del Complemento
■ Attivazione dell’infiammazione
■ Liberazione di IL
LA MALATTIA RENALE NEL CONTESTO DELLE RETI CLINICHE INTEGRATE
Carlo Mura1, Annalisa Noce2, Giulia Marrone2, Massimo Belluardo3, Salvatore Mancuso4, Anna Mudoni5, Francesco Logias6
1UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
2UOSD Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata - Italia
3UOC Nefrologia, Dialisi e Trapianti, AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
4Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
5U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
6ASL Ogliastra, Lanusei (OG) - Italia
Nel corso degli ultimi anni sono stati emanati documenti sia da parte del Ministero della Salute che della SIN-Rene secondo i quali è necessaria una serie di azioni per contenere la progressione verso gli stadi terminali della malattia renale. Un percorso in tale direzione è cominciato vari anni fa nella zona Valdarno Aretino e ha mostrato buoni risultati. Tale progetto prevedeva una collaborazione stretta fra Ospedale e Territorio con il coinvolgimento dei MMG. Il progetto inizialmente organizzato come PDTA è stato poi ufficializzato come percorso aziendale con delibera nel 2018. Allo scopo di attuare in maniera diffusa il PDTA della malattia renale cronica e le indispensabili connessioni con la medicina del territorio è risultata poi necessaria l’organizzazione in Rete Clinica che uniformasse in tutto il territorio aziendale le modalità d’azione. L’area di applicazione è riferita alle strutture che hanno Unità Nefrodialitiche con Ambulatorio. Obiettivo di partenza è costruire una collaborazione con il Dipartimento della Medicina Generale Territoriale per condividere gli schemi operativi ormai validati dalla comunità scientifica. Indispensabile è stata giudicata l’attività di formazione rivolta ai medici di medicina generale nelle singole zone e progettata con i responsabili delle AFT.
A seguire sono state concordate le varie “competenze” fra professionisti:
• l’identificazione dei soggetti a rischio di MRC: compito generalmente affidato al MMG;
• la diagnosi della patologia nefrologica di base e l’inizio di terapie, a volte complesse ad alta specificità (p. es., le terapie immunosoppressive), atte a stabilizzare la nefropatia di base, compiti questi affidati al nefrologo;
• la gestione dei pazienti con MRC a lenta progressione e la promozione di corretti stili di vita che contribuiscono a rallentare l’evoluzione della MRC: compiti affidati prevalentemente al MMG, secondo schemi di sorveglianza e di trattamento condivisi e integrati;
• la gestione di eventi acuti sovrapposti, che possono essere riconosciuti dal MMG, ma che richiedono interventi clinici ad alta specificità, effettuati generalmente in regime di ricovero o di Day-Service nefrologico, di competenza del nefrologo;
• la sorveglianza e il trattamento dei pazienti con MRC con più rapido declino della funzione renale (fast-progressor) e con un maggiore numero di comorbidità affidati all’equipe nefrologica (medici/infermieri);
• l’educazione terapeutica volta a migliorare l’adesione farmacologica del paziente e alla dieta nefrologica, che deve estendersi all’equipe infermieristica nefrologica;
• il mantenimento in sorveglianza e presa in carico da parte dell’equipe nefrologica di una minoranza di pazienti che scelgono la non-dialysis e che quindi vengono avviati a cure di tipo palliativo.
I nefrologi dovranno uniformare, nel rispetto delle individualità legate al territorio e alle singole professionalità, l’attività degli ambulatori di nefrologia specialmente per quanto riguarda la registrazione informatizzata delle visite, la creazione di un archivio condiviso e la condivisione di alcune parti di software con la medicina generale. Nondimeno essenziale ci pare la realizzazione di un protocollo condiviso con le UO Nutrizione Clinica, Diabetologia e Cardiologia per consolidare un affiancamento all’attività ambulatoriale nefrologica. Essenziale appare anche lo sviluppo di strutture interne all’organizzazione nefrologica che prevedano accessi autogestiti al Day-Service Malattia Renale Avanzata per il controllo periodico dei pazienti ormai prossimi alla dialisi e attività quali la preparazione dell’accesso vascolare, lo screening cardiologico, l’inserimento in lista trapianto pre-emptive per gli idonei e la scelta consapevole e condivisa del trattamento dialitico sostitutivo. Questo non porterà alla scomparsa del trattamento dialitico, ma forse eviterà il riferimento tardivo del paziente allo specialista (late referral) che sarà sempre meno “sparato in dialisi” pur avendo da anni una malattia cronica, forse migliorerà la consapevolezza dei pazienti aumentando l’aderenza alle terapie e di sicuro aiuterà i nefrologi a “regolare il traffico” degli ingressi e a programmarli fin dove possibile.
MODELLI ORGANIZZATIVI INDISPENSABILI NELLA GESTIONE DELLA TERAPIA NUTRIZIONALE NEI PAZIENTI IN PRE-DIALISI: LA DIETA IPOPROTEICA COME MEDICINALE
Annalisa Noce1, Giulia Montalto2, Giulia Marrone1, Carlo Mura3, Massimo Belluardo4, Salvatore Mancuso5, Francesco Logias6
1UOSD Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata - Italia
2Scuola di Specializzazione in Nefrologia, Università degli Studi di Roma Tor Vergata - Italia
3UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
4UOC Nefrologia, Dialisi e Trapianti, AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
5Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
6ASL Ogliastra, Lanusei (OG) - Italia
Oggigiorno, la terapia dietetico-nutrizionale (TDN) a contenuto proteico controllato è divenuta fondamentale per la gestione clinica dei pazienti affetti da malattia renale cronica (MRC). I primi scienziati italiani che si dedicarono a tale tipologia di TDN in ambito nefrologico sono stati il Prof. Giovannetti e il Prof. Giordano, che si resero conto dei vantaggi da essa indotti nei pazienti affetti da MRC avanzata, in quanto sembrava in grado di contrastare le comorbidità ad essa correlate. La Consensus del 2018 ha messo in luce come una corretta e personalizzata TDN nei pazienti affetti da MRC sia in grado di ritardare la necessità di ricorrere alla terapia renale sostitutiva e di ridurre significativamente i costi del SSN impiegati per la sua cura e per il suo trattamento. La TDN a contenuto proteico controllato riduce la pressione intraglomerulare, vasocostringendo l’arteriola afferente e, allo stesso tempo, riduce l’attività delle cellule mesangiali, inibendo la produzione di trasforming-growth-factor β.
Tale TDN non induce di per sé malnutrizione, anzi sembrerebbe prevenire la sindrome da malnutrizione proteico-calorica in quanto corregge lo stato di intossicazione del paziente, contrasta le alterazioni metaboliche e migliora i sintomi clinici. Al fine di evitare la sindrome da malnutrizione proteico-calorica è fondamentale però che la TDN sia a contenuto proteico controllato ma allo stesso tempo normo-lievemente ipercalorica. Altro aspetto di fondamentale rilevanza in corso di TDN a contenuto proteico controllato è la correzione del possibile stato di acidosi metabolica, che caratterizza i pazienti affetti da MRC, poiché tale alterazione attiva il sistema ubiquitina-proteasoma-ATP dipendente, inducendo proteolisi muscolare.
Analizzando in modo dettagliato i diversi regimi dietetico-nutrizionali che possono essere utilizzati nei pazienti affetti da MRC in base allo stadio di malattia (Fig. 1), si osserva che fino allo stadio 3a è consigliata una TDN normoproteica (0,8 g di proteine/kg di peso corporeo/die), normo-lievemente ipercalorica e caratterizzata da un intake di sale pari a 2-3 g/die. Tale TDN rispecchia le caratteristiche della dieta Mediterranea.
A partire dallo stadio 3b si utilizza una dieta ipoproteica di cui si conoscono attualmente tre diverse opzioni: i) la LPD tradizionale (0,6 g di proteine/kg di peso corporeo/die) con prodotti aproteici; ii) la vegan diet (0,7 g di proteine/kg di peso corporeo/die) che non utilizza prodotti aproteici e che esclude dalle fonti proteiche assunte le carni rosse, le carni bianche e il tuorlo dell’uovo; iii) la PLADO diet (0,7 g di proteine/kg di peso corporeo/die) caratterizzata da almeno il 50% di proteine di origine vegetale e da un intake di fibre pari a 25/30 g/die. Tutti e tre i regimi dietetico-nutrizionali descritti sono normo-lievemente ipercalorici, ipofosforici e iposodici.
Dallo stadio 4 di MRC può essere utilizzata una dieta fortemente ipoproteica (0,3/0,4 g di proteine/kg di peso corporeo/die) supplementata con chetoanaloghi (1 cp ogni 5 kg di peso corporeo), che utilizza prodotti aproteici. I chetoanaloghi sono miscele di aminoacidi essenziali privati del gruppo aminico. Tali composti, attraverso il processo di transaminazione, formano gli aminoacidi corrispondenti, utilizzando i gruppi aminici liberi in circolo. I chetoanaloghi in commercio in Italia sono caratterizzati da un basso contenuto di triptofano, poiché il suo accumulo, come dimostrato in modelli animali, induce depressione, ansia, disturbi del sonno, compromissione della funzione cognitiva e progressione della MRC stessa. I chetoanaloghi inducono una serie di benefici nell’organismo vale a dire che contrastano l’acidosi metabolica, l’iperazotemia, la disfunzione endoteliale e l’ipercatabolismo proteico.
Un innovativo regime dietetico-nutrizionale è rappresentato dalla LPD supplementata con chetoanaloghi, la cui posologia è pari a 1 cp di chetoanaloghi ogni 10 kg di peso corporeo del paziente. Tale innovativo regime dietetico-nutrizionale sembrerebbe preservare maggiormente la funzione renale residua e ridurre la disfunzione endoteliale e la produzione di tossine uremiche rispetto alla LPD tradizionale, anche se gli studi attualmente condotti sono contraddistinti da una bassa numerosità campionaria.
In conclusione, la TDN a contenuto proteico controllato, incentrata sul paziente, personalizzata e con buon rapporto costo/beneficio, rappresenta un utile strumento, da affiancare alla terapia farmacologica, nella gestione clinica del paziente affetto da MRC. La TDN sembrerebbe in grado di aumentare la longevità, di migliorare la qualità di vita e di procrastinare l’inizio della dialisi.
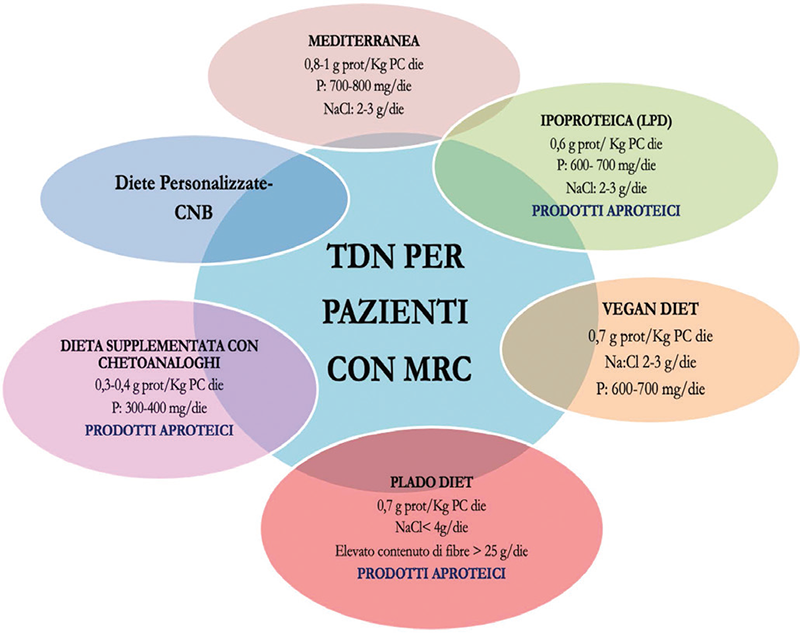
FIGURA 1 - Possibili schemi nutrizionali da utilizzare nella MRC in base allo stadio della malattia.
MODELLI ORGANIZZATIVI INDISPENSABILI NELLA GESTIONE DELLA TERAPIA NUTRIZIONALE PER I PAZIENTI IN PRE-DIALISI
Giulia Marrone1, Annalisa Noce1, Carlo Mura2, Massimo Belluardo3, Salvatore Mancuso4, Anna Mudoni5, Francesco Logias6
1UOSD di Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata, Roma - Italia
2UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
3UOC Nefrologia, Dialisi e Trapianti, AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
4Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
5U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
6ASL Ogliastra, Lanusei (OG) - Italia
L’ambulatorio di Nefronutrizione è una realtà ancora poco conosciuta e messa in atto nel territorio italiano. L’ambulatorio di Nefronutrizione dovrebbe essere presente in tutti i servizi di Nefrologia e in particolar modo in quelle strutture che presentano un bacino d’utenza di pazienti in pre-dialisi.
L’ambulatorio dovrebbe essere idealmente rappresentato da una serie di specialisti, oltre ai medici nefrologi e ai nutrizionisti (dietisti o biologi nutrizionisti), tra cui il personale infermieristico, lo psicologo, il chinesiologo clinico, il chirurgo dei trapianti e così via (Fig. 2).
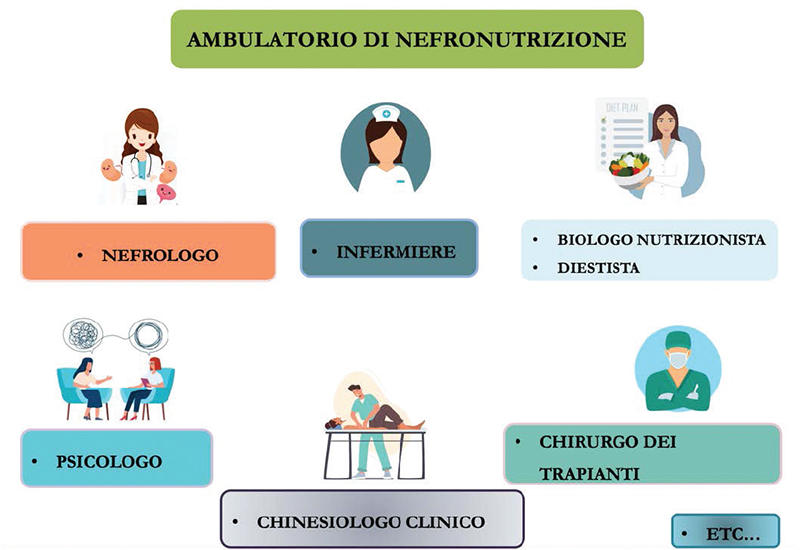
FIGURA 2 - Approccio multidisciplinare in un ambulatorio di Nefronutrizione.
Addentrandosi maggiormente nell’organizzazione dell’ambulatorio di Nefronutrizione, esso dovrebbe prevedere un approccio combinato tra la gestione clinica e quella nutrizionale del paziente affetto da malattia renale cronica. In particolare, dovrebbero essere richiesti periodicamente esami laboratoristici ematici e urinari di routine ma anche esami che permettano di valutare la presenza di acidosi metabolica (vale a dire la bicarbonatemia venosa) oppure che ci permettano di stimare l’intake alimentare di sodio e di proteine (vale a dire attraverso la raccolta delle urine delle 24 ore, ossia tramite sodiuria delle 24 ore e azoturia delle 24 ore).
Dovrebbero inoltre essere monitorate la pressione arteriosa e le misure antropometriche (in particolare il peso corporeo e le circonferenze di vita, addome e fianchi) e dovrebbero essere condotte l’anamnesi patologica e quella alimentare. In particolare, il counseling nutrizionale condotto in questa fase può permettere di valutare il contenuto proteico, l’apporto calorico e il contenuto di sodio e inoltre può permettere di promuovere il consumo di fibre e di alimenti di origine vegetale, offrendo le giuste indicazioni non solo sui metodi di cottura ma anche sulle tipologie di alimenti da consumare.
Ulteriore valutazione che dovrebbe essere condotta nell’ambito della visita Nefronutrizionale è la bioimpedenziometria (BIA). Tale esame permette una stima della composizione corporea, in particolare della massa grassa, della massa magra, dell’acqua corporea totale, della sua distribuzione intra- ed extra-cellulare e dell’angolo di fase. Ulteriore indagine da condurre per la valutazione della componente muscolare dovrebbe essere l’esame ultrasonografico del muscolo quadricipite femorale. Infatti, lo spessore di tale muscolo sembrerebbe un buon indicatore nel management e nella prevenzione della sarcopenia uremica.
Nell’ambito della visita dovrebbero anche essere somministrati dei questionari per la valutazione della qualità di vita e delle abitudini alimentari (quali lo short form-36, SF-36, e il PREvención con DIeta MEDiterránea, PREDIMED).
Come valutazione finale dovrebbero essere condotti dei test funzionali, finalizzati a valutare il grado di performance fisica del paziente, che sappiamo essere strettamente correlato con l’evoluzione della malattia renale cronica.
I test funzionali dovrebbero soddisfare dei criteri relativi alla qualità delle misurazioni, tra i quali l’affidabilità, ossia la riproducibilità dei valori in prove ripetute sullo stesso individuo, la validità, ossia il risultato del test deve avere parametri di riferimento, la validità predittiva di un esito connesso a una prestazione o alla salute, la fattibilità e la sicurezza per la persona e lo svolgimento in assenza di controindicazioni sanitarie (patologie acute o instabili, ecc.).
I test di performance fisica sono considerati un indicatore fondamentale nella valutazione dello stato di salute e rappresentano un predittore della longevità, come evidenziato anche da studi scientifici. Per tale motivo, l’attività fisica quotidiana, somministrata da personale esperto sulla base delle capacità dei pazienti, è di fondamentale importanza per il mantenimento dello stato di salute.
Pertanto, dati di letteratura evidenziano che il paziente affetto da malattia renale cronica dovrebbe essere gestito con un approccio olistico, infatti la sinergia tra le varie figure professionali permette di ottenere il massimo risultato in termini di management clinico e di miglioramento della qualità di vita del paziente.
NOVITÀ FARMACOLOGICHE DELL’IPERKALIEMIA
Maria Rosa Caruso1, Paolo Betti1
1Nefrologia e Dialisi, ASST Valle Olona (VA) - Italia
Introduzione e fisiopatologia
L’iperkaliemia è definita come una concentrazione di potassio >5,5 mEq/L. Il potassio è uno ione distribuito per il 98% a livello intracellulare, per via dell’effetto della pompa Na-K-ATPasica, ed è responsabile del potenziale a riposo della membrana cellulare.
Il potassio è ingerito con la dieta ed è escreto principalmente tramite l’urina. La sua omeostasi è sotto controllo sia ormonale, tramite l’aldosterone, che tramite meccanismi regolatori diretti. La ridotta funzione renale o l’uso di farmaci che interferiscono con la sua regolazione ormonale sono le principali cause di iperkaliemia.
I pazienti nefropatici frequentemente presentano inoltre comorbidità che rendono indicato l’uso di farmaci attivi sull’asse renina-angiotensina-aldosterone (RAASi) e ciò li espone particolarmente al rischio di iperkaliemia.
I RAASi sono farmaci di prima linea per il trattamento dello scompenso cardiaco e per il controllo delle nefropatie proteinuriche. I pazienti affetti da IRC trattati con questi farmaci sono esposti a un aumentato rischio di sviluppare iperkaliemia e conseguentemente alla sospensione del trattamento, con aumentato rischio di peggioramento delle comorbidità e della mortalità.
Trattamento dell’iperkaliemia cronica
I trattamenti dell’iperkaliemia consistono in restrizione dietetica di potassio (che è contenuto però in molti cibi “salutari”), uso di bicarbonato di sodio per correggere l’acidosi, uso di diuretici potassio-disperdenti, riduzione della dose/sospensione dei RAASi e uso di resine a scambio ionico che legano il potassio lungo il tratto gastro-intestinale.
Resine a scambio ionico di vecchia generazione
Il polistirene sulfonato di sodio (SPS) e il polistirene sulfonato di calcio sono resine a scambio cationico ampiamente disponibili e dal basso costo, che rimuovono il potassio attraverso il tratto gastrointestinale. Sono in uso dagli anni ’60 e sono attualmente approvati per il trattamento dell’iperpotassiemia. Tendono a causare costipazione e disturbi gastrointestinali e sono controindicati in caso di patologia intestinale ostruttiva. Nella vastissima esperienza con il loro utilizzo, sono stati segnalati casi di ischemia gastrointestinale, con casi anche fatali di perforazione intestinale. La maggior parte dei casi è stata riportata dopo somministrazione concomitante di soluzioni di SPS e sorbitolo, che attualmente non sono più in commercio.
Sul rischio di eventi avversi gastrointestinali delle formulazioni di SPS e CPS senza sorbitolo sono stati pubblicati diversi studi: alcuni hanno evidenziato un aumentato tasso di eventi avversi gastrointestinali nella popolazione trattata, mentre altri non hanno confermato tale osservazione.
Mancano studi non tanto sull’efficacia dei farmaci nel ridurre la potassiemia, quanto sulla capacità di mantenere a lungo termine i pazienti in trattamento ottimale con RAASi e sull’eventuale capacità di ridurre la mortalità o altri hard outcome. Tali studi non erano infatti richiesti per l’approvazione e, dal momento che il brevetto è scaduto, non c’è particolare interesse a condurne.
Resine a scambio ionico di nuova generazione
La richiesta di nuovi farmaci con migliori tollerabilità e palatabilità (e quindi compliance) ha condotto l’industria a sviluppare due nuove resine per il trattamento dell’iperpotassiemia: Patiromer e Sodio Zirconio Ciclosilicato (SZC).
Patiromer agisce principalmente a livello del colon e utilizza il calcio come ione di scambio. È stato studiato sui pazienti affetti da insufficienza renale cronica o scompenso cardiaco e non sui pazienti dializzati. I principali studi randomizzati hanno dimostrato la sua efficacia nel controllare l’iperkaliemia e la capacità di mantenere una terapia con RAASi a dose elevata nella maggioranza dei pazienti.
SZC agisce lungo tutto il tratto gastrointestinale e lega potassio in scambio di cationi idrogeno e sodio. È stato studiato anche in pazienti sottoposti a emodialisi e gli studi nel complesso hanno dimostrato le sue efficacia e tollerabilità oltre, anche qui, al mantenimento di RAASi a elevato dosaggio. Per quanto riguarda i pazienti in dialisi è stato dimostrato un migliore controllo della kaliemia interdialitica.
Una recente metanalisi degli studi complessivamente pubblicati con queste due nuove resine ha dimostrato che il loro uso nei pazienti con scompenso cardiaco a rischio di iperkaliemia ha permesso l’ottimizzazione della terapia in un maggior numero di pazienti e ridotto gli episodi di iperkaliemia (Tab. 2).
| SPS | Patiromer | SZC | |
|---|---|---|---|
| Indicazioni | Trattamento dell’iperpotassiemia | È indicato per il trattamento dell’iperkaliemia negli adulti | È indicato per il trattamento dell’iperkaliemia negli adulti |
| Interazioni | Somministrare almeno 3 ore prima dell’assunzione di altri medicinali orali o 3 ore dopo | Deve essere somministrato ad almeno 3 ore di distanza da altri medicinali orali | 2 ore prima dei farmaci orali con biodisponibilità gastrica pH-dipendente o 2 ore dopo.
Indipendentemente dagli altri farmaci |
| Posologia | 15 g (un misurino dosatore) da una a quattro volte al giorno | 8,4 g, fino a una dose massima di 25,2 g al giorno | Correzione: 10 g × 3 volte die (24-48 h)
Mantenimento: da 5 grammi a giorni alterni fino a 10 tutti i giorni |
| Controindicazioni | Ipersensibilità
Patologia intestinale ostruttiva |
Ipersensibilità | Ipersensibilità |
| Avvertenze | Se si presenta una costipazione clinicamente significativa, si deve interrompere il trattamento fino a quando non si ripristina una normale motilità intestinale. Non si devono usare lassativi contenenti magnesio o sorbitolo | Negli studi clinici non erano inclusi pazienti con anamnesi di occlusione intestinale, intervento GI di chirurgia maggiore e patologie GI severe. Per i pazienti con patologie GI severe correnti o pregresse si devono valutare con attenzione i benefici e i rischi della somministrazione di Patiromer prima e nel corso del trattamento | Il SZC può essere opaco ai raggi X.
Il rischio di perforazione intestinale è al momento sconosciuto. Dal momento che la perforazione intestinale è stata segnalata con leganti del potassio incluso SZC, deve essere prestata particolare attenzione ai segni e ai sintomi correlati alla perforazione intestinale |
| Prescrizione | Classe A (RNRL, Centri ospedalieri o specialisti in medicina interna, nefrologia e cardiologia)
(CPS: classe A RR) |
Piano terapeutico (validità 6 mesi), Centri ospedalieri o specialisti nefrologi, cardiologi o internisti, per pazienti con: • iperkaliemia persistente (>5,5 mEq/L) e • ridotta risposta o controindicazione alle resine Per i pazienti in tp con RAASi e • IRC st >= IIIb o • FEVs < 40% Per i pazienti non in terapia con RAASi e • IRC stadio IV-V • IRC in dialisi (solo SZC) |
|
MODELLI ORGANIZZATIVI INDISPENSABILI NELLA GESTIONE DEL PRURITO NEL PAZIENTE AFFETTO DA MALATTIA RENALE CRONICA
Annalisa Noce1, Giulia Montalto2, Giulia Marrone1, Carlo Mura3, Massimo Belluardo4, Salvatore Mancuso5, Anna Mudoni6, Francesco Logias7
1UOSD di Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata, Roma - Italia
2Scuola di Specializzazione in Nefrologia, Università degli Studi di Roma Tor Vergata - Italia
3UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
4UOC Nefrologia, Dialisi e Trapianti, AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
5Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
6U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
7ASL Ogliastra, Lanusei (OG) - Italia
Il prurito uremico viene considerato in ambito nefrologico come un sintomo comune e debilitante che colpisce il paziente affetto da malattia renale cronica (MRC) sia in terapia conservativa che in terapia sostitutiva. Sebbene le cause legate al prurito sistemico siano ormai ben definite, quelle associate al prurito uremico, invece, risultano di più complessa origine. Infatti, i fattori di rischio ad esso legati sono innumerevoli, quali alterazioni del metabolismo calcio-fosforo, comorbidità, età anagrafica e sesso, nonché l’età dialitica. Secondo un report del 2022 si stima che il 25-62% dei pazienti in dialisi peritoneale sia affetto da prurito uremico. Tale percentuale sale considerevolmente negli emodializzati ed è compresa tra il 38% e l’84%.
Tra le cause del prurito uremico (Fig. 3), la disregolazione immunitaria gioca un ruolo chiave nella sua fisiopatologia. A tal proposito, rispetto ai pazienti non pruriginosi, quelli con prurito correlato alla MRC mostrano livelli più elevati di proteina C-reattiva e di vari mediatori dell’infiammazione (quali istamina, IL-2 e IL-6). Inoltre, i livelli sierici di IL-31 sembrerebbero essere direttamente correlati all’intensità del prurito uremico nei pazienti in dialisi. L’accumulo dei tossici uremici, associato in parte ad una ridotta efficienza dialitica, e la disregolazione dei recettori oppioidi sono coinvolti nella patogenesi del prurito uremico. Un recente studio ha messo in evidenza anche il ruolo dell’ormone TSH nell’insorgenza del prurito uremico stesso, dimostrando come l’ipotiroidismo subclinico possa rappresentare una comorbidità ad esso correlata.
Clinicamente, il prurito correlato alla MRC si manifesta quotidianamente (o quasi), può coinvolgere tutte le aree del corpo e ha un decorso fluttuante e prolungato. Solitamente si presenta in assenza di un’eruzione cutanea primaria ma l’abitudine di grattarsi può portare a cambiamenti secondari della cute tra cui escoriazioni, prurigo nodularis, lichen simplex o eczema non specifico. Per la sua variabilità clinica, fare diagnosi di prurito uremico risulta difficoltoso; per esempio può presentarsi come sintomo più o meno severo, intermittente o persistente oppure comparire prima del trattamento sostitutivo o alla fine. Nel 50% dei pazienti si presenta come generalizzato e simmetrico, ma, in alcuni casi, può coinvolgere solamente alcune parti del corpo (come collo, viso e schiena). Per tali motivi, non esistono criteri standardizzati per porre la sua diagnosi, bensì bisogna valutare il quadro clinico complessivo del paziente ed è necessario che i sintomi persistano per almeno 6 settimane. La diagnosi di prurito uremico rimane quindi una diagnosi di esclusione.
Analizzando in modo dettagliato tutti i possibili schemi terapeutici preposti al trattamento di questa condizione clinica, di particolare rilevanza risultano la cura e la possibile risoluzione della condizione clinica di base. Nel caso della MRC è importante aumentare l’efficienza dialitica, ottimizzando la durata e la tipologia del trattamento dialitico stesso, e contrastare l’insorgenza e la progressione delle comorbidità ad essa correlate (in particolare le alterazioni del metabolismo calcio-fosforo). L’utilizzo di sostanze topiche quali steroidi, capsaicina e inibitori della calcineurina, possono essere utili come terapia adiuvante nel trattamento del prurito uremico. Negli ultimi anni, una valida opzione terapeutica è rappresentata da trattamenti sistemici quali resine non assorbibili (colestiramina) e anticorpi monoclonali diretti contro l’IL-4 e l’IL-13 (Dupilumab). Ulteriori e valide alternative terapeutiche utili nel contrastare il prurito uremico sono la sertralina e la talidomide. Infine, un trattamento emergente, ancora in fase di studio, è il Difelikefalin vale a dire un agonista altamente selettivo, e con un’azione limitata a livello periferico, del recettore k degli oppioidi. È stato messo in luce come questo farmaco riduca in maniera statisticamente significativa l’intensità e la durata del prurito uremico e come migliori significativamente la qualità di vita dei pazienti trattati rispetto a quelli che avevano ricevuto il placebo.
L’uso della fototerapia rimane dibattuto per il potenziale rischio di sviluppare tumori cutanei, che è elevato nei pazienti immunocompromessi affetti da malattia renale avanzata e in quelli destinati a ricevere un trattamento immunosoppressivo dopo il trapianto renale.
In conclusione, il prurito è un sintomo frequente nei pazienti affetti da MRC che compromette la qualità di vita dei pazienti stessi. Nella gestione clinica del prurito uremico è rilevante indagare la causa generante e mettere in atto strategie terapeutiche utili a contrastare la sua insorgenza e a controllare la sua intensità.
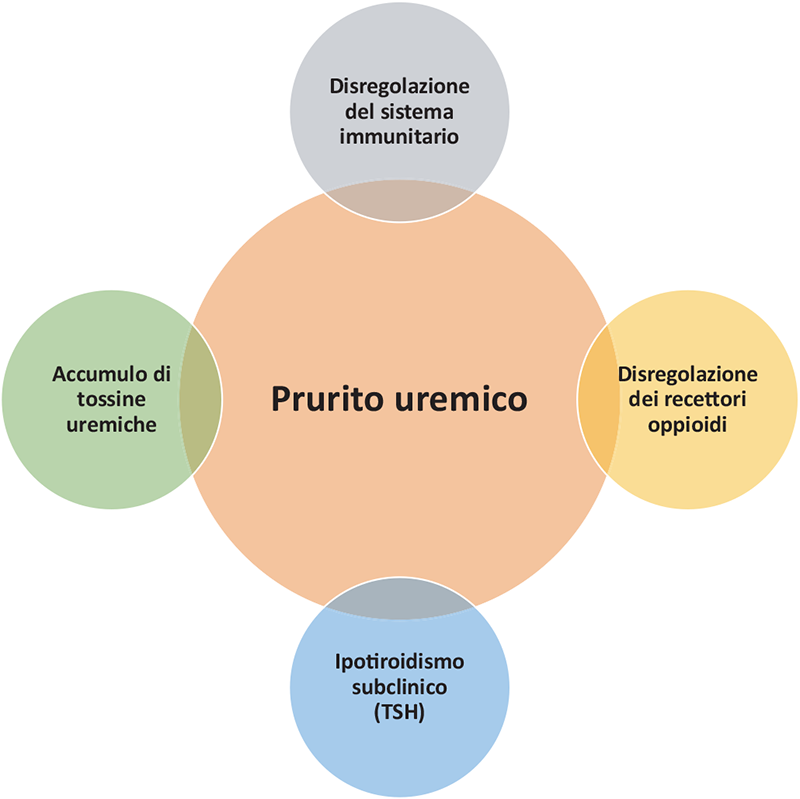
FIGURA 3 - Principali cause del prurito uremico.
MODELLI ORGANIZZATIVI INDISPENSABILI NELLA GESTIONE DELLA DIALISI DOMICILIARE ASSISTITA
Simeone Andrulli1, Maddalena Sedda1, Annalisa Carta1, Annalisa Sini1, Elisabetta Carta1, Antonio Pais1, Francesco Carta1, Angela De Luca1, Maria Pina Pira1, Rita Pusceddu1, Agostina Angela Leoni1
1ASSL Ospedale S Francesco U.O. di Nefrologia e Dialisi Nuoro - Italia
Perché la dialisi domiciliare rappresenta una valida opzione terapeutica
In un paziente con uremia terminale irreversibile sono possibili varie opzioni terapeutiche volte ad assicurare un buon controllo delle funzioni essenziali assicurate di norma dai reni, ormai definitivamente e irreversibilmente compromessi. Una fase critica è quella rappresentata dalla transizione tra la fase conservativa pura e la fase sostitutiva pura del percorso del paziente con insufficienza renale cronica progressiva. Questa fase di transizione andrebbe gestita con la dialisi incrementale sia sul versante della terapia extracorporea (emodialisi) sia sul versante della dialisi peritoneale, il trattamento domiciliare dell’uremia terminale fino a oggi più noto e comune.
Una terapia erogata a domicilio permette al paziente con uremia terminale di adattare meglio la sua necessità di dialisi al proprio stile di vita, con minori interferenze nella sua attività lavorativa e nella sua vita personale e sociale. Ne deriva un miglioramento atteso dei risultati clinici come la stessa qualità di vita.
I progressi compiuti nelle tecnologie rendono il trattamento domiciliare più semplice e fattibile rispetto al passato anche sul versante del trattamento extracorporeo. Per l’emodialisi domiciliare ora occorrono minori modifiche strutturali dell’abitazione dove sarà fatta, infatti sono disponibili apparecchiature più semplici e sistemi con cartuccia e filtro pre-assemblati che rendono più agevole il montaggio della macchina di dialisi usata a domicilio. I viaggi del paziente dal domicilio al Centro e ritorno sono azzerati con una riduzione del disagio del paziente, una riduzione del costo del trattamento e un minore inquinamento. Vari sono i motivi a favore della dialisi domiciliare. Si permette al paziente di adattare gli schemi di dialisi al proprio stile di vita e sono attesi un migliore controllo pressorio, una migliore qualità di vita e una riduzione dei costi. L’emodialisi domiciliare rappresenta una valida opzione terapeutica tra le possibili strategie di trattamento sostitutivo dell’insufficienza renale cronica. Avere in un Centro varie opzioni terapeutiche è fondamentale per assicurare ai vari pazienti un approccio personalizzato, anche in senso longitudinale, vale a dire durante il loro percorso evolutivo. In un Centro valido saranno presenti l’accesso a un programma di trapianto, un efficiente ambulatorio di pre-dialisi, un servizio dietologico, un team per allestire e revisionare gli accessi vascolari e la condivisione delle informazioni con piattaforme in rete.
Chi offre in Italia l’emodialisi domiciliare
Oggi l’emodialisi domiciliare in Italia può essere fornita da tre aziende:
• Fresenius mette a disposizione il cycler NxStage System One, la soluzione di emodialisi domiciliare più diffusa nel mondo. Si tratta di un sistema portatile, con interfaccia e montaggio semplici e un riscaldatore per le sacche di dialisato già pronte. È messo a disposizione anche un sistema di preparazione del dialisato a partire dall’acqua della rete idrica.
• Spindial mette a disposizione il sistema Physidia che presenta importanti differenze con il sistema precedente: è disponibile anche il tampone bicarbonato, i flussi di dialisato consigliati sono lievemente maggiori, vi è un gocciolatore venoso, il dializzatore è a scelta ed è presente una batteria per restituire il sangue anche in assenza di corrente.
• Sapio Life in collaborazione con BBRAUN AVITUM mette a disposizione il DIALOG IQ che presenta enormi differenze con i due sistemi precedenti. Si tratta di un monitor di dialisi completo, che può fornire un trattamento di emodialisi e di HDF; ha una pompa dell’eparina oltre al gocciolatore venoso e un video touchscreen e non ha i vincoli di basso flusso ematico e di dialisato dei sistemi precedenti, con la possibilità di fare trattamenti emodialitici standard (3 trattamenti/settimana) con minime modifiche strutturali al domicilio dei pazienti. Sapio inoltre mette a disposizione nel piano di trattamento anche il personale infermieristico. Questo è un punto interessante se si considerano: a) la bassa densità demografica della popolazione sarda distribuita in piccoli comuni mal collegati e b) l’espansione del pool dei pazienti con malattia renale avanzata e di età elevata con comorbidità/fragilità e bisogni crescenti di assistenza sociosanitaria.
Le caratteristiche essenziali di questi 3 sistemi sono sintetizzate nella Tabella 3.
| NxStage | Physidia S3 | Sapio Life | |
|---|---|---|---|
| Peso (kg) | 37 | 23 | Maggiore |
| Trasportabilità | Sì | Sì | No |
| Tecnica dialitica | Diffusivo | Diffusivo-Convettivo | Diffusivo-Convettivo |
| Dialisato | Lattato | Lattato e Bicarbonato | Bicarbonato |
| Volume dialisato | 20-25 L | 25 L | 120 L |
| Flusso dialisato | Basso | Basso | Alto |
| Sacche | Sì | Sì | No |
| Circuito ematico | Priming automatico (rimozione manuale dell’aria) | Priming automatico (gocciolatore) | Linee classiche |
| Tempo trattamento | 2-3 ore | 2-2,5 ore | 3-4 ore |
| Dializzatore | Purema 1,6 mq | A scelta | A scelta |
| Infermiere | No | No | Sì |
| Connettività | No | Sì | Sì |
| Sfigmomanometro | No | Sì | Sì |
| Batteria tampone | No | Sì | No |
| Riscaldatore | Esterno | Integrato | Integrato |
| Restituzione in assenza di corrente | No | Sì | No |
Risorse e fattori che favoriscono la dialisi domiciliare
La cura dei dializzati richiede ingenti risorse economiche e sanitarie. L’emodialisi domiciliare, come la dialisi domiciliare peritoneale, consente un risparmio economico, soprattutto se il trasporto del paziente al Centro avviene in ambulanza.
I fattori che dovrebbero favorire la dialisi domiciliare sono vari, come la distanza del paziente dal Centro, la migliore qualità di vita e il più favorevole impatto ecologico, oltre ai costi più contenuti. La disponibilità di piattaforme informatiche in rete assicura comunque la disponibilità dei dati dialitici domiciliari nel Centro di riferimento.
La durata attesa dell’emodialisi assistita sarà diversa in rapporto alla tipologia dei pazienti trattati: breve in pazienti anziani con comorbidità e lunga in pazienti giovani, con un accesso vascolare nativo e in attività lavorativa.
Conclusioni
L’emodialisi domiciliare, in Centri nefrologici attenti, attivi e di qualità, ha potenzialità di sviluppo notevoli, considerando i progressi tecnologici, i diversi contesti socio-sanitari e territoriali e l’espansione epidemiologica della malattia renale cronica in pazienti con importanti comorbidità.
MODELLI ORGANIZZATIVI INDISPENSABILI IN AFERESI TERAPEUTICA
Annalisa Sini1, Anna Mudoni2, Francesco Logias3
1ASSL Ospedale S Francesco U.O. di Nefrologia e Dialisi, Nuoro - Italia
2U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
3ASL Ogliastra, Lanusei (OG) - Italia
Qualsiasi processo che determini la rimozione di cellule, molecole, componenti o tossine dal sangue o da un organismo può essere considerato “aferesi”. Il campo di applicazione delle tecniche aferetiche è in continua evoluzione interessando vari ambiti: cardiochirurgia, intensive care, ematologia, nefrologia, neurologia, cardiologia, reumatologia, diabetologia, oculistica, otorinolaringoiatria e gastroenterologia. L’aferesi terapeutica ha l’obiettivo di rimuovere sostanze a elevato peso molecolare quali lipoproteine, fibrinogeno e immunoglobuline.
La Tabella 4 classifica le patologie in base alla riconosciuta efficacia della terapia aferetica secondo le Linee Guida ASFA.
| Categoria I | Patologie in cui l’aferesi è riconosciuta come terapia di prima scelta sulla base di trial controllati |
| Categoria II | Patologie in cui l’aferesi può essere utilizzata come terapia di supporto |
| Categoria III | Patologie in cui non sono disponibili trial controllati per supportare la validità dell’aferesi |
| Categoria IV | Patologie in cui l’aferesi non dà benefici |
La domanda di procedure aferetiche è cresciuta negli USA a partire dalla fine degli anni ’70; pertanto sono stati sviluppati alcuni modelli di servizio di aferesi terapeutica coinvolgendo tre aree essenziali della medicina: assistenza, formazione e ricerca.
Alcuni grandi Centri ospedalieri avevano le risorse e il volume necessari per dare inizio a propri servizi di AT. La maggior parte degli ospedali, i cosiddetti “ospedali di comunità”, erano troppo piccoli per giustificare la spesa per l’equipaggiamento e un personale necessari per la creazione di un servizio di aferesi terapeutica autonomo, in considerazione della sporadica domanda per tali procedure.
Dall’esperienza americana derivano i principali esempi organizzativi delle Unità di Aferesi Terapeutica.
Il primo modello di aferesi terapeutica proposto è di tipo centralizzato, con operatività dalle ore 7:30 alle ore 16:00 dei giorni feriali e con un servizio di pronta disponibilità. Tutte le procedure (ambulatoriali e ospedaliere) sono effettuate da personale specializzato proveniente dalla Unità di Medicina Trasfusionale.
I vantaggi correlati a tale organizzazione son rappresentati dalla facilità di accesso ai trattamenti per i pazienti, dall’uniformità dei servizi erogati e dalla presenza di strutture di supporto.
In alternativa è stata istituita un’associazione medica, il Bay Area Mobile Apheresis Program (BAMAP), come entità in grado di fornire servizi di aferesi a numerosi ospedali e Centri medici di un intero Stato, stringendo convenzioni con i più importanti Centri immuno-trasfusionali. Prerogativa fondamentale è la presenza di infermieri con esperienza in area critica e di medici con specializzazioni in immunologia, nefrologia, critical care e medicina trasfusionale. Formazione continua e partecipazione a programmi di ricerca costituiscono le parti integranti delle attività del BAMAP.
Un terzo modello è appannaggio dei nefrologi, il cosiddetto “nephrology based mobile extracorporeal therapy service”. Si tratta di un servizio mobile in cui l’equipaggiamento è trasportato da un ospedale all’altro mediante una compagnia di trasporto. Viene ritenuta un requisito indispensabile, per garantire la qualità, la disponibilità di un manuale contenente i dati relativi a tutte le procedure e gli elementi necessari per un programma di aferesi terapeutica. Condizioni considerate di emergenza, training, tipo di procedure più frequenti e ricerca sono sovrapponibili agli altri modelli.
Tra le nuove strategie di erogazione di assistenza sanitaria, negli ultimi anni, si è diffusa la tele-aferesi: una nuova categoria di telemedicina descritta per la prima volta nel 2020 che necessita di tecnologie avanzate aggiuntive. Infatti sono necessari: 1) dispositivi per aferesi provvisti di fotocamera e microfono integrati per consentire l’interazione tra operatore e paziente; 2) un collegamento a strumenti di monitoraggio remoto per accedere ai parametri vitali; 3) l’accesso alla documentazione elettronica per inserire i dati della procedura nella cartella clinica elettronica. L’obiettivo è migliorare la qualità delle prestazioni sia facilitando l’accesso alle cure che perfezionando i dispositivi tecnici di aferesi al fine di aumentare la sicurezza durante il trattamento.
Prevede un Centro di Aferesi che formi operatori dove risiedono i pazienti, con sviluppo delle esigenze tecniche e professionali tramite telecomunicazioni.
L’uso del modello è regolamentato da norme e pratiche mediche specifiche dello Stato e deve conformarsi ai requisiti per il trattamento dei dati sanitari protetti (HIPAA).
Secondo le Linee Guida proposte da SiDEM e IFEIT l’Unità di Aferesi Terapeutica (TAU) deve essere ubicata in un ospedale che comprenda:
1) un laboratorio di immunoematologia e/o un servizio trasfusionale;
2) un laboratorio diagnostico che offra analisi di chimica clinica e di microbiologia;
3) aree di terapia intensiva e stanze di recupero.
In caso di assenza, l’Unità dovrà stipulare una formale convenzione con strutture allocate in un diverso istituto a una distanza adeguata.
La TAU deve rivedere annualmente i risultati delle procedure e rispettare una serie di indicatori obbligatori a garanzia della qualità dei servizi erogati.
In conclusione il servizio di aferesi terapeutica deve servire un ampio bacino di utenza; può risiedere in un ospedale, può operare mediante un Centro mobile con trasporto delle apparecchiature nei diversi ospedali o in alternativa esercitare in telemedicina.
Il personale dedicato deve avere una comprovata esperienza nella gestione dei trattamenti extracorporei e tale competenza deriva da un’adeguata formazione, da un costante aggiornamento e dalla partecipazione a studi clinici.
MODELLI ORGANIZZATIVI NELLA GESTIONE DEL TRAPIANTO DI RENE
Massimo Belluardo1, Annalisa Noce2, Giulia Marrone2, Carlo Mura3, Salvatore Mancuso4, Anna Mudoni5, Francesco Logias6
1UOC Nefrologia, Dialisi e Trapianti , AOUS Azienda Ospedaliera Universitaria Senese, Siena - Italia
2UOSD Nefrologia e Dialisi, Dipartimento di Medicina dei Sistemi, Università degli Studi di Roma Tor Vergata, Roma - Italia
3UOSD Nefrologia e Dialisi, ASL Toscana Sud Est, P.O. La Gruccia Montevarchi (Ar) - Italia
4Centro Emodialisi Mazarese, Mazara del Vallo (TP) - Italia
5U.O. Nefrologia e Dialisi, Pia Fondazione di Culto e religione, Azienda Ospedaliera Cardinale G. Panico, Tricase (Le) - Italia
6ASL Ogliastra, Lanusei (OG) - Italia
Il percorso assistenziale del candidato al trapianto di rene nell’Azienda Ospedaliero-Universitaria di Siena si articola in tre fasi:
1) inserimento/esclusione e mantenimento del paziente in lista attiva;
2) trapianto;
3) follow-up.
Nella fase di inserimento in lista d’attesa è facoltà del paziente scegliere due Centri Trapianti sul territorio nazionale, di cui uno nella Regione di residenza.
L’inizio del trattamento dialitico è la condizione necessaria per accedere alla lista per trapianto di rene da donatore cadavere.
Il Centro Trapianti, al termine delle visite mediche e chirurgiche relative all’iscrizione in lista d’attesa, riterrà il paziente:
• idoneo e, quindi, inserito in lista attiva;
• non idoneo per presenza di controindicazioni al trapianto;
• temporaneamente non idoneo per documentazione insufficiente.
Durante il periodo che intercorre tra l’inserimento in lista attiva e il trapianto di rene sono necessari scambi di informazioni cliniche e di laboratorio tra il Centro Trapianti e il Centro Dialisi: l’invio dei campioni di siero del paziente ogni 3 mesi al Laboratorio di Immunogenetica e Biologia dei Trapianti dell’Ospedale è necessario per il continuo aggiornamento della sieroteca riguardante il profilo immunologico dell’iscritto. Il mancato invio di un siero determina, in caso di selezione del paziente in fase allocativa, la sua esclusione dal crossmatch e l’avviso da parte del Laboratorio di Istocompatibilità al Centro Trapianti di pertinenza. In caso di mancato invio di due sieri consecutivi, sarà necessaria la rivalutazione del paziente da parte del Centro Trapianti con eventuale sospensione o esclusione dell’iscritto in lista nel caso di accertati motivi clinici di non idoneità.
Quando si rende disponibile un donatore cadavere, il Centro Regionale Allocazione Organi e Tessuti (CRAOT) coordina tutte le fasi organizzative e procedurali dell’allocazione di organi e tessuti e individua i potenziali donatori fino alla consegna di organi o tessuti a un Centro Trapianti o a un Centro di Conservazione. Chirurghi, nefrologi e infermieri che afferiscono al Centro Trapianti di rene collaborano al fine di eseguire il trapianto nel più breve tempo possibile. Successivamente il chirurgo valuta l’idoneità dell’organo da trapiantare e l’anestesista verifica le condizioni del paziente, controlla la documentazione precedente e fa sottoscrivere il consenso all’anestesia generale.
Nefrologo e chirurgo discuteranno il caso per il monitoraggio clinico con particolare riguardo agli aspetti di gestione internistico-chirurgica. Durante la valutazione clinica del paziente viene impostata la terapia immunosoppressiva come da protocollo condiviso. Nella fase postoperatoria della degenza, una volta superato il rischio chirurgico, in caso di problematiche di carattere medico-internistico, in accordo con il nefrologo, sarà concordato il trasferimento del paziente presso la Degenza Protetta U.O.C. Nefrologia Dialisi e Trapianto.
Alla dimissione, il programma di follow-up prevede: 1) esecuzione di esami di laboratorio periodici da inviare al Centro Trapianti di rene; 2) visite ambulatoriali di controllo programmate presso il Centro Trapianti: a 1 mese, a 3 mesi, a 6 mesi, a 12 mesi, a 18 mesi e, successivamente, a cadenza annuale. In seguito alla visita di follow-up viene consegnata al paziente la relazione con le indicazioni da seguire a domicilio e la data del successivo controllo di follow-up.
ll percorso di “Trapianto da donatore vivente” consente di programmare il trapianto riducendo i tempi di attesa e i rischi e ottimizzando le condizioni cliniche del donatore e del ricevente. Il donatore vivente può essere un familiare, la cui compatibilità riduce li rischio di rigetto, oppure un non consanguineo. Al donatore devono essere fornite le informazioni necessarie per una decisione consapevole. Il donatore, nel rispetto della legislazione (art. 2 legge 458/67), deve essere maggiorenne, ben cosciente della scelta e consapevole delle conseguenze personali e deve esprimere un consenso informato. La donazione è gratuita, libera, revocabile e senza costrizione. Il rischio dell’intervento per il donatore è lo stesso di un qualsiasi intervento chirurgico. Il donatore vivente deve essere sottoposto a rigorosi accertamenti medici con un’assistenza a lungo termine.
La Parte Terza (Decreto 16 aprile 2012 n° 116) elabora una relazione finale verificando che riceventi e donatori abbiano osservato i principi del consenso informato.
La Tabella 5 illustra il programma di studio standard del donatore di rene.
| VALUTAZIONE INIZIALE: Accurata raccolta dell’anamnesi (familiarità per insufficienza renale e/o nefropatie; precedenti trasfusioni e/o gravidanze e vaccinazioni, precedenti patologie, eventuali interventi chirurgici, neoplasie e malattie infettive), Stato nutrizionale |
| ESAMI CLINICI E LABORATORISTICI: Gruppo sanguigno, Emocromo con formula, Azotemia, Sodio, Potassio, Calcio, Cloro, Creatinina, Clearance della creatinina, Glicemia, GOT, GPT, GammaGT, Fosfatasi alcalina, LDH, Bilirubina totale e frazionata, Colesterolo totale e HDL, Tigliceridi, Esame urine (ripetuto almeno tre volte), Proteinuria delle 24 ore, Protidemia, Elettroforesi proteica, PT, PTT, Fibrinogeno, Ricerca sangue occulto nelle feci e, nell’uomo, PSA |
| MICROBIOLOGIA E INFETTIVOLOGIA: Urinocoltura 2 controlli, Marker Epatite B: HBsAg, HBsAb, HBsc Ab, HBeAg, HbeAb, Biologia molecolare per HCV e HIV, Sierologia per CMV (IgG, IgM), Toxoplasma, Epstein Barr, HTLV I e II, Screening sifilide (VDRL, TPHA), Mantoux |
| FASE DI STUDIO IMMUNOLOGICO: Tipizzazione HLA, Crossmatch donatore/ricevente |
| ESAMI STRUMENTALI E VISITE SPECIALISTICHE: ECG, Ecocardio e visita cardiologica, Rx Torace, Ecografia addominale, Valutazione psicologica, Scintigrafia renale morfofunzionale sequenziale con radionefrogramma, Angio-TAC in 3D con ricostruzione dei vasi renali
Donna: Visita ginecologica con Pap test, Rx mammografia ed ecografia mammaria per donne > 40 anni Uomo: visita urologica e PSA |
| PROCEDURE MEDICO-LEGALI: Valutazione psicologica, Accettazione dei soggetti coinvolti, mediante firma autografa del consenso informato, Riunione della Commissione medica con valutazione clinica conclusiva di fattibilità della donazione e stesura del verbale, Valutazione di Parte Terza riguardo alla libera, Informata e consapevole volontà di donazione, Invio della coppia e trasmissione degli atti al Giudice competente per territorio per le formalità di legge, Determinazione della data del trapianto |
Questo corso ha proposto un approfondimento professionalizzante sulla gestione della malattia renale cronica ed è stato accreditato per il riconoscimento di crediti formativi. Esaminando il panorama delle pià recenti novità il management del malato nefropatico docenti selezionati in base alla propria esperienza hanno proposto approfondimenti rivolti ad argomenti di estrema attualità, come la gestione della malattia renale cronica, della dialisi sia domiciliare che in area critica, della fistola artero-venosa, il trattamento delle alterazioni metaboliche e nutrizionali, le malattie rare ed il percorso assistenziale del paziente con trapianto di rene nelle varie fasi (inserimento/mantenimento in lista, trapianto e follow up). Questo appuntamento ha inoltre promosso un dibattito, che continuerà in edizioni successive, sulle più recenti acquisizioni scientifiche in ambito nefrologico e sulle implicazioni terapeutiche che ne derivano, in considerazione delle ultime novità terapeutiche e risorse tecnologiche in nefrologia. Questi proceedings raccolgono una parte delle presentazioni.