 |
G Clin Nefrol Dial 2024; 36: 23-28 ISSN 2705-0076 | DOI: 10.33393/gcnd.2024.3068 ORIGINAL RESEARCH ARTICLE |
 |
Come accompagnare la coppia con rene policistico in un percorso di diagnosi genetica preimpianto
Supporting couples with polycystic kidney disease in a preimplantation genetic diagnosis process
Preimplantation diagnosis process for couples with polycystic kidney disease involves several steps: genetic and gynecological counseling, in vitro fertilization (IVF/ICSI), embryo biopsy, genetic analysis, selection of healthy embryos and implantation.
The importance of preimplantation diagnosis for couples affected by polycystic kidney disease (PKD) lies in several key factors:
1. prevention of inherited disease: PKD is a genetic disorder with a high likelihood of being passed from parent to offspring. Preimplantation diagnosis offers couples the opportunity to identify and avoid passing on the disease to their children;
2. family planning options: by undergoing preimplantation diagnosis, couples can make better decisions about their family planning options. They can select embryos that do not carry the PKD gene mutation and reduce the risk of having a child affected by the disease;
3. emotional burden reduction: PKD can lead to significant emotional burdens for affected individuals and their families. Preimplantation diagnosis provides a proactive approach to avoid these burdens by preventing the transmission of the disease to next generations;
4. enhanced reproductive choices: with preimplantation diagnosis, couples have a greater control over their reproductive choices. They can pursue assisted reproductive techniques such as in vitro fertilization (IVF) while simultaneously minimizing the risk of passing on PKD to their offspring;
5. improved pregnancy outcomes: by selecting embryos that are free of the PKD gene mutation, couples increase the likelihood of having a healthy pregnancy and a child free of the disease. It can lead to improved pregnancy outcomes and the birth of healthy children. Overall, preimplantation diagnosis offers hope and empowerment to couples affected by PKD by providing them with the means to build a family while minimizing the risk of passing the disease to next generations.
Keywords: Medically assisted reproduction, NGS, PGT, PMA, Preimplantation genetic diagnosis
Received: March 14, 2024
Accepted: March 21, 2024
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Test genetico preimpianto, PGT
Il test genetico preimpianto (PGT) è la forma più precoce di diagnosi prenatale, in quanto permette di identificare la presenza di malattie genetiche ereditarie e di alterazioni cromosomiche in embrioni ottenuti da fecondazione in vitro prima del loro trasferimento in utero (1).
A differenza delle altre tecniche di diagnosi prenatale invasiva (villocentesi e amniocentesi), il PGT evita il ricorso all’interruzione di gravidanza in caso di risultato positivo all’analisi genetica.
Infatti, i recenti progressi nella comprensione del genoma umano e nelle metodiche di diagnostica molecolare hanno portato a una conoscenza e a una consapevolezza maggiori dei meccanismi alla base di malattie ereditarie, riconducibili ad alterazioni genetiche o cromosomiche. La valutazione del rischio genetico/familiare è particolarmente importante per le coppie che affrontano un percorso di PMA, al fine di intraprendere scelte riproduttive opportune.
Il PGT è l’unico strumento diagnostico che informa le coppie circa lo stato di salute dei propri embrioni prima dell’instaurarsi della gravidanza, in modo da minimizzare i rischi gestazionali, quali l’aborto spontaneo/terapeutico e le sindromi cromosomiche e genetiche fetali.
Il test viene eseguito nell’ambito di un percorso di procreazione medicalmente assistita (PMA) di II livello, che prevede alcune fasi, illustrate successivamente. La tecnica è sovrapponibile a una villocentesi, in quanto il materiale di partenza per l’analisi è lo stesso, mentre cambia lo stadio a cui avviene l’analisi, che, in questo caso, è molto precoce e prima del trasferimento dell’embrione in utero. È possibile analizzare sia il corredo cromosomico nella sua interezza che malattie genetiche associate a singoli geni, le cui mutazioni sono presenti in uno o in entrambi i partner della coppia e di cui si vuole evitare la trasmissione.
Il PGT può essere effettuato per diverse indicazioni e in base a queste si distingue in 3 distinte tipologie. In particolare, è possibile effettuare il PGT per malattie monogeniche (PGT-M) in caso di patologie ereditarie autosomiche dominanti, come il rene policistico AD, e autosomiche recessive, come il rene (2).
Il PGT-M è infatti indicato per coppie portatrici di malattie causate da alterazione di un singolo gene. Tali malattie possono essere dominanti; quindi, è sufficiente un genitore affetto per avere un rischio di ricorrenza nella prole (50%), oppure recessive, che rappresentano un rischio per i figli nel caso in cui entrambi i genitori siano portatori sani (rischio 25%).
Per poter valutare la fattibilità del PGT durante la prima visita genetica, è necessario conoscere la base molecolare della malattia familiare. Prima di effettuare l’analisi sugli embrioni, viene effettuato un set-up preclinico per verificare la fattibilità dell’indagine e l’informatività dei polimorfismi utilizzati per l’indagine: vengono raccolti i campioni di DNA e l’anamnesi della coppia e dei parenti disponibili; successivamente vengono analizzati sia l’alterazione genetica causativa della malattia sia i diversi marcatori molecolari fiancheggianti, vale a dire dei polimorfismi di lunghezza (STR) o di sequenza (SNP). Si ottiene così l’identificazione dell’aplotipo a rischio, vale a dire la porzione di cromosoma che contiene il gene malato, la cui trasmissione viene analizzata nei vari membri della famiglia coinvolti nell’indagine preliminare. La presenza dei marcatori è fondamentale per dare solidità all’analisi (spesso la sola mutazione non è sufficiente) e per eseguire un’analisi indiretta nel caso in cui la mutazione causativa della patologia non fosse direttamente visibile con un’analisi diretta.
Nel caso del rene policistico causato da mutazioni del gene PKD1, a causa delle sue particolarità, spesso è possibile analizzare solo l’aplotipo a rischio, avendo a disposizione almeno 2 soggetti affetti della famiglia (3).
Dopo il set-up preclinico, in caso di fattibilità positiva all’analisi, la coppia può iniziare il percorso di PMA, al fine di ottenere un numero sufficiente di embrioni da analizzare per la specifica malattia genetica. Viene quindi eseguito il PGT-M (e successivamente si esegue l’analisi dei cromosomi PGT-A) sul DNA ottenuto dalla biopsia della blastocisti, i cui risultati vengono poi discussi con la coppia per programmare il trasferimento dell’embrione non affetto in utero.
Consulenza genetica nel PGT
Il percorso di PGT inizia e si conclude con la consulenza genetica, che rappresenta uno step di assoluta importanza e che viene effettuata da genetisti con comprovata esperienza nella diagnosi preimpianto. Durante la consulenza genetica pre-PGT-M, la coppia viene informata sulla condizione genetica in esame e sulle percentuali di rischio di ricorrenza; vengono discusse la gravità, la penetranza, la variabilità fenotipica, la prognosi e le opzioni terapeutiche esistenti. Inoltre, viene verificata la fattibilità di diagnosticare il difetto genetico in questione mediante il PGT, discutendo le eventuali opzioni riproduttive alternative (diagnosi prenatale invasiva e non invasiva, fecondazione eterologa) (4).
Alla coppia vengono illustrati il percorso di diagnosi preimpianto, la necessità per il PGT-M di effettuare uno studio preliminare sul DNA della coppia, propedeutico all’analisi indiretta sull’embrione, e la necessità di coinvolgere ulteriori familiari.
Con la coppia, in consulenza genetica pre-test, vengono esaminate le metodologie e le strategie diagnostiche disponibili per la diagnosi genetica, illustrando i livelli di accuratezza, i parametri qualitativi, le tempistiche, i vantaggi e i limiti della metodica, nonché la percentuale di errata diagnosi. Durante la consulenza, inoltre, il genetista informa la coppia circa l’attendibilità e l’accuratezza diagnostica in relazione al campione bioptico ottenuto e illustra tutte le potenziali limitazioni come la possibilità che la diagnosi non sia conclusiva o fattibile per alcuni embrioni, la probabilità di ottenere un embrione non affetto e la possibilità che tutti gli embrioni risultino affetti, dunque non trasferibili per la presenza di difetti genetici e/o cromosomici.
Il processo decisionale riguardante quali embrioni siano trasferibili deve essere discusso con la coppia prima dell’inizio del ciclo di PMA-PGT e aggiornato al bisogno durante o dopo la conclusione del ciclo.
In fase di consulenza è opportuno discutere con la coppia circa la probabilità di ottenere una gravidanza/nascita e il rischio di aborto per ciclo iniziato e per transfer effettuato, correlati all’età materna e alla specifica malattia genetica; è importante anche informare sul destino degli embrioni affetti e dei non affetti in sovrannumero rispetto alle esigenze di pianificazione familiare della coppia e sul destino degli embrioni non diagnosticati o di quelli non idonei al trasferimento. In caso di dubbio diagnostico e/o di necessità di conferma dei risultati ottenuti, viene discussa la possibilità di effettuare una seconda biopsia del trofectoderma, previo consenso informato.
Successivamente, alla fine dell’analisi di set-up preclinico, viene eseguita una consulenza genetica in cui vengono illustrati l’effettiva fattibilità tecnica del test e il rischio a posteriori di trasmissione della malattia, così come, al termine dell’analisi PGT-M, viene eseguita una consulenza post-PGT multidisciplinare, in cui vengono spiegati e chiariti il referto di laboratorio e l’esito del test sugli embrioni.
Infine, in caso di gravidanza, in consulenza genetica prenatale, viene discussa con la coppia la possibilità di effettuare la diagnosi prenatale per confermare il risultato del PGT e l’eventuale follow-up della gravidanza e dei bambini nati.
Ciclo di procreazione medicalmente assistita (PMA)
Il ciclo di PMA con diagnosi preimpianto è un percorso complesso, che vede la partecipazione coordinata di più specialisti che seguono ognuno un aspetto diverso del percorso ma che perseguono lo stesso obiettivo: aiutare una coppia con malattia genetica ad avere figli liberi dalla malattia.
Perché questo si possa verificare, occorre sottoporsi a un ciclo di PMA in cui la donna stimola il proprio ovaio con opportuni farmaci a produrre un numero maggiore di ovuli di quello prodotto mensilmente durante il ciclo ovulatorio. Quando il medico giudicherà idonea la stimolazione delle ovaie, si procederà al prelievo degli ovuli (un intervento chirurgico minore che avviene in regime ambulatoriale con una leggera anestesia); lo stesso giorno il partner maschile produrrà gli spermatozoi. L’unione degli ovuli e degli spermatozoi darà luogo agli embrioni, che, dal 5° al 7° giorno di sviluppo, verranno sottoposti a biopsia. Gli embrioni, che, in questo stadio, prendono il nome di blastocisti, saranno crioconservati in azoto liquido in attesa del risultato dell’analisi genetica della biopsia che ci dirà quale embrione potrà essere riposizionato nell’utero della donna. Dopo 12 giorni dal transfer sapremo con l’esecuzione del test di gravidanza se l’embrione avrà attecchito e se la gravidanza sarà iniziata.
Questa procedura è la procedura tipica di un ciclo di PMA. Nella diagnosi preimpianto si aggiungono alcune fasi specifiche, che devono essere effettuate prima dell’inizio della stimolazione; fasi che ci consentiranno di identificare nell’embrione la presenza del gene mutato (Fig. 1).
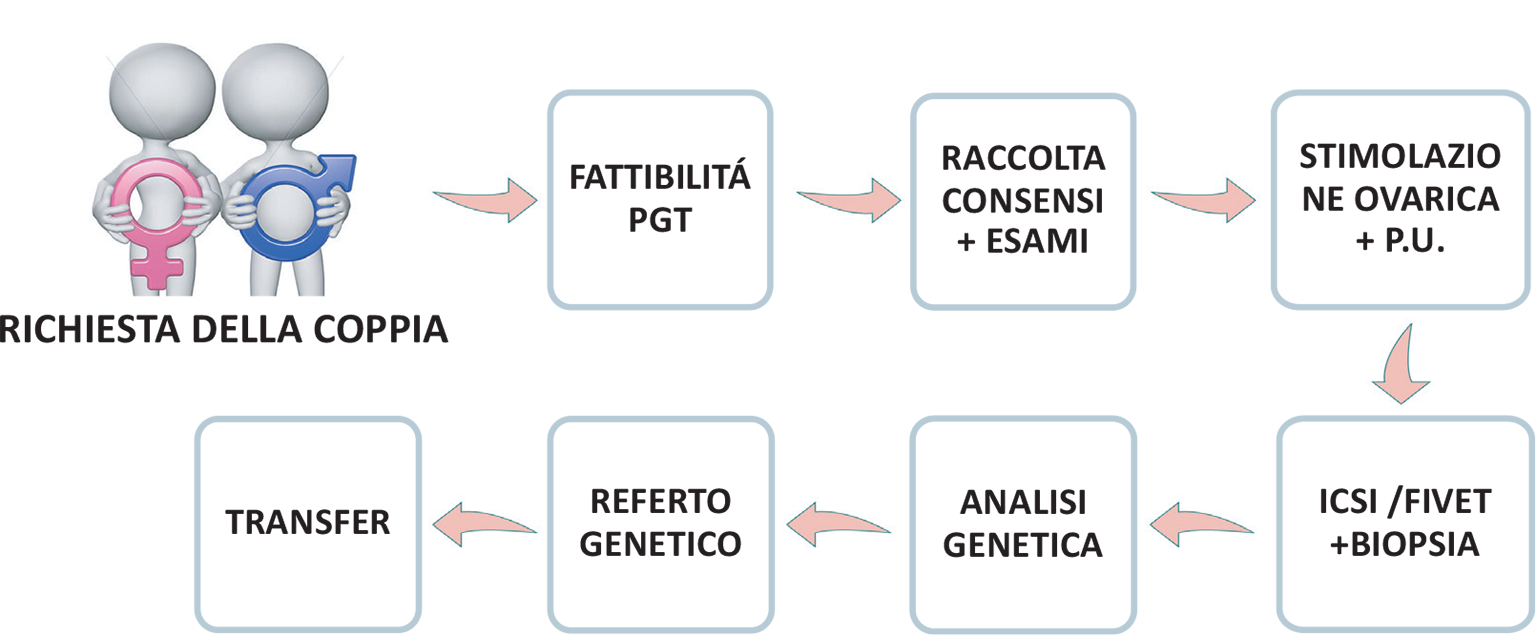
FIGURA 1 - Percorso ciclo PMA+PGT.
Deve essere in ogni caso fatta, prima di stabilire l’accesso al ciclo di trattamento, una valutazione generale che comprenda:
– lo stato di salute generale;
– le terapie farmacologiche in atto;
– la compatibilità dello stato di salute con la gravidanza (d’intesa con lo specialista che segue la patologia esistente).
La valutazione pretrattamento deve essere completata come nel caso di pazienti che si sottopongono a cicli di FIVET/ICSI senza preimpianto. Tale valutazione include:
– la valutazione della riserva ovarica per la scelta del miglior protocollo possibile di stimolazione ovarica. Esistono condizioni quali endometriosi, cisti ovariche, uso di alcuni farmaci, PCOS, alterazioni intrauterine (come fibromi, polipi, adenomiosi) ed endometriti, che possono potenzialmente ridurre la risposta ovarica e/o l’impianto embrionario;
– la valutazione del campione seminale del partner maschile, più specificatamente per pazienti con condizioni ereditarie potenzialmente associate con una spermatogenesi ridotta;
– la valutazione morfologica dell’utero (ecografia 3D, isteroscopia);
– test sierologici per le malattie infettive, come previsto dalla normativa vigente (d.lgs. 191).
Un punto fondamentale del percorso di PGT-M è costituito dalla necessità di avere un numero sufficiente di embrioni da testare, considerando, per esempio, che, in caso di rene policistico, è del 50% la possibilità di avere embrioni affetti dalla malattia.
I punti chiave sono due:
– l’età della donna (perché la riserva ovarica diminuisce con l’età e occorrono molti più ovociti per avere lo stesso numero di blastocisti utilizzabili, come illustrato nella Figura 2);
– la risposta alla stimolazione e l’utilizzo di protocolli specifici per ottenere un numero maggiore di ovuli. Nel caso in cui la riserva ovarica sia ridotta, un protocollo interessante è il DUOSTIM, una doppia stimolazione che avviene nello stesso ciclo ovarico e che ci può consentire in casi adeguati di sfruttare al meglio la risposta alla stimolazione farmacologica delle ovaie e il tempo per ottenere un numero idoneo di ovuli (Fig. 3).
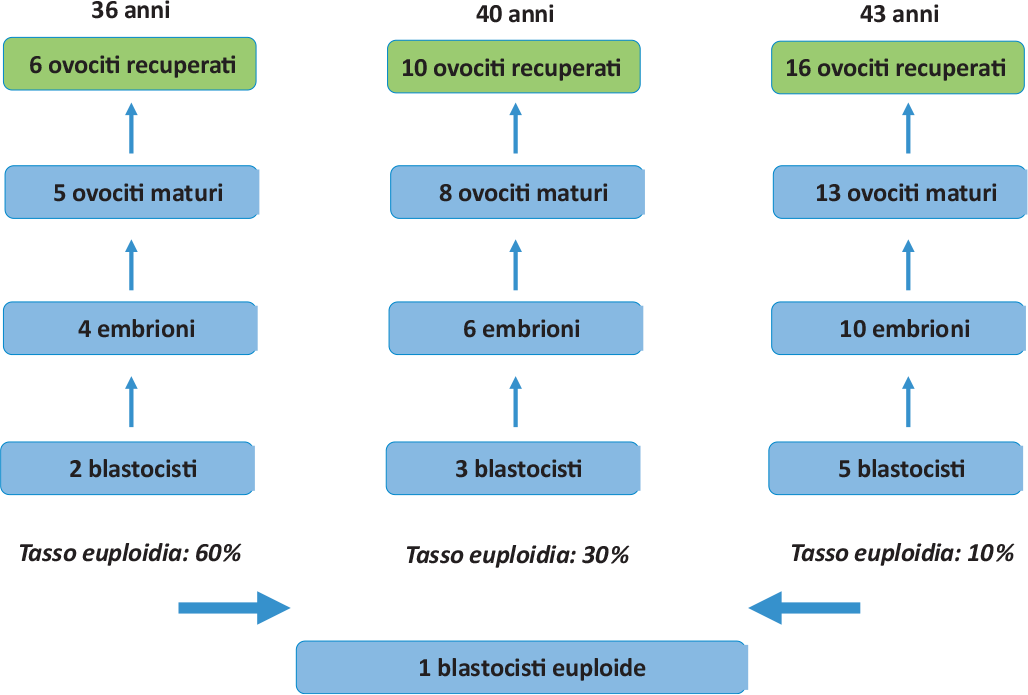
FIGURA 2 - Schema che dimostra come con all’avanzare dell’età materna si riduce sensibilmente il tasso di embrioni euploidi (con un numero normale di cromosomi) ed aumenta esponenzialmente il numero di ovociti che è necessario recuperare per ottenere una singola blastocisti sana.
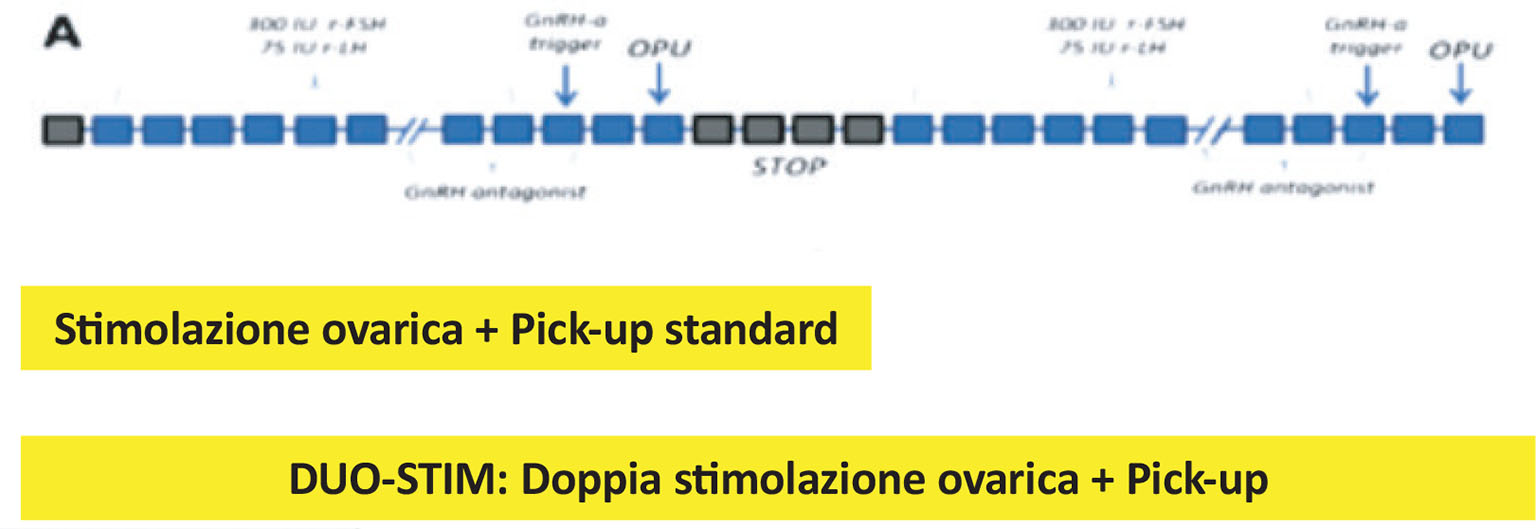
FIGURA 3 - Il ciclo di PMA prevede la stimolazione ovarica, il prelievo ovocitario (pick-up) e la fecondazione di tutti gli ovociti maturi prelevati. In caso di scarsa riserva ovarica è possibile eseguire, nello stesso mese, una doppia stimolazione ovarica e relativi pick-up (ciclo DUO-STIM).
Quindi quali sono le tappe del percorso di procreazione medicalmente assistita con diagnosi preimpianto? Vediamole insieme da vicino in questa sintesi (Fig. 4):
FIGURA 4 - Percorso multidisciplinare.
- fattibilità della diagnosi: il laboratorio di genetica valuta la documentazione della coppia e dei suoi familiari per valutare la fattibilità del caso;
- set-up: il set-up (messa a punto della tecnica) prevede un prelievo del sangue della coppia e la raccolta di saliva dei parenti (genitori o fratelli). Questa tappa è fondamentale per tutto il percorso e ci permette successivamente di individuare la mutazione nell’embrione;
- raccolta consensi e prescrizione esami: dopo aver ricevuto il referto del set-up si procede alla prescrizione degli esami propedeutici al ciclo di fecondazione assistita e alla raccolta dei consensi informati;
- stimolazione ovarica e prelievo ovocitario: il ciclo di PMA prevede una stimolazione ovarica che dura circa 12/15 giorni con successivo prelievo ovocitario. Spesso, per ottimizzare i tempi e avere più embrioni da analizzare, si effettua il siclo di DUOSTIM, che prevede una doppia stimolazione che di solito inizia dopo 5 giorni dal primo prelievo ovocitario;
- ICSI e biopsia delle blastocisti: gli ovociti raccolti vengono inseminati e gli embrioni vengono portati fino allo stadio di blastocisti per permettere al laboratorio di eseguire la biopsia;
- analisi genetica: le biopsie vengono inviate al laboratorio di genetica per eseguire la diagnosi ed emettere il referto entro circa 30 giorni;
- comunicazione referto: il referto viene comunicato tramite videochiamata da parte del Genetic Counselor, in modo da visionarlo e da discuterne insieme alla coppia;
- transfer embrionario: all’arrivo del risultato si procede a preparare farmacologicamente l’utero per poter procedere al trasferimento di una blastocisti risultata sana per la patologia. Dopo circa 12 giorni dal transfer embrionario si esegue il test di gravidanza.
Come si esegue la diagnosi preimpianto sugli embrioni?
Per testare un embrione, l’embriologo deve biopsiare, vale a dire prelevare, una porzione dell’embrione che sia quanto più rappresentativa possibile della costituzione genetica dell’embrione stesso e che non lo danneggi (Fig. 5).
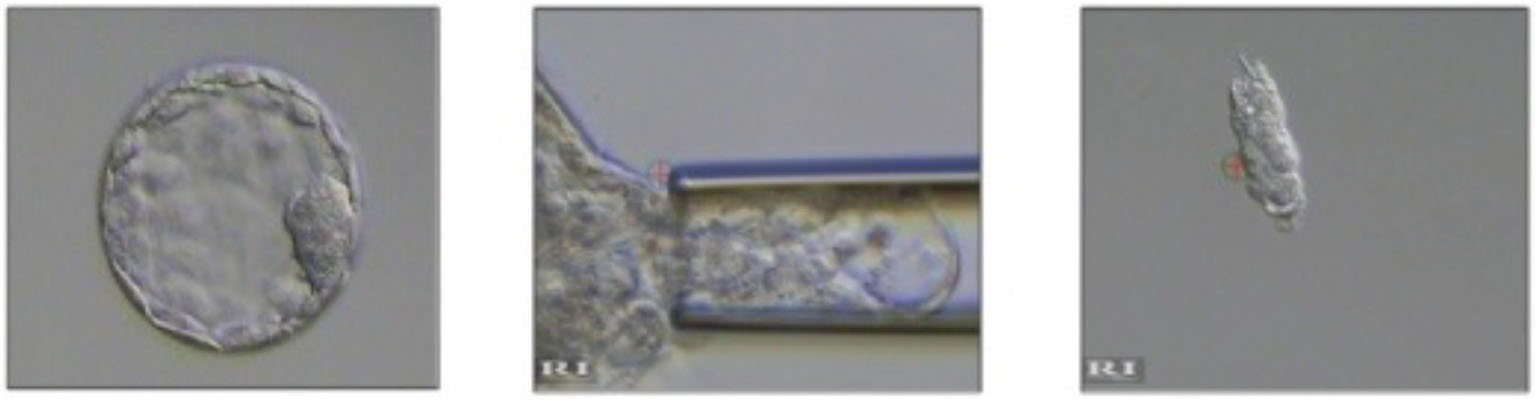
FIGURA 5 - Cosa vuol dire eseguire una biopsia. Prendere una porzione dell’embrione che sia quanto più rappresentativa possibile e che non lo danneggi. Dal 2016-2017 la maggior parte delle biopsie in Europa è eseguita sulla blastocisti, Data from the ESHRE PGT Consortium Data Collection 2016-2017.
La biopsia viene effettuata in quinta/sesta/settima giornata di sviluppo embrionario, al raggiungimento dello stadio di blastocisti.
È importante che questa procedura venga effettuata in questo stadio di sviluppo e non nei giorni precedenti (come succedeva qualche anno fa): la biopsia allo stadio di blastocisti non comporta alcuna compromissione dello sviluppo embrionario, che non viene danneggiato dalla procedura, ed è possibile prelevare più cellule che rendono migliore e maggiormente affidabile l’analisi. In questo stadio di sviluppo l’embrione è formato da due popolazioni distinte di cellule: il trofoectoderma e la massa cellulare interna. Quest’ultima è costituita da un insieme di cellule poste internamente all’embrione che andranno a formare il feto; il trofoectoderma invece è formato da cellule che daranno origine alla placenta e altri annessi embrionari. Sono proprio le cellule del trofoectoderma a essere prelevate per l’analisi.
Le cellule vengono prelevate utilizzando il micromanipolatore e un laser ad alta precisione che aiuta a separarle dalla blastocisti. Una volta eseguita la biopsia, la blastocisti verrà riposta in incubatore e vitrificata, mentre il frammento bioptico verrà posto in una provetta contenente una soluzione idonea (tubing) e preparato per l’analisi o la spedizione al laboratorio di genetica che lo analizzerà e che invierà successivamente il referto (Fig. 6).
Fare una biopsia embrionaria richiede molta abilità. Gli embriologi devono sottoporsi a una formazione adeguata e mantenersi costantemente aggiornati. Il laboratorio deve essere attrezzato e organizzato e deve avere esperienza nella coltura embrionaria prolungata fino alla stadio di blastocisti, cosi come nelle tecniche di vitrificazione e scongelamento degli embrioni. Pertanto è necessario che siano costantemente verificati gli indicatori di performance di ogni operatore su ognuna delle tecniche di laboratorio eseguite ed è fondamentale biopsiare un gran numero di blastocisti (Fig. 7).
Quali test è possibile eseguire sulle cellule prelevate all’embrione e con quali limiti?
Ogni cellula del nostro corpo contiene una molecola identica di DNA. Durante il ciclo vitale delle cellule, noto come ciclo cellulare, il DNA viene replicato e distribuito equamente tra due cellule figlie. Entrambi questi processi sono cruciali ma possono essere soggetti a errori. Durante la replicazione del DNA, un enzima chiamato DNA polimerasi legge e copia la sequenza del DNA per produrre una molecola identica. Tuttavia, possono verificarsi errori durante questo processo, noti come varianti, che alterano la sequenza del DNA. Alcune varianti sono innocue, altre contribuiscono alla diversità genetica individuale, mentre altre ancora possono causare malattie. Queste ultime sono le varianti associate a fenotipi clinici patologici (5).
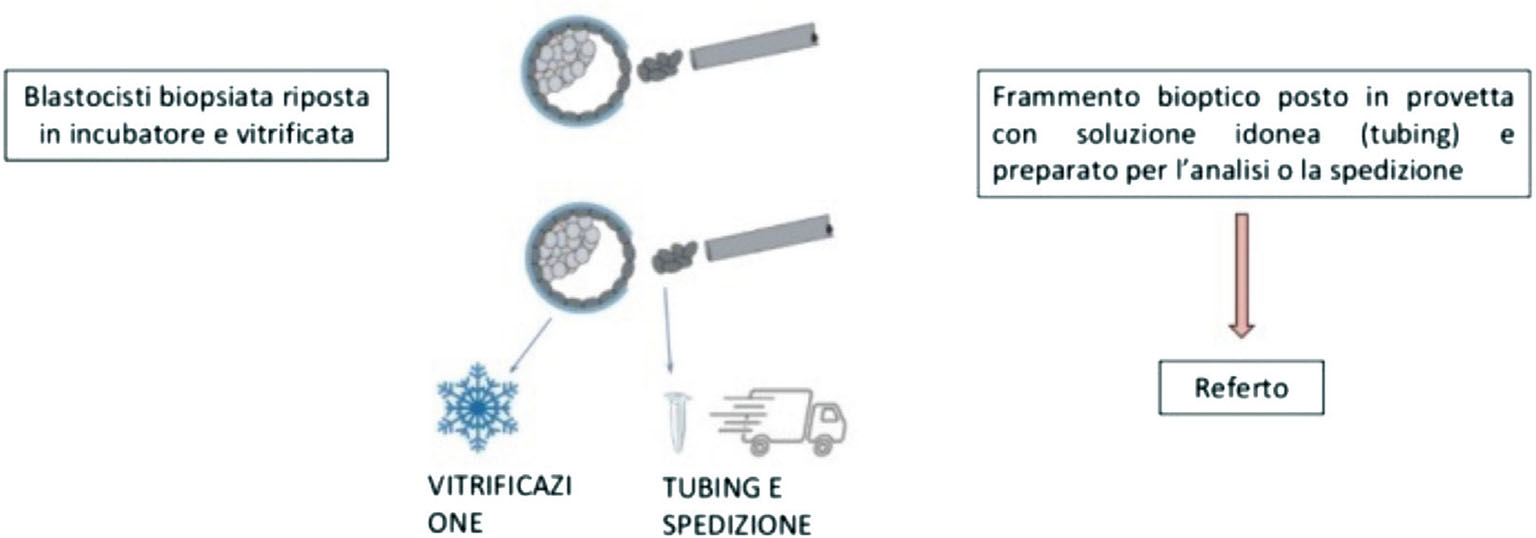
FIGURA 6 - Esecuzione della biopsia.
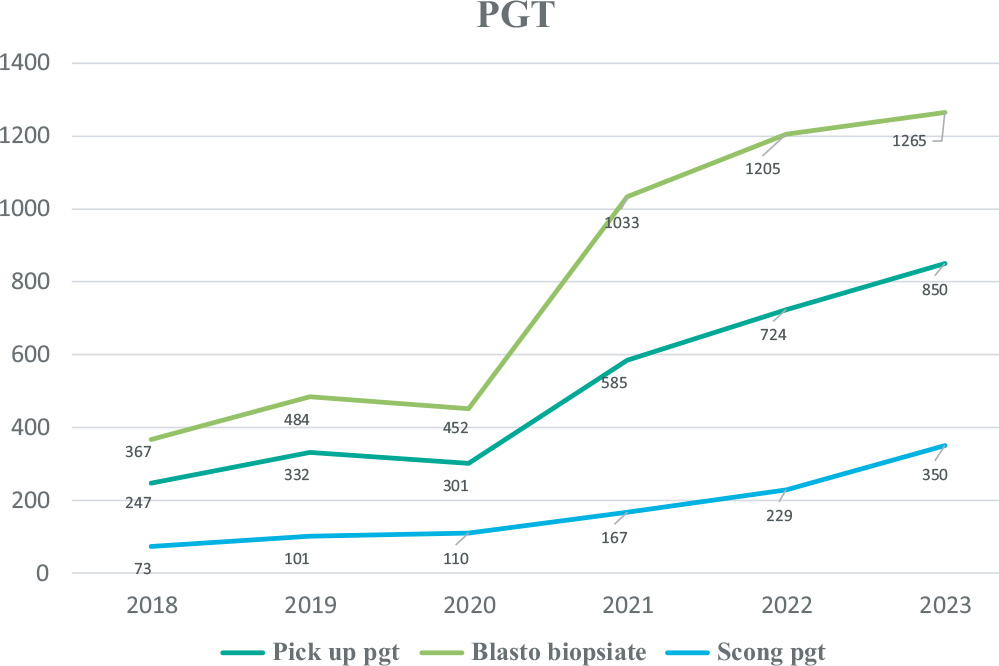
Figura 7 - Esperienza del Centro Demetra.
Le varianti genetiche possono essere di diversi tipi, da piccole mutazioni puntiformi a grandi delezioni. Per esempio, la sindrome del rene policistico è una malattia genetica causata da varianti nel DNA. Esistono diverse forme di questa sindrome e le più comuni sono note come forma autosomica dominante e forma autosomica recessiva. Nella forma dominante, una singola copia mutata di un gene è sufficiente per sviluppare la malattia, mentre, nella forma recessiva, sono necessarie due copie mutate.
Durante la fase di set-up pre-PGT-M, il laboratorio di genetica analizza il DNA dei familiari per studiare non solo la mutazione in questione, ma anche i marcatori fiancheggianti. Questo approccio consente un’analisi più completa, riducendo il rischio di drop-out allelico e aumentando contemporaneamente l’accuratezza diagnostica. L’utilizzo dei marcatori fiancheggianti è particolarmente importante per il rene policistico causato da mutazioni nel gene PKD1, poiché la sequenza di questo gene è in parte ripetuta nel nostro DNA in una regione non funzionale chiamata pseudogene. L’analisi dei marcatori fiancheggianti insieme alle nuove tecnologie di sequenziamento (targeted) riduce gli errori di diagnosi dovuti a questa complicazione (2).
In sintesi, prima di intraprendere il percorso di fecondazione assistita con PGT-M, le coppie a rischio devono seguire diversi passaggi, in ordine: la consulenza genetica, la valutazione della fattibilità del caso, il processo di fecondazione assistita, la biopsia dell’embrione e infine il PGT-M. Nel referto verranno segnalati solo gli embrioni affetti e non affetti, mentre i portatori sani e il sesso non saranno riportati. Se richiesto, è possibile eseguire contemporaneamente il PGT-A per rilevare eventuali anomalie cromosomiche come la trisomia 21.
Il PGT in Italia
Al momento il PGT non è previsto dai Livelli Essenziali di Assistenza (LEA), sebbene da anni le principali associazioni del settore della medicina della riproduzione e della genetica ne abbiamo sollecitato l’inserimento. In alcune Regioni (Toscana, Emilia Romagna, Provincia Autonoma di Trento, Sardegna e Veneto) il PGT è stato inserito nei LEA regionali o garantito con specifiche delibere ed è dunque possibile eseguire questa tecnica in centri PMA non solo privati/convenzionati ma anche pubblici. Il costo varia da zero (centri pubblici che accettano l’esenzione per specifica malattia rara) a poche centinaia di euro di ticket, fino ad alcune migliaia di euro nei centri PMA privati.
Per cercare un centro PGT in Italia è possibile consultare la pagina Online.
Per ulteriori informazioni sul PGT, consultare il sito Online.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Carvalho F, Moutou C, Dimitriadou E, et al; ESHRE PGT-M Working Group. ESHRE PGT Consortium good practice recommendations for the detection of monogenic disorders. Hum Reprod Open. 2020;2020(3):hoaa018. CrossRef PubMed
- 2. Wang Y, Zhai F, Guan S, et al; AR. A comprehensive PGT-M strategy for ADPKD patients with de novo PKD1 mutations using affected embryo or gametes as proband. J Assist Reprod Genet. 2021;38(9):2425-2434. CrossRef PubMed
- 3. Peng C, Chen H, Ren J, et al. A long-read sequencing and SNP haplotype-based novel preimplantation genetic testing method for female ADPKD patient with de novo PKD1 mutation. BMC Genomics. 2023;24(1):521. CrossRef PubMed
- 4. Xiao M, Shi H, Rao J, et al. Combined Preimplantation Genetic Testing for Genetic Kidney Disease: Genetic Risk Identification, Assisted Reproductive Cycle, and Pregnancy Outcome Analysis. Front Med (Lausanne). 2022;9:936578. CrossRef PubMed
- 5. De Rycke M, Berckmoes V. Preimplantation Genetic Testing for Monogenic Disorders. Genes (Basel). 2020;11(8):871. CrossRef PubMed