 |
G Clin Nefrol Dial 2024; 36: 29-35 ISSN 2705-0076 | DOI: 10.33393/gcnd.2024.3064 ORIGINAL RESEARCH ARTICLE |
 |
Personalizzazione della terapia ormonale per le donne affette da malattia del rene policistico autosomico dominante (ADPKD): strategie attuabili e prospettive future
Customization of hormone therapy in women with autosomal dominant polycystic kidney disease (ADPKD): actionable strategies and future perspectives
Autosomal dominant polycystic kidney disease (ADPKD) is the most common genetically inherited kidney disease and the fourth leading cause of renal replacement therapy worldwide. It is characterized by the development of multiple cysts in the kidneys and in other organs, the increase in renal volume and the progressive loss of renal function. ADPKD outcome seems to be sensitive to hormonal fluctuations, particularly those of sex hormones. Despite the limited literature available, this review presents the first comprehensive overview of contraception and hormonal replacement therapy in women with ADPKD, delving into the risks and benefits associated with different contraceptive methods, including hormonal, intrauterine devices, and non-hormonal approaches. It also explores personalized strategies for contraception based on the severity of renal disease and the presence of comorbidities.
Although the protective role of female sex hormones in slowing the progression of renal failure is acknowledged, hormonal therapy in women with ADPKD remains intricate and challenging due to its potential impact on liver disease progression. Women with ADPKD typically experience a slower progression of renal disease compared to men, largely influenced by hormonal dynamics.
This literature review underscores the importance of a multidisciplinary assessment and a thorough patient discussion to identify the most suitable contraceptive method for each woman affected by polycystic kidney disease.
Keywords: ADPKD, Contraception, Female sexual hormones, Fertile age, Hormonal therapy, Menopause transition, Polycystic kidney
Received: March 14, 2024
Accepted: March 19, 2024
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Background
ADPKD
La malattia del rene policistico autosomico dominante dell’adulto (ADPKD) è la più diffusa tra le patologie renali cistiche geneticamente determinate, con l’85% dei casi attribuiti a mutazioni nel gene PKD1 sul cromosoma 16 e il 10% a mutazioni nel gene PKD2 sul cromosoma 4. La diagnosi di ADPKD si basa tendenzialmente sulla storia familiare e sulla diagnostica strumentale, sebbene circa il 25% dei casi sia in assenza di familiarità nota, suggerendo forme latenti o nuove mutazioni genetiche (1).
Le manifestazioni renali includono cisti bilaterali che portano a un marcato incremento volumetrico renale, a un sovvertimento strutturale del parenchima e a una progressiva insufficienza renale, che colpisce circa il 50% degli individui entro i 60 anni. Una meta-analisi ha stabilito una progressione di malattia meno aggressiva nelle donne che negli uomini (2).
L’ADPKD può associarsi inoltre a ipertensione arteriosa, ematuria, prolasso della valvola mitrale, versamento pericardico, diverticolosi, cisti pancreatiche e aneurismi cerebrali (3,4). Tra le più frequenti manifestazioni extra-renali vi sono il riscontro di multiple cisti epatiche, che interessano il 10% dei pazienti con ADPKD e talora un grave coinvolgimento epatico con organomegalia (PLD). Tali cisti si sviluppano a partire dai dotti biliari intraepatici e raramente si associano ad alterazioni della funzionalità epatica (tranne nei casi di marcato effetto di compressione sulle vie biliari principali e/o di complicanze legate alle cisti stesse). Sebbene il coinvolgimento epatico si verifichi in una percentuale simile tra maschi e femmine, si manifesta precocemente e in modo più severo nel sesso femminile (5). La maggior parte delle donne sviluppa cisti epatiche entro i 60 anni, in particolare quelle con una storia di gravidanze e/o di terapia estrogeno-progestinica utilizzata a scopo contraccettivo. Uno studio prospettico condotto su donne in postmenopausa affette da ADPKD ha rivelato il ruolo cruciale degli estrogeni nella cistogenesi epatica e nell’aumento del volume epatico (6). I cambiamenti ormonali che si osservano durante la gravidanza, in particolare i livelli aumentati di estrogeni, possono contribuire all’ingrandimento delle cisti epatiche e alla crescita delle cisti renali, anche se in misura minore. Inoltre, l’aumento del flusso sanguigno renale durante la gravidanza potrebbe esacerbare la crescita delle cisti. È importante notare che l’effetto della gravidanza sull’ADPKD è estremamente variabile nella popolazione. Alcune donne possono osservare un marcato aumento delle dimensioni delle cisti, mentre altre potrebbero non manifestare alcuna alterazione degna di nota (7).
Un elemento fondamentale per la gestione di tali pazienti è quindi l’implicazione di un team multidisciplinare, che comprenda un nefrologo, un ginecologo e un genetista. Il loro obiettivo è fornire consulenze personalizzate basate sulle caratteristiche cliniche della paziente al fine di affrontare efficacemente questo percorso.
ADPKD, ormoni sessuali femminili e RAAS
Ormoni sessuali femminili
Negli ultimi decenni, c’è stata una spiccata attenzione nella ricerca medica verso il benessere delle donne. Allo stesso tempo, c’è stato un maggiore focus sull’analisi e sulla gestione degli aspetti della salute sessuale femminile e delle fasi fisiologiche, ma impattanti, della vita di una donna, inclusa la menopausa.
È cruciale riconoscere inoltre come le donne in età fertile richiedano sempre più terapie ormonali, non solo a scopo contraccettivo, ma anche per gestire varie condizioni come sanguinamenti uterini anomali, endometriosi, adenomiosi, dolore pelvico cronico, dismenorrea, sindrome dell’ovaio policistico (PCOS) e sindrome premestruale. L’uso di contraccettivi ormonali in donne con malattia renale policistica autosomica dominante (ADPKD) è stato da sempre oggetto di dibattito. Durante il periodo post-menopausale, inoltre, l’assistenza ginecologica è diretta verso la gestione dei sintomi climaterici come vampate di calore e sindrome genito-urinaria, insieme alla prevenzione dell’osteoporosi.
D’altra parte, è nota l’influenza degli estrogeni sul sistema renina-angiotensina-aldosterone e, soprattutto, è noto l’impatto promotore degli estrogeni sulle cisti epatiche e sulla proliferazione cellulare. Conseguentemente l’ADPKD è convenzionalmente considerata una controindicazione per i trattamenti ormonali.
Ormoni steroidei e regolazione riproduttiva
Gli ormoni steroidei, compresi estrogeni e progesterone, svolgono un ruolo cruciale nella regolazione della riproduzione mammaliana, specialmente nello sviluppo e nella funzione dell’utero. Operando principalmente attraverso il controllo della trascrizione genica all’interno dell’utero, questi ormoni esercitano i loro effetti attraverso recettori specifici, agendo come fattori di trascrizione nucleari. La loro attività regolatrice è innescata dal legame delle molecole steroidee, avviando una cascata di eventi che influenzano la trascrizione genica. L’estradiolo, l’estrone e l’estrone solfato, variando in proporzioni in base al ciclo riproduttivo, rappresentano i principali estrogeni nella donna. Gli estrogeni ricoprono ruoli cruciali nei processi cellulari, inclusa la regolazione della proliferazione cellulare (8). Il progesterone endogeno subisce trasformazioni metaboliche in tre metaboliti biologicamente attivi. Circa il 50% viene convertito in 5α-diidroprogesterone nel corpo luteo, il 35% subisce un metabolismo epatico a 3β-diidroprogesterone e il 10% si trasforma in 20α-diidroprogesterone (9). I recettori degli estrogeni (ER), specificamente ER-alfa e ER-beta negli epatociti, inducono effetti diretti e indiretti sulla proliferazione cellulare. Il legame degli estrogeni a questi recettori può influenzare direttamente la trascrizione genica correlata alla proliferazione cellulare, promuovendo la progressione cellulare attraverso la fase G1. Indirettamente, gli estrogeni stimolano inoltre la trascrizione e il rilascio di fattore di crescita epatocitario (HGF) e di fattore di crescita simile all’insulina (IGF), amplificando il meccanismo di crescita cellulare. Gli estrogeni interagiscono inoltre anche con altre vie di attivazione della proliferazione cellulare (10). Al contrario, non ci sono dati nella letteratura che dimostrino il ruolo primario del progesterone nella crescita delle cisti epatiche.
Estrogeni e sistema renina-angiotensina-aldosterone (RAAS): un’interazione complessa
Il sistema renina-angiotensina-aldosterone (RAAS) regola intricate funzioni cardiovascolari e renali, esercitando un profondo impatto sulla regolazione della pressione sanguigna. Un’iperattivazione del RAAS è coinvolta in varie malattie cardiovascolari e renali, inclusa l’ipertensione. Gli estrogeni sono importanti soppressori del RAAS e, in fase menopausale, la loro fisiologica riduzione comporta un aumento del rischio cardiovascolare in genere (11-14). La modulazione del RAAS presenta variazioni nelle diverse fasi del ciclo mestruale. Mentre il ruolo specifico del RAAS nelle fasi follicolare e ovulatoria del ciclo mestruale non è stato ampiamente studiato, nella fase luteale, caratterizzata da alti livelli di estrogeni e di progesterone, l’attività del RAAS aumenta. Il progesterone compete invece con l’aldosterone per i recettori mineralcorticoidi, mentre il testosterone, meno compreso, sembra aumentare i livelli di renina e l’attività ACE (15). Questi effetti ormonali estremamente complessi sul RAAS contribuiscono infatti alle differenze di genere nelle malattie cardiovascolari e renali.
Il ruolo degli estrogeni sulla funzione renale
Contrariamente alle aspettative, gli estrogeni ricoprono un ruolo protettivo contro la progressione della malattia nelle donne affette da ADPKD (16). Nell’ADPKD, i maschi presentano un rischio più elevato di progressione verso la malattia renale terminale con un’entrata in dialisi che precede mediamente di circa 7 anni quella delle donne. È anche da notare che i maschi sono più inclini a sviluppare calcoli renali e che i calcoli renali possono accelerare la progressione della malattia. Gli estrogeni infatti giocano un ruolo chiave nell’espressione dell’osteopontina, una proteina che rappresenta una difesa contro la litogenesi (17). In una recente scoperta, gli ormoni sessuali maschili sembrano essere implicati nella stimolazione dell’attivazione del RAAS e nel rilascio di endotelina-1 (ET1), mentre gli estrogeni intervengono sopprimendo questo asse a favore di una migliore funzione renale (18).
Menopausa precoce come indicatore di rischio
Le donne che vanno incontro a una menopausa precoce (prima dei 45 anni) sviluppano un rischio più elevato di sviluppare insufficienza renale. Questo sottolinea l’intricata interazione tra regolazione ormonale e ADPKD. D’altra parte però benché gli estrogeni esercitino un ruolo protettivo sulla funzione renale, il loro impatto a livello epatico è dannoso nelle donne affette da ADPKD.
Alla luce di quanto discusso finora e delle evidenze scientifiche disponibili, possiamo ora cercare di sviluppare un approccio terapeutico mirato che tenga conto delle esigenze cliniche specifiche delle donne affette da ADPKD, con l’obiettivo di massimizzare i benefici e di ridurre al minimo i potenziali rischi (Fig. 1).
Possibili strategie terapeutiche per le donne affette da ADPKD
Età fertile
Dispositivo intrauterino al rame
L’ADPKD presenta sfide uniche nella gestione delle esigenze contraccettive. In tale contesto, il dispositivo intrauterino (IUD) al rame emerge come la scelta d’elezione: essendo l’unica opzione non ormonale attualmente disponibile e non interferendo con la funzione renale, rappresenta il gold-standard per la contraccezione in questa popolazione (19-22). L’IUD al rame, approvato dalla FDA nel 1988, è un contraccettivo a lunga durata composto da un device a forma di T in polietilene avvolto in filo di rame (19). Sebbene i meccanismi d’azione specifici degli IUD non medicati siano ancora in parte sconosciuti, si ritiene che creino un ambiente sfavorevole per la fecondazione senza inibire l’ovulazione. Il rilascio di ioni di rame inibisce la mobilità degli spermatozoi, mentre la risposta infiammatoria provocata dalla presenza del dispositivo estraneo da un lato presenta un effetto spermicida e, dall’altro, genera un ambiente ostile per la fecondazione stessa.
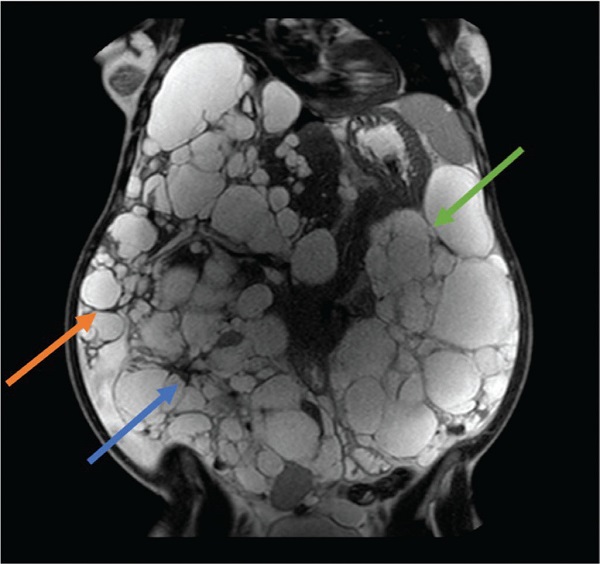
FIGURA 1 - Donna di 41 anni affetta da ADPKD, con nefro- ed epatomegalia. In anamnesi: 5 anni di terapia contraccettiva a base di estroprogenistico e 2 pregresse gravidanze. Classe Mayo 1 E.
Freccia arancione: margine inferiore del lobo epatico destro; freccia blu: rene destro; freccia verde: rene sinistro.
È importante notare che l’uso dell’IUD al rame potrebbe non essere efficace per alcune patologie ginecologiche comuni che richiedono trattamenti ormonali, come l’endometriosi, la dismenorrea, l’amenorrea e la sindrome dell’ovaio policistico (SOP) (23). Gli IUD al rame rappresentano comunque un’alternativa efficace nei casi di trattamento ormonale controindicato, come l’ipertensione, l’obesità, il cancro al seno, la trombosi venosa profonda e i tumori epatici benigni e maligni, come l’iperplasia nodulare focale, l’adenoma epatocellulare e l’epatocarcinoma (24).
Nonostante la sua efficacia, l’IUD al rame può causare effetti collaterali come perdite di sangue, dispareunia, crampi e vaginite, ma la maggior parte di essi tende a migliorare nel tempo. Le complicanze legate all’inserimento dell’IUD, come il rischio di malattia infiammatoria pelvica e la perforazione uterina, sono rare, ma vanno prese in considerazione. Questo dispositivo, infine, è controindicato nel caso di anomalie strutturali uterine (utero bicorno, fibromi uterini, ecc.) (21).
Dispositivi intrauterini a base di levonorgestrel
I dispositivi intrauterini a base di levonorgestrel (LNG-IUD) stanno emergendo come una promettente opzione terapeutica per diverse condizioni ginecologiche tra le donne affette da ADPKD. La loro variabilità di dosaggi e durata consente una personalizzazione del trattamento in base alle esigenze specifiche di ogni paziente.
Il LNG-IUD da 52 mg, uno dei più diffusi, rilascia quotidianamente 20 mcg di LNG. Varianti come Mirena e Liletta, approvate dalla FDA, possono essere utilizzate fino a 8 anni, garantendo un trattamento a lungo termine affidabile. Un’altra opzione è il LNG-IUD contenente 19,5 mg di LNG (Kyleena), che rilascia 13 mcg al giorno e può anch’esso essere utilizzato per un massimo di 8 anni. Il LNG-IUD da 13,5 mg (Skyla), o “LNG-IUD a basso dosaggio”, rilascia 8 mcg di LNG al giorno e ha una durata di utilizzo limitata a 3 anni consecutivi.
Questi dispositivi agiscono principalmente addensando il muco cervicale e modificando il pattern dell’endometrio (22-25). Sebbene possano occasionalmente sopprimere l’ovulazione, la maggior parte delle donne continua a ovulare con il LNG-IUD, soprattutto con quello a basso dosaggio (22). L’amenorrea è spesso osservata durante l’uso del dispositivo.
Oltre alla contraccezione, i LNG-IUD sono efficaci nel trattamento di varie patologie ginecologiche. Per esempio, il LNG-IUD da 52 mg è considerato il trattamento standard non chirurgico per patologie endometriali come l’iperplasia endometriale e il carcinoma endometrioide di grado 1 (24,25). È inoltre efficace nel ridurre il sanguinamento mestruale abbondante (HMB), nel trattamento del dolore correlato all’endometriosi (25-29) e nella riduzione del volume uterino in pazienti affette da adenomiosi e fibromi uterini (28).
Tuttavia, è importante tenere conto degli effetti collaterali associati ai LNG-IUD, tra cui cefalea, nausea, tensione mammaria e diminuzione della libido, dovuti principalmente al progestinico.
Contraccettivi orali combinati (COC) estroprogestinici
I contraccettivi orali combinati (COC) agiscono sopprimendo l’ovulazione attraverso l’inibizione dell’ormone rilasciante gonadotropina (GnRH) nell’ipotalamo, che, a sua volta, inibisce l’ormone follicolo-stimolante (FSH) e l’ormone luteinizzante (LH), interrompendo l’impulso di LH a metà ciclo ovarico. Inoltre, causano l’atrofia dell’endometrio, aumentano lo spessore del muco cervicale e compromettono la mobilità tubarica, contribuendo tutti insieme all’effetto contraccettivo. Sul mercato attuale, esiste una vasta gamma di COC che differiscono per tipo e dosaggio di progesterone ed estrogeno. I COC offrono numerosi benefici non contraccettivi, tra cui il sollievo dal dolore pelvico associato all’endometriosi, il trattamento dei segni correlati alla sindrome dell’ovaio policistico (acne e irsutismo) e la riduzione della dismenorrea, della menometrorragia e, conseguentemente, dell’anemia da carenza di ferro. Inoltre, riducono il rischio di cancro ovarico, del colon-retto e dell’endometrio, oltre a ridurre il rischio di patologia benigna al seno e di cisti ovariche (30-34).
Tuttavia, le malattie epatiche costituiscono una controindicazione per l’uso dei COC, pertanto non possono essere somministrati alle pazienti affette da ADPKD con coinvolgimento epatico (24). Uno studio recente ha infatti evidenziato un aumento del volume cistico epatico nelle donne in premenopausa affette da malattia epatica policistica in associazione con l’uso dei COC, con un incremento del 15,5% del volume epatico nel corso di 10 anni di utilizzo. In conclusione, è fortemente sconsigliato il loro utilizzo nelle pazienti affette da ADPKD con coinvolgimento epatico di malattia (35).
Anello vaginale contraccettivo
L’anello vaginale rappresenta un’opzione ormonale combinata con un meccanismo d’azione analogo a quello della pillola estroprogestinica e in particolare la soppressione dell’ovulazione. Questi dispositivi, composti da anelli di polimero plastico, rilasciano etinilestradiolo e il progestinico di terza generazione (etonogestrel), assorbendo direttamente gli ormoni attraverso la mucosa vaginale nella circolazione sanguigna sistemica. Vengono mantenuti in posizione per 21 giorni e rimossi per 7 giorni e, durante la settimana di interruzione, si verifica un sanguinamento endometriale. Gli effetti collaterali sono simili a quelli delle pillole contraccettive orali combinate (COC), compresi cefalea, sensibilità al seno, nausea, cambiamenti del tono dell’umore e secrezione vaginale (24,36,37). Le controindicazioni sono parimenti simili, incluse un BMI elevato, emicrania, anamnesi di trombosi venosa profonda, ipertensione e cancro al seno (24). Di particolare rilievo per questa review è la caratteristica chiave degli anelli vaginali: il loro assorbimento locale, che comporta un rischio inferiore di effetti avversi sistemici legati agli estrogeni. Tale assorbimento permette di bypassare il passaggio gastrointestinale ed epatico, mantenendo livelli stabili di estrogeni nel corso della giornata. Questa peculiare caratteristica rende gli anelli vaginali l’unica opzione ormonale che potrebbe essere considerata per le donne con ADPKD. Grazie al loro dosaggio ormonale sistemico inferiore, consegnato a livelli stabili e bypassando il metabolismo epatico, potrebbero rappresentare una possibilità di trattamento personalizzato e mirato in casi selezionati, sottoposti a un rigoroso follow-up (38).
Contraccettivi a base di solo progestinico (POP)
I contraccettivi a base di solo progestinico rappresentano un’alternativa più sicura rispetto ai tradizionali metodi che coinvolgono estrogeni esterni, come l’etinilestradiolo. Conosciuti come progestin-only pills (POP), sono ampiamente adottati per la loro natura non invasiva e la facilità di reversibilità come metodo contraccettivo. I POP agiscono inibendo l’ovulazione e modificando il muco cervicale. Il desogestrel 75 mg, somministrato in modo continuativo per 28 giorni, ha dimostrato risultati ottimali, con un tasso di inibizione dell’ovulazione del 99%. Questi farmaci sono considerati la scelta primaria per la contraccezione ormonale in specifiche categorie di pazienti, come le donne più anziane e le donne in fase di allattamento (39,40). A differenza delle pillole contraccettive combinate (COC), i POP possono essere utilizzati in sicurezza da donne con diagnosi di trombofilia. Tuttavia, alcune controindicazioni restano valide, come pazienti con malattia tromboembolica venosa, sanguinamento vaginale non indagato, malattia epatica grave e individui con tumori sensibili agli ormoni sessuali.
Studi hanno evidenziato che i tassi di inibizione dell’ovulazione sono simili tra i COC e i POP contenenti desogestrel. Inoltre, alcuni Autori considerano le pillole a base di solo progesterone come trattamento gold-standard per l’endometriosi (41). Per quanto riguarda le pazienti con sindrome dell’ovaio policistico (PCOS), mentre i COC rappresentano la terapia di elezione, i POP sono raccomandati solo in caso di controindicazioni ai COC, specialmente per le donne desiderose di contraccezione con sintomi correlati all’iperandrogenismo (42).
Considerando il profilo di sicurezza dei POP, in particolare per quanto riguarda il rischio trombotico e l’azione limitata del progesterone sul sistema renina-angiotensina-aldosterone, le pazienti con ADPKD senza coinvolgimento epatico possono trarre beneficio dal loro utilizzo. Tuttavia, è essenziale un bilancio accurato tra rischi e benefici, accompagnato da un consenso informato e da un rigoroso follow-up.
Transizione alla menopausa
La fase premenopausale rappresenta un periodo cruciale nella vita delle donne, caratterizzato da sintomi che possono impattare notevolmente sulla qualità della vita. Tradizionalmente, la terapia ormonale sostitutiva (HRT) è stata considerata il trattamento principale per la sintomatologia climaterica. Numerosi studi hanno dimostrato l’importanza di tale terapia anche per la riduzione del rischio di cancro del colon-retto, ma anche nel ridurre il rischio di osteoporosi (43,44). Attualmente, tutti i sintomi della menopausa possono essere affrontati con trattamenti personalizzati per ciascun sintomo (43,45-47). I sintomi vasomotori (VMS) possono essere parzialmente controllati da formulazioni naturali, anche se raramente sono efficaci, e la compliance delle pazienti è, di conseguenza, limitata. Altre evidenze dimostrano l’efficacia di un’attività fisica regolare nel ridurre le vampate di calore (48,49). L’atrofia vulvo-vaginale può essere trattata con unguenti e lubrificanti a base di acido ialuronico. La supplementazione di vitamina D è importante per la prevenzione dell’osteoporosi.
Tuttavia, recenti sviluppi nel campo della terapia medica stanno portando all’identificazione di nuove opzioni di trattamento. Un esempio significativo è il farmaco Fezolinet, un antagonista del recettore della neurochinina-3 (NK3R), approvato dalla FDA nel 2023 per il trattamento dei sintomi vasomotori. Questo rappresenta un’alternativa completamente non ormonale, ampliando le opzioni terapeutiche disponibili.
Inoltre, considerando la complessità della sindrome policistica dell’ovaio (ADPKD) e i potenziali rischi associati alla terapia ormonale, un approccio personalizzato è essenziale. Le opzioni non ormonali, come modifiche dello stile di vita, terapia comportamentale cognitiva e supplementazione di calcio e vitamina D, sono cruciali per gestire i sintomi e ridurre il rischio di osteoporosi, soprattutto considerando la compromissione renale associata all’ADPKD (50).
Questi progressi indicano una trasformazione nel trattamento dei sintomi della premenopausa, promuovendo un’attenzione maggiore verso approcci personalizzati e terapie non ormonali per migliorare la qualità della vita delle donne in questa fase della loro vita.
Conclusioni
In conclusione, la gestione della terapia ormonale e della contraccezione nelle pazienti con ADPKD richiede un approccio personalizzato, che enfatizzi l’assistenza individualizzata per ottimizzare i risultati riducendo al minimo i rischi. Per la contraccezione, gli IUD al rame rappresentano il gold-standard, mentre la terapia ormonale può essere presa in considerazione per la gestione dei sintomi, con una valutazione attenta dei suoi effetti sulla funzione epatica e renale. Gli anticoncezionali a base di solo progestinico e i dispositivi intrauterini con rilascio di levonorgestrel sono raccomandati per il dolore correlato all’endometriosi, mentre le pillole a base di solo progestinico (POP) o i contraccettivi orali combinati (COC) sono opzioni per la PCOS. L’anello vaginale potrebbe offrire un’opzione combinata estrogeno-progestinica più sicura. Per quanto riguarda la menopausa, il rapporto rischio-beneficio della terapia ormonale sostitutiva è discutibile, con alternative non ormonali come il Fezolinet che si presentano molto promettenti.
In conclusione, è fondamentale una valutazione personalizzata per adattare il trattamento alle esigenze individuali di ciascuna paziente affetta da ADPKD. Tuttavia, sono necessarie ulteriori ricerche per ottimizzare l’approccio alla terapia ormonale in queste pazienti. L’implementazione di strategie terapeutiche mirate però è, a nostro avviso, l’unica via percorribile atta a migliorare significativamente la gestione della malattia e la qualità della vita delle pazienti con ADPKD (Fig. 2).
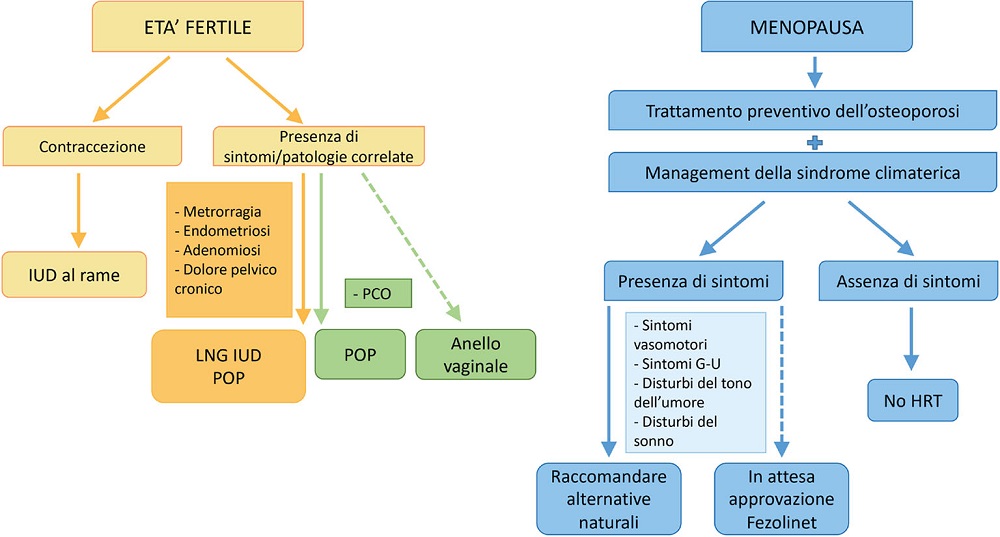
FIGURA 2 - Possibile algoritmo terapeutico.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Finnigan NA, Leslie SW. Polycystic Kidney Disease In Adults. 2023 Nov 4. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan. PubMed
- 2. Neugarten J, Acharya A, Silbiger SR. Effect of gender on the progression of nondiabetic renal disease: a meta-analysis. J Am Soc Nephrol. 2000;11(2):319-329. CrossRef PubMed
- 3. Liu J, Fujikura K, Dev H, et al. Pericardial Effusion on MRI in Autosomal Dominant Polycystic Kidney Disease. J Clin Med. 2022;11(4):1127. CrossRef PubMed
- 4. Harris PC, Torres VE. Polycystic Kidney Disease, Autosomal Dominant. 2002 Jan 10 [updated 2022 Sep 29]. In: Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2024. PubMed.
- 5. Coco D, Leanza S. Polycystic Kidney Disease and Polycystic Liver Disease Associated to Advanced Gastric Cancer: an External Complication of Potter III Disease. Maedica (Buchar). 2023;18(1):157-160. PubMed
- 6. Sherstha R, McKinley C, Russ P, et al. Postmenopausal estrogen therapy selectively stimulates hepatic enlargement in women with autosomal dominant polycystic kidney disease. Hepatology. 1997;26(5):1282-1286. PubMed
- 7. Chapman AB, Johnson AM, Gabow PA. Pregnancy outcome and its relationship to progression of renal failure in autosomal dominant polycystic kidney disease. J Am Soc Nephrol. 1994;5(5):1178-1185. CrossRef PubMed
- 8. Hewitt SC, Korach KS. Progesterone action and responses in the alphaERKO mouse. Steroids. 2000;65(10-11):551-557. CrossRef PubMed
- 9. Kolatorova L, Vitku J, Suchopar J, Hill M, Parizek A. Progesterone: A Steroid with Wide Range of Effects in Physiology as Well as Human Medicine. Int J Mol Sci. 2022;23(14):7989. CrossRef PubMed
- 10. Yager JD, Davidson NE. Estrogen carcinogenesis in breast cancer. N Engl J Med. 2006;354(3):270-282. CrossRef PubMed
- 11. Gava AL, Freitas FPS, Meyrelles SS, Silva IV, Graceli JB. Gender-dependent effects of aging on the kidney. Braz J Med Biol Res. 2011;44(9):905-913. CrossRef PubMed
- 12. Xue B, Johnson AK, Hay M. Sex differences in angiotensin II- and aldosterone-induced hypertension: the central protective effects of estrogen. Am J Physiol Regul Integr Comp Physiol. 2013;305(5):R459-R463. CrossRef PubMed
- 13. Komukai K, Mochizuki S, Yoshimura M. Gender and the renin-angiotensin-aldosterone system. Fundam Clin Pharmacol. 2010;24(6):687-698. CrossRef PubMed
- 14. Renke G, Kemen E, Scalabrin P, Braz C, Baesso T, Pereira MB. Cardio-Metabolic Health and HRT in Menopause: Novel Insights in Mitochondrial Biogenesis and RAAS. Curr Cardiol Rev. 2023;19(4):e060223213459. CrossRef PubMed
- 15. O’Donnell E, Floras JS, Harvey PJ. Estrogen status and the renin angiotensin aldosterone system. Am J Physiol Regul Integr Comp Physiol. 2014;307(5):R498-R500. CrossRef PubMed
- 16. Pechere-Bertschi A, Burnier M. Gonadal steroids, salt-sensitivity and renal function. Curr Opin Nephrol Hypertens. 2007;16(1):16-21. CrossRef PubMed
- 17. Heller HJ, Sakhaee K, Moe OW, Pak CYC. Etiological role of estrogen status in renal stone formation. J Urol. 2002;168(5):1923-1927. CrossRef PubMed
- 18. Conte C, Antonelli G, Melica ME, Tarocchi M, Romagnani P, Peired AJ. Role of Sex Hormones in Prevalent Kidney Diseases. Int J Mol Sci. 2023;24(9):8244. CrossRef PubMed
- 19. Howard SA, Benhabbour SR. Non-Hormonal Contraception. J Clin Med. 2023;12(14):4791. CrossRef PubMed
- 20. Bahamondes L, Fernandes A, Monteiro I, Bahamondes MV. Long-acting reversible contraceptive (LARCs) methods. Best Pract Res Clin Obstet Gynaecol. 2020;66:28-40. CrossRef PubMed
- 21. Hubacher D, Chen PL, Park S. Side effects from the copper IUD: do they decrease over time? Contraception. 2009;79(5):356-362. CrossRef PubMed
- 22. Horvath S, Schreiber CA, Sonalkar S. Contraception. 2018 Jan 17. In: Feingold KR, Anawalt B, Blackman MR, et al. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000. PubMed.
- 23. Hardeman J, Weiss BD. Intrauterine devices: an update. Am Fam Physician. 2014;89(6):445-450. PubMed
- 24. World Health Organization. Medical eligibility criteria for contraceptive use. 5th ed.; 2015. Online (Accessed March 2024)
- 25. RCOG/BSGE. Management of Endometrial Hyperplasia (Green-top Guideline No. 67). Online (Accessed March 2024)
- 26. ACOG Practice Bulletin No. ACOG Practice Bulletin No. 121: Long-acting reversible contraception: Implants and intrauterine devices. Obstet Gynecol. 2011;118(1):184-196. CrossRef PubMed
- 27. Alhamdan D, Bignardi T, Hardas G, Merkur H, Condous G. Mirena intra-uterine system: does it improve long term symptoms in women with chronic pelvic pain and/or endometriosis after laparoscopy? A multicentre randomized controlled trial. Rev Recent Clin Trials. 2010;5(3):143-146. CrossRef PubMed
- 28. Magalhaes J, Ferreira-Filho ES, Soares-Junior JM, Baracat EC. Uterine volume, menstrual patterns, and contraceptive outcomes in users of the levonorgestrel-releasing intrauterine system: A cohort study with a five-year follow-up. Eur J Obstet Gynecol Reprod Biol. 2022;276:56-62. CrossRef PubMed
- 29. Bahamondes L, Petta CA, Fernandes A, Monteiro I. Use of the levonorgestrel-releasing intrauterine system in women with endometriosis, chronic pelvic pain and dysmenorrhea. Contraception. 2007;75(6)(suppl):S134-S139. CrossRef PubMed
- 30. Kamani M, Akgor U, Gültekin M. Review of the literature on combined oral contraceptives and cancer. Ecancermedicalscience. 2022;16:1416. CrossRef PubMed
- 31. Grimes DA, Jones LB, Lopez LM, Schulz KF. Oral contraceptives for functional ovarian cysts. In: Grimes DA, ed. Cochrane Database of Systematic Reviews. John Wiley & Sons, Ltd; 2009. CrossRef
- 32. Barrionuevo P, Nabhan M, Altayar O, et al. Treatment Options for Hirsutism: A Systematic Review and Network Meta-Analysis. J Clin Endocrinol Metab. 2018;103(4):1258-1264. CrossRef PubMed
- 33. Iversen L, Sivasubramaniam S, Lee AJ, Fielding S, Hannaford PC. Lifetime cancer risk and combined oral contraceptives: the Royal College of General Practitioners’ Oral Contraception Study. Am J Obstet Gynecol. 2017;216(6):580.e1-580.e9. CrossRef PubMed
- 34. Dayal M, Barnhart KT. Noncontraceptive benefits and therapeutic uses of the oral contraceptive pill. Semin Reprod Med. 2001;19(4):295-303. CrossRef PubMed
- 35. Ahrendt HJ, Karckt U, Pichl T, Mueller T, Ernst U. The effects of an oestrogen-free, desogestrel-containing oral contraceptive in women with cyclical symptoms: results from two studies on oestrogen-related symptoms and dysmenorrhoea. Eur J Contracept Reprod Health Care. 2007;12(4):354-361. CrossRef PubMed
- 36. Harwood B, Mishell DR Jr. Contraceptive vaginal rings. Semin Reprod Med. 2001;19(4):381-390. CrossRef PubMed
- 37. Madden T, Blumenthal P. Contraceptive vaginal ring. Clin Obstet Gynecol. 2007;50(4):878-885. CrossRef PubMed
- 38. Lete I, Dueñas JL, Esplugues JV, Marti-Cabrera M. Is the vagina an adequate route for the administration of hormonal contraceptives? Curr Drug Metab. 2010;11(10):839-849. CrossRef PubMed
- 39. Milsom I, Korver T. Ovulation incidence with oral contraceptives: a literature review. J Fam Plann Reprod Health Care. 2008;34(4):237-246. CrossRef PubMed
- 40. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Cardiovascular disease and use of oral and injectable progestogen-only contraceptives and combined injectable contraceptives. Results of an international, multicenter, case-control study. Contraception. 1998;57(5):315-324. CrossRef PubMed
- 41. Casper RF. Introduction: A focus on the medical management of endometriosis. Fertil Steril. 2017;107(3):521-522. CrossRef PubMed
- 42. Spritzer PM, Motta AB, Sir-Petermann T, Diamanti-Kandarakis E. Novel strategies in the management of polycystic ovary syndrome. Minerva Endocrinol. 2015;40(3):195-212. PubMed
- 43. Cameron CR, Cohen S, Sewell K, Lee M. The Art of Hormone Replacement Therapy (HRT) in Menopause Management. J Pharm Pract. 2023 Apr 1:8971900231167925. CrossRef PubMed
- 44. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021;28(9):973-997. CrossRef PubMed
- 45. de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised Global Consensus Statement on Menopausal Hormone Therapy. Climacteric. 2016;19(4):313-315. CrossRef PubMed
- 46. Langer RD. The evidence base for HRT: what can we believe? Climacteric. 2017;20(2):91-96. CrossRef PubMed
- 47. Langer RD, Hodis HN, Lobo RA, Allison MA. Hormone replacement therapy – where are we now? Climacteric. 2021;24(1):3-10. CrossRef PubMed
- 48. Nilsson S, Henriksson M, Berin E, Engblom D, Holm AS, Hammar M. Resistance training reduced luteinising hormone levels in postmenopausal women in a substudy of a randomised controlled clinical trial: A clue to how resistance training reduced vasomotor symptoms. PLoS One. 2022;17(5):e0267613. CrossRef PubMed
- 49. Franco OH, Chowdhury R, Troup J, et al. Use of Plant-Based Therapies and Menopausal Symptoms: A Systematic Review and Meta-analysis. JAMA. 2016;315(23):2554-2563. CrossRef PubMed
- 50. Johnson KA, Martin N, Nappi RE, et al. Efficacy and Safety of Fezolinetant in Moderate to Severe Vasomotor Symptoms Associated With Menopause: A Phase 3 RCT. J Clin Endocrinol Metab. 2023;108(8):1981-1997. CrossRef PubMed