 |
G Clin Nefrol Dial 2023; 35: 51-57 ISSN 2705-0076 | DOI: 10.33393/gcnd.2023.2627 ORIGINAL ARTICLE |
 |
Influenza di genere e sesso nello sviluppo e nel decorso delle malattie renali
Gender and sex in the development and progression of renal diseases
Sex-based disparities in nephrology have been a historically understudied area.
In nephrology, gender differences exist with regard to the epidemiology, evolution and prognosis of chronic kidney disease (CKD). In some cases, these differences run contrary to the general population trends. We discuss such gender and sex disparities, including differing impact of traditional and novel risk factors, as well as hormonal factors, all of them potentially influencing propensity, progression and biochemical and psychological aspects of CKD. The factors involved in this gender disparity may include diet, kidney and glomerular size, differences in glomerular hemodynamics, and the direct effects of sex hormones.
The progression rate of many renal diseases is affected by sex. In polycystic kidney disease, membranous nephropathy, immunoglobulin A nephropathy, and “chronic renal disease of unknown etiology”, men progress at a faster rate to end-stage renal failure than women do. In many, but not all, animal models of renal disease, estrogens slow progression rate. Animal and experimental studies have tried to offer further mechanistic explanations for gender differences in disease progression. It has been suggested that the gender dimorphism of CKD progression may represent the effects of the interaction of circulating steroids with specific kidney receptors. Endogenous estrogens have in general been considered to have anti-fibrotic and anti-apoptotic effects on the kidney. On the other hand, the faster decline of kidney function in men has been attributed to the specific pro-apoptotic and pro-fibrotic properties of androgens.
Keywords: CKD, Estradiol, Gender, Renal disease progression, Testosterone
Received: July 3, 2023
Accepted: August 22, 2023
Published online: September 26, 2023
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2023. The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
In anni relativamente recenti è andata aumentando la consapevolezza che sesso e genere rappresentano determinanti di rilievo nell’insorgenza e nella progressione delle nefropatie, nel referral nefrologico, nella risposta e nell’aderenza alle terapie e infine per quanto riguarda gli esiti per il paziente. In molti Paesi con disuguaglianze di genere riguardanti il reddito, il grado di istruzione e di occupazione lavorativa, il genere femminile si associa inoltre a una disparità di accesso alle cure (1,2) e di possibilità di ricevere un trapianto (3,4). Sebbene i due termini sesso e genere vengano spesso usati in modo intercambiabile, in realtà rappresentano due entità concettualmente distinte. Secondo l’Organizzazione Mondiale della Sanità il sesso rappresenta un attributo biologico, che, a sua volta, include aspetti cromosomici, anatomici, ormonali e relativi recettori, mentre il genere riguarda aspetti comportamentali, culturali, psicologici, ruolo sociale, nonché la percezione soggettiva del sé. Quasi tutta la Letteratura nefrologica, derivante sia da studi preclinici sull’animale che da studi clinici, ha esaminato soprattutto le dicotomie legate alle differenze sessuali, mentre sono più limitate le conoscenze su come il genere possa influenzare il declino della funzione renale e gli outcomes. Inoltre, l’uso nella Letteratura scientifica di sesso e genere come se fossero sinonimi, così come l’uso indifferenziato di maschio/uomo o di femmina/donna, può aver generato dei bias nella successiva interpretazione dei risultati. In linea di massima si può affermare che gli aspetti legati al sesso, geneticamente determinato, e al relativo assetto ormonale modulano la patogenesi, la progressione e la risposta alla terapia, mentre le caratteristiche relative al genere condizionano il management non farmacologico, l’aderenza alle prescrizioni, la scelta della terapia sostitutiva e la disponibilità alla donazione del rene. Un ulteriore aspetto che sta emergendo nella Letteratura più recente riguarda le problematiche nefrologiche che possono insorgere nelle “minoranze sessuali e di genere” (5), per effetto degli interventi chirurgici come la gonadectomia, della terapia ormonale esogena (Gender Affirming Hormone Therapy, GAHT), dell’elevata prevalenza nelle persone LGBTQ+ di fattori di rischio per malattia renale cronica (CKD) come ipertensione, obesità e diabete (6,7), nonché delle barriere sociali e psicologiche che condizionano l’accesso e la tempestività delle cure (8).
In questo articolo verranno esaminate soprattutto le differenze legate alle influenze del sesso nel decorso di alcune nefropatie, poiché i dati relativi alle differenze di genere al momento sono più scarsi e non sempre distinguibili dalle modulazioni dovute al sesso.
Modulazione degli ormoni sessuali e fisiopatologia renale
Negli studi sperimentali esiste un dimorfismo legato al sesso che condiziona differenze funzionali e una maggiore propensione dei maschi a sviluppare patologie renali. Tuttavia, i risultati derivanti dall’animale non si possono completamente trasferire all’uomo, poiché per molti anni anche negli studi sperimentali si utilizzavano prevalentemente animali di sesso maschile e i modelli che sono stati adottati sono molto eterogenei (p. es., gonadectomia pre- oppure post-puberale, manipolazione ormonale a volte coerente con il sesso gonadico oppure cross-over). Molto verosimilmente nell’ambito delle malattie renali le differenze legate al sesso riconoscono influenze multifattoriali, dove, in misura diversa, entrano in gioco differenze strutturali, modulazioni degli ormoni sessuali e dei loro recettori sugli organi target tra cui il rene, fattori genetici ed epigenetici e stile di vita.
Differenze strutturali del rene
Nel genere umano e negli animali da esperimento, i maschi hanno reni di peso e volume superiore. Nei roditori, il peso del rene risente dell’azione degli androgeni che determina un aumentato sviluppo di tutto il tubulo (9). Nell’uomo, studi post-mortem hanno mostrato che il “driver” principale che governa il volume del rene e dei nefroni è rappresentato dalla superficie corporea e non dall’azione degli ormoni sessuali (10). Per quanto riguarda il numero dei nefroni, secondo alcuni Autori non vi sono differenze significative tra uomo e donna, mentre secondo altri nelle donne il patrimonio nefronico è ridotto del 15% circa (11); i maschi inoltre presentano un volume glomerulare aumentato, ma questa caratteristica non sembra geneticamente determinata, ma in funzione della massa corporea (10).
Effetti degli ormoni sessuali e dei loro recettori
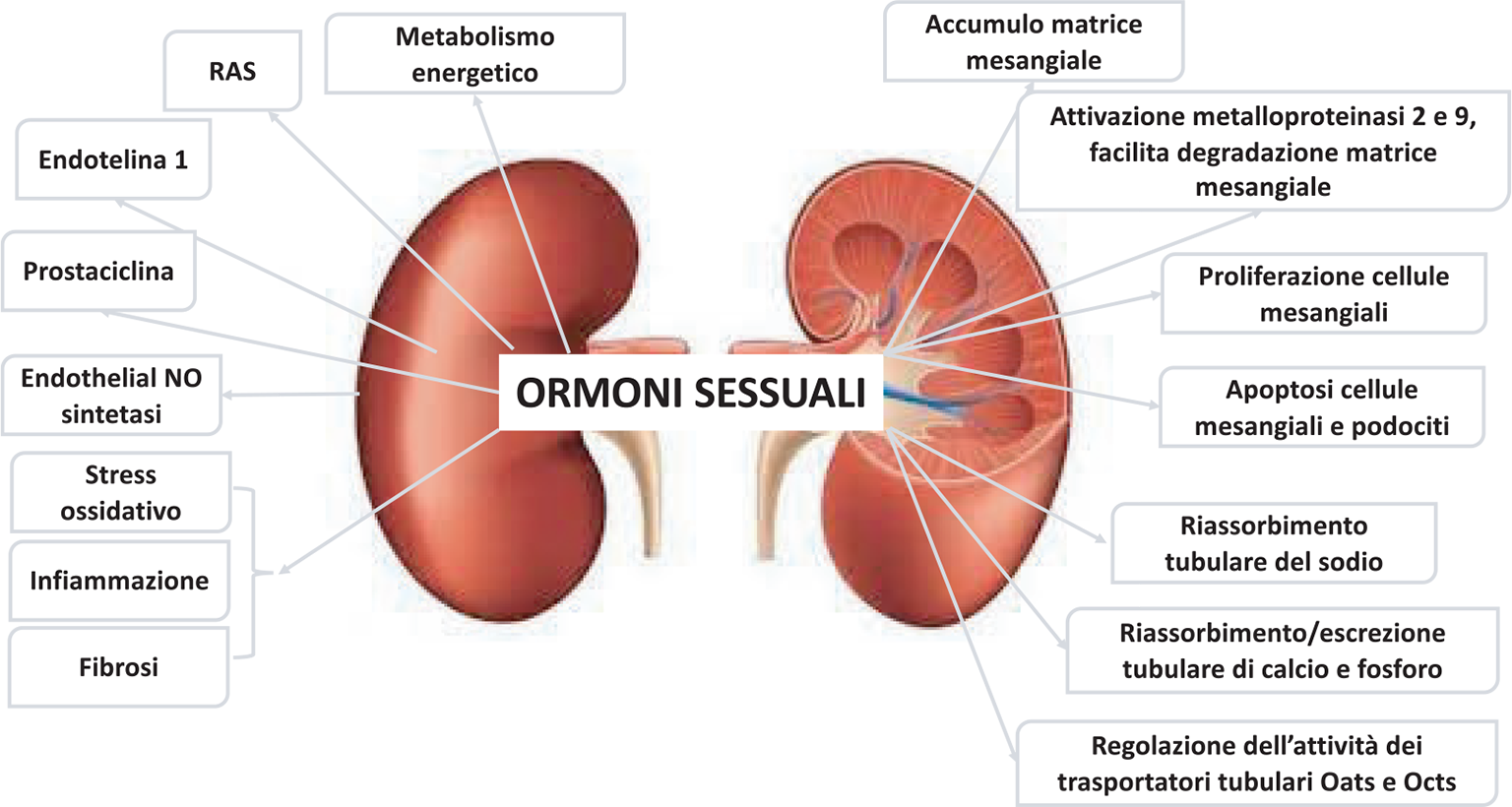
La funzione renale risente dell’effetto degli ormoni sessuali. Alterazioni nella loro secrezione/sintesi o nell’espressività dei recettori possono contribuire alla diversa progressione del danno o alle differenze nei processi riparativi del rene (11,12) (Fig. 1). Estrogeni, progesterone e androgeni esplicano il loro meccanismo d’azione attraverso due tipi di recettori: i) i recettori lenti citoplasmatici, che sono trascrizione-dipendenti e che vengono distinti in recettori degli estrogeni (ER), degli androgeni (AR) e del progesterone (PR); ii) i recettori rapidi di membrana (G protein-coupled estrogen receptor o GPER per gli estrogeni, GPRC6A per gli androgeni); questi sono trascrizione-indipendenti e agiscono in un tempo che va da pochi secondi a 10 minuti circa (13). Per ciascuno dei recettori lenti esistono due isoforme: i recettori degli estrogeni ERα ed ERβ, i recettori degli androgeni AR-A e AR-B e i recettori del progesterone PR-A e PR-B. Queste isoforme sono selettivamente espresse sugli organi target e attivano risposte specifiche. Nel rene sono stati identificati tre recettori per gli estrogeni ERα e ERβ e GPER30 (14). Gli steroidi sessuali interferiscono con molti meccanismi coinvolti nel danno renale, stimolando o inibendo la sintesi di varie citokine, dei fattori di crescita e di sostanze vaso-attive come l’angiotensinogeno, il Nitric Oxide (NO) e l’endotelina. Inoltre intervengono in alcuni processi cellulari come la proliferazione delle cellule mesangiali, l’accumulo di matrice e la sintesi di collagene (15). A livello delle cellule mesangiali, l’estradiolo sopprime la sintesi di collagene I e IV, attraverso un’interazione con il Transforming Growth Factor-β (TGF-β) (16); stimola le metalloproteinasi 2 e 9, enzimi capaci di degradare la matrice mesangiale. Le due azioni (riduzione della sintesi e aumentata digestione della matrice) concorrono a mitigare i processi di glomerulosclerosi (17). Nel ratto, gli estrogeni, sempre attraverso l’inibizione del TGF-β, rallentano l’apoptosi delle cellule mesangiali (15) e, in altri modelli, contrastano l’apoptosi dei podociti, mentre il testosterone, con un effetto recettore-mediato, promuove la perdita podocitaria (18). Concentrazioni fisiologiche di estrogeni nelle colture di cellule glomerulari e di cellule dell’endotelio vascolare sono in grado di stimolare la sintesi di NO attraverso i recettori ERα, così come incrementano il release locale di prostaciclina, che a sua volta stimola l’attività della endothelial-NO sintetasi (19). Gli ormoni sessuali si intersecano anche con il sistema renina angiotensina (RAS) a più livelli (Tab. I). Gli estrogeni esercitano una down-regolazione sull’espressione della renina, dell’enzima di conversione (ACE) e dell’angiotensina II (AII), mentre aumentano l’angiotensinogeno (20); a livello della midollare renale aumentano la densità dei recettori AT2 dell’angiotensina II e riducono la densità dei recettori AT1 nel rene e nelle miofibrocellule vascolari, con effetti benefici sul riassorbimento del sodio e sulla vasocostrizione. Al contrario, il testosterone esplica sul RAS azioni di segno opposto (20), promuovendo l’attivazione del RAS, l’aumento dei recettori AT1 e la vasocostrizione sull’arteriola efferente (17). I recettori degli androgeni sono espressi anche su miocardiociti e fibrocellule muscolari lisce (21) e nel rene sulle cellule mesangiali, sull’endotelio glomerulare e sulle cellule del tubulo prossimale e del collettore, indicando la possibilità di azioni dirette intra-renali. Attraverso un meccanismo AII-mediato viene incrementato il riassorbimento prossimale del sodio, responsabile a sua volta di un aumento dei valori pressori. Nell’uomo esiste il riscontro che i livelli di prorenina, di renina e di attività reninica plasmatica sono più elevati rispetto alla donna (22). Il testosterone può quindi promuovere il danno renale modificando l’emodinamica intra-renale attraverso lo stimolo di produzione dell’AII e, attraverso uno stimolo sull’endotelina, contribuisce ulteriormente alla vasocostrizione e a promuovere lo stress ossidativo e la fibrosi (17) (Fig. 1). Attraverso questi effetti sul RAS, estrogeni e testosterone possono modificare l’emodinamica intra-renale e contribuire al dimorfismo di genere osservato sia nelle malattie renali che nell’ipertensione arteriosa. Anche se non tutti i dati osservati nell’animale sono coerenti con quanto avviene nell’uomo e anche se le conclusioni non risultano univoche, la maggior parte delle evidenze indica anche nella specie umana che essere donna (in età fertile) conferisce un vantaggio, per effetti diretti sulla biologia renale (17) e indirettamente attraverso gli effetti di cardio-protezione (13). Tuttavia, occorre tenere presente che nelle persone affette da CKD, uomini e donne sperimentano una condizione di ipogonadismo, con livelli ormonali ridotti rispetto ai soggetti sani (13). Tutto questo potrebbe suggerire che gli ormoni sessuali, e in particolare gli androgeni, non hanno un ruolo causale nell’iniziare il danno, ma solamente di tipo permissivo, così come si può ipotizzare che la ridotta sintesi di androgeni rappresenti un meccanismo compensatorio per limitare l’estensione ulteriore del danno. Gli effetti negativi legati a una riduzione degli ormoni circolanti e in particolare del testosterone non si limitano alle conseguenze sull’apparato riproduttivo e ai meccanismi di progressione, ma si estendono alle complicanze della CKD come l’anemia, la ridotta risposta all’eritropoietina, la mineralizzazione ossea e la comparsa di sarcopenia (13).
| Effetto | Estradiolo | Progesterone | Testosterone/DHT |
|---|---|---|---|
| Angiotensina II | riduzione | riduzione? | aumento |
| Recettori AT1 | riduzione densità | ? | aumento |
| Recettori AT2 | aumento densità | aumento densità | riduzione |
| Endotelina 1 | riduzione | ? | aumento |
| Endothelial-NO sintetasi | aumento | ? | riduzione |
| Stress ossidativo | anti-ossidante | anti-ossidante | pro-ossidante |
| Arteriola afferente | ↓ vasodilatazione | ? | ↑ vasodilatazione |
| Effetto vasomotorio | vasodilatatorio | vasocostrittore | vasocostrittore |
| Riassorbimento tubulare del sodio | riduzione | aumento | aumento |
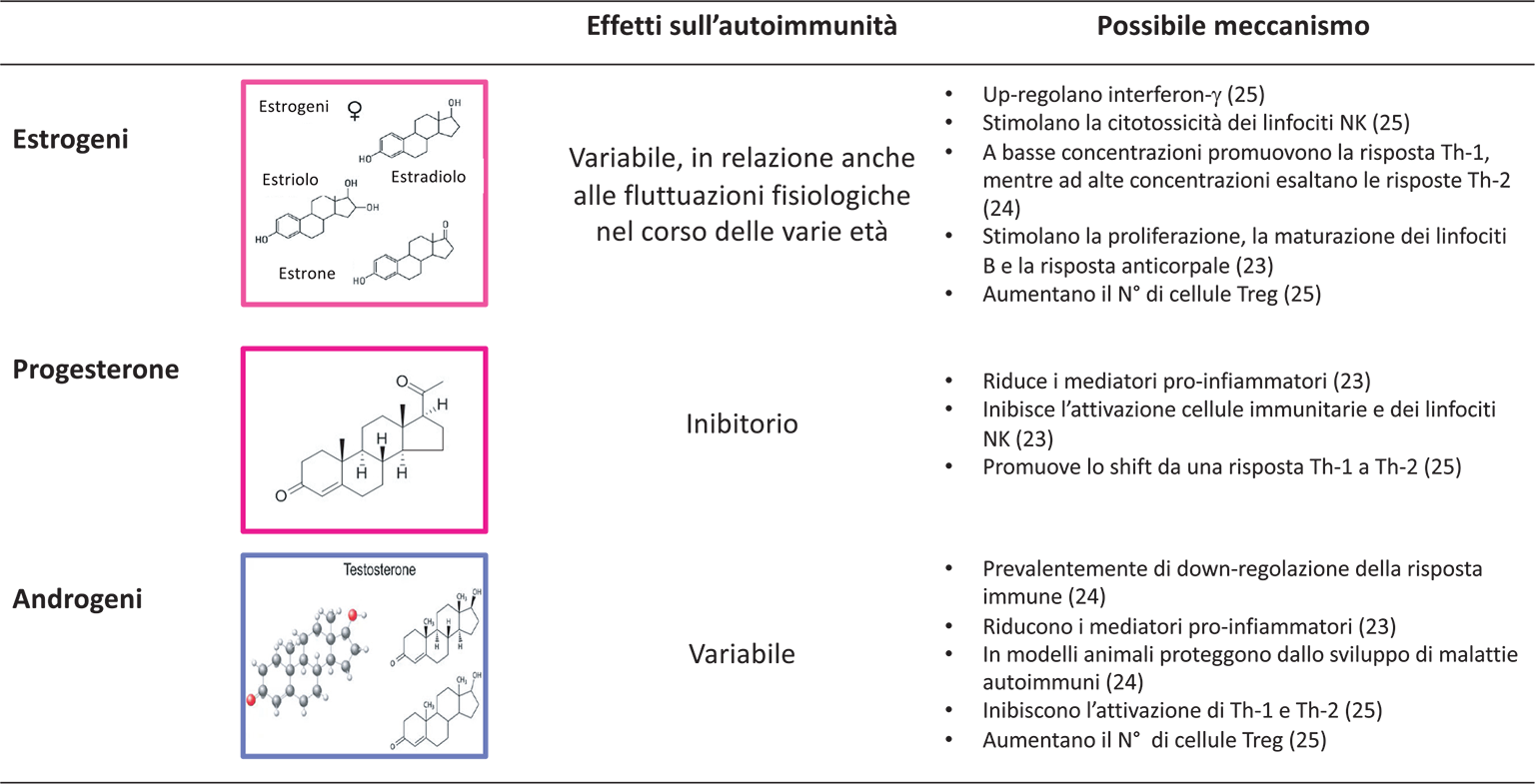
Gli ormoni sessuali interferiscono anche con l’immunità innata e adattativa e i loro rispettivi recettori sono variamente presenti sulle cellule immunocompetenti (23,24) (Fig. 2). I recettori ERα sono largamente espressi sulle cellule T e aumentano la produzione di autoanticorpi. I recettori ERβ up-regolano le cellule B. Complessivamente androgeni e progesterone hanno effetti immunomodulatori e immunosoppressivi, mentre gli estrogeni, sia nell’uomo che nella donna, promuovono l’immunità umorale (25) con effetti di immunostimolazione e di promozione dell’autoimmunità (25). Negli Stati Uniti le malattie autoimmuni per l’80% sono appannaggio delle donne (23). Anche per quanto riguarda l’interazione tra ormoni sessuali e sistema immunitario è possibile ipotizzare che estrogeni e testosterone non rappresentino il primum movens per innescare una patologia autoimmune o da dis-regolazione immunitaria, ma che svolgano prevalentemente un ruolo favorente/permissivo.
Dicotomie di sesso e genere nell’epidemiologia e nella progressione delle malattie renali
Gli studi di popolazione che misurano la prevalenza della CKD in varie aree geografiche del mondo, utilizzando la stima del filtrato glomerulare (eGFR) in combinazione o meno con il rapporto albuminuria/creatininuria (UACr), concludono in maniera uniforme che negli stadi CKD 1-5, non in dialisi, vi è una netta prevalenza delle donne (26,27). Questo dato contraddice le informazioni provenienti dai Registri di dialisi, compreso il Registro italiano, in cui circa il 60% dei pazienti incidenti in terapia sostitutiva è rappresentato da maschi (28) e anche il riscontro di una maggiore prevalenza delle glomerulonefriti nei maschi (29,30) (Tab. II). Inoltre, è in conflitto con i presupposti biologici, che indicano un effetto protettivo degli estrogeni (17). Diversi motivi possono spiegare tale discrepanza: a) il vantaggio di sopravvivenza delle donne, associato a un più lento declino della funzione renale, va ad ampliare la platea delle donne affette da CKD; b) un bias nelle stime, dovuto all’uso dell’eGFR, che porta a sovra-diagnosticare l’insufficienza renale. Infatti, le equazioni di calcolo per l’eGFR, pur contenendo dei correttivi per il sesso, nelle donne sottostimano il reale valore del filtrato glomerulare. L’utilizzo di un unico valore soglia per definire l’insufficienza renale (eGFR < 60 mL/min per 1,73 m2) senza correttivi per sesso ed età e di un unico valore di UACr, che non tiene conto della differente escrezione urinaria di creatinina, aumenta il rischio di sovradimensionare la prevalenza di CKD nelle donne (31). Nelle coorti di pazienti con CKD non dialitica in carico agli ambulatori nefrologici, contrariamente agli studi di popolazione, solo un terzo circa è rappresentato da donne (32,33,34), verosimilmente per un ritardo nel riconoscimento della malattia e nell’invio alle cure specialistiche.
La relazione tra progressione del danno renale e sesso è più complessa, poiché, oltre ai fattori biologici, entrano in gioco anche fattori più strettamente legati al genere, come un maggiore consumo di carne negli uomini o la maggiore difficoltà nel ridurre l’introito di sale. Numerosi studi retrospettivi e prospettici, così come alcune meta-analisi (30,35), in modo uniforme hanno mostrato che nei maschi il declino della funzione renale è più rapido e aumenta il rischio di fabbisogno dialitico (36). Esistono dati che contraddicono tale affermazione. Infatti, la meta-analisi di Jafar, che comprende 11 trial clinici randomizzati, volti a valutare l’effetto degli ACE-inibitori e in cui la maggior parte delle donne si trova in età post-menopausa, mostra una progressione più rapida nelle donne (37).
| Malattia | Maschi:Femmine | Annotazioni |
|---|---|---|
| Nefropatia da IgA | 2:1 (fino 6:1) | Nelle donne clearance più efficiente di molecole con glicosilazione alterata; assenza di differenze di genere nella prognosi a lungo termine |
| Glomerulosclerosi Segmentaria Focale | 3-4:1 | Negli uomini i valori di proteinuria sono più elevati; raggiungono in minore misura rispetto alle donne una remissione completa e la recidiva di GSSF post-trapianto si riscontra più di frequente |
| GN Membranosa | 2:1 | Le donne raggiungono in maggior numero la remissione completa della proteinuria |
| Nefropatia Diabetica (DMT2) | 2:1 | Negli uomini progressione più rapida nel passaggio da DKD a CKD e all’ESKD rispetto alle donne in età fertile |
| Lupus (giovani) | 1:15 | Negli uomini con LES, forme istologiche più severe e più rapido declino funzionale renale; nessuna differenza nella mortalità |
| GN da anti-GBM | – | Diversa presentazione clinica: le donne giovani, fumatrici spesso hanno solo il quadro polmonare senza coinvolgimento del rene; assenza di differenze di genere nella prognosi a lungo termine |
| Calcolosi renale | 3:1 | |
| Pielonefrite acuta (pazienti ricoverati) | 1:3 | |
| Pielonefrite acuta (pazienti ambulatoriali) | 1:10 | |
| Rene policistico dell’adulto | Le donne raggiungono la fase di ESKD con fabbisogno dialitico a un’età superiore rispetto agli uomini, che viceversa presentano un più rapido declino funzionale | |
| Nefropatia da analgesici | Quasi esclusivamente nel sesso femminile |
Differenze di sesso e genere nelle glomerulonefriti
I diversi tipi di glomerulonefrite (GN) hanno meccanismi fisiopatologici distinti, ma tutti riconducibili a un’alterata risposta del sistema immunitario, che a sua volta può essere diversamente influenzata dagli ormoni sessuali (23,24). Il gioco che sottende alla relazione tra immunità e ormoni sessuali è molto complesso, con risposte che possono essere di segno opposto nelle patologie prevalentemente associate a una risposta Th-1 rispetto a quanto avviene nelle patologie associate a una risposta anticorpo-mediata (Th-2-associata) (Fig. 2). In questo scenario molto articolato si può inserire la gravidanza, che in molti casi può slatentizzare o riattivare una patologia autoimmune come il Lupus o, in altre GN, può accelerare la perdita di funzione renale. Vari studi hanno documentato che le GN primitive sono nettamente prevalenti nel sesso maschile, senza significative distinzioni geografiche (Tab. II). In realtà non siamo certi che ciò rispecchi la prevalenza reale o piuttosto che non rappresenti la conseguenza di un diverso accesso alle cure e all’indagine bioptica. La GN da depositi di IgA mesangiali (IgAN) ha un rapporto M:F che risente dell’area geografica; infatti in Asia orientale il rapporto M:F è di 1,4:1, mentre in Europa e negli Stati Uniti il rapporto sale a 6:1 (29), a indicare un ruolo aggiuntivo di fattori genetici e ambientali. Uno studio condotto su 52 pazienti con IgAN e 10 controlli sani (38) ha mostrato che le donne hanno maggiori capacità di effettuare la clearance di molecole con glicosilazione alterata e questo potrebbe giustificare la minore prevalenza della IgAN nelle donne. È ancora oggetto di discussione se nei pazienti con IgAN vi sia tra uomini e donne una dicotomia nella progressione verso l’End Stage Kidney Disease (ESKD), come veniva ipotizzato all’inizio degli anni 2000 (35). Uno studio cinese più recente, che comprende 988 pazienti, di cui i maschi al baseline hanno caratteristiche isto-morfologiche più severe e una funzione renale peggiore, a lungo termine non dimostra differenze di sopravvivenza del rene (39). Nei maschi inoltre è presente una stretta correlazione tra alto score istologico Oxford MEST e maggiore velocità di progressione (40). Anche la GN membranosa presenta nell’uomo una prevalenza doppia e un outcome più severo (30,35). La migliore sopravvivenza del rene rilevata nelle donne è attribuibile a valori di proteinuria e di pressione arteriosa più bassi, sia al baseline che durante tutto il periodo di follow-up (30). Le donne più facilmente ottengono con la terapia una remissione completa e presentano un minor numero di recidive (30). La glomerulonefrite a lesioni minime e la glomerulosclerosi segmentaria e focale (GSSF) rientrano nel capitolo delle podocitopatie e rappresentano un continuum della stessa malattia, anche se, clinicamente, hanno comportamenti diversificati. Nell’ambito della GN a lesioni minime non si rilevano differenze di presentazione clinica tra uomini e donne, nella risposta alla terapia e nel numero di episodi di recidiva (41). Nella GSSF il rapporto M:F è pari a 1,5; nei maschi si manifesta con proteinuria più elevata e una minore propensione a ottenere la remissione della proteinuria (30), così come più frequentemente presentano recidive post-trapianto (42). La GN da anticorpi anti-membrana basale (anti-GBM) è una patologia rara che quasi sempre si presenta come sindrome reno-polmonare e con l’andamento clinico di una forma rapidamente progressiva (RP). Nelle prime descrizioni sembrava appannaggio di giovani maschi adulti, mentre nelle descrizioni più recenti non è stata riscontrata una diversa distribuzione tra i due sessi. La sintomatologia clinica può variare in base a sesso, età e abitudine al fumo: i maschi giovani e fumatori presentano la classica forma reno-polmonare con emoftoe e GN-RP, mentre nelle giovani donne fumatrici è stato descritto il solo interessamento polmonare, senza glomerulonefrite. Nei pazienti adulti e anziani non sono descritte differenze di manifestazioni cliniche (43).
Considerazioni conclusive
Esistono dati epidemiologici e sperimentali che mostrano una prevalenza e una modalità di presentazione e di decorso clinico diverse tra maschi e femmine in molte nefropatie. Gli studi sperimentali hanno consentito di formulare ipotesi plausibili per spiegare tale dimorfismo, riconoscendo alla base delle differenze un ruolo degli ormoni sessuali, dei loro recettori e di differenti meccanismi biologici. La maggior parte delle conoscenze attuali fa riferimento a fattori collegati al sesso, ma certamente anche le differenze di genere, più legate a fattori socio-ambientali, culturali e di stile di vita entrano in gioco e hanno un peso nel condizionare gli esiti.
Disclosures
Conflict of interest: The author declares no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. García GG, Iyengar A, Kaze F, Kierans C, Padilla-Altamira C, Luyckx VA. Sex and gender differences in chronic kidney disease and access to care around the globe. Semin Nephrol. 2022;42(2):101-113. CrossRef PubMed
- 2. Carrero JJ, Hecking M, Ulasi I, Sola L, Thomas B. Chronic Kidney Disease, Gender, and Access to Care: A Global Perspective. Semin Nephrol. 2017;37(3):296-308. CrossRef PubMed
- 3. Katz-Greenberg G, Shah S. Sex and Gender Differences in Kidney Transplantation. Semin Nephrol. 2022;42(2):219-229. CrossRef PubMed
- 4. Wolfe RA, Ashby VB, Milford EL, et al. Differences in access to cadaveric renal transplantation in the United States. Am J Kidney Dis. 2000;36(5):1025-1033. CrossRef PubMed
- 5. Rolón L, Hsu RK. Adding CKD to the Alphabet Soup: A Snapshot of Kidney Health in the LGBTQ+ Population. J Am Soc Nephrol. 2023;34(4):523-525. CrossRef PubMed
- 6. Caceres BA, Sharma Y, Doan D. Hypertension risk in sexual and gender minority individuals. Expert Rev Cardiovasc Ther. 2022;20(5):339-341. CrossRef
- 7. Beach LB, Elasy TA, Gonzales G. Prevalence of Self-Reported Diabetes by Sexual Orientation: Results from the 2014 Behavioral Risk Factor Surveillance System. LGBT Health. 2018;5(2):121-130. CrossRef PubMed
- 8. Mohottige D, Lunn MR. Ensuring Gender-Affirming Care in Nephrology: Improving Care for Transgender and Gender-Expansive Individuals. Clin J Am Soc Nephrol. 2020;15(8):1195-1197. CrossRef PubMed
- 9. Lane PH. Estrogen receptors in the kidney: lessons from genetically altered mice. Gend Med. 2008;5(suppl A):S11-S18. CrossRef PubMed
- 10. Neugarten J, Kasiske B, Silbiger SR, Nyengaard JR. Effects of sex on renal structure. Nephron J. 2002;90(2):139-144. CrossRef PubMed
- 11. Ciarambino T, Crispino P, Giordano M. Gender and Renal Insufficiency: Opportunities for Their Therapeutic Management? Cells. 2022;11(23):382. CrossRef PubMed
- 12. Conte C, Antonelli G, Melica ME, Tarocchi M, Romagnani P, Peired AJ. Role of Sex Hormones in Prevalent Kidney Diseases. Int J Mol Sci. 2023;24(9):8244. CrossRef PubMed
- 13. Valdivielso JM, Jacobs-Cachá C, Soler MJ. Sex hormones and their influence on chronic kidney disease. Curr Opin Nephrol Hypertens. 2019;28(1):1-9. CrossRef PubMed
- 14. Brar A, Markell M. Impact of gender and gender disparities in patients with kidney disease. Curr Opin Nephrol Hypertens. 2019;28(2):178-182. CrossRef PubMed
- 15. Neugarten J, Golestaneh L. Gender and the prevalence and progression of renal disease. Adv Chronic Kidney Dis. 2013;20(5):390-395. CrossRef PubMed
- 16. Zdunek M, Silbiger S, Lei J, Neugarten J. Protein kinase CK2 mediates TGF-beta1-stimulated type IV collagen gene transcription and its reversal by estradiol. Kidney Int. 2001;60(6):2097-2108. CrossRef PubMed
- 17. Neugarten J, Golestaneh L. Influence of sex on the progression of Chronic kidney disease. Mayo Clin Proc. 2019;94(7):1339-1356. CrossRef PubMed
- 18. Doublier S, Lupia E, Catanuto P, et al. Testosterone and 17β-estradiol have opposite effects on podocyte apoptosis that precedes glomerulosclerosis in female estrogen receptor knockout mice. Kidney Int. 2011;79(4):404-413. CrossRef PubMed
- 19. Neugarten J, Silbiger SR, Golestaneh L. Gender and kidney disease. In: Brenner BM, ed. Brenner and Rector’s The Kidney. 9th ed. Elsevier; 2008:674-680.
- 20. Kang AK, Miller JA. Effects of gender on the renin-angiotensin system, blood pressure, and renal function. Curr Hypertens Rep. 2002;4(2):143-151. CrossRef PubMed
- 21. Hu J, Tan S, Zhong Y. Effects of testosterone on renal function in salt-loaded rats. Am J Med Sci. 2011;342(1):38-43. CrossRef PubMed
- 22. James GD, Sealey JE, Müller F, Alderman M, Madhavan S, Laragh JH. Renin relationship to sex, race and age in a normotensive population. J Hypertens Suppl. 1986;4(5):S387-S389. PubMed
- 23. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol. 2016;16(10):626-638. CrossRef PubMed
- 24. Sciarra F, Campolo F, Franceschini E, Carlomagno F, Venneri MA. Gender-Specific Impact of Sex Hormones on the Immune System. Int J Mol Sci. 2023;24(7):6302. CrossRef PubMed
- 25. Moulton VR. Sex Hormones in acquired immunity and autoimmune disease. Front Immunol. 2018;9:2279. CrossRef PubMed
- 26. Mills KT, Xu Y, Zhang W, et al. A systematic analysis of worldwide population-based data on the global burden of chronic kidney disease in 2010. Kidney Int. 2015;88(5):950-957. CrossRef PubMed
- 27. Carrero JJ, Hecking M, Chesnaye NC, Jager KJ. Sex and gender disparities in the epidemiology and outcomes of chronic kidney disease. Nat Rev Nephrol. 2018;14(3):151-164. CrossRef PubMed
- 28. Kramer A, Boenink R, Stel VS, et al. The ERA-EDTA Registry Annual Report 2018: a summary. Clin Kidney J. 2020;14(1):107-123. CrossRef PubMed
- 29. Suzuki Y, Monteiro RC, Coppo R, Suzuki H. The Phenotypic Difference of IgA Nephropathy and its Race/Gender-dependent Molecular Mechanisms. Kidney360. 2021;2(8):1339-1348. CrossRef PubMed
- 30. Cattran DC, Reich HN, Beanlands HJ, Miller JA, Scholey JW, Troyanov S; Genes, Gender and Glomerulonephritis Group. The impact of sex in primary glomerulonephritis. Nephrol Dial Transplant. 2008;23(7):2247-2253. CrossRef PubMed
- 31. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7-11. CrossRef PubMed
- 32. Chesnaye NC, Dekker FW, Evans M, et al. Renal function decline in older men and women with advanced chronic kidney disease-results from the EQUAL study. Nephrol Dial Transplant. 2021;36(9):1656-1663. CrossRef PubMed
- 33. Santoro A, Gibertoni D, Rucci P, et al. The PIRP project (Prevenzione Insufficienza Renale Progressiva): how to integrate hospital and community maintenance treatment for chronic kidney disease. J Nephrol. 2019;32(3):417-427. CrossRef PubMed
- 34. Swartling O, Rydell H, Stendahl M, Segelmark M, Trolle Lagerros Y, Evans M. CKD Progression and Mortality Among Men and Women: A Nationwide Study in Sweden. Am J Kidney Dis. 2021;78(2):190-199.e1. CrossRef PubMed
- 35. Neugarten J, Acharya A, Silbiger SR. Effect of gender on the progression of nondiabetic renal disease: a meta-analysis. J Am Soc Nephrol. 2000;11(2):319-329. CrossRef PubMed
- 36. Ricardo AC, Yang W, Sha D, et al; CRIC Investigators. Sex-Related Disparities in CKD Progression. J Am Soc Nephrol. 2019;30(1):137-146. CrossRef PubMed
- 37. Jafar TH, Schmid CH, Stark PC, et al. The rate of progression of renal disease may not be slower in women compared with men: a patient-level meta-analysis. Nephrol Dial Transplant. 2003;18(10):2047-2053. CrossRef PubMed
- 38. Nakamura I, Iwase H, Arai K, et al. Detection of gender difference and epitope specificity of IgG antibody activity against IgA1 hinge portion in IgA nephropathy patients by using synthetic hinge peptide and glycopeptide probes. Nephrology (Carlton). 2004;9(1):26-30. CrossRef PubMed
- 39. Deng W, Tan X, Zhou Q, et al. Gender-related differences in clinicopathological characteristics and renal outcomes of Chinese patients with IgA nephropathy. BMC Nephrol. 2018;19(1):31. CrossRef PubMed
- 40. Riispere Ž, Laurinavičius A, Kuudeberg A, et al. IgA nephropathy clinicopathologic study following the Oxford classification: progression peculiarities and gender-related differences. Medicina (Kaunas). 2016;52(6):340-348. CrossRef PubMed
- 41. Lee H, Yoo KD, Oh YK, et al. Predictors of Relapse in Adult-Onset Nephrotic Minimal Change Disease. Medicine (Baltimore). 2016;95(12):e3179. CrossRef PubMed
- 42. Moroni G, Gallelli B, Quaglini S, Banfi G, Montagnino G, Messa P. Long-term outcome of renal transplantation in adults with focal segmental glomerulosclerosis. Transpl Int. 2010;23(2):208-216. CrossRef PubMed
- 43. Beckwith H, Lightstone L, McAdoo S. Sex and gender in Glomerular disease. Semin Nephrol. 2022;42(2):185-196. CrossRef PubMed