 |
G Clin Nefrol Dial 2023; 35: 1-8 ISSN 2705-0076 | DOI: 10.33393/gcnd.2023.2509 ORIGINAL ARTICLE |
 |
Health Technology Assessment in nefrologia e dialisi
Health Technology Assessment in nephrology and dialysis
The nephrology and dialysis sector is characterized by a high technological content, considerable technological and digital complexity, continuous innovation within the care processes and a strong economic impact on the national and regional health system. The purpose of this article is to illustrate the application of the Health Technology Assessment (HTA) methodology in the evaluation of technological innovations in the nephrology and dialysis field. In particular, the evaluation steps of the multidimensional and multidisciplinary process applied to the nephrodialysis field will be described, specifically a device to be used in patients with chronic kidney disease, also considering important comorbidities such as cardiomyopathies and arrhythmias, which often require implantation of electronic cardiac implantable devices in renal patients. The HTA uses a rigorous scientific methodology, and today represents an essential tool for a governance of the modern health system, in which every innovative technological element that significantly modifies the organization must be evaluated. For this strategic reason, HTA becomes an important intervention for the dialysis sector, where technological innovations are a fundamental sector. For a precise understanding of the function of HTA in dialysis, a complete example of the application of HTA for the evaluation of a resorbable antibacterial device for the prevention of infections from cardiac implantable electronic devices on patients with high infectious risk has been shown, such as patients with chronic kidney disease.
Keywords: Dialysis, Digital health, Governance, Health Technology Assessment, Innovation, Nephrology
Received: October 24, 2022
Accepted: January 18, 2023
Published online: February 9, 2023
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Nel corso degli anni, la Health Technology Assessment (HTA) ha esteso e incluso le prospettive dei pazienti, le dimensioni organizzative e altri aspetti sociali nel processo di valutazione concettuale e metodologica dei risultati clinici e del rapporto costo-efficacia dei farmaci (1,2). In parallelo, il ruolo della tecnologia nell’assistenza sanitaria si è gradualmente esteso da un orientamento biomedico a un approccio più olistico, che include dispositivi medici come strumenti di imaging, robotica e soluzioni sanitarie digitali.
La problematica strategica che emerge è legata ai processi di valutazione, vale a dire stabilire quali siano le metodologie scientifiche di valutazione sistematica dei servizi di sanità elettronica e tecnologica, capaci di produrre informazioni utili e di supporto per il processo decisionale a livello della politica sanitaria e della pratica clinica prima della loro implementazione sul campo assistenziale (3). Questa tematica è influenzata anche dalla rapida evoluzione delle proprietà tecnologiche e dai sistemi e dai processi di interconnessione tra le tecnologie sanitarie e gli aspetti comportamentali, culturali e organizzativi (4) ed è ad essi connessa.
Le tecnologie sanitarie producono un impatto a livello ambientale, dell’ecosistema, dell’economia sanitaria e delle pratiche ingegneristiche sanitarie ed è in questo contesto che la HTA con i suoi framework sviluppa metodi e processi orientati alla trasparenza, alla ripetibilità e all’integrazione con il sistema sanitario (5).
La HTA Core Model® è un framework metodologico per la produzione e la condivisione delle informazioni della HTA. Il modello è strutturato su tre componenti, ognuna delle quali ha uno specifico scopo:
1) un set standardizzato di domande di HTA che consente agli utenti di definire specifiche domande di ricerca all’interno di una struttura gerarchica;
2) una guida metodologica che supporta nella formulazione delle domande di ricerca;
3) un reporting strutturato per la presentazione dei risultati attraverso un format standardizzato (6).
La HTA interessa svariati settori della sanità: 1) epidemiologico, con un’analisi sulla significatività epidemiologica della condizione clinica interessata; 2) clinico, con aspetti connessi agli outcome clinici tra cui l’efficacia, il benessere e la sicurezza; 3) tecnico, con aspetti legati alle caratteristiche tecniche del servizio; 4) economico, con gli aspetti di costo e rapporto costo-efficacia; 5) organizzativo, con gli aspetti di natura organizzativa quali formazione, risorse, procedure; 6) etico e legale, collegati sia ai benefici attesi in termini di qualità di vita e sostenibilità delle cure sia ad aspetti legali come la protezione dei dati; 7) bisogni, con tutti quegli aspetti che definiscono i bisogni degli stakeholder rispetto al servizio tecnologico sanitario oggetto di valutazione.
Conseguentemente, la metodologia HTA trova campi utili di applicazione nei più svariati ambiti clinico-assistenziali, soprattutto in quei settori caratterizzati da elevato contenuto tecnologico, notevole complessità e necessità di innovazione all’interno dei processi di cura e da un forte impatto economico sul Sistema Sanitario Nazionale e Regionale.
Il settore della nefrologia e della dialisi racchiude tutti questi aspetti in quanto, da un lato, i trattamenti sostitutivi della funzione renale sono molteplici e in costante evoluzione tecnologica con costi in continua espansione e, dall’altro, il paziente nefropatico costituisce il tipico esempio di cronicità della malattia che richiede una strutturazione adeguata e innovativa dei processi di cura (7). Infatti, in considerazione dell’elevato numero di soggetti a rischio di contrarre e sviluppare una malattia renale cronica (MRC) e della consapevolezza che le velocità di progressione sono estremamente variabili, è necessario valutare l’introduzione di nuovi modelli assistenziali che permettano di intercettare un gran numero di pazienti assegnando a ognuno un grado di sorveglianza appropriato (8). Inoltre la HTA è coinvolta nei percorsi clinico-assistenziali i quali devono essere valutati in termini di impatto innovativo e di miglioramento degli outcome con l’obiettivo finale di migliorare la qualità della prestazione sanitaria e di garantire un risparmio nell’impiego di risorse (8).
Dunque, considerata l’alta prevalenza della MRC, il suo contributo al rischio cardiovascolare e le sue implicazioni organizzative ed economiche, metodologie valutative quali la HTA possono fornire un grosso contributo per l’individuazione delle migliori tecnologie e dei percorsi di cura per i pazienti con MRC, garantendo al contempo una gestione appropriata delle risorse disponibili.
Background
La sostenibilità del Sistema Sanitario Nazionale (SSN) e dei vari Sistemi Sanitari Regionali (SSR) necessita di un’architettura organizzativa e gestionale imperniata su un utilizzo appropriato delle risorse umane, finanziarie e tecnologiche. Fattori non governabili, come l’invecchiamento della popolazione, con il conseguente aumento della cronicità e della comorbilità, e l’incremento delle aspettative di salute dei cittadini, associati a fattori invece governabili, quali il contemporaneo lievitare dei costi del sistema sanitario generato dalla spinta incessante all’innovazione tecnologica, richiedono un assessment da condurre con metodologia scientifica per una corretta e appropriata allocazione delle risorse finanziarie.
Per il conseguimento degli obiettivi della Governance, quali gestione appropriata delle risorse e programmazione strategica, la HTA rappresenta uno strumento fondamentale in quanto si caratterizza per i seguenti fattori: 1) valutazione integrata multidimensionale connessa alle seguenti dimensioni: problema di salute e uso della tecnologia corrente, descrizione delle caratteristiche tecniche della tecnologia, sicurezza, efficacia clinica, valutazione economica e dei costi, aspetti etici, aspetti organizzativi, aspetti sociali e dei pazienti e aspetti legali (9); 2) valutazione eseguita con il contributo di differenti attori, dunque multidisciplinare; 3) valutazione di tecnologie che hanno impatto significativo sulle dimensioni di valutazione indicate al punto 1.
Nell’ambito clinico-assistenziale della nefrologia e della dialisi, le tecnologie per la sostituzione dell’attività renale attualmente utilizzate consentono l’erogazione delle prestazioni sia in ambito ospedaliero che in ambito extra-ospedaliero, offrendo un’ampia flessibilità nell’organizzazione dei modelli di offerta assistenziale (10). In considerazione dell’elevata gamma di proposte dialitiche, se si vogliono realmente individuare la tecnologia e i percorsi terapeutici più adeguati in termini di risposta clinico-assistenziale e di ottimizzazione delle risorse, diviene strategico proporre una valutazione multidimensionale. Infatti, la gestione del paziente con MRC comporta ingenti costi per la società sia di tipo diretto che di tipo indiretto. “La valorizzazione dei costi diretti “SANITARI” deve tenere in considerazione le seguenti voci: personale medico, materiali, ammortamento attrezzature, manutenzione, service, farmaci e diagnostica; invece, la valorizzazione dei costi diretti “NON SANITARI” deve considerare: personale non medico, servizio alberghiero, servizi generali e servizio di trasporto. Alle suddette voci bisognerebbe aggiungere per completezza un ulteriore parametro dei costi “INDIRETTI” vale a dire: assenza di lavoro in termini di giornate perse e ricorso al caregiver e al personale di assistenza, esclusi familiari/amici” (8).
Dunque, la corretta gestione del paziente con MRC ha un forte impatto anche sulla sua sfera sociale ed etica, aspetto che merita di essere preso in considerazione in un’ottica di valutazione multidimensionale della presa in carico del paziente con MRC.
Inoltre bisogna tenere presente che la MRC è una condizione clinica pericolosa in quanto amplifica il rischio di complicanze cardiovascolari (CV) (8). Dalle evidenze emerge che la MRC rappresenta un fattore di comorbilità rilevante e costituisce un coefficiente di amplificazione del rischio di malattie cardiovascolari e di altre condizioni cliniche ad alta prevalenza nella popolazione generale.
Dal punto di vista dell’innovazione tecnologica, la nefrologia e la dialisi rappresentano due dei settori a più ampia prospettiva di sviluppo nell’ambito della sanità digitale. “Nel 2016, in Italia, il Ministero della Salute ha pubblicato il Piano Nazionale delle Cronicità, nel quale si introduceva il concetto di monitoraggio da remoto per determinate patologie croniche, inclusa l’insufficienza renale cronica terminale in trattamento dialitico domiciliare” (11). Più recentemente, la Missione 6 salute (M6) del Piano Nazionale di Ripresa e Resilienza (PNRR) all’interno della componente “M6C1 – Reti di prossimità, strutture e telemedicina per l’assistenza sanitaria territoriale” prevede una serie di interventi a titolarità del Ministero della Salute tra cui l’implementazione e lo sviluppo della “Telemedicina per un migliore supporto ai pazienti cronici”, come i pazienti in trattamento dialitico.
Dunque, considerata la rilevanza della patologia e delle comorbilità, considerato che le tecnologie, i farmaci e i percorsi terapeutici per i pazienti con MRC impattano fortemente sull’efficacia, sulla sicurezza e sugli aspetti sociali ed etici correlati alla vita di questi pazienti e delle loro famiglie, e preso atto delle forti ricadute in termini economici delle corrette e appropriate gestione e introduzione di nuove tecnologie e di nuovi processi, la metodologia della HTA grazie al suo approccio multidimensionale e multidisciplinare si configura come strumento strategico che i decisori sanitari dovrebbero adottare per il conseguimento della governance.
La metodologia HTA
La metodologia HTA consiste in un processo di valutazione multidimensionale che prevede il coinvolgimento di un team multidisciplinare composto da medici, farmacisti, infermieri, ingegneri clinici/biomedici e controller. La metodologia di valutazione particolarmente efficace e rigorosa è quella del Core Model EUnetHTA®, che è caratterizzata da un insieme di domande che accompagnano il processo valutativo e che organizza le informazioni in nove Dimensioni, ognuna suddivisa in criteri con ogni criterio articolato in sub-criteri o problemi (9).
La sopraccitata metodologia è di tipo operativo e ha lo scopo di proporre un modello, con i relativi strumenti e quesiti valutativi, con l’obiettivo di supportare i decision maker nella corretta allocazione delle risorse per l’eventuale acquisizione di una tecnologia innovativa biomedica frequentemente a elevato costo.
L’attività di valutazione si articola in 3 fasi: a) Fase di Prioritizzazione; b) Fase di Assessment; c) Fase di Appraisal (fase di appropriatezza).
Un processo di valutazione comparativa ha come oggetto diversi fattori: la descrizione della popolazione target e la significatività epidemiologica della malattia, la procedura, la tecnologia biomedica, il livello di efficacia e di sicurezza mostrato dalle evidenze di letteratura, l’impatto economico e organizzativo della nuova tecnologia sui percorsi diagnostici terapeutici assistenziali (PDTA) e l’impatto etico, sociale, legale e strategico.
Fase di prioritizzazione
Le dimensioni oggetto di valutazione nel processo HTA devono essere sottoposte a una determinazione di assegnazione di priorità, definita prioritizzazione. La prioritizzazione delle dimensioni deve essere condotta avvalendosi di professionisti esperti in qualità di decisori.
I criteri che caratterizzano il livello di importanza di ognuna delle dimensioni sono identificati da una scala che varia in base alle dimensioni selezionate e seguono una logica mutuamente esclusiva. Dai punteggi espressi dai decisori, successivamente si procede al calcolo della Media del Giudizio e al calcolo del Giudizio Normalizzato, come illustrato nella Tabella seguente. La Tabella I fornisce un esempio di valutazione numerica dei decisori per le quattro dimensioni nel processo di prioritizzazione.
| Prioritizzazione delle dimensioni della valutazione | |||||
|---|---|---|---|---|---|
| 1°
Decisore |
2°
Decisore |
3°
Decisore |
Media del
Giudizio |
Giudizio
normalizzato |
|
| Sicurezza | 4 | 4 | 4 | 4 | 0,40 |
| Efficacia | 1 | 1 | 1 | 1 | 0,10 |
| Impatto economico e finanziario | 2 | 3 | 3 | 2,7 | 0,27 |
| Impatto organizzativo | 3 | 2 | 2 | 2,3 | 0,23 |
In questo esempio, il ranking del risultato fornito dagli esperti evidenzia che l’importanza delle dimensioni è attribuita come mostrato dalla Tabella II, dove il valore più basso è quello di maggiore importanza.
| Dimensione | Ranking |
|---|---|
| Efficacia | 1 |
| Impatto organizzativo | 2 |
| Impatto economico e finanziario | 3 |
| Sicurezza | 4 |
Fase di assessment
Per ciascuna tecnologia sanitaria considerata di interesse prioritario per l’azienda sanitaria, conseguentemente alla fase di prioritizzazione delle dimensioni e dei relativi pesi assegnati, si procede con la fase di assessment e infine con l’appraisal, che si completa con l’indicazione del valore dell’indicatore di appropriatezza d’uso. Tali fasi si esplicano in coerenza con un modello che comprende i seguenti criteri valutativi di appropriatezza e sostenibilità.
In linea generale, la rilevanza delle tecnologie sanitarie con maggiore impatto dovrebbe essere riconosciuta a tecnologie che si applicano a malattie severe e/o comuni o con numerosi bisogni non soddisfatti e che sono raccomandate nelle Linee Guida istituzionali e professionali e che hanno dimostrato di produrre miglioramenti rispetto agli standard of care in termini di efficacia, sicurezza e tollerabilità.
L’attività di produzione del report di valutazione presuppone una ricerca esaustiva delle prove e degli studi disponibili, pubblicati o meno, relativi alla specifica tecnologia sanitaria oggetto di valutazione. La scelta di quali fonti consultare e di come effettuare la ricerca può introdurre involontariamente dei bias nell’analisi, per cui si procede con la definizione del PICO (Popolazione-Intervento-Comparator-Outcome). Vengono prese in considerazione le ricerche che hanno le seguenti caratteristiche: 1) Periodo di pubblicazione (ultimi 5 anni); 2) Pubblicazioni in lingua inglese; 3) Ricerca limitata agli studi su essere umani; 4) Disegno dello studio: revisioni sistematiche, RCT, studi osservazionali e sperimentali. La produzione del report di valutazione presuppone una ricerca esaustiva delle prove e degli studi disponibili.
Nell’analisi delle dimensioni, la valutazione dell’efficacia clinica ha come interesse le evidenze tratte dalla letteratura analizzata e le informazioni relative ai possibili eventi. La valutazione sull’impatto economico illustra il processo di confronto tra la nuova tecnologia e quelle in uso, evidenziando la relativa valorizzazione, in termini di costo, in funzione delle risorse impiegate nonché della rimborsabilità da parte del SSR. La valutazione sull’impatto organizzativo prodotto dall’introduzione della nuova tecnologia considera aspetti quali le azioni rivolte alla stabilizzazione dell’assetto organizzativo, la necessità di formare gli operatori, la costituzione di gruppi di lavoro ad hoc, la definizione dei PDTA per l’introduzione della nuova tecnologia ed eventualmente il supporto di strumenti di Project Management per l’inserimento della nuova tecnologia nei processi organizzativi.
Fase di appraisal
In base alla documentazione e alla valutazione prodotta nella fase di assessment si procederà alla fase di appraisal, che consiste nella valutazione dell’appropriatezza d’uso espressa mediante punteggi da parte di un team multiprofessionale che è composto da medici, farmacisti, ingegneri e infermieri. I valutatori in base alle evidenze emerse esprimono per ciascuna dimensione in esame un punteggio che varia da 0 a 4, per cui:
- 0: corrisponde all’assenza di informazioni;
- 1: indica un valore peggiorativo della nuova tecnologia;
- 2: esprime un valore sovrapponibile rispetto all’attuale standard;
- 3-4: indica un miglioramento lieve o elevato rispetto allo standard di riferimento che trova impiego nella comune pratica clinica.
Le dimensioni valutative soddisfano i più importanti requisiti di metodo per l’utilizzo di un’analisi decisionale a dimensioni multiple. Infatti l’applicazione di questa metodologia è garanzia di una valutazione in cui le dimensioni non sono duplicate, il punteggio è indipendente da quello assegnato alle altre dimensioni e sono comprese tutte le dimensioni veramente necessarie per stabilire il vero valore intrinseco in possesso di una tecnologia.
I punteggi espressi da ciascuna componente verranno incrociati con il valore dei pesi per ottenere così un indice di appropriatezza, il cui valore determina poi il giudizio favorevole o contrario all’acquisizione.
Metodologia HTA in ambito dialitico
In questo paragrafo descriviamo un esempio di applicazione della metodologia HTA su un dispositivo antibatterico riassorbibile, per la prevenzione delle infezioni sui dispositivi elettronici impiantabili cardiaci (CIED) in pazienti ad alto rischio infettivo, quali i pazienti con patologia renale cronica.
I pazienti con malattia renale cronica sono pazienti ad aumentato rischio di comorbilità cardiovascolari, comprese le cardiomiopatie e le aritmie, che spesso richiedono l’impianto con CIED. La prevalenza riportata dell’uso di CIED nei pazienti con malattia renale allo stadio terminale (ESRD) sottoposti a emodialisi è compresa tra il 7% e il 10% (12).
Una complicazione molto grave che deriva dall’impianto dei CIED è rappresentata dalla comparsa di infezioni. La percentuale di infezioni da CIED all’anno oscilla tra lo 0,6% e il 4% del totale delle ICA, le quali producono il 34% del totale dei decessi per infezione ospedaliera e, nei casi più gravi, l’infezione conduce alla morte del 20% circa dei pazienti entro un anno dall’infezione e del 50% circa entro 3 anni (13).
È importante sottolineare che la popolazione di pazienti con malattia renale mostra tassi più elevati di infezione a livello del dispositivo, dovuti a frequenti accessi vascolari e a cateteri permanenti per dialisi, condizioni che producono l’aumento dell’incidenza di batteriemia e alterazioni immunitarie con disfunzione renale progressiva (12).
In caso di presenza di infezione, il trattamento preferenziale è quello di rimuovere completamente il dispositivo, condizione che può provocare un tasso di mortalità a 12 mesi del 30% in caso di infezione endovascolare e del 10% in caso di infezione limitata alla sola tasca (13).
Sebbene l’estrazione dell’elettrocatetere e del dispositivo che presentino un’infezione da CIED abbia un’indicazione di classe I nelle Linee Guida sulla gestione clinica, i dati del Renal Data System degli Stati Uniti mostrano invece che tale raccomandazione viene poco seguita, con solo un 28% di estrazione del dispositivo nei pazienti con ESRD che presentano infezione da CIED. Ciò potrebbe essere attribuito alle preoccupazioni sui rischi di espianto percepite in questa popolazione (12).
Sarebbe opportuno adottare delle soluzioni che permettano di prevenire l’infezione e i rischi correlati, evitando di dover arrivare all’espianto del dispositivo. Un trattamento addizionale alla profilassi antimicrobica intra-operatoria negli interventi di impianto e sostituzione di CIED è rappresentato da un involucro sterile, antibatterico, completamente riassorbibile progettato per stabilizzare il CIED quando viene impiantato, riducendone il deterioramento e la migrazione batterica. È composto da una rete bioriassorbibile a maglia larga rivestita da polimero che rilascia agenti antimicrobici, come per esempio la Minociclina e Rifampicina con concentrazione di 102 ug/cm2 ognuna per 7 giorni circa e viene scomposto e assorbito dall’organismo in circa 9 settimane.
I pazienti eleggibili all’uso di questo dispositivo sono quelli ad alto rischio di infezione.
Si riporta la Tabella presentata dalla Medtronic (14) che riprende gli elaborati del CRDM dell’Emilia Romagna (13) sui fattori di rischio e sulla loro probabilità di sviluppare un’infezione da CIED (Fig. 1 a sinistra) e su quelli di mortalità con un’infezione da CIED in atto (Fig. 1 a destra). Lo score finale del paziente è dato dalla somma degli Odds Ratio (OR), che dipendono dal tipo di procedura, dal percorso farmacologico e dalle caratteristiche del paziente. In base al lavoro dei ricercatori di Medtronic (14) gli score finali suddividono il rischio infettivo a sei mesi nelle seguenti 4 fasce:
– < 3 = 1,0% rischio di infezione a sei mesi;
– 3-6 = 2,4%-3,4% rischio di infezione a sei mesi;
– 7-15 = 3,4%-11,1% rischio di infezione a sei mesi;
– >15 = 11,1-30% rischio di infezione a sei mesi.
Come mostrato nella Figura 1, i pazienti sottoposti a dialisi (OR = 13,39) hanno una probabilità compresa tra il 3,4% e l’11,1% di contrarre un’infezione entro i sei mesi dall’impianto. I pazienti in fase predialitica (OR = 11,97) rientrano nella stessa fascia di rischio dei pazienti dializzati. I pazienti con insufficienza renale (OR = 5,46) presentano un rischio di infezione a sei mesi dall’impianto tra il 2,4% e il 3,4%.
Considerati i valori dell’Odds Ratio e le fasce di rischio collegate, la struttura SC Technology Assessment di Ares Sardegna ha condotto un’analisi a dimensioni multiple secondo la metodologia HTA per valutare l’introduzione del suddetto dispositivo all’interno della pratica clinica del Sistema Sanitario Regionale. La valutazione è stata effettuata attraverso un’analisi delle evidenze della letteratura clinica relativamente alle dimensioni di valutazione riportate nella Tabella riportata in Figura 2.
La metodologia utilizzata è stata quella del Core Model EUnetHTA®, semplificata per esigenze temporali, riducendo il numero delle dimensioni e selezionando soltanto quelle ritenute scientificamente esaustive e soddisfacenti per un assessment completo in questo specifico caso, in analogia con il modello di MiniHTA di matrice danese, già utilizzato a livello internazionale, che prevede una selezione delle dimensioni rispetto al Core Model EUnetHTA® (15).
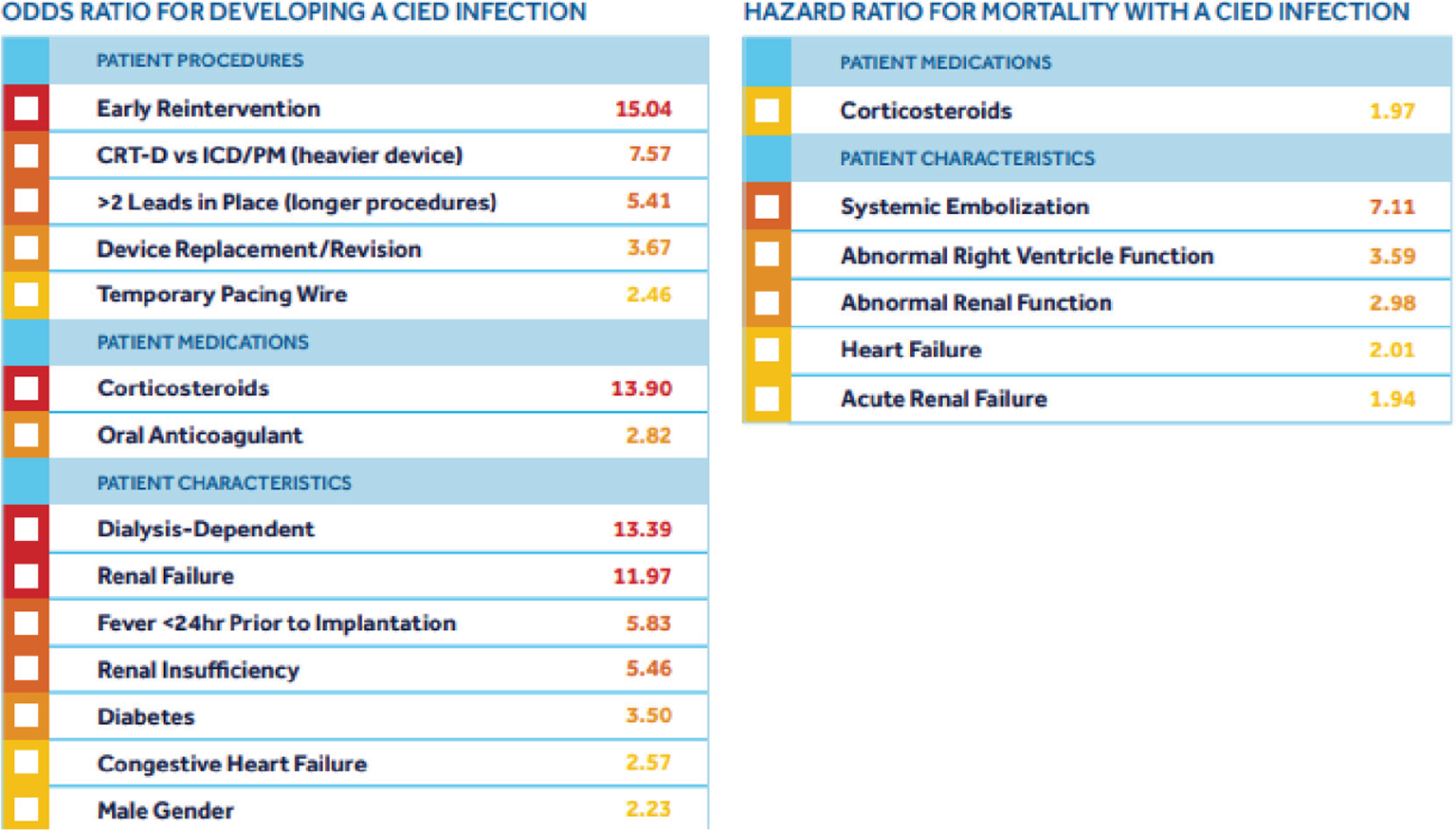
Fig. 1 - A sinistra, fattori di rischio e relativa “probabilità” di sviluppare un’infezione da CIED. A destra, fattori di rischio e relativa mortalità con un’infezione da CIED in atto.
Fig. 2 - Dimensioni di valutazione selezionate per il dispositivo in oggetto.
Prima di procedere con la valutazione, le dimensioni selezionate sono state sottoposte a prioritizzazione, cosa che consente di definirne l’importanza relativa tramite l’espressione di una pesatura specifica. I pesi sono stati successivamente utilizzati nel calcolo finale per il giudizio di appropriatezza. Si riportano nella Figura 3 seguente la prioritizzazione delle dimensioni selezionate effettuata per il dispositivo in oggetto e nella Figura 4 la rappresentazione grafica della distribuzione dei pesi assegnati.
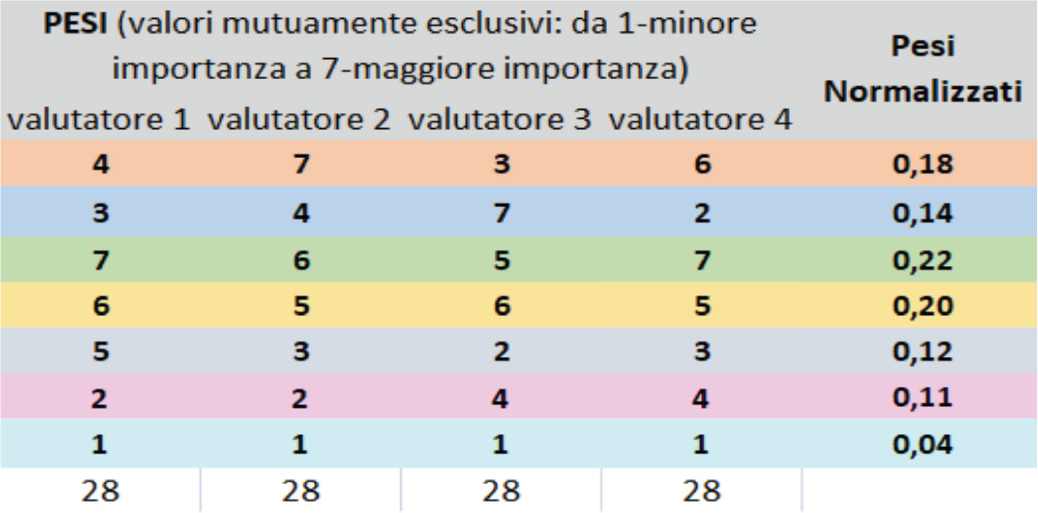
Fig. 3 - Prioritizzazione delle dimensioni selezionate.
Come mostrato nella Figura 3 si evince dai pesi normalizzati che i 4 valutatori hanno ritenuto che la dimensione dell’efficacia clinica (0,22) e quella della sicurezza del paziente (0,20) rappresentano le due dimensioni maggiormente impattanti nella valutazione complessiva della tecnologia.
Per quanto riguarda la valutazione delle dimensioni selezionate, gli strumenti utilizzati sono stati i seguenti: 1) i principali portali di letteratura scientifica biomedica (p. es., PubMed, Cochrane Library); 2) la Biblioteca Scientifica Regionale (BSR) che, nella sezione “Ricerche per la Sanità”, fornisce materiale utile per le ricerche di letteratura in ambito clinico; 3) il portale ABACO per avere informazioni sull’attività ambulatoriale e ospedaliera (prestazioni, ricoveri, ecc.). Inoltre è stata adottata la metodologia PICO per formulare in maniera strutturata il quesito sanitario specifico (foreground question).
Dall’analisi effettuata è emerso che la comparsa di infezioni è una complicazione molto grave che deriva dall’impianto di CIED. Su un totale di 600.000 pazienti CIED in Italia, all’anno circa 2.570 sono i casi di morte accertati correlati a un’infezione da CIED.
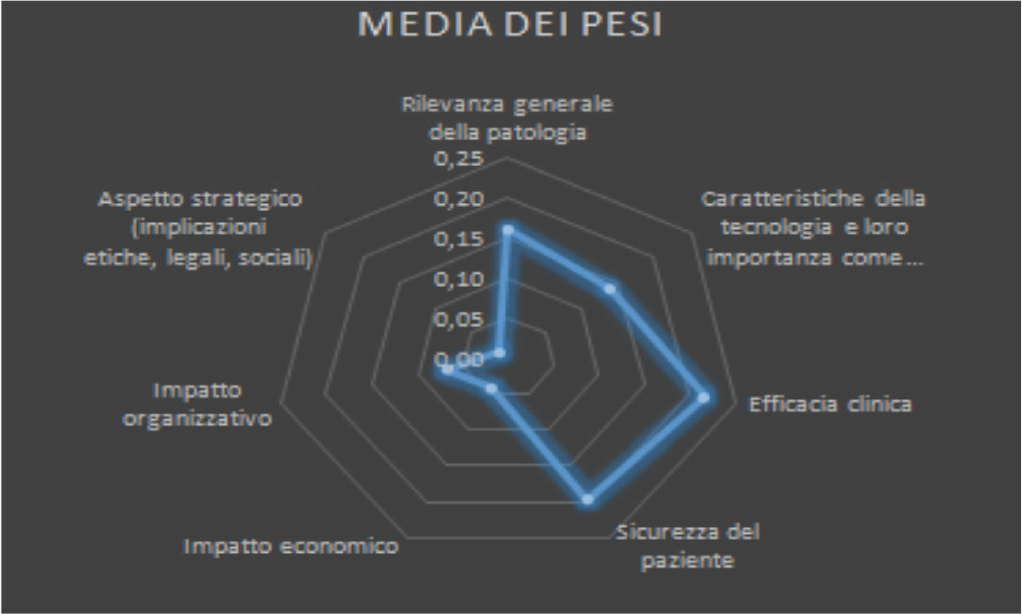
Fig. 4 - Rappresentazione grafica della distribuzione dei pesi assegnati.
I benefici attesi del dispositivo sulla mortalità e sulla gravità della malattia sono direttamente correlati alla sua capacità di prevenire le infezioni da CIED. Il target di pazienti con cui utilizzare il dispositivo è tra quelli ad alto rischio infettivo, tra i quali ricadono i pazienti con malattia renale cronica. Tutti gli studi selezionati hanno evidenziato che utilizzando l’involucro sia nella sua versione precedente non riassorbibile che in quella attuale bioriassorbibile, l’involucro abbassa il rischio di infezione con una percentuale del 40% circa.
Relativamente alla sicurezza del paziente, in nessuno studio si è rilevata l’insorgenza di effetti collaterali o reazioni allergiche dovuti alle componenti “rete, polimero, antibiotici” dell’involucro.
Per quanto riguarda l’impatto economico, si è concluso che il rapporto costo-efficacia per l’adozione del dispositivo è vantaggioso nel momento in cui vengono rispettati i criteri di eleggibilità in modo da circoscrivere il target dei pazienti a quelli che hanno il rischio infettivo più alto.
L’analisi multidimensionale e multidisciplinare descritta è stata tradotta in un Report di Mini-HTA e le evidenze raccolte sono state successivamente presentate in commissione di valutazione HTA composta da esperti nell’ambito della tecnologia oggetto di valutazione. Alla luce delle evidenze presentate e del proprio background di conoscenze e competenze, ogni membro della commissione ha espresso un punteggio da 0 (assenza di informazioni o netto peggioramento) a 4 (caratteristica molto importante o netto miglioramento), come mostrato nella legenda punteggi (Fig. 5) per ciascuna delle dimensioni. Si precisa che i membri della commissione erano 7 con profili professionali differenti rispetto a quelli che hanno espresso i valori dei pesi in fase di prioritizzazione.
Dopo aver espresso pesi e punteggi, è stato calcolato l’indice di appropriatezza tramite l’applicazione di uno strumento di analisi decisionale a dimensioni multiple (Fig. 5). Considerato l’indice di appropriatezza ottenuto pari a 0,83, la commissione di valutazione ha dato parere positivo all’acquisto del dispositivo per tutti i pazienti che effettivamente presentano un elevato rischio infettivo “CIED correlato” opportunamente selezionati, tra cui i pazienti con malattia renale cronica.
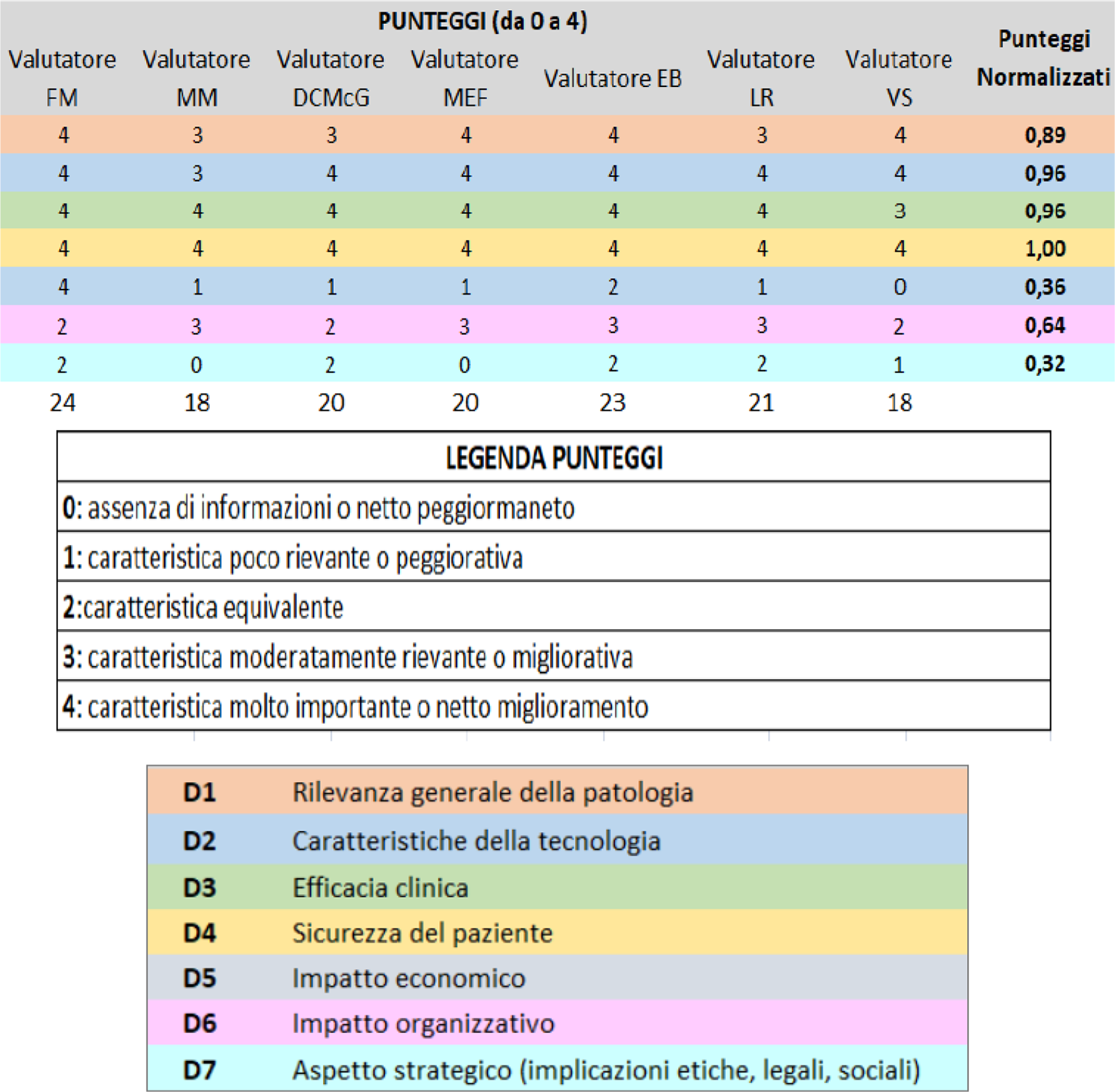
Fig. 5 - Punteggi assegnati dai valutatori alle dimensioni selezionate e legenda dei punteggi.
Come mostrato in figura 6 e figura 7, l’indice di appropriatezza deriva da una combinazione lineare tra i pesi e i punteggi ed esprime il grado di appropriatezza per l’acquisizione della tecnologia in esame. Considerato che il cut-off dell’indice di appropriatezza è di 0,5, il valore di 0,83 è considerato positivo per l’acquisizione della tecnologia (16).

Fig. 6 - Esito della valutazione.
Conclusioni
In un contesto di invecchiamento della popolazione, di crescita di aspettativa di vita in buona salute e di bisogni, diviene strategica l’applicazione di una metodologia scientifica e rigorosa per valutare l’introduzione di una tecnologia innovativa e ad alto costo nei percorsi di cura del paziente. La metodologia valutativa HTA, multidimensionale e multidisciplinare, rappresenta per i decision maker e per i sanitari uno strumento strategico per garantire l’introduzione delle migliori tecnologie innovative nei PDTA delle patologie croniche.
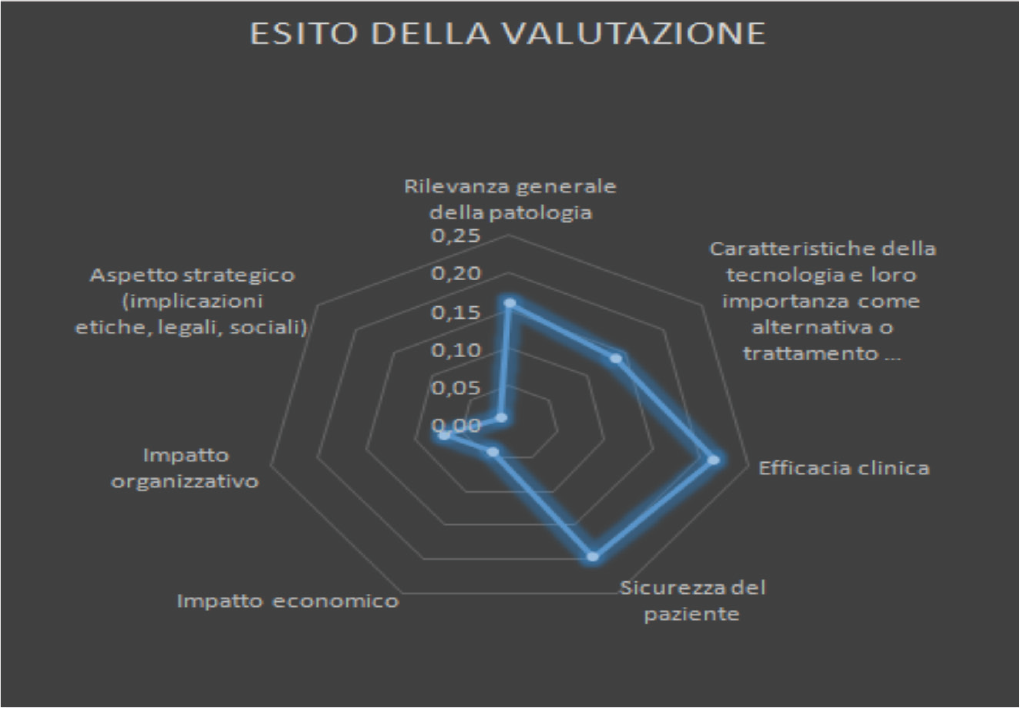
Fig. 7 - Calcolo dell’indice di appropriatezza.
Uno dei settori che presenta l’esigenza di garantire una particolare sensibilità alle proposte di innovazione tecnologica è proprio rappresentato dalla nefrologia e dalla dialisi. In questo lavoro è stato illustrato il percorso valutativo della HTA articolato nelle 3 fasi (prioritizzazione, assessment e appraisal), che si conclude con l’indicazione di un indice di appropriatezza. Inoltre, considerato che i pazienti con malattia renale cronica sono pazienti ad aumentato rischio di comorbilità cardiovascolari che spesso richiedono l’impianto di CIED, nel presente lavoro è stato presentato un modello di applicazione della metodologia HTA su un dispositivo antibatterico riassorbibile per la prevenzione delle infezioni da CIED su pazienti ad alto rischio infettivo quali i pazienti con patologia renale cronica.
È importante sottolineare che la popolazione di pazienti con malattia renale mostra tassi più elevati di infezione del dispositivo, che possono essere attribuiti all’aumento dell’incidenza di batteriemia da frequenti accessi vascolari e cateteri permanenti per dialisi, così come alterazioni immunitarie con disfunzione renale progressiva. In caso di presenza di infezione, il trattamento preferenziale consiste nel rimuovere completamente il dispositivo. Tuttavia i dati del Renal Data System degli Stati Uniti hanno mostrato un allarmante basso tasso di estrazione del dispositivo nei pazienti con ESRD con infezione da CIED, probabilmente a causa delle preoccupazioni circa i rischi di espianto percepite in questa popolazione.
In un’ottica di potenziamento della prevenzione del processo di infezione, al trattamento addizionale che consiste nella profilassi antimicrobica intra-operatoria negli interventi di impianto e sostituzione di un CIED, si può aggiungere l’impiego di un involucro sterile, antibatterico e completamente riassorbibile, progettato per stabilizzare il CIED quando viene impiantato.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Draborg E, Gyrd-Hansen D, Poulsen PB, Horder M. International comparison of the definition and the practical application of health technology assessment. Int J Technol Assess Health Care. 2005;21(1):89-95. CrossRef PubMed
- 2. Banta D, Jonsson E. History of HTA: introduction. Int J Technol Assess Health Care. 2009;25(S1)(suppl 1):1-6. CrossRef PubMed
- 3. Lancet T; The Lancet. Is digital medicine different? Lancet. 2018;392(10142):95. CrossRef PubMed
- 4. May C, Finch T, Mair F, et al. Understanding the implementation of complex interventions in health care: the normalization process model. BMC Health Serv Res. 2007;7(1):148. CrossRef PubMed
- 5. Polisena J, De Angelis G, Kaunelis D, Gutierrez-Ibarluzea I. Environmental impact assessment of a health technology: a scoping review. Int J Technol Assess Health Care. 2018;34(3):317-326. CrossRef PubMed
- 6. Eunethta. HTA Core Model®. Online (Accessed January 2023).
- 7. Burrai F, Othman S, Brioni E, et al. Effects of Virtual Reality in Patients Undergoing Dialysis: study Protocol. Holist Nurs Pract. 2019;33(6):327-337. CrossRef PubMed
- 8. Ministero della Salute. Documento di indirizzo per la malattia renale cronica. 2014. Online (Accessed January 2023).
- 9. Eunethta. HTA Core Model ®. EUnetHTA JA2 WP8 DELIVERABLE. Online (Accessed January 2023).
- 10. Gillespie F, Amicosante AMV, Lo Scalzo A, et al. Cerbo M– Agenas – HTA Report Adaptation – “Valutazione HTA delle Modalità di dialisi in Italia”, Roma, Ottobre 2015. Online (Accessed January 2023).
- 11. Fantuzzi AL, Berri E, Tartaglione L, et al. Porreca S. Telemedicina tra clinica e nutrizione nella Malattia Renale Cronica (MRC): appunti di esperienze al femminile. G Clin Nefrol Dial. 2021;33:12-19. CrossRef
- 12. Barakat AF, Wazni OM, Tarakji KG, et al. Transvenous Lead Extraction in Chronic Kidney Disease and Dialysis Patients With Infected Cardiac Devices. Circ Arrhythm Electrophysiol. 2018 Jan;11(1):e005706. CrossRef PubMed
- 13. Regione Emilia-Romagna. Scheda di Valutazione del dispositivo medico TYRX™ involucro antibatterico riassorbibile. Online (Accessed January 2023).
- 14. Medtronic TYRX. UC201405268gEN. Online (Accessed January 2023).
- 15. Ehlers L, Vestergaard M, Kidholm K, et al. Doing mini-health technology assessments in hospitals: a new concept of decision support in health care? Int J Technol Assess Health Care. 2006;22(3):295-301. CrossRef PubMed
- 16. Delibera 173 del 28/02/2019. ATS Sardegna. Linee di indirizzo per le health technology assessment e modalità di funzionamento della relativa commissione nella ATS Sardegna. Online (Accessed January 2023).