 |
G Clin Nefrol Dial 2022; 34: 74-79 ISSN 2705-0076 | DOI: 10.33393/gcnd.2022.2472 ORIGINAL ARTICLE |
 |
Approccio nutrizionale all’ipofosforemia post-trapianto di rene: uno studio pilota
Nutritional approach to kidney post-transplantation hypophosphatemia: a pilot study
Renal transplantation is the gold standard for the treatment of ESRD patients. During the early-stage post-transplantation, metabolic and electrolytic alterations may develop, including hypophosphatemia and the treatment includes a diet rich in phosphorus, sometimes with the addition of oral or intravenous phosphorus supplement. Forty-four kidney transplanted patients with hypophosphatemia were evaluated retrospectively. They were divided into two groups based on whether patients received (group A, 14 patients) or not (group B, 30 patients) dietary prescription for hypophosphatemia. Group A was further divided into two subgroups: group A1 (8 patients), with baseline phosphatemia ≥0.5 mmol/L, treated only with a diet rich in animal phosphorus, and group A2 (6 patients), with baseline phosphatemia ≤0.5 mmol/L, who received a potassium phosphate supplement in addition to the same dietary prescription. Three months after transplantation, group A had a greater increase of phosphatemia compared with group B (group A: 0.58 ± 0.12 vs 0.93 ± 0.22 mmol/L; group B: 0.59 ± 0.11 to 0.8 ± 0.13 mmol/L). Furthermore, in group A2 the increase of phosphatemia was lower than in group A1.
In conclusion, dietary approach supported by dietary counseling was effective in treating post kidney transplantation hypophosphatemia. The results of this pilot study might represent a useful working hypothesis for studies with a larger cohort of enrolled patients in order to confirm for these patients the efficacy of the nutritional approach and of the dietary counseling to post renal transplantation hypophosphatemia.
Keywords: Diet, Hypophosphatemia, Kidney transplantation
Received: July 26, 2022
Accepted: August 8, 2022
Published online: September 14, 2022
Giornale di Clinica Nefrologica e Dialisi - ISSN 2705-0076 - www.aboutscience.eu/gcnd
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0).
Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il trapianto di rene è il gold standard del trattamento della malattia renale cronica terminale (ESKD) in quanto restituisce la funzionalità renale al paziente, migliora la qualità di vita e ne prolunga la sopravvivenza (1,2). Nonostante il ripristino della normale funzione renale, il trapianto di rene induce cambiamenti specifici nel metabolismo del fosforo che possono causare una grave ipofosfatemia (2).
L’ipofosfatemia colpisce fino al 93% dei pazienti sottoposti a trapianto di rene nei primi 4 mesi dopo il trapianto (3,4). Diverse sono le cause alla base della sua origine: la disfunzione tubulare post-trapianto, dovuta al danno ischemico conseguente alla riperfusione dell’organo (4), l’iperparatiroidismo persistente (2,4) e gli elevati livelli di FGF-23, che comportano un’aumentata escrezione di fosforo attraverso le urine a causa della ridotta espressione dei co-trasportatori del fosforo a livello del tubulo renale prossimale (2), l’ipovitaminosi D, che contribuisce alla riduzione dell’assorbimento intestinale e del riassorbimento renale di fosforo (2,5) e la terapia immunosoppressiva, che aggrava la perdita renale di fosforo (2,6).
Il significato clinico dell’ipofosfatemia varia a seconda che si sviluppi nella fase post-trapianto precoce o tardiva (4). A breve termine gli effetti includono astenia, debolezza muscolare e osteomalacia; se l’ipofosfatemia è grave (valori al di sotto di 0,3 mmol/L), si possono avere complicanze acute come anemia emolitica, rabdomiolisi, ridotta contrattilità cardiaca e insufficienza respiratoria (3,7,8). A lungo termine l’ipofosfatemia può favorire o esacerbare la persistenza o la comparsa di una complicanza molto diffusa nei pazienti con malattia renale cronica, l’osteodistrofia (9-11), nonché contribuire allo sviluppo di complicanze cardiovascolari e a una ridotta funzionalità del rene trapiantato (2).
La terapia per l’ipofosfatemia comprende innanzitutto una dieta ricca di fosforo (12) talvolta accompagnata da un’integrazione orale o endovenosa. Livelli sierici di fosfato al di sotto di 0,5 mmol/L sono considerati come cut-off per l’inizio di una terapia integrativa, così come la presenza di sintomi clinici (principalmente debolezza muscolare) in presenza di valori di fosfato al di sotto di 1,0 mmol/L (5,13).
Pochi studi hanno indagato sul metabolismo dei minerali nel periodo post-trapianto renale (7) e nessuno ha valutato l’efficacia di un intervento dietetico personalizzato per la correzione dell’ipofosfatemia.
Soggetti e metodi
Pazienti
Sono stati valutati retrospettivamente 44 pazienti sottoposti a trapianto renale nel periodo tra ottobre 2019 e giugno 2021 presso il Centro Trapianti Rene e Pancreas dell’Azienda Ospedale-Università di Padova, 30 maschi (68%) e 14 femmine (32%), età media di 52 ± 11 anni, che presentavano ipofosforemia (0,30 ≤ fosforo plasmatico ≤ 0,75 mmol/L) (Tab. I).
| Gruppo A
(14 pazienti) |
Gruppo B
(30 pazienti) |
|
|---|---|---|
| Femmine | 7 (50%) | 8 (27%) |
| Maschi | 7 (50%) | 22 (73%) |
| Età (anni) | 49 ± 13 | 53,2 ± 11,2 |
| Peso (kg) | 70,1 ± 13,7 | 69,2 ± 11,11 |
| Altezza (m) | 1,68 ± 0,1 | 1,69 ± 0,2 |
| BMI (kg/m2) | 24,7 ± 3,8 | 24,2 ± 3,6 |
I pazienti arruolati sono stati suddivisi in due gruppi a seconda che avessero ricevuto (gruppo A, 14 pazienti) o meno (gruppo B, 30 pazienti) prescrizioni nutrizionali per l’ipofosforemia.
Il valore medio della fosforemia alla prima osservazione non differiva significativamente tra i due gruppi.
Il gruppo A è stato ulteriormente suddiviso in due sottogruppi in base al valore della fosforemia alla prima osservazione: sottogruppo A1 (8 pazienti) con valori di fosforemia alla prima osservazione ≥ 0,5 mmol/L e sottogruppo A2 (6 pazienti) con valori di fosforemia alla prima osservazione ≤ 0,5 mmol/L.
Trattamento
Il sottogruppo A1 è stato trattato esclusivamente con intervento nutrizionale mediante una dieta ricca di fosforo di origine animale, mentre il gruppo A2 è stato trattato con la stessa dieta integrata da una supplementazione orale di fosfato di potassio (Kphos, Biohealth Italia, Corso Francia, 233/D 10098 Rivoli, Torino) variabile da 250 mg di P e 500 mg di K/die (1 bustina) a 750 mg di P e a 1.500 mg di K/die (3 bustine) in base all’entità dell’ipofosforemia (2,13).
Protocollo
I pazienti sono stati seguiti a livello ambulatoriale per un periodo di tre mesi dopo il trapianto.
L’intervento dietetico consisteva in tre diete di differente apporto energetico e proteico a elevato contenuto di fosforo di origine animale (Tab. II). Il fabbisogno energetico di ciascun paziente è stato stimato tramite la formula di Harris Benedict corretta per il livello di attività fisica secondo i valori medi riportati dai Larn 2014 (17) e su questa base ad ogni paziente è stata assegnata una delle tre diete.
| Dieta 1.500-1.600 kcal | Dieta 1.700-1.800 kcal | Dieta 1.900-2.000 kcal | |
|---|---|---|---|
| Energia (kcal) | 1.567 | 1.784 | 1.942 |
| Proteine (%) | 17 | 19 | 19 |
| Proteine (g) | 64 | 80,6 | 88 |
| Proteine vegetali (g) | 31 | 35 | 39 |
| Proteine animali (g) | 33 | 45 | 49 |
| Carboidrati (%) | 50 | 48 | 49 |
| Carboidrati (g) | 202 | 241 | 247 |
| di cui zuccheri (g) | 84 | 85 | 86 |
| Lipidi (%) | 33 | 33 | 32 |
| Lipidi (g) | 57 | 64 | 68 |
| Fibra (g) | 24 | 26 | 28 |
| Colesterolo (mg) | 227 | 260 | 295 |
| Calcio (mg) | 1.031 | 1.077 | 1.213 |
| Fosforo (mg) | 1.215 | 1.426 | 1.574 |
| Sodio (mg) | 1.051 | 1.284 | 1.456 |
| Potassio (mg) | 3.158 | 3.484 | 3.574 |
| Magnesio (mg) | 267 | 288 | 308 |
Nelle tre diete circa il 60% del fosforo derivava da fonti di origine animale, in quanto maggiormente biodisponibile, contrariamente a quello di origine vegetale il cui assorbimento è limitato dal fatto che è principalmente presente sotto forma di fitato (14,15).
Durante un colloquio individuale della durata di circa un’ora un dietista dava istruzioni affinché venisse compilato un diario alimentare settimanale al fine di valutare in modo più preciso gli effettivi introiti alimentari di ciascuno e illustrava le diete ai pazienti.
Per il calcolo delle diete e dei diari alimentari sono state utilizzate le Tabelle di composizione degli alimenti italiane aggiornate, CREA 2019 (18).
Esami ematochimici
I pazienti sono stati osservati ai tempi T0 (2 settimane dopo il trapianto), T1 (7 settimane dopo il trapianto) e T2 (12 settimane dopo il trapianto). Sia a T0 che a T2 abbiamo sottoposto i pazienti al controllo del peso corporeo e dei seguenti parametri plasmatici: urea, creatinina, filtrato glomerulare (eGFR) calcolato mediante formula CKD-EPI, calcio, magnesio, paratormone (PTH), 25 OH Vit D, colesterolo totale, trigliceridi e fosfaturia delle 24 ore; a T1 sono stati ripetuti i dosaggi di urea, creatinina, fosforo e magnesio (Tab. III).
| Gruppo A | Gruppo B | |||||
|---|---|---|---|---|---|---|
| T0 | T2 | p-value | T0 | T2 | p-value | |
| Creatinina (µmol/L) | 114,14 ± 32,03 | 112 ± 38,93 | <0,78 | 134,4 ± 43,13 | 135,6 ± 39,84 | <0,98 |
| Urea (mmol/L) | 7,81 ± 2,55 | 9,1 ± 2,46 | <0,02 | 9,7 ± 3,81 | 9,7 ± 3,88 | <0,85 |
| GFR (mL/min/1,73 m2) | 60 ± 16,15 | 61 ± 19,3 | <0,67 | 55 ± 21,91 | 56 ± 24,1 | <0,61 |
| Calcio (mmol/L) | 2,34 ± 0,17 | 2,45 ± 0,14 | <0,004 | 2,3 ± 0,14 | 2,5 ± 0,09 | <0,001 |
| Fosforo (mmol/L) | 0,58 ± 0,12 | 0,93 ± 0,23 | <0,001 | 0,59 ± 0,11 | 0,78 ± 0,12 | <0,001 |
| Magnesio (mmol/L) | 0,66 ± 0,05 | 0,7 ± 0,08 | <0,06 | 0,7 ± 0,09 | 0,7 ± 0,08 | <0,02 |
| PTH (ng/L) | 100,2 ± 71,3 | 55,3 ± 54,91 | <0,19 | 140,6 ± 112 | 71 ± 7,7 | <0,2 |
| Vitamina D (nmol/L) | 27,71 ± 18,2 | 61,25 ± 12,46 | <0,004 | 22,3 ± 17,4 | 62,1 ± 11,4 | <0,004 |
| Colesterolo (mg/dL) | 5,11 ± 1,05 | 5,12 ± 0,70 | <0,48 | 4,34 ± 1,50 | 5,68 ± 1,34 | <0,96 |
| Trigliceridi (mg/dL) | 1,77 ± 1,31 | 1,72 ± 0,54 | <0,38 | 1,99 ± 0,80 | 2,49 ± 1,57 | <0,88 |
Analisi statistica
I dati raccolti sono stati elaborati mediante il programma di statistica GraphPad Prism versione 9.2. Nei risultati ottenuti le variabili categoriche sono state espresse come numero assoluto e percentuale, mentre le variabili continue come Media ± DS.
La significatività della differenza tra le medie è stata valutata tramite il “t” test per dati appaiati e non appaiati, accettando come valori significativi quelli con p < 0,05.
Risultati
Apporti alimentari
Dall’analisi dei diari alimentari è stato possibile valutare l’aderenza da parte dei pazienti sia al piano alimentare che alle indicazioni nutrizionali fornite, oltre che calcolare gli apporti calorico-proteici e di fosforo dei pazienti appartenenti al gruppo A (Tab. IV). Gli apporti medi di energia, proteine e fosforo ottenuti mediante elaborazione dei diari alimentari compilati dai due gruppi di pazienti sono riportati nella Tabella IV. L’apporto calorico in tutto il campione è rimasto quasi invariato nei tre mesi successivi al trapianto passando da 1.747 ± 15,1 kcal (25 kcal/kg) a T0 a 1.851 ± 97,6 kcal (26 kcal/kg) a T2, mentre l’apporto proteico è moderatamente aumentato passando da 70,1 ± 3,0 g (1,0 g/kg) a 81,0 ± 7,7 g (1,2 g/kg) con un incremento maggiore nel gruppo A2 (+17 g di proteine/die) rispetto al gruppo A1 (+6 g di proteine/die). L’apporto di fosforo è incrementato parallelamente a quello proteico passando da 1.250 ± 50 mg (18 mg/kg) a 1.556 ± 221 mg (22 mg/kg).
| Gruppo A1 | Gruppo A2 | |||||
|---|---|---|---|---|---|---|
| T0 | T1 | T2 | T0 | T1 | T2 | |
| Energia (kcal) | 1.759 ± 416 | 1.650 ± 279 | 1.703 ± 245 | 1.736 ± 394 | 2.070 ± 401 | 1.999 ± 387 |
| Proteine (g) | 71 ± 21,5 | 73 ± 12,7 | 77 ± 11,8 | 68 ± 17,3 | 85 ± 17,35 | 85 ± 22,8 |
| Fosforo (mg) | 1.090 ± 262 | 1.122 ± 180 | 1.306 ± 104 | 1.410 ± 330 | 1.697 ± 196 | 1.807 ± 416 |
Fosforo plasmatico
A T0 il livello del fosforo plasmatico era inferiore alla norma in entrambi i gruppi con valori non significativamente diversi tra gruppo A e gruppo B (Tab. V); a T1 la fosforemia è aumentata rispetto a T0 in entrambi i gruppi pur senza raggiungere il livello di norma e con un aumento più cospicuo per il gruppo A (p < 0,01). A T2 nel gruppo A la fosforemia è rientrata nel range di norma in 11 pazienti su 14, mentre nel gruppo B è aumentata rispetto a T1 senza però rientrare nei limiti; anche a T2 la fosforemia media del gruppo A era significativamente superiore a quella del gruppo B (p < 0,01) (Fig. 1).
| Gruppo A | Gruppo B | p-value | |
|---|---|---|---|
| Fosforo plasmatico T0 (mmol/L) | 0,58 ± 0,12 | 0,59 ± 0,11 | <0,58 |
| Fosforo plasmatico T1 (mmol/L) | 0,77 ± 0,21 | 0,65 ± 0,12 | <0,01 |
| Fosforo plasmatico T2 (mmol/L) | 0,93 ± 0,23 | 0,78 ± 0,12 | <0,01 |
Nel sottogruppo A1 il livello di fosforo a T0 era significativamente superiore rispetto al sottogruppo A2, che ha pertanto assunto l’integratore. A T1 la fosforemia è risultata aumentata rispetto a T0 in entrambi i gruppi raggiungendo il valore di norma solo nel gruppo A1 in 5 pazienti su 8. A T2 nel gruppo A1 la fosforemia è rientrata ampiamente nel range di norma in 7 pazienti su 8, mentre nel gruppo A2, nonostante l’aumento rispetto a T1, il valore della fosforemia è rimasto lievemente al di sotto del range di norma (Tab. VI).
Nelle Figure 2 e 3 è possibile osservare rispettivamente l’andamento della fosforemia del gruppo A1 (dieta) e del gruppo A2 (dieta e integratore).
Discussione
Dopo il trapianto di rene molti pazienti presentano un’ipofosfatemia conseguente al persistere di elevati livelli circolanti di PTH e agli effetti dei farmaci immunosoppressori sul metabolismo del calcio, del fosforo e della vitamina D (2,19). Il principale provvedimento terapeutico consigliato è garantire un adeguato apporto di fosforo attraverso la dieta e qualora questo non fosse sufficiente o in caso di ipofosfatemia severa, il ricorso all’integrazione (12,16), anche se in letteratura vi sono scarse evidenze in merito.
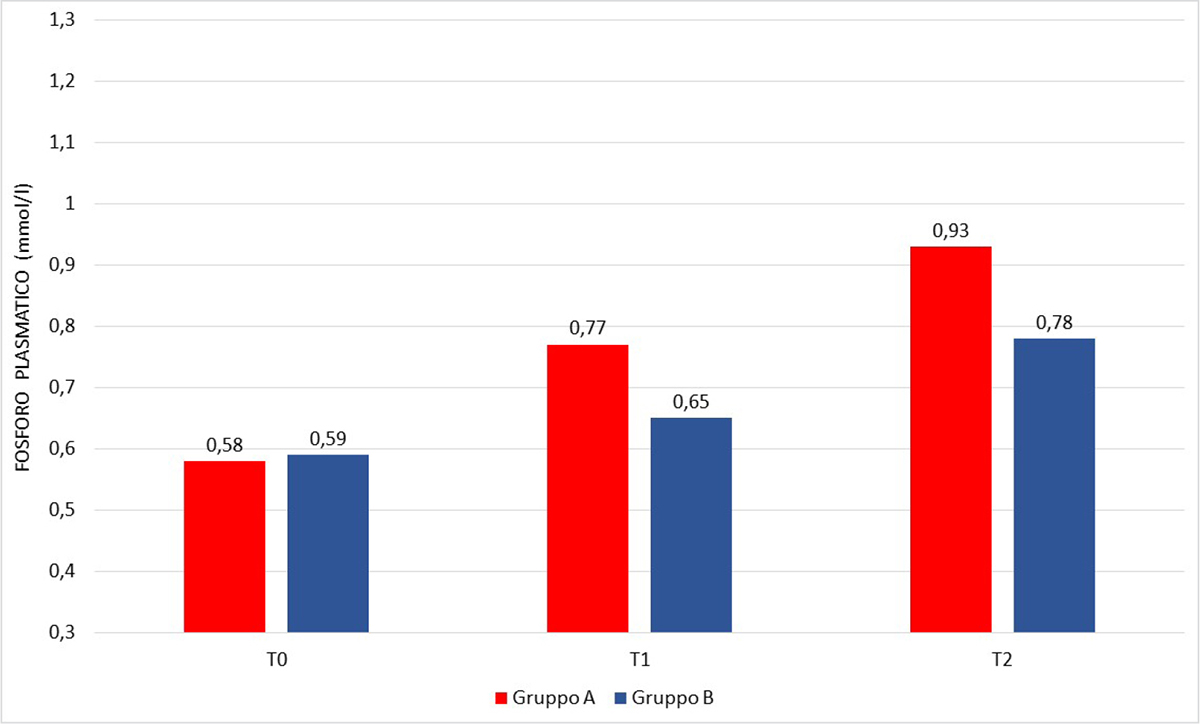
Fig. 1 - Fosforo plasmatico a T0, T1 e T2 nel gruppo A vs gruppo B.
| Gruppo A1 | Gruppo A2 | p-value | |
|---|---|---|---|
| Fosforo plasmatico T0 (mmol/L) | 0,65 ± 0,09 | 0,49 ± 0,09 | <0,01 |
| Fosforo plasmatico T1 (mmol/L) | 0,87 ± 0,21 | 0,62 ± 0,11 | <0,02 |
| Fosforo plasmatico T2 (mmol/L) | 1,04 ± 0,24 | 0,79 ± 0,09 | <0,05 |
| P-value T0-T2 | <0,002 | <0,001 | |
| Fosforo urinario T0 (mmol/24 h) | 22,4 ± 7,83 | 26,3 ± 10,95 | <0,45 |
| Fosforo urinario T2 (mmol/24 h) | 21,44 ± 11,84 | 27,36 ± 5,71 | <0,28 |
| P-value T0-T2 | <0,72 | <0,86 |
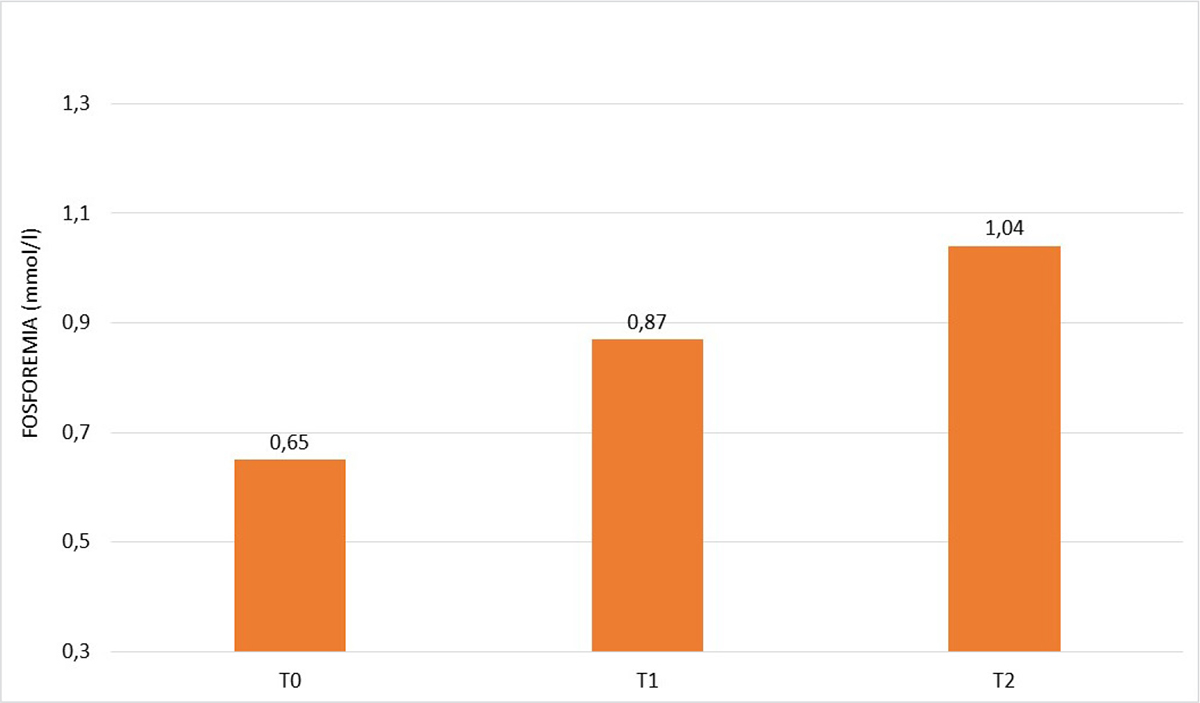
Fig. 2 - Andamento della fosforemia nel gruppo a sola dieta A1 (8 pazienti) a T0, T1 e T2.
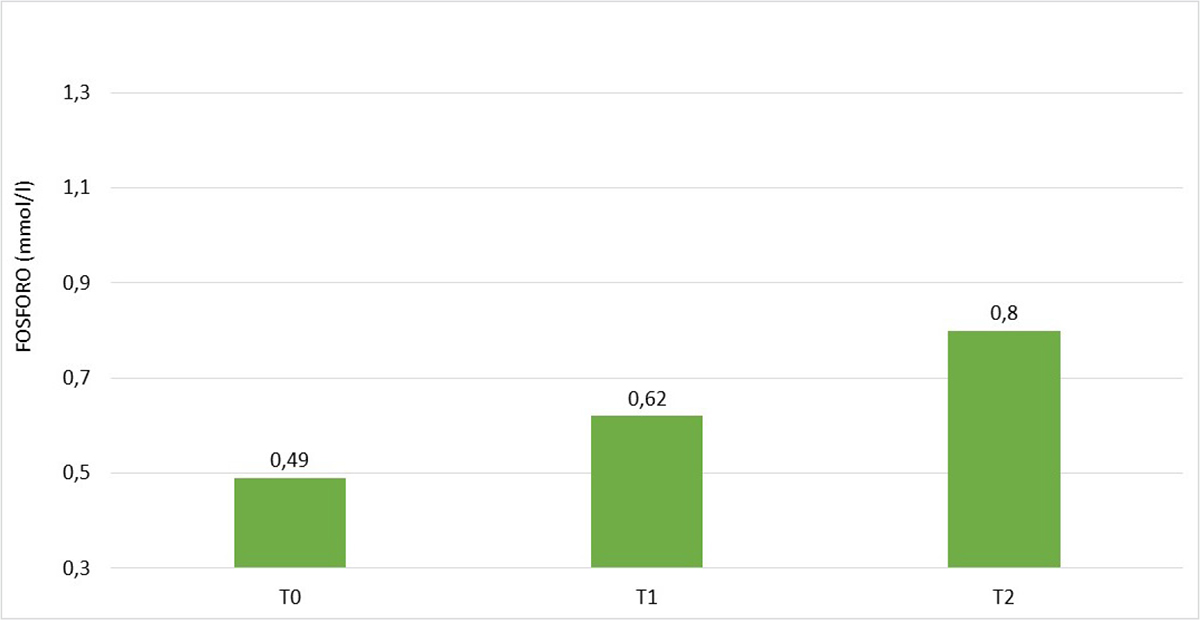
Fig. 3 - Andamento della fosforemia nel gruppo A2 (6 pazienti), rilevata a T0, T1 e T2.
Il nostro studio è il primo disegnato con l’intento di valutare l’efficacia di un counseling e della prescrizione dietetica sui livelli di fosforemia nell’immediata fase post-trapianto di rene.
Relativamente all’apporto calorico, abbiamo osservato che in tutta la coorte di pazienti arruolati nello studio è rimasto quasi invariato nei tre mesi successivi al trapianto mentre l’apporto proteico è moderatamente aumentato parallelamente a quello del fosforo. Invece, come atteso, nei pazienti trattati anche con integratore alimentare (gruppo A2) si è osservato complessivamente un maggiore introito di fosforo (+417 mg/die vale a dire 6 mg/kg, p < 0,01).
In tutta la coorte di pazienti arruolati è stato osservato un aumento dell’assunzione di fosforo di origine animale (+20%), dato particolarmente importante in quanto questo presenta una biodisponibilità superiore al fosforo di origine vegetale. Infatti, il fosforo presente nei vegetali è prevalentemente sotto forma di fitato, che può liberarsi solo mediante la fitasi, enzima non presente nell’uomo (14,15,20).
A tre mesi dal trapianto la fosforemia dei pazienti del nostro studio era mediamente rientrata nei limiti di norma; tuttavia, nei pazienti del gruppo A1 si è osservato un aumento, anche se non statisticamente significativo, superiore a quanto rilevato nel gruppo A2. Questo dato può essere spiegato dalle più profonde anomalie del metabolismo del fosforo presenti nel gruppo A2.
Wolf et al. (21-23) hanno riportato che nei pazienti con livelli di fosforo sierico più bassi tre mesi dopo il trapianto di rene sono associati livelli più elevati di FGF-23, fattore di crescita dei fibroblasti che induce fosfaturia e che inibisce la sintesi di 1,25-diidrossivitamina D. I dati dei nostri pazienti sono in accordo con una fosfaturia più elevata nel gruppo A2 rispetto al gruppo A1, che tuttavia non ha raggiunto la significatività statistica probabilmente a causa della bassa numerosità della nostra coorte di pazienti. Comunque si può assumere che tale differenza possa essere attribuita non solo al maggior apporto di fosforo ma anche ad anomalie dei meccanismi regolatori.
In conclusione, l’approccio dietetico supportato dal counseling nutrizionale si è rivelato efficace nel trattamento dell’ipofosforemia post-trapianto di rene. I risultati di questo studio pilota possono costituire un’utile working hypothesis per studi con una maggiore numerosità al fine di dimostrare l’utilità dell’approccio dietetico e del counseling nutrizionale per l’ipofosforemia post-trapianto di rene.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. US Renal Data System (USRDS). USRDS Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States Vol 7.2. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Disease; 2013. Online (Accessed June 2022).
- 2. Baia LC, Heilberg IP, Navis G, de Borst MH; NIGRAM investigators. Phosphate and FGF-23 homeostasis after kidney transplantation. Nat Rev Nephrol. 2015;11(11):656-666. CrossRef PubMed
- 3. Ambühl PM, Meier D, Wolf B, Dydak U, Boesiger P, Binswanger U. Metabolic aspects of phosphate replacement therapy for hypophosphatemia after renal transplantation: impact on muscular phosphate content, mineral metabolism, and acid/base homeostasis. Am J Kidney Dis. 1999;34(5):875-883. CrossRef PubMed
- 4. Chadban S, Chan M, Fry K, et al; CARI. The CARI guidelines. Nutritional management of hypophosphataemia in adult kidney transplant recipients. Nephrology (Carlton). 2010;15(suppl 1):S48-S51. CrossRef PubMed
- 5. Sakhaee K. Post-renal transplantation hypophosphatemia. Pediatr Nephrol. 2010;25(2):213-220. CrossRef PubMed
- 6. Pochineni V, Rondon-Berrios H. Electrolyte and Acid-Base Disorders in the Renal Transplant Recipient. Front Med (Lausanne). 2018;5:261. CrossRef PubMed
- 7. Wolf M, Weir MR, Kopyt N, Mannon RB, Von Visger J, Deng H, Yue S, Vincenti F. A Prospective Cohort Study of Mineral Metabolism After Kidney Transplantation. Transplantation. 2016 Jan;100(1):184-93. CrossRef PubMed
- 8. Ghanekar H, Welch BJ, Moe OW, Sakhaee K. Post-renal transplantation hypophosphatemia: a review and novel insights. Curr Opin Nephrol Hypertens. 2006;15(2):97-104. CrossRef PubMed
- 9. Torres A, Lorenzo V, Salido E. Calcium metabolism and skeletal problems after transplantation. J Am Soc Nephrol. 2002;13(2):551-558. CrossRef PubMed
- 10. Haffner D, Leifheit-Nestler M. CKD-MBD post kidney transplantation. Pediatr Nephrol. 2021;36(1):41-50. CrossRef PubMed
- 11. Torregrosa JV, Bover J, Cannata Andía J, et al.; Spanish Nephrology Society. Spanish Society of Nephrology recommendations for controlling mineral and bone disorder in chronic kidney disease patients (S.E.N.-M.B.D.). Nefrologia. 2011;31 Suppl 1:3-32. CrossRef PubMed
- 12. Uma Chitra, K. Sunitha Premalatha. Nutritional management of renal transplant patients, Indian Journal of Transplantation, 2013;7:88-93. CrossRef
- 13. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant. 2009 Nov;9 Suppl 3:S1-155. CrossRef PubMed
- 14. Calvo MS, Lamberg-Allardt CJ. Phosphorus. Adv Nutr. 2015;6(6):860-862. CrossRef PubMed
- 15. Kalantar-Zadeh K, Gutekunst L, Mehrotra R, et al. Understanding sources of dietary phosphorus in the treatment of patients with chronic kidney disease. Clin J Am Soc Nephrol. 2010;5(3):519-530. CrossRef PubMed
- 16. Chan M, Patwardhan A, Ryan C, et al; Caring for Australasians with Renal Impairment; Dietitians Association of Australia. Evidence-based guidelines for the nutritional management of adult kidney transplant recipients. J Ren Nutr. 2011;21(1):47-51. CrossRef PubMed
- 17. LARN. Livelli di Assunzione di Riferimento di Nutrienti ed energia per la popolazione italiana, IV Revisione, SINU. Roma. SICS Editore. 2014;32-71.
- 18. Tabelle di Composizione Degli Alimenti, CREA 2019. Disponibile Online
- 19. Rho MR, Lim JH, Park JH, et al. Evaluation of nutrient intake in early post kidney transplant recipients. Clin Nutr Res. 2013;2(1):1-11. CrossRef PubMed
- 20. Kovesdy CP, Bross R, Shinaberger CS, et al. Understanding sources of dietary phosphorus in the treatment of patients with chronic kidney disease. Clin J Am Soc Nephrol. 2010 Mar;5(3):519-30. CrossRef PubMed
- 21. Bhan I, Shah A, Holmes J, et al. Post-transplant hypophosphatemia: Tertiary ‘Hyper-Phosphatoninism’? Kidney Int. 2006;70(8):1486-1494. CrossRef PubMed
- 22. Sánchez Fructuoso AI, Maestro ML, Calvo N, et al. Role of fibroblast growth factor 23 (FGF23) in the metabolism of phosphorus and calcium immediately after kidney transplantation. Transplant Proc. 2012;44(9):2551-2554. CrossRef PubMed
- 23. Wolf M. Update on fibroblast growth factor 23 in chronic kidney disease. Kidney Int. 2012 Oct;82(7):737-47. CrossRef PubMed