 |
G Clin Nefrol Dial 2020; 32: 135-142 DOI: 10.33393/gcnd.2020.2180 REVIEW |
 |
L’ecografia del rene trapiantato: caratteristiche specifiche e utilizzo nella pratica clinica
Ultrasound of renal transplantation: specific characteristics and use in clinical practice
Renal transplantation (RTx) is at the moment the best therapy for end stage renal disease. In recent years, the increase of the global knowledge about immunology and RTx complications allowed a significant increase in the duration of RTx and in patients’ survival.
RTx ultrasound gives to transplant clinicians the possibility of carrying out a structural monitoring of the graft from the beginning throughout the duration of the RTx. Then, ultrasound is a first-level method that all clinicians should be able to perform and interpret.
In this paper we will present some basic concepts about the ultrasound image of the “healthy” transplanted kidney, relating them to the main pathological pictures that may occur during a clinical-ultrasound monitoring of the RTx.
Finally, some concepts regarding the use and usefulness of ultrasound with contrast media (CEUS) in the evaluation and the follow-up of RTx will be discussed.
Keywords: CEUS, Echo color Doppler, Renal transplantation, Ultrasonography
Received: July 28, 2020
Accepted: September 4, 2020
Published online: October 16, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il trapianto renale (TR) rappresenta, a oggi, la migliore opzione terapeutica per i pazienti affetti da insufficienza renale cronica (IRC). Esso, infatti, oltre a migliorare sensibilmente l’omeostasi generale dei pazienti nefropatici, garantisce ad essi una maggiore sopravvivenza e una migliore qualità della vita rispetto alla dialisi (1).
La migliore conoscenza dei meccanismi immunologici legati alla tolleranza del TR ha permesso un suo crescente sviluppo grazie all’utilizzo di nuovi farmaci immunosoppressori e di una sempre maggiore personalizzazione della terapia anti rigetto; ciò ha determinato non solo un incremento significativo della durata del TR stesso, ma ha anche reso possibile un’ampliamento del pool di pazienti trapiantabili, che, per la loro complessità clinica, in passato non avevano accesso alla lista di trapianto renale (2).
L’ecografia del rene trapiantato (ERT) è stata introdotta nella pratica clinica all’inizio degli anni ’70, mentre lo studio Doppler ha visto il suo ingresso solo successivamente. Con il passare del tempo, queste tecniche hanno assunto sempre più importanza, essendo economiche, non invasive e permettendo l’analisi del TR senza esporlo a rischi di tossicità. L’ERT è ormai ubiquitariamente utilizzata nella valutazione preprocedurale e nell’esecuzione delle biopsie del TR e il suo utilizzo permette una riduzione importante delle maggiori complicanze legate alla procedura (3).
Come vedremo più avanti, la possibilità di effettuare, lungo tutta la durata del TR, un monitoraggio ecografico del graft rende l’ERT una metodica di primo livello che ogni clinico che si occupa di TR dovrebbe essere in grado di effettuare e di interpretare.
L’obiettivo di questo lavoro è di presentare inizialmente dei concetti base riguardanti l’immagine ecografica del rene trapiantato sano, rapportandoli, poi, ai principali quadri patologici che si possono presentare nel corso di un monitoraggio clinico-ecografico del TR. Nell’ultima parte del lavoro, infine, verranno trattati alcuni concetti riguardanti l’utilizzo e l’utilità dell’ecografia con mezzo di contrasto (CEUS) nella valutazione e nel follow-up del TR.
Ecografia renale del rene trapiantato “sano”
La valutazione ecografica di qualsiasi organo del corpo umano non può esimersi da un’accurata conoscenza dell’anatomia strutturale dell’organo studiato e delle strutture circostanti.
Il rene trapiantato viene solitamente posto in posizione extra peritoneale, a livello della fossa iliaca destra o sinistra. La scelta della sede di impianto è in funzione della storia chirurgica del paziente, delle caratteristiche dei vasi iliaci e delle preferenze dell’operatore chirurgo. L’anastomosi vascolare è solitamente ottenuta con i vasi iliaci esterni.
In caso di un TR da donatore deceduto, l’arteria viene prelevata con un piccolo patch aortico in modo da facilitarne l’anastomosi termino-laterale con l’arteria iliaca esterna. In presenza, invece, di un TR da donatore vivente, l’arteria renale è ottenuta totalmente con il rene del donatore ed è anastomizzata direttamente o termino-lateralmente o termino-terminalmente all’arteria iliaca esterna.
In entrambi i tipi di donazione, i vasi venosi vengono anastomizzati termino-lateralmente alla vena iliaca esterna del ricevente.
Infine, l’uretere del donatore viene anastomizzato alla vescica del ricevente attraverso la creazione di una nuova ureterocistotomia (4).
L’ERT, eseguita utilizzando preferibilmente sonde convex a banda larga e con frequenza di 3,5-7 MHz, andrebbe organizzata già nelle prime ore post-operatorie e, comunque, possibilmente entro le 24 ore. Essendo il rene trapiantato molto superficiale, è possibile anche ottenere una sua visualizzazione ottimale con sonde lineari small-parts da 5-8 MHz.
Nell’immediato post TR, l’ERT permette l’identificazione di eventuali criticità legate alla procedura chirurgica. È importante che l’operatore esegua un’attenta valutazione del graft appena trapiantato, valutando, in particolare, le dimensioni e l’ecogenicità, e che si accerti dell’assenza di dilatazioni delle vie urinarie e di raccolte perirenali.
Dal punto di vista morfostrutturale, il rene trapiantato appare molto simile a quello nativo, anche se l’assenza della capsula adiposa perirenale e la sua posizione molto superficiale potrebbero modificarne leggermente le caratteristiche ecogeniche (Fig. 1).
Anche le sue dimensioni sono simili a quelle dei reni nativi, anche se, progressivamente, tendono a incrementarsi per i processi di iperfiltrazione. Il parenchima renale e la differenziazione cortico-midollare sono solitamente ben visibili e caratterizzabili. Il sistema collettore di un TR ben funzionante può apparire lievemente dilatato, anche in relazione alla presenza dello stent ureterale JJ, ben visibile ecograficamente grazie alla sua immagine a doppio binario lineare che termina, da una parte, nella pelvi renale e, dall’altra, in vescica. In aggiunta, l’elevata quantità di urina che scorre nelle vie urinarie principali e la perdita di tonicità ureterale derivata dalla sua denervazione sono fattori potenzialmente favorenti lo sviluppo di idronefrosi moderata.
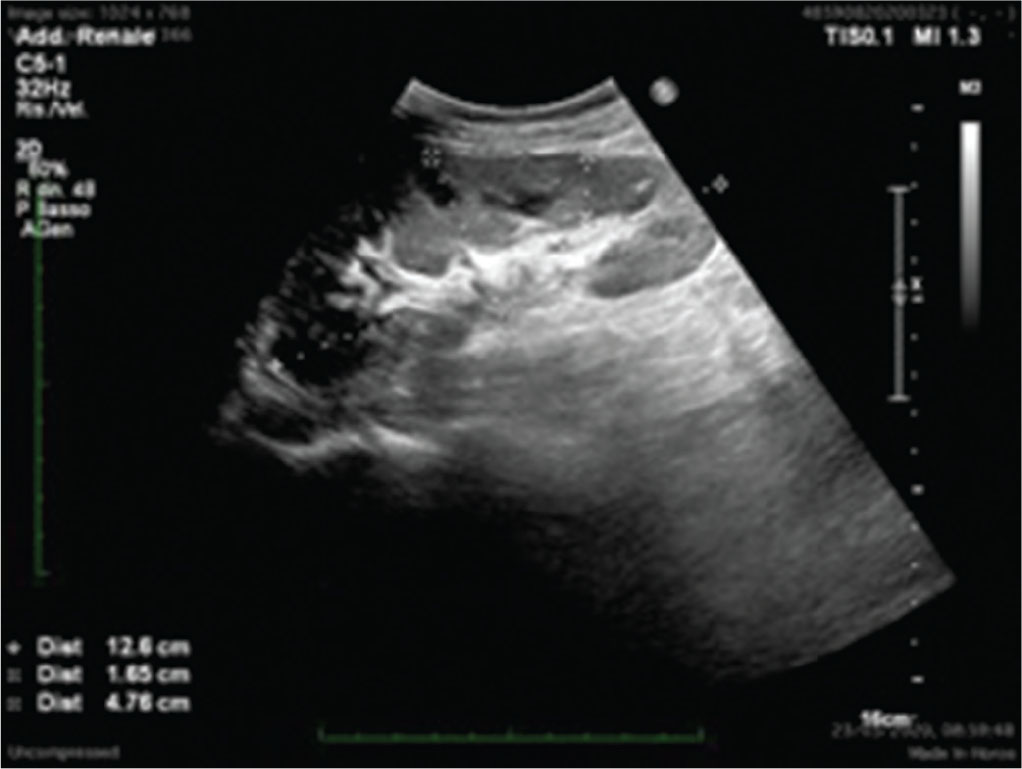
(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
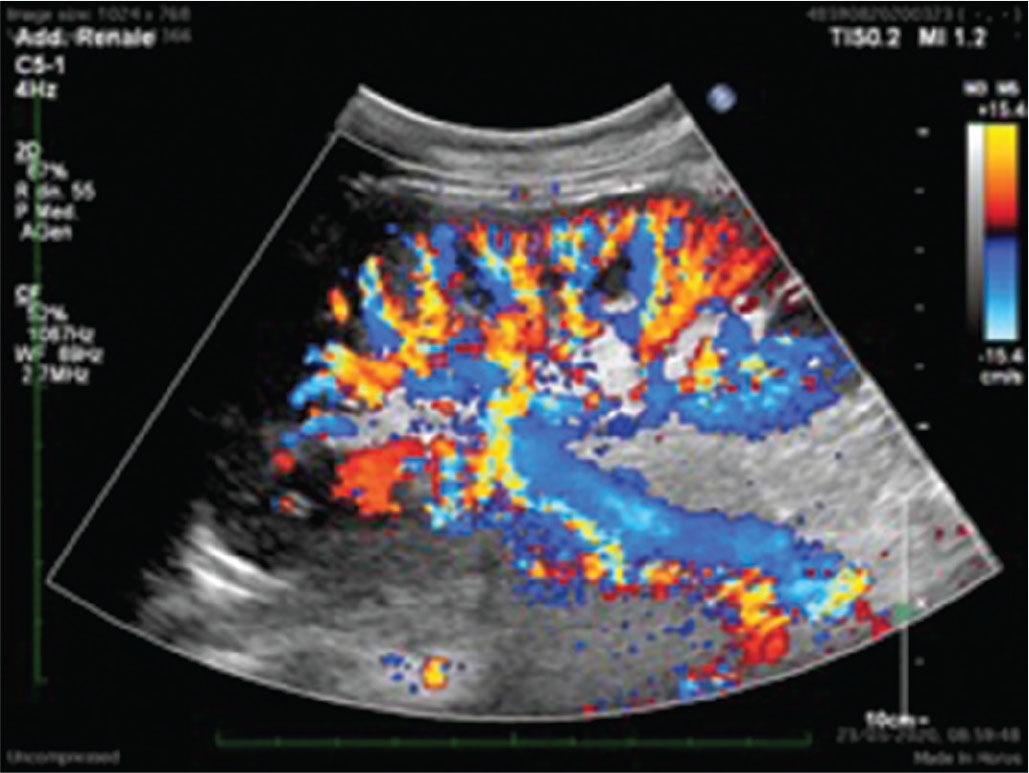
Lo studio Doppler del TR è altrettanto importante. Particolare attenzione andrà riservata alla valutazione del corretto flusso a carico delle arterie iliache, dell’anastomosi e della corretta vascolarizzazione all’interno del TR, con misurazione dei principali indici di flusso. Già in questa fase, le analisi color Doppler e, in particolare, il power Doppler possono essere molto sensibili nell’escludere la presenza di stenosi iliache/renali e di trombosi arteriose o venose, qualora ve ne sia il sospetto clinico (2).
Come si può ben apprezzare nella Figura 2, i vasi del TR sano sono certamente ben rappresentati, spesso addirittura in maniera migliore rispetto al rene nativo.
L’arteria renale normale è caratterizzata da una curva spettrale monofasica, con componenti diastoliche discrete. Andando più in periferia, la curva spettrale si caratterizza sempre per un tracciato a bassa resistenza, ma fortemente influenzato dalle condizioni generali del microcircolo arterioso del TR. Va effettuata un’accurata e globale valutazione degli indici di resistenza (IR), con valori normali che dovrebbero assestarsi sempre uniformemente sotto 0,8, campionando quante più zone possibili del TR.
Ecografia renale nei principali quadri patologici
Come detto in precedenza, l’ERT rappresenta un punto cardine nella valutazione e nel follow-up del TR. In particolare, la modificazione di alcune immagini o di alcune caratteristiche ecografiche del rene trapiantato può essere d’aiuto, in presenza di un sospetto clinico legato ad anomalie biochimiche e /o urinarie, nel confermare la presenza di patologie acute o croniche a carico del TR. In alcune circostanze, inoltre, l’ERT può essere utilizzata come un utile strumento di follow-up terapeutico.
(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
Nei prossimi paragrafi verrà descritto il ruolo dell’ERT nella valutazione, nella diagnosi e nel follow-up dei principali quadri morbosi del TR, suddivisi schematicamente in:
– alterazioni parenchimali;
– alterazioni vascolari;
– alterazioni urologiche;
– raccolte perirenali.
Alterazioni parenchimali
Le alterazioni parenchimali sono sicuramente le problematiche più frequenti durante un TR. Clinicamente si manifestano spesso solo con anomalie biochimiche e/o urinarie, quindi, nelle prime fasi post TR, con una ritardata ripresa della normale funzione renale, mentre, nelle fasi successive, con un incremento degli indici di ritenzione azotata, associato o meno alla presenza di proteinuria (5).
Nell’ambito delle anomalie parenchimali, i quadri di più frequente riscontro sono la necrosi tubulare acuta (NTA), il rigetto (acuto o cronico) e il danno legato alle terapie immunosoppressive, in particolare agli inibitori della calcineurina, e alle infezioni.
La necrosi tubulare acuta è un rilievo sempre più frequente nella pratica clinica. Essa si verifica soprattutto nel trapianto da donatore cadavere e, solitamente, si risolve in circa 15-45 giorni. Diversi fattori concorrono allo sviluppo di una NTA. L’importanza maggiore sicuramente ricade sull’ischemia a cui il graft viene esposto, ma, potenzialmente, può anche essere legata a ipotensioni marcate nell’immediato post trapianto. L’ERT, sfortunatamente, non mostra caratteri di specificità nell’identificare una NTA. Spesso l’operatore può rilevare solo un modesto ingrandimento globale del rene, associato a una discreta alterazione dell’ecogenicità del parenchima e delle piramidi renali. Frequentemente si possono evidenziare, all’analisi color Doppler, alterazioni del flusso diastolico, con una sua riduzione e un consensuale incremento degli IR e degli indici di pulsatilità a carico dei vasi interlobari. C’è da dire, in ogni caso, che queste alterazioni possono presentarsi similarmente anche in presenza di una trombosi della vena renale o in quadri di severi rigetti.
Il rigetto e la sua diagnosi precoce rappresentano a oggi un’importante sfida per i centri trapianto. Scolasticamente, si possono distinguere tre diverse forme di rigetto: rigetto iperacuto, rigetto acuto e rigetto cronico. La distinzione tra le diverse forme è legata essenzialmente alla tempistica rispetto al TR. Il rigetto iperacuto insorge entro 24 ore dal TR, richiedendo l’espianto immediato del trapianto. Il rigetto acuto è una forma che si manifesta nell’arco delle prime settimane post trapianto, mentre il rigetto cronico è caratterizzato da un progressivo deterioramento funzionale del rene a partire dal terzo mese (6). L’ERT, in questo caso, può essere molto d’aiuto in presenza di un sospetto clinico, specialmente in quei casi in cui sia stato valutato ecograficamente il rene precedentemente. Infatti, il rilievo di un significativo ingrandimento dimensionale con aspetto globoso del rene associato a una significativa variazione dell’ecogenicità parenchimale può far sospettare in maniera importante un rigetto acuto. Il Doppler può rilevare elevati indici di resistenza al flusso, con valori >0,9. Contrariamente al rigetto acuto, l’aspetto ecografico del rigetto cronico, che, a oggi, rappresenta la causa principale di perdita di TR a lungo termine, non è tipico e può variare da una situazione di normalità a quadri di franca iperecogenicità, associata ad assottigliamento della corticale e a una riduzione significativa della vascolarizzazione parenchimale intrarenale.
Questi rilievi, inoltre, rendono difficilmente eseguibile la biopsia del rene trapiantato per l’alto rischio di complicanze procedurali.
Il danno legato alle terapie immunosoppressive e, in particolare, agli inibitori della calcineurina (ciclosporina e tacrolimus) è causato dalla vasocostrizione a carico dell’arteriola afferente dei glomeruli procurata da questi agenti e dalla stimolazione di processi pro fibrotici intrarenali ad essi legati. Il danno acuto, determinato da alti livelli dei farmaci nel sangue, può essere saltuariamente evidenziato ecograficamente, con un incremento significativo degli indici di resistenza e una riduzione nella brillante vascolarizzazione caratteristica del rene trapiantato sano. Evidentemente, un danno cronico legato a questi farmaci sarà caratterizzato dall’iperecogenicità del parenchima renale e da quelle caratteristiche ecografiche che sono tipiche dei quadri di nefropatia cronica avanzata.
Il ruolo dell’ecografia nella diagnostica delle patologie infettive renali è piuttosto controverso. Ciò che deve guidare l’ecografista in senso infettivo è sicuramente un sospetto clinico, caratterizzato da una febbre di origine sconosciuta, magari associata a dolore a carico del rene. A volte, però, i pazienti possono anche essere asintomatici e apiretici, in quanto la terapia immunosoppressiva potrebbe in parte limitare o nascondere le evidenze di un processo infettivo (7). In ogni caso, come nel rene nativo, l’aspetto ecografico delle infezioni del rene trapiantato è abbastanza variabile e aspecifico. Gli aspetti ecografici prevalenti della pielonefrite sono caratterizzati da un rene che può apparire globoso, con un modesto ispessimento del grasso perirenale e, spesso, un incremento dell’ecogenicità parenchimale determinato dall’estensione del processo infiammatorio nel rene. Nel parenchima renale, inoltre, è possibile spesso apprezzare focali lesioni isolate o multiple lesioni iperecogene che sovvertono la struttura della corticale e, conseguentemente, alterano il disegno parenchimale. L’ecografia può essere di notevole aiuto nell’identificazione di ascessi renali, che possono presentare una complessa forma cistica anecogena o iperecogena in presenza di materiale corpuscolato. Procedure eco-guidate o TC-guidate possono essere utilizzate per drenare in sufficiente sicurezza tali lesioni (8).
Qualsiasi tipo di nefropatia, sia essa primariamente parenchimale, vascolare o urologica, in fase terminale determina il fallimento del TR. Il trapianto renale non funzionante solitamente viene lasciato in situ. L’ERT è importante anche una volta che il trapianto è fallito. È essenziale praticare un monitoraggio stretto delle caratteristiche ecografiche del TR nel corso della progressiva riduzione della terapia immunosoppressiva e, ancora, nel follow-up a lungo termine. Rigetti acuti possono manifestarsi e possono rendersi particolarmente pericolosi anche per la vita del paziente, così come, nel lungo temine, lesioni neoplastiche possono svilupparsi sul rene trapiantato ormai non più funzionante. Dal punto di vista ecografico, il rene trapiantato cronico e non funzionante non ha caratteristiche dissimili da quelle di un rene nativo non funzionante: infatti, le dimensioni si riducono progressivamente, viene completamente alterata la differenziazione cortico-midollare e si osserva una globale riduzione della vascolarizzazione intraparenchimale. Spesso si possono presentare degenerazioni cistiche anche particolarmente estese (soprattutto dopo molto tempo dalla ripresa della terapia sostitutiva) e il parenchima può essere sede anche di calcificazioni estese (Fig. 3).
Alterazioni vascolari
Le complicanze vascolari sono probabilmente il gruppo di patologie in cui l’ERT trova la principale applicazione e utilità. Rappresentano un’importante causa di perdita del graft e possono essere potenzialmente gravate anche da un alto grado di mortalità e morbilità. Nonostante le metodiche di imaging più raffinate, come l’angiografia o l’angio-risonanza, rappresentino sicuramente le metodiche di diagnosi più sensibili e specifiche di tutte le complicanze vascolari, per la sua semplicità e rapidità di esecuzione, l’eco Doppler deve essere sempre eseguito prima di utilizzare metodiche di secondo livello.
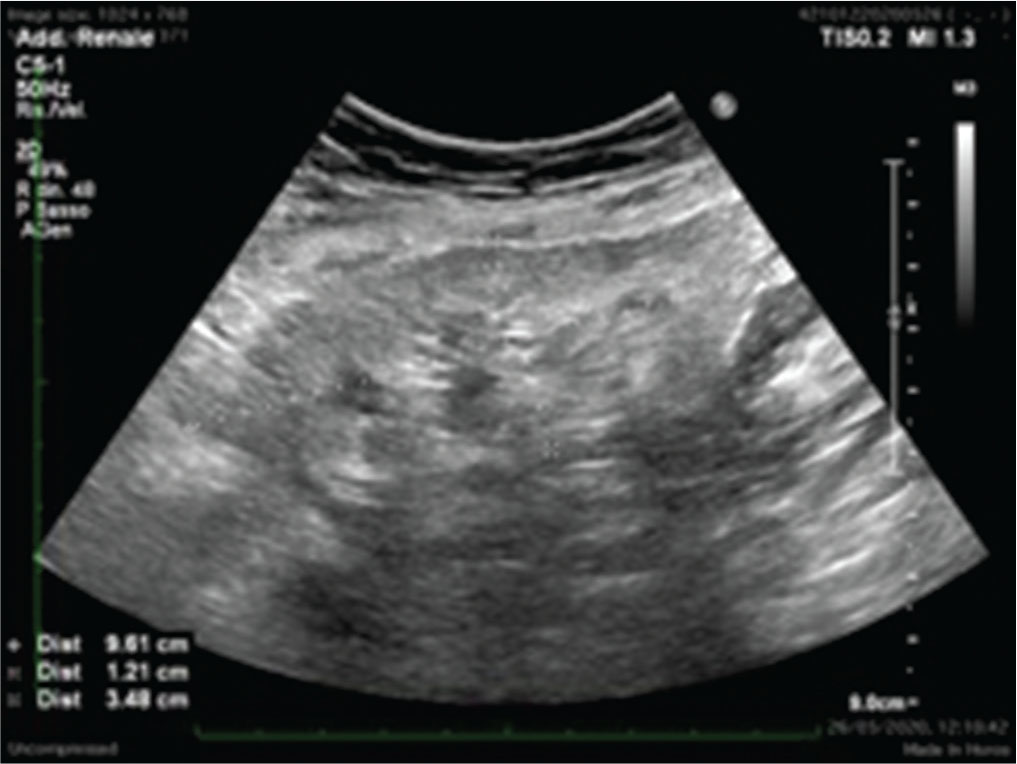
(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
La complicanza vascolare più frequente in ambito trapiantologico è rappresentata dalla stenosi dell’arteria renale. Altre complicanze, meno frequenti ma altrettanto importanti, sono la trombosi della vena renale e la trombosi dell’arteria renale.
La stenosi dell’arteria renale del rene trapiantato solitamente dà segno di sé nei primi tre mesi post trapianto (9). La valutazione dell’arteria renale dovrebbe essere effettuata in ogni esame ecografico del rene trapiantato, con particolare attenzione in quei casi in cui vi sia un sospetto clinico. I segni di sospetto sono: 1) presenza di ipertensione molto severa e di recente insorgenza resistente alla terapia medica, 2) presenza di soffio sistolico a livello dei vasi del rene trapiantato e 3) recente peggioramento della funzione renale.
L’arteria renale deve essere mappata utilizzando tecniche color Doppler, valutando l’arteria renale possibilmente in tutta la sua interezza, facendo attenzione alla possibile distorsione del segnale colore da sottocampionamento (aliasing) e all’incremento significativo della velocità di flusso. La sensibilità dell’eco color Doppler varia tra l’87% e il 94%, con una specificità compresa tra l’86% e il 100%, con falsi positivi causati dall’inginocchiamento (kinking) dell’arteria renale o da compressione estrinseca. Nella Tabella I sono riassunti i criteri diagnostici eco color Doppler di stenosi dell’arteria renale del rene trapiantato (10,11).
Se una stenosi dell’arteria renale è una complicanza vascolare che può dar segno di sé relativamente lentamente, la trombosi dell’arteria e della vena renale sono due eventi che rappresentano delle vere e proprie urgenze mediche. Entrambe sono abbastanza rare, presentandosi rispettivamente in meno dell’1% e del 5% dei trapianti renali rispettivamente ed entrambe sono complicanze tipiche del primo periodo post trapianto. Inoltre, la presentazione clinica delle due problematiche è abbastanza simile ed è caratterizzata da un’interruzione improvvisa della funzione urinaria, da dolore e da tensione a livello addominale in prossimità del trapianto.
| Criteri eco color Doppler di stenosi dell’arteria renale nel trapianto renale | |
|
Criteri diagnostici diretti – VPS >2-2,5 m/s – Gradiente trans stenotico (rapporto stenosi/prestenosi) 2:1 – Rapporto tra VPS nell’arteria renale e nell’arteria iliaca >3,5:1 |
Criteri diagnostici indiretti – Scomparsa del picco sistolico precoce (early systolic peak) – Acceleration index <3,0 m/s2 – Acceleration time >0,07/s – Riduzione significativa degli IR intrarenali (<0,5) |
In presenza di una trombosi acuta e totale dell’arteria renale, il rene trapiantato si mostrerà diffusamente ipoecogeno e globoso e le immagini color Doppler mostreranno un’assenza totale di flusso arterioso dalla porzione a valle del trombo fino al trapianto renale. L’organo risulterà totalmente non vascolarizzato. In presenza, invece, di un infarto segmentale del rene trapiantato, si potrà evidenziare nell’area ischemica una massa ipoecogena rispetto al parenchima circostante, con margini mal definiti, delimitati da un orletto iperecogeno. Al Doppler, l’area infartuale avrà la forma caratteristica di un cuneo con apice rivolto verso la capsula renale. Tale area risulterà totalmente priva di segnale Doppler. Così come per la trombosi arteriosa, anche in presenza di una trombosi venosa acuta, il rene trapiantato si presenterà globoso e ipoecogeno e si noterà la perdita della differenziazione cortico-midollare. Del materiale trombotico potrà facilmente essere visualizzato nella vena renale. Si noterà, inoltre, una riduzione significativa della componente diastolica con un incremento importante dell’indice di resistenza fino a valori vicini all’unità.
Se, come detto precedentemente, l’ERT è in grado di aiutare l’operatore nell’esecuzione di biopsie renali, essa è di grandissima utilità nella valutazione delle complicanze determinate dalla procedura. La presenza di fistole artero-venose può riscontrarsi relativamente frequentemente (1%-16% delle biopsie renali). La formazione di una fistola artero-venosa è legata alla puntura sia della parete arteriosa che della parete venosa di due vasi intraparenchimali, che determina, quindi, una comunicazione tra i due vasi. All’analisi color Doppler si visualizzerà un’area di flusso turbolento e di aliasing con una velocità molto elevata e dei bassi indici di resistenza. È importante il monitoraggio di queste alterazioni nei giorni successivi alla procedura, in quanto esse possono aumentare di volume, rompersi o determinare un’ischemia significativa vascolare a valle. In questi casi, è opportuno valutare radiologicamente con esami con mezzo di contrasto le caratteristiche della fistola e procedere, eventualmente, alla sua embolizzazione.
Alterazioni urologiche
La maggior parte delle complicanze urologiche si verifica nei primi momenti post trapianto e, comunque, entro i primi 3-6 mesi dall’intervento. Una valutazione ecografica può permettere una diagnosi precoce e l’attuazione di processi terapeutici medici e chirurgici risolutivi.
Tra tutte le complicanze urologiche, l’ostruzione urinaria, che si manifesta clinicamente con un peggioramento aspecifico della funzione renale, è, di certo, il quadro di più frequente riscontro e il quadro in cui l’ERT ha un ruolo diagnostico principale (12) (Fig. 4).
Nel paziente portatore di rene trapiantato, la maggior parte dei quadri ostruttivi è legata a problemi coinvolgenti il terzo distale dell’uretere. Nelle prime fasi post trapianto, un edema a carico dei tessuti anastomizzati o la presenza di coaguli possono rendere difficoltoso il corretto scorrimento dell’urina in vescica attraverso un uretere denervato e, quindi, tendenzialmente ipotonico. Inoltre, alterazioni della perfusione ematica del terzo distale dell’uretere, soprattutto in presenza di ureteri molto lunghi, possono, alla lunga, determinare quadri di stenosi ureterale. L’ERT, oltre a mostrare un quadro di idronefrosi, può permettere di valutare il ruolo nello sviluppo dell’idronefrosi di eventuali raccolte perirenali (linfoceli, ematomi) (13). Occasionalmente, l’ostruzione delle vie urinarie può essere determinata da una calcificazione dello stent ureterale posizionato subito dopo il trapianto renale e che dovrebbe essere rimosso entro il secondo mese post trapianto.

(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
L’incidenza di una litiasi clinicamente rilevante nel TR si attesta intorno all’1% (9). Rispetto alla popolazione generale, i pazienti portatori di TR presentano numerosi fattori di rischio (iperparatiroidismo persistente, ipercalcemia, ipercalciuria) che li espongono a un maggiore rischio di sviluppo di calcolosi renale, nella maggior parte dei casi di ossalato/fosfato di calcio (14). Così come nel rene nativo, anche in quello trapiantato l’ecografia rileverà la presenza di un’immagine iperecogena, solitamente ben definita, caratterizzata dal classico cono d’ombra e al cosiddetto “effetto Arlecchino” (twinkling artefact). Essendo il rene trapiantato denervato, il paziente difficilmente presenterà quadri clinici di franche coliche renali, quindi un semplice peggioramento improvviso della funzione renale potrebbe incrementare il sospetto della presenza di calcolosi.
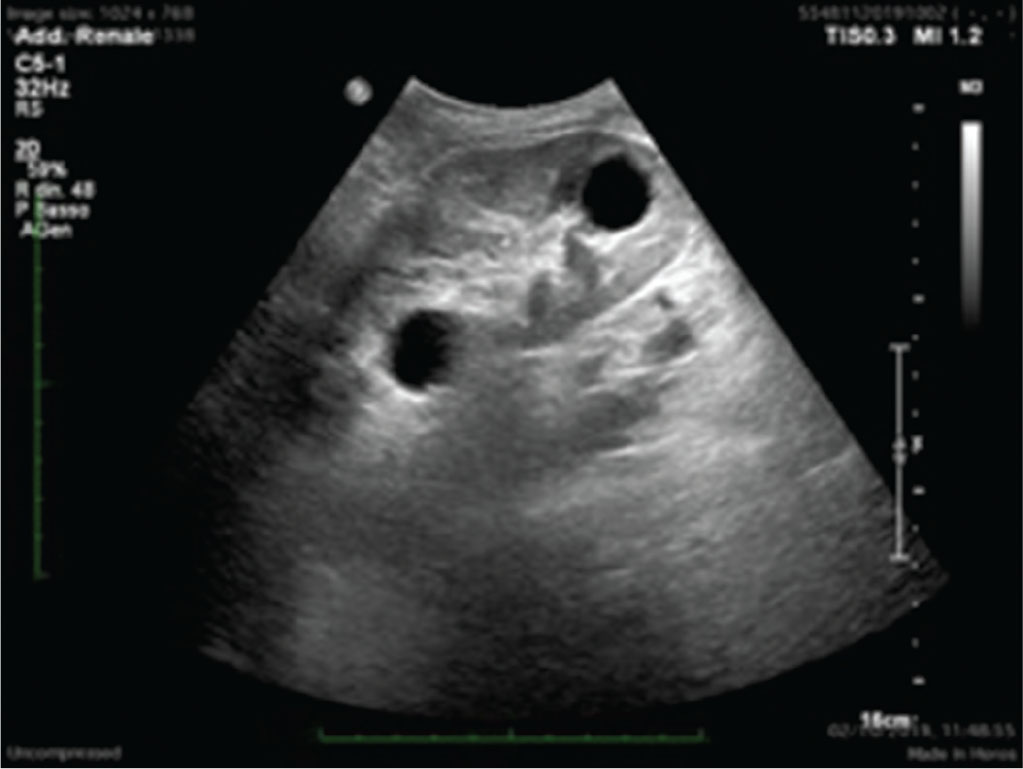
Uno stretto follow-up ecografico del rene trapiantato può permettere anche l’identificazione precoce di formazioni solide quali tumori e cisti renali. A causa dell’immunosoppressione, necessaria, a cui i pazienti sono esposti, l’incidenza di tumori solidi, specialmente della pelle, e di tumori ematologici è maggiore che nella popolazione generale. Consensualmente, rispetto alla popolazione generale, in questi pazienti è riportato un incremento significativo della prevalenza di adenocarcinomi renali sia a carico del rene trapiantato che a carico dei reni nativi, che andrebbero, quindi, sempre valutati in occasione dell’ERT. Il sospetto clinico ed ecografico non può esimersi dalla successiva esecuzione di tecniche di imaging di II livello, quali CEUS ed esami tomografici, per ottenere una migliore caratterizzazione delle lesioni. Ecograficamente, l’adenocarcinoma renale si presenta come una piccola neoformazione nodulare, soprattutto iperecogena, disomogenea per la presenza di aree necrotiche al suo interno, ma ben distinguibile dal restante parenchima renale.
Il riscontro di cisti renali è, invece, molto frequente nel rene trapiantato (Fig. 5).
Le cisti, che vanno ben caratterizzate fin dai primi riscontri ecografici per attuarne, poi, un follow-up ecografico, possono essere già presenti nel rene al momento della donazione oppure possono formarsi negli anni successivi al trapianto. Queste cisti possono distribuirsi ubiquitariamente nel parenchima renale. È importante, in ogni caso, attuarne uno stretto monitoraggio per identificarne eventuali modifiche strutturali potenzialmente in senso neoplastico.
Raccolte perirenali
Il riscontro ecografico di raccolte fluide perirenali è piuttosto frequente, soprattutto nelle fasi immediatamente successive al trapianto. Le raccolte renali più frequenti sono l’ematoma, il linfocele, l’urinoma e l’ascesso. La rilevanza clinica di queste formazioni è legata alle loro nature, alle loro dimensioni e alla loro sede. Come vedremo, l’ERT permette una loro caratterizzazione abbastanza precisa ed è, quindi, utile nella loro differenziazione. Inoltre, come per molte altre anomalie, ne permette un follow-up successivo.
(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
Gli ematomi perirenali sono riscontri abbastanza frequenti e, solitamente, sono localizzati nel tessuto sottocutaneo o intorno al trapianto stesso. Ecograficamente, l’ematoma si presenta come una formazione ben definita, inizialmente iperecogena, che, poi, organizzandosi con il tempo, tende a ridursi di ecogenicità. La maggior parte degli ematomi post-chirurgici ha una risoluzione spontanea, ma un monitoraggio ecografico quotidiano è raccomandato per definirne eventuali modifiche dimensionali ed eventuali compressioni sul rene trapiantato.
Ancora più frequente dell’ematoma è sicuramente il linfocele (Fig. 6), il cui riscontro può essere presente fino nel 20% dei pazienti trapiantati nei 2-3 mesi post trapianto.
A differenza dell’ematoma, il linfocele, determinato dallo stillicidio di vasi linfatici dei vasi iliaci e/o del rene trapiantato, presenta delle caratteristiche prettamente anecogene. Appare come una raccolta similcistica rotondeggiante e, a volte, sepimentata. Può andare in diagnosi differenziale con altre formazioni perirenali, come, per esempio, l’urinoma. In tal caso, un drenaggio della raccolta seguito da una valutazione della creatinina e del potassio nel liquido aspirato (sovrapponibile ai liquidi sierici nel caso del linfocele) può definirne meglio la natura. È molto importante la diagnosi differenziale con l’urinoma, spesso associato a dolore, febbre, contrazione della diuresi e peggioramento della funzione renale. Il progressivo incremento dimensionale della raccolta, associato alle caratteristiche cliniche sopra descritte permette la formulazione di una diagnosi che può ben essere confermata da esami di II livello come l’uro-TC.

(Personal image, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano)
Ascessi peri-trapianto non vengono osservati molto frequentemente e spesso si sviluppano nell’arco delle prime settimane post TR. L’ERT non è sempre in grado di differenziare l’ascesso dalle altre possibili raccolte perirenali. Questo perché l’ascesso può assumere, a seconda della sua composizione, un aspetto ecografico piuttosto variabile. Solitamente può apparire come una massa di raccolta fluida con, all’interno, setti o detriti oppure come una massa similsolida con, all’interno, materiali riflettenti iperecogeni (comet-tail) o coni d’ombra, determinati dalla presenza di gas all’interno. L’esecuzione di una TC può essere più utile nella caratterizzazione della lesione.
La CEUS nello studio del rene trapiantato
Le caratteristiche strutturali e la posizione anatomica in cui si trova il rene trapiantato lo rendono un organo potenzialmente ben studiabile con la CEUS. Inoltre, la possibilità di utilizzare un esame con contrasto non nefrotossico anche nelle prime fasi post trapianto fa della CEUS una metodica molto interessante nella gestione del TR.
Cosi come il rene nativo, il rene trapiantato è riccamente vascolarizzato e riceve una gran quota di sangue (circa il 10-15% della portata cardiaca). In seguito all’infusione del mezzo di contrasto, è possibile ottenere una visualizzazione progressiva ma totale di tutto l’albero vascolare renale, partendo prima dai vasi di maggior calibro, per, poi, visualizzare anche i vasi più piccoli. È, quindi, ovvio che la CEUS, al momento, abbia l’indicazione principale nello studio di patologie vascolari renali, come la necrosi corticale o l’infarto renale, e nello studio di tutte le alterazioni in cui può essere presente una modificazione della vascolarizzazione strutturare renale, come, per esempio, cisti renali o masse solide. Lo studio più specifico dell’arteria e della vena renale, specialmente per quadri di trombosi maggiori, vede ancora oggi ben caratterizzato e ben definito l’uso del color Doppler. Pertanto, nello studio di queste anomalie, a oggi, la CEUS non ha ancora trovato spazio sufficiente. È, inoltre, oggetto di studio il possibile ruolo della CEUS quantitativa nella discriminazione delle diverse patologie parenchimali e nella predizione dell’outcome renale a lungo termine. I dati oggi presenti in letteratura sono ancora insufficienti e spesso contrastanti.
Conclusioni
L’ecografia del rene trapiantato rappresenta ormai una pratica ben stabilizzata nella maggior parte dei Centri nefrologici che trattano pazienti trapiantati.
Le sue applicazioni nel paziente portatore di trapianto renale sono massimali e sicuramente, con l’utilizzo delle nuove metodiche contrastografiche, potranno, in futuro, ottenere uno sviluppo maggiore.
La vera speranza per il futuro è di poter ottenere anche una migliore e più precisa caratterizzazione ecografica di alcuni quadri patologici più specifici del paziente trapiantato (per esempio, rigetti), in modo da poter utilizzare questo esame strumentale non solo in senso diagnostico specifico, ma anche nell’attuazione di diagnosi precoci.
Disclosures
Conflict of interest: The authors declare that there is no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Vollmer WM, Wahl PW, Blagg CR. Survival with dialysis and transplantation in patients with end-stage renal disease. N Engl J Med. 1983;308(26):1553-58.
- 2. McCullough KP, Keith DS, Meyer KH, Stock PG, Brayman KL, Leichtman AB. Kidney and pancreas transplantation in the United States, 1998-2007: access for patients with diabetes and end-stage renal disease. Am J Transplant. 2009;9(4 Pt 2):894-906.
- 3. Granata A, Clementi S, Londrino F, et al. Renal transplant vascular complications: the role of Doppler ultrasound. J Ultrasound. 2014;18(2):101-7. Published 2014 Apr 11.
- 4. Greco F, Alba S, Fornara P, Mirone V. Renal transplantation: technical aspects, diagnosis and management of early and late urological complications. Panminerva Med. 2016;58(4):294-303.
- 5. Irshad A, Ackerman S, Sosnouski D, Anis M, Chavin K, Baliga P. A review of sonographic evaluation of renal transplant complications. Curr Probl Diagn Radiol. 2008;37(2):67-79.
- 6. Naik RH, Shawar SH. Renal Transplantation Rejection. In: StatPearls. Treasure Island (FL): StatPearls Publishing. May 30, 2020.
- 7. Kamath NS, John GT, Neelakantan N, Kirubakaran MG, Jacob CK. Acute graft pyelonephritis following renal transplantation. Transpl Infect Dis. 2006;8(3):140-7.
- 8. Eilers E, Moter A, Bollmann R, Haffner D, Querfeld U. Intrarenal abscesses due to Ureaplasma urealyticum in a transplanted kidney. J Clin Microbiol. 2007;45(3):1066-8.
- 9. Dodd GD 3rd, Tublin ME, Shah A, Zajko AB. Imaging of vascular complications associated with renal transplants. AJR Am J Roentgenol. 1991;157(3):449-59.
- 10. Snider JF, Hunter DW, Moradian GP, Castaneda-Zuniga WR, Letourneau JG. Transplant renal artery stenosis: evaluation with duplex sonography. Radiology. 1989;172(3 Pt 2):1027-30.
- 11. Samhan M, Al-Mousawi M, Hayati H, Abdulhalim M, Nampoory MR. Urologic complications after renal transplantation. Transplant Proc. 2005;37(7):3075-6.
- 12. Bennett LN, Voegeli DR, Crummy AB, McDermott JC, Jensen SR, Sollinger HW. Urologic complications following renal transplantation: role of interventional radiologic procedures. Radiology. 1986;160(2):531-6.
- 13. Di Carlo HN, Darras FS. Urologic considerations and complications in kidney transplant recipients. Adv Chronic Kidney Dis. 2015;22(4):306-11.
- 14. Messa P, Cafforio C, Alfieri C. Calcium and phosphate changes after renal transplantation. J Nephrol. 2010;23(Suppl 16):S175-81.