 |
AboutOpen | 2024; 11: 66-68 ISSN 2465-2628 | DOI: 10.33393/ao.2024.3097 POINT OF VIEW |
 |
La farmacovigilanza nella ricerca clinica no profit: requisiti e sfide
Pharmacovigilance in no profit clinical research. Requirements and challenges
The goals of Pharmacovigilance (PV) include early detection of new adverse reactions, broadening information on known reactions, identifying risk factors, comparing drug safety profiles, and effectively communicating safety information to healthcare professionals. In non-profit clinical research, PV activities often face challenges due to limited resources and training. An exploratory survey by the Italian Data Manager Group in 2022 highlighted critical issues in non-profit clinical trials, such as the lack of multidisciplinary support and insufficient training in PV. To strengthen PV in non-profit studies, continuous professional development and adequate resources are essential. Ensuring the presence of dedicated, well-trained professionals and promoting the use of updated tools and processes can significantly improve the management of PV activities, ultimately safeguarding patient health and maintaining high-quality research standards.
Keywords: Patient Safety Management, Pharmacovigilance process, Pharmacovigilance training, PV in no profit clinical research, Research Team
Received: April 14, 2024
Accepted: June 18, 2024
Published online: August 1, 2024
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La farmacovigilanza (FV) è definita dall’Organizzazione Mondiale della Sanità come la scienza e le attività finalizzate all’identificazione, alla valutazione, alla comprensione e alla prevenzione degli effetti avversi o di qualsiasi altro problema correlato all’uso dei medicinali (1). Non esistono, infatti, farmaci esenti da rischi ed è, quindi, necessario sorvegliare costantemente il profilo di tollerabilità dei prodotti immessi sul mercato.
Secondo la definizione adottata più di recente dalla normativa europea, una reazione avversa da farmaco è una reazione nociva e non voluta conseguente all’uso di un farmaco, incluse le reazioni avverse dovute a sovra-dosaggio, a uso improprio, ad abuso, a errori medici, all’uso al di fuori delle condizioni autorizzate dagli enti predisposti per patologia, popolazione o posologia (uso off-label) e all’esposizione per motivi professionali (2,3).
Gli obiettivi della farmacovigilanza sono molteplici, tra cui:
– individuare il più velocemente possibile nuove reazioni avverse causate da farmaci e vaccini;
– ampliare le informazioni su reazioni avverse sospette o già note;
– identificare i fattori di rischio che predispongono alla comparsa di sospette reazioni avverse in relazione a età, sesso, dosaggio, patologie concomitanti e interazioni farmacologiche;
– confrontare i profili di sicurezza di farmaci appartenenti alla stessa categoria terapeutica e valutare i vantaggi di un farmaco rispetto ad altri trattamenti disponibili per la stessa patologia;
– comunicare con attenzione tali informazioni di sicurezza a tutti gli operatori sanitari per migliorare la pratica clinica.
Più in generale, la farmacovigilanza (FV) rappresenta un utile strumento al fine di assicurare e tutelare la salute del paziente già dalla fase di pre-marketing.
I dati sulla sicurezza dei farmaci possono essere ricavati da differenti fonti: studi clinici, letteratura scientifica, rapporti inviati dalle industrie farmaceutiche e segnalazione spontanea di sospette reazioni avverse. Nessuna di queste fonti è di per sé sufficiente e solo combinata alle altre garantisce un uso più sicuro del farmaco.
Sicuramente un ruolo fondamentale è rivestito dai dati raccolti in corso di studio: le sperimentazioni cliniche, profit e no profit, hanno infatti l’obiettivo di fornire le migliori informazioni possibili sulla sicurezza e sull’efficacia dei farmaci sperimentali in tutte le fasi di studio, garantendone un utilizzo appropriato e sicuro (4).
Per quanto riguarda la ricerca no profit, spesso nella progettazione e nella realizzazione di questi studi l’attività di farmacovigilanza viene trascurata a causa, spesso, delle carenze di risorse umane e strutturali o di formazione sul tema, aspetti che rappresentano a oggi un importante ostacolo per lo sviluppo delle sperimentazioni cliniche senza scopo di lucro, che, secondo l’ultimo rapporto dell’Agenzia Italiana del Farmaco (AIFA), in Italia sono state nel 2022 pari al 15% (5). Con l’applicazione poi da gennaio 2022 del Regolamento Europeo n. 536 del 2014, che ha cambiato in maniera radicale le modalità di presentazione della documentazione e le tempistiche di valutazione, è stato inevitabile che la ricerca indipendente abbia subito ulteriori rallentamenti (6).
In linea generale la normativa vigente prevede che le responsabilità dei promotori di sperimentazioni no profit, anche in materia di farmacovigilanza, siano le medesime dei promotori industriali, allo scopo di garantire una maggiore qualità dello studio (6).
Ruolo del team di ricerca
Quando si parla di promotore no profit si fa riferimento a quella “Struttura, Ente, Istituzione pubblica, Fondazione, Associazione/società scientifica o di ricerca, Istituto di ricovero e cura a carattere scientifico o persona” che svolgono la propria attività istituzionale non a fini di lucro (7).
Le attività di farmacovigilanza nelle sperimentazioni cliniche no profit riguardano principalmente l’identificazione e la raccolta di eventi di sicurezza, la compilazione e la segnalazione di “Eventi Avversi Seri” (SAE), la valutazione dei SAE ai fini della definizione di “Sospette reazioni avverse gravi inaspettate” (SUSAR), la notifica dei decessi al Promotore e al Comitato Etico, la realizzazione di “Procedure Operative Standard” (SOP), la redazione e l’invio di “Rapporti di aggiornamento sulla sicurezza” (DSUR) e l’Inserimento SUSAR in EudraVigilance/Rete Nazionale di Farmacovigilanza.
Per quanto riguarda la comunicazione dei dati di sicurezza negli anni la normativa di riferimento ne ha sottolineato l’importanza e l’obbligatorietà da parte del promotore no profit e delle aziende farmaceutiche coinvolte, per gli adempimenti in materia di farmacovigilanza e di sicurezza delle sperimentazioni cliniche (8).
In questo contesto diventa, pertanto, necessaria la presenza di figure professionali dedicate e costantemente formate che possano contribuire e collaborare nella segnalazione delle tossicità dei farmaci oggetto di sperimentazione, concorrendo nel contempo alla migliore informazione al paziente anche attraverso la promozione e l’introduzione di strumenti informatizzati.
Nel 2022, il Gruppo Italiano Data Manager-Coordinatori di Ricerca Clinica (GIDMcrc) ha effettuato un’indagine esplorativa rivolta ai centri promotori di ricerca clinica no profit allo scopo di analizzare lo stato attuale del coinvolgimento del team di ricerca rispetto alla gestione delle attività di farmacovigilanza in termini di formazione continua, aggiornamento e sviluppo di attività educazionali all’interno delle proprie strutture di riferimento.
Le criticità più importanti segnalate dai partecipanti riguardavano la mancanza di un gruppo multidisciplinare a supporto della gestione delle attività di farmacovigilanza (66%) e un’insufficiente formazione sul tema. Più della metà dei professionisti (55%) che hanno partecipato al sondaggio infatti non ha svolto nell’ultimo anno una formazione specifica sul tema dichiarando inoltre che solo l’12% delle strutture aziendali in cui operano svolge attività di questo tipo (9).
Un promotore di studi no profit deve quindi promuovere all’interno della propria realtà professionale il miglioramento continuo delle competenze garantendo in primis ai diversi professionisti coinvolti adeguate qualifiche inerenti ai compiti assegnati (Fig. 1).
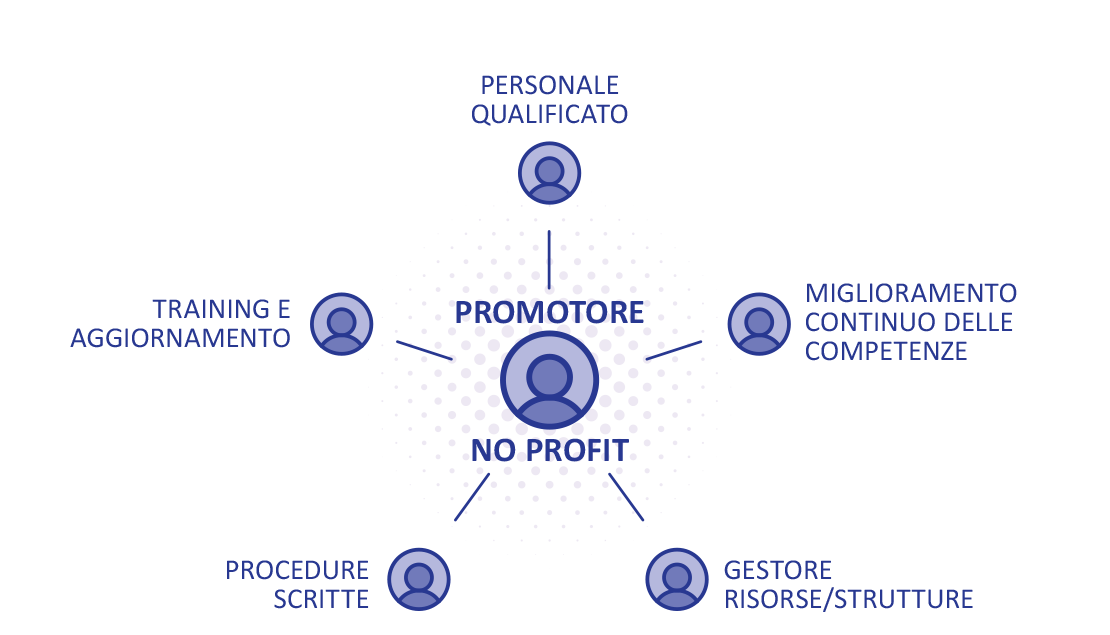
FIGURA 1 - Promotori no profit: requisiti di gestione dell’attività di farmacovigilanza.
Conclusioni
Benché la farmacovigilanza rappresenti uno degli aspetti cruciali nel ciclo di vita di una molecola, negli anni è emerso come in alcuni particolari contesti, come la ricerca accademica, questa attività sia stata di fatto sottovalutata. Un errore che non si può commettere, sia per ragioni puramente etiche sia perché ormai i livelli di qualità che vengono richiesti agli studi no profit sono esattamente uguali a quelli degli studi sponsorizzati. I dati raccolti dal Gruppo Italiano Data Manager hanno testimoniato ancora una volta quanto sia necessario sostenere e implementare sempre una formazione continua e specifica, per una migliore e adeguata gestione delle attività di farmacovigilanza nei centri promotori di studi clinici no profit. Occorrerebbe inoltre promuovere processi e garantire strumenti/attrezzature adeguati e aggiornati oltre che garantire un’adeguata gestione delle risorse, mettendo a disposizione personale qualificato nel settore della farmacovigilanza per la realizzazione delle attività previste nelle diverse fasi di svolgimento dello studio.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors’ contributions: VF conceived the presented idea. All Authors contributed to write the final manuscript. CC supervised the manuscript.
Data Availability Statement: All data supporting this study are available within the manuscript.
Bibliografia
- 1. World Health Organization (WHO). The Importance of Pharmacovigilance: Safety Monitoring of medicinal products, Products Geneva. World Health Organization; 2002. Online (Accessed April 2024)
- 2. Gazzetta ufficiale dell’Unione europea del 31 dicembre 2010. Regolamento (UE) N. 1235/2010 del Parlamento Europeo e del Consiglio del 15 dicembre 2010. Online (Accessed April 2024)
- 3. Gazzetta ufficiale dell’Unione europea del 31 dicembre 2010. Direttiva 2010/84/UE del Parlamento Europeo e del Consiglio del 15 dicembre 2010. Online (Accessed April 2024)
- 4. ICH Guidance for Industry E6(R2): Good Clinical Practice. Online (Accessed April 2024)
- 5. Agenzia Italiana del Farmaco (AIFA). La Sperimentazione Clinica dei Medicinali in Italia, 20° Rapporto Nazionale AIFA Anno 2022. Online (Accessed April 2024)
- 6. I numeri del cancro in Italia 2023, AIRTUM. Intermedia Editore. 2023: Online (Accessed April 2024)
- 7. D.M. 17.12.2004 Prescrizioni e condizioni di carattere generale, relative all’esecuzione delle sperimentazioni cliniche dei medicinali, con particolare riferimento a quelle ai fini del miglioramento della pratica clinica, quale parte integrante dell’assistenza sanitaria. Pubblicato nella Gazz. Uff. 22 febbraio 2005, n. 43. Online (Accessed April 2024)
- 8. Decreto 30 novembre 2021 Misure volte a facilitare e sostenere la realizzazione degli studi clinici di medicinali senza scopo di lucro e degli studi osservazionali e a disciplinare la cessione di dati e risultati di sperimentazioni senza scopo di lucro a fini registrativi, ai sensi dell’art. 1, comma 1, lettera c), del decreto legislativo 14 maggio 2019, n. 52. (22A01189) (GU Serie Generale n.42 del 19-02-2022). Online (Accessed April 2024)
- 9. Cagnazzo C., Cenna R., Stabile S. et al. Pharmacovigilance in no profit clinical trial: duties and responsibilities for the research team, P354 21st ISoP Annual Meeting 2022. CrossRef