 |
AboutOpen | 2019; 6(1): 78–85
ORIGINAL RESEARCH ARTICLE |
 |
Il valore di obinutuzumab per il trattamento in prima linea del Linfoma Follicolare: un’analisi basata su approccio Multicriteria Decision Analysis (MCDA)
The value of obinutuzumab for untreated advanced Follicular Lymphoma: an assessment based on Multicriteria Decision Analysis (MCDA)
Introduction: Multicriteria Decision Analysis (MCDA) provides a framework that enhances transparency and repeatability of decisions taken on a multicriteria basis.
Objective: This analysis aims at assessing obinutuzumab compared to rituximab used as a first-line treatment for Follicular Lymphoma (FL) in the Italian health care system, using an MCDA approach.
Materials and Methods: We used the EVIDEM V10 MCDA framework and a Delphi approach to scrutinize the views of a panel of physicians, payers and patients on value domains and their application to our research target.
Results: All stakeholders attached medium-high scores to FL severity (patients at higher risk of relapsing), unmet needs, obinutuzumab clinical benefit and evidence quality, and lower scores to organizational impact and, except for payers, to costs. The comparative analysis highlighted positive scores for the domains “incremental efficacy” (2.6: range −5/+5) and “incremental patient benefit” (1.5: range −5/+5) of obinutuzumab compared to rituximab. A slight increase of severe adverse events (≥3) for obinutuzumab was estimated by the panellists. Obinutuzumab compared to rituximab received a neutral evaluation for costs and for organizational impact.
Conclusion: This study reveals that MCDA could be a useful framework for evaluating a drug and it can be used to elicit the views of different stakeholder groups (as patients). The key criteria driving the value of obinutuzumab accordingly to all the stakeholder groups were disease severity, type of therapeutic benefit and unmet needs.
Keywords: Delphi, Follicular lymphoma, MCDA, Obinutuzumab
Submitted: October 18, 2019
Accepted: October 21, 2019
Published online: November 19, 2019
© 2019 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC-ND 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Premessa e domanda di ricerca
Il sistema di valutazione di nuovi farmaci, di nuove indicazioni e formulazioni di farmaci esistenti ai fini della determinazione del prezzo, delle scelte di rimborso e accesso a livello locale presenta alcuni elementi comuni tra i Paesi europei, ma anche differenze sostanziali. Le differenze riguardano le priorità attribuite ai diversi domini di tale valutazione, le modalità di integrazione dei domini per la determinazione del valore aggiunto di un nuovo farmaco rispetto ai suoi comparatori e la valutazione della coerenza tra valore aggiunto, impatto economico previsto e decisioni di rimborso, prezzo e accesso locale (1).
Tali sistemi di valutazione possono essere collocati tra due estremi rappresentati da una parte dal modello inglese, in cui il beneficio viene valutato in termini di incremento assoluto di QALYs (Quality Adjusted Life Years Saved) e la valutazione della coerenza tra impatto economico e valore di un nuovo farmaco viene misurata rapportando l’ICER (Incremental Cost Effectiveness Ratio) a un valore-soglia, e dall’altra da modelli multi-criterio caratterizzati da una bassa trasparenza rispetto, almeno, alla valutazione di coerenza tra costo e beneficio incrementale (2). Il sistema inglese presenta certamente il vantaggio di maggiore trasparenza rispetto a processo e criteri utilizzati, ma è stato criticato per la sua rigidità (cui si è intervenuto con strumenti di flessibilità, quali sconti nascosti e valori-soglia più elevati per i farmaci indicati per malattie a bassa aspettativa di vita) e per la parzialità dei QALYs quale indicatore di impatto economico (cui ha fatto seguito l’introduzione di un “budget impact test” per farmaci a impatto importante sulla spesa). D’altra parte l’uso di un approccio multi-criterio è certamente più inclusivo, ma rischia di essere poco trasparente e riproducibile. L’approccio MCDA (Multicriteria Decision Analysis) nasce proprio dall’esigenza di rendere più trasparente e riproducibile il processo di valutazione a supporto della decisione e dalla consapevolezza che le scelte dovrebbero basarsi su approcci multi-criterio, evitando l’eccessiva semplificazione rappresentata dall’ ICER (3). Tale approccio, implicitamente usato in qualunque decisione, è stato oggetto di una riflessione specifica sul suo potenziale uso nell’approvazione dei farmaci (4), nelle negoziazioni di prezzo e rimborso (5), nella scelta clinica (6) e di una riflessione sistematica di una Task Force dell’ISPOR (7). Tuttavia, la sua applicazione è stata piuttosto limitata nella ricerca e, soprattutto, nella pratica dei soggetti istituzionali (3).
Scopo del presente contributo è analizzare, mediante approccio MCDA, il valore di obinutuzumab percepito da differenti portatori di interesse italiani (clinici, pagatori e pazienti) per la sua ultima indicazione approvata con Decisione della Commissione Europea del 18/9/2017, ovvero per il trattamento di pazienti con Linfoma Follicolare (LF) avanzato non pretrattato, in associazione a chemioterapia, come terapia di induzione, seguito da obinutuzumab come terapia di mantenimento nei soggetti che ottengono una risposta. Obinutuzumab era già stato rimborsato per la Leucemia Linfatica Cronica (LLC) con Determinazione AIFA di rimborsabilità n. 46/2017 e, in seconda linea, per il LF recidivato/refrattario, con Determinazione AIFA di rimborsabilità n. 3/2017. Al momento dello svolgimento della presente ricerca non era stata ancora pubblicata la Determinazione AIFA di rimborsabilità per la nuova indicazione, mentre era già disponibile (marzo 2018) la relativa raccomandazione del NICE (National Institute for Health and Care Excellence) (8). Quest’ultimo, a fronte della costo-efficacia (ICER per QALY inferiore a £30.000) di obinutuzumab rispetto a rituximab, ne raccomanda l’utilizzo come opzione per il LF avanzato non trattato in pazienti a più alto rischio (8).
Sulla scia di tale raccomandazione, anche in ambito italiano, si è ritenuto che il target più probabile dell’estensione di rimborsabilità di obinutuzumab fosse rappresentato dai pazienti a rischio intermedio e alto [indice FLIPI (Follicular Lymphoma International Prognostic Index) ≥2; Appendice]. La valutazione comparativa è stata effettuata rispetto a rituximab, sia originator che biosimilare, standard di riferimento per il LF e comparatore nella formulazione endovenosa (forma originator) utilizzato nello studio clinico registrativo della nuova indicazione di obinutuzumab (9).
Materiali e metodi
In qualità di portatori di interesse (d’ora in avanti indicati nel testo anche come panellist) sono stati coinvolti 5 clinici (ematologi), 5 rappresentanti di pagatori regionali/di aziende sanitarie e 4 pazienti con LF. La scelta dei clinici si è ispirata all’esperienza maturata nell’area terapeutica, quella dei pagatori alla loro distribuzione geografica e al ruolo assunto a livello regionale (partecipazione attiva/supporto a Commissione Terapeutica Regionale/Aziendale), mentre i pazienti, selezionati dall’associazione “La Lampada di Aladino Onlus”, sono soggetti con LF stabilizzato di età molto variabile (range: 40-80 anni).
La valutazione dell’opinione dei panellist è avvenuta adottando la metodologia MCDA, seguendo, come modello di raccolta delle valutazioni, l’approccio EVIDEM nella sua 10a versione (10). È stato chiesto ai panellist di esprimere: (i) un giudizio di priorità sui diversi “domini” di valore di un farmaco e (ii) una valutazione sul posizionamento (ovvero di confronto rispetto ad alternative esistenti sul mercato) del farmaco/indicazione oggetto di analisi rispetto a tali domini. Sono stati considerati i seguenti 6 domini: livello di bisogno, tipologia di beneficio apportato, beneficio e rischio incrementale, qualità delle evidenze sui benefici, costo incrementale e fattibilità.
- Il livello di bisogno dipende dalla gravità della malattia (una malattia è tanto più grave quanto è più mortale e/o impatta sulla qualità di vita dei pazienti), da quanto è insoddisfatto tale bisogno da alternative terapeutiche esistenti sul mercato e dalla numerosità dei pazienti.
- La tipologia di beneficio apportato valuta se il farmaco può guarire, rallentare la progressione della malattia o avere un effetto solo sui sintomi.
- Il beneficio e rischio incrementale valuta, rispetto alla migliore alternativa terapeutica esistente sul mercato, (i) il miglioramento dei dati clinici (aumento della sopravvivenza e di altri parametri clinici che misurano l’efficacia del farmaco) e della qualità di vita dei pazienti e (ii) l’aumento della numerosità e gravità degli effetti collaterali.
- La qualità delle evidenze sui benefici è riferita alla tipologia di studi effettuati. Ad esempio gli studi randomizzati e controllati sono considerati di più alta qualità rispetto a quelli in cui i pazienti non vengono assegnati casualmente a braccio sperimentale e a braccio di controllo. Le analisi degli effetti di un farmaco su sottopopolazioni sono considerate di maggiore qualità se pianificate prima di condurre lo studio sperimentale rispetto a quelle realizzate successivamente (cosiddette analisi post hoc). L’approccio EVIDEM non utilizza alcun specifico strumento di valutazione della qualità degli studi.
- Il costo incrementale valuta un aumento del costo unitario per paziente trattato rispetto alla sua gestione con la migliore alternativa presente sul mercato. Il costo incrementale include quello per la terapia farmacologica (farmaco, somministrazione, follow-up), per altre prestazioni sanitarie (ad esempio maggiori o minori ricoveri per effetto di maggiori o minori effetti collaterali gravi), per prestazioni non sanitarie (ad esempio, supporto assistenziale a un paziente non autosufficiente) e per la società nel suo complesso (ad esempio maggiore o minore presenza sul lavoro del paziente per effetto della malattia).
- La fattibilità infine include: (i) l’impatto organizzativo, ovvero l’effetto di un farmaco sull’organizzazione nelle aziende sanitarie (ad esempio, riduzione degli accessi all’ospedale per effetto di una terapia orale sostitutiva di una terapia iniettiva) e (ii) gli effetti sull’aderenza (il paziente assume il farmaco nelle modalità prescritte) e sulla persistenza al trattamento (il paziente non interrompe la terapia se non su indicazione del medico).
Ai panellist è stato richiesto di esprimere: (i) un giudizio di priorità attribuibile ai sei domini sopra definiti (peso relativo rispetto all’intero processo decisionale), (ii) un ranking assoluto (con valori da 0 a 5, dove 0 rappresenta il minimo valore e 5 il massimo valore) per i domini non comparativi (gravità della malattia, livello di bisogno, entità del beneficio apportato e qualità delle evidenze) facendo riferimento allo stato antecedente l’introduzione di obinutuzumab e (iii) un ranking comparativo (da –5 a +5, dove –5 rappresenta il massimo peggioramento rispetto a rituximab e +5 il massimo miglioramento rispetto a rituximab) per i domini di confronto (benefico clinico, rischio, beneficio paziente, costo e impatto organizzativo) rispetto a rituximab.
Le valutazioni delle opinioni dei panellist sono state raccolte tramite un questionario strutturato mediante tecnica Delphi, che ha previsto l’interlocuzione tra ricercatore e key informant (questi ultimi in cieco tra di loro) attraverso step successivi (massimo tre) finalizzati a trovare il consenso su una rappresentazione finale delle valutazioni (11). In aggiunta al questionario, ai panellist è stato fornito un documento sintetico sulle evidenze esistenti (Appendice), oltre a un’analisi comparativa della variazione del costo-terapia (range: prezzo cessione SSN – prezzo ex-factory) di rituximab (originator e biosimilare) o di obinutuzumab (Appendice Figura 1). Per quest’ultimo, poiché non è ancora rimborsata l’estensione di indicazione al momento della valutazione, è stato ipotizzato un costo-terapia compreso tra un valore massimo, ovvero il relativo prezzo ex-factory disponibile al momento dell’analisi, e uno minimo corrispondente al prezzo ex-factory di rituximab originator (Appendice Figura 1).
Risultati
Il questionario e il documento sulle evidenze di obinutuzumab sono stati trasmessi ai panellist il 22 giugno 2018. Il primo round dello studio Delphi si è concluso il 5 settembre 2018 (data dell’ultima compilazione del questionario). Il primo documento di elaborazione delle risposte è stato trasmesso ai panellist il 19 novembre 2018. Tale documento è stato revisionato dai panellist e discusso nell’ambito di un incontro finale, tenutosi il 18 gennaio 2019.
La prima parte del questionario è finalizzata a determinare i pesi attribuiti ai singoli domini nella valutazione di un farmaco, per le scelte di accesso, rimborso, prescrizione e utilizzo. Ai panellist è stata richiesta di effettuare una valutazione di carattere generale, ovvero non riferita in modo specifico al LF.
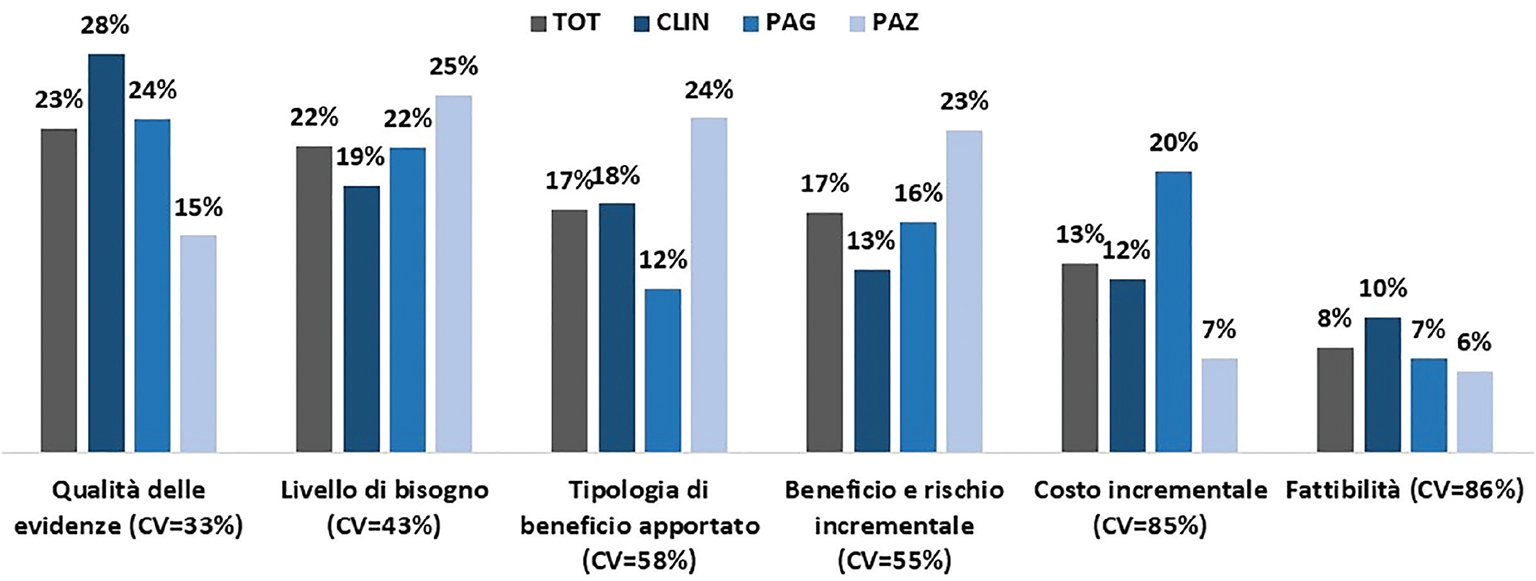
Rispetto all’intero processo decisionale, la qualità delle evidenze (23%) e il livello di bisogno (22%) rappresentano i domini più rilevanti, seguiti dalla tipologia di beneficio (17%) e dal profilo incrementale di beneficio-rischio (17%) (Figura 1). Minore è invece il peso mediamente attribuito all’effetto di un nuovo farmaco sui costi incrementali (13%) e sulla dimensione della fattibilità (8%) (Figura 1). Il giudizio è relativamente più omogeneo per il livello di bisogno, la tipologia di benefico apportato, il beneficio e rischio incrementale e la qualità delle evidenze, anche se, come atteso, quest’ultimo dominio ha una rilevanza piuttosto bassa per i pazienti. È invece presente una maggiore variabilità per le dimensioni dei costi incrementali (maggiore peso attribuito dai pagatori) e della fattibilità.
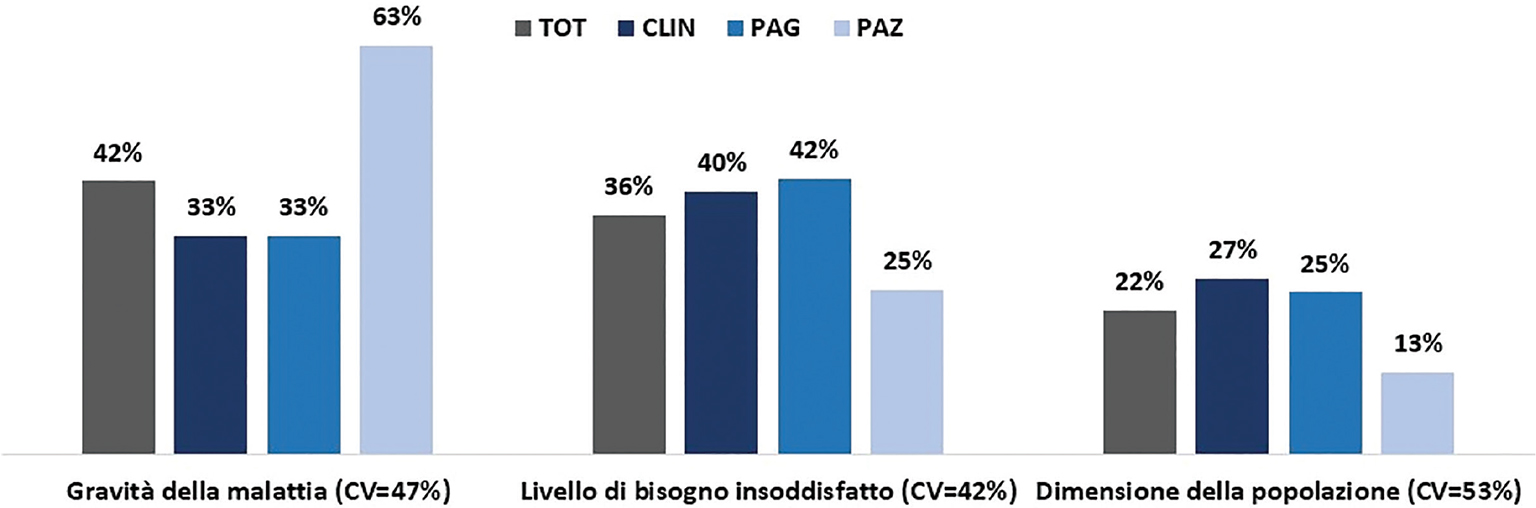
La Figura 2 riporta una chiara indicazione sull’importanza relativa degli elementi che compongono il dominio livello di bisogno: la gravità della malattia (42%) – in particolar modo nei pazienti (63%) – e il livello di bisogno insoddisfatto (36%) sono considerati più rilevanti, mentre minore è il peso attribuito alla numerosità dei pazienti (22%).
* Minimo 0, Massimo 60, Ʃ = 60 (dato riproporzionato su base percentuale).
La domanda posta ai panellist è la seguente: supponiamo che lei debba valutare un farmaco per fare una scelta (es. inclusione in prontuario, prescrizione in un contesto di risorse scarse) e che esistano diversi criteri di valutazione da combinare per prendere una decisione. Se dovesse attribuire un punteggio tra 0 e 60 a tali criteri, dove 0 è il punteggio minimo e 60 è il punteggio massimo di importanza attribuibile a ogni criterio e la somma dei punteggi dovesse essere 60 (se, quindi, a un criterio viene attribuito un punteggio di 60, tutti gli altri avranno un punteggio pari a 0), che punteggio attribuirebbe ai seguenti criteri?
* Minimo 0, Massimo 30, Ʃ = 30 (dato riproporzionato su base percentuale).
La domanda posta ai panellist è la seguente: se dovesse attribuire un punteggio tra 0 e 30 ai criteri associabili al livello di bisogno, dove 0 è il punteggio minimo e 30 è il punteggio massimo di importanza attribuibile a ogni criterio e la somma dei punteggi dovesse essere 30 (se, quindi, a un criterio viene attribuito un punteggio 30, tutti gli altri avranno un punteggio pari a 0), che punteggio attribuirebbe ai seguenti criteri?
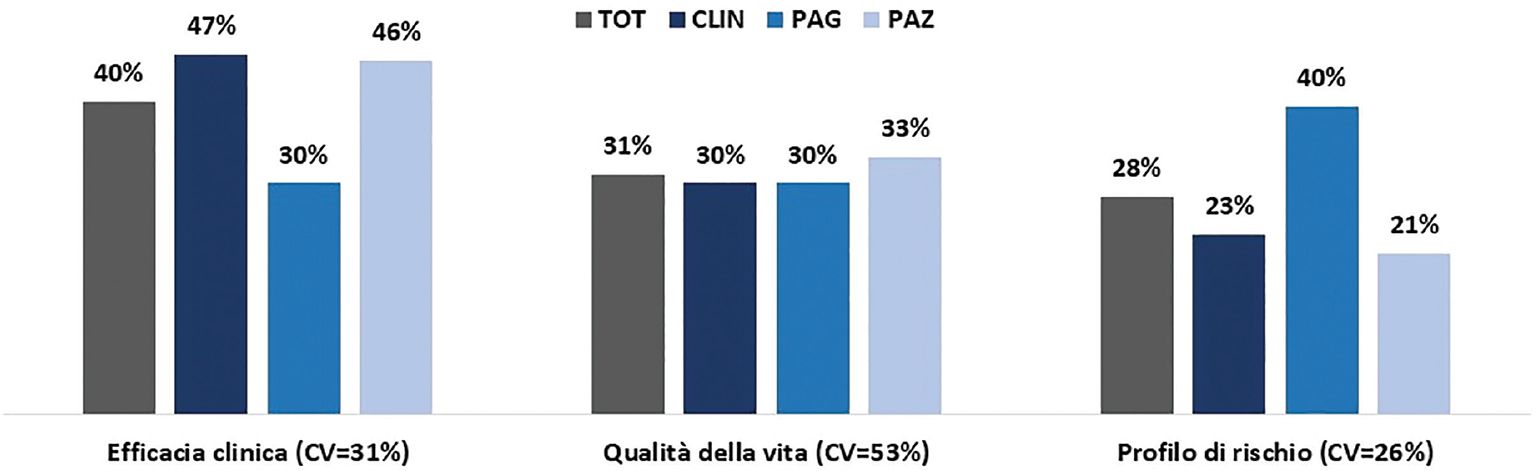
Con riferimento al dominio beneficio e rischio incrementale, il peso attribuito al sotto-dominio efficacia clinica (40%) è maggiore rispetto alla qualità della vita (31%) e al profilo di rischio (28%), questi ultimi piuttosto simili tra loro (Figura 3). Si osservano delle differenze tra le categorie di panellist. I clinici e i pazienti attribuiscono maggiore importanza all’efficacia clinica, mentre i pagatori attribuiscono più rilevanza al profilo di sicurezza. È possibile che i pagatori abbiano dato un’interpretazione del concetto di “efficacia clinica” ristretta agli endpoint surrogati e che considerino gli effetti collaterali più rilevanti per i costi sostenuti nella loro gestione.
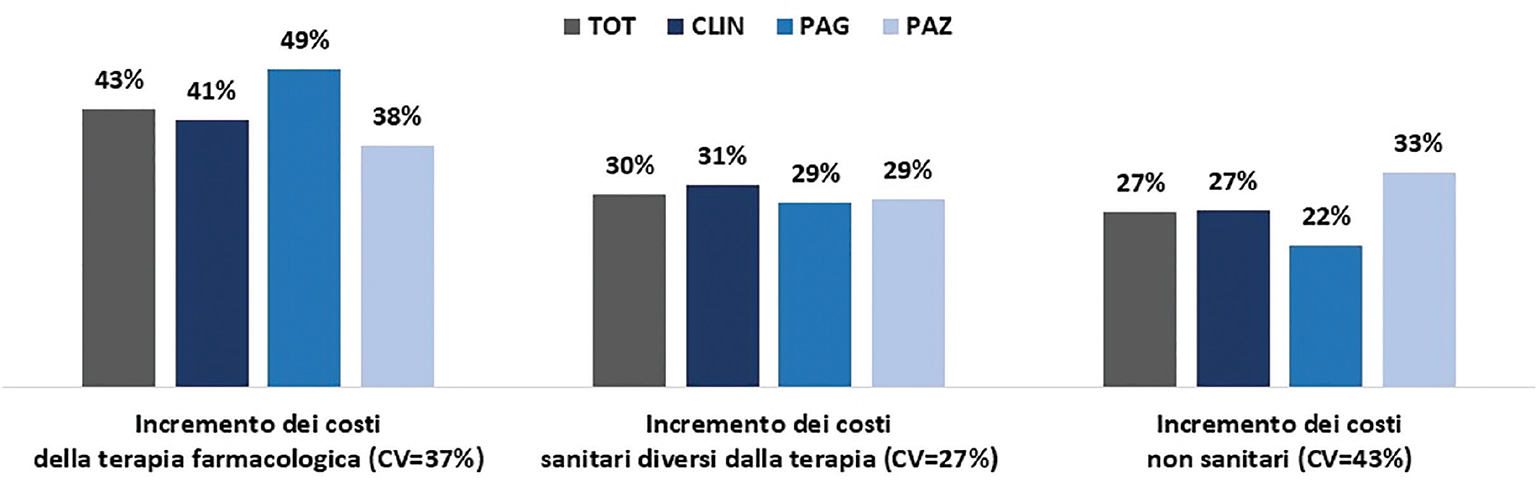
La Figura 4 mostra un’evidente indicazione di priorità rispetto alle diverse prospettive di analisi dei costi: l’impatto sui costi delle terapie farmacologiche (43%) è più rilevante rispetto a quello sugli altri costi diretti sanitari (30%) e a quello sui costi non sanitari (costi collegati alla perdita di produttività) (27%). È possibile che in tale valutazione pesi la percezione di un generale elevato costo dei farmaci oncologici e, soprattutto, un approccio pervasivo di silos budget, cui sembrano particolarmente soggetti pagatori e secondariamente i clinici. In riferimento ai soli costi non sanitari si nota come, rispetto alle altre due categorie di panellist, sono i pazienti ad attribuire il maggiore peso. Si ritiene che ciò potrebbe dipendere dal fatto che, rispetto a clinici e pagatori, i pazienti, in virtù della propria condizione di “malato”, riescano a pesare adeguatamente l’impatto del LF sulla propria capacità lavorativa.
* Minimo 0, Massimo 30, Ʃ = 30 (dato riproporzionato su base percentuale).
La domanda posta ai panellist è la seguente: se dovesse attribuire un punteggio tra 0 e 30 ai criteri associabili all’incremento di beneficio, dove 0 è il punteggio minimo e 30 è il punteggio massimo di importanza attribuibile a ogni criterio e la somma dei punteggi dovesse essere 30 (se, quindi, a un criterio viene attribuito un punteggio 30, tutti gli altri avranno un punteggio pari a 0), che punteggio attribuirebbe ai seguenti criteri?
* Minimo 0, Massimo 30, Ʃ = 30 (dato riproporzionato su base percentuale).
La domanda posta ai panellist è la seguente: se dovesse attribuire un punteggio tra 0 e 30 ai criteri associabili all’incremento di costo, dove 0 è il punteggio minimo e 30 è il punteggio massimo di importanza attribuibile a ogni criterio e la somma dei punteggi dovesse essere 30 (se, quindi, a un criterio viene attribuito un punteggio 30, tutti gli altri avranno un punteggio pari a 0), che punteggio attribuirebbe ai seguenti criteri?
La seconda parte del questionario esprime la valutazione dei panellist per obinutuzumab rispetto a: i) ranking assoluti (range: da 0 a 5, dove 0 rappresenta il minimo valore e 5 il massimo valore attribuiti al farmaco) per i domini non comparativi e a ii) ranking comparativi (range: da –5 a +5, dove –5 rappresenta il massimo peggioramento rispetto a rituximab e +5 il massimo miglioramento rispetto a rituximab) per i domini di confronto rispetto a rituximab (Tabella I).
Il livello di gravità del LF è stato giudicato medio-alto [punteggio medio = 3,5 (range: 0-5)] da tutti i panellist, confermando come i pazienti a maggiore rischio di progressione (FLIPI ≥2) rappresentino il target prioritario del trattamento (Tabella I (a)).
Rispetto all’attuale scenario nel quale rituximab costituisce la strategia terapeutica di riferimento per i pazienti a rischio intermedio e alto (FLIPI ≥2) (Appendice), il livello di bisogno insoddisfatto è stato valutato mediamente intermedio [punteggio medio = 2,6 (range: 0-5)] (Tabella I (b)). Pagatori e clinici hanno percepito un più alto livello di bisogno insoddisfatto [punteggio medio pagatori = 3,2 (range: 0-5); punteggio medio clinici = 2,6 (range: 0-5)] rispetto ai pazienti [punteggio medio pazienti = 1,7 (range: 0-5)] (Tabella I (b)). Si ritiene che sulla percezione dei pazienti abbia probabilmente impattato la propria situazione di controllo della malattia e conseguentemente (rispetto a clinici e pagatori) la maggiore difficoltà di effettuare valutazioni prospettiche distinguendo tra pazienti a basso, medio e alto rischio.
Verosimilmente in virtù dei risultati dello studio clinico registrativo (l’80% dei pazienti con obinutuzumab sopravvive senza progressione a tre anni), l’entità del beneficio apportato da obinutuzumab è stata valutata medio-alta [punteggio medio = 3,2 (range: 0-5)] (Tabella I (c)) (9). Anche la qualità delle evidenze è stata giudicata medio-alta [punteggio medio = 2,9 (range: 0-5)] (Tabella I (d)).
L’analisi comparativa rispetto a rituximab riporta un giudizio positivo sul beneficio clinico di obinutuzumab [punteggio medio = 2,6 (range: da –5 a +5)] (Tabella I (e)), poiché quest’ultimo determina una riduzione del 34% del rischio di morte e progressione (con un valore del 41-42% per i pazienti a rischio medio-alto di progressione). L’entità del beneficio incrementale (80% rispetto al 73,3% di pazienti sopravviventi senza progressione a tre anni) è stata valutata a un livello intermedio (compreso tra un punteggio minimo di 0 e uno massimo di 1) e una conferma del beneficio incrementale e della persistenza degli effetti da dati real-life viene considerata importante anche dai pazienti. Essendovi un modesto aumento delle reazioni avverse severe di grado ≥3 rispetto a rituximab (74,6% vs 67,8%) (9), il profilo di rischio di obinutuzumab è stato valutato lievemente peggiorativo [punteggio medio = –0,9 (range: da –5 a +5)] (Tabella I (f)). Rispetto a rituximab i panellist hanno valutato positivamente il beneficio incrementale di obinutuzumab inerente alla qualità della vita e le preferenze dei pazienti (prospettiva del paziente) [punteggio medio = 1,5 (range: da –5 a +5)] (Tabella I (g)). Tuttavia l’incremento del beneficio nella prospettiva del paziente è minore rispetto a quello clinico, dato l’uso della somministrazione endovenosa nella fase di mantenimento.
Sebbene l’impatto della variazione dei costi di obinutuzumab rispetto a rituximab sia complessivamente neutrale [punteggio medio = 0,0 (range: da –5 a +5)] (Tabella I (h)), tale dominio risulta caratterizzato dalla più alta variabilità di valutazione. Considerando un prezzo simile a quello ex-factory di rituximab originator (Appendice Figura 1) come indicazione di un possibile esito negoziale della rimborsabilità di obinutuzumab, clinici [punteggio medio = 1,8 (range: da –5 a +5)] e pazienti [punteggio medio = 2,0 (range: da –5 a +5)] hanno valutato positivamente il costo-terapia di obinutuzumab, mentre i pagatori hanno espresso un giudizio negativo [punteggio medio = –2,2 (range: da –5 a +5)]. È stato infine valutato mediamente trascurabile [punteggio medio = –0,2 (range: da –5 a +5)] (Tabella I (i)) l’impatto organizzativo associato alla somministrazione endovenosa di obinutuzumab (del primo ciclo della fase di induzione e nella fase di mantenimento di obinutuzumab) rispetto a quella sottocutanea di rituximab.
| Domini (domanda) | Range | Totale | Clinici | Pagatori | Pazienti | CV | |
|---|---|---|---|---|---|---|---|
| Ranking assoluti | |||||||
| Gravità LF | (a) | [0;5] | 3,5 | 3,2 | 3,6 | 3,3 | 28% |
| Bisogno insoddisfatto | (b) | [0;5] | 2,6 | 2,6 | 3,2 | 1,7 | 31% |
| Entità beneficio | (c) | [0;5] | 3,2 | 3,0 | 3,0 | 3,3 | 27% |
| Qualità delle evidenze | (d) | [0;5] | 2,9 | 3,4 | 2,4 | 3,0 | 34% |
| Ranking comparativi | |||||||
| Δ beneficio clinico | (e) | [–5;+5] | 2,6 | 2,6 | 2,2 | 2,3 | 16% |
| Δ rischio | (f) | [–5;+5] | –0,9 | –1,2 | –1,2 | 0,3 | 37% |
| Δ beneficio paziente | (g) | [–5;+5] | 1,5 | 1,6 | 1,2 | 1,7 | 10% |
| Δ costi | (h) | [–5;+5] | 0,0 | 1,8 | –2,2 | 2,0 | 60% |
| Δ impatto organizzativo | (i) | [–5;+5] | –0,2 | 0,0 | –0,6 | 0,3 | 29% |
CV = coefficiente di variazione; LF = linfoma follicolare
(a) Indicare il livello di gravità del LF prima dell’ingresso di obinutuzumab nelle sue due dimensioni essenziali (aspettativa di vita, qualità di vita), tra 5 (massima gravità) e 0 (minima gravità).
(b) Indicare il livello di bisogno insoddisfatto sul LF prima dell’ingresso di obinutuzumab tra 5 (massimo livello) e 0 (minimo livello).
(c) Indicare l’entità del beneficio apportato da obinutuzumab su LF tra 5 (cura del paziente) e 0 (nessun beneficio).
(d) Indicare il livello di qualità delle evidenze sui benefici di obinutuzumab tra 5 (molto alte) e 0 (molto basse).
(e) Indicare l’entità del beneficio incrementale sotto il profilo clinico apportato da obinutuzumab rispetto al suo comparatore rituximab su LF tra +5 (beneficio incrementale massimo rispetto a rituximab) e –5 (peggioramento del benefico rispetto a rituximab), essendo 0 il punteggio da attribuire in caso di assenza di beneficio incrementale.
(f) Indicare l’entità di riduzione degli effetti collaterali apportati da obinutuzumab rispetto al suo comparatore rituximab su LF tra +5 (riduzione massima degli effetti collaterali rispetto a rituximab) e –5 (aumento importante degli effetti collaterali rispetto a rituximab), essendo 0 il punteggio da attribuire in caso di sostanziale parità degli effetti collaterali.
(g) Indicare l’entità del beneficio incrementale valutato dai pazienti/nella prospettiva dei pazienti apportato da obinutuzumab rispetto al suo comparatore rituximab su LF tra +5 (beneficio incrementale massimo rispetto a rituximab) e –5 (peggioramento del benefico rispetto a rituximab), essendo 0 il punteggio da attribuire in caso di assenza di beneficio incrementale.
(h) Qualificare l’entità del costo differenziale apportato da obinutuzumab rispetto al suo comparatore rituximab su LF tra +5 (riduzione sostanziale dei costi rispetto a rituximab) e –5 (aumento sostanziale dei costi rispetto a rituximab), con riferimento al solo costo della terapia farmacologica e della sua gestione (costo farmaco, costo somministrazione, costo follow-up dei pazienti).
(i) Indicare se obinutuzumab avrà un impatto organizzativo (collegato, ad esempio, alla modalità di somministrazione), e quantificare tale impatto tra 5 (miglioramento sostanziale su organizzazione e/o aderenza rispetto a rituximab) e –5 (peggioramento sostanziale su organizzazione e/o aderenza rispetto a rituximab).
Discussione
Il presente studio ha analizzato il valore di obinutuzumab in confronto con rituximab nel trattamento in prima linea dei pazienti affetti da LF a medio-alto rischio. L’analisi è stata effettuata sulla base dell’approccio MCDA, con una consultazione degli esperti tramite metodo Delphi.
L’analisi comparativa condotta rispetto a rituximab riporta un giudizio positivo del beneficio incrementale di obinutuzumab, con un incremento di valore pari a 2,6 (range: da –5 a +5) a fronte di un lieve aumento del profilo di rischio (–0,9; range: da –5 a +5). Ciò a testimonianza da parte di tutti i panellist del “bisogno” di nuovi trattamenti (dominio “bisogno insoddisfatto”), soprattutto nei pazienti a maggiore rischio di progressione (dominio “gravità LF”) identificato dal punteggio FLIPI ≥2, target prioritario di obinutuzumab. Tale setting di pazienti, qui considerato, è in linea con quello identificato dalla recente Determina AIFA n. 309/2019 pubblicata in Gazzetta Ufficiale n. 65 del 18 marzo 2019 in merito alla classificazione ai fini della rimborsabilità della nuova indicazione terapeutica riconosciuta per obinutuzumab.
Anche l’analisi comparativa del benefico incrementale di obinutuzumab nella prospettiva del paziente (qualità della vita e preferenze dei pazienti) riporta un giudizio positivo, anche se più contenuto rispetto al beneficio nella prospettiva clinica, rispetto a rituximab (punteggio = 1,5; range: da –5 a +5). Le stime dell’entità dell’impatto organizzativo e del costo differenziale (nell’ipotesi di un costo di obinutuzumab simile a quello di rituximab originator) di obinutuzumab rispetto a rituximab si collocano invece complessivamente in una posizione neutrale.
Le analisi per tipologia dei panellist (clinici, pazienti, pagatori), per quanto risentano di una bassa numerosità, hanno fornito indicazioni interessanti, alcune attese come il maggior peso attribuito ai costi da parte dei pagatori, altre meno come il minor peso attribuito dai pazienti al profilo di rischio del farmaco. Quest’ultimo risultato potrebbe dipendere dal fatto che i pazienti intervistati, essendo la patologia sotto controllo, percepiscano come più rilevante l’efficacia clinica del trattamento rispetto ad eventuali effetti collaterali.
A conoscenza degli autori esiste un solo studio MCDA in Italia, applicato ai farmaci oncologici e riferito sempre a obinutuzumab, per l’indicazione del linfoma non-Hodgkin refrattario a rituximab (12) su un panel di 19 esperti di cui 5 clinici, 5 pagatori e 9 pazienti. Con riferimento alla rilevanza dei diversi domini, la presente analisi ha prodotto risultati abbastanza sovrapponibili a quella di Garau et al. Viene confermato un peso più elevato attribuito al profilo rischio-beneficio e al livello di bisogno insoddisfatto rispetto all’impatto organizzativo e a quello sui costi. Quest’ultimo è più rilevante degli altri solo per i pagatori. Le due analisi riportano risultati simili anche per il maggiore peso attribuito all’incremento del costo dei farmaci rispetto agli altri costi sanitari diretti e di quelli indiretti, generato presumibilmente da una forte insistenza sul contenimento della spesa farmaceutica, anche in relazione alla presenza di tetti di spesa specifici sui farmaci.
I risultati della presente analisi devono essere letti alla luce di alcune osservazioni. La prima è rappresentata dalla bassa numerosità dei panellist che rende meno significative le valutazioni quantitative, soprattutto se analizzate sulle singole categorie. In secondo luogo, i pazienti, nonostante abbiano ricevuto un rapporto sintetico e semplificato sulle evidenze di obinutuzumab, hanno esplicitato alcune difficoltà nella valutazione del dominio costo incrementale (terapia farmacologica, prestazioni sanitarie e non sanitarie). È quindi molto probabile che clinici e pagatori si siano basati, nel rispondere al questionario, in prevalenza sulle evidenze, mentre i pazienti abbiano fornito delle risposte (soprattutto sul peso da attribuire ai criteri) su base esperienziale. La discussione dei dati ha fatto poi emergere come il giudizio di impatto neutrale sui costi possa essere condizionato da dinamiche competitive di mercato.
Nonostante tali limiti, lo studio può fornire le basi per un uso più sistematico di logiche multicriterio e multistakeholder di valutazione per la gestione dell’accesso e dell’uso dei farmaci, ispirata ai principi del MCDA e a una conseguente maggiore trasparenza e riproducibilità delle scelte.
In diversi sistemi sanitari e in particolare in Italia, la prospettiva di stakeholder quale quella dei pazienti viene raramente richiesta o inserita in modo sistematico nel processo di valutazione di una nuova tecnologia sanitaria, anche se esistono alcune esperienze regionali che stanno andando in questa direzione (13). Recentemente però l’Agenzia Italiana del Farmaco (AIFA), sulla base di quanto indicato dall’ultimo documento sulla governance farmaceutica (14), ha deciso, all’interno del progetto Open Aifa, di istituire un tavolo permanente di consultazione con le Associazioni di pazienti finalizzato a trattare tematiche inerenti al farmaco quali accesso, ricerca e sicurezza. In quest’ottica l’utilizzo della metodologia MCDA fornirebbe ai decision maker, come AIFA, opinioni di differenti stakeholder, tra cui anche i pazienti, sulla stima del valore di una tecnologia sanitaria.
Conclusioni
Quest’analisi rappresenta la seconda esperienza di utilizzo di un approccio MCDA per valutare il valore di una terapia farmacologica in ambito nazionale. Considerando i pazienti con LF a rischio intermedio e alto di progressione o morte (FLIPI ≥2), i domini chiave alla base del valore di obinutuzumab in accordo a quanto espresso dai panellist sono stati la gravità della malattia, il bisogno insoddisfatto e l’incremento del benefico terapeutico.
Ispirata ai principi dell’MCDA (maggiore trasparenza e riproducibilità), la presente analisi fornisce le basi per un uso più sistematico di applicazione di logiche multicriterio e multi-stakeholder di valutazione per la gestione dell’accesso e dell’uso dei farmaci, nelle quali anche i pazienti possono avere un maggiore coinvolgimento.
Ringraziamenti
Si ringraziano, per la partecipazione al Delphi Panel:
- Luca Arcaini, IRCCS Fondazione San Matteo, Pavia
- Francesco Cattel, Azienda Ospedaliera Universitaria Città della Salute e della Scienza, Torino
- Alessandro D’Arpino, Azienda Ospedaliera di Perugia
- Marco Ladetto, Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Alessandria
- Giuseppe Longo, Policlinico di Modena
- Stefano Luminari, IRCCS Arcispedale S. Maria Nuova e Università di Modena e Reggio Emilia
- Stefano Molica, Azienda Ospedaliera Pugliese-Ciaccio di Catanzaro
- Chiara Poggiani, Azienda Zero, Padova
- Alessandro Pulsoni, Sapienza Università di Roma
- Gianluca Trifirò, Università di Messina
Si ringrazia l’Associazione “La Lampada di Aladino Onlus” per il supporto nell’identificazione e coinvolgimento dei pazienti esperti.
Disclosures
Financial support: This research was made possible by an educational grant from Roche S.p.A.
Conflict of interest: The authors declare no conflicts of interest.
Bibliografia
- 1. Sussex, Towse A, Devlin N. Operationalizing value-based pricing of medicines: a taxonomy of approaches. Pharmacoeconomics. 2013 Jan;31(1):1–10.
- 2. Jommi C. Innovation and drugs price and reimbursement: a comparison between Italy and the other major EU countries. Global & Regional Health Technology Assessment. 2015;2(3):117–62.
- 3. Kolasa K, Zah V, Kowalczyk M. How can multi criteria decision analysis support value assessment of pharmaceuticals? - Findings from a systematic literature review. Expert Rev Pharmacoecon Outcomes Res. 2018 Aug;18(4):379–91.
- 4. Mussen F, Salek S, Walker S. A quantitative approach to benefit-risk assessment of medicines - part 1: the development of a new model using multi-criteria decision analysis. Pharmacoepidemiol Drug Saf. 2007 Jul;16 Suppl 1:S2–S15.
- 5. Goetghebeur MM, Wagner M, Khoury H et al. Bridging health technology assessment (HTA) and efficient health care decision making with multicriteria decision analysis (MCDA): applying the EVIDEM framework to medicines appraisal. Med Decis Making. 2012 Mar-Apr;32(2):376–88.
- 6. Tervonen T, Naci H, van Valkenhoef G et al. Applying Multiple Criteria Decision Analysis to Comparative Benefit-Risk Assessment: choosing among statins in primary prevention. Med Decis Making. 2015 Oct;35(7):859–71.
- 7. Marsh K, IJzerman M, Thokala P et al. Multiple criteria decision analysis for health care decision making--Emerging Good Practices: Report 2 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health. 2016 Mar-Apr;19(2):125–37.
- 8. NICE, Obinutuzumab for untreated advanced follicular lymphoma - Technology appraisal guidance [TA513] Published date: 21 March 2018. https://www.nice.org.uk/guidance/ta513/chapter/1-Recommendations (ultimo accesso 14/03/2019).
- 9. Marcus R, Davies A, Ando K et al. Obinutuzumab for the first-line treatment of follicular lymphoma. N Engl J Med. 2017;377(14):1331–44.
- 10. EVIDEM. EVIDEM Framework 10th Edition. https://www.evidem.org/ (ultimo accesso 16/4/2019).
- 11. Esmé G, Trevelyan J, Robinson C. Delphi methodology in health research: how to do it? Eur J Integr Med. 2015;7(4):423–8.
- 12. Garau M, Hampson G, Devlin N et al. Applying a Multicriteria Decision Analysis (MCDA) approach to elicit stakeholders’ preferences in Italy: The case of obinutuzumab for rituximab-refractory Indolent Non-Hodgkin Lymphoma (iNHL). Pharmacoecon Open. 2018;2(2):153–63.
- 13. Jommi C, Bertolani A. Patient Associations and HTA for medicines: present and future role in Italy. Global & Regional Health Technology Assessment. 2018:1-11.
- 14. Ministero della Salute. Documento in materia di governance farmaceutica. http://www.salute.gov.it/imgs/C_17_notizie_3567_listaFile_itemName_0_file.pdf. (ultimo accesso 16/4/2019).