 |
AboutOpen | 2024; 11: 21-29 ISSN 2465-2628 | DOI: 10.33393/ao.2024.2893 ORIGINAL RESEARCH ARTICLE |
 |
Una valutazione economica di due sequenze terapeutiche nel trattamento di prima linea della rettocolite ulcerosa attiva da moderata a grave in Italia
Economic evaluation of two therapeutic sequences in the first-line treatment of moderate to severe active ulcerative rectocolitis in Italy
Background: Vedolizumab (VDZ) and infliximab are used to treat moderate to severe ulcerative colitis (UC). The choice of the drug to use at first-line is often based on a combination of clinical and economic factors. The cost of treatment pathway is rarely considered. Therefore, this cost-consequence analysis (CCA) investigated the overall costs of treatment pathway for vedolizumab followed by infliximab (VDZ → IFX) compared to infliximab followed by vedolizumab (IFX → VDZ).
Methods: We used a published cost-consequence model (CCM), based on a targeted literature search reporting the time-on-treatment data for vedolizumab or infliximab in UC in first and second-line of treatment. CCM time horizon was defined by the length of treatment sequences. Considering the Italian hospital perspective, the CCA evaluated the biologic drugs acquisition costs, drug administration costs, hospitalization costs, switch costs, colectomy costs and third-line treatment costs. Third-line options included colectomy, tofacitinib, ustekinumab or dose escalation of second-line biologic.
Results: Over the 5.2-year time horizon (duration of the longer VDZ → IFX pathway), the mean cost per patient of VDZ → IFX pathway was slightly lower than the mean cost per patient of IFX → VDZ pathway (€ 86,339 vs 89,636). The CCM predicted that using VDZ as first-line treatment delayed the time to costly third-line therapies compared to first-line using IFX (VDZ-first-line median time-on-treatment 3.6-years and IFX-second-line 1.6-years; IFX-first-line 1.4-years and VDZ-second-line 2.3-years and third-line 1.5-years).
Conclusion: The CCA showed that a biologic treatment pathway that begins with first-line vedolizumab is not more expensive than one beginning with first-line infliximab and delayed the time to costly third-line.
Keywords: Cost-Consequence Analysis, Inflammatory Bowel Disease, Infliximab, Ulcerative Colitis, Ulcerative Rectocolitis, Vedolizumab
Received: December 18, 2023
Accepted: February 8, 2024
Published online: March 2, 2024
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La rettocolite ulcerosa (Ulcerative Rectocolitis, RCU) è una malattia infiammatoria cronica intestinale (Inflammatory Bowel Disease, IBD) che interessa primariamente il retto, potendosi estendere anche ad altre porzioni del colon (proctite, colite sinistra, pancolite) (1,2). È caratterizzata da periodi alterni di riacutizzazione e di remissione clinica ed endoscopica (3). Il principale sintomo è costituito dal sanguinamento rettale, al quale possono aggiungersi tenesmo, diarrea, dolore addominale e calo del peso corporeo (3). La RCU si manifesta solitamente tra i 30 e i 50 anni, con un’incidenza annua che varia nel modo dai 9 ai 20 casi ogni 100.000 abitanti (4). La presenza di questa malattia infiammatoria genera per il soggetto che ne soffre una compromissione della qualità di vita e per i Servizi Sanitari un importante onere economico (4,5).
Due dei principali endpoint clinici a cui dovrebbe mirare l’attuale strategia di trattamento della RCU sono la remissione clinica completa senza steroidi e la guarigione mucosale (6). Una rapida risoluzione dei sintomi e il controllo della malattia nel lungo periodo sono obiettivi di primaria importanza (7,8).
Sebbene, a oggi, non sia disponibile una cura definitiva per la RCU, l’avvento prima degli anticorpi monoclonali diretti contro il fattore di necrosi tumorale alfa (infliximab, adalimumab e golimumab) e, successivamente, degli anticorpi monoclonali anti-integrina α4β7 (vedolizumab) o anti-interleuchina 12/23 (ustekinumab) e delle Small Molecule Drugs (filgotinib, tofacitinib, upadacitinib) ha sensibilmente modificato il trattamento della RCU da moderata a grave (9-12).
Il progresso clinico portato dall’era dei biologici e il loro utilizzo nella pratica clinica ha però determinato un aumento della spesa farmacologica a carico dei Servizi Sanitari. Pertanto, per efficientare le risorse economiche a disposizione, diventa fondamentale indentificare una strategia terapeutica che permetta di raggiungere una veloce risposta clinica nella fase di induzione e una prolungata remissione della malattia nella successiva fase di mantenimento.
Dal momento che è possibile che, nel corso della propria storia clinica, un paziente con RCU affronti la progressione della malattia, è altrettanto plausibile che venga sottoposto a differenti trattamenti farmacologici. Per questo, sempre nell’ottica dell’efficientamento delle risorse disponibili e della sostenibilità economica, diviene fondamentale ottimizzare il percorso terapeutico della RCU in fase attiva da moderata a grave, identificando quale sequenza di farmaci sia la più conveniente in termini di beneficio clinico e di costo di trattamento.
La presente analisi è stata quindi condotta con l’obiettivo di fornire ai decisori un momento di riflessione di natura economico-sanitaria sulle modalità di trattamento della RCU attiva da moderata a grave nei pazienti adulti naïve al trattamento biologico (bio-naïve), che non hanno risposto in modo adeguato alla terapia convenzionale inclusi corticosteroidi e 6-mercaptopurina (6-MP) o azatioprina (AZA) o che risultano intolleranti o per cui esista una controindicazione medica a queste terapie. Nello specifico, replicando al contesto italiano una precedente esperienza condotta nel Regno Unito (13), la presente analisi ha valutato se nella pratica clinica la sequenza che prevede l’utilizzo in prima linea di vedolizumab (VDZ) seguito da un inibitore del fattore di necrosi tumorale alfa (anti-TNFα) in seconda linea determini un’allocazione più efficiente delle risorse disponibili rispetto alla sequenza che prevede l’utilizzo di un anti-TNFα in prima linea seguito da VDZ in seconda linea.
Metodi
Tipologia di valutazione economica
Dal momento che il disegno della presente valutazione economica è costituito dalla conduzione di un’analisi dei costi e delle conseguenze associati a due differenti sequenze terapeutiche, la Cost-Consequence Analysis (CCA) costituisce una tipologia di valutazione economica idonea a presentare tali informazioni (14). La CCA è un tipo di analisi economica che valuta un’ampia gamma di costi e di conseguenze associati a tecnologie sanitarie o a percorsi di trattamento, riportandoli separatamente, senza alcuna espressione aggregata (14).
Popolazione target
La popolazione considerata nella CCA è costituita da pazienti adulti con RCU in fase attiva, di grado da moderato a grave, che non hanno risposto in modo adeguato alla terapia convenzionale (inclusi 6-MP o AZA) o che risultano intolleranti o per cui esiste una controindicazione medica a queste terapie.
Modello di sequenziamento
Vedolizumab (15,16) e gli anti-TNFα infliximab (IFX) (17-20), adalimumab (ADA) (21,22) e golimumab (GOL) (23,24) sono farmaci biologici attualmente rimborsati e utilizzati in Italia per il trattamento della RCU attiva da moderata a grave. La decisione di quale farmaco utilizzare nelle differenti linee di trattamento è guidata dall’indicazione di rimborsabilità (16,18,20,22,24), seguita dalla valutazione di fattori clinici e del prezzo del farmaco, quest’ultimo spesso considerato su base annua e raramente come possibile sequenza di trattamenti. Pertanto, nella presente CCA, si è deciso di indagare se la scelta del biologico da somministrare in prima linea nei pazienti bio-naïve con RCU potesse influenzare il tempo di permanenza in trattamento e i costi complessivi della sequenza terapeutica.
La CCA è stata condotta utilizzando un preesistente modello di sequenziamento riferito al Regno Unito (UK) (13), grazie al quale sono stati confrontati i costi di trattamento associati a due sequenze terapeutiche alternative:
i. VDZ somministrato in prima linea, a fallimento della terapia convenzionale, seguito, in seconda linea, da un anti-TNFα;
ii. anti-TNFα somministrato in prima linea, a fallimento della terapia convenzionale, seguito, in seconda linea, da VDZ.
L’attività di validazione dei dati di input, che ha consentito di adattare al contesto italiano il modello di sequenziamento UK (13) è avvenuta tramite la conduzione di un Expert Panel che ha coinvolto 5 gastroenterologi, 4 farmacisti ospedalieri e 1 farmacoeconomista (25). A ciascuno di loro, durante un tavolo di discussione, è stato presentato il modello di sequenziamento e chiesto di esprimere una propria valutazione sulla struttura e sui valori associati ai principali parametri. I risultati dell’Expert Panel sono presentati in dettaglio in un altro documento al quale si rimanda (25).
Orizzonte temporale
Dato che prolungare il tempo al successivo trattamento dovrebbe determinare un effetto positivo sullo stato di salute del paziente, la scelta dell’orizzonte temporale deve permettere di rilevare, se presenti, eventuali differenze temporali tra le due sequenze di trattamento confrontate. Dal momento che non si esclude a priori che le due sequenze terapeutiche alternative possano essere caratterizzate da differenti durate di trattamento, al fine di rendere omogeneo il confronto in termini di orizzonte temporale osservato e, quindi, di correlato consumo di risorse, nella CCA è stato ipotizzato il ricorso alla somministrazione di una terza linea di trattamento nel caso che una delle due sequenze raggiungesse prima dell’altra il fallimento della seconda linea.
Trattamenti considerati
Dal momento che, in relazione alla popolazione target e all’opinione espressa dall’Expert Panel (25), il mix dei farmaci anti-TNFα che vengono utilizzati nella prima linea di trattamento della RCU attiva da moderata a grave è costituito unicamente da infliximab nelle sue varie formulazioni (originatore somministrato mediante infusione endovenosa [IFXOri IV] (17), biosimilare somministrato mediante infusione endovenosa [IFXBio IV] (19) e biosimilare somministrato per via sottocutanea [IFXBio SC] (19)), la CCA è stata condotta considerando le due seguenti sequenze terapeutiche: i) VDZ somministrato in prima linea, a fallimento della terapia convenzionale, seguito, in seconda linea, da IFX (VDZ → IFX); ii) IFX somministrato in prima linea, a fallimento della terapia convenzionale, seguito, in seconda linea, da VDZ (IFX → VDZ). La Tabella 1 riporta nel dettaglio la corrispondente percentuale di utilizzo e il relativo schema posologico delle formulazioni di infliximab, validate dall’Expert Panel (25). Lo stesso mix di utilizzo di infliximab considerato nella prima linea è stato applicato alla seconda linea.
| Anti-TNFα | % di utilizzo | Schema di somministrazione | Fonte |
|---|---|---|---|
| IFXOri IV | 5,00% | 5mg/kg: settimana 0, 2, 6; poi ogni 8 settimane | (17,25) |
| IFXBio IV | 91,60% | 5mg/kg: settimana 0, 2, 6; poi ogni 8 settimane | (19,25) |
| IFXBio SC | 3,40% | 5mg/kg: settimana 0, 2; 4 settimane dopo l’ultima somministrazione endovenosa 120 mg ogni 2 settimane | (19,25) |
In accordo con quanto riportato nel riassunto delle caratteristiche di prodotto (RCP) per VDZ IV è stato considerato lo schema posologico che prevede la somministrazione di 300 mg mediante infusione endovenosa alle settimane 0, 2 e 6 e successivamente ogni 8 settimane (15).
Con l’obiettivo di tenere conto di quanto avviene nella pratica clinica e in linea con quanto indicato dall’Expert Panel (25), nel modello di sequenziamento è stato assunto che, sia in prima che in seconda linea, una percentuale di pazienti, manifestando una riduzione della risposta, possa trarre benefico da un’ottimizzazione del trattamento. Nel caso dei pazienti trattati con VDZ, l’Expert Panel ha assunto che l’ottimizzazione corrisponda a un aumento della frequenza di somministrazione ogni 4 settimane, mentre, nei pazienti trattati con infliximab, è stato assunto un aumento del dosaggio a 10 mg/kg, semplificando di fatto la variabilità dell’ottimizzazione di quest’ultimo poiché sono utilizzabili aumenti intermedi da 5 mg/kg a 10 mg/kg, nonché la riduzione dell’intervallo di somministrazione fino a 4 settimane (25).
Nella CCA, indipendentemente dalla linea di trattamento, per VDZ è stata considerata una percentuale di ottimizzazione del trattamento del 20% (27). In assenza di specifici dati di letteratura, a infliximab è stata associata la stessa percentuale di ottimizzazione del trattamento. Ai fini della stima del costo di trattamento nella CCA si è assunto che l’ottimizzazione si possa verificare dopo almeno sei mesi di trattamento, indipendentemente dal farmaco biologico somministrato.
Sulla base di quanto proposto da una ricerca di mercato, rivista e validata dall’Expert Panel (25), la Tabella 2 presenta, distinguendo per sequenza di trattamento, la percentuale di utilizzo delle possibili opzioni di trattamento somministrate a fallimento della seconda linea:
i) ottimizzazione del trattamento farmacologico somministrato in seconda linea;
ii) interruzione del trattamento farmacologico somministrato in seconda linea ed inizio del trattamento di terza linea con tofacitinib (TOF);
iii) interruzione del trattamento farmacologico somministrato in seconda linea ed inizio del trattamento di terza linea con ustekinumab (UST);
iv) interruzione del trattamento farmacologico somministrato in seconda linea e successiva terapia chirurgica.
| Terza linea | VDZ → IFX | IFX → VDZ | Fonte |
|---|---|---|---|
| % di utilizzo | % di utilizzo | ||
| Ottimizzazione IFX | 20,00% | (25,27) | |
| Ottimizzazione VDZ | 20,00% | (25,27) | |
| Tofacitinib | 31,25% | 31,25% | (25) |
| Ustekinumab | 43,75% | 43,75% | (25) |
| Terapia chirurgica | 5,00% | 5,00% | (25) |
VDZ = vedolizumab; IFX = infliximab.
Come fatto per VDZ e IFX, anche per UST è stato assunto che, sia in prima che in seconda linea, una percentuale di pazienti, manifestando una riduzione della risposta, possa trarre benefico da un’ottimizzazione del trattamento che, in questo caso, corrisponderebbe a un aumento della frequenza di somministrazione passando da ogni 12 a ogni 8 settimane. Sulla base di quanto riportato in letteratura (26), indipendentemente dalla linea di trattamento, per UST è stata considerata una percentuale di ottimizzazione del trattamento del 74%. Anche in questo caso si è assunto che l’ottimizzazione si possa verificare dopo almeno sei mesi di trattamento con UST.
Persistenza in trattamento
In linea con quanto adottato nel modello di sequenziamento originario (13) la persistenza in trattamento è determinata dalla Duration of Treatment (DoT) mediana associata ai farmaci biologici somministrati in prima e in seconda linea. La DoT mediana definisce il tempo che intercorre tra l’inizio di una linea di trattamento e la successiva. Essa, in aggiunta allo schema posologico, è fondamentale per calcolare il costo complessivo della sequenza di trattamento.
Le DoT considerate nella CCA per VDZ e per IFX in prima e in seconda linea riflettono i risultati di una revisione della letteratura condotta con l’obiettivo di stimare la persistenza in trattamento per VDZ e anti-TNFα in popolazioni che non hanno ricevuto un precedente trattamento con biologico (bio-naïve) o in popolazioni in cui il trattamento con un biologico è fallito (bio-exposed) (13). La revisione della letteratura è stata condotta consultando la banca dati PubMed per il periodo compreso tra il 1° gennaio 2019 e il 20 dicembre 2021 (13). Sono stati considerati gli studi che menzionavano UC/RCU, VDZ, ADA, IFX o TNF nel titolo o nell’abstract; ciascuno di essi doveva riportare dati per la persistenza, l’interruzione o la durata del trattamento (13). Il processo di revisione della letteratura ha identificato 19 studi utili eleggibili, di cui:
− 14 studi (n = 7.690) hanno riportato i dati per gli anti-TNFα biologici nei pazienti naïve ai biologici;
− 7 studi (n = 585) hanno riportato i dati per VDZ nei pazienti naïve ai biologici;
− 1 studio (n = 47) ha riportato i dati per gli anti-TNFα nei pazienti esposti al trattamento biologico;
− 5 studi (n = 549) hanno riportato i dati per VDZ nei pazienti esposti al trattamento biologico.
La Figura 1, sulla base dei dati raccolti dalla revisione della letteratura (13), presenta la durata in anni, suddivisa per linee di trattamento, delle due sequenze confrontate. Nel paziente con RCU attiva da moderata a grave l’utilizzo di VDZ in prima linea ritarda di 1,5 anni l’accesso alle terapie di terza linea rispetto a quanto accade invece per il paziente che inizia la sequenza di trattamento con IFX (Fig. 1).
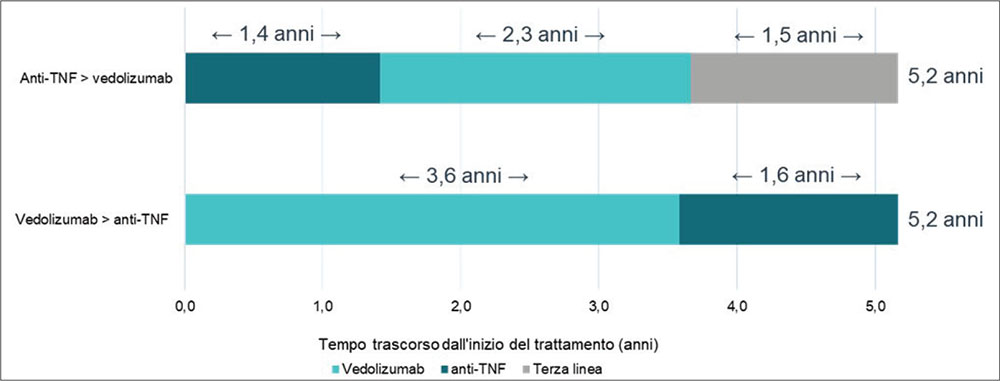
FIGURA 1 - DoT delle sequenze terapeutiche.
VDZ = vedolizumab; IFX = infliximab.
Prospettiva di analisi
La CCA è stata condotta considerando la prospettiva del Servizio Sanitario Nazionale (SSN), includendo i costi diretti sanitari determinati dalle due sequenze terapeutiche confrontate nel trattamento dei pazienti adulti con RCU in fase attiva, di grado da moderato a grave. In particolare, sono stati considerati i costi di acquisto dei farmaci biologici, i relativi costi di somministrazione (quando presenti), il costo delle ospedalizzazioni correlate alla RCU, il costo del cambio di trattamento (switch) e il costo della terapia chirurgica.
Costi di trattamento
Costo di acquisto dei farmaci biologici
Nel caso base della CCA, per ciascun farmaco biologico è stato considerato il rispettivo prezzo ex-factory al netto delle riduzioni di legge. La Tabella 3 riporta in dettaglio per ciascun biologico il costo medio annuo di trattamento, distinguendo tra primo e successivi anni. Nello specifico, il costo medio annuo di trattamento (primo e successivi anni) associato a VDZ, a IFX e a UST tiene conto del corrispondente effetto dell’ottimizzazione del dosaggio in presenza di perdita di efficacia.
| Biologico | Costo di trattamento* | |
|---|---|---|
| Primo anno | Secondo anno e successivi | |
| Prima o seconda linea | ||
| Vedolizumab IV | € 17.509,94 | € 16.695,53 |
| Infliximab** | € 11.689,16 | € 11.390,15 |
| Terza linea | ||
| Tofacitinib*** | € 10.813,74 | € 9.371,90 |
| Ustekinumab**** | € 22.003,89 | € 18.421,86 |
*Per VDZ, anti-TNFα e UST il relativo costo di trattamento tiene conto anche dell’effetto determinato dall’ottimizzazione.
**5,0% originatore somministrato mediante infusione endovenosa (IFXOri IV), 91,6% biosimilare somministrato mediante infusione endovenosa (IFXBio IV) e 3,4% biosimilare somministrato per via sottocutanea (IFXBio SC).
***Nella CCA sono state considerate la dose raccomandata di 10 mg somministrati per via orale due volte al giorno per l’induzione per 8 settimane e la dose di mantenimento di 5 mg somministrati per via orale due volte al giorno.
****Nella CCA è stato assunto che il trattamento con ustekinumab venga iniziato con una singola dose di 390 mg per via endovenosa (paziente con peso corporeo di 70 kg), mentre la prima dose di 90 mg somministrata per via sottocutanea deve essere somministrata alla settimana 8 dopo la dose per via endovenosa per poi essere somministrata ogni 12 settimane oppure ogni 8 settimane in presenza dell’ottimizzazione del trattamento.
Nella CCA la valorizzazione del costo medio annuo in terza linea con TOF o UST è stata effettuata considerando la media semplice tra primo e successivi anni di trattamento. Nello specifico, per TOF è stato utilizzato un costo medio annuo di trattamento di € 10.092,82, mentre per UST di € 20.212,88.
Ogni volta che lo schema posologico lo ha richiesto, in accordo con le Linee Guida AIFA (28), la relativa dose di somministrazione è stata stimata considerando un paziente tipo con peso medio corporeo di 70 kg.
Costo di somministrazione
La somministrazione dei farmaci biologici per via endovenosa è stata valorizzata considerando come proxy l’importo di € 9,71 rimborsato dal SSN per la tariffa (cod. 99.25) “iniezione o infusione di sostanze chemioterapiche per tumore” (29), in aggiunta all’importo di € 20,66 (cod. 89,7 – “visita generale”) utilizzato come proxy per valorizzare la vista gastroenterologica (29). Dal momento che si assume che vengano effettuate dal paziente o dal caregiver senza costi a carico del SSN, alle somministrazioni sottocutanee od orali è stato associato il solo costo per la visita gastroenterologica (€ 20,66), effettuata ogni 3 mesi al rinnovo del piano terapeutico.
Costo di ospedalizzazione
Grazie ai risultati di una recente analisi retrospettiva di Real World Evidence (RWE) condotta su un campione di circa 3 milioni di assistiti afferenti alle Aziende Sanitarie Locali (ASL) della Regione Lazio (30), è stato possibile associare un costo medio annuo per le ospedalizzazioni correlate alla RCU per i pazienti trattati con VDZ o IFX, distinguendo tra prima e seconda linea. L’analisi di RWE è stata condotta con lo scopo di fornire evidenze circa i consumi di risorse sanitarie per la gestione dei pazienti affetti da malattie infiammatorie croniche intestinali (MICI) in trattamento biologico. Sulla base dei risultati dell’analisi di RWE, ai pazienti trattati in prima linea con VDZ o con IFX è stato associato un costo medio annuo per l’ospedalizzazione da RCU di € 896,00 e di € 966,00, rispettivamente (30). Differentemente, ai soggetti trattati in seconda linea con VDZ o con IFX è stato associato un costo medio annuo per l’ospedalizzazione da RCU di € 1.282,00 e di € 1.752,00, rispettivamente (30). In assenza di uno specifico dato per la terza linea di trattamento, nella CCA è stato considerato come proxy il costo medio annuo per l’ospedalizzazione da RCU di € 1.426,00 associato ai pazienti trattati in seconda linea con UST (30).
Costo del cambio di trattamento
Su indicazione dell’Expert Panel (25), in presenza del cambio di trattamento biologico, è stato considerato un costo di € 120,06, determinato dall’esecuzione di una valutazione endoscopica e di una visita gastroenterologica. Per la prima prestazione è stata considerata la tariffa di € 99,40 rimborsata dal SSN per la prestazione “esofagogastroduodenoscopia (EGD) con biopsia” (cod. 45.16), mentre, per la seconda, è stata considerata come proxy la tariffa di € 20,66 rimborsata dal SSN per la prestazione “visita generale” (cod. 89.7).
Costo della terapia chirurgica
L’approccio chirurgico per il trattamento della RCU prevede tre distinti momenti riguardanti prima l’esecuzione della colectomia con posizionamento di un’ileostomia, poi l’esecuzione della proctectomia con confezionamento di J-pouch e, infine, la chiusura dell’ileostomia (25). L’intervento di colectomia con posizionamento di un’ileostomia è stato valorizzato considerando un importo di € 9.225,50 corrispondente alla media semplice delle tariffe di € 7.133,00 e di € 11.318,00 rimborsate dal SSN rispettivamente per il DRG149 (Interventi maggiori su intestino crasso e tenue senza CC) e per il DRG570 (Interventi maggiori su intestino crasso e tenue con CC senza diagnosi gastrointestinale maggiore). Anche l’intervento di proctectomia con confezionamento di J-pouch è stato valorizzato considerando lo stesso importo di € 9.225,50 associato alla colectomia con posizionamento di ileostomia. L’intervento di chiusura di ileostomia è stato invece valorizzato considerando un importo di € 4.491,00 corrispondente a quanto rimborsato dal SSN per il DRG153 (Interventi minori su intestino crasso e tenue senza CC). Sommando i costi associati alle tre fasi si ottiene un importo complessivo di € 22.942,00 per l’esecuzione e il completamento della terapia chirurgica.
Costo della terza linea
La Tabella 4, alla luce di quanto descritto nel paragrafo “Trattamenti considerati”, riporta il costo medio annuo di trattamento della terza linea, distinguendo tra le due sequenze alternative.
| Terza linea | VDZ → IFX | IFX → VDZ |
|---|---|---|
| % di utilizzo | % di utilizzo | |
| Ottimizzazione IFX | 20,00% | |
| Ottimizzazione VDZ | 20,00% | |
| Tofacitinib | 31,25% | 31,25% |
| Ustekinumab | 43,75% | 43,75% |
| Intervento chirurgico (colectomia) | 5,00% | 5,00% |
| Costo medio annuo ponderato* | € 17.322,90 | € 18.857,78 |
VDZ = vedolizumab; IFX = infliximab.
*Al fine del calcolo del costo medio annuo di trattamento per la terza linea per ustekinumab è stato considerato che il 74% dei pazienti dopo sei mesi di trattamento ricorra all’ottimizzazione, vale a dire a una riduzione del tempo di somministrazione da ogni 12 settimane a ogni 8 settimane (26).
Analisi di sensibilità
Con l’obiettivo di valutare la solidità dei risultati stimati nel caso base della CCA sono state condotte un’analisi deterministica e un’analisi di scenario. L’analisi deterministica ha ricalcolato i risultati del caso base facendo variare del ±20% i valori dei principali parametri del modello: i) DoT di VDZ nella prima linea di trattamento; ii) DoT di VDZ nella seconda linea di trattamento; iii) DoT di IFX nella prima linea di trattamento; iv) DoT di IFX nella seconda linea di trattamento; v) costo delle ospedalizzazioni; vi) costo della terapia chirurgica. Dal momento che quello utilizzato nel caso base potrebbe non rispecchiare il prezzo di cessione dei farmaci biologici praticato alle strutture sanitarie, l’analisi di scenario ha invece stimato l’impatto sui risultati di alcune ipotesi di sconto applicate ai prezzi di acquisto di VDZ, di IFX, di TOF e di UST. Rispetto al caso base, vengono presentati cinque scenari alternativi in ciascuno dei quali, facendo riferimento a quanto pubblicato nel rapporto AIFA (aggiornamento dicembre 2022) in tema di biosimilari (31), viene mantenuto fisso uno sconto addizionale del 38,13% per IFXOri IV, dell’80,37% per IFXBio IV e del 24,50% per IFXBio SC, mentre, in assenza di specifiche informazioni, viene fatto variare lo sconto addizionale applicato ai prezzi di acquisto di VDZ, TOF e UST dal 10% al 50%, con scaglioni incrementali di 10 punti percentuali.
Risultati
Risultati della CCA
La Figura 2 illustra i risultati della CCA per le sequenze terapeutiche VDZ → IFX e IFX → VDZ nel trattamento dei pazienti adulti con RCU attiva da moderata a grave. In 5,2 anni, a fronte di un maggiore arco temporale che intercorre tra l’inizio della prima e la fine della seconda linea (5,2 anni vs 3,7 anni) e quindi di un ritardo al ricorso della terza linea, la sequenza VDZ → IFX (prima linea € 64.755 + seconda linea € 21.584 = € 86.339) determina il minor costo medio di trattamento rispetto alla sequenza IFX → VDZ (prima linea € 18.126 + seconda linea € 41.956 + terza linea € 29.554 = € 89.636) (Tab. 5). Il percorso che prevede VDZ in prima linea determina una riduzione dei costi di trattamento di € 3.297 rispetto a quello che prevede IFX in prima linea, grazie a una maggiore persistenza e a una riduzione dei costi delle successive linee.
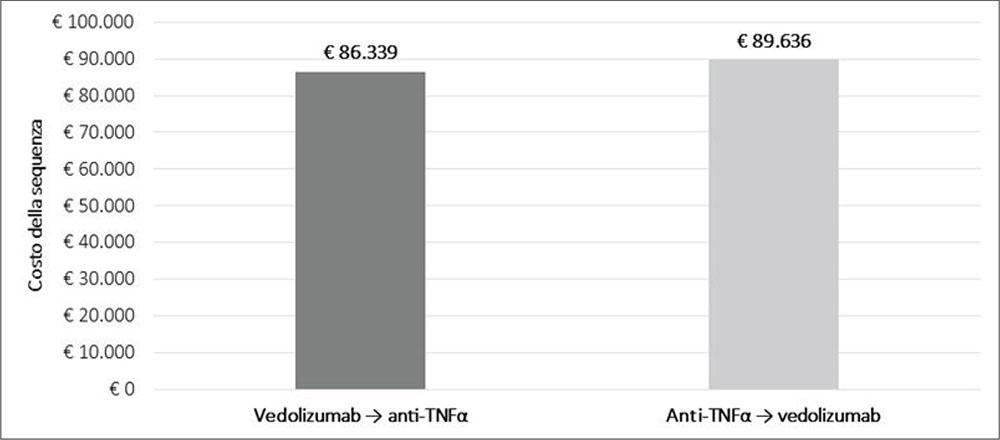
FIGURA 2 - Risultati della CCA.
VDZ = vedolizumab; IFX = infliximab.
| Sequenza | Prima linea | Seconda linea | Terza linea | Totale |
|---|---|---|---|---|
| VDZ → IFX | ||||
| Persistenza in trattamento (anni) | 3,6 | 1,6 | 0,0 | 5,2 |
| Costo di trattamento | € 64.755 | € 21.584 | € 0 | € 86.339 |
| IFX → VDZ | ||||
| Persistenza in trattamento (anni) | 1,4 | 2,3 | 1,5 | 5,2 |
| Costo di trattamento | € 18.126 | € 41.956 | € 29.554 | € 89.636 |
| Delta VDZ → IFX vs IFX → VDZ | –€ 3.297 |
VDZ = vedolizumab; IFX = infliximab.
Analisi deterministica
L’analisi di sensibilità deterministica mostra come le DoT di IFX nella prima e nella seconda linea di trattamento costituiscano i parametri in grado di influenzare maggiormente i risultati del caso base della CCA (Fig. 3). Da notare però come nessuno di essi determini una variazione tale da generare una differenza significativa tra i costi di trattamento delle due sequenze osservate (Fig. 3).
Analisi di scenario
I risultati delle analisi di scenario, finalizzati a stimare l’impatto di alcune ipotesi di sconto adottate per il calcolo del costo di trattamento delle due sequenze, sono riportati nella Tabella 6. Considerando tutte le assunzioni di sconto applicate ai farmaci biologici, nei cinque scenari alternativi proposti la sequenza terapeutica che prevede la somministrazione in prima linea di VDZ determina sempre il minor costo di trattamento (Tab. 6).
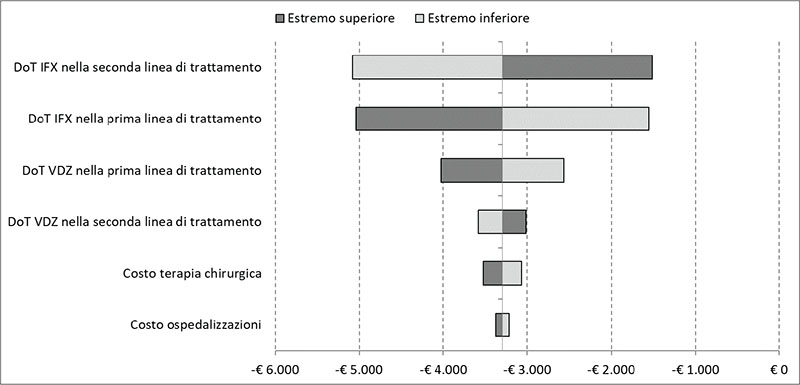
FIGURA 3 - Analisi deterministica: risultati.
DoT = durata del trattamento; VDZ = vedolizumab; IFX = infliximab.
| Scenario | VDZ → IFX | IFX → VDZ | Differenza |
|---|---|---|---|
| Caso Base(1) | € 86.339 | € 89.636 | –€ 3.297 |
| Scenario alternativo 1(2) | € 66.244 | € 70.622 | –€ 4.378 |
| Scenario alternativo 2(3) | € 60.180 | € 64.191 | –€ 4.011 |
| Scenario alternativo 3(4) | € 54.116 | € 57.759 | –€ 3.643 |
| Scenario alternativo 4(5) | € 48.052 | € 51.328 | –€ 3.276 |
| Scenario alternativo 5(6) | € 41.988 | € 44.896 | –€ 2.908 |
VDZ = vedolizumab; IFX = infliximab.
(1) Per tutti i trattamenti sono stati considerati i rispettivi prezzi ex-factory al netto delle sole riduzioni obbligatorie di legge.
(2) Rispetto al caso base, per IFXOri IV è stato considerato uno sconto addizionale del 38,13%, per IFXBio IV uno sconto addizionale dell’80,37% e per IFXBio SC uno sconto addizionale del 24,50%, mentre per VDZ, TOF e UST è stato considerato uno sconto addizionale del 10%.
(3) Rispetto al caso base, per IFXOri IV è stato considerato uno sconto addizionale del 38,13%, per IFXBio IV uno sconto addizionale dell’80,37% e per IFXBio SC uno sconto addizionale del 24,50%, mentre per VDZ, TOF e UST è stato considerato uno sconto addizionale del 20%.
(4) Rispetto al caso base, per IFXOri IV è stato considerato uno sconto addizionale del 38,13%, per IFXBio IV uno sconto addizionale dell’80,37% e per IFXBio SC uno sconto addizionale del 24,50%, mentre per VDZ, TOF e UST è stato considerato uno sconto addizionale del 30%.
(5) Rispetto al caso base, per IFXOri IV è stato considerato uno sconto addizionale del 38,13%, per IFXBio IV uno sconto addizionale dell’80,37% e per IFXBio SC uno sconto addizionale del 24,50%, mentre per VDZ, TOF e UST è stato considerato uno sconto addizionale del 40%.
(6) Rispetto al caso base, per IFXOri IV è stato considerato uno sconto addizionale del 38,13%, per IFXBio IV uno sconto addizionale dell’80,37% e per IFXBio SC uno sconto addizionale del 24,50%, mentre per VDZ, TOF e UST è stato considerato uno sconto addizionale del 50%.
Discussione
Data la natura cronica della RCU, più che condurre un confronto tra le singole linee, appare importante identificare quale sequenza di trattamenti sia in grado di determinare il maggior beneficio clinico in rapporto al costo sostenuto dal SSN. In quest’ottica, dal momento che è caratterizzata da una significativa valenza economica (identificazione delle risorse sanitarie consumate), la durata del trattamento ricopre un ruolo di primaria importanza. Lungo un orizzonte temporale di 5,2 anni, in virtù di un accesso ritardato alla terza linea di 1,5 anni, la sequenza che prevede la somministrazione in prima linea di VDZ nella popolazione bio-naïve con RCU attiva da moderata a grave determina il minor costo di trattamento rispetto alla sequenza con IFX in prima linea (€ 86.339 vs € 89.636). Anche se minima, la differenza del costo di trattamento (–€ 3.297) dimostra come l’analisi di un percorso di cura che riflette i costi a lungo termine possa produrre risultati differenti rispetto a quelli attesi per analisi di breve periodo (p. es., un anno) condotte su singole molecole. Vale a dire che a fronte di un orizzonte temporale di lungo periodo la somministrazione di VDZ in prima linea non determinerebbe un aumento dei costi di trattamento a carico del SSN, ma un efficientamento del percorso di cura dei pazienti adulti bio-naïve con RCU attiva da moderata a grave che non hanno risposto in modo adeguato alla terapia convenzionale.
Dal momento che, per replicare ciò che potrebbe avvenire nella pratica clinica, è stato fatto ricorso a un preesistente modello di simulazione (13), risulta opportuno interpretare i risultati della CCA alla luce delle seguenti osservazioni. Una prima osservazione ricade sull’adozione dell’orizzonte temporale. L’analisi del caso base ha considerato un orizzonte temporale sufficientemente lungo da includere, se presenti, le differenze di DoT tra le due sequenze confrontate e, conseguentemente, di numero di linee di trattamento somministrate e di costi ad esse associati. Sulla base dell’analisi condotta nel Regno Unito (13), alla sequenza VDZ → IFX è stata associata una durata di trattamento di 5,2 anni, di cui 3,6 anni in prima linea con VDZ e 1,6 anni in seconda linea con IFX, mentre alla sequenza IFX → VDZ è stata associata una durata di trattamento di 3,7 anni, di cui 1,4 in prima linea con IFX e 2,3 anni in seconda linea con VDZ. Nel caso in cui la CCA avesse confrontato questi due differenti orizzonti temporali (5,2 anni vs 3,7 anni), non avrebbe, di fatto, pesato l’effetto economico associato all’accesso anticipato alla terza linea di trattamento (ottimizzazione trattamento di seconda linea, trattamento con un terzo agente biologico [TOF o UST], terapia chirurgica, ecc.) da parte dei pazienti che iniziano il percorso terapeutico con IFX. Perciò, affinché i due orizzonti temporali fossero di uguale durata (5,2 anni ciascuno) e il confronto economico fosse omogeneo, alla sequenza IFX → VDZ è stato aggiunto il ricorso alla terza linea di trattamento per un periodo di 1,5 anni.
Una seconda osservazione riguarda la fonte dei dati clinici (13) da cui sono state estrapolate le DoT associate alle prime e alle seconde linee di trattamento delle sequenze confrontate. Come indicato nel testo, il processo di revisione della letteratura ha identificato 19 studi utili, di cui 14 hanno riportato i dati per gli anti-TNFα somministrati a 7.690 pazienti bio-naïve, 7 hanno riportato i dati per VDZ somministrato a 585 pazienti bio-naïve, 5 hanno riportato i dati per VDZ somministrato nei pazienti bio-exposed e 1 ha riportato i dati per gli anti-TNFα somministrati nei pazienti bio-exposed (13). Dal momento che, soprattutto in quest’ultimo caso (anti-TNFα nei pazienti bio-exposed), l’esiguità del numero di studi e del correlato numero di pazienti potrebbe nascondere una variabilità della DoT associata, è stata condotta un’analisi di sensibilità deterministica finalizzata a indagare l’impatto della variabilità delle durate di trattamento sul risultato del caso base. Le permanenze in trattamento di prima e seconda linea associata a IFX rappresentano, tra tutti quelli considerati, i parametri che determinano la maggiore incertezza sul risultato del caso base. Va comunque precisato che anche a fronte di sensibili variazioni (± 20% rispetto al valore del caso base) delle DoT associate a IFX, permarrebbe il vantaggio economico a favore della sequenza VDZ → IFX.
Una terza osservazione è collegata alla scelta dei prezzi di acquisto dei farmaci biologici. Nel caso base il confronto tra le sequenze è stato effettuato considerando per ciascun farmaco biologico il corrispettivo prezzo ex-factory al netto delle sole riduzioni obbligatorie di legge, ma al lordo di qualsiasi ulteriore sconto negoziato. È quindi verosimile affermare che i risultati del caso base potrebbero non riflettere i costi di cessione dei farmaci biologici attualmente praticati alle strutture sanitarie. Con l’obiettivo, quindi, di replicare ciò che avviene nella pratica clinica è stata condotta un’analisi di scenario grazie alla quale, rispetto al caso base, sono stati applicati sconti addizionali ai farmaci biologici. Considerando i cinque scenari alternativi ipotizzati, la sequenza VDZ → IFX è rimasta sempre cost-saving rispetto alla sequenza IFX → VDZ (range variazione dei risultati: da –€ 4.378 a –€ 2.908), confermando i risultati del caso base.
Una quarta osservazione è inerente alla scelta del mix di farmaci biologici individuati per definire il trattamento con anti-TNFα. Come riportato nella sezione metodi, la totalità dei dati di input del modello è stata validata dall’Expert Panel (25), compreso il mix di farmaci biologici considerati per la classe anti-TNFα. Nello specifico l’Expert Panel ha ritenuto che, con riferimento al contesto italiano, la totalità dei pazienti con RCU attiva da moderata a grave che non ha risposto alla terapia convenzionale venga trattata con infliximab, di cui il 95% con il biosimilare (IV e SC) (25). Ciò è in linea con quanto indicato dallo statement 2 riportato nell’aggiornamento delle Linee Guida IG-IBD che “per gli adulti con RCU attiva da moderata a grave, refrattaria alla terapia convenzionale e naïve ai biologici, suggerisce di utilizzare infliximab rispetto ad adalimumab e a golimumab per l’induzione e la remissione” (32).
Nella CCA, oltre ai costi farmacologici, sono stati considerati anche i costi associati alle ospedalizzazioni e alla terapia chirurgica. L’analisi deterministica ha evidenziato come anche a fronte di una sensibile variazione (± 20%) dei valori considerati nel caso base per questi costi il risultato del confronto tra le due sequenze rimanga pressoché invariato.
Conclusioni
Alla luce dei risultati ottenuti, è possibile affermare che il ricorso alla sequenza di trattamento che prevede la somministrazione di VDZ in prima linea costituisca una valida strategia di ottimizzazione dell’impiego delle risorse sanitarie associate al trattamento dei pazienti con RCU in fase attiva, di grado da moderato a grave, che non hanno risposto in modo adeguato alla terapia convenzionale o che risultano intolleranti o per cui esista una controindicazione medica a queste terapie. Essendo questa una conclusione preliminare basata sull’utilizzo di un modello di simulazione, si ritiene che future analisi economiche fondate su studi clinici orientati al percorso di trattamento piuttosto che al confronto di singoli farmaci contribuiranno a rispondere a eventuali rimanenti aree di incertezza.
Disclosures
Conflict of interest: The Authors declare no conflict of interests. SEV has served as speaker for Abbvie, Agave, AGPharma, Alfasigma, Aurora Pharma, CaDiGroup, Celltrion, Dr Falk, EG Stada Group, Fenix Pharma, Fresenius Kabi, Galapagos, Janssen, JB Pharmaceuticals, Innovamedica/Adacyte, Malesci, Mayoly Biohealth, Omega Pharma, Pfizer, Reckitt Benckiser, Sandoz, SILA, Sofar, Takeda, Tillots, Unifarco; he has served as consultant for Abbvie, Agave, Alfasigma, Biogen, Bristol-Myers Squibb, Celltrion, Diadema Farmaceutici, Dr. Falk, Fenix Pharma, Fresenius Kabi, Janssen, JB Pharmaceuticals, Merck & Co, Nestlé, Reckitt Benckiser, Regeneron, Sanofi, SILA, Sofar, Synformulas GmbH, Takeda, Unifarco; he received research support from Pfizer, Reckitt Benckiser, SILA, Sofar, Unifarco, Zeta Farmaceutici.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Kobayashi T, Siegmund B, Le Berre C, et al. Ulcerative colitis. Nat Rev Dis Primers. 2020;6(1):74. CrossRef PubMed
- 2. Nakase H, Uchino M, Shinzaki S, et al. Evidence-based clinical practice guidelines for inflammatory bowel disease 2020. J Gastroenterol. 2021;56(6):489-526. CrossRef PubMed
- 3. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel J-F. Ulcerative colitis. Lancet. 2017;389(10080):1756-1770. CrossRef PubMed
- 4. Cohen RD, Yu AP, Wu EQ, Xie J, Mulani PM, Chao J. Systematic review: the costs of ulcerative colitis in Western countries. Aliment Pharmacol Ther. 2010;31(7):693-707. CrossRef PubMed
- 5. Paschos P, Katsoula A, Salanti G, Giouleme O, Athanasiadou E, Tsapas A. Systematic review with network meta-analysis: the impact of medical interventions for moderate-to-severe ulcerative colitis on health-related quality of life. Aliment Pharmacol Ther. 2018;48(11-12):1174-1185. CrossRef PubMed
- 6. Turner D, Ricciuto A, Lewis A, D’Amico F, Dhaliwal J, Griffiths AM, Bettenworth D, Sandborn WJ, Sands BE, Reinisch W, Schölmerich J, Bemelman W, Danese S, Mary JY, Rubin D, Colombel JF, Peyrin-Biroulet L, Dotan I, Abreu MT, Dignass A; International Organization for the Study of IBD. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology. 2021 Apr;160(5):1570-1583. CrossRef PubMed
- 7. Gray JR, Leung E, Scales J. Treatment of ulcerative colitis from the patient’s perspective: a survey of preferences and satisfaction with therapy. Aliment Pharmacol Ther. 2009;29(10):1114-1120. CrossRef PubMed
- 8. Peyrin-Biroulet L, Van Assche G, Sturm A, et al. Treatment satisfaction, preferences and perception gaps between patients and physicians in the ulcerative colitis CARES study: A real world-based study. Dig Liver Dis. 2016;48(6):601-607. CrossRef PubMed
- 9. Chao YS, Loshak H. Biologics versus Immunomodulators for the Treatment of Ulcerative Colitis: A Review of Comparative Clinical Effectiveness and Cost-Effectiveness [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019. Online (Accessed December 2023)
- 10. Arora Z, Shen B. Biological therapy for ulcerative colitis. Gastroenterol Rep (Oxf). 2015;3(2):103-109. CrossRef PubMed
- 11. Bhattacharya A, Osterman MT. Biologic Therapy for Ulcerative Colitis. Gastroenterol Clin North Am. 2020 Dec;49(4):717-729. CrossRef PubMed
- 12. Breton J, Kastl A, Conrad MA, Baldassano RN. Positioning biologic therapies in the management of pediatric inflammatory bowel disease. Gastroenterol Hepatol (N Y). 2020;16(8):400-414. PubMed
- 13. Dhar A, Wilson A, Reid V, et al. Choice of first biologic in moderate to severe ulcerative colitis – a decision analysis using time-on-treatment and UK costs. Presented at the 2023 ECCO Congress 3rd March 2023. CrossRef
- 14. Gov.Uk Guidance. Cost consequence analysis: health economic studies Online (Accessed December 2023)
- 15. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto. Entyvio. Online (Accessed December 2023)
- 16. Agenzia Italiana Del Farmaco (AIFA). DETERMINA 7 luglio 2021 Riclassificazione del medicinale per uso umano «Entyvio», ai sensi dell’art. 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. DG/807/2021). (21A04297) (GU Serie Generale n.174 del 22-07-2021). Online (Accessed December 2023)
- 17. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto. Remicade. Online (Accessed December 2023)
- 18. Agenzia Italiana Del Farmaco (AIFA). DETERMINA 31 luglio 2014 Regime di rimborsabilita’ e prezzo a seguito di nuove indicazioni terapeutiche del medicinale per uso umano «Remicade (infliximab)». (Determina n. 823/2014). (14A06444) (GU Serie Generale n.190 del 18-08-2014). Online (Accessed December 2023)
- 19. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto. Remsima. Online (Accessed December 2023)
- 20. Agenzia Italiana Del Farmaco (AIFA). DETERMINA 9 dicembre 2014 Regime di rimborsabilita’ e prezzo del medicinale per uso umano «Remsima» (infliximab), autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determina n. 1471/2014). (14A09840) (GU Serie Generale n.302 del 31-12-2014). Online (Accessed December 2023)
- 21. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto. Adalimumab. Online (Accessed December 2023)
- 22. Agenzia Italiana Del Farmaco (AIFA). DETERMINA 10 aprile 2014 Regime di rimborsabilita’ e prezzo a seguito di nuove indicazioni terapeutiche del medicinale per uso umano Humira (adalimumab). (Determina n. 350/2014). (14A03306) (GU Serie Generale n.98 del 29-04-2014). Online (Accessed December 2023)
- 23. European Medicines Agency (EMA). Riassunto delle caratteristiche di prodotto. Golimumab. Online (Accessed December 2023)
- 24. Agenzia Italiana Del Farmaco (AIFA). DETERMINA 19 gennaio 2015 Regime di rimborsabilita’ e prezzo a seguito di nuove indicazioni terapeutiche del medicinale per uso umano «Simponi» (golimumab). (Determina n. 19/2015). (15A00523) (GU Serie Generale n.22 del 28-01-2015). Online (Accessed December 2023)
- 25. Technical Report. Tavolo di Discussione Multidisciplinare: Le sequenze di trattamento nella Colite Ulcerosa. Takeda. Data on file.
- 26. Chaparro M, Hermida S, Acosta D, et al. Real world evidence of ustekinumab in ulcerative colitis: short and longterm effectiveness and safety: the ULISES study. United European Gastroenterology Journal 2023, Vol 11 (S8). Oral Presentations. Sunday, October 15, 2023. Unsolved issues in IBD outcome 14:30-15:30 / D4. ISSN 2050-6414 (Online)
- 27. Macaluso FS, Ventimiglia M, Orlando A. Effectiveness and Safety of Vedolizumab in Inflammatory Bowel Disease: A Comprehensive Meta-analysis of Observational Studies. J Crohns Colitis. 2023;17(8):1217-1227. CrossRef PubMed
- 28. Agenzia Italiana Del Farmaco (AIFA). Linee guida per la compilazione del dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale ai sensi del D.M. 2 agosto 2019. Online (Accessed December 2023)
- 29. Ministero della Salute. Decreto Remunerazione delle prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. Supplemento ordinario alla “Gazzetta Ufficiale” n. 23 del 28 gennaio 2013 – Serie generale. Online (Accessed December 2023)
- 30. Dovizio M, Perrone V, Veronesi C, et al. La gestione terapeutica ed i costi sanitari associati in pazienti con malattie infiammatorie croniche intestinali (MICI): dati di real-world della regione Lazio. Clinico Economics Italian Articles On Outcomes Research. Vol 18 anno 2023 pp. 41-48 Online (Accessed December 2023)
- 31. Agenzia Italiana Del Farmaco (AIFA). Biosimilari: Analisi della variabilità regionale. Analisi grafica della variabilità regionale dei consumi e del costo dei medicinali biologici a brevetto scaduto nel canale acquisti diretti. (Dato NSIS/Tracciabilità del farmaco aggiornato a dic-2022) Online
- 32. Macaluso FS, Orlando A, Papi C, et al; Italian Group for the Study of Inflammatory Bowel Disease (IG-IBD); Working panel; Review panel. Use of biologics and small molecule drugs for the management of moderate to severe ulcerative colitis: IG-IBD clinical guidelines based on the GRADE methodology. Dig Liver Dis. 2022;54(4):440-451. CrossRef PubMed