 |
AboutOpen | 2019; 5(1): 39-47
ORIGINAL RESEARCH ARTICLE |
 |
Il percorso diagnostico terapeutico e assistenziale nella gestione del paziente con melanoma cutaneo: l’esperienza dell’IDI di Roma
The integrated care pathway for melanoma: the Istituto Dermopatico dell’Immacolata experience in Rome
Introduction: The Integrated Care Pathway (ICP) represents a multidisciplinary outline of anticipated care, placed in an appropriate timeframe, to support patients with specific conditions or symptoms. The aim of this paper is to define the ICP for patients with melanoma referring to the “Istituto Dermopatico dell’Immacolata-IRCCS di Roma e Villa Paola” (“Center”).
Methods and results: A multidisciplinary group (oncologists, dermatologists, surgeons, pathologists etc.) was defined as well as a facilitator to act as a link between all experts. The first step of ICP development was a review of current practice for patients with melanoma referring to the Center. This first step had the scope to define the multidisciplinary process map (a “picture” of the care plan) for patients with melanoma. The process map defined: i) the activities performed during delivery of care to the patients, ii) the responsibilities for these activities and iii) potential problem areas or opportunities for improvements. The process map formed the basis of the final ICP document.
Conclusion: The adoption of melanoma ICP will allow the multidisciplinary group to ensure that clinical guidelines and available evidence are incorporated into everyday practice.
Keywords: Continuity of care, Integrated Care Pathway, Melanoma, Patient care
Submitted: May 13, 2019
Accepted: May 22, 2019
Published online: June 7, 2019
© 2019 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC-ND 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Premessa e domanda di ricerca
Il melanoma è un tumore maligno che origina dai melanociti, cellule della cute deputate alla difesa della pelle dai raggi ultravioletti (UV) mediante la produzione di melanina. L’insorgenza del melanoma avviene prevalentemente a livello della cute, anche se raramente può interessare altri distretti corporei come le mucose, le meningi e l’uvea (1-3).
Allo sviluppo del melanoma concorrono fattori sia genetici che ambientali. Recenti acquisizioni sull’eterogeneità genetica del melanoma hanno portato alla scoperta di specifiche mutazioni che sembrerebbero essere correlate alla sede d’insorgenza e al tipo di esposizione solare. Accanto alla consueta classificazione anatomo-clinica del melanoma (a diffusione superficiale, nodulare, acrale-lentigginoso o lentigo maligna), se ne sta delineando una nuova che integra i profili mutazionali (BRAF, NRAS, NF1, cKIT, CDKN2A). L’esposizione ai raggi UV, sia naturali che artificiali, rappresenta il più importante fattore di rischio ambientale. In generale tra i principali fattori di rischio per il melanoma vengono considerati: un elevato numero di nevi melanocitici, la presenza e il numero di nevi atipici, la presenza di un nevo melanocitico congenito gigante, il fototipo I-II (lentiggini, capelli, occhi e pelle chiari), la storia familiare di melanoma, un pregresso melanoma o altri tumori della pelle non melanocitari, l’esposizione a raggi UV (soprattutto se intensa e intermittente naturale e/o artificiale) e le ustioni solari (specialmente in età infantile).
Secondo gli ultimi dati riportati nelle linee guida dell’Associazione Italiana di Oncologia Medica (AIOM) 2018, circa l’85% dei melanomi cutanei interessa le popolazioni di Nord-America, Europa e Oceania (4). In Europa l’incidenza del melanoma è più alta nelle popolazioni nordiche (12-25 casi/100.000 abitanti/anno) rispetto a quelle dei Paesi mediterranei (3-5 casi/100.000 abitanti/anno), mentre la mortalità è sostanzialmente stabile (2,3 casi/100.000 abitanti/anno).
Il melanoma è uno dei principali tumori che insorge in giovane età, con un picco d’incidenza intorno ai 50-60 anni. In Italia rappresenta il secondo e il terzo tumore più frequente rispettivamente nei maschi e nelle femmine sotto i 50 anni di età (4). Secondo le più recenti stime AIOM, nel 2017 sarebbero stati circa 14.000 i nuovi casi di melanoma, trend in aumento sia nei maschi (+4,4%) che nelle femmine (+3,1%) (4). Come per l’Europa, anche in Italia l’incidenza del melanoma cutaneo è caratterizzata da una sensibile variabilità geografica contraddistinta da un andamento decrescente da Nord a Sud (tassi fino a due volte più bassi) (4). Nonostante l’aumento dell’incidenza, anche in Italia come in molti Paesi europei la mortalità è rimasta sostanzialmente stabile (4).
La sempre maggiore disponibilità di linee guida evidence-based e l’istituzione di gruppi multidisciplinari finalizzati a descrivere il flusso dei pazienti all’interno del sistema sanitario hanno migliorato sia l’efficacia clinica che il coordinamento dei servizi tra i vari dipartimenti ospedalieri proponendo modelli di cura sempre più efficienti (1-3).
Secondo la definizione adottata dall’European Pathway Association (EPA), un Percorso Diagnostico Terapeutico e Assistenziale (PDTA) è “un intervento complesso mirato alla condivisione dei processi decisionali e dell’organizzazione dell’assistenza per un gruppo specifico di pazienti durante un periodo di tempo ben definito” (5). Le principali caratteristiche di un PDTA includono: i) un’esplicitazione degli obiettivi e degli elementi chiave dell’assistenza basata su evidenze scientifiche, best practice, aspettative e caratteristiche dei pazienti, ii) la facilitazione delle comunicazioni tra i membri del gruppo multidisciplinare, pazienti e loro familiari, iii) il coordinamento del processo di assistenza tramite il coordinamento dei ruoli e l’attuazione consequenziale delle attività dei gruppi multidisciplinari di assistenza, dei pazienti e dei loro familiari, iv) la documentazione, il monitoraggio e la valutazione degli outcome clinici e infine v) l’identificazione delle risorse appropriate. L’obiettivo di un PDTA è quindi incrementare la qualità dell’assistenza attraverso il “continuum” assistenziale, migliorando gli outcome, promuovendo la sicurezza dei pazienti, aumentando la soddisfazione dell’utenza e ottimizzando l’uso delle risorse (5).
In tale contesto la definizione di un percorso dedicato ai pazienti affetti da melanoma costituisce un obiettivo prioritario per l’Istituto Dermopatico dell’Immacolata (IDI) IRCCS, sede di Roma e Villa Paola (d’ora in avanti identificato come “Istituto”). La mappatura di un PDTA nasce dall’esigenza di lavorare in un’ottica integrata aziendale (gruppo multidisciplinare) per fornire un unico punto di riferimento al paziente affetto da melanoma. L’attività del gruppo multidisciplinare deve essere finalizzata all’ottimizzazione dei tempi di diagnosi e di trattamento, alla semplificazione delle procedure e alla riduzione dei disagi per il paziente; essa deve quindi offrire un’assistenza di elevata qualità caratterizzata da percorsi personalizzati, secondo protocolli basati sulle evidenze scientifiche più aggiornate.
Metodologia applicata
Il PDTA per la gestione del paziente con melanoma cutaneo qui presentato aggiorna la precedente versione del 20 ottobre 2018 in base alle più recenti acquisizioni in letteratura, rifacendosi in particolare alle linee guida nazionali AIOM 2018 (4), al nuovo sistema di stadiazione e classificazione dell’American Joint Committee on Cancer (AJCC) 8a edizione 2017 (6), all’update dell’American Society of Clinical Oncology-Society of Surgical Oncology (ASCO-SSO) 2018 (7), alle già note linee guida del National Comprehensive Cancer Network (NCCN) 2019 (1) e della European Society for Medical Oncology (ESMO) 2015 (2) e alle European consensus-based interdisciplinary guidelines 2016 (3).
Il PDTA del paziente affetto da melanoma è complesso e multidisciplinare. Le esigenze dei pazienti variano notevolmente in base alle caratteristiche e alla stadiazione della malattia, secondo necessità e tempistiche difficilmente realizzabili in ambienti non dedicati. L’Unità Operativa Funzionale (UOF) del Melanoma dell’Istituto si configura come una cabina di regia per ottimizzare la gestione e il follow-up del paziente affetto da melanoma e la prevenzione nei pazienti a rischio (familiari, nevo di Spitz atipico, lesioni di dubbia interpretazione etc.). Alla UOF del Melanoma afferiscono specialisti dermatologi e oncologi che, insieme ad altri specialisti dell’Istituto (chirurghi, anatomopatologi etc.), assistono in qualità di gruppo di lavoro multidisciplinare (GLM) i pazienti, integrando le proprie specifiche competenze.
L’attività di mappatura è stata sviluppata raccogliendo dati e informazioni fornite dal GLM coinvolto attivamente nel percorso di diagnosi e cura del paziente con melanoma. Hanno fatto parte del GLM le seguenti figure professionali: dermatologo, oncologo, chirurgo generale, chirurgo plastico, anatomopatologo, biologo molecolare ed epidemiologo.
Il contributo offerto dal GLM riguarda la definizione del processo di assistenza locale esistente per la gestione del paziente con melanoma. È stata quindi definita una mappa organizzativa (flow chart) per rappresentare graficamente l’ordine dei passaggi dell’attuale percorso di diagnosi e cura dei pazienti con melanoma, dalla prima visita alla fase di follow-up. La mappa organizzativa mira a specificare la sequenza temporale delle attività svolte.
Il presente PDTA si applica a tutto il personale medico, paramedico, amministrativo, impegnato nella ricerca che opera nell’Istituto e ai pazienti con diagnosi di melanoma che usufruiscono di servizi erogati presso il Centro.
Le indicazioni riportate in questo documento riflettono i contenuti delle pubblicazioni più autorevoli disponibili al momento della stesura. I risultati di studi futuri potrebbero però determinare percorsi diversi da quelli attuali e richiedere aggiornamenti dello stesso PDTA. Potrebbe inoltre essere necessario, in circostanze particolari e nell’interesse di specifici pazienti, deviare dalle raccomandazioni di questo PDTA.
La stadiazione del melanoma è stata effettuata sulla base della classificazione TNM, così come riportata dall’ultima revisione dell’AJCC 8a edizione (vedi Appendice supplementare Tabelle A, B e C).
Il PDTA del melanoma
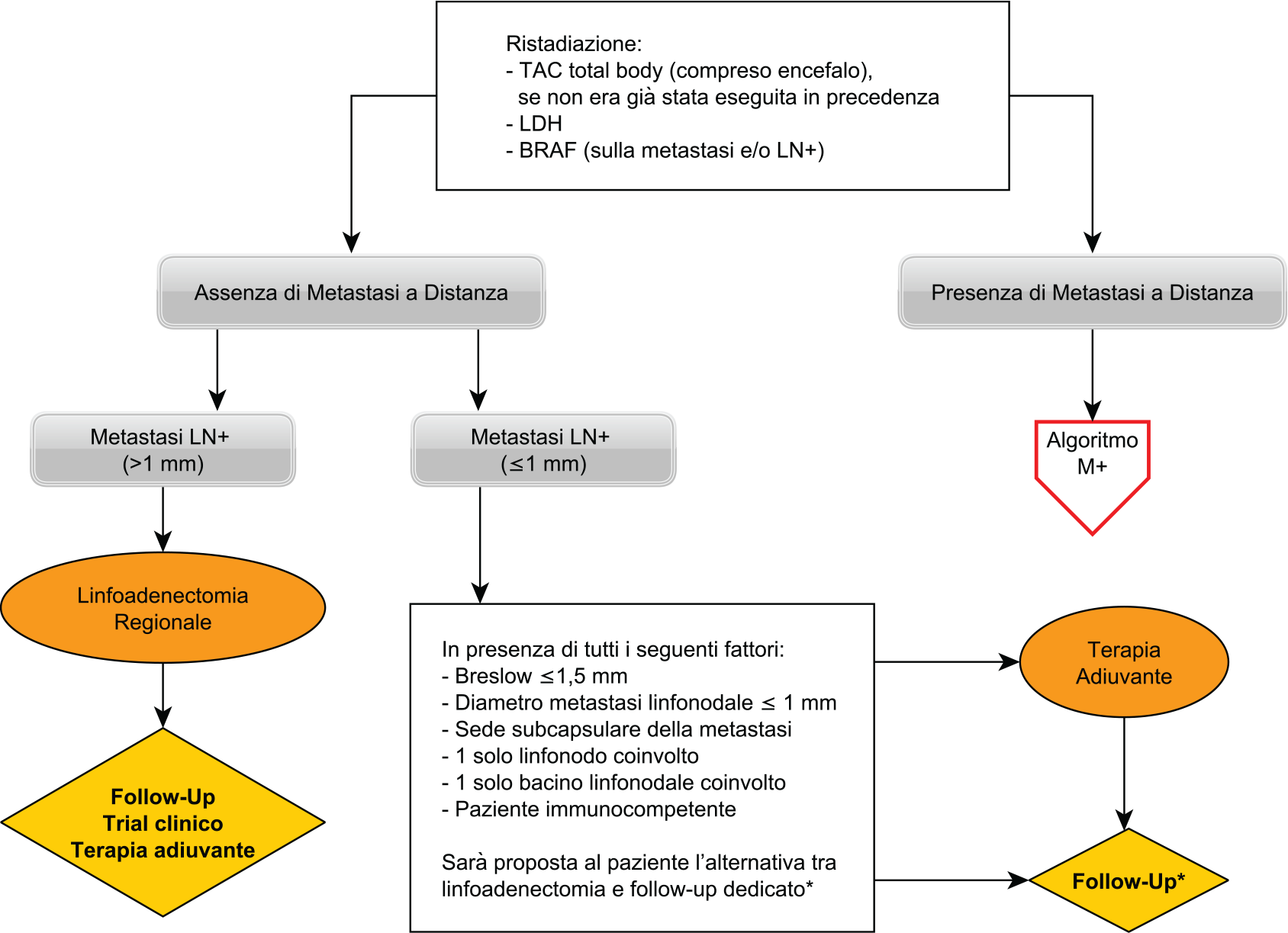
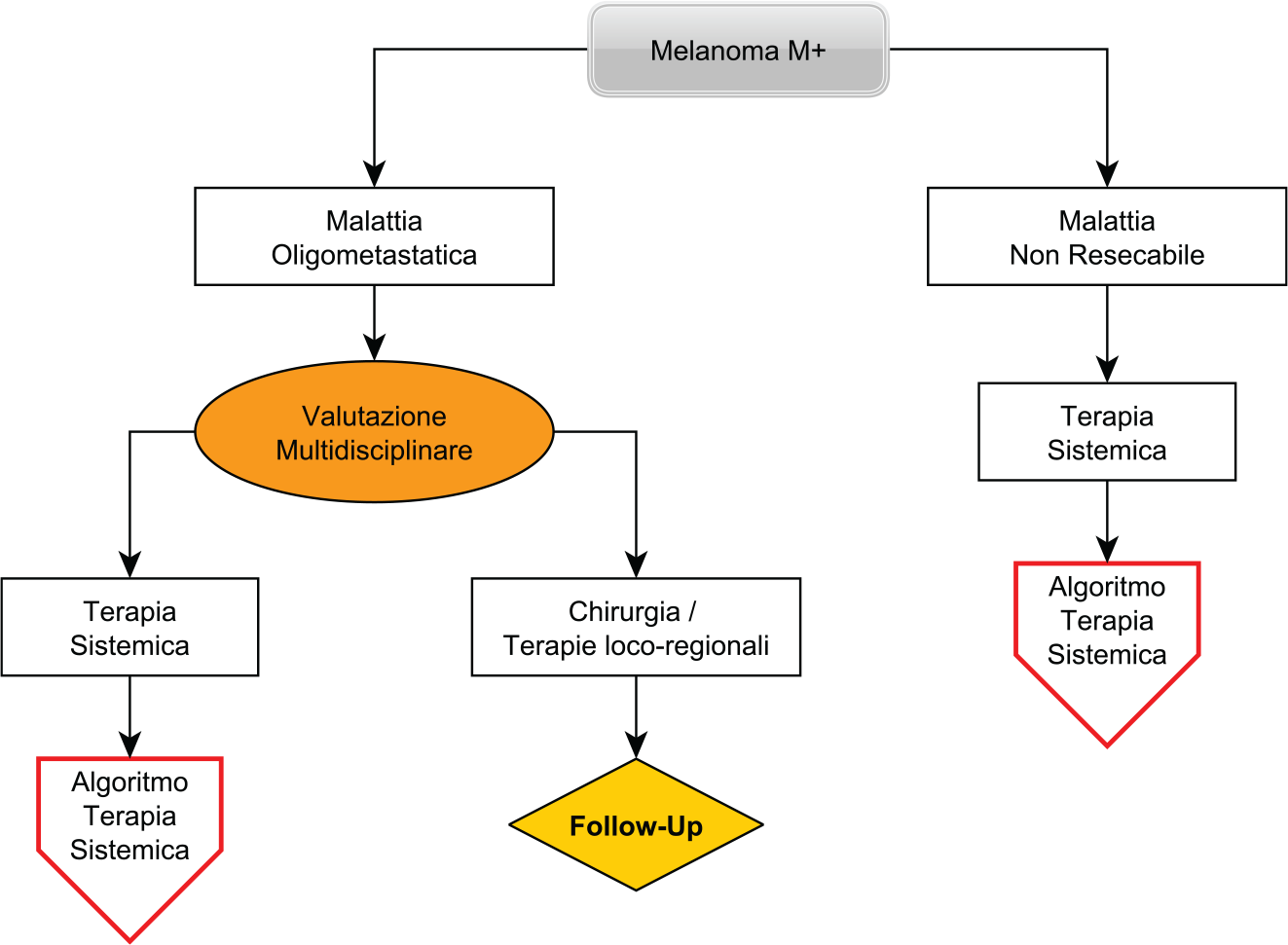
Le Figure da 1 a 4 mostrano il risultato del processo di mappatura del PDTA che, secondo il gruppo di lavoro multidisciplinare, dovrebbe essere posto in essere per un’efficace gestione del paziente con melanoma cutaneo. La Figura 1 riporta il dettaglio del melanoma primitivo. Le Figure 2 e 3 illustrano rispettivamente la gestione del paziente in caso di linfonodo positivo (LN+) o di metastasi a distanza (M+). Infine, la Figura 4 illustra l’algoritmo in caso di somministrazione di terapia sistemica.
La visita dermatologica
La visita dermatologica costituisce il primo passo verso la diagnosi. In caso di riscontro di un melanoma clinicamente evidente o di una lesione fortemente sospetta, prima dell’asportazione deve essere eseguita l’epiluminescenza digitale. La visita dermatologica è, di norma, così strutturata: i) accettazione del paziente (raccolta dei dati generali da parte dell’infermiere), ii) visita del dermatologo (con l’ausilio del dermatoscopio portatile) e iii) in caso di lesione sospetta, presa in carico del paziente (ritorno dall’infermiere, prescrizioni del medico, assistenza alla prenotazione di analisi, esami strumentali etc.).
Lesione sospetta
Prima di asportare la lesione sospetta il chirurgo deve accertarne l’acquisizione dell’immagine in epiluminescenza digitale. La lesione sospetta dovrebbe essere asportata completamente con una biopsia escissionale e con margini di tessuto sano di 1-2 mm. Tale procedura permette un’analisi istopatologica adeguata e una corretta stadiazione locale della malattia, senza compromettere la possibilità di una successiva radicalizzazione. Prima di inviare il tessuto da esaminare, il chirurgo dovrà controllare la corretta compilazione del modulo di richiesta dell’esame istologico, su cui andrà riportato il sospetto diagnostico e qualsiasi altra informazione anamnestica, clinica e tecnica che possa essere d’aiuto nella diagnosi istologica.
Referto istologico
La stadiazione locale (pT) viene definita nel referto dell’esame istologico del melanoma primitivo e permette di definire e programmare la successiva stadiazione strumentale, l’allargamento chirurgico e l’eventuale biopsia del linfonodo sentinella. Il referto istologico dovrà contenere le seguenti informazioni: dati del paziente, n° referto/anno, data del referto, sede della neoformazione, reperto macroscopico, istotipo (diffusione superficiale, nodulare, desmoplastico etc.), fase di crescita (radiale, verticale etc.), spessore secondo Breslow, ulcerazione, microsatellitosi e/o invasione linfovascolare, numero mitosi/mm2, regressione (indicare soprattutto se ≥ 75%), stadiazione pT (AJCC 8a edizione 2017), linfociti infiltranti il tumore (TIL), neurotropismo, componente nevica associata e stato dei margini laterali e profondi. Sulla base delle caratteristiche dell’esame istologico e della visita clinica verrà programmata la stadiazione strumentale [tranne che per il melanoma in situ (pTis)] e l’ampliamento chirurgico.
Comunicazione al paziente
La comunicazione al paziente dell’esito della diagnosi sarà effettuata dal medico che ha eseguito l’asportazione chirurgica o, in sua assenza, da chi abbia effettuato la prima visita. Alla consegna dell’esame istologico il paziente riceverà una lettera informativa (vedi Appendice supplementare Allegato 1) e verrà inviato all’UOF del Melanoma, dove sarà dettagliatamente informato sulla sua malattia e visitato con priorità, possibilmente entro lo stesso giorno.
Esami di stadiazione
Gli esami da eseguire per la stadiazione strumentale, finalizzata a individuare eventuali metastasi occulte, variano in base alle caratteristiche del melanoma primitivo evidenziate nel referto istologico (Tab. I).
| Melanoma | Indagini di laboratorio e strumentali – Stadiazione |
|---|---|
| pTis (in situ) | Non necessari |
| pT1a (stadio IA) | Esami strumentali solo se clinicamente indicati |
| pT1b (stadio IB) | Ecografia linfonodi loco-regionali + Ecografia addome |
| pT2a-b (stadio IB-IIA) | Ulteriori esami se clinicamente indicati |
| pT3a (stadio IIA)
pT3b (stadio IIB) pT4a (stadio IIB) |
TAC total body mdc + LDH
Ulteriori esami se clinicamente indicati |
| pT4b N0 M0 (stadio IIC)
pT1-4 N+ M0 (stadio III) |
TAC total body mdc (o PET/TAC) + LDH + BRAF Ulteriori esami se clinicamente indicati |
| pT1-4 N+ M+ (stadio IV) | TAC total body mdc (o PET/TAC) + LDH + BRAF (FNAB o biopsia della lesione sospetta opzionale)
Ulteriori esami se clinicamente indicati |
BRAF = analisi per individuare la mutazione; FNAB = biopsia ad ago sottile; LDH = lattico deidrogenasi; mdc = mezzo di contrasto; PET = tomografia a emissione di positroni; TAC = tomografia assiale computerizzata.
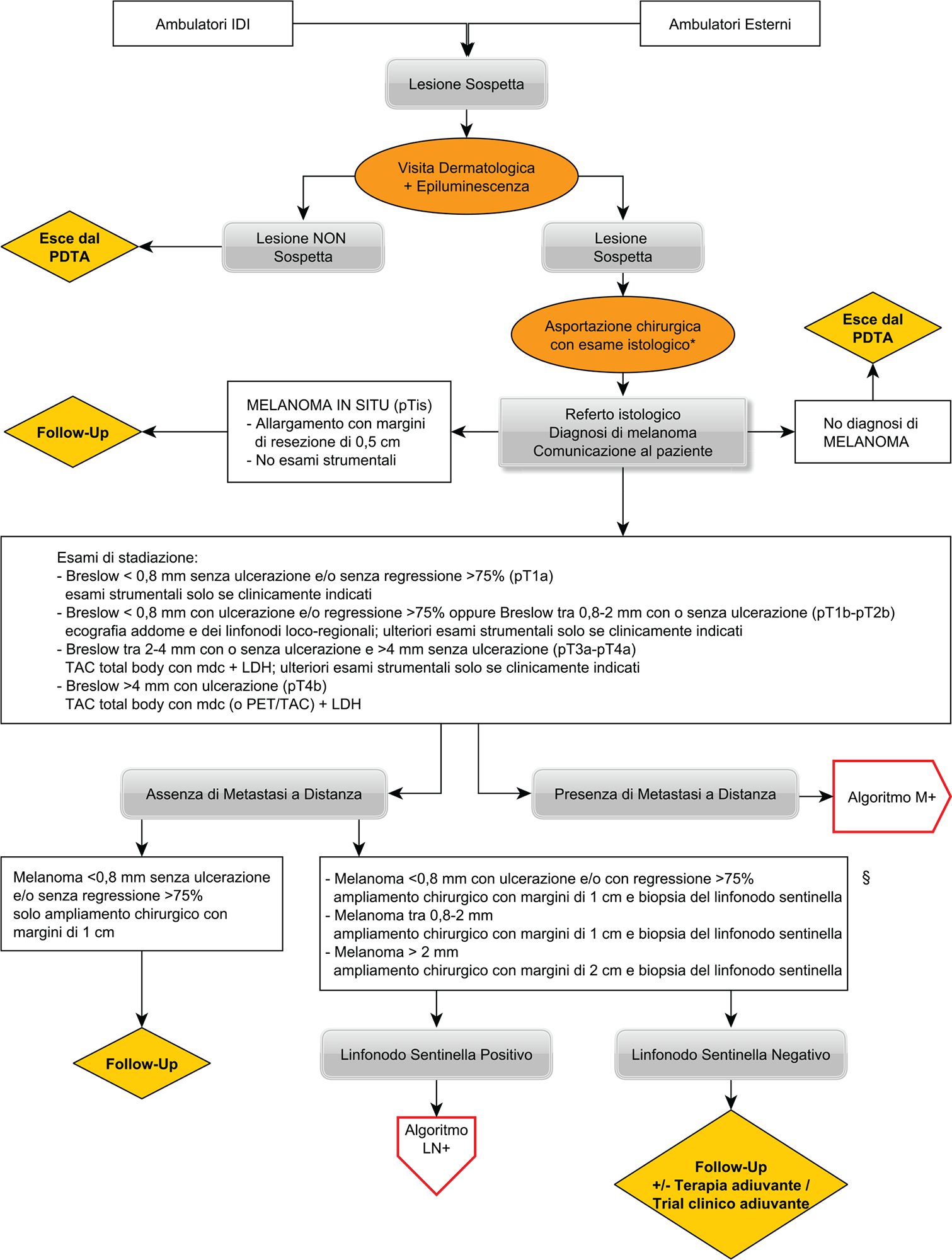
*Escissione in toto della lesione con margine sano di 1-2 mm. In casi particolari (per sede: dita, orecchio, viso, lesioni molto estese etc.) potrà essere effettuata una biopsia incisionale della zona più rappresentativa.
§Per la scelta della migliore strategia terapeutica saranno sottoposti ad analisi molecolare tutti i casi di melanoma a partire dallo stadio IIC.
LDH = lattico deidrogenasi; mdc = mezzo di contrasto; PET = tomografia a emissione di positroni; TAC = tomografia assiale computerizzata.
*Follow-up dedicato:
• Ecografie dei linfonodi loco-regionali ed ecografia dell’addome ogni 4 mesi per i primi 2 anni, ogni 6 mesi tra i 3 e i 5 anni e successivamente ogni anno.
• TAC total body con mezzo di contrasto o PET/TAC ogni 6/12 mesi per i primi 4 anni, poi annuale.
• LDH semestrale.
LDH = lattico deidrogenasi; PET = tomografia a emissione di positroni; TAC = tomografia assiale computerizzata.

§Alto carico può essere inteso ≥ 3 siti metastatici.
*Ipilimumab può essere considerato in prima linea in pazienti con basso carico di malattia, M1a o M1b, LDH normale.
CT = chemioterapia; LDH = lattico deidrogenasi; UNL = limite superiore della norma.
Ampliamento chirurgico
L’ampliamento chirurgico del melanoma dovrà avvenire preferenzialmente entro 4-6 settimane dalla diagnosi secondo le modalità indicate nella Tabella II.
Linfonodo sentinella
La biopsia del linfonodo sentinella (BLS) costituisce un momento fondamentale per la stadiazione chirurgica del melanoma. La tecnica di BLS è una procedura considerata minimamente invasiva, che permette di individuare i pazienti con linfonodi metastatici (LN+), clinicamente non palpabili. La metodica richiede l’esecuzione preoperatoria di una linfoscintigrafia, al fine di individuare correttamente il linfonodo da asportare.
Dopo aver discusso con il paziente i potenziali rischi e benefici della procedura, la BLS deve essere offerta a tutti i pazienti che abbiano un melanoma primitivo con spessore > 0,8 mm secondo Breslow, indipendentemente dalle altre caratteristiche istopatologiche associate, oppure nei melanomi pT1b e pT > 1b. Non è opportuno eseguire la BLS in caso di metastasi linfonodali clinicamente evidenti o evidenza strumentale di disseminazione linfonodale e/o viscerale di malattia. Si raccomanda inoltre di segnalare nel referto del linfonodo sentinella: il diametro massimo della metastasi (se ci sono più focolai, il diametro massimo di quello maggiore), la sede della metastasi (capsulare, sottocapsulare, parenchimale o mista), la presenza di estensione extra capsulare, la profondità d’invasione secondo Starz, la presenza di cellule neviche. Per il campionamento del linfonodo si suggerisce di adottare le linee guida EORTC Melanoma Group. Secondo l’attuale sistema di stadiazione, il linfonodo sentinella viene considerato positivo anche soltanto in presenza di cellule tumorali isolate, evidenziate solamente con colorazioni immunoistochimiche per HMB45 e/o per Melan A/Mart1 o altri marcatori melanoma specifici.
| Spessore melanoma | Margine sano |
|---|---|
| In situ | 0,5 cm |
| ≤ 1,0 mm | 1 cm |
| 1,01-2 mm | 1 cm |
| > 2 mm | 2 cm |
Tali margini sono raccomandati ma suscettibili di modifica in base a considerazioni anatomico-funzionali da parte del chirurgo.
Analisi molecolare
Fino a pochi anni fa il trattamento del melanoma metastatico era costituito dalla chemioterapia citotossica, caratterizzata da bassi tassi di risposta e di sopravvivenza. Tuttavia, a partire dal 2011, l’approvazione di farmaci a bersaglio molecolare, costituiti da inibitori della chinasi BRAF mutata (vemurafenib e dabrafenib) e della chinasi MEK (trametinib e cobimetinib), e da anticorpi monoclonali inibitori dei checkpoints immunologici (es. ipilimumab diretto verso il recettore CTLA4; nivolumab e pembrolizumab diretti verso il recettore PD1), ha determinato un notevole progresso nella terapia del melanoma metastatico.
La mutazione del gene BRAF interessa circa il 50% dei casi di melanoma e permette l’identificazione di pazienti che possono beneficiare di un trattamento con farmaci BRAF/MEK inibitori. La mutazione in NRAS interessa circa il 30% dei casi di melanoma ed è mutualmente esclusiva con la mutazione di BRAF. Poiché le mutazioni di BRAF e NRAS sono in genere mutualmente esclusive, in caso di assenza di mutazioni di BRAF è indicata la valutazione dello stato mutazionale di NRAS. Le mutazioni in cKIT si osservano in circa l’1-3% dei melanomi e considerandone la bassa frequenza è indicata una prima valutazione delle mutazioni di BRAF e NRAS. Con l’obiettivo di scegliere la migliore strategia terapeutica, verranno sottoposti ad analisi molecolare tutti i casi di melanoma a partire dallo stadio IIC. L’analisi molecolare va preferibilmente eseguita su tessuto di melanoma metastatico, e solo se questo non fosse disponibile su tessuto del melanoma primitivo.
Linfoadenectomia regionale (CLND)
Previa consultazione multidisciplinare, la CLND dovrebbe essere proposta e discussa esaurientemente con i pazienti con linfonodo sentinella istologicamente positivo per metastasi di melanoma. Sebbene la CLND possa fornire importanti informazioni sulla stadiazione e possa apportare dei benefici in termini di controllo locale della malattia, è opportuno informare il paziente che questa procedura potrebbe determinare alcune complicanze (soprattutto linfedema post-chirurgico) senza chiari benefici sulla sopravvivenza globale.
Metastasi linfonodali ≤ 1 mm o > 1 mm di diametro
Sarà proposta e documentata al paziente l’alternativa tra CLND e osservazione clinico-strumentale in presenza di tutti i seguenti criteri: spessore di Breslow ≤ 1,5 mm, diametro delle metastasi linfonodali ≤ 1 mm, sede subcapsulare delle metastasi, un solo linfonodo coinvolto, un solo bacino linfonodale coinvolto, paziente immunocompetente, assenza di altre caratteristiche clinico-patologiche ad alto rischio (i.e. microsatellitosi concomitante).
Sarà invece proposta al paziente la CLND in presenza di almeno uno dei seguenti criteri: spessore di Breslow > 1,5 mm, diametro delle metastasi linfonodali > 1 mm, diffusione/estensione extra capsulare delle metastasi, più di due linfonodi coinvolti, più di un bacino linfonodale coinvolto, paziente immunocompromesso, presenza di altre caratteristiche clinico-patologiche ad alto rischio (i.e. microsatellitosi concomitante).
Nei pazienti con metastasi del linfonodo sentinella ad alto rischio, la CLND dovrebbe essere proposta e discussa esaurientemente con il paziente previa consultazione multidisciplinare, dal momento che potrebbe determinare alcune complicanze (soprattutto linfedema post-chirurgico) senza chiari benefici sulla sopravvivenza globale. Tuttavia è necessario considerare che, soprattutto nel subset di pazienti ad alto rischio, l’intervento di CLND potrebbe consentire una migliore sopravvivenza libera da malattia (DFS) loco-regionale e permettere una stadiazione più accurata della malattia.
Metastasi ai linfonodi regionali clinicamente evidenti
La CLND è indicata in caso di metastasi ai linfonodi regionali clinicamente evidenti (esame obiettivo/ecografia/TAC, confermate da prelievo citologico o bioptico) se tecnicamente radicale. Nella diagnosi di un linfonodo sospetto l’esame citologico rappresenta la scelta da preferire rispetto alla biopsia chirurgica, per non alterare le strutture anatomiche in caso di dissezione linfonodale. L’estensione della dissezione è in rapporto alla regione anatomica da sottoporre a CLND; l’estensione della dissezione e il numero dei linfonodi esaminati definiscono l’adeguatezza della dissezione stessa e la conseguente valutazione patologica. In caso di macrometastasi è consigliabile la valutazione della presenza di mutazioni nei geni BRAF, NRAS e/o cKIT.
Trattamento chirurgico della malattia avanzata oligometastatica e delle recidive
Si raccomanda una valutazione multidisciplinare per pianificare la migliore strategia terapeutica in ogni singolo paziente. In caso di fallimento di un trattamento loco-regionale o qualora il trattamento chirurgico non trovasse indicazione, deve essere considerato un approccio terapeutico sistemico. Una corretta valutazione multidisciplinare, che tenga conto dei rischi e dei benefici per il singolo caso, potrà indicare la migliore strategia terapeutica associando i diversi trattamenti disponibili quali terapia sistemica, chirurgia, radioterapia, elettrochemioterapia, perfusione loco-regionale etc. Per i pazienti che si presentano con un primo episodio singolo di secondarismo in-transit o satellitosi, può esservi indicazione a eseguire una resezione chirurgica con margini istologicamente liberi, se tecnicamente radicale. Nei pazienti in cui viene asportato un secondarismo in-transit deve essere considerata l’opzione della tecnica del linfonodo sentinella, essendo elevata la probabilità di secondarismi linfonodali occulti, se la ripresa evolutiva avviene almeno dopo una DFS di 6-12 mesi dall’ultimo episodio di trattamento chirurgico per melanoma primario o secondario.
In caso d’impossibilità a eseguire una resezione chirurgica radicale o in caso di plurime riprese loco-regionali a livello di un arto, previa consultazione multidisciplinare, possono essere presi in considerazione: a) il trattamento perfusionale in ipertermia con melfalan in associazione con TNFα (se malattia molto estesa, > 5 mm o > 5 lesioni) come evidenziato in una revisione sistematica di trial randomizzati, b) l’elettrochemioterapia (terapia di scelta per secondarismi cutanei di sedi generalmente diverse dagli arti).
La chirurgia palliativa trova indicazione nelle lesioni emorragiche gastroenteriche o con rischio di perforazione o di occlusione o d’invaginazione, in considerazione anche delle nuove opportunità di trattamento sistemico che favoriscono l’integrazione fra le diverse strategie terapeutiche laddove i possibili benefici sopravanzino i rischi chirurgici.
Terapia adiuvante
In soggetti ad alto rischio resi liberi da malattia può essere valutata l’opportunità di un trattamento in adiuvante. Le opzioni possono essere comprese tra l’inserimento in studi clinici, il trattamento con interferone e/o l’osservazione clinico-strumentale. Dai risultati delle recenti evidenze scientifiche emergono dati estremamente interessanti circa l’uso dei farmaci anti BRAF/MEK e immunoterapici (anti-CTLA4 e anti-PD1) in un setting adiuvante.
Follow-up fino al 5° anno
Alla fine dell’iter di stadiazione e con un TNM definito, i pazienti dovranno essere reindirizzati all’UOF del Melanoma con la documentazione clinica necessaria (esami istologici, strumentali e di laboratorio, copia della cartella clinica) per programmare il follow-up e le eventuali opzioni terapeutiche. Nei 5 anni successivi alla diagnosi di melanoma (Tab. III), il paziente verrà regolarmente monitorato allo scopo di: offrire riferimento sanitario multidisciplinare nella gestione della malattia e supporto psicosociale, individuare recidive di melanoma o progressione di malattia più precocemente possibile, diagnosticare eventuali nuovi melanomi (~10% dei casi) e altri tumori cutanei più precocemente possibile, educare il paziente e i familiari alla prevenzione, alla fotoprotezione e all’auto-controllo periodico delle lesioni cutanee.
| Melanoma | Visita | Indagini strumentali |
|---|---|---|
| Tis (in situ) | (DERMATOLOGICA)
Ogni 6 mesi |
No |
| T1a N0 M0 (stadio IA) | (DERMATOLOGICA)
Ogni 6 mesi |
- Ecografia linfonodi loco-regionali e della cicatrice annuale
(Altri esami solo se clinicamente indicati) |
| T1b-3a N0 M0 (stadio IB-IIA) | (DERMATOLOGICA E ONCOLOGICA)
Ogni 3-6 mesi per i primi 2 anni, poi ogni 6 mesi fino al 5° anno |
- Ecografia linfonodi loco-regionali e della cicatrice semestrale
- Ecografia addome annuale (se non eseguita TAC) - TAC total body mdc ogni 24 mesi se Breslow > 1,5 mm (opzionale) (Altri esami se clinicamente indicati) |
| T3b-4a N0 M0 (stadio IIB) | (DERMATOLOGICA E ONCOLOGICA)
Ogni 3 mesi per i primi 2 anni, poi ogni 6 mesi fino al 5° anno |
- Ecografia linfonodi loco-regionali e della cicatrice semestrale
- Ecografia addome semestrale (se non eseguita TAC) - TAC total body mdc annuale (Altri esami se clinicamente indicati) |
| T4b N0 M0 (stadio IIC)
T1-4 N+ M0 (stadio III) |
(DERMATOLOGICA E ONCOLOGICA)
Ogni 3 mesi per i primi 2 anni, poi ogni 6 mesi fino al 5° anno |
- TAC total body mdc o PET/TAC ogni 6-12 mesi per i primi 3 anni, poi annuale
- Ecografia linfonodi loco-regionali e della cicatrice a ogni controllo - Ecografia addome a ogni controllo clinico (se non eseguita TAC) - LDH ed emocromo semestrale (Altri esami se clinicamente indicati) |
| T1-4 N+ M+ | (DERMATOLOGICA E ONCOLOGICA)
Ogni 3 mesi |
- TAC total body mdc o PET/TAC ogni 3-6 mesi
- LDH ed emocromo semestrale (Altri esami come RMN, scintigrafia ossea etc. se clinicamente indicati) |
L’indicazione a eseguire esami strumentali e la frequenza delle visite periodiche dipendono dai fattori di rischio del paziente, dallo stadio e dal rischio di ripresa di malattia. Le recidive di melanoma avvengono soprattutto nei primi 3-5 anni, anche se sono possibili recidive tardive.
LDH = lattico deidrogenasi; mdc = mezzo di contrasto; PET = tomografia a emissione di positroni; RMN = risonanza magnetica nucleare; TAC = tomografia assiale computerizzata.
Follow-up dal 5° al 10° anno
Dopo il 5° anno è indicata una visita annuale per il resto della vita (opzionale semestrale per pazienti con molti nevi, presenza di nevi atipici o pazienti in stadio ≥ IIB) per il rischio aumentato di sviluppare un secondo melanoma rispetto alla popolazione generale. Eventuali esami strumentali andrebbero richiesti in base allo stadio di malattia (Tab. IV), su indicazione clinica e a giudizio del medico per il rischio di ripresa tardiva di malattia.
| Melanoma | Visita | Indagini strumentali |
|---|---|---|
| Tis (in situ) | (DERMATOLOGICA)
Ogni 6-12 mesi |
No (esami solo se clinicamente indicati) |
| T1a-2a N0 M0 (stadio IA-IB) | (DERMATOLOGICA)
Ogni 6-12 mesi |
No (esami solo se clinicamente indicati) |
| T2b-3a N0 M0 (stadio IIA) | (DERMATOLOGICA)
Ogni 6-12 mesi |
No (esami solo se clinicamente indicati) |
| T3b-4a N0 M0 (stadio IIB) | (DERMATOLOGICA E ONCOLOGICA)
Ogni 6-12 mesi |
- Ecografia addome, linfonodi loco-regionali e della cicatrice ogni 24 mesi (opzionale)
(Altri esami se clinicamente indicati) |
| T4b N0 M0 (stadio IIC)
T1-4 N+ M0 (stadio III) |
(DERMATOLOGICA E ONCOLOGICA)
Ogni 6 mesi |
- Ecografia addome, linfonodi loco-regionali e della cicatrice ogni 12-24 mesi (opzionale)
(Altri esami se clinicamente indicati) |
| T1-4 N+ M+ | (DERMATOLOGICA E ONCOLOGICA)
Ogni 3-6 mesi |
- TAC total body mdc o PET/TAC ogni 3-6 mesi
(Altri esami se clinicamente indicati) |
Conclusioni
I pazienti affetti da melanoma potrebbero sperimentare un’assistenza sanitaria frammentata non in grado di garantire la continuità della cura. Spesso, la gestione dei pazienti con melanoma è programmata solo in funzione della successiva consultazione, anziché per tutta la sequenza di eventi previsti a partire dalla diagnosi, con una conseguente perdita di efficienza. La gestione integrata di una malattia diviene sempre più una strategia innovativa per fornire un’assistenza sanitaria di alta qualità (8).
Il progetto presentato evidenzia come il processo di mappatura costituisca uno strumento atto a identificare tutte le fasi di un percorso di diagnosi e cura del paziente con melanoma cutaneo e quindi finalizzato ad assicurare che tutte le attività/prestazioni siano eseguite/erogate in modo coerente e tempestivo. La definizione di tale percorso permette inoltre a tutte le figure del gruppo multidisciplinare di arricchire le proprie competenze professionali, facendo conseguentemente aumentare il know-how clinico e organizzativo della struttura.
Disclosures
Financial support: This research was made possible by an educational grant from Novartis.
Conflict of interest: None of the authors has financial interest related to this research to disclose.
Bibliografia
- 1. NCCN Clinical Practice Guidelines in Oncology: Cutaneous Melanoma. Version 1.2019. January 17, 2019.
- 2. Dummer R, Hauschild A, Lindenblatt N et al.; ESMO Guidelines Committee. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015 Sep;26 Suppl 5:v126-32.
- 3. Garbe C, Peris K, Hauschild A et al.; European Dermatology Forum (EDF); European Association of Dermato-Oncology (EADO); European Organisation for Research and Treatment of Cancer (EORTC). Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline – Update 2016. Eur J Cancer. 2016 Aug;63:201-17.
- 4. AIOM (Associazione Italiana di Oncologia Medica). Linee guida Melanoma. Edizione 2018.
- 5. http://e-p-a.org/sito-internet-e-p-a/percorsi-diagnostici-terapeutici-e-assistenziali-pdta/ Accesso Novembre 2017.
- 6. Gershenwald JE, Scolyer RA, Hess KR et al. Melanoma staging: evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017 Nov;67(6):472-92.
- 7. Wong SL, Faries MB, Kennedy EB et al. Sentinel lymph node biopsy and management of regional lymph nodes in melanoma: American Society of Clinical Oncology and Society of Surgical Oncology clinical practice guideline update. Ann Surg Oncol. 2018 Feb;25(2):356-77.
- 8. Campbell H, Hotchkiss R, Bradshaw N, Porteous M. Integrated care pathways. BMJ 1998 Jan 10;316(7125):133-7.