 |
AboutOpen | 2024; 11: 30-36 ISSN 2465-2628 | DOI: 10.33393/ao.2024.2695 REVIEW |
 |
Le patologie dell’interfaccia vitreoretinica
Vitreoretinal interface disorders
This article is designed to bridge the knowledge gap for Doctors, shedding light on retinal pathologies that have long dwelled in the shadows of ultra-specialization. It delves into the identification and management of atypical conditions affecting the vitreomacular interface, encompassing disorders like vitreomacular traction, epiretinal membrane, full thickness macular holes and lamellar holes. Optical coherence tomography emerges as a crucial diagnostic tool, significantly enhancing our capacity to recognize abnormalities at the vitreoretinal junction, offering clinical insights unattainable through conventional ophthalmic methods. While vitrectomy remains the predominant choice for treating these conditions, alternative approaches are being explored.
Keywords: Epiretinal membrane (ERM), Full thickness macular holes (FTMH), Lamellar holes, Optical coherence tomography (OCT), Vitreomacular traction (VMT), Vitreoretinal interface disorders
Received: October 23, 2023
Accepted: March 6, 2024
Published online: April 12, 2024
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Questo articolo mira a fornire una panoramica delle principali patologie vitreoretiniche, semplificandone i concetti per rendere più accessibile questa importante area della medicina.
L’introduzione della tomografia a coerenza ottica qualche decennio fa ha aperto un nuovo scenario nel percorso diagnostico-terapeutico delle patologie dell’interfaccia vitreoretinica. L’Optical Coherence Tomography (OCT), chiamata anche Tomografia a Coerenza Ottica, è una tecnica di imaging avanzata utilizzata in oftalmologia per ottenere immagini dettagliate delle strutture interne dell’occhio. L’OCT utilizza una sorgente di luce a banda larga, spesso nella gamma dell’infrarosso, che emette onde luminose coerenti, per generare immagini ad alta risoluzione delle strutture sotto la superficie di un tessuto. L’immagine risultante è chiamata “tomogramma” e rappresenta una sezione trasversale delle strutture del tessuto esaminato. L’OCT maculare in condizioni fisiologiche mostra una retina ben strutturata, uno spessore retinico uniforme, la presenza di una fovea ben definita e i diversi strati retinici con una propria caratteristica reflettività interna (Fig. 1).
È possibile identificare tra le alterazioni dell’interfaccia vitreomaculare la trazione vitreomaculare, la membrana epiretinica, fori maculari a tutto spessore e fori lamellari (1,2). Si stima che la prevalenza dei pazienti di età compresa tra i 40 e i 75 anni affetti da patologie dell’interfaccia vitreoretiniche sia del 15,9% (3). Tale prevalenza tende ad aumentare in modo direttamente proporzionale all’aumentare dell’età (4).
Anatomia oculare del segmento posteriore
Il corpo vitreo è contenuto nello spazio compreso anteriormente tra il cristallino e il corpo ciliare e la retina posteriormente. Questa struttura gelatinosa comprende circa l’80% del volume dell’occhio ed è composta da circa il 98% di acqua e il 2% di proteine e matrice extracellulare. Il collagene è la principale proteina strutturale, di cui il tipo II e il tipo IX sono le più rappresentate e costituiscono rispettivamente il 75% e il 15% del collagene vitreale. Costituenti in misura minore sono l’acido ialuronico, il condroitin solfato e la fibrillina.
L’interfaccia vitreoretinica è costituita dalla corteccia vitreale posteriore, dalla membrana limitante interna (ILM) e dalla matrice extracellulare interposta. L’ILM è composta principalmente da collagene di tipo IV. La corteccia vitreale posteriore e l’ILM retinica sono adese tra loro da un complesso macromolecolare composto da fibronectina, laminina e altri componenti extracellulari che formano una matrice.
Il normale processo di invecchiamento del gel vitreale provoca lo sviluppo del distacco posteriore di vitreo (DPV). La progressiva liquefazione, detta sinchisi, inizia già in età pediatrica e tende a creare nel tempo lacune al suo interno. La separazione vitreoretinica normalmente avviene in molti siti nella periferia retinica. Questo processo si svolge per anni prima che si concretizzi una separazione definitiva del corpo vitreo dalla macula e dal nervo ottico, che porta al definitivo DPV. Gli stadi iniziali sono tipicamente asintomatici. Il distacco di vitreo normalmente si traduce in una separazione completa e netta tra l’ILM della retina e il vitreo corticale. Una separazione anomala della corteccia vitrea dall’ILM comporta invece l’insorgenza delle patologie dell’interfaccia vitreoretinica. Questi quadri clinici sono favoriti dalla presenza di aree di adesione anormale della corteccia vitreale all’ILM (1,2).
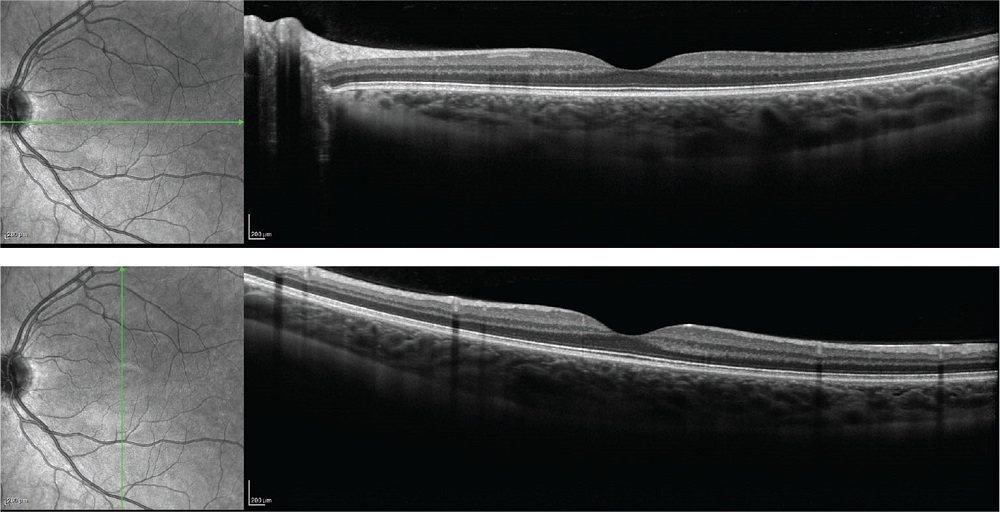
FIGURE 1 - Scansioni lineari di OCT maculare in condizioni fisiologiche, con profilo e architettura retinica nei limiti della norma.
Sindrome da trazione vitreomaculare (VMT)
Nella sindrome da trazione vitreomaculare (VMT) (Fig. 2), la corteccia vitreale risulta tenacemente adesa focalmente alla fovea ma già separata dalla regione perifoveale, con l’effetto risultante di una trazione anteroposteriore sulla fovea stessa e una consequenziale deformazione retinica (5).
I sintomi possono includere offuscamento della vista, disturbi visivi consistenti nella visione di oggetti deformati (metamorfopsie) o di dimensioni minori rispetto a quelle reali (micropsia) e fotopsia (sintomo visivo caratterizzato dalla percezione di “scintille” o “bagliori” di luce improvvisi e brevi, che possono apparire come lampi luminosi o scintillanti nell’ambito del campo visivo).
L’OCT è un esame diagnostico dirimente in quanto permette di individuare l’adesione del vitreo sulla fovea.
In conformità con la definizione dell’International Vitreomacular Traction Study Group, la VMT può essere classificata come “focale” o “ampia”, sulla base della larghezza orizzontale dell’adesione. Queste ampie aree di adesione con trazione possono essere associate a ispessimento della macula ed edema maculare cistoide (6).
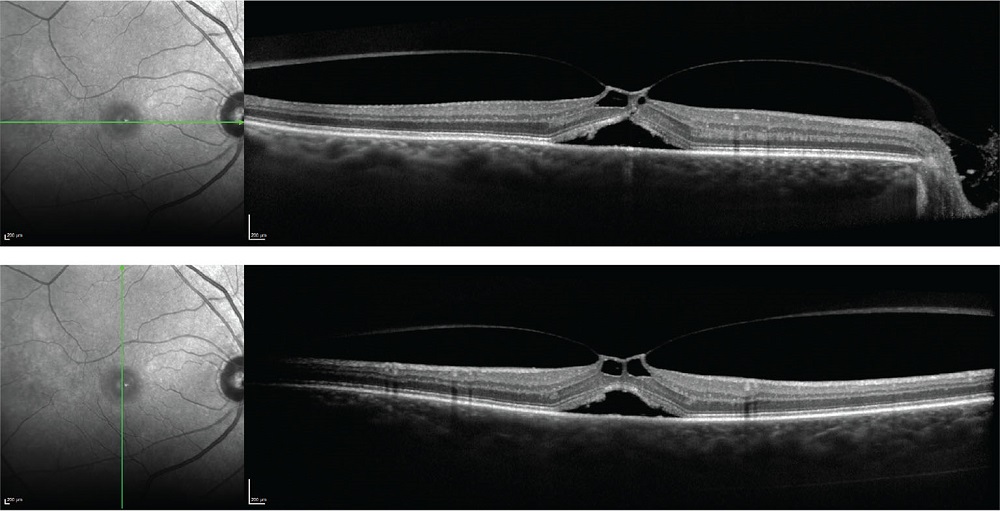
FIGURE 2 - Scansione OCT che mostra un’ampia trazione vitreomaculare con associato sollevamento del neuroepitelio retinico sottostante.
Il trattamento della VMT prevede l’osservazione nei casi asintomatici. In caso di disturbi visivi, tuttavia, esistono diverse opzioni terapeutiche che possono essere percorse (7).
La vitreolisi farmacologica che utilizza l’ocriplasmina intravitreale (Jetrea; ThromboGenics NV, Leuven, Belgio), una proteina ricombinante per la plasmina umana, è stata approvata per la prima volta per l’uso della VMT e del foro maculare a tutto spessore nel 2012. Il suo meccanismo d’azione è promuovere la rottura della fibronectina e della laminina e quindi rilasciare la corteccia vitrea dall’ILM all’interfaccia vitreomaculare. Dato il suo tasso di successo relativamente basso e i possibili eventi avversi, l’uso della vitreolisi enzimatica nella VMT si è dimostrato limitato (8).
La vitreolisi pneumatica è una tecnica che prevede l’iniezione di gas espansivo intravitreale con l’obiettivo di scindere l’adesione vitreale e di indurre un DPV completo. Sebbene la vitreolisi pneumatica rimanga un’opzione promettente, finora sono mancati dati di studi prospettici. Inoltre, va tenuta in considerazione la possibilità di una risoluzione tardiva della trazione vitreomaculare (9,10).
La vitrectomia pars plana (PPV) è attualmente il cardine del trattamento della VMT sintomatica. L’intervento chirurgico comporta la rimozione del corpo vitreo e la separazione meccanica del vitreo dal disco ottico inducendo un DPV e rilasciando la trazione del vitreo dal suo attacco alla fovea.
Una revisione sistematica del 2013 riporta come esista un miglioramento medio dell’acuità visiva di 10 lettere ETDRS in circa 1/3 degli occhi esaminati sottoposti a PPV (11).
Membrana epiretinica (ERM)
La membrana epiretinica (ERM) può essere definita come una proliferazione pre-retinica di cellule miofibroblastiche associate a una matrice extracellulare (12).
L’esatto meccanismo di sviluppo dell’ERM è poco conosciuto ma la teoria più accreditata propone che l’ERM si formi a partire da un DPV anomalo in cui gli ialociti residui sulla superficie retinica subiscono una crescita e una metaplasia per formare l’ERM (13,14). L’ILM retinica funge da impalcatura per queste proliferazioni e contrazioni cellulari. La trazione centripeta della membrana epiretinica provoca una deformazione del bordo della fovea e un ispessimento della retina. In alcuni casi, questa contrazione centripeta può portare alla formazione di un foro, chiamato “pseudoforo”, caratterizzato da una buona acuità visiva (15) (Fig. 3).
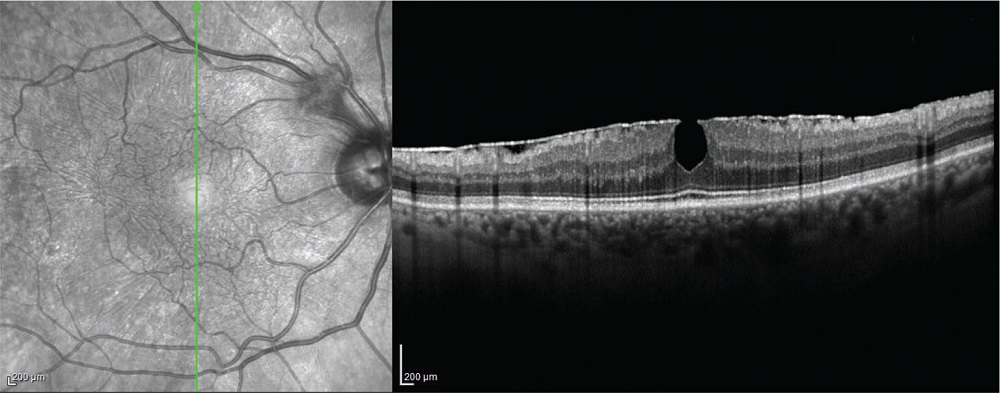
FIGURE 3 - Scansione OCT con membrana epiretinica antistante il piano retinico associata a uno pseudoforo maculare.
In molti casi, i pazienti con membrana epiretinica possono essere asintomatici. Lo sviluppo dei sintomi dipende dalla sede, dalla durata, dalla gravità e dal tipo di ERM. I sintomi più comuni includono riduzione dell’acuità visiva, visione offuscata, metamorfopsie, perdita della stereopsi e micropsia. Un sintomo recentemente riconosciuto è stato definito “interferenza binoculare” e si verifica quando il soggetto colpito ha bisogno di chiudere un occhio per migliorare la sua visione complessiva in assenza di diplopia o di strabismo. Questi pazienti hanno una qualità di vita significativamente ridotta. La diagnosi e la stadiazione della membrana epiretinica si eseguono con l’esame del fondo oculare e l’OCT. In generale, l’ERM può essere classificata come primaria (idiopatica) o secondaria (p. es., secondaria a uveite, occlusione venosa retinica o diabete) (16).
La diagnosi avviene durante l’esame del fondo oculare e, più recentemente, anche con l’uso dell’OCT. Diversi autori hanno proposto nuovi sistemi di stadiazione per l’ERM idiopatica. In uno studio sono stati definiti quattro stadi patologici sulla base della deformazione anatomica che provoca la membrana epiretinica (Fig. 4) (16,17).
La maggior parte delle ERM può essere monitorata nel tempo, in particolare se sono asintomatiche e se presentano una minima distorsione o un minimo ispessimento della retina (18).
La vitrectomia associata al peeling dell’ERM è il trattamento gold standard per questa patologia. L’intervento chirurgico è indicato quando si verifica una riduzione dell’acuità visiva associata a sintomi come metamorfopsie o diplopia monoculare (19,20).
Attualmente non esistono Linee Guida definite riguardo al grado di compromissione dell’acuità visiva necessario per determinare l’indicazione all’intervento chirurgico.
Fori maculari a tutto spessore (FTMH)
Il foro maculare a tutto spessore (Fig. 5) è un difetto foveale che determina l’interruzione degli strati retinici neurali, dalla membrana limitante interna fino all’epitelio pigmentato retinico.
Anche in questo caso la genesi è essenzialmente legata a un DPV anomalo. La trazione progressiva a livello della fovea determina la completa interruzione di tutti gli strati neurali a causa della deiscenza delle pseudocisti foveali o della rottura della retina esterna trazionata (21).
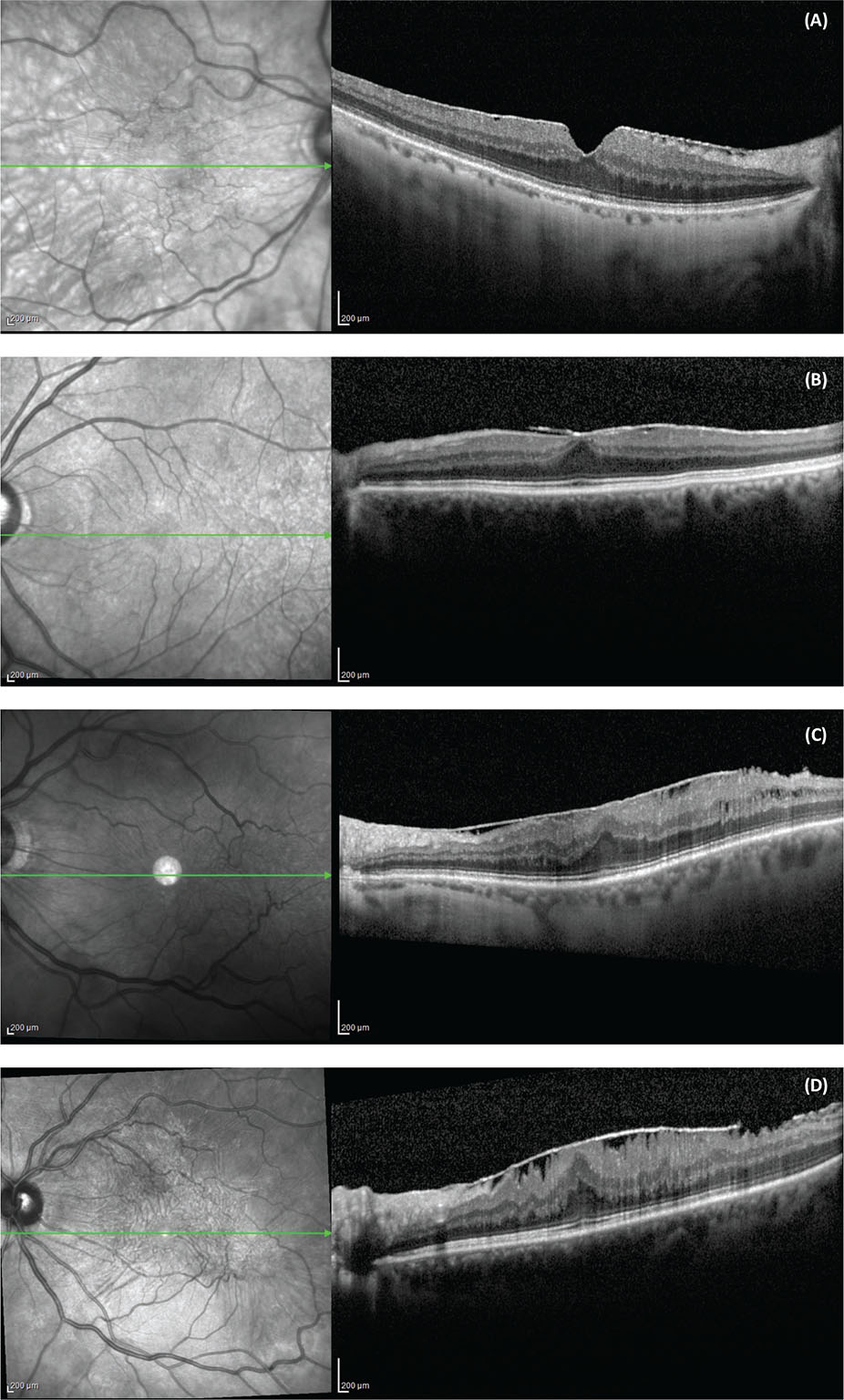
FIGURE 4 - Membrana epiretinica e classificazione. (A) Stadio 1, ERM con profilo foveale conservato; (B) Stadio 2, ERM con perdita della fisiologica depressione foveale; (C) Stadio 3, ERM associata alla comparsa di uno strato retinico foveale ectopico interno; (D) stadio 4, ERM associata a un sovvertimento degli strati retinici interni.
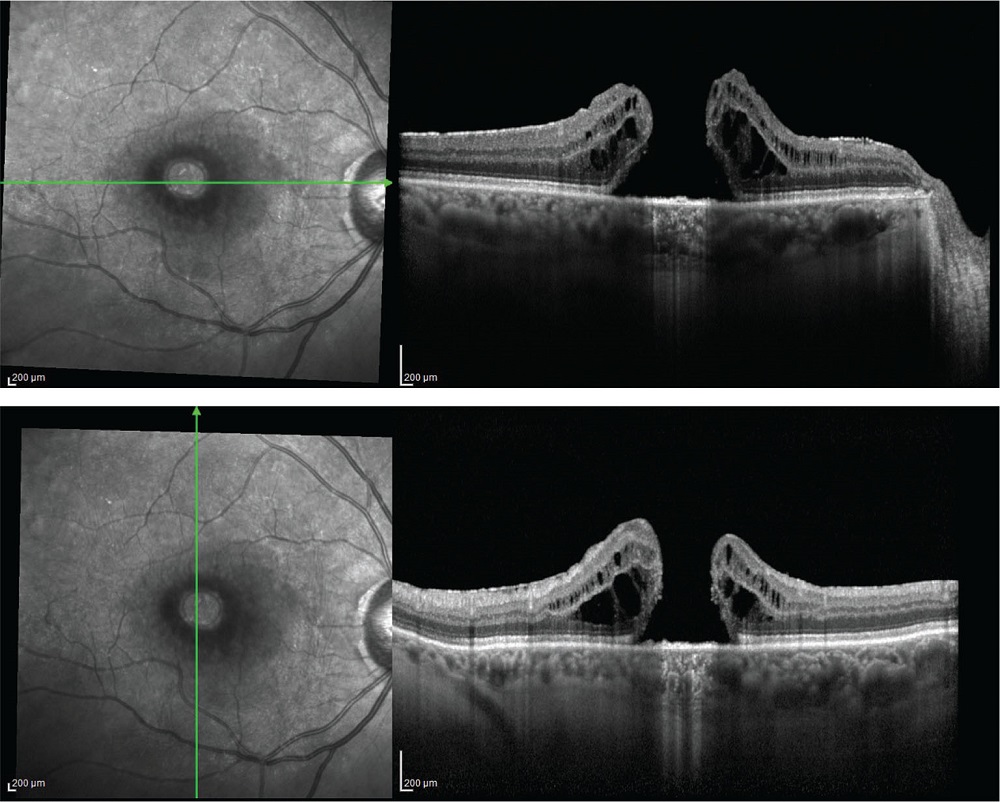
FIGURE 5 - Scansione OCT in foro maculare a tutto spessore.
Sebbene la forza trazionale sulla retina sia solitamente in direzione anteroposteriore, una volta che si è formato un foro maculare a tutto spessore anche la componente tangenziale dovuta alla contrazione dell’ILM residua sul bordo del foro può causare l’allargamento del foro (22).
Il quadro clinico è caratterizzato da un deficit visivo centrale, detto scotoma. La diagnosi e la stadiazione vengono eseguite con l’esame del fondo oculare e l’esame OCT. La maggioranza dei FTMH è di natura idiopatica (DPV anomalo correlato all’età), tuttavia cause secondarie di FTMH possono includere un trauma contusivo, la miopia elevata, la pregressa chirurgia vitreoretinica o l’iniezione intravitreale (23). La stadiazione del FTMH si basa su due caratteristiche principali: la dimensione del foro e la presenza o meno di VMT. Il FTMH è classificato come piccolo (< 200 μm), medio (200-400 μm) e grande (> 400 μm). Questi valori di cut-off sono stati scelti in quanto forniscono informazioni prognostiche e si correlano bene con i risultati del trattamento (6). Anche la presenza o l’assenza di VMT è importante, poiché la trazione vitreomaculare è solitamente necessaria per il trattamento efficace del foro maculare a tutto spessore quando si utilizza la vitreolisi farmacologica (8).
L’osservazione non è solitamente raccomandata per i pazienti con FTMH, tranne che in rare circostanze in cui il foro è molto piccolo e la VMT è ancora presente con vitreo attaccato solo ai margini del foro. In questa situazione, può verificarsi una chiusura spontanea del foro secondaria allo sviluppo di un DPV completo (24). La vitrectomia per il trattamento del FTMH è il trattamento gold standard. La tecnica prevede la rimozione del corpo vitreo e il distacco della ialoide posteriore dalla superficie retinica, seguiti dal peeling dell’ILM e, infine, dal tamponamento con gas (25-27). Il tamponamento con gas ha lo scopo di facilitare la chiusura del foro maculare e di stabilizzare la retina.
Se il FTMH risulta molto grande, l’acuità visiva può non migliorare nonostante il successo del trattamento chirurgico nel ripristinare la continuità anatomica.
Recentemente, in caso di recidiva di foro maculare, sono state introdotte nuove tecniche, tra cui l’utilizzo di una patch di membrana amniotica e il trapianto retinico autologo a tutto spessore (28-30). Nuove analisi hanno evidenziato dei fattori predittivi per il raggiungimento di migliori risultati visivi dopo la chirurgia. Questi comprendono le dimensioni iniziali del foro, l’integrità della linea della zona ellissoidale, corrispondente allo strato esterno dei fotorecettori retinici, e la ricostituzione della membrana limitante esterna nel post-operatorio (31,32).
Fori lamellari
Il foro lamellare (Fig. 6) è un difetto foveale a spessore parziale con un contorno foveale irregolare e può essere o meno associato a una perdita di tessuto.
I fori lamellari sono accompagnati da disturbi della visione centrale associati a metamorfopsie. La patogenesi è legata alla trazione centrifuga della membrana epiretinica (22).
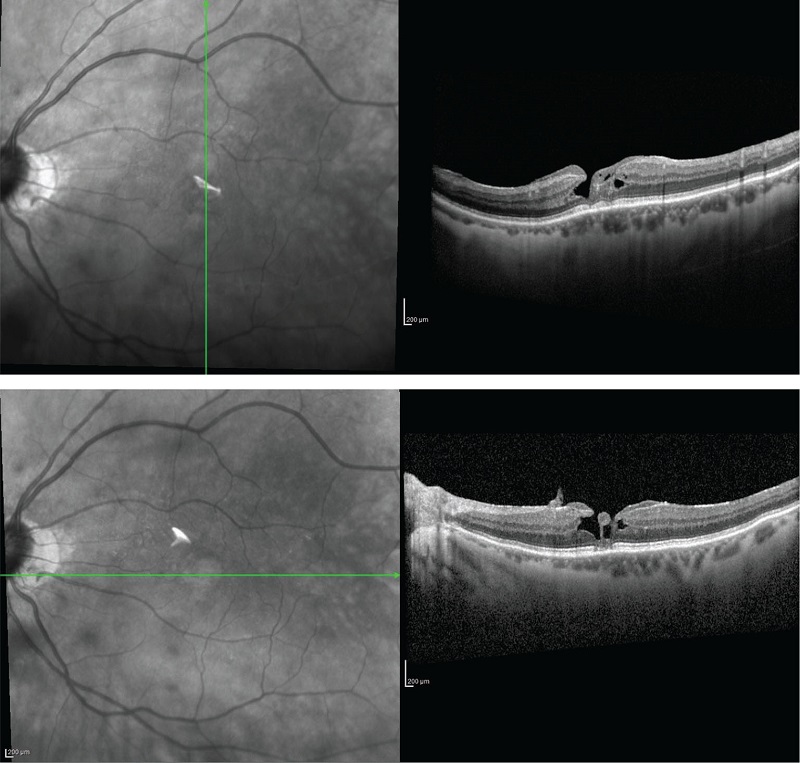
FIGURE 6 - OCT in corso di foro lamellare.
La gestione dei fori lamellari è tendenzialmente più conservativa che per i fori maculari a tutto spessore. In generale, la maggior parte dei pazienti può essere osservata poiché l’acuità visiva di solito rimane stabile nel tempo con i cambiamenti anatomici che progrediscono lentamente. Per i pazienti sintomatici, la vitrectomia con peeling dell’ILM è un’opzione terapeutica. Tuttavia, il recupero visivo è generalmente modesto (33).
Conclusioni
In conclusione, le patologie dell’interfaccia vitreoretinica possono avere un impatto significativo sulla vista e sulla vita dei pazienti. La diagnosi precoce e la gestione tempestiva di queste patologie sono cruciali per prevenire danni permanenti alla retina e per migliorare l’outcome visivo. Con il progresso nelle tecniche di diagnosi e trattamento, la prognosi per i pazienti affetti da patologie dell’interfaccia vitreoretinica ha subito un costante e continuo miglioramento. L’OCT, inoltre, ha consentito di identificare, classificare e descrivere al meglio le diverse patologie dell’interfaccia vitreoretinica.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Ashleigh L. Levison, Peter K. Kaiser, Vitreomacular interface diseases: Diagnosis and management, Taiwan Journal of Ophthalmology, 2014;4(2): 63-68 CrossRef
- 2. Okada M, Chiu D, Yeoh J. Vitreomacular disorders: a review of the classification, pathogenesis and treatment paradigms including new surgical techniques. Clin Exp Optom. 2021;104(6):672-683. CrossRef PubMed
- 3. Liesenborghs I, De Clerck EEB, Berendschot TTJM, et al. Prevalence of optical coherence tomography detected vitreomacular interface disorders: the Maastricht Study. Acta Ophthalmol. 2018;96(7):729-736. CrossRef PubMed
- 4. Steel DHW, Lotery AJ. Idiopathic vitreomacular traction and macular hole: a comprehensive review of pathophysiology, diagnosis, and treatment. Eye (Lond). 2013;27(Suppl 1)(suppl 1):S1-S21. CrossRef PubMed
- 5. Meuer SM, Myers CE, Klein BE, et al. The epidemiology of vitreoretinal interface abnormalities as detected by spectral-domain optical coherence tomography: the beaver dam eye study. Ophthalmology. 2015;122(4):787-795. CrossRef PubMed
- 6. Duker JS, Kaiser PK, Binder S, et al. The International Vitreomacular Traction Study Group classification of vitreomacular adhesion, traction, and macular hole. Ophthalmology. 2013;120(12):2611-2619. CrossRef PubMed
- 7. Errera M-H, Liyanage SE, Petrou P, et al. A study of the natural history of vitreomacular traction syndrome by OCT. Ophthalmology. 2018;125(5):701-707. CrossRef PubMed
- 8. Stalmans P, Benz MS, Gandorfer A, et al; MIVI-TRUST Study Group. Enzymatic vitreolysis with ocriplasmin for vitreomacular traction and macular holes. N Engl J Med. 2012;367(7):606-615. CrossRef PubMed
- 9. Chan CK, Crosson JN, Mein CE, Daher N. Pneumatic vitreolysis for relief of vitreomacular traction. Retina. 2017;37(10):1820-1831. CrossRef PubMed
- 10. Chan CK, Mein CE, Crosson JN. Pneumatic vitreolysis for management of symptomatic focal vitreomacular traction. J Ophthalmic Vis Res. 2017;12(4):419-423. CrossRef PubMed
- 11. Jackson TL, Nicod E, Angelis A, et al. Pars plana vitrectomy for vitreomacular traction syndrome: a systematic review and metaanalysis of safety and efficacy. Retina. 2013;33(10):2012-2017. CrossRef PubMed
- 12. Mirza RG, Johnson MW, Jampol LM. Optical coherence tomography use in evaluation of the vitreoretinal interface: a review. Surv Ophthalmol. 2007;52(4):397-421. CrossRef PubMed
- 13. Iuliano L, Fogliato G, Gorgoni F, Corbelli E, Bandello F, Codenotti M. Idiopathic epiretinal membrane surgery: safety, efficacy and patient related outcomes. Clin Ophthalmol. 2019;13:1253-1265. CrossRef PubMed
- 14. Fung AT, Galvin J, Tran T. Epiretinal membrane: A review. Clin Exp Ophthalmol. 2021;49(3):289-308. CrossRef PubMed
- 15. Zhao F, Gandorfer A, Haritoglou C, et al. Epiretinal cell proliferation in macular pucker and vitreomacular traction syndrome: analysis of flat-mounted internal limiting membrane specimens. Retina. 2013;33(1):77-88. CrossRef PubMed
- 16. Stevenson W, Prospero Ponce CM, Agarwal DR, Gelman R, Christoforidis JB. Epiretinal membrane: optical coherence tomography-based diagnosis and classification. Clin Ophthalmol. 2016;10:527-534. CrossRef PubMed
- 17. Govetto A, Lalane RA III, Sarraf D, Figueroa MS, Hubschman JP. Insights into epiretinal membranes: presence of ectopic inner foveal layers and a new optical coherence tomography staging scheme. Am J Ophthalmol. 2017;175:99-113. CrossRef PubMed
- 18. Casuso LA, Scott IU, Flynn HWJ Jr, et al. Long-term follow-up of unoperated macular holes. Ophthalmology. 2001;108(6):1150-1155. CrossRef PubMed
- 19. Elhusseiny AM, Flynn HWJ Jr, Smiddy WE. Long-term outcomes after idiopathic epiretinal membrane surgery. Clin Ophthalmol. 2020;14:995-1002. CrossRef PubMed
- 20. Wong JG, Sachdev N, Beaumont PE, Chang AA. Visual outcomes following vitrectomy and peeling of epiretinal membrane. Clin Exp Ophthalmol. 2005;33(4):373-378. CrossRef PubMed
- 21. Chew EY, Sperduto RD, Hiller R, et al. Clinical course of macular holes: the Eye Disease Case-Control Study. Arch Ophthalmol. 1999;117(2):242-246. CrossRef PubMed
- 22. Gaudric A, Aloulou Y, Tadayoni R, Massin P. Macular pseudoholes with lamellar cleavage of their edge remain pseudoholes. Am J Ophthalmol. 2013 Apr;155(4):733-42, 742.e1-4. CrossRef PubMed
- 23. Shukla D. Secondary macular holes: when to jump in and when to stay out. Expert Rev Ophthalmol. 2013;8(5):437-446. CrossRef
- 24. Liang X, Liu W. Characteristics and risk factors for spontaneous closure of idiopathic full-thickness macular hole. J Ophthalmol. 2019;2019:4793764. CrossRef PubMed
- 25. Morescalchi F, Costagliola C, Gambicorti E, Duse S, Romano MR, Semeraro F. Controversies over the role of internal limiting membrane peeling during vitrectomy in macular hole surgery. Surv Ophthalmol. 2017;62(1):58-69. CrossRef PubMed
- 26. Tognetto D, Grandin R, Sanguinetti G, et al; Macular Hole Surgery Study Group. Internal limiting membrane removal during macular hole surgery: results of a multicenter retrospective study. Ophthalmology. 2006;113(8):1401-1410. CrossRef PubMed
- 27. Spiteri Cornish K, Lois N, Scott N, et al. Vitrectomy with internal limiting membrane (ILM) peeling versus vitrectomy with no peeling for idiopathic full-thickness macular hole (FTMH). Cochrane Database Syst Rev. 2013;(6):CD009306. CrossRef PubMed
- 28. Michalewska Z, Michalewski J, Adelman RA, Nawrocki J. Inverted internal limiting membrane flap technique for large macular holes. Ophthalmology. 2010;117(10):2018-2025. CrossRef PubMed
- 29. Morizane Y, Shiraga F, Kimura S, et al. Autologous transplantation of the internal limiting membrane for refractory macular holes. Am J Ophthalmol. 2014;157(4):861-869.e1. CrossRef PubMed
- 30. Parravano M, Giansanti F, Eandi CM, Yap YC, Rizzo S, Virgili G. Vitrectomy for idiopathic macular hole. Cochrane Database Syst Rev. 2015;2015(5):CD009080. PubMed
- 31. Ruiz-Moreno JM, Staicu C, Piñero DP, Montero J, Lugo F, Amat P. Optical coherence tomography predictive factors for macular hole surgery outcome. Br J Ophthalmol. 2008;92(5):640-644. CrossRef PubMed
- 32. Wakabayashi T, Fujiwara M, Sakaguchi H, Kusaka S, Oshima Y. Foveal microstructure and visual acuity in surgically closed macular holes: spectral-domain optical coherence tomographic analysis. Ophthalmology. 2010;117(9):1815-1824. CrossRef PubMed
- 33. Bottoni F, Deiro AP, Giani A, Orini C, Cigada M, Staurenghi G. The natural history of lamellar macular holes: a spectral domain optical coherence tomography study. Graefes Arch Clin Exp Ophthalmol. 2013;251(2):467-475. CrossRef PubMed