 |
AboutOpen | 2024; 10: 10-17 ISSN 2465-2628 | DOI: 10.33393/ao.2024.2634 POINT OF VIEW |
 |
Follow-up del carcinoma mammario: perché è necessario avviare un Consensus nel 2024?
Follow-up of breast cancer: why is it necessary to start a Consensus in 2024?
In Italy, breast cancer is the most frequently diagnosed cancer in women, with 55,900 new cases in 2023 (over 90% in the early stages). Due to the screening, early diagnosis and adjuvant treatment, these patients have a 5-years survival rate of 87% after the diagnosis.
There are 834,154 women in Italy with a previous diagnosis of breast cancer: most of these women require a follow-up.
The AIOM, ESMO and ASCO Guidelines recommend for early breast cancer (EBC) a clinical follow-up with only physical examination (and eliciting of symptoms) and an annual X-ray mammography, on the basis of the results of two randomized trials published in 1994 that showed no benefit in overall survival with intensive follow-up.
However, an Italian survey reported the application by 80% of oncologists of an intensive follow-up based on the individual patient’s risk of recurrence. In fact, the oncologists believe that an early diagnosis of locoregional or distant recurrence may allow an early start of very effective therapies.
In this lack of up-to-date scientific data, many questions about follow-up remain unanswered and the few ongoing studies will provide results in several years.
Non-compliance with guideline recommendations leads to increased costs for the healthcare system. Furthermore, management varies widely from centre to centre with regard to guideline recommendations, resulting in inequalities between patients. For these reasons, the follow-up of breast cancer should be reconsidered.
In the absence of recent scientific evidence, a multidisciplinary group of breast cancer experts has initiated a Consensus on the follow-up of EBC according to the mini-Delphi methodology. The project will be completed by the end of 2024.
Keywords: Consensus, Early breast cancer, Follow-up, Mini-Delphi methodology
Received: July 10, 2023
Accepted: January 16, 2024
Published online: February 23, 2024
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2024 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
In Italia, il carcinoma mammario rappresenta la neoplasia più frequentemente diagnosticata (55.900 nuovi casi nell’anno 2020) (1) e la prima causa di morte per tumore nel sesso femminile (12.995 decessi nel 2017) (2).
Tuttavia, grazie allo screening mammografico, alla diagnosi precoce e alla larga applicazione di efficaci trattamenti adiuvanti, la sopravvivenza a 5 anni dalla diagnosi è pari all’87% (2).
Incidenza e sopravvivenza così alte giustificano l’elevata prevalenza, con 834.154 donne vive in Italia nel 2020 dopo una diagnosi di carcinoma mammario (2).
Di queste, oltre 241.000 sono donne che hanno ricevuto una diagnosi da meno di 5 anni e circa 192.000 sono donne con una diagnosi ricevuta da 5-10 anni (Tab. 1).
| Tempo trascorso dalla diagnosi | Numero donne vive nel 2020 | Proporzione |
|---|---|---|
| ≤2 anni | 116.782 | 14% |
| 2 - ≤5anni | 125.123 | 15% |
| 5 - ≤10 anni | 191.855 | 23% |
| 10 - ≤15 anni | 150.148 | 18% |
| 15 - ≤20 anni | 91.757 | 11% |
| >20 anni | 141.806 | 17% |
La maggior parte viene seguita in centri oncologici con un programma di follow-up i cui obiettivi sono:
- diagnosi precoce di ripresa locoregionale e di secondo tumore mammario (omo-/controlaterale);
- sorveglianza delle tossicità a medio/lungo termine dei trattamenti adiuvanti;
- correzione di stili di vita inappropriati;
- motivare le pazienti a seguire la terapia ormonale adiuvante (migliorare l’aderenza);
- facilitare i percorsi di riabilitazione (fisica e psicologica) e di re-inserimento nella vita sociale e lavorativa.
In questo articolo vengono illustrate le evidenze scientifiche oggi disponibili relative al follow-up del carcinoma mammario in fase precoce e le Linee Guida disponibili, italiane e internazionali, con particolare attenzione alla sorveglianza oncologica.
Vengono inoltre illustrate le questioni ancora aperte e sono indicati i motivi per cui si è ritenuto opportuno iniziare un percorso di Consensus del follow-up del carcinoma mammario in fase precoce.
Evidenze scientifiche e Linee Guida italiane e internazionali
L’obiettivo principale del follow-up è l’aumento della sopravvivenza globale, grazie alla diagnosi precoce di ripresa della malattia.
Il rischio annuale di ripresa della malattia ha un picco nel secondo anno dopo la diagnosi ma rimane intorno al 2%-5% dal 5° al 20° anno (3). Le pazienti con linfonodi ascellari positivi tendono ad avere un rischio annuale di ripresa superiore rispetto alle pazienti con neoplasie con linfonodi negativi e, nei primi anni, il rischio di ripresa è più elevato nelle pazienti operate per carcinomi con recettori estrogenici-negativi (4).
Le Linee Guida AIOM (5), ESMO (6) e ASCO (7,8), in ambito di sorveglianza oncologica, danno indicazioni all’esecuzione di un esame obiettivo e di una Rx-mammografia, in assenza di sintomi, indipendentemente dal rischio di ripresa della singola paziente.
In particolare, le Linee Guida AIOM 2023 (5) danno indicazione a un esame obiettivo (ogni 3-6 mesi nei primi 3 anni, ogni 6-12 mesi nei successivi 2 anni e quindi annualmente) e a una Rx-mammografia annuale (Tab. 2) come di seguito riportato, e sconsigliano, in assenza di sintomi/segni di ripresa della malattia, l’esecuzione di altre indagini laboratoristiche e strumentali.
- L’esame obiettivo può essere eseguito ogni 3-6 mesi nei primi 3 anni, ogni 6-12 mesi nei successivi due anni e quindi annualmente. Raccomandazione condizionata a favore, con una qualità molto bassa delle evidenze scientifiche (5).
Questa raccomandazione si basa sui risultati degli studi clinici disponibili (7,9-14), dai quali emerge come l’esame obiettivo, combinato con un’adeguata anamnesi, sia uno strumento decisivo per rilevare il 15-49% delle recidive locoregionali e/o seconde neoplasie in pazienti asintomatiche, in assenza tuttavia di dati relativi all’impatto dell’esame obiettivo sulla sopravvivenza per l’intera popolazione delle donne operate per carcinoma mammario (7,9-14).
Nonostante ciò, si reputa che la diagnosi precoce di una recidiva locoregionale possa avere un impatto sulla sopravvivenza di queste pazienti. Infatti, circa il 20% delle pazienti con ripresa locale e circa il 40% delle pazienti con ripresa regionale svilupperà negli anni successivi metastasi a distanza e quindi una diagnosi tempestiva di recidiva locale e/o regionale e un adeguato trattamento locale associato a una terapia sistemica adiuvante potrebbero contribuire a migliorare la sopravvivenza di una quota di queste pazienti.
| Raccomandazione | FORZA della Raccomandazione | Qualità globale delle evidenze | ||
|---|---|---|---|---|
| Sorveglianza oncologica | ||||
| Esame obiettivo | Ogni 3-6 mesi × 3 anni→
Ogni 6-12 mesi × 2 anni→ POI Ogni anno |
Condizionata a favore | Diagnosi recidive locoregionali e/o seconde neoplasie mammarie | Molto bassa |
| Rx-mammografia | Ogni 12 mesi | Condizionata a favore | Diagnosi recidiva locale/secondo tumore mammario omo-/controlaterale | Bassa |
| Follow-up intensivo | Esami di imaging e laboratorio | Condizionata a sfavore | Diagnosi (precoce) metastasi a distanza | Alta |
Gli intervalli consigliati per l’esecuzione dell’esame obiettivo sono arbitrari, basati su una prassi consolidata e non su evidenze scientifiche. Nessuno studio ha infatti realmente confrontato, per esempio, il beneficio di visite cliniche meno frequenti in pazienti con malattia a basso rischio o di visite più frequenti in pazienti con malattia ad alto rischio (9,10).
- Una Rx-mammografia per la ghiandola mammaria residua e/o controlaterale dovrebbe essere eseguita con regolarità e con cadenza annuale. Raccomandazione forte a favore, con una qualità delle evidenze bassa (5).
Questa seconda raccomandazione si basa su studi osservazionali, dai quali emerge come la sorveglianza mammografica si associ a una riduzione della mortalità tra le donne con pregressa neoplasia mammaria, indipendentemente dall’età (9,14-19).
Inoltre, emerge che la sorveglianza mammografica può contribuire alla diagnosi di recidiva nella mammella residua e di secondi tumori mammari omo- e controlaterali.
Mancano invece solide evidenze scientifiche circa l’impatto della Rx-mammografia annuale in termini di sopravvivenza nell’intera popolazione di pazienti operate per carcinoma mammario (20-26) e circa i tempi ottimali della sorveglianza mammografica nelle donne operate (17,28), anche se di norma è suggerita una valutazione annuale.
Non esiste inoltre una soglia d’età delle pazienti tale da suggerire l’eventuale sospensione della Rx-mammografia, che viene quindi raccomandata per tutte le pazienti sopravviventi con una ragionevole aspettativa di vita.
- In assenza di sospetti clinici individuali o di programmi personalizzati, il follow-up intensivo non dovrebbe essere raccomandato. In particolare, indagini strumentali quali Rx-torace, ecografia addominale, TC total body, PET-TC-FDG, CEA e CA-15-3 non dovrebbero essere eseguite.
Raccomandazione condizionata a sfavore, con una qualità delle evidenze alta (5).
Le Linee Guida AIOM 2023 (5) sconsigliano l’esecuzione di un follow-up intensivo in base ai risultati di due studi randomizzati condotti nelle seconda metà degli Anni Ottanta e pubblicati nel 1994, che hanno confrontato un follow-up clinico rispetto a un follow-up intensivo (28,29).
Nel primo studio (28) sono state randomizzate 1.320 pazienti con carcinoma mammario di stadio I-II-III dal 1986 al 1988 e nel secondo (29) 1.243 dal 1985 al 1986.
Entrambi i trial confrontavano un follow-up clinico con esame obiettivo (ogni 3 mesi per i primi due anni e poi ogni 6 mesi nei successivi tre anni) e Rx-mammografia (annuale) e un follow-up intensivo, che prevedeva, oltre a un esame obiettivo e a una Rx-mammografia, l’esecuzione di Rx-torace (ogni 6 mesi), scintigrafia ossea e, nello studio GIVIO, anche ecografia epatica (annuale) ed esami ematobiochimici (ogni 3 mesi per i primi due anni e poi ogni 6 mesi nei successivi tre anni) (Fig. 1). La scintigrafia ossea veniva eseguita per 5 anni ma con una frequenza differente: ogni 12 mesi nello studio GIVIO e ogni 6 mesi nell’altro.
Nello studio GIVIO (a un follow-up mediano di 71 mesi) non è stata osservata alcuna differenza nella sopravvivenza globale tra follow-up clinico e intensivo (p = 0,43), con 122 morti (18%) nel gruppo di controllo e 132 morti (20%) nel gruppo intensivo. Non è stata riportata alcuna differenza nel Time to Distant metastasis (127 eventi di malattia nelle 665 pazienti del gruppo di controllo e 127 eventi nelle 655 pazienti del gruppo di follow-up intensivo; p = 0,63) (28).
Anche nel secondo studio (29) non è stata riportata alcuna differenza in sopravvivenza globale né in mortalità globale a 5 anni (19,5% nel follow-up clinico e 18,6% nel follow-up intensivo). È invece risultata statisticamente significativa la differenza in Relapse-free survival a 5 anni (che ha considerato tuttavia in questo trial solo gli eventi metastasi a distanza o morte), con una più precoce diagnosi di ripresa nelle pazienti assegnate al follow-up intensivo. In questo gruppo di pazienti assegnate al follow-up intensivo è stato riportato un aumentato tasso di diagnosi di metastasi intratoraciche e ossee (112 casi vs 71), verosimile conseguenza dell’esecuzione semestrale non solo della radiografia del torace ma anche della scintigrafia ossea (che era annuale nello studio GIVIO). Non sono state riportate differenze in riprese locali e locoregionali.
Per la gestione delle tossicità delle terapie antitumorali e per gli stili di vita, le Linee Guida AIOM 2023 (5) riportano le raccomandazioni elencate nella Tabella 3).

FIGURE 1 - Follow-up nel carcinoma mammario in fase precoce. Disegno dei due studi randomizzati di fase che hanno valutato un follow-up clinico rispetto a un follow-up intensivo (28,29).
| Raccomandazione | FORZA della Raccomandazione | Qualità globale delle evidenze | ||
|---|---|---|---|---|
| Gestione tossicità | ||||
| Se terapia ormonale adiuvante con antiaromatasici | MOC/DEXA + test ematologici | Forte a favore | Diagnosi osteoporosi | Alta |
| Se terapia ormonale adiuvante con antiestrogeni | MOC/DEXA + test ematologici prima dell’inizio della terapia con bifosfonati/denosumab da Nota AIFA 79 | Forte a favore | Riduzione rischio fratture ossee (prevenzione primaria) | Alta |
| Se terapia ormonale adiuvante con tamoxifene | Visita ginecologica + eco TV basale → visita ginecologica annuale con eco TV in casi selezionati | Forte a favore | Diagnosi polipi endometriali, ca endometrio | Alta |
| Se terapia adiuvante con trastuzumab (± pertuzumab) o TDM-1 | Ecocardio basale → ogni 3 mesi durante terapia → a 18 e a 24 mesi dall’inizio | Condizionata a favore | Diagnosi ↓ LVEF | Bassa |
| Stili di vita | Modifica della dieta alimentare se sovrappeso/obesità
Eseguire attività fisica |
Condizionata a favore | Migliorare la qualità di vita e ↓ rischio recidive | Bassa |
| ASCO 2013 e 2016 | ESMO 2019 | AIOM 2021 | |
|---|---|---|---|
| Anamnesi ed esame obiettivo | Ogni 3-6 mesi (anni 1-3)
Ogni 6 mesi (anni 4-5) Annuale (dal 5° anno in poi) |
Ogni 3-6 mesi (anni 1-3)
Ogni 6 mesi (anni 4-5) Annuale (dal 5° anno in poi) |
Ogni 3-6 mesi (anni 1-3)
Ogni 6 mesi (anni 4-5) Annuale (dal 5° anno in poi) |
| Autoesame
Rx-mammografia Eco/RM mammaria |
No
Annuale Solo in pazienti selezionate |
No
Annuale Solo < 35 anni d’età, mammella densa, familiarità, predisposizione genetica |
No
Annuale In pazienti selezionate, familiarità, predisposizione genetica |
| Rx torace
TC Esame ginecologico |
No
No No |
No
No Annuale se TAM |
No
No Annuale se TAM |
| Esami ematobiochimici
Marker tumorali MOC (DEXA) |
No
No Limitata a Inibitori aromatasi (TAM + OFS) |
Limitata alle pazienti in ET
No Limitata a inibitori aromatasi (oppure OFS) |
No
No Limitata a Inibitori aromatasi |
| Eco addome
Scintigrafia ossea PET-TC/WB MRI |
No
No No |
No
No No |
No
No No |
TAM = Tamoxifene; ET = Endocrino-Terapia; IA = Inibitori dell’Aromatasi; OFS = Ovarian Function Suppression.
Le Linee Guida ESMO 2023 (6) e ASCO 2013 e 2016 (7,8) danno indicazioni pressoché sovrapponibili (Tab. 4).
Questioni aperte
Molte sono le questioni ancora irrisolte in ambito di follow-up del carcinoma mammario in fase precoce.
1 – Follow-up del carcinoma mammario effettuato nella pratica clinica
Le raccomandazioni indicate dalla Linee Guida nazionali e internazionali trovano scarsa applicazione nella pratica clinica. Una survey effettuata per valutare il tipo di follow-up seguito dagli oncologi in Italia e rivolta agli oncologi medici direttori di unità oncologiche ha fatto emergere che dei 134 direttori intervistati, il 77,9% dichiarava di seguire presso la propria struttura un follow-up personalizzato, in base al rischio di ripresa della singola paziente (30). Le caratteristiche tumorali considerate rilevanti per classificare le pazienti ad alto rischio di ripresa erano rappresentate soprattutto dal diametro patologico del tumore primitivo, dallo stato patologico linfonodale e dal sottotipo fenotipico tumorale (HER2-positivo: 71,4%; Luminal/HER2-positivo: 46,9%, Triplo negativo: 94,5%) (Fig. 2).
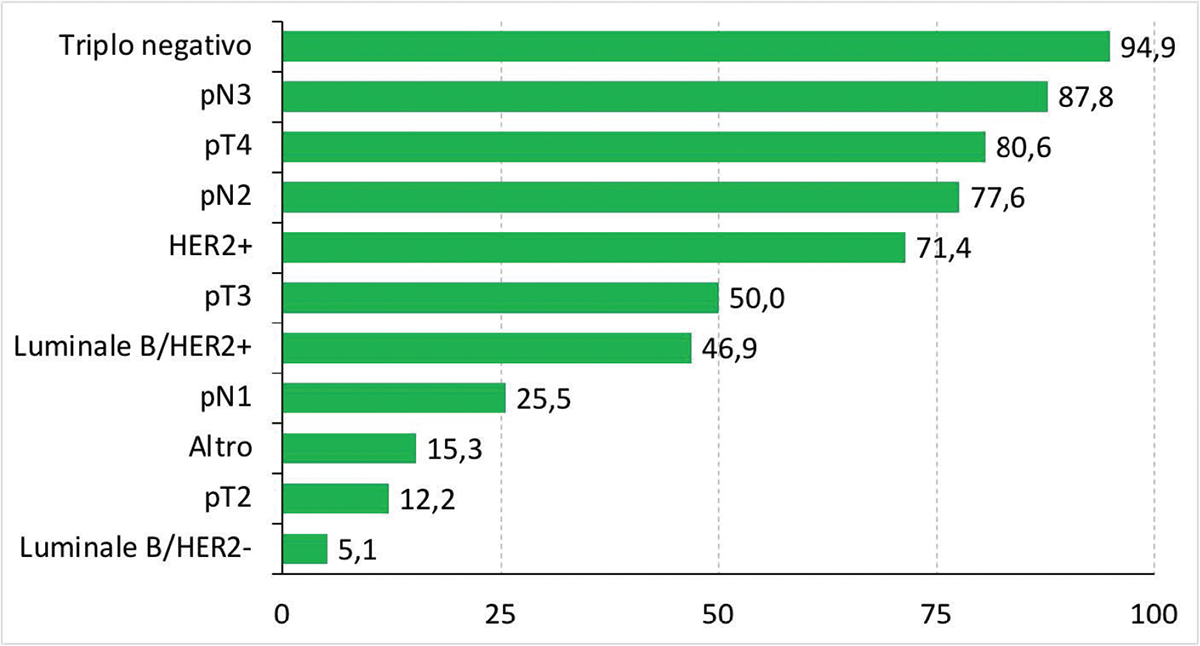
FIGURE 2 - caratteristiche del tumore alla mammella considerate rilevanti per classificare le pazienti ad alto rischio di ripresa (30).
Gli esami richiesti in maniera statisticamente significativa durante il follow-up delle pazienti considerate ad alto rischio rispetto alle pazienti considerate a basso rischio sono stati: marker tumorali (94,5% vs 84,5%; p = 0,03), Rx-torace (81,7% vs 62,5%; p = 0,005), ecografia epatica (91,4% vs 69,8%; p < 0,0001), scintigrafia ossea (46,8% vs 26,6%; p = 0,006), TC total body (34,4% vs 6,5%; p<0,0001) (30).
Questa propensione degli oncologi medici a richiedere un follow-up intensivo nella pratica clinica è basata sulla convinzione che questo tipo di follow-up possa anticipare la diagnosi di ripresa di malattia e, quindi, grazie all’inizio dei trattamenti efficaci oggi disponibili, possa aumentare la sopravvivenza di queste pazienti. In realtà, i due studi randomizzati, anche se condotti negli anni ’80 (28,29), non hanno dimostrato un vantaggio in sopravvivenza globale nel gruppo di pazienti seguite con follow-up intensivo.
A questo gli oncologi controbattono affermando che oggi, in presenza di una ripresa locoregionale di carcinoma mammario, possono essere effettuati trattamenti locoregionali adeguati e terapie adiuvanti più efficaci e che, in presenza di metastasi a distanza, possono essere iniziate precocemente terapie con farmaci che determinano vantaggi clinicamente rilevanti e statisticamente significativi in sopravvivenza nei vari sottotipi tumorali. Sono stati infatti riportati in letteratura vantaggi in PFS e in OS nelle pazienti metastatiche HER2-positive trattate in prima linea con chemioterapia associata a trastuzumab e pertuzumab (31) e nelle pazienti con neoplasie HR-positive/HER2-negative trattate con ribociclib e letrozolo (32), nonché vantaggi significativi in PFS nelle pazienti con carcinoma mammario metastatico triplo negativo trattate con immunoterapia associata a chemioterapia (33,34). Inoltre, oggi è indicato valutare, nella malattia oligometastatica, un trattamento chirurgico e/o radioterapico associato a una terapia antitumorale sistemica.
2 – Quali esami strumentali/test utilizzare?
L’unico esame strumentale oggi raccomandato nel follow-up è la Rx-mammografia.
Dalle evidenze della letteratura non emerge un vantaggio in sopravvivenza globale dall’esecuzione di altri esami strumentali di imaging (28,29). A ciò va aggiunta la considerazione del rischio di insorgenza di tumori maligni da radiazioni assorbite durante l’esecuzione di esami strumentali effettuati durante il follow-up, con un rischio stimato, tra le pazienti di 50-59 anni d’età seguite con follow-up intensivo strumentale, di un caso di tumore maligno da radiazioni su cento pazienti (outcome a 28 anni) (35).
Nella ricerca di test alternativi capaci di diagnosticare riprese precoci di carcinoma mammario, sono stati riportati in letteratura risultati interessanti.
Uno studio che ha valutato le cellule tumorali nel midollo osseo di donne con carcinoma mammario in fase precoce (evidenziate nel 30,6% di 4.703 pazienti con carcinoma mammario di stadio I-II-III) ha dimostrato che la loro presenza nel midollo osseo è un fattore prognostico indipendente di peggiore sopravvivenza a 10 anni (36). Uno studio che ha valutato il ruolo prognostico della presenza di cellule tumorali circolanti a 5 anni dalla diagnosi ha riportato come la loro presenza (evidenziata nel 5% del sangue periferico di 353 pazienti con carcinoma mammario HR-positivo clinicamente libere da malattia) sia risultata essere fattore prognostico indipendente di ripresa tardiva di neoplasia (37).
Sono inoltre stati pubblicati numerosi studi che hanno utilizzato la presenza del DNA delle cellule tumorali (ctDNA) per valutare la malattia residua in pazienti sottoposte a chemioterapia neoadiuvante con risultati molto interessanti sul valore prognostico di ripresa precoce di carcinoma mammario (Tab. 5) (38,39). Nel 2023 è stato inoltre pubblicato il primo studio prospettico di fase II, randomizzato, che ha testato l’utilità clinica del ctDNA (valutato ogni 3 mesi) nel guidare una terapia adiuvante (pembrolizumab per 1 anno) in 161 pazienti con carcinoma mammario in fase iniziale triplo negativo (40) a rischio moderato/alto (pazienti con malattia residua invasiva dopo chemioterapia neoadiuvante e chirurgia oppure pazienti con pT > 2 cm e interessamento linfonodale trattate con chirurgia upfront e chemioterapia adiuvante). Nei primi 12 mesi, il tasso di detenzione di ctDNA è risultato pari al 25%. Delle 32 pazienti (sulle 45 risultate ctDNA+) che sono state collocate a terapia adiuvante con pembrolizumab, il 72% (23/32) aveva tuttavia già metastasi all’imaging di stadiazione effettuato al momento dell’evidenza di ctDNA circolante.
| Study | Technique | Method | ctDNA/Total SAMPLES | |
|---|---|---|---|---|
| Riva et al. (2017) | ddPCR | Customized panel to track TP53 mutations previously characterized in tumor tissue | 38/41 |
– Customized panel detected 75% at baseline – Slow decrease in ctDNA during neoadjuvant chemotherapy was associated with shorter survival |
| Garcia-Murillas et al. (2019) | ddPCR | Primary tumor was sequenced and personalized tumor-specific ddPCR was used | 101/170 |
– ctDNA detection during follow-up was associated with a high rate of relapse |
| Rothé et al. (2019) (NeoAllto trial) | ddPCR | PIK3CA and/or TP53 mutations | 69/455 |
– ctDNA detection before neoadjuvant anti-HER2 therapy was associated with low pCR rates |
| McDonald et al. (2019) | Targeted digital sequencing (TARDIS) | Exome sequencing of tumor biopsies and analysis of dozens to hundreds of mutations in serial plasma samples | 33/33 |
– TARDIS results were informative in 100% of the samples – Patients with pCR showed a large decrease in ctDNA concentration during therapy |
| Radovich et al. (2020) | NGS | Commercial platform covering multiple genes (FoundationACT® or FoundationOneLiquid Assay®) | 142/196 |
– Detection of ctDNA and CTCs in triple-negative breast cancer patients after neoadjuvant therapy was associated with disease recurrence |
| Magbanua et al. (2021) | NGS | Personalized ctDNA test to detect up to 16 patient-specific mutations | 61/84 |
– Lack of ctDNA clearance predicted poor response and metastasis |
| Lin PH et al. (2021) | NGS | Deep sequencing of a target gene panel (14 genes) | 60/90 |
– The presence of ctDNA after neoadjuvant therapy was a robust marker for predicting relapse in stage II-to-III breast cancer patients |
Il test ctDNA non ha fornito indicazioni utili per la terapia adiuvante, ma si è dimostrato efficace nel rilevare precocemente le recidive del carcinoma mammario triplo negativo. Nelle donne a moderato/alto rischio, ha anticipato la diagnosi di recidiva di soli 1,6 mesi (95% CI 1,2-4,9 mesi).
3 – Quale durata del follow-up?
Oggi non è prevista una differente durata del follow-up in base al rischio di ripresa della singola paziente.
4 – Quale organizzazione/gestione del follow-up?
Esistono da anni problematiche organizzative relativamente alla gestione di pazienti con carcinoma mammario in fase precoce, visti il numero crescente di donne che entrano in questo percorso e le difficoltà conseguenti.
Convenzionalmente, le pazienti vengono prese in carico dall’oncologo medico fino al termine dell’ormonoterapia adiuvante o fino a 5 anni dalla diagnosi. Al completamento del periodo di follow-up oncologico specialistico, la paziente viene riaffidata al Medico di Medicina Generale (MMG) nell’ambito del cosiddetto modello sequenziale condiviso di follow-up.
Tuttavia, si stanno ipotizzando anche altri modelli organizzativi. Per esempio, un modello in cui, già dal termine dei trattamenti antitumorali iniziali (locoregionali ± chemioterapia/immunoterapia/terapia a bersaglio molecolare/inibitori di PARP adiuvanti), le pazienti potrebbero essere gestite, all’interno del centro oncologico, dall’oncologo medico, dal radioterapista e dal chirurgo senologo oppure un modello in cui vengono riaffidate direttamente al MMG.
Un modello organizzativo che comprende il coinvolgimento del MMG è stato inserito nel PDTA 2022 della Rete Oncologica Veneta (ROV) (41).
Studi in corso
Pochi sono gli studi effettuati per affrontare la tematica del follow-up nel carcinoma mammario in fase precoce e altrettanto pochi sono gli studi in corso che stanno valutando nuove strategie per aumentare il tasso di diagnosi di ripresa precoce di carcinoma mammario.
Uno studio giapponese di fase III, iniziato nel 2013, con l’obiettivo di dimostrare una superiorità in termini di sopravvivenza globale di un follow-up intensivo rispetto a un follow-up standard, ha randomizzato in 3 anni 1.700 pazienti con carcinoma mammario in fase precoce ad alto rischio di ripresa (<30%) a 5 anni dalla chirurgia (42). Il protocollo prevedeva di seguire le pazienti per 7 anni dal termine dell’arruolamento e i risultati ancora non sono disponibili. Il follow-up standard prevedeva un esame fisico (ogni 3 mesi × 3 anni, ogni 6 mesi × 2 anni e poi annuale) e Rx-mammografia e marker tumorali annuali × 5 anni; il follow-up intensivo invece comprendeva un esame fisico (ogni 3 mesi × 3 anni, ogni 6 mesi × 2 anni e poi annuale), Rx-mammografia annuale, marker tumorali (ogni 3 mesi × 3 anni, ogni 6 mesi × 2 anni), TC torace-addome, scintigrafia ossea e risonanza magnetica o/TC cerebrale (ogni 6 mesi × 3 anni e annuale × 2 anni); una PET-TC poteva sostituire TC torace-addome e scintigrafia ossea.
Uno studio italiano, KRONOS study, iniziato nel 2014, ha arruolato pazienti con carcinoma mammario di stadio I-II-III operate e trattate con terapie adiuvanti, randomizzando tra braccio A (controllo, che prevedeva esami strumentali e marker tumorali come da pratica locale) e braccio B (sperimentale, che prevedeva la determinazione periodica di CEA e CA-15-3 e PET-FDG18 eseguita solo nel caso di aumento critico dei livelli dei marker) (43), con l’obiettivo primario di verificare se il follow-up sperimentale potesse anticipare la diagnosi di ripresa locoregionale e di metastasi a distanza rispetto al follow-up standard.
I risultati di questo studio non sono ancora disponibili.
Un altro studio internazionale, ACTIVELY, coordinato da Lucia Del Mastro, è stato presentato ad Aprile 2023 all’Horizon Europe Program (Del Mastro Lucia, comunicazione orale). Questo trial di fase 2 randomizzato vuole valutare l’impatto di un follow-up intensivo rispetto a un follow-up clinico standard sull’anticipazione diagnostica nelle pazienti con carcinoma mammario di stadio I-II-III ad alto rischio di recidiva (superiore al 25% a 5 anni).
Conclusioni
In considerazione delle scarse, e datate, evidenze della letteratura scientifica disponibili, delle conoscenze bio-patologiche che permettono di suddividere il carcinoma mammario in differenti sottotipi con diversa prognosi, delle possibilità terapeutiche oggi disponibili nel trattamento della ripresa locoregionale e metastatica e delle disuguaglianze esistenti nel follow-up del carcinoma mammario tra i vari centri oncologici, si è ritenuto opportuno iniziare un percorso di Consensus secondo la metodologia mini-Delphi (44,45), che si concluderà entro il 2024.
Acknowledgements
Medical writing support was provided by Luisa Crinò.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. I numeri del canaro in Italia 2023. Online (Accessed January 10, 2024)
- 2. I numeri del cancro in Italia 2020. Online (Accessed June 22, 2023)
- 3. Pan H, Gray R, Braybrooke J, et al; EBCTCG. 20-year risks of breast cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med. 2017;377(19):1836-1846. CrossRef PubMed
- 4. Saphner T, Tormey DC, Gray R. Annual hazard rates of recurrence for breast cancer after primary therapy. J Clin Oncol. 1996;14(10):2738-2746. CrossRef PubMed
- 5. Linee guida AIOM Carcinoma Mammario in Stadio Precoce. Edizione 2023. Online (Accessed January 10, 2024)
- 6. Loibl S, André F, Bachelot T. et al. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology (2023). CrossRef (Accessed Juanuary 10, 2024)
- 7. Khatcheressian JL, Hurley P, Bantug E, et al; American Society of Clinical Oncology. Breast cancer follow-up and management after primary treatment: american Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013;31(7):961-965. CrossRef PubMed
- 8. Runowicz CD, Leach CR, Henry NL, et al. American Cancer Society/American Society of Clinical Oncology breast Clinical Oncology Breast Cancer Survivorship Care Guideline. J Clin Oncol. 2016;34(6):611-635. CrossRef PubMed
- 9. de Bock GH, Bonnema J, van der Hage J, Kievit J, van de Velde CJ. Effectiveness of routine visits and routine tests in detecting isolated locoregional recurrences after treatment for early-stage invasive breast cancer: a meta-analysis and systematic review. J Clin Oncol. 2004;22(19):4010-4018. CrossRef PubMed
- 10. Montgomery DA, Krupa K, Cooke TG. Follow-up in breast cancer: does routine clinical examination improve outcome? A systematic review of the literature. Br J Cancer. 2007;97(12):1632-1641. CrossRef PubMed
- 11. Lu W, de Bock GH, Schaapveld M, Baas PC, Wiggers T, Jansen L. The value of routine physical examination in the follow up of women with a history of early breast cancer. Eur J Cancer. 2011;47(5):676-682. CrossRef PubMed
- 12. Montgomery DA, Krupa K, Cooke TG. Alternative methods of follow up in breast cancer: a systematic review of the literature. Br J Cancer. 2007;96(11):1625-1632. CrossRef PubMed
- 13. Loomer L, Brockschmidt JK, Muss HB, Saylor G. Postoperative follow-up of patients with early breast cancer. Patterns of care among clinical oncologists and a review of the literature. Cancer. 1991;67(1):55-60. CrossRef PubMed
- 14. Pace BW, Tinker MA. Follow-up of patients with breast cancer. Clin Obstet Gynecol. 1994;37(4):998-1002. CrossRef PubMed
- 15. Temple LK, Wang EE, McLeod RS. Preventive health care, 1999 update: 3. Follow-up after breast cancer. Canadian Task Force on Preventive Health Care. CMAJ. 1999;161(8):1001-1008. PubMed
- 16. Lash TL, Fox MP, Buist DS, et al. Mammography surveillance and mortality in older breast cancer survivors. J Clin Oncol. 2007;25(21):3001-3006. CrossRef PubMed
- 17. Schootman M, Jeffe DB, Lian M, Aft R, Gillanders WE. Surveillance mammography and the risk of death among elderly breast cancer patients. Breast Cancer Res Treat. 2008;111(3):489-496. CrossRef PubMed
- 18. Lash TL, Fox MP, Silliman RA. Reduced mortality rate associated with annual mammograms after breast cancer therapy. Breast J. 2006;12(1):2-6. CrossRef PubMed
- 19. Yang SH, Yang KH, Li YP, et al. Breast conservation therapy for stage I or stage II breast cancer: a meta-analysis of randomized controlled trials. Ann Oncol. 2008;19(6):1039-1044. CrossRef PubMed
- 20. Abner AL, Recht A, Eberlein T, et al. Prognosis following salvage mastectomy for recurrence in the breast after conservative surgery and radiation therapy for early-stage breast cancer. J Clin Oncol. 1993;11(1):44-48. CrossRef PubMed
- 21. Montgomery DA, Krupa K, Jack WJ, et al. Changing pattern of the detection of locoregional relapse in breast cancer: the Edinburgh experience. Br J Cancer. 2007;96(12):1802-1807. CrossRef PubMed
- 22. Houssami N, Abraham LA, Miglioretti DL, et al. Accuracy and outcomes of screening mammography in women with a personal history of early-stage breast cancer. JAMA. 2011;305(8):790-799. CrossRef PubMed
- 23. Mellink WA, Holland R, Hendriks JH, Peeters PH, Rutgers EJ, van Daal WA. The contribution of routine follow-up mammography to an early detection of asynchronous contralateral breast cancer. Cancer. 1991;67(7):1844-1848. CrossRef PubMed
- 24. Gutter Z. Cancer of the remaining breast: radiologic contribution to diagnosis. Can Med Assoc J. 1976;114(1):27-30. PubMed
- 25. Senofsky GM, Wanebo HJ, Wilhelm MC, et al. Has monitoring of the contralateral breast improved the prognosis in patients treated for primary breast cancer? Cancer. 1986;57(3):597-602. CrossRef PubMed
- 26. Robertson C, Arcot Ragupathy SK, Boachie C, Dixon JM et al. The clinical effectiveness and cost-effectiveness of different surveillance mammography regimens after the treatment for primary breast cancer: systematic reviews registry database analyses and economic evaluation. Health Technol Assess. 2011 Sep;15(34):v-vi, 1-322. CrossRef PubMed
- 27. Orel SG, Fowble BL, Solin LJ, Schultz DJ, Conant EF, Troupin RH. Breast cancer recurrence after lumpectomy and radiation therapy for early-stage disease: prognostic significance of detection method. Radiology. 1993;188(1):189-194. CrossRef PubMed
- 28. Ghezzi P; The GIVIO Investigators. Impact of follow-up testing on survival and health-related quality of life in breast cancer patients. A multicenter randomized controlled trial. JAMA. 1994;271(20):1587-1592. CrossRef PubMed
- 29. Rosselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA. 1994 May 25;271(20):1593-7. CrossRef PubMed
- 30. Natoli C, Brocco D, Sperduti I. et al.“FOLLOW-UP” Study Group. Breast cancer “tailored follow-up” in Italian oncology units: a web-based survey. PLoS One. 2014 Apr 8;9(4):e94063. CrossRef PubMed
- 31. Swain SM, Miles D, Kim S-B, et al; CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2020;21(4):519-530. CrossRef PubMed
- 32. Hortobagyi GN, Stemmer SM, Burris HA, et al. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med. 2022;386(10):942-950. CrossRef PubMed
- 33. Schmid P, Adams S, Rugo HS, et al; IMpassion130 Trial Investigators. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018;379(22):2108-2121. CrossRef PubMed
- 34. Emens LA, Adams S, Barrios CH, et al. First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol. 2021;32(8):983-993. CrossRef PubMed
- 35. Fresco R, Spera G, Meyer C, Cabral P, Mackey JR. Imaging radiation doses and associated risk and benefits in subjects participating in breast cancer clinical trials. Oncologist. 2015;20(7):702-712. CrossRef PubMed
- 36. Braun S, Vogl FD, Naume B, et al. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 2005;353(8):793-802. CrossRef PubMed
- 37. Sparano J, O’Neill A, Alpaugh K, et al. Association of circulating tumor cells with late recurrence of estrogen receptor-positive breast cancer: a secondary analysis of a randomized clinical trial. JAMA Oncol. 2018;4(12):1700-1706. CrossRef PubMed
- 38. Sant M, Bernat-Peguera A, Felip E, Margelí M. Role of ctDNA in breast cancer. Cancers (Basel). 2022;14(2):310. CrossRef PubMed
- 39. Garcia-Murillas I, Schiavon G, Weigelt B, et al. Mutation tracking in circulating tumor DNA predicts relapse in early breast cancer. Sci Transl Med. 2015;7(302):302ra133. CrossRef PubMed
- 40. Turner NC, Swift C, Jenkins B, et al; c-TRAK TN investigators. Results of the c-TRAK TN trial: a clinical trial utilising ctDNA mutation tracking to detect molecular residual disease and trigger intervention in patients with moderate- and high-risk early-stage triple-negative breast cancer. Ann Oncol. 2023;34(2):200-211. CrossRef PubMed
- 41. Percorso DTA. (PDTA) per i pazienti affetti da tumore della mammella – Elaborato dalla Rete Oncologica Veneto (ROV) 2022. Online (Accessed June 22, 2023)
- 42. Hojo T, Masuda N, Mizutani T, et al. Intensive vs. standard post-operative surveillance in high-risk breast cancer patients (INSPIRE): Japan Clinical Oncology Group Study JCOG1204. Jpn J Clin Oncol. 2015;45(10):983-986. CrossRef PubMed
- 43. Zamagni C, Gion M, Mariani L, et al. CA15.3 and 18-FDG PET in the follow-up of early breast cancer (BC) patients (pts): A prospective, multicentric, randomized trial—KRONOS patient-oriented new surveillance study Italy. J Clin Oncol. 2017;35(15_suppl):TPS11627. CrossRef
- 44. Gustafson DH, Shukla RK, Delbecq A, Walster GW. A comparative study of differences in subjective likelihood estimates made by individuals, interacting groups, Delphi groups, and nominal groups. Organ Behav Hum Perform. 1973;9(2):280-291. CrossRef
- 45. Rowe G, Wright G. Expert opinion in forecasting: role of the Delphi technique. In: Armostrong JS (Ed.), Principles of forecasting. Kluwer Academic Press. 2001; pag 125-126. CrossRef