 |
AboutOpen | 2023; 10: 103-109 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2609 ORIGINAL RESEARCH ARTICLE |
 |
Brentuximab vedotin + AVD nel cHL: impatto di costo su eventi avversi, tossicità, neoplasie secondarie, fine vita e linee successive di trattamento in Italia
Brentuximab vedotin + AVD in cHL: cost impact on adverse events, toxicity, second malignancies, end-of-life and subsequent lines of therapy in Italy
Introduction: In classical Hodgkin lymphoma (cHL), the delayed effects of therapies, such as second malignancies and toxicity, and the high relapse rate are potentially associated with an expense for the National Health Service (NHS).
Objective: The objective of the study was to estimate the impact of introducing the combination of brentuximab vedotin (Adcetris®), doxorubicin, vinblastine and dacarbazine (A+AVD) for the first line (1L) treatment of stage III/IV cHL on costs associated with adverse events (AEs), pulmonary toxicity, second malignancies, end-of-life and second and subsequent lines (2L+) treatments.
Method: The incidence of the events analysed was derived from clinical trials and Italian reports. Unit costs were estimated based on the national tariffs and the Italian literature. The results were modelled and extrapolated to the population in two scenarios, a current one without A+AVD and a future one in which A+AVD is introduced. The time horizon was six years and the perspective is that of the Italian NHS.
Results: The introduction of A+AVD in 1L is associated with a reduction in the costs of AEs, pulmonary toxicity, second malignancies and end-of-life following 1L and in the acquisition costs of 2L+ treatments of approximately € 10,400/patient corresponding to a total saving of € 18.46 M over six years for the NHS; this saving grows as the use of A+AVD increases.
Conclusion: The introduction of A+AVD for the 1L treatment of stage III/IV cHL is associated with a reduction in costs for the NHS for the management of AEs, pulmonary toxicity, second malignancies, end-of-life and 2L+ treatments.
Keywords: Brentuximab vedotin, Cost analysis, Economic analysis, Hodgkin lymphoma, Italy
Received: May 25, 2023
Accepted: September 12, 2023
Published online: October 2, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il linfoma di Hodgkin classico (cHL) è una neoplasia del sistema immunitario caratterizzata da una proliferazione dei linfociti B (1), con un’incidenza nel 2020 pari a 2.150 pazienti in Italia (2), di cui oltre il 30% diagnosticato con uno stadio avanzato (III/IV) (3).
Grazie all’efficacia delle cure attualmente disponibili, oltre l’85% dei pazienti è vivo a 5 anni dalla diagnosi (2), ma gli effetti ritardati delle terapie, quali l’insorgenza di carcinomi secondari e di tossicità cardiaca e polmonare (2,4) e l’alto tasso di recidiva soprattutto in stadio avanzato (1), fanno emergere la necessità di un miglioramento del trattamento del cHL.
Recentemente, la combinazione di brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina (A+AVD) si è inserita nel contesto italiano per il trattamento del cHL avendo ottenuto la rimborsabilità (5) in 1L grazie all’efficacia dimostrata rispetto allo standard terapeutico (combinazione di doxorubicina, bleomicina, vinblastina e dacarbazina, ABVD (6,4)) nella popolazione in stadio III/IV non precedentemente trattata (7-9). In particolare, i risultati dello studio clinico globale di fase III, multicentrico, randomizzato, open-label, ECHELON-1 hanno dimostrato che il trattamento con A+AVD è associato a un rischio di progressione e di morte significativamente inferiore rispetto ad ABVD, con una sopravvivenza libera da progressione (PFS) a 6 anni pari rispettivamente all’82,3% e al 74,5% e con una sopravvivenza globale (OS) a 6 anni pari rispettivamente al 93,3% e all’89,4% (9). Oltre a essere efficace, A+AVD è caratterizzato da un profilo di sicurezza in termini di eventi avversi (AE) complessivamente positivo, prevedibile e controllabile (8). Inoltre, i pazienti trattati con A+AVD rispetto a quelli in terapia con ABVD sono caratterizzati da una minore incidenza di tossicità polmonare (1,8% e 6,7% a seguito del trattamento) (7) e di neoplasie secondarie (3,5% e 4,9% a 6 anni dall’inizio del trattamento) (9).
Considerati i benefici clinici (7-9), l’introduzione di A+AVD è potenzialmente associata a un vantaggio economico per il Sistema Sanitario Nazionale (SSN) per quanto riguarda la gestione del paziente, in termini del trattamento a seguito di progressione, dell’insorgenza di AE, tossicità e neoplasie e del fine vita. Sulla base dei dati di ECHELON-1 con follow-up a 5 anni (8), si è stimato che l’introduzione di A+AVD in 1L per il cHL in stadio IV comporti un risparmio in termini di costo dei trattamenti di seconda linea e successive (2L+) nei primi tre anni di commercializzazione rispetto allo standard terapeutico (10), grazie a una minore necessità di ricorso a terapie aggiuntive a seguito del trattamento di 1L con A+AVD. Al meglio della nostra conoscenza, non sono invece attualmente disponibili studi che stimino l’impatto di costo di A+AVD in relazione ai principali outcome dello studio clinico ECHELON-1 (7-9), in termini di valorizzazione dell’efficacia (sopravvivenza dei pazienti) e della safety (gestione di AE, tossicità farmaco-dipendenti e neoplasie secondarie).
L’obiettivo dello studio è quindi quello di stimare l’impatto di costo sui principali outcome (costi associati agli AE, alla tossicità polmonare, alle neoplasie secondarie e al fine vita) nei pazienti affetti da cHL in stadio III/IV non precedentemente trattati (pazienti oggetto di studio nel clinical trial di A+AVD) (7-9) dal punto di vista del SSN italiano in un orizzonte temporale di 6 anni; pertanto non è stato stimato il costo di trattamento delle 1L. L’analisi vuole inoltre stimare l’impatto di A+AVD sui costi dei trattamenti di 2L+ (10) sulla base dei dati a 6 anni derivanti dallo studio clinico ECHELON-1 (9) e considerando le stime di popolazione attuali.
Metodi
Per stimare l’impatto dell’introduzione di A+AVD sui costi di AE, tossicità polmonare, neoplasie secondarie e fine vita e sui costi delle terapie di 2L+ nei pazienti affetti da cHL in stadio III/IV trattati in 1L, è stato sviluppato un modello in Microsoft Excel in tre fasi. Innanzitutto, è stata stimata l’incidenza degli eventi di interesse per l’analisi sulla base dello studio clinico ECHELON-1 (7-9), in termini di probabilità di sviluppare un AE, tossicità polmonare e neoplasie secondarie, di iniziare un trattamento di 2L+ e di morire; in secondo luogo, sono stati stimati i costi unitari per la gestione degli eventi oggetto di studio; infine, i risultati sono stati espansi alla popolazione di interesse, vale a dire pazienti affetti da cHL in stadio III/IV trattati in 1L.
Il modello prevede il confronto tra due scenari: uno scenario attuale, nel quale tutti i pazienti sono trattati in 1L con lo standard terapeutico (ABVD), e uno scenario futuro in cui viene introdotto il regime con A+AVD.
L’impatto dell’introduzione di A+AVD in 1L per il trattamento dei pazienti affetti da cHL in stadio III/IV è stato stimato su un orizzonte temporale di 6 anni, come da follow-up più recente dello studio clinico ECHELON-1 (9) e i costi sono espressi in Euro (€) 2022. La prospettiva considerata è quella del SSN italiano.
Incidenza degli eventi analizzati
AE e tossicità polmonare
L’incidenza degli AE e della tossicità polmonare è stata stimata a partire dallo studio clinico ECHELON-1 (7) per A+AVD e ABVD in 1L e si è assunto che i pazienti possano sviluppare tali eventi una tantum in seguito alla somministrazione del farmaco. Per quanto riguarda gli AE, sono stati inclusi nell’analisi gli AE non rari (AE di grado 1-2 con frequenza ≥ 10% (11) e di grado 3+ con frequenza ≥ 5% (12); inoltre, l’incidenza della neutropenia di grado 3+ e della neutropenia febbrile di grado 3+ per il braccio A+AVD è relativa ai soli pazienti che hanno ricevuto il fattore di crescita G-CSF come profilassi primaria, in linea con le raccomandazioni cliniche (11). I dettagli dell’incidenza di AE e tossicità polmonare sono riportati nella Tabella Supplementare 1.
Neoplasie secondarie
Nel modello, ogni anno i pazienti hanno una probabilità di sviluppare una neoplasia secondaria stimata a partire dal tasso cumulativo di incidenza a 6 anni presentato in ECHELON-1: in particolare, la probabilità annua di sviluppare una neoplasia secondaria è stata modellizzata tramite una curva parametrica con distribuzione esponenziale tale per cui il 96,5% e il 95,1% dei pazienti nel braccio A+AVD e ABVD rispettivamente risultino liberi da una neoplasia secondaria in 6 anni, come da studio clinico (9). Il tasso di incidenza annuo risultante è pari a circa lo 0,6% con A+AVD e lo 0,8% con ABVD.
La distribuzione per tipologia di neoplasia secondaria nei due bracci è stata derivata dallo studio clinico (9) (Tabella Supplementare 2) e moltiplicata in ognuno dei 6 anni per la probabilità specifica di quell’anno per un paziente di sviluppare una neoplasia.
I pazienti che sviluppano una neoplasia secondaria hanno una probabilità annua di morire basata su curve di mortalità specifiche per ogni neoplasia, costruite a partire dai tassi di sopravvivenza a 5 anni tratti dal rapporto AIRTUM (2), considerando distribuzioni esponenziali. Si è verificato che nel modello la mortalità per neoplasia fosse inferiore alla mortalità complessiva osservata nello studio clinico (9). È stato assunto che lo sviluppo delle neoplasie secondarie avvenga all’inizio dell’anno e che la morte si verifichi alla fine dell’anno.
Fine vita
Per stimare i costi relativi al fine vita, la probabilità per i pazienti di morire è stata derivata dalle curve di sopravvivenza globale dello studio clinico ECHELON-1 (9) digitalizzate tramite il software Graph Digitizer. In particolare, la mortalità è pari al 3,0%, all’1,1%, allo 0,9%, allo 0,5%, allo 0,4% e allo 0,3% dall’anno 1 all’anno 6 con A+AVD e pari al 4,2%, all’1,9%, all’1,9%, allo 0,5%, all’1,4% e allo 0,6% dall’anno 1 all’anno 6 con ABVD.
Trattamenti di 2L+
La stima dei costi dei trattamenti di 2L+ è stata effettuata aggiornando l’analisi di Fiorentino et al. del 2023 (10) modificando i dati dello studio clinico ECHELON-1 con follow-up a 5 anni (8) con i dati del follow-up a 6 anni (9) relativi alla quota di utilizzo, al numero e alla tipologia dei trattamenti di 2L+. In particolare, in Ansell et al. nel 2022 (9) viene riportata una quota di utilizzo dei trattamenti di 2L+ nel braccio A+AVD pari al 20,4% e nel braccio ABVD pari al 23,8% (versus il 20,1% e il 23,7% nei due bracci in Straus et al. 2021 (8)), un numero di trattamenti di 2L+ pari a 1,47 e 1,71 in A+AVD e ABVD (versus 1,46 e 1,71 in Straus et al. 2021 (8)) e l’introduzione di un nuovo regime immunoterapico (combinazione di nivolumab e chemioterapia). Le quote di utilizzo dei singoli trattamenti sono riportate nella Tabella Supplementare 3. Sono state utilizzate le informazioni tratte da studi clinici (13) e Linee Guida (6) per l’aggiornamento della posologia e della durata di trattamento delle nuove terapie considerate.
Costi unitari
I costi unitari per la gestione degli AE e della tossicità polmonare sono stati stimati come media tra i valori derivati dalle tariffe ambulatoriali e ospedaliere per acuti ritenuti più appropriati e validati dove possibile mediante la letteratura italiana e i costi relativi agli AE in Italia stimati tramite un approccio di micro-costing pubblicati in letteratura, se disponibili (14-18) (Tabella Supplementare 1).
Per quanto riguarda le neoplasie secondarie, i costi annui sono stati ricavati dalla letteratura italiana (2,14,19-29) e inflazionati all’anno 2022 (30) (Tabella Supplementare 2). I costi unitari relativi alle neoplasie secondarie sono stati applicati ai pazienti che sviluppano una neoplasia in uno specifico anno nel modello e ai pazienti che hanno sviluppato una neoplasia secondaria negli anni precedenti e che non sono morti nel corso degli anni.
I costi associati al fine vita sono stati stimati tramite un approccio di micro-costing, considerando: la gestione e il monitoraggio dei pazienti, a seconda che il fine vita dei pazienti sia gestito in ospedale, in hospice o a domicilio tramite il SSN, i farmaci somministrati ai pazienti che sono gestiti al domicilio (i costi dei farmaci sono considerati già inclusi nelle tariffe DRG e hospice) e il supporto psicologico per i pazienti che sono gestiti al domicilio (le spese associate al supporto psicologico sono considerate già comprese nelle tariffe DRG e hospice). La durata media della gestione del paziente e il consumo di risorse prima del decesso sono stati stimati a partire da report pubblici italiani (31-33) mentre i costi sono stati ricavati dai tariffari nazionali e regionali per la gestione dei pazienti in ospedale, in hospice e a domicilio (15,34-38), dai tariffari ambulatoriali per le sedute psicologiche (14) e dai dati di vendita IQVIA per i trattamenti farmacologici (39). Sulla base degli input considerati, il costo medio del fine vita è stato stimato pari a 1.561,9 €/paziente (Tabella Supplementare 4).
Infine, l’analisi delle linee successive di terapia si è basata sugli stessi costi di Fiorentino et al. del 2023 (10). In particolare, i costi relativi ai farmaci di 2L+ includono il costo di acquisto al netto degli sconti di legge e il costo di somministrazione in regime di ricovero nel caso di trattamenti chemioterapici; gli altri costi provengono dalla letteratura e sono stati inflazionati (30) dove necessario (Tabella Supplementare 3).
Popolazione
La popolazione oggetto di analisi corrisponde ai pazienti affetti da cHL in stadio III/IV trattati in 1L ed è stata stimata a partire dai report AIRTUM (2) e dalla letteratura (1,3,40) (Tab. I). Si è assunto che la popolazione incidente in 1L rimanga costante nei 6 anni di analisi e che la quota di utilizzo di A+AVD sia crescente nel tempo dal primo al terzo anno di commercializzazione, per poi rimanere costante negli ultimi tre anni di analisi (41), sostituendosi in maniera proporzionale alla quota di pazienti trattati con ABVD. Per stimare il numero di pazienti trattati in 2L+, la proporzione di pazienti che avanzano a una linea successiva di trattamento è stata tratta dai dati di ECHELON-1 con follow-up a 6 anni (9,42).
| Scenario senza A+AVD in 1L (scenario attuale) | ||||||
|---|---|---|---|---|---|---|
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Anno 6 | |
| Pazienti incidenti con cHL (1,2,40) | 2.151 | 2.151 | 2.151 | 2.151 | 2.151 | 2.151 |
| Pazienti in stadio III/IV (3) | 658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
| Pazienti trattati in 1L (41) | 658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
| Pazienti trattati in 1L con ABVD (41) | 658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
| Pazienti trattati in 2L+ a seguito di ABVD (9) | 157
(23,8%) |
157
(23,8%) |
157
(23,8%) |
157
(23,8%) |
157
(23,8%) |
157
(23,8%) |
| Scenario con l’introduzione di A+AVD in 1L | ||||||
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Anno 6 | |
| Pazienti incidenti con cHL (1,2,40) | 2.151 | 2.151 | 2.151 | 2.151 | 2.151 | 2.151 |
| Pazienti in stadio III/IV (3) | 658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
658
(30,6%) |
| Pazienti trattati in 1L (41) | 658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
658
(100,0%) |
| Pazienti trattati in 1L con ABVD (41) | 461
(70,0%) |
395
(60,0%) |
329
(50,0%) |
329
(50,0%) |
329
(50,0%) |
329
(50,0%) |
| Pazienti trattati in 1L con A+AVD (41) | 197
(30,0%) |
263
(40,0%) |
329
(50,0%) |
329
(50,0%) |
329
(50,0%) |
329
(50,0%) |
| Pazienti trattati in 2L+ a seguito di ABVD (9) | 110
(23,8%) |
94
(23,8%) |
78
(23,8%) |
78
(23,8%) |
78
(23,8%) |
78
(23,8%) |
| Pazienti trattati in 2L+ a seguito di A+AVD (9) | 40
(20,4%) |
54
(20,4%) |
67
(20,4%) |
67
(20,4%) |
67
(20,4%) |
67
(20,4%) |
A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; ABVD: doxorubicina, bleomicina, vinblastina e dacarbazina; 1L: prima linea; cHL: linfoma di Hodgkin classico; 2L+: seconda linea e successive.
Analisi di sensibilità
Per verificare l’impatto sui risultati e testarne la robustezza, sono state effettuate alcune analisi di sensibilità deterministiche in cui sono stati fatti variare di +/- 20% gli input considerati maggiormente incerti in quanto tratti dagli studi clinici e dalla letteratura e di conseguenza non necessariamente rispecchianti il contesto real-world italiano. In particolare, sono stati fatti variare: 1) input di incidenza, quali il numero di nuovi pazienti affetti da cHL, la quota di utilizzo dei trattamenti di 2L+ a seguito del trattamento di 1L con ABVD o A+AVD, il numero medio di linee di trattamento di 2L+; 2) input di costo, quali i costi degli AE e della tossicità polmonare e i costi delle neoplasie secondarie. Inoltre, sono state utilizzate delle possibili fonti alternative per stimare il tasso di incidenza della tossicità polmonare (43) e il costo del fine vita (18,44).
Risultati
Il costo medio per la gestione di AE, tossicità polmonare, neoplasie secondarie e fine vita e per le terapie di 2L+ di un paziente trattato in 1L per cHL in stadio III/IV con ABVD (scenario attuale) e A+AVD (scenario futuro) è stato stimato rispettivamente pari a 22.300 € e a 11.900 €: l’introduzione di A+AVD comporterebbe quindi un risparmio per il SSN italiano di 10.400 €/paziente, pari a una riduzione di quasi il 50% di costi/paziente rispetto alla spesa sostenuta a oggi.
La riduzione di spesa/paziente del SSN italiano è guidata per oltre il 90% dall’acquisto dei farmaci di 2L+ e per la restante parte (circa il 10%) dagli altri costi diretti sanitari. Il risparmio principale considerando gli altri costi diretti sanitari è trainato dalla diminuzione dei costi legati alla gestione delle neoplasie secondarie (60% sui risparmi medi per paziente dati dagli altri costi diretti sanitari) e delle tossicità polmonari (20% sui risparmi medi per paziente dati dagli altri costi diretti sanitari).
Comparando la spesa/paziente sostenuta dal SSN italiano prima dell’introduzione di A+AVD per il trattamento di 1L del cHL in stadio III/IV e dopo, si stima che tutte le voci di costo incluse nell’analisi generino un risparmio: in particolare, comparando lo scenario senza A+AVD e lo scenario con A+AVD, la spesa per la gestione della tossicità polmonare risulta ridotta di circa l’80%, il costo per l’acquisto dei trattamenti di 2L+ e della gestione delle neoplasie secondarie risulta diminuito del 50% ed è stata stimata una riduzione del 40% della spesa del fine vita, mentre il costo di gestione degli AE è risultato ridotto del 4%.
Considerando la popolazione eleggibile, vale a dire i pazienti affetti da cHL in stadio III/IV, si stima una riduzione dei costi per il SSN italiano associati all’introduzione di A+AVD in 1L pari a 18,46 M € in 6 anni. I risparmi crescono all’aumentare dell’utilizzo di A+AVD, passando da 2,00 M € l’anno 1 a 3,50 M € l’anno 6 (Fig. 1).
Analisi di sensibilità
I risultati delle analisi di sensibilità sono riportati nella Figura 2. Modificando i parametri più incerti del modello, i risultati relativi all’impatto di costo dell’introduzione di A+AVD sulla gestione di AE, tossicità polmonare, neoplasie secondarie, fine vita e acquisto di terapie di 2L+ continuano a evidenziare un risparmio per il SSN italiano variando da –25,63 M € a –11,29 M €, rispetto alla baseline pari a –18,46 M €. Inoltre, si evince che l’approccio utilizzato nello studio è conservativo: utilizzando infatti fonti di letteratura alternative relativamente all’incidenza della tossicità polmonare e alle voci di costo del fine vita, si stima un risparmio per il SSN superiore ai risultati di baseline.
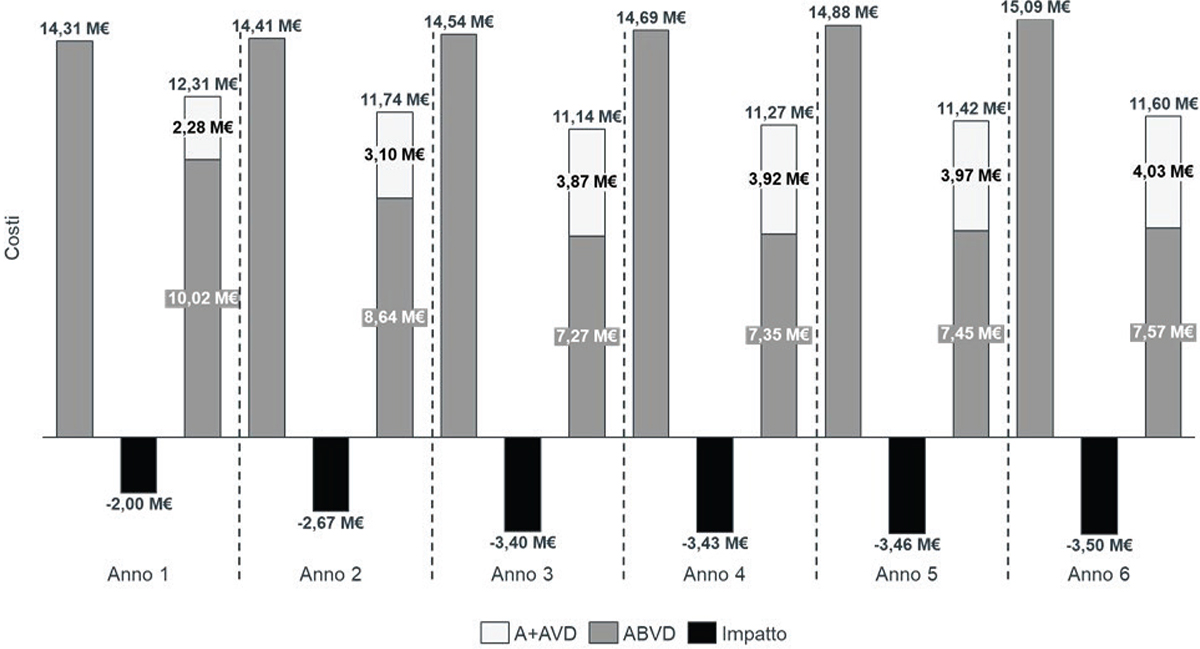
Fig. 1 - Impatto di costo per il SSN italiano dato dall’introduzione di A+AVD in prima linea sulla gestione di eventi avversi, tossicità polmonare, neoplasie secondarie e fine vita e sui costi dei trattamenti di 2L+ (anno 1-6). SSN: Sistema Sanitario Nazionale; 1L: prima linea; 2L+: seconda linea e successive; A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; ABVD: doxorubicina, bleomicina, vinblastina e dacarbazina.
Nota: i totali potrebbero non corrispondere alla somma delle parti a causa degli arrotondamenti.
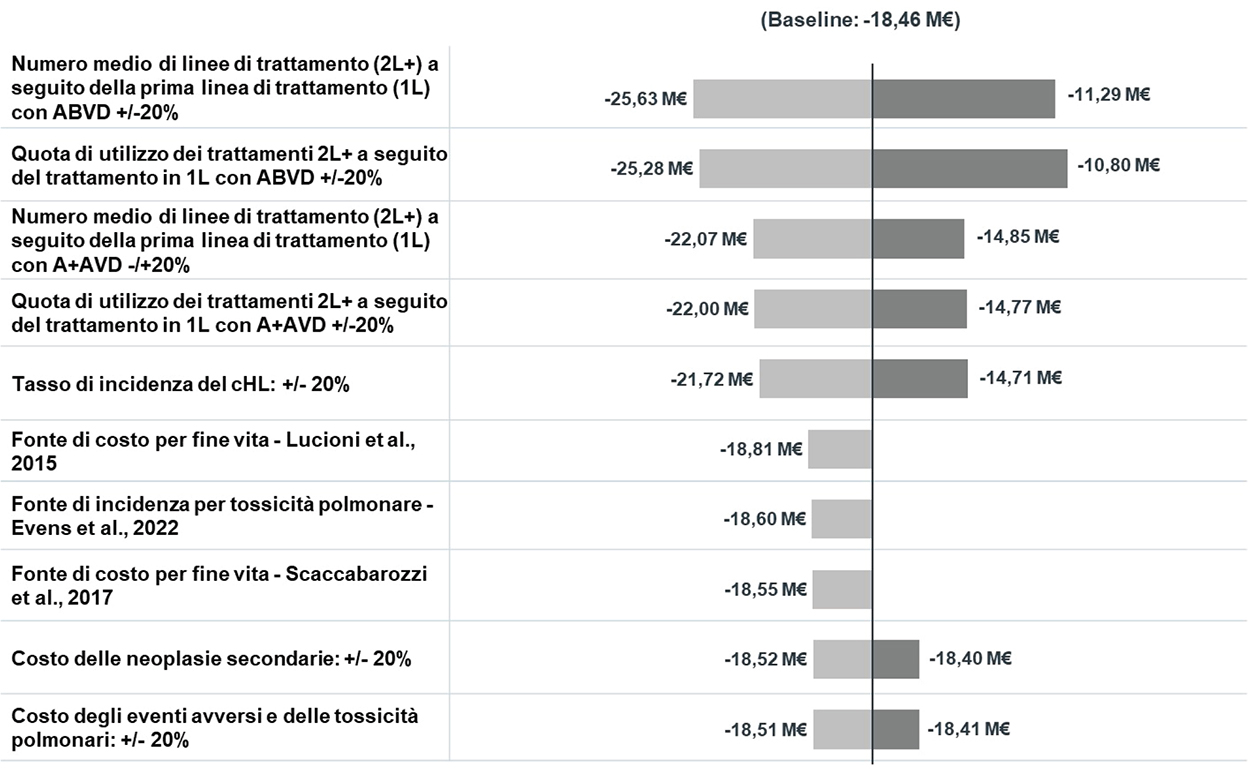
Fig. 2 - Analisi di sensibilità. SSN: Sistema Sanitario Nazionale; A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; cHL: linfoma di Hodgkin classico; 2L+: seconda linea e successive (18,43,44).
Discussione
I risultati dello studio clinico ECHELON-1 hanno dimostrato che A+AVD in 1L per il trattamento del cHL in stadio III/IV è efficace in termini di PFS (7-9) e OS (7,9) e hanno evidenziato la diminuzione dell’incidenza di tossicità polmonare (7) e neoplasie secondarie (8,9), mantenendo un profilo di sicurezza in termini di AE controllabile (7-9). Inoltre, uno studio US ha recentemente simulato l’impatto clinico di A+AVD su 10 anni, suggerendo come gli outcome osservati in ECHELON-1 possano tradursi in benefici nel lungo periodo (45).
La nostra analisi è la prima a stimare i costi sostenuti dal SSN per la gestione del paziente affetto da cHL in stadio III/IV nel contesto italiano, studiando l’impatto economico dell’introduzione di A+AVD su AE, tossicità polmonare, neoplasie secondarie e fine vita a seguito dei trattamenti di 1L e aggiornando i costi dei trattamenti di 2L+ (10) sulla base dei dati del follow-up a 6 anni dello studio clinico (9): i risultati hanno evidenziato che il beneficio dell’introduzione di A+AVD non è solo clinico, ma anche economico. In particolare, il nostro studio ha stimato un impatto di costo di A+AVD nei trattamenti di 2L+ pari a circa 10.000 €/paziente, leggermente più basso rispetto a Fiorentino et al. 2023 (10) a causa di una quota inferiore di utilizzo di trattamenti di 2L+ nel braccio A+AVD nel follow-up a 5 anni (8) rispetto al follow-up a 6 anni (9) (20,4% versus 23,8%). Considerando l’impatto sull’acquisizione dei trattamenti di 2L+ congiuntamente alla gestione degli eventi associati al trattamento di 1L, l’introduzione di A+AVD in Italia è stimata essere associata a un risparmio per il SSN pari a circa 18,46 M € in 6 anni. Tale risultato riesce a cogliere, grazie all’utilizzo di un orizzonte temporale coerente con il più recente aggiornamento dello studio clinico ECHELON-1 (9), l’impatto economico di medio-lungo termine dell’introduzione di A+AVD, che permette un risparmio crescente per il SSN italiano, da 2,00 M € l’anno 1 a 3,50 M € l’anno 6.
Inoltre le analisi di sensibilità effettuate hanno evidenziando che l’utilizzo di A+AVD in 1L comporterebbe una diminuzione dei costi per il SSN, variabile tra –25,63 M € e –11,29 M €. Si ritiene peraltro che la stima del risparmio sia conservativa. Modificando alcune fonti utilizzate, specialmente relative agli input di costo (18,44), l’impatto economico per il SSN diminuirebbe ulteriormente, probabilmente a causa della sottostima dei costi basati sui tariffari nazionali (25,46,47). Inoltre, lo studio non include una stima dei costi sostenuti dalla società, quali le possibili perdite di produttività date dall’assenteismo e dalla minore partecipazione al mercato del lavoro, in quanto l’obiettivo dell’analisi è stimare i costi diretti sostenuti dal SSN. Ci si aspetta, con l’inclusione dei costi indiretti, un aumento della stima del risparmio, sottolineando ulteriormente il burden economico della patologia, come mostrato in un recente studio US basato su ECHELON-1 relativo all’impatto della mortalità sulla produttività nel cHL in stadio III/IV (48).
Nonostante le analisi aggiuntive e la conservatività dei risultati, il nostro studio presenta alcune limitazioni.
Innanzitutto, i dati utilizzati potrebbero non riflettere completamente la pratica clinica e il contesto italiano. Tuttavia, la fonte principale dei dati clinici del modello è uno studio clinico di fase III, multicentrico, randomizzato, open-label (7-9) e le fonti principali di costo sono i tariffari nazionali e la letteratura italiana più recente e sono quindi ritenute le fonti più solide attualmente disponibili.
In secondo luogo, la stima di alcuni costi è basata sulle tariffe nazionali in vigore nel 2022 ma non più aggiornate dal 2013 (14,15) e queste tariffe potrebbero non riflettere i costi reali (25,46,47). Questa rappresenta tuttavia la metodologia standard per gli studi di costo (49) e, inoltre, sono state effettuate varie analisi di sensibilità relative alle voci di costo per valutare la solidità dei risultati.
In conclusione, al meglio della nostra conoscenza, questo studio contribuisce in modo originale alla letteratura, studiando i vantaggi economici legati alla gestione degli eventi conseguenti alla 1L di trattamento e all’acquisto dei trattamenti di 2L+ derivanti dall’introduzione in 1L di A+AVD per il trattamento del cHL in stadio III/IV. Riteniamo che questa analisi possa costituire un valido punto di partenza per ricerche future e per stimare i costi totali associati al cHL, includendo ulteriori costi rilevanti, quali per esempio l’acquisizione dei trattamenti di 1L e i costi indiretti.
Disclosures
Conflict of interest: At the time of the start of the project and the drafting of the manuscript, CV, BC, FF were employees of IQVIA Italia, a company that receives professional service commissions from a large number of sponsors for a variety of activities in the biopharmaceutical sector, including Takeda Pharmaceutical Company Limited. PM, SR, LF are employees of Takeda Italia S.p.A.
Financial support: This study received financial support by Takeda Pharmaceutical Company Ltd.
Bibliografia
- 1. Opinto G, Agostinelli C, Ciavarella S, Guarini A, Maiorano E, Ingravallo G. Hodgkin Lymphoma: A Special Microenvironment. J Clin Med. 2021;10(20):4665. CrossRef PubMed
- 2. AIRTUM Working Group. I numeri del cancro in Italia – Rapporto 2021. Online (Accessed September 2022)
- 3. Luminari S, Cesaretti M, Rashid I, et al. Incidence, clinical characteristics and survival of malignant lymphomas: a population-based study from a cancer registry in northern Italy. Hematol Oncol. 2007;25(4):189-197. CrossRef PubMed
- 4. Brice P, de Kerviler E, Friedberg JW. Classical Hodgkin lymphoma. Lancet. 2021;398(10310):1518-1527. CrossRef PubMed
- 5. Gazzetta Ufficiale della Repubblica Italiana: GU Serie Generale n.223 del 17-09-2021. Online (Accessed September 2022)
- 6. AIOM. Linee guida linfomi – Edizione 2018. Online (Accessed September 2022)
- 7. Connors JM, Jurczak W, Straus DJ, et al; ECHELON-1 Study Group. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2018;378(4):331-344. CrossRef PubMed
- 8. Straus DJ, Długosz-Danecka M, Connors JM, et al. Brentuximab vedotin with chemotherapy for stage III or IV classical Hodgkin lymphoma (ECHELON-1): 5-year update of an international, open-label, randomised, phase 3 trial. Lancet Haematol. 2021;8(6):e410-e421. CrossRef PubMed
- 9. Ansell SM, Radford J, Connors JM, et al; ECHELON-1 Study Group. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2022;387(4):310-320. CrossRef PubMed
- 10. Fiorentino F, Canali B, Morelli P, Demma F. Brentuximab vedotin in combination with doxorubicin, vinblastine and dacarbazine for first-line treatment of stage IV HL: cost impact on subsequent lines in Italy. AboutOpen. 2023;10:6-12. CrossRef
- 11. Adcetris EMA. Riassunto delle caratteristiche del prodotto. Online. (Accessed September 2022)
- 12. Carlson JJ, Canestaro W, Ravelo A, Wong W. The cost-effectiveness of alectinib in anaplastic lymphoma kinase-positive (ALK+) advanced NSCLC previously treated with crizotinib. J Med Econ. 2017;20(7):671-677. CrossRef PubMed
- 13. Clinical trial NCT04981899. Online (Accessed September 2022)
- 14. Prestazioni di assistenza specialistica ambulatoriale, 2013. Gazzetta Ufficiale della Repubblica Italiana: GU Serie Generale n.23 del 28-01-2013. Online (Accessed September 2022)
- 15. Tariffe delle prestazioni di assistenza ospedaliera per acuti, 2013. Gazzetta Ufficiale della Repubblica Italiana: GU Serie Generale n.23 del 28-01-2013. Online (Accessed September 2022)
- 16. Armeni P, Borsoi L, Fornaro G, Jommi C, Grossi F, Costa F. Cost-effectiveness and Net Monetary Benefit of Durvalumab Consolidation Therapy Versus No Consolidation Therapy After Chemoradiotherapy in Stage III Non-small Cell Lung Cancer in the Italian National Health Service. Clin Ther. 2020;42(5):830-847. CrossRef PubMed
- 17. Favaretto A, Grossi F, Morabito A, Ravasio R. Costs of adverse events associated with afatinib, erlotinib, and gefitinib first-line therapies in advanced non-small-cell lung cancer harboring EGFR-activating mutations: Il Costo Degli Eventi Avversi Associati ad Afatinib, Erlotinib e Gefitinib Nel Trattamento del Tumore del Polmone non a Piccole Cellule con Mutazione EGFR. Glob Reg Health Technol Assess 2017;4(1):grhta.5000270. CrossRef
- 18. Lucioni C, Iannazzo S, Mazzi S, Saporiti G, Chiroli S. Cost-effectiveness of ponatinib in chronic myeloid leukemia in Italy: Valutazione di costo-efficacia di ponatinib nella terapia della leucemia mieloide cronica in Italia. Glob Reg Health Technol Assess 2015;2(1). CrossRef
- 19. Altini M, Solinas L, Bucchi L, et al. Assessment of Cancer Care Costs in Disease-Specific Cancer Care Pathways. Int J Environ Res Public Health. 2020;17(13):4765. CrossRef PubMed
- 20. Francisci S, Guzzinati S, Capodaglio G, et al. Patterns of care and cost profiles of women with breast cancer in Italy: EPICOST study based on real world data. Eur J Health Econ. 2020;21(7):1003-1013. CrossRef PubMed
- 21. Hofmarcher T, Lindgren P, Wilking N, Jönsson B. The cost of cancer in Europe 2018. Eur J Cancer. 2020;129:41-49. CrossRef PubMed
- 22. Capri S, Russo A. Cost of breast cancer based on real-world data: a cancer registry study in Italy. BMC Health Serv Res. 2017;17(1):84. CrossRef PubMed
- 23. Gerace C, Montorsi F, Tambaro R, et al. Cost of illness of urothelial bladder cancer in Italy. Clinicoecon Outcomes Res. 2017;9:433-442. CrossRef PubMed
- 24. Leal J, Luengo-Fernandez R, Sullivan R, Witjes JA. Economic Burden of Bladder Cancer Across the European Union. Eur Urol. 2016;69(3):438-447. CrossRef PubMed
- 25. Filetti S, Ladenson PW, Biffoni M, D’Ambrosio MG, Giacomelli L, Lopatriello S. The true cost of thyroid surgery determined by a micro-costing approach. Endocrine. 2017;55(2):519-529. CrossRef PubMed
- 26. Luengo-Fernandez R, Leal J, Gray A, Sullivan R. Economic burden of cancer across the European Union: a population-based cost analysis. Lancet Oncol. 2013;14(12):1165-1174. CrossRef PubMed
- 27. Maio M, Ascierto P, Testori A, et al. The cost of unresectable stage III or stage IV melanoma in Italy. J Exp Clin Cancer Res. 2012;31(1):91. CrossRef PubMed
- 28. Roehrborn CG, Black LK. The economic burden of prostate cancer. BJU Int. 2011;108(6):806-813. CrossRef PubMed
- 29. AIRTUM. Registro Clinico Nazionale del Melanoma, 2012. 2012. Online (Accessed September 2022)
- 30. Rivaluta. Rivalutazioni e documentazione su prezzi, costo e retribuzioni contrattuali. ISTAT 2022. Online (Accessed January 2022)
- 31. Undicesimo rapporto sulla condizione assistenziale dei malati oncologici.2019. Online (Accessed January 2022)
- 32. Tredicesimo rapporto sulla condizione assistenziale dei malati oncologici. 2021. Online (Accessed January 2022)
- 33. Rapporto a cura del Ministero della Salute. Disposizioni per garantire l’accesso alle cure palliative e alla terapia del dolore. 2015. Online (Accessed January 2022)
- 34. La riforma delle cure palliative in Lombardia 04-11-2017. DGR 5918/2016 Regione Lombardia. Online (Accessed September 2022)
- 35. Sistema tariffario per le cure domiciliari. Deliberazione della giunta regionale n. 1561 24-09-2018 Emilia-Romagna. Online (Accessed September 2022)
- 36. Tariffa per le cure palliative (hospice). Giunta regionale delibera num. 613 del 03/05/2021 della regione Emilia-Romagna. Online (Accessed September 2022)
- 37. Sistema di tariffe per cure domiciliari. Decreto commissariale n. 1 del 07.01.2013 della Regione Campania. Online (Accessed September 2022)
- 38. Tariffa per le cure palliative (hospice). Deliberazione Giunta Regionale n. 586 del 21/11/2019 della regione Campania. Online (Accessed September 2022)
- 39. IQVIA dati di vendita. MAT Febbraio 2022.
- 40. Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010;363(19):1812-1821. CrossRef PubMed
- 41. Takeda data on file.
- 42. Collins GP, Rueda A, Salles G, von Tresckow B, Zaja F. Management of Hodgkin lymphoma in the era of brentuximab vedotin: real-world data from five European countries. Leuk Lymphoma. 2018;59(9):2113-2120. CrossRef PubMed
- 43. Evens AM, Connors JM, Younes A, et al. Older patients (aged ≥60 years) with previously untreated advanced-stage classical Hodgkin lymphoma: a detailed analysis from the phase III ECHELON-1 study. Haematologica. 2022;107(5):1086-1094. CrossRef PubMed
- 44. Scaccabarozzi G, Limonta F, Amodio E. Hospital, local palliative care network and public health: how do they involve terminally ill patients? Eur J Public Health. 2017 Feb 1;27(1):25-30. CrossRef PubMed
- 45. Phillips T, Migliaccio-Walle K, Yu KS, et al. Estimating long-term outcomes in classic Hodgkin lymphoma: a United States population-based oncology simulation model based on overall survival from the ECHELON-1 trial. Leuk Lymphoma. 2023;64(5):1017-1025. CrossRef PubMed
- 46. Berto P, Lopatriello S, Aiello A, et al. Cost of laparoscopy and laparotomy in the surgical treatment of colorectal cancer. Surg Endosc. 2012;26(5):1444-1453. CrossRef PubMed
- 47. Palmieri V, Baldi C, Di Blasi PE, et al. Impact of DRG billing system on health budget consumption in percutaneous treatment of mitral valve regurgitation in heart failure. J Med Econ. 2015;18(2):89-95. CrossRef PubMed
- 48. Phillips TJ, Liu N, Bloudek B, Migliaccio-Walle K, Reynolds J, Burke JM. 10-Year impact on productivity costs associated with mortality in stage III or IV classical Hodgkin lymphoma based on the overall survival update of the ECHELON-1 Trial: application of an oncology simulation model in the United States. Blood. 2022;140(suppl 1):10791-10792. Online CrossRef
- 49. Tarricone R. Cost-of-illness analysis. What room in health economics? Health Policy. 2006;77(1):51-63. CrossRef PubMed