 |
AboutOpen | 2023; 10: 82-86 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2600 CORRESPONDENCE |
 |
Comments to “Cost per responder for vedolizumab and ustekinumab in Crohn’s disease patients after failure of TNF-α inhibitors in Italy”
Received: April 21, 2023
Accepted: May 11, 2023
Published online: June 5, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
L’articolo “Costo per responder di vedolizumab e ustekinumab nel trattamento della malattia di Crohn in pazienti che hanno fallito una precedente terapia con un antagonista del TNF-α in Italia” (1), recentemente pubblicato sulla Vostra rivista, secondo il nostro parere non descrive la realtà italiana nel suo complesso, ma, piuttosto, fotografa una situazione particolare, poiché lo scenario rappresentato sulla scorta degli input selezionati dagli Autori ha natura eccezionale per tutte le ragioni che di seguito andremo a delineare.
Con la presente desideriamo, quindi, evidenziare i seguenti punti a supporto di quanto sopra.
1. Utilizzo dello studio RWE di Onali 2022 come unica fonte clinica
Ravasio e colleghi calcolano il cost per responder (CPR) considerando il rischio relativo di remissione stimato da un unico studio osservazionale di Onali et al. (2) che confronta VDZ e UST in una popolazione di pazienti con malattia di Crohn (CD) dopo fallimento con un inibitore del TNF-α. Riteniamo che tale scelta sia metodologicamente poco difendibile per varie ragioni.
a. I risultati di Onali et al. (2) andrebbero considerati nel complesso delle evidenze comparative disponibili, come da consolidata prassi dell’evidence-based medicine: almeno altri 3 studi RWE di alta qualità confrontano VDZ e UST nella CD (3,4,5), di cui due già precedentemente meta-analizzati da Parrot et al. (6). Tale meta-analisi indica una netta superiorità di UST, senza eterogeneità (0%, Fig. 1a). Se si considerano nel pool di dati anche i risultati delle due coorti di pazienti con fallimento di anti-TNF (MSHS e SPARC) analizzate da Ibing et al. (5), l’UST mantiene il risultato favorevole, sempre in assenza di eterogeneità (Fig. 1b).
b. Se, invece, si includono anche i dati di Onali et al. (2), il trend rimane a favore di UST; tuttavia, si perdono significatività statistica e omogeneità (Fig. 1c), il che conferma la peculiarità dei risultati del suddetto studio, già evidenziata dagli stessi Autori: cit. (Onali 2022) “In the attempt to interpret our results, we compared UST and VDZ response rates with those reported in the aforementioned studies. Remission and response to UST were in line with those previously reported, whereas VDZ rates were higher… reflecting a population with less refractory disease and potentially better response to VDZ”.
c. Dal punto di vista formale, inoltre, lo studio di Onali et al. (2) ha fallito l’obiettivo primario di dimostrare differenze su outcome oggettivi (“a recent meta-analysis showed no difference in steroid-free remission between UST and VDZ at the end of the induction, while UST proved to be superior after 1 year of treatment… However, no comparative data using objective outcomes have been reported. To address this issue, we performed a retrospective, multicenter, real-world study comparing the effectiveness of UST and VDZ in patients with active CD in which 1 or more TNFi failed”). Le conclusioni di Onali et al. (2) infatti recitano: “However, no difference was observed between the 2 groups when objective outcomes were investigated at this time point (1 anno)”.
d. Un altro spunto di riflessione è relativo all’intervallo tra l’ingresso sul mercato italiano di UST e la raccolta dati (gennaio 2016 - dicembre 2020) dello studio di Onali et al. (2): UST è disponibile in Italia da agosto 2018 ed è pertanto ragionevole ipotizzare che i dati di risposta a UST siano in maggioranza riferiti a pazienti “più difficili”, in cui il farmaco è stato utilizzato come ultima risorsa al fallimento delle terapie disponibili per mancanza di alternative. La situazione per VDZ era differente: rimborsato dall’aprile 2016, già introdotto nell’algoritmo terapeutico e, come evidenziato da Onali et al. (2), somministrato a pazienti meno refrattari alla malattia e probabilmente più responsivi al farmaco stesso.
Alla luce di queste considerazioni, abbiamo sviluppato ulteriori studi al fine di riportare un’analisi più generale della situazione, che includa anche i dati clinici comparativi presentati nei diversi scenari, di seguito illustrati (Fig. 1): il solo studio Onali (2), Parrot (6), il pool di Parrot (6) e Onali (2) (forest plot non riportato; Odds Ratio UST vs VDZ 1,22), tutti gli studi, tutti gli studi eccetto Onali (2).
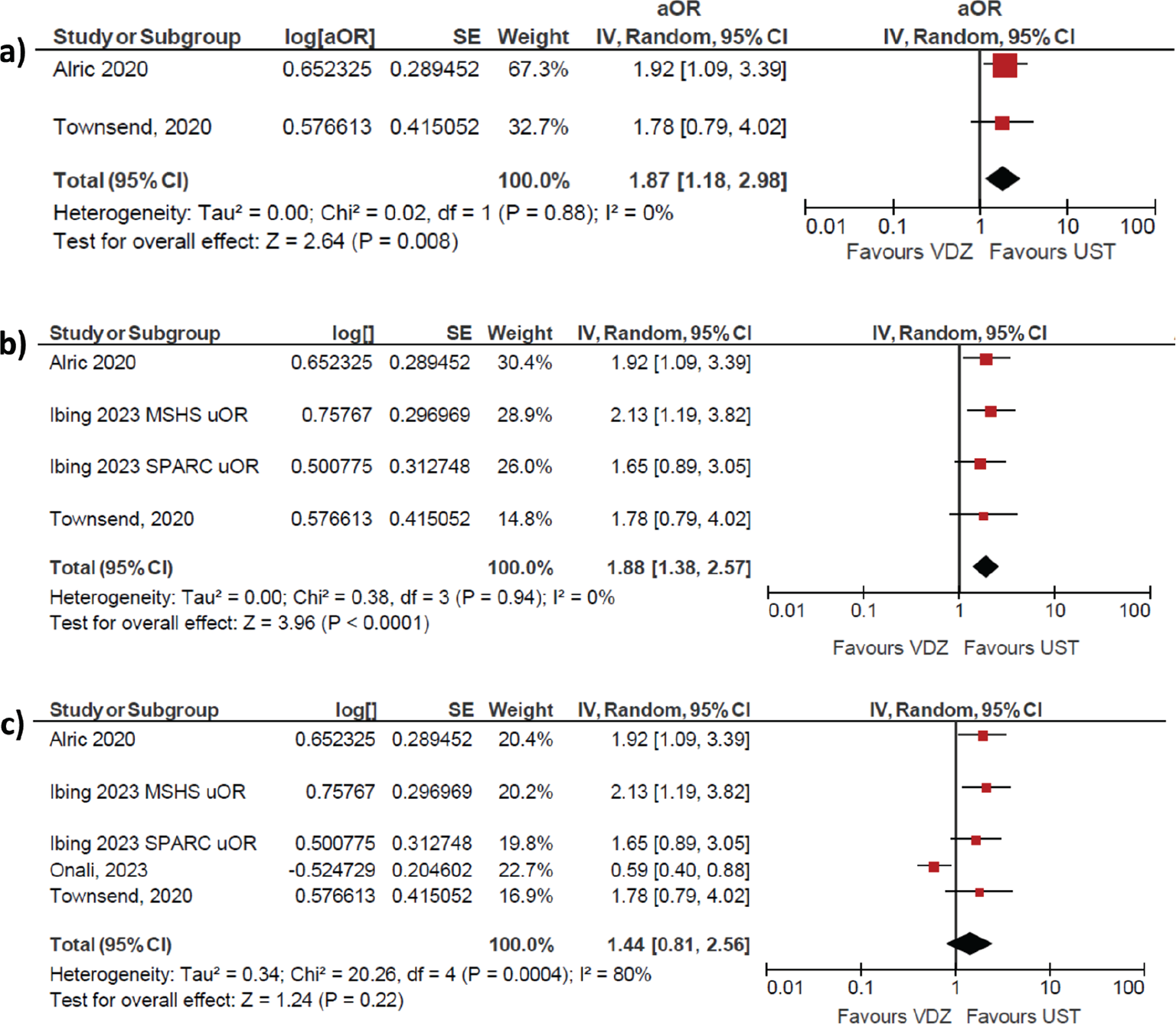
Fig. 1 - Remissione clinica a 52 settimane, come da Parrot et al. (a), con tutti gli studi selezionati, incluso Onali 2022 (b) con tutti gli studi selezionati, escluso Onali 2022 (c).
2. La dose escalation non rispecchia la pratica clinica
a. Nello scenario base, il CPR è stato calcolato esclusivamente sui dosaggi base riportati in RCP al primo anno (UST ha un’induzione più impattante sui costi di VDZ).
b. La percentuale di dose escalation è stata impostata uguale a 0 nello scenario base, dal momento che i tassi emersi in Onali (2) non erano differenziali (22,4% per UST e 22,2% per VDZ); tuttavia la riduzione dell’intervallo di somministrazione da ogni 12 a ogni 8 settimane di UST è meno impattante dal punto di vista economico rispetto al dimezzamento dell’intervallo a carico di VDZ da 8 a 4 settimane. Per tale ragione il tasso di escalation di Onali 2022, anche se simile come percentuale, risulta essere differenziante tra i due farmaci dal punto di vista economico e pertanto andrebbe considerato come una variabile nello scenario base.
c. La percentuale di dose escalation riportata da Onali (2) (22,4% per UST e 22,2% per VDZ) è stata utilizzata nell’articolo di Ravasio et al. come analisi di sensibilità. Questo scenario “alternativo”, pur essendo più ragionevole, sembra ancora piuttosto distante dalla real-practice.
d. Una revisione sistematica di studi RW che hanno riportato il tasso di dose escalation di vari farmaci biologici nel trattamento della CD ha identificato un tasso medio di dose escalation pari al 35% nelle popolazioni con almeno il 50% dei pazienti in seconda linea biologica (7,8,9,10,11,12,13), ovvero la popolazione considerata da Onali et al. (2).
e. Negli studi interventistici, il tasso di dose escalation risulta ancora maggiore, raggiungendo il 58% per UST (elaborato dallo studio IM-UNITI) e il 59% per VDZ (elaborato da GEMINI II).
f. Pertanto, riteniamo opportuno ripetere le analisi considerando anche la dose escalation emersa dagli studi RW (Tab. I), oltre allo scenario che Ravasio et al. hanno impostato.
g. Per UST è stato selezionato lo studio condotto da Iborra et al.; questa è una scelta conservativa: lo studio di Liefferinckx et al. (8) riporta infatti un tasso di dose escalation inspiegabilmente basso.
h. Per VDZ abbiamo presentiamo due scenari: uno basato su Amiot (10), unico studio con numerosità campionaria accettabile e percentuale paragonabile di pazienti con fallimento di anti-TNF, e l’altro su Pugliese (14) che, a fronte di una coorte più numerosa, ha una percentuale di bio-naive molto maggiore rispetto agli studi considerati per UST (la linea di trattamento è una variabile associata alla dose escalation (15,16,17), come confermato anche dall’analisi univariata presentata nella revisione citata sopra.
| Farmaco | Fonte | Bio-experienced/bio-naive | N. pazienti | Tasso di escalation |
|---|---|---|---|---|
| UST | Liefferinckx 2019 | 99,3%/0,7% | 152 | 6,6% |
| Iborra 2020 | 96%/4% | 407 | 28,0% | |
| VDZ | Amiot 2017 | 100%/0% | 173 | 59,5% |
| Pugliese 2020 | 19%/81% | 487 | 24,3% | |
| Iborra 2018 | 100%/0% | 30 | 50,0% |
L’impatto delle possibili combinazioni degli input fin qui discussi sul confronto del costo per paziente in remissione con VDZ vs UST è riassunto nella Tabella II: consideriamo tre livelli di dose escalation (No dose escalation, Dose escalation da RW con simili tassi di pazienti anti-TNF failure e Dose escalation da RW con numerosità maggiore) e 5 diversi OR di remissione.
Le varie combinazioni di input clinici sono valutate rispetto ai costi di terapia calcolati sulla base dei prezzi ex-factory al netto delle riduzioni di legge (rdl) nello scenario base e a 4 livelli indipendenti di ipotesi di sconti negoziali confidenziali (0%, 10%, 20% e 30%) (Tab. II).
Infine, in ultima colonna, sono riportati gli esiti dei confronti quando il costo annuale considerato è quello stimato da una recente analisi real-world (18) condotta a livello italiano (18.175 € per VDZ e 17.270 € per UST, comprensivo di costi farmaceutici, ospedalieri e specialistici). La Figura 2 presenta il risultato di questa sottoanalisi (base clinica: tutti gli studi, come il caso base).
Nella Tabella II, il colore blu indica un minor CPR per UST rispetto a VDZ; il colore grigio che indica le zone di confronto è favorevole a VDZ. La cella con trama a righe orizzontali individua il caso preso come riferimento da Ravasio et al. (differenza a favore di VDZ di circa 17.500 € per paziente in remissione); la cella con trama a righe verticali rappresenta invece il caso base da noi proposto (CPR di 69.466 € e 50.571 €, per VDZ e UST, rispettivamente, differenza a favore di UST di quasi 19.000 euro), illustrato anche nella Figura 2.
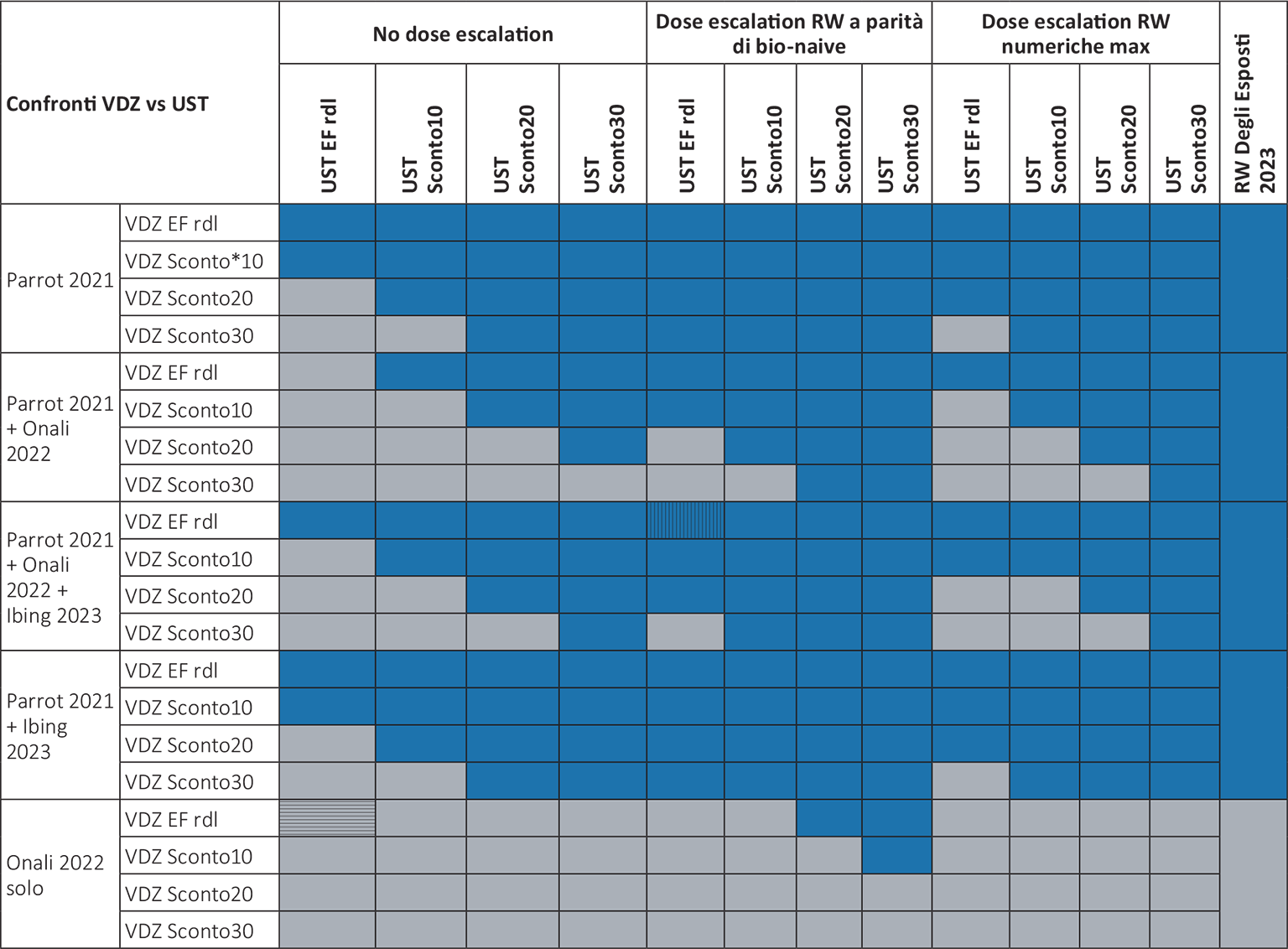
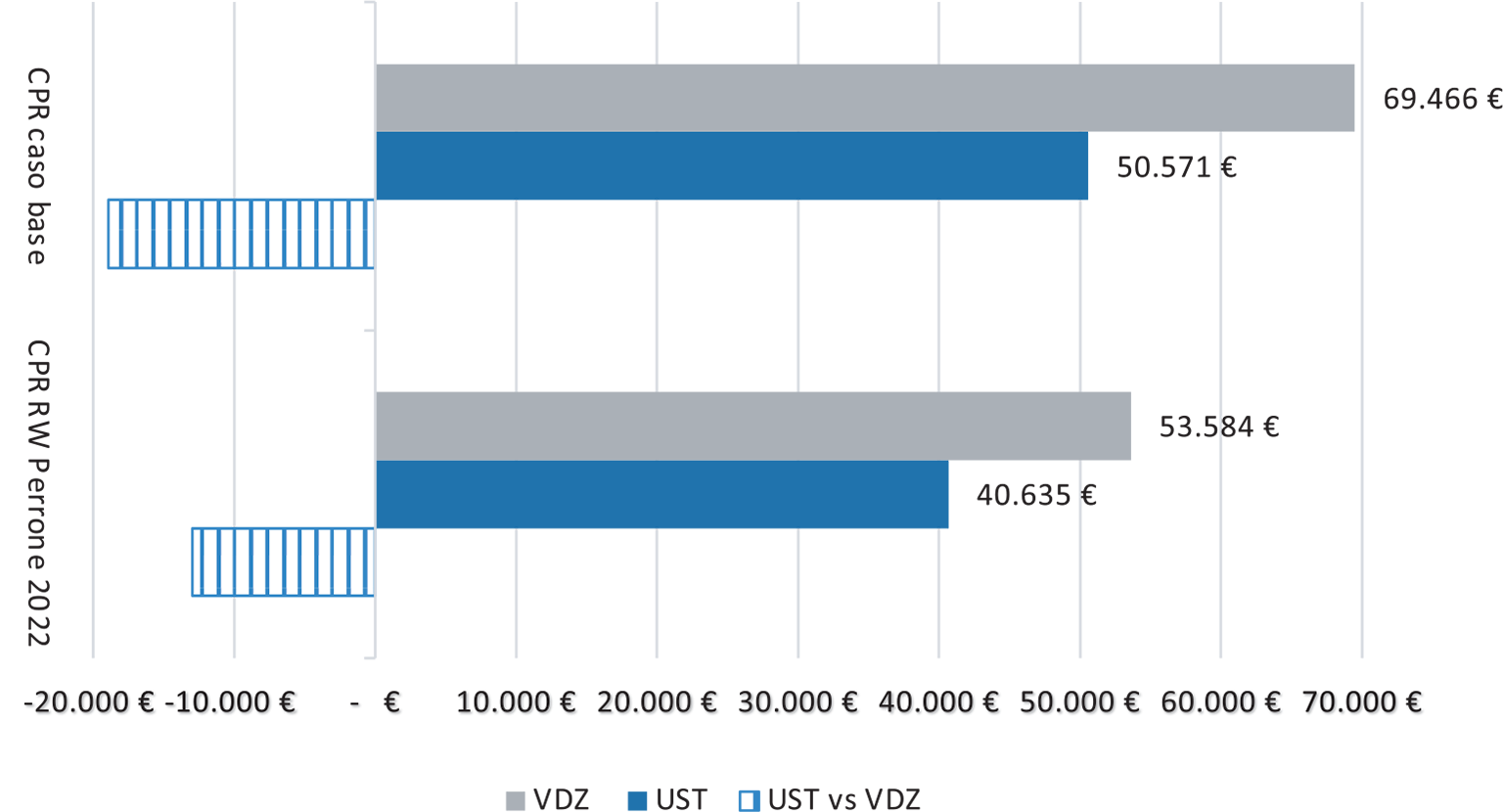
Fig. 2 - CPR nel caso base e nello scenario con i costi RW (Degli Esposti et al. 2023).
Dato che il tasso di dose escalation appare come il parametro gravato da maggiore incertezza, riportiamo le stesse stime con un tasso pari a quello dello scenario RW con numerosità massima, trascurando il bias a carico di VDZ sull’elevata percentuale di bio-naive: anche in questo caso la differenza continua a essere a favore di UST, con un CPR inferiore di 6.200 € vs VDZ.
In conclusione, riteniamo che lo scenario di confronto presentato da Ravasio et al. (1) sia relativo a una situazione molto particolare. Anche se possibile nell’ambito della variabilità di pazienti e situazioni riscontrabili nella pratica clinica, tuttavia, lo studio pubblicato secondo la nostra opinione non può essere considerato generalizzabile alla realtà italiana nel complesso. Affinché le analisi di efficienza allocativa possano essere effettivamente utili a un decisore di spesa sanitaria, esse devono valutare scenari credibili e valutarne l’incertezza. In netto contrasto con le conclusioni di Ravasio et al., le simulazioni che presentiamo indicano con chiarezza che il quadro complessivo delle informazioni disponibili indirizzi verso la scelta di UST per i pazienti con CD dopo fallimento di un anti-TNF-α, in quanto più costo efficace di VDZ nella maggior parte delle possibili realtà nazionali.
Disclosures
Conflict of interest: The Authors declare to be employees of Janssen-Cilag SpA.
Financial support: This paper received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Authors contribution: All authors contributed equally to this manuscript.
Bibliografia
- 1. Ravasio R, Viti R, Roscini SA. Costo per responder di vedolizumab e ustekinumab nel trattamento della malattia di Crohn in pazienti che hanno fallito una precedente terapia con un antagonista del TNF-α in Italia. AboutOpen | 2023; 10: 13-21. CrossRef
- 2. Onali S, Pugliese D, Caprioli FA, et al; IG-IBD. An Objective Comparison of Vedolizumab and Ustekinumab Effectiveness in Crohn’s Disease Patients’ Failure to TNF-Alpha Inhibitors. Am J Gastroenterol. 2022;117(8):1279-1287. CrossRef PubMed
- 3. Alric H, Amiot A, Kirchgesner J, et al. The effectiveness of either ustekinumab or vedolizumab in 239 patients with Crohn’s disease refractory to anti-tumour necrosis factor. Aliment Pharmacol Ther. 2020;51(10):948-957. CrossRef PubMed
- 4. Townsend T, Razanskaite V, Dodd S, et al. Comparative effectiveness of ustekinumab or vedolizumab after one year in 130 patients with anti-TNF-refractory Crohn’s disease. Aliment Pharmacol Ther. 2020;52(8):1341-1352. CrossRef PubMed
- 5. Ibing S, Cho JH, Böttinger EP, Ungaro RC. Second-Line Biologic Therapy Following Tumor Necrosis Factor Antagonist Failure: A Real-World Propensity Score-Weighted Analysis. Clin Gastroenterol Hepatol. 2023 Feb 12:S1542-3565(23)00105. CrossRef PubMed
- 6. Parrot L, Dong C, Carbonnel F, Meyer A. Systematic review with meta-analysis: the effectiveness of either ustekinumab or vedolizumab in patients with Crohn’s disease refractory to anti-tumour necrosis factor. Aliment Pharmacol Ther. 2022;55(4):380-388. CrossRef PubMed
- 7. Macaluso FS, Fries W, Privitera AC, et al; Sicilian Network for Inflammatory Bowel Diseases [SN-IBD]. A Propensity Score-matched Comparison of Infliximab and Adalimumab in Tumour Necrosis Factor-α Inhibitor-naïve and Non-naïve Patients With Crohn’s Disease: Real-Life Data From the Sicilian Network for Inflammatory Bowel Disease. J Crohn’s Colitis. 2019;13(2):209-217. CrossRef PubMed
- 8. Liefferinckx C, Verstockt B, Gils A, et al; Belgian Inflammatory Bowel Disease Research and Development Group [BIRD group]. Long-term Clinical Effectiveness of Ustekinumab in Patients with Crohn’s Disease Who Failed Biologic Therapies: A National Cohort Study. J Crohn’s Colitis. 2019;13(11):1401-1409. CrossRef PubMed
- 9. Iborra M, Beltrán B, Fernández-Clotet A, et al; GETECCU group (Grupo Español de trabajo de Enfermedades de Crohn y Colitis Ulcerosa). Real-world long-term effectiveness of ustekinumab in Crohn’s disease: results from the ENEIDA registry. Aliment Pharmacol Ther. 2020;52(6):1017-1030. CrossRef PubMed
- 10. Amiot A, Serrero M, Peyrin-Biroulet L, et al; OBSERV-IBD study group and the GETAID. One-year effectiveness and safety of vedolizumab therapy for inflammatory bowel disease: a prospective multicentre cohort study. Aliment Pharmacol Ther. 2017;46(3):310-321. CrossRef PubMed
- 11. Iborra M, Beltrán B, Maroto N, et al. Vedolizumab, an option in patients with inflammatory bowel disease intolerant to thiopurines and refractory to biological agents. Gastroenterol Hepatol. 2018 Nov;41(9):535-543. CrossRef PubMed
- 12. Peeters H, Louis E, Baert F, et al. Efficacy of switching to infliximab in patients with Crohn’s disease with loss of response to adalimumab. Acta Gastroenterol Belg. 2018;81(1):15-21. PubMed
- 13. Plevris N, Jones GR, Jenkinson PW, et al. Implementation of CT-P13 via a Managed Switch Programme in Crohn’s Disease: 12-Month Real-World Outcomes. Dig Dis Sci. 2019;64(6):1660-1667. CrossRef PubMed
- 14. Pugliese D, Privitera G, Armuzzi A; LIVE IG-IBD study group. Italian real-life study evaluating the long-term effectiveness of vedolizumab for the treatment of inflammatory bowel disease: the elderly cohor. Poster presentations: Clinical: Therapy and Observation 2020. European Crohn’s and Colitis Organisation; 2020:477.
- 15. Sah J, Teeple A, Muser E, Gutierrez C, Dassopoulos T. Treatment persistence and maintenance dose titration among ulcerative colitis patients on biologics: a pooled study of three United States claim databases. Curr Med Res Opin. 2022;38(7):1093-1101. CrossRef PubMed
- 16. Taxonera C, Rodríguez C, Bertoletti F, et al; Collaborators. Clinical Outcomes of Golimumab as First, Second or Third Anti-TNF Agent in Patients with Moderate-to-Severe Ulcerative Colitis. Inflamm Bowel Dis. 2017;23(8):1394-1402. CrossRef PubMed
- 17. Baert F, Glorieus E, Reenaers C, et al; BIRD (Belgian IBD Research and Development). Adalimumab dose escalation and dose de-escalation success rate and predictors in a large national cohort of Crohn’s patients. J Crohn’s Colitis. 2013;7(2):154-160. CrossRef PubMed
- 18. Degli Esposti L, Daperno M, Dovizio M, et al. A retrospective analysis of treatment patterns, drug discontinuation and healthcare costs in Crohn’s disease patients treated with biologics. Dig Liver Dis. 2023;S1590-8658(23)00568-6. CrossRef PubMed