 |
AboutOpen | 2023; 10: 69-77 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2584 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di minimizzazione dei costi di HYQVIA® nel trattamento dell’immunodeficienza primaria (PID) e secondaria (SID) in Italia
Cost-minimization analysis of HYQVIA® in the treatment of primary immunodeficiency disease (PID) and secondary immunodeficiency disease (SID) in Italy
Background: Primary (PID) or secondary (SID) immunodeficiencies are diseases caused by quantitative and/or functional alterations of the different mechanisms involved in the innate and adaptive immune response. This economic evaluation was conducted to compare the cost of treatment of HYQVIA® (hyaluronidase-facilitated subcutaneous infusion of immunoglobulin, fSCIG) compared to intravenous immunoglobulin (IVIG) or subcutaneous immunoglobulin (SCIG), currently reimbursed in Italy, in the treatment of PIDs or SIDs.
Methods: A cost-minimisation analysis was carried out, considering the hospital’s perspective. The direct medical costs (cost of immunoglobulins and cost of administration) were assessed. The analysis was conducted considering one year (52 weeks) time horizon. The reference population included adult patients with PID with impaired antibody production or adult patients with SID with severe or recurrent infections, ineffective antimicrobial treatment and documented specific antibody defect (PSAF) or serum IgG level < 4 g/L.
Results: In the maintenance treatment of PID, HYQVIA® (€ 20,020.00) was the therapeutic alternative with the lowest mean annual cost compared to HIZENTRA® (€ 22,165.19) and VENITAL® (€ 24,967.68). Moreover, in the maintenance treatment of SIDs, HYQVIA® (€ 17,160.00) was the cost-saving therapeutic alternative compared to VENITAL® (€ 22,107.68). A sensitivity analysis confirmed the base case results.
Conclusion: Due to lower costs of administration and different scheme of administration, HYQVIA® was a cost-saving alternative to SCIG e IVIG in the treatment of PID and to IVIG in the treatment of SID.
Keywords: Cost, HYQVIA®, Immunoglobulin, Primary immunodeficiency disease; Secondary immunodeficiency disease
Received: March 20, 2023
Accepted: April 12, 2023
Published online: May 2, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Le immunodeficienze (ID) sono un gruppo di malattie causate da alterazioni quantitative e/o funzionali dei diversi meccanismi coinvolti nella risposta immunitaria innata e adattativa (1,2). Sono classificate come immunodeficienze primarie (PID), se la loro origine è genetica, o secondarie (SID), se la loro origine è acquisita. Entrambe le tipologie di ID sono associate a complicazioni come infezioni, disturbi autoimmuni, disregolazione del sistema immunitario con linfoproliferazione, disturbi infiammatori, linfomi e altri tipi di cancro (2). Le PID costituiscono un gruppo eterogeneo di più di 480 malattie circa (3). Il Primary Immunodeficiencies Classification Committee of the International Union of Immunology Societies (IUIS) ha identificato 10 gruppi di PID in funzione del disturbo immunitario sottostante o del sintomo predominante; i più frequenti sono le carenze anticorpali, le sindromi ben definite e i difetti della funzione fagocitaria (3). Le SID, invece, sono il risultato dell’esposizione a diversi fattori, tra cui agenti infettivi (per esempio, HIV, EBV, CMV), farmaci (per esempio, anticorpi anti-CD20, anti-CD38, HSCT, CAR-T), neoplasie ematologiche (per esempio leucemia linfocitica cronica o mieloma multiplo) o disordini metabolici (4). Le principali manifestazioni ematologiche associate alle PID e alle SID sono le citopenie periferiche e le sindromi da carenza di anticorpi (5,6).
La terapia con immunoglobuline (IG), nota anche con il termine di “terapia sostitutiva”, è in uso da oltre sessant’anni e, grazie all’efficacia dimostrata, è ben consolidata nella pratica clinica (7). Le IG sono somministrate per via endovenosa (intravenous immunoglobulin, IVIG) o sottocutanea (subcutaneous immunoglobulin, SCIG) per tutta la vita del paziente. Sebbene ogni via di somministrazione presenti propri vantaggi e svantaggi, il trattamento con SCIG si è dimostrato efficace quanto quello con IVIG (8,9). Il trattamento con SCIG è inoltre particolarmente adatto per i pazienti con accesso venoso limitato o per quelli che cercano di ridurre il carico di cure tramite l’autosomministrazione a domicilio (7). Tuttavia, a causa del minor volume di IG che può essere infuso in un singolo sito sottocute e della minore biodisponibilità rispetto alla somministrazione per via endovenosa (IV), i trattamenti SCIG convenzionali richiedono dosaggi più frequenti (tipicamente settimanali rispetto a quelli mensili con le IVIG) e più siti di iniezione e aghi per ogni infusione (10,11).
HYQVIA® è un prodotto sostitutivo delle IG indicato per il trattamento delle ID, sviluppato per combinare i vantaggi sia della somministrazione IV che di quella SC. HYQVIA® è un’unità a doppio flaconcino costituita da un flaconcino di immunoglobulina umana normale (immunoglobulina 10% o IG 10%) e da un flaconcino di ialuronidasi umana ricombinante (rHuPH20) (12). La ialuronidasi è un enzima utilizzato per aumentare temporaneamente la permeabilità dei tessuti e il flusso dei fluidi catalizzando l’idrolisi dell’acido ialuronico (12). Pertanto, la componente ialuronidasi, somministrata SC subito prima della componente IG, consente di somministrare volumi maggiori di IG in un singolo sito SC e, quindi, di effettuare dosaggi meno frequenti rispetto ad altre SCIG (per esempio, fino a 3-4 settimane anziché settimanalmente) (12). Diversi studi hanno confermato la sicurezza e l’efficacia della ialuronidasi umana ricombinante nel facilitare l’assorbimento e la dispersione dei farmaci nei tessuti umani SC (13,14,15). Gli studi clinici di HYQVIA® (hyaluronidase-facilitated subcutaneous infusion of immunoglobulin, fSCIG) ne hanno dimostrato un elevato grado di sicurezza e di efficacia (16,17,18). Attualmente HYQVIA® è rimborsato in Italia per la terapia sostitutiva negli adulti, nei bambini e negli adolescenti di età compresa tra 0 e 18 anni per il trattamento di: i) sindromi da immunodeficienza primaria (PID) con compromissione della produzione di anticorpi e ii) immunodeficienze secondarie (SID) in pazienti con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (proven specific antibody failure, PSAF) o livello sierico di IgG < 4 g/L (19).
Obiettivo
La presente valutazione economica è stata condotta con l’obiettivo di confrontare il costo medio annuo di trattamento di HYQVIA® (fSCIG) con quello delle SCIG o delle IVIG, attualmente rimborsate in Italia, nella gestione delle PID con compromissione della produzione di anticorpi o delle SID in pazienti con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (PSAF) o livello sierico di IgG < 4 g/L.
Metodi
Tecnica di analisi e confronti
Dal momento che, sulla base di quanto riportato in letteratura (8,9,13,14,15,16,17,18), si è stabilita, indipendentemente dalla via di somministrazione (fSC, SC o IV), un’uguale efficacia delle IG nel trattamento delle PID o delle SID, è stata condotta un’analisi di minimizzazione dei costi (cost minimization analysis, CMA), focalizzando l’attenzione sui costi di trattamento.
In linea con tale obiettivo sono state condotte due sotto analisi: i) la prima riferita al trattamento di mantenimento delle PID in pazienti con infezioni severe e ii) la seconda riferita, invece, al trattamento di mantenimento delle SID in pazienti con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (PSAF) o livello sierico di IgG < 4 g/L.
Dal momento che, attualmente, per ciascuna immunoglobulina (fSCIG, SCIG e IVIG) rimborsata dal Servizio Sanitario Nazionale (SSN) è stato negoziato con l’Agenzia Italiana del Farmaco (AIFA) lo stesso prezzo ex-factory di € 55,00 per grammo di prodotto (19,20,21,22,23,24,25,26,27,28,29,30), la CMA di HYQVIA®, per una maggiore chiarezza espositiva, è stata condotta rispetto alle SCIG e alle IVIG maggiormente utilizzate (31). Così facendo, nella prima sotto analisi (PID), HYQVIA® (12) è stata confrontata con HIZENTRA® (20), che copre circa l’80% del mercato delle SCIG (31), e con VENITAL® (25), che copre invece circa il 41% del mercato delle IVIG (31). Nella seconda sotto analisi, in linea con l’indicazione al trattamento delle SID qui considerata, HYQVIA® (12) è stata invece confrontata con la sola VENITAL® (IVIG) (25). Da questo secondo confronto è stata esclusa HIZENTRA® (20) poiché non presenta la stessa indicazione rimborsata per HYQVIA® (19) e per VENITAL® (25) nel trattamento delle SID.
Prospettiva di analisi
La CMA è stata condotta considerando la prospettiva dell’ospedale. Sono stati quindi valutati i costi diretti sanitari a carico dell’ospedale, quali il costo di acquisto delle IG e il relativo costo di somministrazione.
Orizzonte temporale
Entrambe le sotto analisi sono state condotte considerando un unico orizzonte temporale di un anno, corrispondente a 52 settimane di trattamento. Si ritiene che tale arco temporale sia idoneo a rilevare eventuali differenze in termini di costo di trattamento, soprattutto in ottica di previsione e definizione del budget di spesa per l’ospedale.
Popolazione
La popolazione di riferimento considerata nella CMA è rappresentata da pazienti adulti (età ≥18 anni) affetti da PID, con compromissione della produzione di anticorpi, o da SID, con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (PSAF) o livello sierico di IgG < 4 g/L. Dal momento che, per ciascuna IG considerata, il corrispondente dosaggio di somministrazione è peso-dipendente (12,32,33), nella CMA, in accordo con quanto indicato nelle Linee Guida AIFA (34), è stato considerato per il paziente adulto un peso medio corporeo di 70 kg.
Somministrazione
Immunodeficienze primarie
La Tabella I riporta lo schema di somministrazione di HYQVIA® (12), HIZENTRA® (32) e VENITAL® (33) utilizzato per stimare il costo del trattamento di mantenimento nelle PID. Per HIZENTRA® e VENITAL®, sulla base di quanto riportato nello studio osservazionale condotto da Matucci et al. (35), è stata considerata una dose media mensile di mantenimento di 0,4 g/kg (corrispondente a 28,0 grammi/mese considerando un paziente adulto di 70 kg). Dal momento che nello studio osservazionale condotto da Matucci et al. (35) non era presente una fSCIG, nella CMA si è assunto di considerare anche per HYQVIA® la stessa dose media mensile di mantenimento di 0,4 g/kg. Sulla base dei rispettivi riassunti delle caratteristiche del prodotto (RCP) si è assunto che tale dose media mensile venga suddivisa in 4 somministrazioni mensili a intervalli settimanali (4 somministrazioni al mese) per HIZENTRA® (32) e in 1,14 somministrazioni mensili (una somministrazione ogni 3,5 settimane) per HYQVIA® (12) e per VENITAL® (33).
| Parametri | HYQVIA® | HIZENTRA® | VENITAL® |
|---|---|---|---|
| Via di somministrazione | fSC | SC | IV |
| Dose/mese* | 0,4 g/kg | 0,4 g/kg | 0,4 g/kg |
| Dose/mese paziente adulto 70 kg* | 28,0 g | 28,0 g | 28,0 g |
| N. somministrazioni/mese | 1,14 | 4,00 | 1,14 |
| Dose/anno paziente adulto 70 kg** | 364,0 g | 364,0 g | 364,00 g |
| N. somministrazioni/anno | 14,86 | 52,0 | 14,86 |
*Mese = 4 settimane; **Anno = 52 settimane.
Immunodeficienze secondarie
La Tabella II riporta lo schema di somministrazione considerato per stimare il costo del trattamento di mantenimento nelle SID di HYQVIA® (12) e VENITAL® (33). In assenza di specifici studi di confronto diretto, la dose media mensile di mantenimento è stata dedotta dai rispettivi RCP (12,33). Per entrambe le IG è stata quindi considerata una dose media mensile di 24 grammi per un paziente adulto di 70 kg (34), calcolata come media tra la dose minima (0,2 g/kg ogni 3,5 settimane) e massima (0,4 g/kg ogni 3,5 settimane), suddivisa in 1,14 somministrazioni mensili (una somministrazione ogni 3,5 settimane) (12,33).
| Parametri | HYQVIA® | VENITAL® |
|---|---|---|
| Via di somministrazione | fSC | IV |
| Dose/mese paziente adulto 70 kg* | 24,0 g | 24,0 g |
| N. somministrazioni/mese | 1,14 | 1,14 |
| Dose/anno paziente adulto 70 kg** | 312,0 g | 312,00 g |
| N. somministrazioni/anno | 14,86 | 14,86 |
*Mese = 4 settimane; **Anno = 52 settimane.
Costo di acquisizione delle immunoglobuline
Considerando quanto riportato nelle rispettive Gazzette Ufficiali (19,20,25), per ciascuna IG è stato considerato il prezzo ex-factory di € 55,00 per grammo di prodotto.
Costo somministrazione
Immunoglobuline sottocute
Sulla base della pratica clinica e di quanto indicato nello studio osservazionale di Matucci et al. (35), si è assunto che la somministrazione delle IG fSC o SC venga effettuata dal paziente o dal caregiver in ambito domiciliare, utilizzando la pompa di infusione e i materiali (deflussori, spike e siringhe) necessari per ogni singola infusione messi a disposizione dall’ospedale.
Nella CMA è stato considerato un costo medio di € 41,25 per ogni somministrazione SC effettuata (Tab. III). Sulla base dei dati mercato (36), si è assunto che l’auto-somministrazione SC avvenga nell’80% dei casi utilizzando la pompa Crono S-PID® 50 venduta a un prezzo di € 1.460,00 e nel restante 20% dei casi utilizzando la pompa Crono S-PID® 100 venduta a un prezzo di € 1.760,00. Per ciascuna pompa è stata considerata una durata media di funzionamento di tre anni (156 settimane) (36). Oltre al costo della pompa di infusione, è stato calcolato e valorizzato, agli attuali prezzi di mercato (36), anche il corrispettivo consumo medio dei materiali necessari per ogni singola somministrazione quali deflussori, spike e siringhe (Tab. III).
| Crono S-PID 50 | Crono S-PID 100 | Media | |
|---|---|---|---|
| Pompa a infusione | |||
| – percentuale di utilizzo | 80% | 20% | |
| – costo della pompa a infusione | € 1.460,00 | € 1.760,00 | € 1.520,00 |
| – numero di infusioni per pompa (durata) | 156 | 156 | 156 |
| Costo pompa per singola infusione | € 9,36 | € 11,28 | € 9,74 |
| Materiali per la somministrazione | |||
| – n° deflussori per somministrazione | 2,6 | 2,6 | 2,6 |
| – costo deflussore | € 5,33 | € 5,33 | € 5,33 |
| – n° spike | 1 | 1 | 1 |
| – costo spike | € 0,70 | € 0,70 | € 0,70 |
| – n° siringhe per somministrazione | 2,6 | 2,6 | 2,6 |
| – costo siringa dedicata | € 5,70 | € 9,80 | € 6,52 |
| Costo materiali per somministrazione | € 29,38 | € 40,04 | € 31,51 |
| Costo somministrazione annuo | € 38,74 | € 51,32 | € 41,25 |
Dal momento che, a differenza di quanto avviene per HIZENTRA® e per le altre SCIG, l’azienda titolare di HYQVIA® fornisce attualmente gratuitamente materiali e pompa di infusione senza alcun costo addizionale per l’ospedale, nel caso base della CMA a HYQVIA® non è stato associato alcun costo di somministrazione.
Immunoglobuline endovenose
A differenza di HYQVIA® e HIZENTRA®, VENITAL® (come accade per le altre IVIG rimborsate) viene somministrata per via endovenosa. In questo caso, nella CMA è stato considerato un costo medio a carico dell’ospedale per singola somministrazione IV di € 333,02 (Tab. IV). Le principali voci di consumo di risorse e di costo sostenute dall’ospedale per la somministrazione delle IVIG sono rappresentate dal personale medico-infermieristico e dall’utilizzo dell’ambulatorio terapeutico. I tempi medi (ore) di presenza del medico e dell’infermiere o di utilizzo dell’ambulatorio terapeutico e i corrispondenti costi medi orari associati ad ogni singola somministrazione delle IVIG considerati nella CMA sono stati determinati sulla base dei dati di raccolti dallo studio osservazionale di Matucci et al. (35) (Tab. IV). Poiché riferiti al 2008 (35), i costi orari del personale medico-infermieristico, occupato nella somministrazione endovenosa delle immunoglobuline, e dell’ambulatorio terapeutico, luogo in cui avviene tale somministrazione, sono stati rivalutati a dicembre 2022 (ultimo dato disponibile) (37). Sommando così le componenti personale medico (€ 30,01), personale infermieristico (€ 112,98) e ambulatorio (€ 190,02), si è ottenuto il costo medio di € 333,02 per singola somministrazione IV (Tab. IV).
| Parametri | |
|---|---|
| Personale medico | |
| – costo orario medico (€) | € 60,03 |
| – durata somministrazione (h) | 0,50 |
| Costo annuo personale medico | € 30,01 |
| Personale infermieristico | |
| – costo orario infermiere (€) | € 28,25 |
| – durata somministrazione (h) | 4,0 |
| Costo annuo personale infermieristico | € 112,98 |
| Ambulatorio terapeutico | |
| – costo orario ambulatorio terapeutico (€) | € 47,58 |
| – durata della somministrazione (h) | 4,00 |
| Costo ambulatorio (€) | € 190,02 |
| Costo medio per la somministrazione IV delle immunoglobuline (€) | € 333,02 |
Altri costi
Dalla CMA sono stati esclusi i costi per le procedure diagnostiche perché, sulla base di quanto riportato nello studio osservazionale di Matucci et al. (35), non si evidenziano differenze di consumo tra le immunoglobuline considerate (fSCIG, SCIG e IVIG). Inoltre, poiché trascurabili, sono stati esclusi dalla valutazione anche i costi determinati dai farmaci per la premedicazione somministrati ai pazienti che ricevono IVIG. Infatti, secondo quanto riportato nello studio osservazionale di Matucci et al. (35), tali costi, su base annua, ammonterebbero a circa € 11,28.
Analisi di sensibilità
Dal momento che, nell’analisi sia delle PID che delle SID, l’esclusione del costo di somministrazione di HYQVIA® rappresenta il principale parametro in grado di influenzare i risultati della CMA, è stata condotta un’analisi di scenario in cui, a differenza del caso base, è stato incluso anche per HYQVIA® tale costo.
Inoltre, dal momento che, in assenza di uno specifico dato riportato dallo studio osservazionale di Matucci et al. (35), si è assunto nel caso base della CMA di considerare anche per HYQVIA® lo stesso dosaggio medio mensile utilizzato per le altre due IG nel trattamento delle PID, è stata condotta un’analisi della soglia (Threshold Analysis) finalizzata a considerare per quale aumento del dosaggio mensile di HYQVIA® quest’ultima alternativa non risulterebbe cost-saving rispetto a HIZENTRA® e a VENITAL®, includendo anche in questo caso il costo di somministrazione per HYQVIA®.
Infine, solo rispetto a VENITAL® nel trattamento sia delle PID che delle SID, è stata condotta una seconda analisi della soglia finalizzata a considerare per quale riduzione dei costi orari del personale medico-infermieristico e dell’utilizzo dell’ambulatorio terapeutico le due strategie di trattamento HYQVIA® e VENITAL® risulterebbero costo-neutrali; anche in questo caso è stato incluso il costo di somministrazione per HYQVIA®.
Risultati
Analisi di minimizzazione dei costi
Immunodeficienze primarie
La Tabella V descrive i risultati dell’analisi di minimizzazione dei costi nel trattamento delle PID. Il costo medio annuo (52 settimane) per paziente trattato con HYQVIA® (€ 20.020,00) risulta inferiore di € 2.145,19 (−9,7%) rispetto a quello associato a HIZENTRA® (SCIG) (€ 22.165,19) e di € 4.947,68 (−19,8%) rispetto a quello associato a VENITAL® (IVIG) (€ 24.967,68).
| Parametri | HYQVIA®
(fSCIG) |
HIZENTRA®
(SCIG) |
VENITAL®
(IVIG) |
|---|---|---|---|
| PID | |||
| Costo annuo IG | € 20.020,00 | € 20.020,00 | € 20.020,00 |
| Costo annuo somministrazione | € 0,00 | € 2.145,19 | € 4.947,68 |
| Costo trattamento annuo | € 20.020,00 | € 22.165,19 | € 24.967,68 |
| Delta vs HYQVIA | −€ 2.145,19 | −€ 4.947,68 | |
| SID | |||
| Costo annuo IG | € 17.160,00 | n.v. | € 17.160,00 |
| Costo annuo somministrazione | € 0,00 | n.v. | € 4.947,68 |
| Costo trattamento annuo | € 17.160,00 | n.v. | € 22.107,68 |
| Delta vs HYQVIA | −€ 4.947,68 |
n.v. = non valutato.
Immunodeficienze secondarie
Nel trattamento delle SID, HYQVIA® determina il minor costo medio annuo (52 settimane) per paziente trattato (€ 17.160,00) rispetto a quello associato a VENITAL® (IVIG) (€ 22.107,68), con una differenza di € 4.947,68 (−22,4%) (Tab. V).
Analisi di sensibilità
La Tabella VI riporta i risultati dell’analisi di scenario condotta per entrambi i confronti. Anche includendo i costi di somministrazione, HYQVIA® determinerebbe sempre il minor costo medio annuo rispetto a HIZENTRA® e VENITAL® nel trattamento di mantenimento delle PID e rispetto a VENITAL® nel trattamento di mantenimento delle SID.
La Figura 1 illustra il risultato dell’analisi della soglia corrispondente alla variazione della dose media mensile di HYQVIA® nel trattamento delle PID rispetto a HIZENTRA® e a VENITAL®. Affinché HYQVIA® determini un maggior costo di trattamento annuo rispetto a HIZENTRA®, il corrispondente dosaggio medio mensile dovrebbe essere superiore a 30 g/mese (+7,1%), mentre, rispetto a VENITAL®, il corrispondente dosaggio medio mensile dovrebbe essere superiore a 34 g/mese (+21,4%).
Le Figure 2.A e 2.B illustrano invece i risultati dell’analisi della soglia corrispondente alla percentuale di riduzione dei costi orari del personale medico-infermieristico e dell’utilizzo dell’ambulatorio terapeutico per la somministrazione IV affinché HYQVIA® e VENITAL® siano costo-neutrali nel trattamento delle PID o delle SID, rispettivamente. In entrambi i casi, solo a fronte di una sensibile riduzione dell’87,6%% dei costi orari considerati nel caso base per il personale medico-infermieristico e per l’utilizzo dell’ambulatorio terapeutico, le due strategie di trattamento risulterebbero costo-neutrali.
| HIQVIA® | HIZENTRA® | VENITAL® | |
|---|---|---|---|
| PID | |||
| Caso base | € 20.020,00 | € 22.165,19 | € 24.967,68 |
| – di cui immunoglobuline | € 20.020,00 | € 20.020,00 | € 20.020,00 |
| – di cui somministrazione | € 0,00 | € 2.145,19 | € 4.947,68 |
| Delta vs HIQVIA | −€ 2.145,19 | −€ 4.947,68 | |
| Analisi di scenario | € 20.632,91 | € 22.165,19 | € 24.967,68 |
| – di cui immunoglobuline | € 20.020,00 | € 20.020,00 | € 20.020,00 |
| – di cui somministrazione | € 612,91 | € 2.145,19 | € 4.947,68 |
| Delta vs HIQVIA | −€ 1.532,28 | −€ 4.334,77 | |
| SID | |||
| Caso base | € 17.160,00 | n.v. | € 22.107,68 |
| – di cui immunoglobuline | € 17.160,00 | n.v. | € 17.160,00 |
| – di cui somministrazione | € 0,00 | n.v. | € 4.947,68 |
| Delta vs HIQVIA | −€ 4.947,68 | ||
| Analisi di scenario | € 17.772,91 | n.v. | € 22.107,68 |
| – di cui immunoglobuline | € 17.160,00 | n.v. | € 17.160,00 |
| – di cui somministrazione | € 612,91 | n.v. | € 4.947,68 |
| Delta vs HIQVIA | −€ 4.334,77 |
n.v. = non valutato.
Discussione
Partendo dall’assunzione che non ci sia alcuna differenza significativa in termini di efficacia clinica tra fSCIG, SCIG e IVIG (8,9,13,14,15,16,17,18), l’obiettivo della presente CMA è stato quello di stimare, considerando la prospettiva dell’ospedale: i) il costo medio annuo associato a HYQVIA®, HIZENTRA® e VENITAL® nel trattamento di mantenimento delle PID con compromissione della produzione di anticorpi e ii) il costo medio annuo associato a HYQVIA® e VENITAL® nel trattamento di mantenimento delle SID in pazienti con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (PSAF) o livello sierico di IgG < 4 g/L.
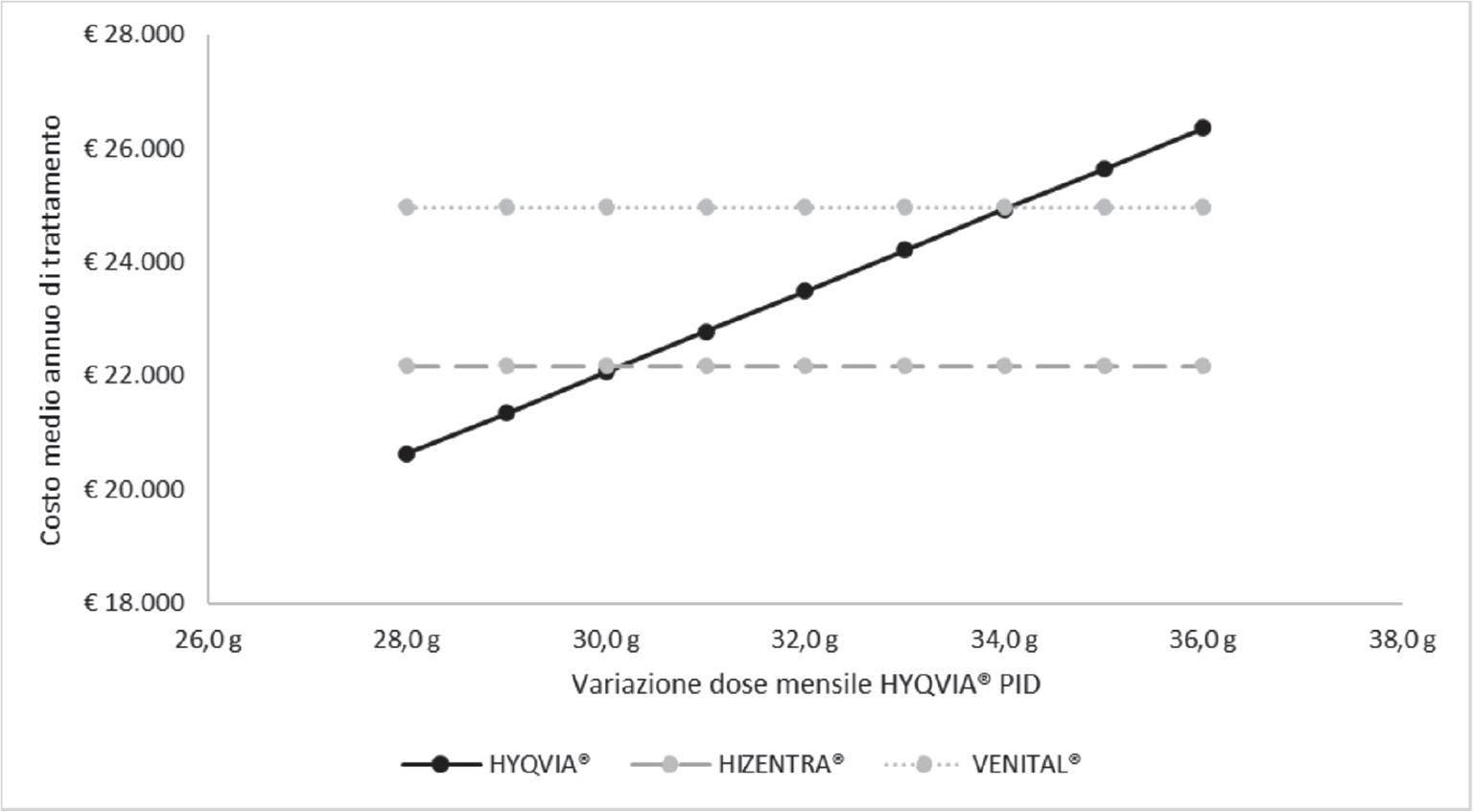
Fig. 1 - Analisi della soglia: variazione della dose mensile di HYQVIA® nelle PID.
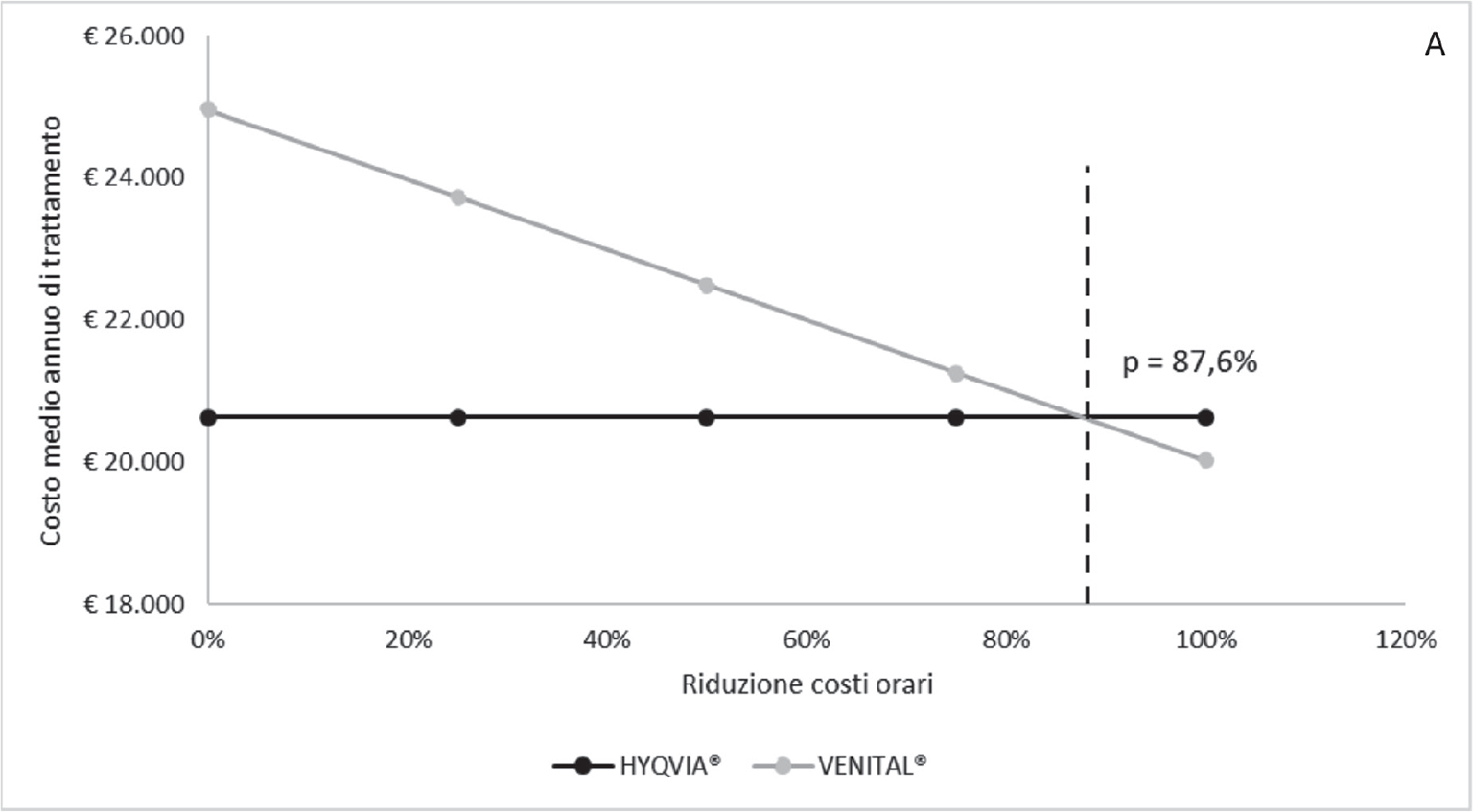
Fig. 2.A - Analisi della soglia: variazione dei costi orari della somministrazione IV nelle PID.
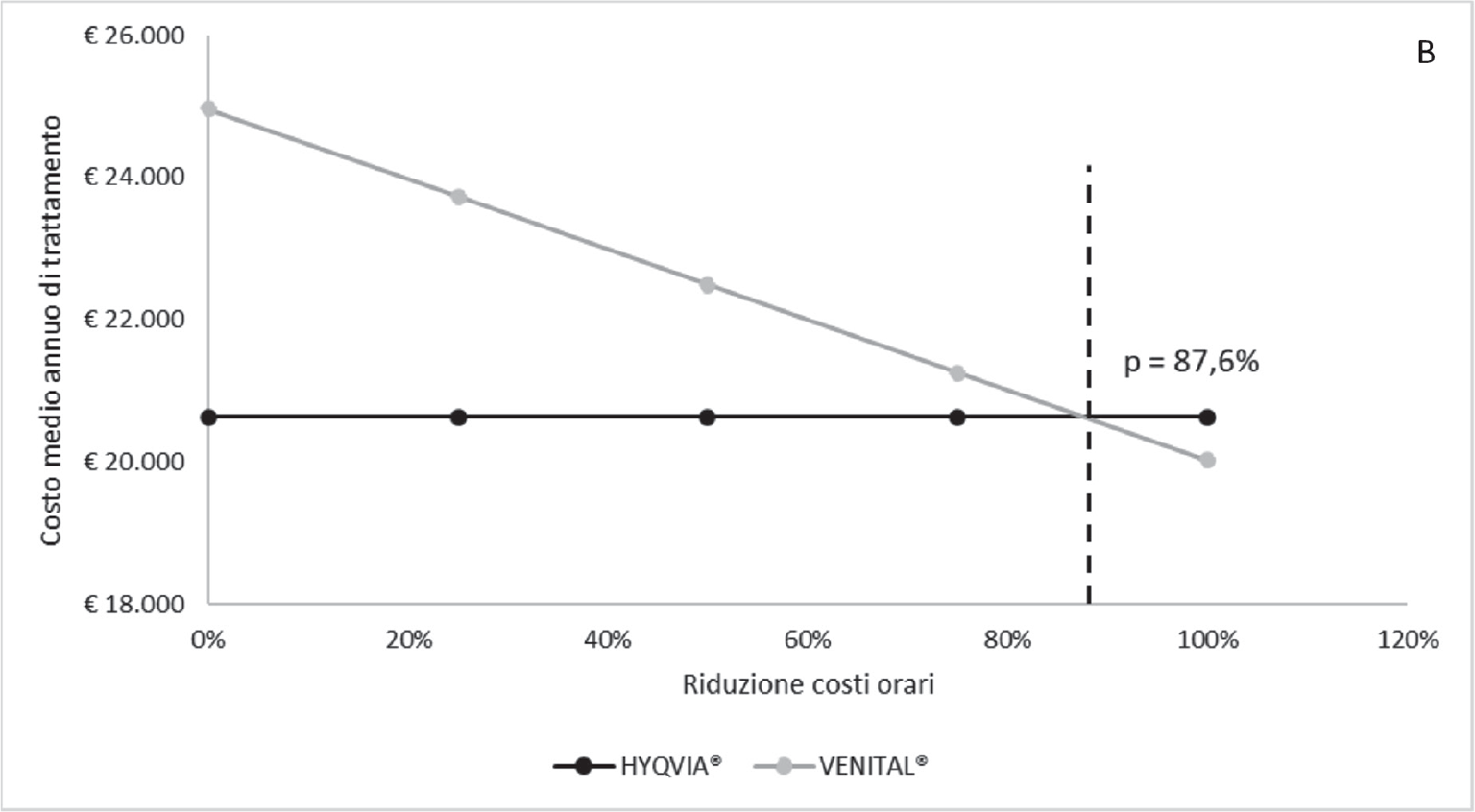
Fig. 2.B - Analisi della soglia: variazione dei costi orari della somministrazione IV nelle SID.
Nel trattamento di mantenimento delle PID, quale fonte di riferimento, sono stati considerati i dosaggi delle IG riportati nello studio osservazionale condotto da Matucci et al. (35), mentre, in assenza di uno specifico studio di confronto diretto, nel trattamento di mantenimento delle SID sono stati considerati i dosaggi di HIZENTRA® (12) e VENITAL® (33) indicati nei rispettivi RCP.
In entrambe le sotto analisi, in linea con quanto riportato nelle rispettive Gazzette Ufficiali (19,20,25), per ciascuna IG è stato considerato il prezzo ex-factory di € 55,00 per grammo di prodotto.
Nel trattamento di mantenimento delle PID HYQVIA® (€ 20.020,00) è risultata l’alternativa terapeutica con il minor costo medio annuo di mantenimento rispetto sia a HIZENTRA® (€ 22.165,19) sia a VENITAL® (€ 24.967,68). Anche nel trattamento di mantenimento delle SID, HYQVIA® (€ 17.160,00) risulta essere l’alternativa terapeutica con il minor costo medio annuo di mantenimento rispetto a VENITAL® (€ 22.107,68).
Dal momento che, in entrambi i confronti (PID e SID), l’esclusione del costo di somministrazione per HYQVIA® (l’azienda titolare del farmaco, a oggi, fornisce gratuitamente materiali e pompa di infusione senza alcun costo addizionale a carico dell’ospedale) rappresenta il principale parametro in grado di influenzare i risultati della CMA, è stata condotta un’analisi di scenario in cui tale costo è stato considerato anche per HYQVIA®. Nel confronto con HIZENTRA® nel trattamento di mantenimento delle PID, grazie a un minor numero di somministrazioni annue (14,86 vs 52), HYQVIA® rimarrebbe cost-saving. Anche nel confronto con VENITAL®, nel trattamento di mantenimento sia delle PID che delle SID, a fronte di uno stesso numero di somministrazioni annue, ma in virtù di un differente costo di valorizzazione per la somministrazione SC (€ 41,25) rispetto a quella IV (€ 333,02), HYQVIA® rimarrebbe cost-saving. In riferimento a quest’ultimo confronto, dal momento che il costo medio associato alla somministrazione IV risulta più oneroso per l’ospedale rispetto a quello per la somministrazione SC (€ 333,02 vs € 41,25), è stata condotta anche un’analisi della soglia per verificare per quale riduzione dei costi orari considerati nel caso base per il personale medico-infermieristico e per l’utilizzo dell’ambulatorio terapeutico le due strategie di trattamento (HYQVIA® e VENITAL®) risulterebbero costo-neutrali. Questa analisi è stata condotta per verificare il peso sul risultato del caso base di un’eventuale sovrastima dei costi orari. In realtà si osserva come solo a fronte di un’irrealistica riduzione di oltre l’85% dei costi orari indicati nel caso base le due alternative terapeutiche risulterebbero costo-neutrali nel trattamento di mantenimento delle PID o delle SID.
Al momento della conduzione della presente analisi non sono presenti in letteratura valutazioni economiche che abbiano confrontato HYQVIA® rispetto ad altre IG. Tuttavia, con riferimento alla letteratura internazionale, è presente il tema del confronto del costo di trattamento effettuato a domicilio con SCIG rispetto a quello somministrato in ospedale con IVIG. I risultati di una serie di analisi di Real-World condotte in Francia, Svizzera, Giappone e Canada sono concordi nell’associare costi di trattamento inferiori alle SCIG rispetto alle IVIG (38-39). Nello studio francese l’utilizzo delle SCIG ha determinato una riduzione del 25% dei costi rispetto a quelli associati all’utilizzo delle IVIG (38). L’analisi di minimizzazione dei costi condotta considerando la prospettiva del sistema sanitario svizzero ha riscontrato un risparmio totale di € 8.897 per paziente nell’arco di 3 anni passando dall’IVIG somministrata mensilmente in regime ambulatoriale alla SCIG somministrata settimanalmente a domicilio (39). Nello studio giapponese, i pazienti che sono passati da IVIG a SCIG hanno registrato una riduzione della perdita di produttività (40). Infine, lo studio canadese, nel corso di un anno di osservazione, ha rilevato una riduzione dei costi medi ospedalieri (CAD 1.826 vs CAD 187) e delle visite (CAD 84 vs CAD 744) nei pazienti con SCIG somministrate a domicilio rispetto ai pazienti con IVIG somministrate in ospedale (41).
Limiti dell’analisi
Un primo limite della CMA è stato quello di aver condotto nel trattamento delle PID un confronto considerando per HYQVIA® lo stesso dosaggio medio mensile identificato per le SCIG (HIZENTRA®) e per le IVIG (VENITAL®) nello studio osservazione di Matucci et al. (35). Si giustifica tale considerazione poiché attualmente non sono disponibili in letteratura studi riferiti al contesto nazionale o internazionale che abbiano confrontato HYQVIA® rispetto ad altre immunoglobuline nel trattamento di mantenimento delle PID. Al fine di verificare l’impatto di tale assunzione è stata condotta un’analisi di scenario finalizzata a stimare per quale aumento del dosaggio mensile HYQVIA® non sarebbe più cost-saving rispetto a HIZENTRA® e a VENITAL® nel trattamento delle PID. Affinché ciò accada il dosaggio medio mensile di HYQVIA® utilizzato nel caso base (28 g/mese) dovrebbe aumentare del 7,1% (30 g/mese) rispetto a HIZENTRA® e del 21,4% (34 g/mese) rispetto a VENITAL®.
Un secondo limite è stato quello di aver estrapolato dalle informazioni riportate nei rispettivi RCP (12,33) il dosaggio medio mensile di HIQVIA® e VENITAL® nel trattamento delle SID. A giustificazione di tale scelta si sottolinea il fatto che a oggi nel trattamento delle SID non sono disponibili in letteratura studi nazionali o internazionali che abbiano confrontato HYQVIA® rispetto ad altre IVIG.
In assenza di dati aggiornati, un terzo limite è da ricercare nell’aver utilizzato, anche se attualizzati, i costi unitari riportati in una pubblicazione del 2008 (35) per valorizzare i consumi delle risorse sanitarie associati alla somministrazione per via endovenosa delle IG. L’analisi della soglia ha comunque dimostrato come, solo a fronte di irrealistiche riduzioni dei costi orari del personale medico-infermieristico e dell’ambulatorio, VENITAL® determinerebbe lo stesso costo di HIQVIA® nel trattamento di mantenimento nelle PID o nelle SID. Va comunque sottolineato che l’assenza di recenti dati di letteratura sugli attuali costi delle diverse procedure di somministrazione richieda in futuro la conduzione di specifiche analisi finalizzate a colmare tale mancanza.
Un ulteriore limite dello studio può essere riscontrato nella scelta di aver valorizzato i consumi delle IG sulla base dei rispettivi prezzi ex-factory; prezzi che potrebbero non riflettere eventuali negoziazioni regionali/locali.
Dalla CMA sono stati esclusi i costi per le procedure diagnostiche poiché, sulla base di quanto riportato nello studio condotto da Matucci et al (35), non si ipotizzano differenze nei consumi tra le immunoglobuline considerate. Poiché trascurabili, sono stati inoltre esclusi dalla valutazione anche i costi determinati dai farmaci per la premedicazione nei pazienti che ricevono IVIG. Infatti, tali costi, se considerati, ammonterebbero, su base annua, a € 11,28 (35). Infine, dal momento che la CMA ha considerato i soli costi diretti sanitari, qualora fossero stati inclusi anche i costi diretti non sanitari, quali quelli di trasferimento da casa all’ospedale per ricevere il trattamento IVIG, e/o i costi indiretti, quali la perdita di produttività dovuta alla somministrazione delle IG in ambito ospedaliero, la differenza tra il costo medio di HYQVIA® e quello di VENITAL® sarebbe stata maggiore.
Conclusioni
Per garantire la sostenibilità, oltre alla tollerabilità, alle caratteristiche cliniche e alle preferenze dei pazienti, la scelta di un trattamento dovrebbe essere fatta considerando anche il relativo impatto economico. Grazie ai minori costi di somministrazione rispetto a SCIG e IVIG e al diverso schema di somministrazione rispetto a SCIG, i risultati della CMA identificano in HYQVIA® un’opzione economicamente vantaggiosa rispetto alle alternative SC e IV nel trattamento delle PID con compromissione della produzione di anticorpi e rispetto alle alternative IV nel trattamento delle SID in pazienti con infezioni severe o ricorrenti, trattamento antimicrobico inefficace e documentato difetto di anticorpi specifici (PSAF) o livello sierico di IgG < 4 g/L.
Disclosures
Conflict of interest: RR has no financial interests to disclose in connection with this study. SR is employed by Takeda Italia S.p.A. (no stock ownership).
Financial support: Takeda Italia S.p.A. supported this research. The Authors thank Eleonora Buscemi of PharmaLex Italy S.p.A. formerly MA Provider for her contribution in validating the analysis and writing the manuscript. Takeda Italia S.p.A. funded the medical writing.
Bibliografia
- 1. Español T, Hernández M, Giner MT, et al. [Directory of diagnostic tests in primary immunodeficiencies]. Allergol Immunopathol (Madr). 2005;33(3):157-161. CrossRef PubMed
- 2. Sánchez-Ramón S, Bermúdez A, González-Granado LI, Rodríguez-Gallego C, Sastre A, Soler-Palacín P; ID-Signal Onco-Haematology Group. Primary and Secondary Immunodeficiency Diseases in Oncohaematology: Warning Signs, Diagnosis, and Management. Front Immunol. 2019 Mar 26;10:586. CrossRef PubMed
- 3. Tangye SG, Al-Herz W, Bousfiha A, et al. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022;42(7):1473-1507. CrossRef PubMed
- 4. Chinen J, Shearer WT. Secondary immunodeficiencies, including HIV infection. J Allergy Clin Immunol. 2010;125(2)(suppl 2):S195-S203. CrossRef PubMed
- 5. Costa-Carvalho BT, Grumach AS, Franco JL, et al. Attending to warning signs of primary immunodeficiency diseases across the range of clinical practice. J Clin Immunol. 2014;34(1):10-22. CrossRef PubMed
- 6. Mortaz E, Tabarsi P, Mansouri D, et al. Cancers related to immunodeficiencies: update and perspectives. Front Immunol. 2016;7:365. CrossRef PubMed
- 7. Wasserman RL; HyQvia Experience Study Group. Clinical Practice Experience with HyQvia in Adults Using Alternative Dosing Regimens and Pediatric Patients: A Retrospective Study. Adv Ther. 2020;37(4):1536-1549. CrossRef PubMed
- 8. Berger M. Subcutaneous immunoglobulin replacement in primary immunodeficiencies. Clin Immunol. 2004;112(1):1-7. CrossRef PubMed
- 9. Wasserman RL, Melamed I, Kobrynski L, et al. Efficacy, safety, and pharmacokinetics of a 10% liquid immune globulin preparation (GAMMAGARD LIQUID, 10%) administered subcutaneously in subjects with primary immunodeficiency disease. J Clin Immunol. 2011;31(3):323-331. CrossRef PubMed
- 10. Misbah S, Sturzenegger MH, Borte M, et al. Subcutaneous immunoglobulin: opportunities and outlook. Clin Exp Immunol. 2009;158(Suppl 1)(suppl 1):51-59. CrossRef PubMed
- 11. Ochs HD, Gupta S, Kiessling P, Nicolay U, Berger M; Subcutaneous IgG Study Group. Safety and efficacy of self-administered subcutaneous immunoglobulin in patients with primary immunodeficiency diseases. J Clin Immunol. 2006;26(3):265-273. CrossRef PubMed
- 12. Hyqvia. Riassunto delle caratteristiche del prodotto. Online (Accessed March 2023)
- 13. Yocum RC, Kennard D, Heiner LS. Assessment and implication of the allergic sensitivity to a single dose of recombinant human hyaluronidase injection: a double-blind, placebo-controlled clinical trial. J Infus Nurs. 2007;30(5):293-299. CrossRef PubMed
- 14. Allen CH, Etzwiler LS, Miller MK, et al; INcreased Flow Utilizing Subcutaneously-Enabled Pediatric Rehydration Study Collaborative Research Group. Recombinant human hyaluronidase-enabled subcutaneous pediatric rehydration. Pediatrics. 2009;124(5):e858-e867. CrossRef PubMed
- 15. Thomas JR, Yocum RC, Haller MF, von Gunten CF. Assessing the role of human recombinant hyaluronidase in gravity-driven subcutaneous hydration: the INFUSE-LR study. J Palliat Med. 2007;10(6):1312-1320. CrossRef PubMed
- 16. Wasserman RL, Melamed I, Stein MR, et al; IGSC, 10% with rHuPH20 Study Group. Recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulins for primary immunodeficiency. J Allergy Clin Immunol. 2012;130(4):951-7.e11. CrossRef PubMed
- 17. Wasserman RL, Melamed I, Kobrynski L, et al. Recombinant human hyaluronidase facilitated subcutaneous immunoglobulin treatment in pediatric patients with primary immunodeficiencies: long-term efficacy, safety and tolerability. Immunotherapy. 2016;8(10):1175-1186. CrossRef PubMed
- 18. Wasserman RL, Melamed I, Stein MR, et al. Longterm tolerability, safety, and efficacy of recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulin for primary immunodeficiency. J Clin Immunol. 2016;36(6):571-582. CrossRef PubMed
- 19. AGENZIA ITALIANA DEL FARMACO DETERMINA 6 luglio 2022 Rinegoziazione del medicinale per uso umano «Hyqvia», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 503/2022). (22A04070) (GU Serie Generale n.167 del 19-07-2022). Online (Accessed March 2023)
- 20. AGENZIA ITALIANA DEL FARMACO DETERMINA 9 maggio 2022 Rinegoziazione del medicinale per uso umano «Hizentra», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 331/2022). (22A03016) (GU Serie Generale n.120 del 24-05-2022). Online (Accessed March 2023)
- 21. AGENZIA ITALIANA DEL FARMACO DETERMINA 7 ottobre 2021 Rinegoziazione del medicinale per uso umano «Keycute», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1201/2021). (21A06200) (GU Serie Generale n.255 del 25-10-2021). Online (Accessed March 2023)
- 22. AGENZIA ITALIANA DEL FARMACO DETERMINA 7 ottobre 2021 Rinegoziazione del medicinale per uso umano «Naxiglo», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1200/2021). (21A06199) (GU Serie Generale n.255 del 25-10-2021) Online (Accessed March 2023)
- 23. AGENZIA ITALIANA DEL FARMACO DETERMINA 20 giugno 2022 Regime di rimborsabilita’ e prezzo, a seguito di nuove indicazioni terapeutiche e rinegoziazione del medicinale per uso umano «Kiovig», ai sensi dell’art. 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 464/2022). (22A03731) (GU Serie Generale n.150 del 29-06-2022) Online (Accessed March 2023)
- 24. AGENZIA ITALIANA DEL FARMACO DETERMINA 26 gennaio 2022 Rinegoziazione del medicinale per uso umano «Privigen», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 80/2022). (22A00809) (GU Serie Generale n.32 del 08-02-2022) Online (Accessed March 2023)
- 25. AGENZIA ITALIANA DEL FARMACO DETERMINA 7 ottobre 2021 Rinegoziazione del medicinale per uso umano «Venital», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1184/2021). (21A06192) (GU Serie Generale n.254 del 23-10-2021). Online (Accessed March 2023)
- 26. AGENZIA ITALIANA DEL FARMACO DETERMINA 7 ottobre 2021 Rinegoziazione del medicinale per uso umano «IG Vena», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1202/2021). (21A06201) (GU Serie Generale n.255 del 25-10-2021). Online (Accessed March 2023)
- 27. AGENZIA ITALIANA DEL FARMACO DETERMINA 9 agosto 2021 Rinegoziazione del medicinale per uso umano «Octagam», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. DG/947/2021). (21A05017) (GU Serie Generale n.199 del 20-08-2021). Online (Accessed March 2023)
- 28. AGENZIA ITALIANA DEL FARMACOCOMUNICATO Autorizzazione all’immissione in commercio del medicinale per uso umano «Gamten» (20A05330) (GU Serie Generale n.249 del 08-10-2020). Online (Accessed March 2023)
- 29. AGENZIA ITALIANA DEL FARMACO DETERMINA 7 ottobre 2021 Rinegoziazione del medicinale per uso umano «Flebogamma Dif», ai sensi dell’art. 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1205/2021). (21A06206) (GU Serie Generale n.256 del 26-10-2021). Online (Accessed March 2023)
- 30. AGENZIA ITALIANA DEL FARMACO DETERMINA 21 aprile 2022 Riclassificazione del medicinale per uso umano «Iqymune», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 309/2022). (22A02691) (GU Serie Generale n.104 del 05-05-2022). Online (Accessed March 2023)
- 31. Takeda, data on file. Merket Tracker IGs. Aggiornamento Novembre 2022.
- 32. Hizentra. Riassunto delle caratteristiche del prodotto. Online. (Accessed March 2023)
- 33. Venital. Riassunto delle caratteristiche del prodotto. Online (Accessed March 2023
- 34. Linee guida per la compilazione del Dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale. Online. (Accessed March 2023
- 35. Matucci A, Ravasio R, Vultaggio A, Maggi E. Analisi di minimizzazione dei costi della terapia con immunoglobuline (Ig) per il trattamento di pazienti con immunodeficienza primaria: confronto tra terapia con Ig sottocute vs endovena. Giornale Italiano di Health Technology Assessment 2008; 1(1): 31-37. Online (Accessed March 2023)
- 36. Prezzi di mercato. Takeda, data on file.
- 37. Istat. INDICE DEI PREZZI AL CONSUMO PER LE RIVALUTAZIONI MONETARIE. Online (Accessed March 2023)
- 38. Beauté J, Levy P, Millet V, et al; French PID study group CEREDIH. Economic evaluation of immunoglobulin replacement in patients with primary antibody deficiencies. Clin Exp Immunol. 2010;160(2):240-245. CrossRef PubMed
- 39. Perraudin C, Bourdin A, Spertini F, Berger J, Bugnon O. Switching patients to home-based subcutaneous immunoglobulin: an economic evaluation of an interprofessional drug therapy management program. J Clin Immunol. 2016;36(5):502-510. CrossRef PubMed
- 40. Igarashi A, Kanegane H, Kobayashi M, Miyawaki T, Tsutani K. Cost-minimization analysis of IgPro20, a subcutaneous immunoglobulin, in Japanese patients with primary immunodeficiency. Clin Ther. 2014;36(11):1616-1624. CrossRef PubMed
- 41. Fu LW, Song C, Isaranuwatchai W, Betschel S. Home-based subcutaneous immunoglobulin therapy vs hospital-based intravenous immunoglobulin therapy: A prospective economic analysis. Ann Allergy Asthma Immunol. 2018;120(2):195-199. CrossRef PubMed