 |
AboutOpen | 2023; 10: 55-59 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2565 POINT OF VIEW |
 |
Percorso diagnostico-terapeutico e modello organizzativo per l’erogazione della terapia genica nelle distrofie retiniche ereditarie in real-life
Diagnostic-therapeutic pathway and organizational model for gene therapy in the administration of congenital retinal dystrophies in real-life
Background: Leber congenital amaurosis is the first form of inherited retinal dystrophy (IRD) treated with a gene therapy approach using voretigene neparvovec (VN). To date, 42 patients have been treated, 25 of whom, treated at Clinica Oculistica Vanvitelli (Naples), have shown – after 45 days of treatment – a significant increase in dim-light visual function, a widening of the visual field, and an increase in central visual acuity.
Objective: A workshop has been organized to foster rapid access, investigate the current organizational scenario, and identify a value framework suitable for making gene therapy delivery efficient in terms of efficacy, safety, and sustainability.
Methods: The workshop involved 14 experts in clinical genetics, ophthalmology, and vitreoretinal surgery. All experts were subjected to questions related to three topics: diagnostic-therapeutic pathway of IRD patients, essential requirements for gene therapy delivery centres, and standardized model for therapy delivery. All contributions were judged to be of equal value.
Results: The panel identified: the steps of the diagnostic pathway to achieve early diagnosis; the essential criteria that delivery centres must possess in terms of experience, multidisciplinary team, and technical equipment; a standardized model for VN administration.
A network of few centres was identified as the best organizational model for VN delivery since it would ensure the gaining of experience and clinical excellence.
Conclusion: This paper provides a perspective that can be used as a starting point to standardize the diagnostic-therapeutic pathway of IRD patients and define the essential requirements that centres must meet for VN administration.
Keywords: Congenital retinal dystrophies, Diagnostic-therapeutic pathway, Gene therapy, Leber congenital amaurosis, Value framework, Voretigene neparvovec
Received: January 23, 2023
Accepted: March 7, 2023
Published online: March 23, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Le distrofie retiniche ereditarie (DRE) sono malattie rare, geneticamente determinate e progressive, in cui, per il coinvolgimento di geni e di meccanismi eziopatogenetici differenti, si assiste alla progressiva degenerazione dei fotorecettori retinici (coni e bastoncelli). Esse sono generalmente monogeniche e causate da una mutazione di uno tra circa oltre 200 geni coinvolti nella codifica di proteine fondamentali per il ciclo visivo. Il danno fotorecettoriale porta nel tempo a un progressivo deficit visivo e a una compromissione della visione notturna e del campo visivo periferico. Le DRE, i cui sintomi compaiono durante l’infanzia, costituiscono una delle principali cause dell’ipovisione (1).
Tra le distrofie retiniche ereditarie, l’amaurosi congenita di Leber rappresenta la causa più frequente di cecità infantile con un’incidenza di 2-3 casi su 100.000 bambini nati vivi e una prevalenza stimata a 1 su 81.000 bambini (2-4). L’amaurosi congenita di Leber è la prima tra le forme di DRE a essere trattata con una terapia genica. Voretigene neparvovec (VN) è un vettore di trasferimento genico che utilizza un vettore virale adeno-associato con proteine del capside di sierotipo 2 (AAV2) come veicolo per il trasporto verso la retina del cDNA che codifica per la proteina umana dell’epitelio pigmentato retinico di 65 kDa (hRPE65). VN si basa sull’utilizzo dell’AAV presente in natura utilizzando tecniche di DNA ricombinante. La terapia genica fornisce una copia sana del gene malato. Iniettato nell’occhio, il vettore virale rilascia la copia funzionante del gene a livello delle cellule retiniche, nelle quali riesce a ripristinare la produzione dell’enzima mancante. Ad oggi sono 42 i pazienti che in Italia hanno già ricevuto il trattamento con VN. Di questi, 12 pazienti pediatrici sono stati trattati presso la Clinica Oculistica dell’Università degli Studi “Luigi Vanvitelli” di Napoli, mostrando dopo 45 giorni dal trattamento un significativo miglioramento della funzione visiva in condizioni di scarsa luce, un allargamento del campo visivo e un aumento dell’acutezza visiva centrale, indici di successo terapeutico (5,6). Nonostante gli ottimi risultati ottenuti nella maggior parte dei pazienti trattati, le analisi dei dati raccolti hanno dimostrato come si registri un minor successo terapeutico nei pazienti con età maggiore; ciò conferma la necessità di un intervento tempestivo per ottenere il miglior risultato possibile. La terapia genica, infine, ha mostrato un buon profilo di sicurezza nei pazienti trattati.
Obiettivo
Con lo scopo di favorirne un rapido accesso, si è ritenuto utile indagare l’attuale scenario organizzativo e identificare un “value framework” adatto a rendere efficiente l’erogazione della terapia genica VN in termini di efficacia clinica, sicurezza e sostenibilità. In linea con tale obiettivo è stato organizzato il “Working Group: Gene Therapies nelle distrofie retiniche ereditarie”, che ha analizzato l’attuale percorso diagnostico-terapeutico e i criteri necessari che il centro erogatore deve possedere affinché possa somministrare la terapia genica VN, garantendo al paziente le massime efficacia e sicurezza.
Il Working Group
Alla riunione del Working Group, tenutasi nel gennaio del 2022, ha partecipato un panel multidisciplinare costituito da 14 esperti (panelist) di comprovata esperienza nella diagnosi e nella cura dell’amaurosi congenita di Leber, nell’erogazione della terapia genica con VN, nella gestione, sulla base di modelli regionali, delle terapie avanzate e dei farmaci innovativi e nel valore del framework organizzativo (Tab. I). La selezione dei panelist è avvenuta considerando come criterio di inclusione una forte expertise in almeno una delle seguenti tre discipline: i) genetica clinica, ii) oftalmologia, con focus sulle distrofie retiniche ereditarie e iii) chirurgia e somministrazione intravitreale.
Come preparazione alla riunione del Working Group, ai panelist è stato inviato del materiale informativo con la descrizione del percorso diagnostico-terapeutico dei primi pazienti trattati con la terapia genica VN, i risultati disponibili di questi primi trattamenti e l’elenco degli attuali centri erogatori con la relativa descrizione del contesto organizzativo nel quale è avvenuta la somministrazione della terapia genica VN.
| Panelist | Affiliazione |
|---|---|
| Maurizio Battaglia Parodi | Professore Associato, Dipartimento di Oftalmologia, Università Vita-Salute San Raffaele di Milano |
| Leonardo Colombo | Responsabile del Centro regionale per le Distrofie Retiniche, Ospedale San Paolo, Milano |
| Fabrizio Giansanti | Direttore SOD Oculistica, AOU Careggi, Firenze |
| Primiano Iannone | Direttore di Medicina Interna, Ospedale Maggiore Carlo Alberto Pizzardi, Bologna |
| Francesco Saverio Mennini | Professore di Economia Sanitaria ed Economia Politica presso la Facoltà di Economia dell’Università di Roma “Tor Vergata” e Presidente SIHTA |
| Marcello Pani | Direttore Farmacia Ospedaliera, Policlinico Universitario Fondazione Agostino Gemelli IRCCS, Roma; Segretario Nazionale SIFO |
| Francesco Parmeggiani | Professore Associato, Clinica Oculistica, Dipartimento di Medicina Traslazionale e per la Romagna, Università degli Studi di Ferrara |
| Ugo Procoli | Medico Oculista, Dipartimento Oftalmologia Universitaria, AO Policlinico Consorziale di Bari |
| Annalisa Scopinaro | Presidente UNIAMO |
| Francesca Simonelli | Professore Ordinario di Malattie dell’Apparato Visivo, Dipartimento Multidisciplinare di Specialità Medico-Chirurgiche e Odontoiatriche, Università degli Studi della Campania Luigi Vanvitelli, Napoli |
| Andrea Sodi | Medico Oculista, Clinica Oculistica, Università degli studi di Firenze |
| Annamaria Staiano | Professore Ordinario di Pediatria presso il Dipartimento di Scienze Mediche Traslazionali dell’Università degli Studi di Napoli “Federico II” |
| Giovanni Staurenghi | Direttore UO Oculistica, Ospedale Luigi Sacco, Milano |
| Ugo Trama | Direttore Direzione Politica del Farmaco e dei Dispositivi Regione Campania |
Aree di interesse
Durante la riunione del Working Group, i panelist sono stati chiamati a rispondere a una serie di domande articolate in tre aree di interesse quali: i) il percorso diagnostico-terapeutico del paziente con DRE, ii) i requisiti essenziali dei centri erogatori della terapia genica VN e iii) il modello standardizzato per la somministrazione della terapia genica VN. Nello specifico, in riferimento alla prima area di interesse è stato chiesto di identificare: i) quali fossero gli step caratterizzanti il percorso diagnostico-terapeutico del paziente con DRE, ii) quali fossero le maggiori criticità e i limiti incontrati nell’esperienza finora accumulata nella gestione delle DRE e iii) quali azioni si potrebbero intraprendere per agevolare la diagnosi e la presa in carico del paziente con DRE. In riferimento alla seconda area di interesse è stato invece chiesto ai panelist: i) di indicare quali fossero i requisiti strutturali, strumentali e organizzativi essenziali che deve avere un centro erogatore per la somministrazione della terapia genica VN e ii) di esprimere il proprio parere su quale possa essere il numero dei centri autorizzati all’erogazione della terapia genica VN per coprire il fabbisogno dei pazienti a livello nazionale. Infine, in riferimento alla terza e ultima area di interesse, è stato chiesto al Working Group di identificare quale fosse il modello più appropriato da adottare nella somministrazione della terapia genica VN.
Ciascun panelist ha avuto lo stesso contributo (uguale peso) nel processo di valutazione delle domande. Le risposte dei panelist hanno permesso di costruire un documento i cui principali risultati sono riportati nei paragrafi successivi.
Il percorso diagnostico
La Figura 1 riporta nel dettaglio i principali step individuati dal Working Group che caratterizzano il percorso diagnostico-terapeutico del paziente con DRE, dalla manifestazione dei primi segni della patologia alla diagnosi conclamata. Essi comprendono: 1) la visita pediatrica, 2) la visita oculistica, 3) la visita oculistica presso un centro specializzato in DRE e 4) la presa in carico presso il centro erogatore. Gli ultimi due step risultano sovrapponibili qualora il centro specializzato in DRE sia anche qualificato per l’erogazione della terapia genica VN.
I panelist hanno identificato nel pediatra il primo professionista sanitario al quale i genitori fanno riferimento. Viene quindi sottolineata la necessità di coinvolgere il pediatra in percorsi formativi finalizzati al riconoscimento dei primi sintomi che portano al sospetto della DRE, quali i movimenti oculari anomali (nistagmo, sguardo erratico, assenza di fissazione), i segni oculo/digitali (pressione/sfregamento del bulbo oculare) e le difficoltà di adattamento alle variazioni di luminosità ambientale (fotofobia, cecità notturna). Al fine di perseguire tale obiettivo, il Working Group ritiene fondamentale il coinvolgimento delle società scientifiche, come per esempio la Società Italiana di Pediatria (SIP), nello sviluppo di opportuni percorsi formativi sulla patologia.
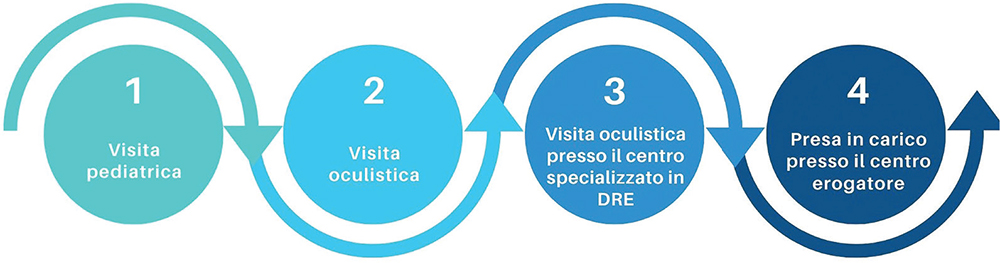
Fig. 1 - Il percorso diagnostico del paziente con DRE.
Seguendo le indicazioni fornite dal Working Group, riconosciuti i sintomi sentinella delle DRE, il pediatra deve indirizzare il paziente a una prima visita oculistica nella quale l’oculista, oltre ai sintomi precitati, deve indagare altri parametri (7) che possono (o meno) confermare il sospetto diagnostico e cioè alterazioni del campo visivo, alterazione della percezione dei colori e alterazioni retiniche sospette (pigmentazione retinica, aspetto distrofico del fondo, anomalie maculari). In aggiunta, l’oculista, in questa fase, deve effettuare un’approfondita analisi anamnestica a livello familiare al fine di identificare eventuali forme degenerative ereditarie già diagnosticate. Anche per questo secondo step, i panelist, al fine di rendere più efficiente l’iter diagnostico della malattia, raccomandano l’implementazione di specifici percorsi formativi anche nell’ambito delle Scuole di Specializzazione di Oftalmologia e dei Corsi di Laurea triennale di Ortottica e Assistenza Oftalmologica.
Alla conferma del sospetto diagnostico, l’oculista deve inviare il paziente presso un centro specializzato in DRE che possiede l’expertise e gli strumenti adeguati per confermare (o meno) la diagnosi di DRE. Tale diagnosi dovrebbe prevedere l’esecuzione delle seguenti analisi/esami: i) l’anamnesi familiare, generale e oculare, ii) l’esame del senso cromatico, iii) l’esame del fondo oculare con documentazione retinografica, iv) l’esame del campo visivo manuale di Goldmann, v) la Tomografia a Coerenza Ottica (OCT), vi) l’esame dell’autofluorescenza retinica e vii) l’esame elettroretinografico standard. I panelist ritengono che, nel caso in cui i risultati delle analisi confermino la diagnosi di DRE, sia utile effettuare una consulenza genetica per la definizione del modello di trasmissione ereditaria della malattia e per l’esecuzione del test genetico, necessario per identificare il gene causa della malattia per l’eleggibilità al trattamento con VN. Infine, una volta confermata la diagnosi di DRE associata alla mutazione del gene RPE65 e verificata la potenziale eleggibilità al trattamento con la terapia genica VN, il centro specializzato in DRE, qualora non fosse abilitato alla somministrazione della terapia genica, deve indirizzare il paziente verso il centro erogatore della terapia. Il Working Group ritiene quindi essenziale che il centro specializzato in DRE, qualora non fosse un centro erogatore, debba potenziare l’interazione con i centri erogatori della terapia genica VN con l’obiettivo di agevolare la tempestiva presa in carico del paziente.
I requisiti del centro erogatore
Il Working Group concorda sull’esigenza non solo di uniformare il percorso diagnostico-terapeutico, ma anche di definire i requisiti essenziali per ottenere la qualifica di centro erogatore della terapia genica VN, qualifica che non può prescindere da una documentata esperienza clinica nel campo delle DRE da parte del centro richiedente.
Sempre secondo i panelist, il centro erogatore deve necessariamente avere un team multidisciplinare e attrezzature specifiche dedicate alla somministrazione della terapia genica VN, oltre a una collaborazione consolidata con il laboratorio di genetica, che può essere interno o esterno al centro stesso. L’erogazione della terapia genica richiede la presenza di risorse professionali dedicate che devono necessariamente collaborare sinergicamente per la buona riuscita del trattamento.
Il team multidisciplinare dovrebbe essere composto da oculisti, ortottisti, genetisti, medici, infermieri e altri specialisti (pediatra, audiologo, nefrologo, neurologo, psicologo) per la componente diagnostica della malattia e da farmacisti, anestesisti e chirurghi della retina di comprovata esperienza per la componente terapeutica (Tab. II).
| Percorso diagnostico | Percorso terapeutico |
|---|---|
| Oculisti | Farmacisti |
| Ortottisti | Anestesisti |
| Genetisti | Chirurghi della retina |
| Infermieri | |
| Altri specialisti (pediatra, audiologo, nefrologo, neurologo, psicologo) |
Seguendo le raccomandazioni fornite dal Working Group, oltre al personale dedicato, il centro erogatore per espletare la fase sia diagnostica che terapeutica deve disporre di specifiche strumentazioni in grado, per esempio, di fornire accurate informazioni sullo stato di salute dei fotorecettori retinici del paziente e di garantire una corretta conservazione del farmaco e la misurazione dei risultati della terapia. Tale strumentazione comprende per la fase diagnostica il retinografo, il perimetro, il tomografo ottico a radiazione coerente (OCT), l’elettroretinografo, il microperimetro e l’apparecchiatura per autofluorescenza (FAF-SLO) e per la fase terapeutica l’apparecchiatura per la misurazione del FST (Full-field light Sensitivity Threshold), la cappa a flusso laminare e il congelatore a –80 °C (Tab. III).
Per un’efficiente erogazione della terapia genica i panelist sottolineano l’importanza della sinergia tra la farmacia del centro (responsabile della gestione coordinata e tempestiva dei processi di acquisto e della preparazione e della somministrazione della terapia), il reparto di erogazione della terapia (con il supporto del case manager, responsabile del coordinamento organizzativo, clinico e infermieristico e della gestione del paziente e dei suoi caregiver) e l’azienda farmaceutica (erogatore dei training necessari per la qualificazione/accreditamento del centro come specificato nel Risk Management Plan, contenuto nel dossier di registrazione del farmaco).
| Percorso diagnostico | Percorso terapeutico |
|---|---|
| Retinografo | Apparecchiatura per la misurazione del FST (Full-field light Sensitivity Threshold) |
| Perimetro | Cappa a flusso laminare |
| Tomografo ottico a radiazione coerente (OCT) | Congelatore a –80 °C |
| Elettroretinografo | |
| Microperimetro | |
| Apparecchiatura per autofluorescenza (FAF-SLO) |
Infine, il Working Group ritiene che il centro che si candida per la qualificazione/certificazione all’erogazione della terapia genica VN debba comunque essere un centro di eccellenza nell’ambito della gestione delle DRE, eccellenza maturata grazie all’appartenenza a network nazionali e internazionali sulle DRE oppure grazie alla partecipazione a trial clinici nelle DRE che hanno consentito al centro stesso di maturare anticipatamente l’esperienza necessaria per gestire i processi clinici e organizzativi correlati alla preparazione, alla manipolazione e all’erogazione della terapia genica, nonché alla gestione di complicanze ed eventi avversi.
Al momento della stesura del presente documento, sul territorio nazionale sono attivi 4 centri, distribuiti in 4 differenti regioni, che hanno ottenuto la qualifica di centro erogatore per la terapia genica nelle DRE, e 4 ulteriori centri che hanno invece una richiesta di qualificazione in corso. Il Working Group ritiene che l’attuale numero di centri attivi sia congruo considerando la rarità della patologia e quindi il limitato numero di pazienti eleggibili alla terapia (prevedibilmente in calo dopo il trattamento dei pazienti prevalenti) e soprattutto l’elevato standard di competenze e dotazioni richieste al centro erogatore della terapia genica. L’attivazione sul territorio nazionale di ulteriori 4 centri erogatori è finalizzata a garantire un maggior numero di centri in grado di accorpare le attività di diagnosi ed erogazione della terapia genica. Il Working Group ricorda però che, nel contesto della gestione delle malattie rare, come le DRE, è necessario uscire dagli schemi della regionalizzazione, attivando il referral dei pazienti verso il centro di riferimento qualificato per l’erogazione della terapia specifica. Pertanto, risulta cruciale costituire una rete efficiente per il referral del paziente, quando necessario.
Modello standardizzato per la somministrazione della terapia genica
Il Working Group è concorde nell’affermare che i centri erogatori debbano svolgere il proprio operato seguendo un modello standardizzato di presa in carico del paziente al fine di garantire le massime efficienza e sicurezza nell’erogazione della terapia genica VN.
Con l’obiettivo quindi di garantire un’efficace e sicura somministrazione della terapia genica VN, i panelist hanno individuato un percorso standardizzato strutturato in 4 distinte fasi: i) procedure pre-intervento, ii) intervento chirurgico, iii) procedure post-intervento e iv) follow-up. Le procedure pre-intervento sono volte a verificare lo stato delle cellule retiniche per confermare la possibilità di intervenire con la pratica chirurgica. Tali procedure comprendono a loro volta gli esami oftalmologici di base (misurazione dell’acutezza visiva centrale, esame del campo visivo cinetico [Goldmann], esame del fondo oculare, OCT per verificare lo spessore retinico maculare [almeno 100 micron], FST per misurare la sensibilità alla luce delle cellule retiniche), la valutazione anestesiologica e la somministrazione di una terapia antibiotica e cortisonica. L’intervento chirurgico, oltre alla preparazione del farmaco che deve avvenire nelle quattro ore prima della somministrazione, deve prevedere l’esecuzione di una vitrectomia via pars plana con iniezione sottoretinica del farmaco in anestesia generale. Nella fase di post-intervento deve essere eseguita un’oftalmoscopia indiretta e si deve procedere con la riduzione (a scalare) della terapia cortisonica e antibiotica locale e sistemica. Infine, durante la fase di follow-up, il Working Group raccomanda che il paziente venga monitorato periodicamente (pochi giorni dopo l’intervento, ogni 3-4 mesi nel primo anno e successivamente una volta l’anno fino a 5 anni dall’intervento) per valutare lo stato della malattia e l’esito della terapia. Nello specifico, per verificare il successo terapeutico, i panelist raccomandano la misurazione dell’acutezza visiva, del campo visivo e della sensibilità luminosa (tramite FST).
Conclusioni
Il presente documento fornisce un primo punto di vista di un Working Group costituito da 14 esperti di comprovata esperienza nella diagnosi e nella cura delle DRE, che può essere utilizzato come base di partenza per uniformare il percorso diagnostico-terapeutico del paziente con DRE e definire i requisiti essenziali ai quali i centri devono rispondere per la somministrazione della terapia genica VN.
Con riferimento alla diagnosi, i panelist raccomandano l’implementazione di programmi formativi, specialmente per il pediatra (sia di libera scelta sia ospedaliero), che permettano una più rapida identificazione dei segni/sintomi sentinella delle DRE nel bambino, sottolineando inoltre come la tempestività della diagnosi (e quindi della somministrazione della terapia) sia la migliore garanzia dell’efficacia della terapia genica VN.
Il Working Group ritiene fondamentale la condivisione a livello nazionale dei requisiti essenziali per i centri erogatori della terapia, come le corrette presa in carico del paziente ed erogazione della terapia genica VN.
Il Working Group concorda infine sull’esigenza di costruire un modello organizzativo per l’erogazione della terapia genica VN che, rispettando requisiti specifici di eccellenza clinica, di gestione ottimale delle risorse (umane e tecnologiche) e di competenza riguardo ai processi di gestione del paziente e di manipolazione dei farmaci, garantisca la massimizzazione del valore terapeutico per il paziente e per il sistema. I panelist sono pertanto d’accordo nel ritenere che una rete di pochi centri, con caratteristiche e requisiti precisi e altamente specializzati nell’erogazione della terapia genica, possa essere il miglior modello da perseguire.
Acknowledgment
This is the final version of record of this article as stated in DOI 10.33393/ao.2023.2616
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: This research was made possible by an educational grant from Novartis.
Bibliografia
- 1. Testa F, Murro V, Signorini S, et al. RPE65-Associated Retinopathies in the Italian Population: A Longitudinal Natural History Study. Invest Ophthalmol Vis Sci. 2022;63(2):13. CrossRef PubMed
- 2. Stone EM. Leber congenital amaurosis – a model for efficient genetic testing of heterogeneous disorders: LXIV Edward Jackson Memorial Lecture. Am J Ophthalmol. 2007;144(6):791-811. CrossRef PubMed
- 3. Amaurosi congenita di Leber, Fondazione Telethon, 2020. Online (Accessed January 2023)
- 4. L’Amaurosi congenita di Leber, Associazione Italiana Amaurosi Congenita di Leber, 2003. Online (Accessed January 2023).
- 5. Testa F, Melillo P, Di Iorio V, et al. Visual function and retinal changes after voretigene neparvovec treatment in children with biallelic RPE65-related inherited retinal dystrophy. Sci Rep. 2022;12(1):17637. CrossRef PubMed
- 6. Testa F, Melillo P, Della Corte M, et al. Voretigene Neparvovec Gene Therapy in Clinical Practice: Treatment of the First Two Italian Pediatric Patients. Transl Vis Sci Technol. 2021;10(10):11. CrossRef PubMed
- 7. Sodi A, Banfi S, Testa F, et al; Italian IRD Working Group. RPE65-associated inherited retinal diseases: consensus recommendations for eligibility to gene therapy. Orphanet J Rare Dis. 2021;16(1):257. CrossRef PubMed