 |
AboutOpen | 2023; 10: 97-102 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2564 POINT OF VIEW |
 |
L’infezione da CMV refrattaria nella fase post-trapianto: inquadramento epidemiologico nel contesto italiano, attuale gestione del paziente e unmet need
Refractory CMV infection in post-transplant phase: epidemiological framing in the Italian context, current patient management and unmet needs
Background: Cytomegalovirus (CMV) infection usually occurs asymptomatically but can represent an important cause of morbidity and mortality in patients with compromised immune system such as transplant patients. Infection may not respond to standard therapies leading to refractoriness (with or without resistance) which jeopardizes transplant successful outcome.
Objective: Since refractoriness represents a critical point, a project has been conducted to verify the epidemiology in the Italian context and to convey the current patients’ unmet medical needs.
Methods: The project included: literature analysis, expert interviews and results’ validation through expert opinion. Based on literature data, a questionnaire was built and submitted to 8 experts with proven experience in the management of post-transplant CMV infection. Topics included epidemiology, patient management, unmet needs and future perspective. Outcomes were validated by 3 additional national experts in solid organ transplantation, hematopoietic stem cell transplantation and infectious diseases.
Results: Epidemiological rates from literature applied to current transplantation numbers in Italy estimate approximately 109 adults and 8 children with refractory post-transplant CMV infection in 2021.
If valganciclovir/ganciclovir are ineffective, foscarnet is predominantly used. When foscarnet fails, patients have no therapeutic alternatives. Despite being a minority, this represents a high medical need. Therefore, the introduction of new therapeutic options with a better efficacy/safety profile would lead to a significant improvement in refractory CMV infection management.
Conclusion: Although refractory infections represent a minority, they are the most critical issue that can occur in post-transplant patients resulting in a high unmet need due to the lack of specific treatment options and the toxicity of current treatments used.
Keywords: Cytomegalovirus infection, Epidemiology, Hematopoietic stem cell transplantation, Patient management, Solid organ transplantation, Unmet needs
Received: January 18, 2023
Accepted: June 7, 2023
Published online: June 28, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il Citomegalovirus (CMV) è un virus ubiquitario appartenente alla famiglia degli Herpesviridae, sottofamiglia delle Betaherpesvirinae (1). È uno dei virus più diffusi a livello globale, soprattutto nei paesi industrializzati: si stima che circa il 30-90% della popolazione sia sieropositivo (2). Tra i donatori di sangue e organi, si stima che la prevalenza si aggiri attorno all’86% (3).
Tale elevata diffusione è dovuta al fatto che solitamente l’infezione avviene in modo asintomatico e il virus rimane latente all’interno dell’organismo per tutta la vita con possibilità di trasmissione per mezzo dei fluidi corporei. Nonostante la maggior parte delle infezioni in organismi immunocompetenti sia autolimitata e spesso asintomatica o pauci-sintomatica, il CMV è un’importante causa di morbilità in soggetti che, per diversi motivi, si trovano con una funzione immunitaria compromessa, come nel caso dei pazienti sottoposti a trapianto (4).
L’uomo è l’unico serbatoio di infezione del CMV, la cui trasmissione avviene da persona a persona attraverso la saliva o altri fluidi corporei, il contatto sessuale, il trasferimento placentare, l’allattamento al seno, la trasfusione di sangue e il trapianto di organi solidi (SOT) o di cellule staminali ematopoietiche (HSCT) (2,5).
L’infezione da CMV costituisce una significativa causa di morbilità e mortalità in seguito a trapianto di organo solido o di cellule staminali ematopoietiche: nei pazienti sottoposti a trapianto, infatti, essendo immunocompromessi, il rischio di sviluppare la malattia da CMV è maggiore (6) e, purtroppo, in alcuni pazienti la malattia procede fino alla refrattarietà ai farmaci antivirali tradizionali. I pazienti sottoposti a trapianto sono particolarmente vulnerabili alla riattivazione dell’infezione latente da CMV del paziente stesso o a un’infezione latente da CMV trasferita dal donatore al ricevente. Il meccanismo di riattivazione è in gran parte sconosciuto, ma i processi che si instaurano in sede di trapianto sono spesso correlati a un aumento dell’infiammazione che a sua volta può rappresentare un fattore scatenante della riattivazione del CMV (1).
Inoltre, dal punto di vista biologico, esiste una forte connessione tra il rigetto di trapianto e l’infezione da CMV: il CMV infetta le cellule endoteliali, dove è in grado di replicarsi e di persistere durante la latenza; l’infezione porta all’aumento delle molecole di adesione sulle cellule endoteliali, promuovendo così processi pro-infiammatori che aumentano l’infiammazione endoteliale del trapianto, con conseguente aumento del reclutamento di cellule immunitarie e dell’espressione di antigeni anti-HLA sulla superficie delle cellule endoteliali, aumentando così il rischio di rigetto del trapianto (7).
Nonostante i progressi delle strategie terapeutiche, il CMV rimane una complicanza importante nel paziente che riceve il trapianto. L’infezione può anche non rispondere alle terapie antivirali attualmente disponibili in commercio indipendentemente dalla presenza di mutazioni genotipiche note per essere associate alla resistenza a queste terapie. In questi casi, si parla di refrattarietà e cioè, così come descritto dalle Linee Guida europee, del fenomeno che si verifica quando la viremia aumenta nonostante il trattamento. In particolare, si definisce infezione refrattaria da CMV l’aumento di >1 log10 nei livelli di DNA di CMV nel sangue o nel siero tra il picco di carica virale nella prima settimana e il picco di carica virale a ≥2 settimane, misurato nello stesso laboratorio con lo stesso test, nonostante almeno due settimane consecutive di trattamento a dosi appropriate; si parla invece di infezione da CMV probabilmente refrattaria quando la carica virale risulta persistente (allo stesso livello del picco di carica virale nella prima settimana e con un aumento di < 1 log10 nel DNA di CMV, misurata nello stesso laboratorio e con lo stesso test, dopo almeno 2 settimane di trattamento adeguato (8). In aggiunta, si possono distinguere l’infezione refrattaria e l’infezione probabilmente refrattaria da CMV con malattia d’organo terminale caratterizzata dal peggioramento o dal non miglioramento di segni e sintomi o dalla progressione del danno d’organo dopo almeno due settimane di trattamento antivirale a dosi adeguate (8).
La resistenza invece è definita dall’alterazione genetica del virus, verificata a livello molecolare, che riduce la suscettibilità a uno o più farmaci antivirali (8).
La letteratura medica a oggi disponibile suggerisce per la gestione dell’infezione da CMV post-trapianto le due seguenti strategie: (i) la profilassi, che consiste nella somministrazione di antivirali per un lungo periodo a tutti i pazienti che hanno subìto un trapianto, indipendentemente dal rischio di sviluppare un’infezione da CMV (9); (ii) la terapia preemptive, che consiste nel monitorare i livelli di viremia nel paziente sottoposto a trapianto ad alto rischio e nel somministrare antivirali solamente quando si registra la presenza del virus oltre una soglia predeterminata nel tentativo di prevenire la progressione dell’infezione asintomatica nella malattia da CMV (9,10).
Accanto agli interventi farmacologici, si sta sempre più diffondendo l’uso di approcci innovativi per la prevenzione e il trattamento dell’infezione da CMV post-trapianto. Tra questi si trova il monitoraggio immunitario che, attraverso l’utilizzo di specifici test (detti T-SPOT.CMV), misura la risposta delle cellule T agli antigeni del CMV consentendo di valutare il rischio di sviluppare la malattia (11). In tema di prevenzione, sono stati condotti diversi studi per lo sviluppo di vaccini anti-CMV, ma purtroppo i risultati ottenuti finora si sono dimostrati contrastanti (11). Un approccio che invece potrebbe sostituirsi alla terapia antivirale è il trasferimento adottivo di cellule T che, ricostituendo la risposta delle cellule T specifiche per il CMV, potrebbe controllare la viremia (11). Nonostante questo metodo si sia dimostrato efficace nella riduzione della carica virale nei pazienti sottoposti a HSCT, l’uso di cellule T di terze parti rimane sperimentale e saranno necessari ulteriori studi per verificarne efficacia e sicurezza; inoltre, sarà necessario superare alcune difficoltà caratteristiche di questo approccio (p. es., la limitata disponibilità di donatori e il tempo di produzione prolungato) prima di raggiungerne la sostenibilità nell’uso diffuso (9,11).
Obiettivo
Dal momento che la refrattarietà (con o senza resistenza) è un punto critico nella gestione dell’infezione da CMV nel paziente sottoposto a trapianto, si è ritenuto di realizzare un percorso progettuale che potesse verificare l’epidemiologia nel contesto italiano e che trasmettesse l’attuale unmet medical need dei pazienti e l’evoluzione nella gestione della patologia con l’introduzione di nuove entità terapeutiche come per esempio maribavir.
Data la natura ancora sperimentale e l’uso ancora limitato delle sopracitate tecniche alterative ai farmaci antivirali nel contesto italiano, tale articolo si concentrerà sulla gestione della patologia legata all’uso degli antivirali.
Metodi
Il progetto si è articolato in tre fasi: (i) analisi di letteratura, (ii) interviste a esperti e (iii) validazione e revisione dei risultati delle interviste tramite expert opinion. L’analisi della letteratura ha avuto lo scopo di costruire un pacchetto di conoscenze preliminari atte a inquadrare l’attuale gestione del paziente e l’individuazione di stime epidemiologiche relative all’infezione da CMV post-trapianto. Nella fattispecie, la ricerca della letteratura disponibile si è svolta utilizzando la banca dati PubMed (disponibile all’indirizzo Online) inserendo la seguente stringa di ricerca: “citomegalovirus OR cytomegalovirus OR cmv” AND “epidemiology OR prevalence OR incidence OR transplant OR transplantation OR hsct OR sot OR management OR treatment OR therapy”.
L’analisi di letteratura ha permesso di calcolare l’epidemiologia dell’infezione refrattaria applicando i tassi riportati dalle fonti bibliografiche ai numeri dei trapianti attuali. Inoltre, ha permesso di inquadrare il decorso della patologia e di delineare l’attuale gestione del paziente.
Al fine di validarne i risultati e di verificarne l’effettiva pratica clinica nella gestione del paziente refrattario, i risultati della ricerca di letteratura sono stati sottoposti, sotto forma di domande chiuse, a un panel di 8 esperti (Tab. I) di comprovata esperienza nella gestione dell’infezione da CMV in pazienti che hanno ricevuto un SOT o un HSCT. Nello specifico, la selezione dei panelist è avvenuta considerando come criterio di inclusione una forte expertise in almeno una delle seguenti aree di competenza: (i) trapianto di organo solido; (ii) trapianto di cellule staminali ematopoietiche; (iii) virologia, con focus sul CMV.
I panelist sono stati chiamati a rispondere a una serie di domande articolate nelle seguenti aree di interesse: (i) epidemiologia; (ii) standard of care e attuale gestione del paziente refrattario; (iii) bisogni insoddisfatti; (iv) prospettive future in relazione all’introduzione di nuove opzioni terapeutiche. Nello specifico, in riferimento alla prima area di interesse, è stato chiesto ai panelist di prendere visione della cascata epidemiologica riportata nella Figura 1 e di verificare che fosse in linea con la casistica interna del centro in cui operano. In riferimento alla seconda area di interesse è stato chiesto di confermare lo standard of care riportato dalle Linee Guida e di confermarne la reale applicazione nella pratica clinica. Per quanto riguarda la terza area di interesse, il panel è stato interrogato su quali fossero le maggiori problematiche riscontrate durante l’utilizzo dell’attuale standard of care e quali fossero i bisogni ancora non soddisfatti nella gestione della patologia di interesse. Infine, in riferimento alla quarta e ultima area di interesse, è stato chiesto quali fossero le prospettive future nella gestione del paziente con infezione refrattaria da CMV in seguito all’arrivo di nuove opzioni terapeutiche come maribavir.
| Baldanti Fausto | Professore Ordinario, Dipartimento di Scienze Clinico-Chirurgiche, Diagnostiche e Pediatriche, Università di Pavia; Direttore UOC Microbiologia e Virologia, Policlinico San Matteo, Pavia; Membro del Consiglio Direttivo AMCLI; Membro del Working Group Infezioni da CMV dell’European Society for Organ Transplantation (ESOT) |
| Citterio Franco | Professore Associato, Dipartimento di Medicina e Chirurgia Traslazionale, Università Cattolica del Sacro Cuore; Direttore UOC Trapianto di Rene, Policlinico Gemelli, Roma; past president e attuale membro SITO |
| Ferraresso Mariano | Professore Ordinario, Dipartimento di Scienze Cliniche e di Comunità, Università degli Studi di Milano; Direttore UOC Trapianto di Rene, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico-Università degli studi di Milano; membro del Consiglio Direttivo SITO; membro ESOT |
| Girmenia Corrado | Responsabile UOSD Pronto Soccorso e Accettazione Ematologica, AOU Policlinico Umberto I, Roma; Referente per il Gruppo di Lavoro GITMO sulle Infezioni |
| Maggiore Umberto | Professore di II Fascia, Dipartimento di Medicina e Chirurgia, Università di Parma |
| Martino Massimo | Direttore Centro Trapianti Cellule Staminali, Grande Ospedale Metropolitano Bianchi-Melacrino-Morello, Reggio Calabria; vicepresidente GITMO |
| Onida Francesco | Dirigente Medico, UOC Ematologia, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico-Università degli Studi di Milano, Milano; Direttore del programma Trapianti di Cellule Staminali Ematopoietiche GITMO |
| Potena Luciano | Direttore SSD Insufficienza Cardiaca e Trapianti, IRCCS Azienda Ospedaliero-Universitaria di Bologna; Presidente ESOT |

Fig. 1 - Cascata epidemiologica dei pazienti eleggibili al trattamento con maribavir basata sui dati di letteratura applicati ai numeri dei trapianti di organo solido e dei trapianti allogenici di cellule staminali ematopoietiche relativi all’anno 2021 (12-17).
Ciascun panelist ha avuto lo stesso contributo (uguale peso) nel processo di valutazione delle domande.
Le risposte dei panelist hanno permesso di costruire un manoscritto che, con l’obiettivo di raggiungere un consenso, è stato condiviso e validato da 3 esperti (Tab. II) di rilevanza nazionale con specifiche competenze in infettivologia, trapianti d’organo solido e trapianti di cellule staminali ematopoietiche.
| Ciceri Fabio | Professore Ordinario di Ematologia; Direttore UOC Ematologia e Trapianto di Midollo Osseo e Oncoematologia, Ospedale vita-salute San Raffaele, Milano; Presidente GITMO |
| Grossi Paolo Antonio | Professore Ordinario di Malattie Infettive, Direttore Clinica delle Malattie Infettive e Tropicali e Dipartimento Trapianti, Università degli Studi dell’Insubria ASST Sette Laghi, Varese; Responsabile second opinion infettivologica del Centro Nazionale Trapianti |
| Vistoli Fabio | Professore Associato di Chirurgia Generale, Divisione di Chirurgia Generale e dei Trapianti, Dipartimento di Ricerca Traslazionale e delle Nuove Tecnologie in Medicina e Chirurgia, Università di Pisa; Vicepresidente del Comitato Coordinatore del Collegio SIN-SITO per i Trapianti di Pancreas e Rene |
I principali risultati del progetto sono riportati nei paragrafi successivi.
Epidemiologia
Il report annuale del Centro Nazionale Trapianti (CNT) riporta che per il 2021 sono stati eseguiti 3.794 SOT. Il Libro GITMO 2022 invece riporta che per l’anno 2021 sono stati eseguiti 5.311 HSCT di cui 3.404 trapianti autologhi e 1.907 trapianti allogenici.
Nella cascata epidemiologica riportata nella Figura 1 sono stati considerati i SOT e gli HSCT allogenici, escludendo quindi gli HSCT autologhi per i quali l’infezione da CMV è rara e poco rilevante.
Per quanto riguarda i SOT, il tasso di incidenza globale dell’infezione/malattia da CMV è molto variabile e dipende sia dal tipo di organo trapiantato che dall’età e dallo stato sierologico di ricevente e donatore: si stima che l’infezione da CMV colpisca circa l’8-39% dei pazienti sottoposti a trapianto di organo solido (15). Applicando una media dei tassi sopracitati, si può stimare che nel 2021 i pazienti che, in seguito a SOT, hanno sviluppato un’infezione da CMV sono circa 892.
Per calcolare i pazienti affetti da infezione refrattaria da CMV in seguito a HSCT, si è considerato che l’82% dei pazienti riceventi un HSCT risulti sieropositivo agli anticorpi anti-CMV (14). Assumendo che la totalità di questi pazienti esegua un regime di profilassi, come descritto dalle Linee Guida e confermato dai panelist, i pazienti che sviluppano infezione da CMV in seguito alla profilassi sono pari al 18,1% (16). Pertanto, si può stimare che per il 2021 i pazienti che, in seguito a HSCT allogenico, hanno sviluppato un’infezione da CMV sono 283.
Sulla totalità dei pazienti riceventi HSCT, la percentuale di infezioni da CMV ammonta quindi al 14,8%: tale percentuale risulta considerevolmente più bassa rispetto al tasso riportato per i SOT (23,5%). Questa differenza è imputabile all’utilizzo diffuso di letermovir, un antivirale indicato per la profilassi della riattivazione e della malattia da CMV in pazienti riceventi un HSCT allogenico, introdotto sul mercato italiano nel 2018. Letermovir, a differenza dei classici antivirali (valganciclovir, ganciclovir, foscarnet e cidofovir) inibitori della DNA polimerasi, possiede un meccanismo d’azione inedito, interviene sul complesso terminasi virale, e un miglior profilo tossicologico. Pertanto, il suo utilizzo ha ridotto le infezioni da CMV post-profilassi e, di conseguenza, ha ridotto anche la popolazione refrattaria.
Assumendo che il 100% dei pazienti con infezione da CMV (1.175) riceva un trattamento, il 10,7% dei pazienti sottoposti a SOT e il 6,9% dei pazienti sottoposti a HSCT sviluppano refrattarietà (15). A questi pazienti si vanno ad aggiungere ulteriori 2 pazienti calcolati secondo il tasso di crescita annuo dal 2011 al 2021 riportato dal Sistema Informativo Trapianti. Pertanto, i pazienti che in seguito a trapianto vanno incontro a un’infezione refrattaria da CMV ammontano a 117 di cui 8 bambini e 109 adulti.
Standard of care e gestione del paziente
La Figura 2 riporta l’algoritmo terapeutico per la gestione del paziente refrattario. Nello specifico, quando il paziente non risponde al trattamento di prima linea (valganciclovir/ganciclovir alla dose standard), il primo tentativo è quello di aumentare la dose di valganciclovir o ganciclovir fino alla dose massima consentita (da 5 mg/kg a 10 mg/kg). Se, nonostante l’utilizzo di questa strategia, la replicazione virale non rallenta, si deve ricorrere ad altre soluzioni. Foscarnet si dimostra essere il trattamento d’elezione al fallimento di valganciclovir ma, nonostante ciò, il suo utilizzo è molto limitato in quanto estremamente nefrotossico e, pertanto, deve essere utilizzato con molta attenzione e per periodi brevissimi. Inoltre, si sottolinea che l’utilizzo di foscarnet nel post-trapianto di cellule staminali ematopoietiche è autorizzato secondo la Legge 648/96 mentre, nel trapianto di organi solidi, non esiste alcuna autorizzazione che ne consenta l’utilizzo e pertanto è impiegato off-label.
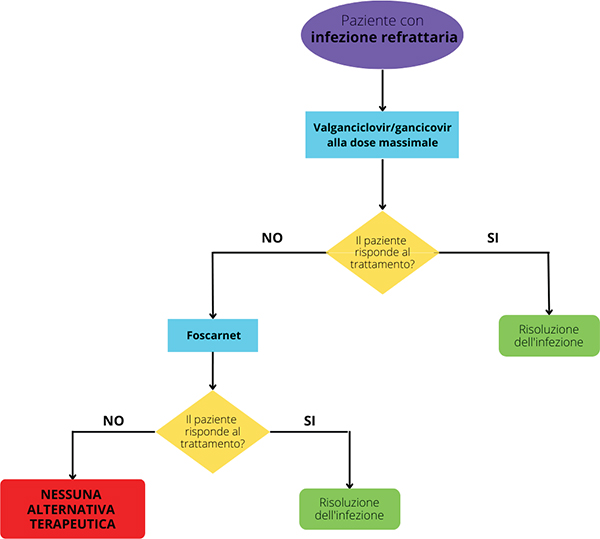
Fig. 2 - Sintesi dell’algoritmo terapeutico dell’infezione da CMV refrattaria.
Un’altra strategia utilizzata e affiancata alla somministrazione di valganciclovir/ganciclovir alle dosi massime o di foscarnet è la riduzione delle dosi della terapia immunosoppressiva nella speranza di non indurre il rigetto e di stimolare le difese naturali del paziente.
Arrivati a questo stadio, se le strategie precedentemente descritte non sono sufficienti a rallentare e ad arrestare la replicazione virale, il paziente con infezione refrattaria non ha alcuna alternativa terapeutica.
Bisogni insoddisfatti
Nonostante l’attuale standard of care, l’infezione e la malattia da CMV nei pazienti sottoposti a trapianto sono associate a un aumento della morbilità e a diverse conseguenze, tra cui infezioni opportunistiche, rigetto e fallimento del trapianto, nonché a un aumento della mortalità (18). Pertanto, la gestione dell’infezione da CMV post-trapianto rappresenta un’area di grande interesse per il Servizio Sanitario Nazionale nonché per la Quality of Life (QoL) dei pazienti sottoposti a trapianto.
Una delle principali criticità che si riscontra nella gestione del paziente è rappresentata dagli effetti avversi gravi che si registrano con l’utilizzo dei classici antivirali: mielosoppressione caratterizzata da leucopenia, neutropenia e trombocitopenia e tossicità renale che porta a uno squilibrio elettrolitico, talvolta letale.
Si riscontra che spesso la gestione di questi effetti collaterali risulta più complessa della gestione dell’infezione stessa. A volte è il paziente stesso che rifiuta di continuare il trattamento per il forte impatto degli effetti avversi. Inoltre, il paziente che sviluppa effetti collaterali aumenta notevolmente gli accessi all’ospedale e ciò rappresenta una criticità onerosa in termini di tempo, di risorse umane e organizzative e anche la QoL del paziente ne risulta fortemente impattata. Quindi, soprattutto nel caso di infezione refrattaria, le terapie disponibili, essendo caratterizzate da una limitata maneggevolezza e da un profilo di sicurezza sfavorevole che spesso costringe alla riduzione della dose con conseguenti minore efficacia e maggiore rischio di sviluppo di refrattarietà, possono peggiorare ulteriormente il quadro clinico aggiungendo gli effetti tossici all’avanzare dell’infezione.
In questo contesto, le infezioni refrattarie (con o senza resistenza), anche se rare, rappresentano la maggiore problematica: non solo le opzioni dell’attuale panorama terapeutico non sono specificatamente studiate per le infezioni refrattarie, ma, inoltre, il loro utilizzo è limitato per via del forte impatto degli effetti collaterali correlati.
Per quanto descritto, l’assenza di opzioni terapeutiche sicure ed efficaci per il trattamento dell’infezione da CMV refrattaria ai classici antivirali (valganciclovir, ganciclovir e foscarnet) costituisce il maggior unmet medical need. Il paziente refrattario necessita di un intervento tempestivo con medicinali di comprovata efficacia e con un profilo di sicurezza più favorevole che consenta di seguire la terapia senza dover intervenire con aggiustamenti di dose costretti da tossicità rilevanti e che, di conseguenza, aiuti la ricostituzione immunitaria del paziente rendendolo nuovamente autonomo nel controllo dell’infezione.
Prospettive future
L’introduzione di letermovir ha già notevolmente cambiato lo scenario terapeutico nel trattamento dell’infezione post-HSCT. Pertanto, l’arrivo di nuove opzioni terapeutiche come maribavir, che, attraverso il suo meccanismo d’azione innovativo (esercita un’inibizione competitiva dell’adenosina trifosfato e si lega alla proteina chinasi UL97 ostacolando diverse funzioni vitali del virus), garantisce un migliore profilo di efficacia e di sicurezza, porterebbe a un notevole miglioramento nella gestione del paziente con infezione refrattaria indipendentemente dalla presenza di resistenza.
Inoltre, data la tendenza sempre maggiore verso la medicina di precisione, sarà necessario integrare l’impiego di farmaci antivirali con l’utilizzo di nuovi approcci come il monitoraggio attraverso i test per l’immunità cellulo-mediata, gli anticorpi monoclonali, i vaccini e il trasferimento di cellule T adottive.
Avere a disposizione un’alternativa terapeutica efficace e sicura alla quale poter ricorrere rapidamente costituirebbe una rivoluzione nel paradigma terapeutico del paziente refrattario che finora non ha a disposizione alcun trattamento mirato.
Conclusioni
I trapianti rappresentano un grande investimento per il Servizio Sanitario Nazionale. Per questo motivo è importante evitarne il fallimento e le infezioni che ne minacciano l’esito positivo. In particolare, l’infezione da CMV, soprattutto quella refrattaria (con o senza resistenza), può portare all’incremento del burden del paziente con un aumento del rischio di fallimento del trapianto e di morte.
Le infezioni refrattarie con o senza resistenza, nonostante rappresentino una minoranza, costituiscono la maggiore criticità che si possa verificare nel paziente nella fase post-trapianto. L’assenza di opzioni terapeutiche specificatamente studiate per le infezioni refrattarie e l’elevata tossicità dei medicinali attualmente impiegati fanno sì che i pazienti con infezione refrattaria presentino un elevato unmet need.
L’introduzione di nuove opzioni terapeutiche come maribavir, medicinale dotato di un meccanismo d’azione innovativo e caratterizzato da un migliore profilo di sicurezza rispetto alle attuali alternative, porterebbe quindi a un notevole miglioramento nella gestione del paziente con infezione refrattaria, sia dal punto di vista dell’efficacia che dal punto di vista della sicurezza.
Disclosures
Conflict of interest: The Authors declare no conflicts of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Griffiths P, Reeves M. Pathogenesis of human cytomegalovirus in the immunocompromised host. Nat Rev Microbiol. 2021;19(12):759-773. CrossRef PubMed
- 2. Crough T, Khanna R. Immunobiology of human cytomegalovirus: from bench to bedside. Clin Microbiol Rev. 2009;22(1):76-98. Table of Contents. CrossRef PubMed
- 3. Zuhair M, Smit GSA, Wallis G, et al. Estimation of the worldwide seroprevalence of cytomegalovirus: A systematic review and meta-analysis. Rev Med Virol. 2019;29(3):e2034. CrossRef PubMed
- 4. Cicchetti A, Giorgio L, Basile M, et al. Analisi del percorso ottimale nella gestione dei pazienti post allo-HSCT a rischio di ri-attivazione del citomegalovirus. Quaderni dell’. Ital J Public Health. 2021;10:3-38.
- 5. Istituto Superiore di Sanità. EpiCentro – L’epidemiologia per la salute pubblica. Citomegalovirus. Online (accessed January 2023).
- 6. Meesing A, Razonable RR. New Developments in the Management of Cytomegalovirus Infection After Transplantation. Drugs. 2018;78(11):1085-1103. CrossRef PubMed
- 7. Boutolleau D, Coutance G, Désiré E, et al. Association between cytomegalovirus infection and allograft rejection in a large contemporary cohort of heart transplant recipients. Transpl Infect Dis. 2021;23(4):e13569. CrossRef PubMed
- 8. Chemaly RF, Chou S, Einsele H, et al; Resistant Definitions Working Group of the Cytomegalovirus Drug Development Forum. Definitions of Resistant and Refractory Cytomegalovirus Infection and Disease in Transplant Recipients for Use in Clinical Trials. Clin Infect Dis. 2019;68(8):1420-1426. CrossRef PubMed
- 9. Girmenia C, Lazzarotto T, Bonifazi F, et al. Assessment and prevention of cytomegalovirus infection in allogeneic hematopoietic stem cell transplant and in solid organ transplant: A multidisciplinary consensus conference by the Italian GITMO, SITO, and AMCLI societies. Clin Transplant. 2019;33(10):e13666. CrossRef PubMed
- 10. Owers DS, Webster AC, Strippoli GF, Kable K, Hodson EM. Pre-emptive treatment for cytomegalovirus viraemia to prevent cytomegalovirus disease in solid organ transplant recipients. Cochrane Database Syst Rev. 2013;2013(2):CD005133. CrossRef PubMed
- 11. Haidar G, Boeckh M, Singh N. Cytomegalovirus Infection in Solid Organ and Hematopoietic Cell Transplantation: state of the Evidence. J Infect Dis. 2020;221(suppl 1):S23-S31. CrossRef PubMed
- 12. Centro Nazionale Trapianti. Report attività annuale rete nazionale trapianti. 2021. Online (Accessed January 2023)
- 13. Gruppo Italiano per il Trapianto di Midollo Osseo, cellule staminali emopoietiche e terapia cellulare. Transplant Data. 2021 Data, Online.
- 14. Girmenia C, Raiola AM, Piciocchi A, et al. Incidence and outcome of invasive fungal diseases after allogeneic stem cell transplantation: a prospective study of the Gruppo Italiano Trapianto Midollo Osseo (GITMO). Biol Blood Marrow Transplant. 2014;20(6):872-880. CrossRef PubMed
- 15. Grossi PA, Baldanti F, Andreoni M, Perno CF. CMV infection management in transplant patients in Italy. J Clin Virol. 2020;123:104211. CrossRef PubMed
- 16. Martino M, Pitino A, Gori M, et al. Letermovir Prophylaxis for Cytomegalovirus Infection in Allogeneic Stem Cell Transplantation: A Real-World Experience. Front Oncol. 2021;11:740079. CrossRef PubMed
- 17. Ministero della Salute. Sistema Informativo Trapianti. Online (Accessed January 2023).
- 18. Chitasombat MN, Watcharananan SP. Burden of cytomegalovirus reactivation post kidney transplant with antithymocyte globulin use in Thailand: A retrospective cohort study. F1000 Res. 2018;7:1568. CrossRef PubMed