 |
AboutOpen | 2023; 10: 13-21 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2515 ORIGINAL RESEARCH ARTICLE |
 |
Costo per responder di vedolizumab e ustekinumab nel trattamento della malattia di Crohn in pazienti che hanno fallito una precedente terapia con un antagonista del TNF-α in Italia
Cost per responder for vedolizumab and ustekinumab in Crohn’s disease patients after failure of TNF-α inhibitors in Italy
Background: The aim of this economic evaluation was to compare the cost per responder between vedolizumab and ustekinumab in patients with Crohn’s disease (CD) after failure of tumor necrosis factor-α inhibitors in Italy.
Methods: Clinical efficacy was assessed using the results of an Italian large multicentre observational retrospective cohort study. The aim of the study was to compare the effectiveness of ustekinumab and vedolizumab as second line therapy in Crohn’s disease patients in which tumour necrosis factor-α inhibitors failed. Clinical efficacy of vedolizumab and ustekinumab was measured by clinical response and clinical remission. Treatment costs were based on the number of administrations at 26 or 52 weeks. Cost per responder, based on clinical efficacy and clinical response, was used as a cost-effectiveness indicator.
Results: Regardless of the clinical efficacy measure used and the treatment duration considered, the cost per responder was consistently lower for vedolizumab compared with ustekinumab on all clinical measures. Considering the clinical response, the cost per responder at 26 weeks was € 15,640 for vedolizumab and € 23,667 for ustekinumab and at 52 weeks was € 23,927 for vedolizumab and € 30,820 for ustekinumab. Considering the clinical remission, the cost per responder at 26 weeks was € 22,832 for vedolizumab and € 33,786 for ustekinumab and at 52 weeks was € 29,488 for vedolizumab and € 46,847 for ustekinumab. Sensitivity analysis confirmed the validity of results.
Conclusion: These results suggest that vedolizumab is a cost-effective option compared with ustekinumab from the perspective of the Italian health service in patients with CD after failure of TNF-α inhibitors.
Keywords: Cost per responder, Crohn’s disease, Italian NHS, TNF-α inhibitors, Ustekinumab, Vedolizumab
Received: November 3, 2022
Accepted: December 7, 2022
Published online: January 16, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La malattia di Crohn (Crohn’s disease, CD) è una patologia infiammatoria cronica dell’intestino caratterizzata da un accumulo progressivo di danno d’organo (per esempio, ascessi, fistole e stenosi) e spesso associata a sintomi sistemici (fino al 40% dei pazienti) (1).
La disponibilità di adeguati trattamenti farmacologici è fondamentale per ridurre significativamente i sintomi e raggiungere una remissione nel lungo termine (2). La terapia convenzionale (conventional therapy, CT) somministrata nella gestione del paziente con CD attiva è rappresentata dagli aminosalicilati, dai glucocorticoidi, dai farmaci immunomodulatori e dagli antibiotici (3). Nell’ultimo decennio il trattamento farmacologico della CD è cambiato con l’impiego delle terapie biologiche (4,5). L’uso dei farmaci biologici è principalmente raccomandato nei pazienti che non possono utilizzare lo SoC a causa di intolleranza, mancata risposta o controindicazioni. Gli inibitori del fattore di necrosi tumorale alfa (TNF-α) vengono considerati la terapia biologica di prima linea per la gestione della CD da moderata a grave refrattaria allo SoC e hanno rappresentato per diversi anni il pilastro del trattamento biologico di questa patologia (1,6). Nonostante l’eccellente efficacia complessiva degli inibitori del TNF-α, circa un terzo dei pazienti non risponde alla terapia di induzione e, tra i pazienti che rispondono, fino al 45% perde progressivamente la risposta nel corso del tempo (7,8).
Negli ultimi anni per il trattamento della CD da moderata a grave sono stati approvati nuovi farmaci biologici, tra cui vedolizumab (VDZ) e ustekinumab (UST) (9,10). Vedolizumab è un anticorpo monoclonale umanizzato della classe delle IgG1 che si lega in modo specifico all’integrina α4β7, espressa in modo preferenziale sui linfociti intestinali (gut-homing) T helper (11). Ustekinumab è un anticorpo monoclonale IgG1κ interamente umano, che lega l’interleuchina (IL)-12/23 (12). In Italia questi farmaci biologici vengono solitamente posizionati dopo il fallimento della terapia con inibitori del TNF-α nel trattamento della CD da moderata a grave.
All’interno del sistema salute, dove uno dei principali obiettivi è il contenimento/efficientamento della spesa farmaceutica, il differente meccanismo d’azione, l’efficacia variabile e il corrispondente costo di trattamento determinano, sia per il clinico sia per il decisore, la necessità di un confronto di costo-efficacia tra ustekinumab e vedolizumab per stimarne l’effettivo “value for money” nel trattamento della CD dopo il fallimento degli inibitori del TNF-α.
Obiettivo
La presente valutazione economica è stata condotta con l’obiettivo di stimare, sulla base dei risultati clinici di uno studio osservazionale, retrospettivo e multicentrico condotto in Italia (13), il costo per responder di vedolizumab e di ustekinumab nel trattamento della malattia di Crohn in fase attiva da moderata a severa nei pazienti che hanno fallito una precedente terapia con uno o più inibitori del TNF-α.
Metodi
Premessa
L’analisi è stata sviluppata in ambiente Microsoft® Excel®. In linea con i timepoint adottati nello studio osservazionale (13), il costo di trattamento associato a vedolizumab e a ustekinumab è stato calcolato considerando due differenti orizzonti temporali: 26 e 52 settimane. Il costo per responder, basato sulla remissione clinica e sulla risposta clinica, di vedolizumab e di ustekinumab è stato quindi calcolato dividendo il corrispondete costo totale di trattamento a 26 o a 52 settimane per gli endpoint clinici (remissione e risposta) valutati nello studio osservazionale (13).
Popolazione
In linea con la popolazione dello studio osservazionale (13), l’analisi di costo per responder ha considerato i pazienti con una diagnosi confermata di CD da almeno 3 mesi, con fallimento (primario o secondario) o con intolleranza a uno o più inibitori del TNF-α secondo le attuali Linee Guida dell’European Crohn’s and Colitis Organization (ECCO) (6) e con indicazione a una seconda terapia biologica con vedolizumab o ustekinumab per malattia luminale.
Studio osservazionale
Gli endpoint clinici (remissione clinica e risposta clinica) considerati nell’analisi di costo per responder riflettono i risultati dello studio osservazionale, retrospettivo, di coorte, condotto in 20 centri italiani di riferimento per il trattamento delle IBD a nome del gruppo italiano per lo studio delle malattie infiammatorie intestinali (IG-IBD) (13).
Complessivamente lo studio osservazionale ha seguito nel tempo 470 pazienti, di cui 231 (49,1%) trattati con vedolizumab e 239 (50,9%) trattati con ustekinumab. Le caratteristiche al basale dei pazienti sono risultate simili tra i due gruppi, fatta eccezione per l’età mediana (UST: 41 anni; VDZ: 47 anni; p = 0,0004), l’età mediana alla diagnosi (UST: 26 anni; VDZ: 32 anni; p < 0,0001), le manifestazioni extraintestinali (UST: 42,7%, VDZ: 10,3%; p = 0,001) e l’uso di steroidi (UST: 31,4%, VDZ: 49,4%; p < 0,0001) (Tab. I).
La Tabella II riporta invece il dettaglio degli endpoint clinici a 26 e a 52 settimane di trattamento considerati nella presente analisi: i) la percentuale di pazienti con risposta clinica a 26 e a 52 settimane, definita come la riduzione di HBI (Harvey Bradshaw Index) ≥ 3 punti rispetto al basale o HBI < 5 se HBI ≤ 7 al basale, e ii) la percentuale di pazienti con remissione a 26 e a 52 settimane, definita con punteggio HBI ≤ 4. Di questi endpoint, la percentuale di remissione a 52 settimane determina una differenza statisticamente significativa a vantaggio di vedolizumab, mentre la maggiore efficacia di vedolizumab valutata dagli altri endpoint rispetto a ustekinumab non è risultata statisticamente significativa.
Orizzonte temporale
Il calcolo del costo per responder è stato effettuato considerando due differenti orizzonti temporali, 26 e 52 settimane di trattamento, che corrispondono ai timepoint di osservazione considerati nello studio osservazionale (13). Si ritiene che tali orizzonti temporali, soprattutto quello a 52 settimane, siano idonei a rilevare, tra vedolizumab e ustekinumab, eventuali differenze in termini sia di efficacia (risposta e remissione) sia di costo di trattamento.
Prospettiva di analisi
L’analisi economica è stata condotta nella prospettiva del Servizio Sanitario Nazionale (SSN) considerando il costo di acquisto della terapia farmacologica (vedolizumab o ustekinumab) e il relativo costo di somministrazione. Il costo della TC, costituito da immunomodulatori e da steroidi, non è stato incluso nell’analisi in quanto lo studio osservazionale non ha riportato il dettaglio di tali consumi associati alla terapia biologica nelle 26 o nelle 52 settimane di trattamento (13). L’esclusione di tali farmaci non dovrebbe però aver determinato differenze incrementali significative nei costi di trattamento complessivi associati a ustekinumab e a vedolizumab o aver favorito quest’ultimo. Tale assunzione troverebbe riscontro in alcuni dei dati raccolti dallo studio osservazionale (13). Entrambe le coorti, infatti, mostrano una sovrapponibile e bassa percentuale di utilizzo al basale di immunomodulatori (UST: 9,6%; VDZ: 9,5%; p = 0,971), mentre a 52 settimane i pazienti trattati con vedolizumab evidenziano una maggiore percentuale di pazienti in remissione liberi da steroidi (UST: 40,6%, VDZ: 51,1%; p = 0,038) (13).
Nella valutazione non è stato incluso alcun costo per la gestione di eventi avversi gravi poiché, alla luce del profilo di sicurezza indagato dallo studio osservazionale (13), non sono emerse differenze significative tali da influenzare l’analisi del costo per responder. Solo due eventi avversi gravi hanno richiesto il ricovero ospedaliero: uno per ustekinumab a causa dello sviluppo di un ascesso addominale e uno per vedolizumab per sepsi da infezione del catetere venoso centrale (13).
| Parametri | Vedolizumab
(n = 231) |
Ustekinumab
(n = 239) |
p | ||||
|---|---|---|---|---|---|---|---|
| Mediana | IQR | Mediana | IQR | ||||
| Età | 47 | 37 | 59 | 41 | 32,5 | 42 | 0,0004 |
| Età alla diagnosi | 32 | 23 | 44,75 | 26 | 19 | 35 | <0,0001 |
| HBI al baseline | 8 | 7 | 10 | 8 | 7 | 10 | 0,053 |
| Durata della malattia | 11 | 7 | 17 | 12 | 6 | 20 | 0,882 |
| N | % | N | % | p | |||
| Sesso (Maschio) | 122 | 52,8% | 129 | 54,0% | 0,801 | ||
| Appendicectomia | 53 | 22,9% | 77 | 32,2% | 0,046 | ||
| Fumo | 149 | 64,5% | 152 | 64,4% | 0,205 | ||
| Storia familiare | 20 | 8,7% | 24 | 10,1% | 0,607 | ||
| Manifestazioni extra intestinali | 66 | 28,6% | 102 | 42,7% | 0,001 | ||
| Comportamento della malattia | 0,141 | ||||||
| B1 | 85 | 37,0% | 80 | 33,5% | |||
| B2 | 112 | 48,7% | 107 | 44,8% | |||
| B3 | 34 | 14,8% | 52 | 21,8% | |||
| Localizzazione della malattia | 0,099 | ||||||
| L1 | 75 | 32,6% | 95 | 39,7% | |||
| L2 | 36 | 15,7% | 24 | 10,0% | |||
| L3 | 120 | 52,2% | 120 | 50,2% | |||
| Tratti digerenti superiori (L4) | 17 | 7,4% | 15 | 6,3% | 0,641 | ||
| Storia di malattia perianale | 21 | 9,1% | 21 | 8,8% | 0,908 | ||
| Precedente uso di TNF-α | 0,752 | ||||||
| Infliximab | 48 | 20,8% | 44 | 18,4% | |||
| Adalimumab | 90 | 39,0% | 92 | 38,5% | |||
| Entrambi | 93 | 40,3% | 103 | 43,1% | |||
| Motivo dell’interruzione di TNF-α | 0,565 | ||||||
| Fallimento primario | 23 | 10,0% | 22 | 9,2% | |||
| Fallimento secondario | 148 | 64,1% | 164 | 68,6% | |||
| Intolleranza | 60 | 26,0% | 53 | 22,2% | |||
| Precedente resezione dell’intestino | 75 | 32,5% | 90 | 37,7% | 0,293 | ||
| Steroidi al basale | 114 | 49,4% | 75 | 31,4% | <0,0001 | ||
| Immunomodulatori al basale | 22 | 9,5% | 23 | 9,6% | 0,971 | ||
| Endpoint | Vedolizumab | Ustekinumab | Delta | p |
|---|---|---|---|---|
| (n = 231) | (n = 239) | |||
| 26 settimane | ||||
| – risposta clinica | 65,4% | 60,1% | 5,3% | n.s. |
| – remissione | 44,8% | 42,1% | 2,7% | n.s. |
| 52 settimane | ||||
| – risposta clinica | 68,4% | 64,6% | 3,8% | n.s. |
| – remissione | 55,5% | 42,5% | 13,0% | p = 0,010 |
n.s. = non significativo.
Nell’analisi del caso base non è stato considerato l’effetto determinato dalla dose escalation sul costo di trattamento di vedolizumab e di ustekinumab rilevato dallo studio osservazionale (13) in quanto non sono emerse differenze significative né a 26 (UST: 16,3%, VDZ: 17,7%) né a 52 settimane di trattamento (UST: 22,4%, VDZ: 22,2%). Tale effetto è stato però valutato nell’analisi di sensibilità.
Infine, dal momento che in letteratura non sono presenti analisi economiche che, nel trattamento della CD, abbiano stimato i consumi e i costi associati all’attività di monitoraggio, tale voce di costo è stata esclusa dall’analisi assumendo l’assenza di costi differenziali tra le due alternative.
Regime posologico
I regimi posologici utilizzati nell’analisi di costo per responder riflettono quanto adottato nello studio osservazionale (13) e riportato nei rispettivi riassunti delle caratteristiche di prodotto (RCP) (11,12). Il regime posologico di vedolizumab prevede la somministrazione di 300 mg, mediante infusione endovenosa (ev), alla settimana 0, 2 e 6 (induzione), seguita dalla somministrazione di 300 mg, sempre mediante infusione ev, ogni otto settimane (mantenimento) (11). In presenza di una riduzione della risposta, alcuni pazienti potrebbero trarre beneficio da un aumento della frequenza di somministrazione di vedolizumab 300 mg per via ev ogni 4 settimane (dose escalation) (11). Il regime posologico utilizzato per ustekinumab prevede, invece, la somministrazione di 6 mg/kg, mediante infusione ev, alla settimana 0 (induzione), seguita dalla somministrazione di 90 mg, tramite iniezione sottocute (sc), ogni dodici settimane (mantenimento) (12). I pazienti che non hanno risposto alla dose ogni 12 settimane possono beneficiare di un aumento della frequenza di dosaggio ogni 8 settimane (dose escalation) (12). La Tabella III riporta il dettaglio del regime posologico e il numero di unità (flaconcini/siringhe) somministrate a 26 e a 52 settimane per i pazienti trattati con vedolizumab o ustekinumab.
Dal momento che lo studio osservazionale (13) non riporta il peso medio dei pazienti e dal momento che il dosaggio della formulazione ev (induzione) di ustekinumab è peso dipendente, per stimarne il relativo costo di trattamento è stata assunta una posologia di riferimento di 390 mg (3 flaconcini da 130 mg ciascuno). Si ritiene che tale posologia, riferita a un paziente con un peso medio corporeo maggiore di 55 kg e inferiore o uguale a 85 kg (12), ricopra la maggior parte della casistica trattata nella pratica clinica.
Costo di acquisizione dei medicinali considerati
Sia per vedolizumab sia per ustekinumab (ev o sc) è stato considerato il prezzo ex-factory al netto degli sconti temporanei di legge (Determinazione AIFA del 3 luglio 2006, GU n° 156 del 7 luglio 2006 e successiva Determinazione AIFA del 9 febbraio 2007, GU n° 57 del 9 marzo 2007 e proroghe). Per vedolizumab è stato considerato un prezzo di € 2.036,04 per la confezione da 1 flaconcino da 300 mg, mentre per ustekinumab è stato considerato un prezzo di € 2.842,88 sia per la confezione da 1 flaconcino (ev) da 130 mg sia per la confezione da 1 siringa (sc) da 90 mg. La Tabella III riporta il dettaglio del costo a 26 e a 52 settimane di trattamento associato ai due farmaci biologici.
| Farmaco | Regime posologico | Numero somministrazioni | Numero unità | Costo di trattamento |
|---|---|---|---|---|
| 26 settimane di trattamento | ||||
| Vedolizumab | Il regime posologico raccomandato è di 300 mg da somministrare mediante infusione endovenosa a zero, due e sei settimane e successivamente ogni otto settimane | 5 | 5 | € 10.180,20 |
| Ustekinumab | Il trattamento deve essere iniziato con una singola dose per via endovenosa in base al peso corporeo. La soluzione per infusione deve essere composta dal numero di flaconcini di STELARA 130 mg così specificato: i) ≤ 55 kg 260 mg 2 flaconcini, ii) da > 55 kg a ≤ 85 kg 390 mg 3 flaconcini, iii) > 85 kg 520 mg 4 flaconcini | 1 | 3 | € 14.214,38 |
| La prima somministrazione sottocutanea di 90 mg (sc) deve avvenire alla settimana 8 dopo la dose endovenosa. Dopo questa, si consiglia la dose ogni 12 settimane | 2 | 2 | € 14.214,38 | |
| 52 settimane di trattamento | ||||
| Vedolizumab | Il regime posologico raccomandato è di 300 mg da somministrare mediante infusione endovenosa a zero, due e sei settimane e successivamente ogni otto settimane | 8 | 8 | € 16.288,32 |
| Ustekinumab | Il trattamento deve essere iniziato con una singola dose per via endovenosa in base al peso corporeo. La soluzione per infusione deve essere composta dal numero di flaconcini di STELARA 130 mg così specificato: i) ≤ 55 kg 260 mg 2 flaconcini, ii) da > 55 kg a ≤ 85 kg 390 mg 3 flaconcini, iii) > 85 kg 520 mg 4 flaconcini | 1 | 3 | € 19.900,13 |
| La prima somministrazione sottocutanea di 90 mg (sc) deve avvenire alla settimana 8 dopo la dose endovenosa. Dopo questa, si consiglia la dose ogni 12 settimane | 4 | 4 | € 19.900,13 | |
Costo della somministrazione
Nell’analisi di costo per responder è stato ipotizzato che la somministrazione sc non determini alcun costo, in quanto si è assunto che i farmaci vengano auto somministrati dal paziente o dal caregiver. Differentemente, la somministrazione endovenosa (ev) è stata valorizzata considerando come proxy la tariffa ambulatoriale di € 9,71 rimborsata dal SSN (14).
Analisi di sensibilità
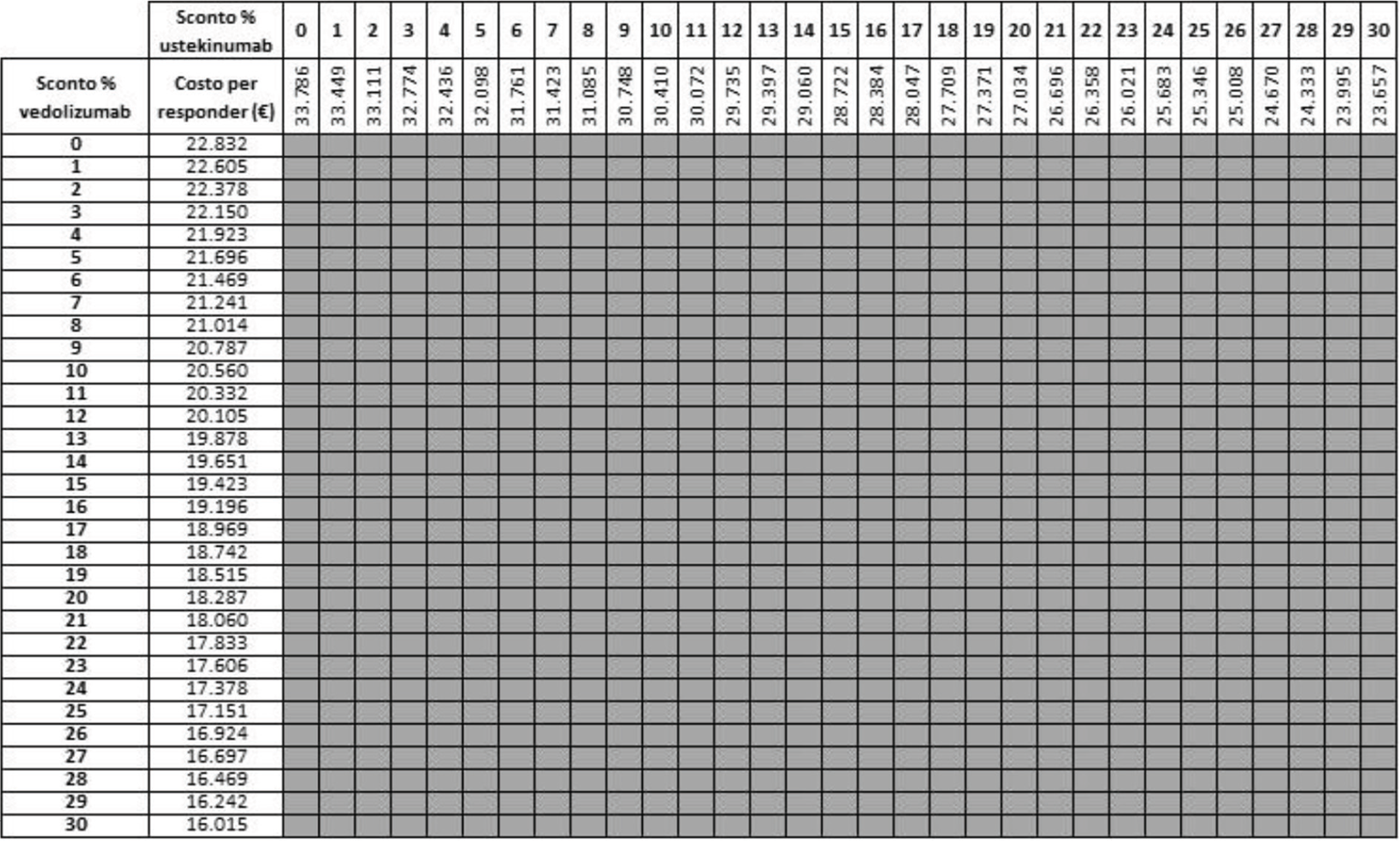
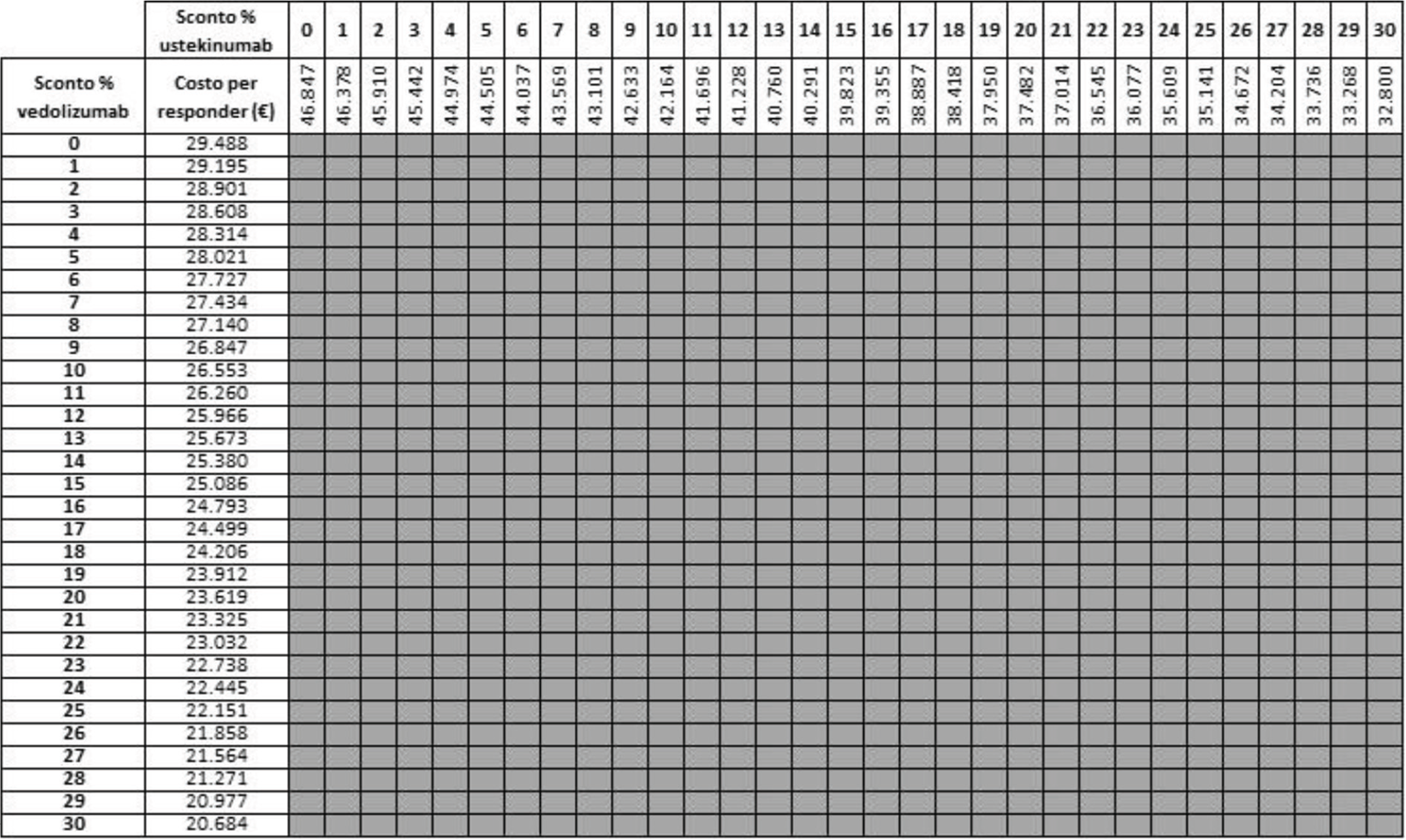
Dato che i risultati del caso base potrebbero non riflettere l’attuale prezzo di vedolizumab e di ustekinumab, in quanto ai rispettivi costi di trattamento potrebbero essere praticati degli sconti aggiuntivi, è stata condotta un’analisi di scenario per valutare l’impatto che diverse ipotesi di sconto potrebbero determinare sul calcolo del costo per responder. È stato quindi ipotizzato che, per entrambi i farmaci, il prezzo possa variare applicando uno sconto compreso tra lo 0% e il 30%. L’analisi di scenario, tramite una serie di Tabelle a matrice, mostra tutti i possibili confronti dei valori di costo per responder a 26 e a 52 settimane di vedolizumab e di ustekinumab ricalcolati per ogni endpoint considerato.
Nonostante i risultati dello studio osservazionale (13) non abbiano identificato significative differenze in termini di dose escalation tra vedolizumab e ustekinumab, è stata condotta un’analisi di sensibilità per valutarne l’effetto sui risultati del caso base. Sono stati quindi ricalcolati i costi per responder a 26 e a 52 settimane di vedolizumab e ustekinumab, applicando le rispettive percentuali di dose escalation a 26 (UST: 16,3%, VDZ: 17,7%) e a 52 settimane (UST: 22,4%, VDZ: 22,2%).
Risultati
Costo per responder a 26 e a 52 settimane
La Figura 1 e la Tabella IV riportano il costo per responder a 26 settimane di trattamento con vedolizumab o con ustekinumab calcolato rispetto alla risposta e alla remissione. In entrambi i confronti vedolizumab determina il minor costo per responder con una differenza rispetto a ustekinumab di € 8.027, se consideriamo come endpoint la risposta, e di € 10.954, se invece consideriamo come endpoint la remissione.
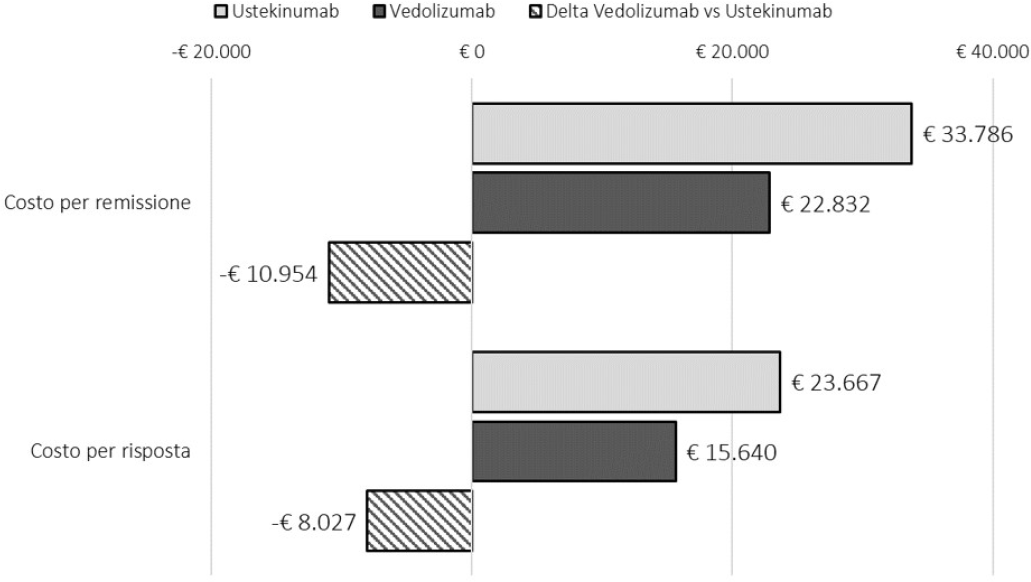
Fig. 1 - Costo per responder a 26 settimane: risposta e remissione.
| Vedolizumab | Ustekinumab | Delta | |
|---|---|---|---|
| (n = 231) | (n = 239) | ||
| Costo per responder a 26 settimane | |||
| – risposta clinica | € 17.640 | € 23.667 | –€ 8.027 |
| – remissione | € 22.832 | € 33.786 | –€ 10.954 |
| Costo per responder a 52 settimane | |||
| – risposta clinica | € 23.927 | € 30.820 | –€ 6.893 |
| – remissione | € 29.488 | € 46.847 | –€ 17.358 |
La Figura 2 e la Tabella IV illustrano i risultati del costo per responder calcolato sempre rispetto a risposta e remissione, ma considerando un orizzonte temporale di 52 settimane. Anche in questo caso, in entrambi i confronti, vedolizumab presenta un costo per responder inferiore a quello associato a ustekinumab, con una differenza di € 6.893, se consideriamo come endpoint la risposta, e di € 17.358, se invece consideriamo come endpoint la remissione.
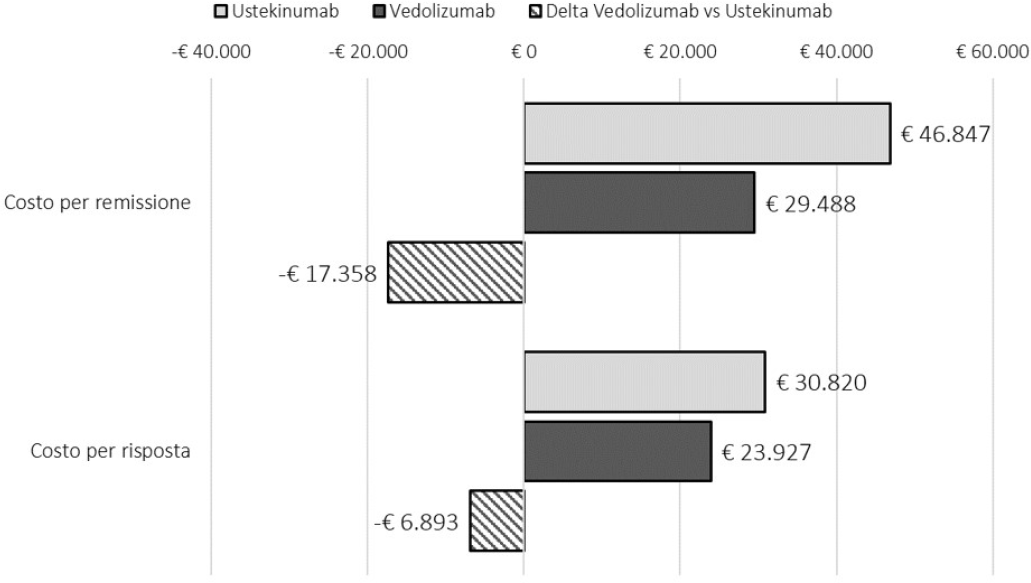
Fig. 2 - Costo per responder a 52 settimane: risposta e remissione clinica.
Analisi di sensibilità
Le Tabelle a matrice V-VIII mostrano i risultati dell’analisi di scenario condotta per stimare l’impatto che uno sconto compreso tra lo 0% e il 30% applicato al costo di trattamento di vedolizumab e di ustekinumab potrebbe determinare sui risultati espressi in termini di costo per responder. Considerando come endpoint la risposta e tutte le possibili combinazioni di sconto, a 26 e a 52 settimane di trattamento la probabilità che il costo per responder di vedolizumab sia inferiore a quello di ustekinumab è del 100% (Tab. V) e del 95,2% (Tab. VI), rispettivamente. Considerando invece come endpoint la remissione e tutte le possibili combinazioni di sconto, indipendentemente dal timepoint (26 o 52 settimane di trattamento) considerato, la probabilità che il costo per responder di vedolizumab sia inferiore a quello di ustekinumab è sempre del 100% (Tabb. VII, VIII).
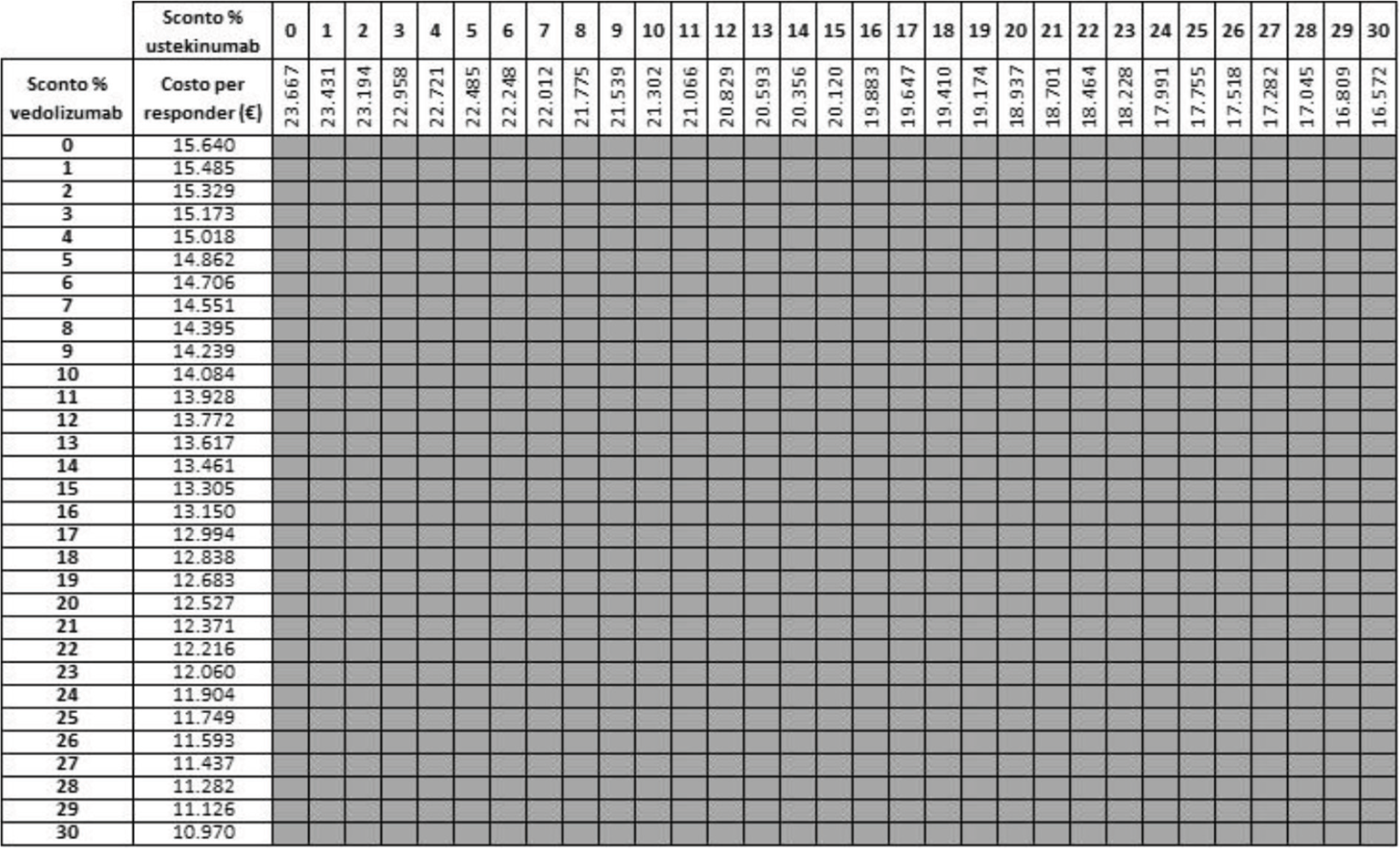
Legenda: grigio = costo per responder di vedolizumab < costo per responder di ustekinumab; rosso = costo per responder di vedolizumab > costo per responder di ustekinumab.
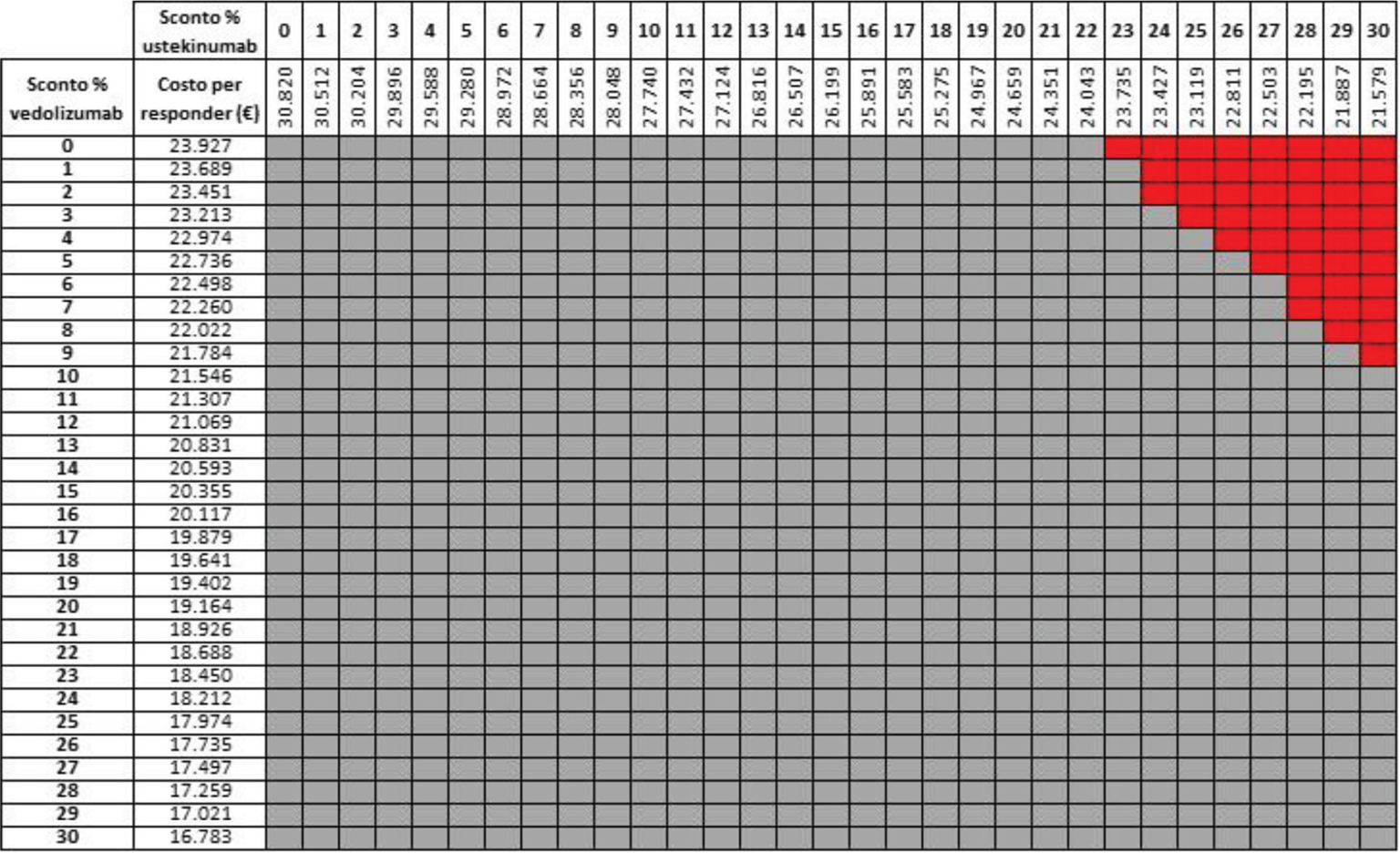
Legenda: grigio = costo per responder di vedolizumab < costo per responder di ustekinumab; rosso = costo per responder di vedolizumab > costo per responder di ustekinumab.
Legenda: grigio = costo per responder di vedolizumab < costo per responder di ustekinumab; rosso = costo per responder di vedolizumab > costo per responder di ustekinumab.
Legenda: grigio = costo per responder di vedolizumab < costo per responder di ustekinumab; rosso = costo per responder di vedolizumab > costo per responder di ustekinumab.
Nella Tabella IX sono infine riportati i risultati dell’analisi di sensibilità nella quale, rispetto al caso base, è stato corretto per le rispettive percentuali di dose escalation il costo di trattamento di vedolizumab e ustekinumab a 26 e a 52 settimane. A prescindere dall’endpoint (risposta o remissione clinica) e dal timepoint (26 o 52 settimane di trattamento) considerati, vedolizumab evidenzia sempre il minor costo per responder rispetto a ustekinumab.
| Vedolizumab | Ustekinumab | Delta | |
|---|---|---|---|
| (n = 231) | (n = 239) | ||
| Costo per responder a 26 settimane | |||
| – risposta clinica | € 17.293 | € 24.438 | –€ 7.145 |
| – remissione | € 25.245 | € 34.887 | –€ 9.642 |
| Costo per responder a 52 settimane | |||
| – risposta clinica | € 27.892 | € 32.792 | –€ 4.900 |
| – remissione | € 34.375 | € 49.843 | –€ 15.469 |
Discussione
La presente analisi di costo per responder è stata condotta con l’obiettivo di pesare i benefici clinici e i costi di trattamento associati all’utilizzo di vedolizumab o di ustekinumab nel trattamento della malattia di Crohn in fase attiva da moderata a severa nei pazienti che hanno fallito una precedente terapia con uno o più inibitori TNF-α.
Il calcolo del costo per responder di vedolizumab e ustekinumab è stato effettuato usando come base clinica i risultati raccolti nello studio osservazionale, retrospettivo, multicentrico promosso dal gruppo IG-IBD (13). La disponibilità di un confronto diretto costituisce un punto di forza della presente analisi, soprattutto se si considera che tale studio ha raccolto dati di real world evidence (RWE) idonei a descrivere la pratica clinica italiana nel trattamento della CD e offre una solida base per stimare l’effettivo “value for money” di un trattamento farmacologico. Studi post marketing o di fase IV vengono, infatti, condotti per verificare che quanto conseguito negli studi clinici randomizzati sia effettivamente riproducibile nella pratica clinica.
Vedolizumab determina in ogni confronto il minor costo per risposta o per remissione rispetto a ustekinumab, indipendentemente dal timepoint (26 e 52 settimane) considerato. Un eventuale limite dell’analisi qui proposta potrebbe risiedere nei timepoint considerati, poiché, data la natura cronica della malattia e della sua terapia a lungo termine, endpoint clinici (remissione clinica e risposta clinica) a due anni o più avrebbero sicuramente dato maggior valore all’analisi. Ciò però non è stato possibile, in quanto la presente valutazione economica si è basata sui timepoint adottati dallo studio osservazionale (13) e attualmente non sono disponibili altri studi osservazionali caratterizzati da orizzonti temporali maggiori.
Purtroppo, non è stato possibile confrontare questi risultati con quanto pubblicato in letteratura, poiché a oggi non sono presenti valutazioni economiche che abbiano adottato la stessa metodologia di analisi. Sono, invece, presenti analisi di costo-efficacia che hanno considerato vedolizumab nel trattamento della CD. Lo studio condotto da Erim et al. (15) ha avuto come obiettivo la stima dei benefici e dei costi incrementali associati all’uso di vedolizumab in pazienti non responder ad adalimumab. Gli Autori hanno osservato come dopo un anno di trattamento con vedolizumab si sia ridotto del 10% il costo medio per paziente e sia aumentato fino a due mesi il tempo medio trascorso in remissione o in malattia lieve. Un successivo studio condotto da Holko et al. (3) ha valutato il rapporto costo-efficacia del trattamento della CD sia con vedolizumab sia con ustekinumab dopo il fallimento della terapia con inibitori del TNF-α. Gli Autori affermano come il trattamento con ustekinumab o con vedolizumab dopo il fallimento della terapia con inibitori del TNF-α sia costo-efficace e come la sostituzione dell’inibitore del TNF-α di seconda linea con ustekinumab o vedolizumab costituisca un fattore in grado di influenzare positivamente il rapporto costo-efficacia. Infine, un più recente studio (Zhou et al. (16)) ha confrontato il rapporto costo-efficacia di vedolizumab rispetto a quello della terapia convenzionale nei pazienti con CD attiva da moderata a grave in Cina. Secondo i risultati dello studio vedolizumab costituisce un’opzione economicamente vantaggiosa nel trattamento di questi pazienti, considerando sia la popolazione TNF-α naïve sia quella che ha fallito almeno un inibitore del TNF-α.
L’analisi di scenario è stata condotta per validare la dimensione economica del confronto tra vedolizumab e ustekinumab (costo per responder), valutando l’impatto di eventuali scontistiche applicate ai rispettivi prezzi di acquisto considerati nel caso base. È stata quindi adottata per entrambi i farmaci biologici una scontistica compresa tra lo 0% e il 30%, in funzione della quale, attraverso la predisposizione di una serie di Tabelle a matrice, sono state valutate tutte le possibili combinazioni del costo per responder per gli endpoint e i timepoint considerati nel caso base. Considerando come endpoint la risposta e tutte le possibili combinazioni di sconto, a 26 e a 52 settimane di trattamento la probabilità che il costo per responder di vedolizumab sia inferiore a quello di ustekinumab è del 100% e del 95,2%, rispettivamente. Considerando invece la remissione come endpoint e tutte le possibili combinazioni di sconto, sia a 26 che a 52 settimane, la probabilità che il costo per responder di vedolizumab sia inferiore a quello di ustekinumab è sempre del 100%. Quindi, anche a fronte di significative riduzioni del prezzo di ustekinumab, vedolizumab rimarrebbe l’alternativa costo-efficace.
Nell’analisi sono stati inclusi i costi di somministrazione per pesare l’impatto economico delle differenti vie di somministrazione adottate nella fase di mantenimento: infusione ev per vedolizumab e iniezione sc per ustekinumab. Dal momento che si è associato un costo pari a zero per l’iniezione sc, assumendo che il farmaco venga auto somministrato dal paziente o dal caregiver, l’inclusione dei costi di somministrazione ha determinato un minino incremento del costo di trattamento per vedolizumab, incremento che però non ha influenzato i risultati dell’analisi.
Il costo della terapia convenzionale, costituita da immunomodulatori e da steroidi, non è stato incluso nell’analisi in quanto lo studio osservazionale (13) non ha riportato il dettaglio dei consumi associati alla terapia biologica a 26 o a 52 settimane di trattamento. Si ritiene che l’esclusione di tali farmaci non dovrebbe aver determinato significative differenze incrementali nei costi di trattamento complessivi associati a ustekinumab e a vedolizumab o quantomeno aver favorito quest’ultimo. Entrambe le coorti, infatti, mostrano una sovrapponibile e bassa percentuale di utilizzo al basale di immunomodulatori (UST: 9,6%; VDZ: 9,5%; p = 0,971), mentre a 52 settimane i pazienti trattati con vedolizumab evidenziano una maggiore percentuale di pazienti in remissione liberi da steroidi (UST: 40,6%, VDZ: 51,1%; p = 0,038) (13).
Nella valutazione non è stato incluso alcun costo per la gestione di eventi avversi gravi poiché, alla luce del profilo di sicurezza indagato dallo studio osservazionale (13), non sono emerse differenze significative tali da influenzare, anche minimamente, l’analisi del costo per responder.
Un eventuale successivo limite dell’analisi risiede nell’aver escluso dal conteggio i costi di eventuali visite specialistiche e dello screening/monitoraggio di laboratorio. Tuttavia, riteniamo che sia ragionevole supporre che questi costi siano abbastanza simili tra i due trattamenti considerati e quindi non influenti sui risultati dell’analisi.
L’analisi di sensibilità ha infine evidenziato che, anche quando il costo di trattamento viene corretto con le percentuali di dose escalation, vedolizumab mostra sempre il minor costo per responder rispetto a ustekinumab.
Conclusioni
Nella prospettiva del SSN, i risultati di quest’analisi identificano in vedolizumab un’opzione terapeutica costo-efficace, se confrontata con ustekinumab, nel trattamento a 26 e a 52 settimane della malattia di Crohn in fase attiva da moderata a grave in pazienti che hanno fallito una precedente terapia con uno o più inibitori del TNF-α.
Disclosures
Conflict of interest: RR has no financial interests to disclose in connection with this study. RV and ASR are employed by Takeda Italia S.p.A.
Financial support: This research was supported by Takeda Italia S.p.A. The Authors thank Paola Raimondo for her contribution in validating the analysis and writing the manuscript. The medical writing was supported by Takeda Italia S.p.A.
Bibliografia
- 1. Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn’s disease. Lancet. 2017;389(10080):1741-1755. CrossRef PubMed
- 2. de Souza HS, Fiocchi C. Immunopathogenesis of IBD: current state of the art. Nat Rev Gastroenterol Hepatol. 2016;13(1):13-27. CrossRef PubMed
- 3. Holko P, Kawalec P, Pilc A. Cost-Effectiveness Analysis of Crohn’s Disease Treatment with Vedolizumab and Ustekinumab After Failure of Tumor Necrosis Factor-α Antagonist. Pharmaco Economics. 2018;36(7):853-865. CrossRef PubMed
- 4. Peyrin-Biroulet L, Sandborn W, Sands BE, et al. Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE): Determining Therapeutic Goals for Treat-to-Target. Am J Gastroenterol. 2015;110(9):1324-1338. CrossRef PubMed
- 5. Turner D, Ricciuto A, Lewis A, et al; International Organization for the Study of IBD. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology. 2021;160(5):1570-1583. CrossRef PubMed
- 6. Torres J, Bonovas S, Doherty G, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: medical Treatment. J Crohn’s Colitis. 2020;14(1):4-22. CrossRef PubMed
- 7. Billioud V, Sandborn WJ, Peyrin-Biroulet L. Loss of response and need for adalimumab dose intensification in Crohn’s disease: a systematic review. Am J Gastroenterol. 2011;106(4):674-684. CrossRef PubMed
- 8. Gisbert JP, Panés J. Loss of response and requirement of infliximab dose intensification in Crohn’s disease: a review. Am J Gastroenterol. 2009;104(3):760-767. CrossRef PubMed
- 9. Sandborn WJ, Feagan BG, Rutgeerts P, et al; GEMINI 2 Study Group. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med. 2013;369(8):711-721. CrossRef PubMed
- 10. Sandborn WJ, Gasink C, Gao LL, et al; CERTIFI Study Group. Ustekinumab induction and maintenance therapy in refractory Crohn’s disease. N Engl J Med. 2012;367(16):1519-1528. CrossRef PubMed
- 11. Vedolizumab. Riassunto delle caratteristiche del prodotto. Disponibile a: Online
- 12. Ustekinumab. Riassunto delle caratteristiche del prodotto. Disponibile a: Online
- 13. Onali S, Pugliese D, Caprioli FA, et al; IG-IBD. An objective comparison of vedolizumab and ustekinumab effectiveness in Crohn’s disease patients’ failure to TNF-alpha inhibitors. Am J Gastroenterol. 2022;117(8):1279-1287. CrossRef PubMed
- 14. Remunerazione delle prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. Supplemento ordinario alla “Gazzetta Ufficiale” n. 23 del 28 gennaio 2013 – Serie generale. Online (Accessed October 2022).
- 15. Erim DO, Mahendraratnam N, Okafor PN, Wheeler SB. The value of vedolizumab as rescue therapy in moderate-severe Crohn’s disease patients with adalimumab non-response in the USA. J Crohn’s Colitis. 2015;9(8):669-675. CrossRef PubMed
- 16. Zhou T, Sheng Y, Guan H. Cost-Effectiveness of Vedolizumab in the Treatment of Moderate-to-Severe Crohn’s Disease in China. Adv Ther. 2021;38(8):4233-4245. CrossRef PubMed