 |
AboutOpen | 2023; 10: 6-12 ISSN 2465-2628 | DOI: 10.33393/ao.2023.2486 ORIGINAL RESEARCH ARTICLE |
 |
Brentuximab vedotin in combinazione con doxorubicina, vinblastina e dacarbazina per il trattamento di HL di stadio IV in prima linea: impatto di costo sulle linee successive in Italia
Brentuximab vedotin in combination with doxorubicin, vinblastine and dacarbazine for first-line treatment of stage IV HL: cost impact on subsequent lines in Italy
Introduction: This study estimates the change in the costs of second-line or later (2L+) treatments compared to the current scenario, associated with the introduction of brentuximab vedotin (Adcetris®) (BV) in combination with doxorubicin, vinblastine and dacarbazine (A+AVD) for the treatment of previously untreated (1L) patients with stage IV classical Hodgkin’s lymphoma (cHL).
Methods: An economic model has been developed that estimates the variation in treatment costs of 2L+ associated with the introduction of BV in 1L from the point of view of the Italian National Health System over a time horizon of 3 years. The population eligible to receive a treatment of 2L+ has been estimated from the literature, considering an increasing consumption in the three years of A+AVD in 1L. Two main scenarios and several alternative scenarios were considered to address the uncertainty that characterizes the distribution of market shares of 2L+ treatments.
Results: In the baseline scenario, over three years, the introduction of BV in 1L is associated with a cumulative reduction in treatment costs of 2L+ of € 1.74 M. In all scenarios, a reduction in treatment costs of 2L+ is confirmed, with a total saving that varies between € 5.6 M and € 1.3 M compared to the main scenarios.
Conclusions: The present analysis shows that the introduction of A+AVD in 1L for the treatment of stage IV CD30+ cHL patients is associated with a reduction in treatment costs of 2L+, even if there are some limitations related to the uncertainty of real cost and population estimates.
Keywords: Brentuximab vedotin, Cost-analysis, Economic evaluation, Hodgkin lymphoma, Italy
Received: August 29, 2022
Accepted: December 7, 2022
Published online: January 16, 2023
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2023 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il Linfoma di Hodgkin Classico (cHL) è un tumore del sistema linfatico, caratterizzato da una proliferazione dei linfociti B (1). In Italia, la patologia rappresenta il 14% dei linfomi e lo 0,6% di tutti i tumori (2), con una prevalenza di circa 67.000 pazienti e un’incidenza di oltre 2.100 nuovi casi ogni anno (2) di cui circa il 14% è diagnosticato allo stadio IV (3). Nonostante il cHL presenti un elevato tasso di sopravvivenza a 5 anni dalla diagnosi (82-85% (2)), il 15% dei pazienti con cHL allo stadio iniziale e il 30% dei soggetti allo stadio avanzato affrontano una ricaduta dopo i primi trattamenti o sono affetti da una forma refrattaria della patologia (1). Inoltre, persiste un eccesso di mortalità tra i sopravvissuti associata agli effetti ritardati della tossicità dei trattamenti e l’insorgenza di carcinomi secondari o di tossicità cardiaca (4).
In prima linea (1L), le opzioni terapeutiche dei pazienti con cHL sono la chemioterapia, specialmente la combinazione di doxorubicina, bleomicina, vinblastina e dacarbazina (ABVD), e la radioterapia, che vengono utilizzate in combinazione o in sequenza (5). A partire da settembre 2021, per i pazienti con cHL CD30+ di stadio IV non precedentemente trattati e non candidabili al trattamento con bleomicina, è stata rimborsata in Italia la combinazione di brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina (A+AVD) (6). Per i pazienti con cLH recidivato/refrattario (R/R) le Linee Guida suggeriscono il trattamento di seconda linea o successive (2L+) con chemioterapia di salvataggio seguita da chemioterapia ad alte dosi e trapianto di cellule staminali autologhe (5) o, negli ultimi anni, il trattamento con terapie immunotropiche (brentuximab vedotin, pembrolizumab e nivolumab) (4,6,7).
L’approvazione europea (8) e poi la rimborsabilità in Italia in classe H di A+AVD in prima linea (6) si basano principalmente sui risultati dello studio clinico di fase III, multicentrico, randomizzato, open-label ECHELON-1 (9), in cui A+AVD è stata comparata con lo standard terapeutico (ABVD) nella popolazione con cHL di stadio III e IV non precedentemente trattata (9). Dal follow-up di 5 anni dello studio clinico (follow-up mediano di 60,9 mesi) è emerso che A+AVD è più efficace di ABVD in termini di sopravvivenza libera da progressione (82% vs 75%), presenta una minore incidenza di neoplasie secondarie (3% vs 4%) ed è associata a scelte di terapie successive differenti (9).
L’obiettivo di questa analisi è di stimare in diversi scenari l’impatto che ha il trattamento di 1L con A+AVD per pazienti non precedentemente trattati affetti da cHL allo stadio IV sui costi dei trattamenti di 2L+ rispetto allo scenario corrente dal punto di vista del Sistema Sanitario Nazionale (SSN) italiano in un orizzonte temporale di 3 anni.
Metodi
Struttura del modello
Per poter stimare l’impatto per il SSN associato all’introduzione di A+AVD in 1L sui costi dei trattamenti di 2L+, è stato sviluppato un modello in Microsoft Excel dove si compara un mondo attuale, in cui il 100% dei pazienti in cura è trattato in 1L con lo Standard of Care (SoC), con un mondo futuro dove si assume una penetrazione crescente del regime A+AVD in 1L per i pazienti allo stadio IV (10%, 20% e 30% nei primi tre anni di commercializzazione). Al fine di rendere i dati di letteratura comparabili con la pratica clinica italiana, sono stati esplorati due scenari principali: uno scenario base in cui i dati sui trattamenti successivi provengono dallo studio clinico ECHELON-1 (9), sia per il mondo attuale sia per il mondo futuro, e uno scenario real world in cui i dati dello studio clinico ECHELON-1 (9) sono stati integrati con le informazioni provenienti da Oncoview sia nel mondo attuale che in quello futuro. Oncoview è un database di proprietà di IQVIA che raccoglie dati real world sulle malattie tumorali in Italia, attraverso delle interviste strutturate mensili a 480 clinici specializzati di oltre 250 centri in Italia. In questa analisi sono stati utilizzati i dati relativi al totale annuo mobile dell’anno 2021 dei pazienti con HL allo stadio IV. Le caratteristiche distintive dei due scenari principali sono riassunti nella Tabella I.
Il modello, in entrambi gli scenari, permette di stimare una spesa per le terapie successive nel primo, nel secondo e nel terzo anno del loro utilizzo per pazienti che sono ricaduti dopo un trattamento di prima linea con A+AVD o con un’altra alternativa di 1L (SoC). La spesa farmaceutica è stata stimata moltiplicando la popolazione eleggibile al trattamento di 2L+ per un costo medio ponderato imputabile alle terapie successive.
La popolazione eleggibile al trattamento di 2L+ è stata calcolata applicando alla popolazione di prima linea le probabilità di necessitare di un trattamento successivo riportate nello studio ECHELON-1 (9) sia per A+AVD che per l’alternativa di prima linea di confronto. Quale sia l’alternativa di confronto dipende dagli scenari simulati. Il costo medio ponderato delle terapie successive dipende dal mix di terapie di 2L+, dal numero medio di trattamenti di 2L+ per paziente e dal costo di trattamento di ciascuna di esse. Nel caso base, la percentuale di utilizzo delle alternative terapeutiche di 2L+ proviene dallo studio clinico ECHELON-1 (9), mentre per lo scenario real world è stata stimata a partire da Oncoview per i pazienti trattati con SoC in 1L. Si noti che i dati dello studio clinico ECHELON-1 sono riferiti ai pazienti CD30+ di stadio III e stadio IV (rispettivamente il 36% e il 64% della popolazione dello studio). Per questa analisi, è stato, quindi, assunto che lo SoC di 2L+ dei pazienti di stadio IV sia uguale a quello dei pazienti di stadio III, ipotesi confermata anche dai dati di Oncoview. La probabilità di ricevere un trattamento di 2L+ e il numero medio di trattamenti di 2L+, invece, a prescindere dallo scenario, sono stati sempre desunti dallo studio ECHELON-1. Sia il numero medio di trattamenti di 2L+ per paziente che le percentuali di utilizzo di ciascuna opzione terapeutica di 2L+ dipendono dal trattamento ricevuto in prima linea.
| INPUT | SCENARIO DI BASE | SCENARIO REAL WORLD | ||
|---|---|---|---|---|
| Mondo attuale | Mondo futuro | Mondo attuale | Mondo futuro | |
| Alternative di 1L presenti (p. es., SoC) | ABVD (come da ECHELON-1) | ABVD (come da ECHELON-1) e A+AVD | Qualsiasi terapia di 1L individuata in Oncoview | Qualsiasi terapia di 1L individuata in Oncoview e A+AVD |
| Alternative di 2L nel mondo attuale | Come da ECHELON-1 | Come da ECHELON-1 | Come da Oncoview | Come da ECHELON-1 post A+AVD 1L; come da Oncoview post SoC 1L |
| Prob. di necessitare di terapie successive | 23,67%
(ECHELON-1) |
20,09% se A+AVD in 1L e 23,67% se SoC in 1L
(ECHELON-1) |
23,67%
(ECHELON-1) |
20,09% se A+AVD in 1L e 23,67% se SoC in 1L
(ECHELON-1) |
| N. medio di terapie successive | 1,69
(ECHELON-1) |
1,46 se A+AVD in 1L e 1,69 se SoC in 1L (ECHELON-1) | 1,69
(ECHELON-1) |
1,46 se A+AVD in 1L e 1,69 se SoC in 1L (ECHELON-1) |
A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; SoC: Standard of Care; 1L: prima linea; 2L: seconda linea.
Popolazione
La popolazione eleggibile a ricevere un trattamento di 2L+ è stata stimata a partire dalla letteratura e in base allo studio clinico ECHELON-1 in due fasi: in primo luogo è stata stimata la popolazione annuale incidente con cHL CD30+ di stadio IV per poi stimare la proporzione di questi pazienti che si prevede abbia necessità di linee di trattamento successive.
La popolazione dei pazienti cHL CD30+ di stadio IV in Italia è stata stimata a partire dal tasso di incidenza annuale del 2020 (2.151 pazienti) (2), dalla proporzione di stadio IV (13,9% del totale) (3) e da quella di CD30+ (100,00%) (1,10) come da indicazione autorizzata. Si considera che la popolazione incidente in 1L rimanga costante nei tre anni di analisi. La percentuale dei pazienti che dalla 1L di trattamento accede a una 2L+ è la stessa in entrambi gli scenari principali ed è stata, invece, stimata a partire dai risultati dello studio ECHELON-1 (23,67% per SoC in 1L vs 20,09% per ABVD in 1L) (9).
Nel mondo futuro, è stata considerata una percentuale di utilizzo di A+AVD in 1L crescente con quote del 10%, del 20% e del 30% rispettivamente nei primi tre anni di commercializzazione, che vanno a sostituirsi in maniera proporzionale alla quota di pazienti in trattamento con lo SoC.
Fonti dati di costo e loro metodi di stima
I costi di trattamento delle linee successive sono stati calcolati considerando le quote di mercato delle varie opzioni terapeutiche in 2L+, i costi di acquisizione dei trattamenti farmacologici, di somministrazione, di radioterapia, di trapianto autologo e di trapianto allogenico (Tab. II e Tab. A Supplementare).
In particolare, i costi dei trattamenti farmacologici sono stati stimati tenendo in considerazione: 1) per i farmaci a somministrazione per via endovenosa, il peso del paziente medio e l’area di superficie corporea stimati a partire dai dati dello studio ECHELON-1 (73,53 kg e 1,86 m2) (11); 2) i dosaggi, il numero dei cicli e la durata dei cicli registrati nelle Linee Guida AIOM (5), nella letteratura internazionale rilevante (9,11-20) e nei riassunti delle caratteristiche del prodotto (21-23); 3) l’ottimizzazione delle somministrazioni per evitare gli sprechi (vial sharing); 4) i prezzi ex-factory, IVA esclusa, al netto delle riduzioni temporanee di legge del 5%+5%, dove applicabile (7); 5) il costo della somministrazione per via sottocutanea (sc) o endovenosa (ev) della chemioterapia, stimato sulla base del Tariffario Nazionale DRG (24). Il costo della radioterapia e del trapianto autologo di cellule staminali ematopoietiche (ASCT) è stato invece stimato sulla base del Tariffario Nazionale DRG (24), mentre il costo del trapianto allogenico è stato stimato a partire della letteratura italiana (Lucioni et al., 2015 (25)) e inflazionato a gennaio 2021 (26).
Analisi di sensibilità
A fronte dell’incertezza che caratterizza alcune variabili del modello sono state condotte diverse analisi di sensibilità in cui sono stati variati parametri di costo e popolazione. In termini di costo, in entrambi gli scenari principali, è stato esplorato l’impatto di diverse possibili combinazioni di sconto confidenziale di brentuximab vedotin, nivolumab e pembrolizumab. Dati il maggiore utilizzo dell’immunoterapia emerso dai dati real world vs ECHELON-1 e la mancanza di informazioni di real practice per i pazienti che progrediscono dopo A+AVD in 1L (vista la recente rimborsabilità), a partire dallo scenario real world è stato valutato l’impatto di un plausibile aumento dell’utilizzo delle immunoterapie (tra il 10% e il 30%) per i pazienti che hanno assunto A+AVD in 1L. In termini di popolazione, in entrambi gli scenari principali, sono stati variati l’incidenza del cHL, la percentuale di pazienti che necessita di un trattamento 2L+ e il numero medio di trattamenti 2L+ per paziente.
| SCENARIO BASE | SCENARIO REAL WORLD | Costo per trattamento | |||
|---|---|---|---|---|---|
| POST A+AVD 1L (ECHELON) | POST SoC* 1L (ECHELON) | POST A+AVD 1L (ECHELON) | POST SoC 1L (Oncoview Stage IV) | ||
| Brentuximab vedotin monoterapia | 4,12% | 18,25% | 4,12% | 37,93% | 71.662,46 € |
| Chemioterapia ad alto dosaggio† | 34,54% | 23,95% | 34,54% | 12,14% | – |
| DHAP | 14,58% | 6,49% | 14,58% | 0,00% | 7.081,87 € |
| IGEV | 6,91% | 2,99% | 6,91% | 0,00% | 8.738,47 € |
| BeGEV | 0,00% | 0,00% | 0,00% | 6,07% | 10.477,66 € |
| BV + Bendamustina | 0,00% | 0,00% | 0,00% | 6,07% | 20.692,84 € |
| BV + altra chemioterapia± | 6,91% | 11,48% | 6,91% | 0,00% | 62.819,35 € |
| BEACOPP | 6,14% | 2,99% | 6,14% | 0,00% | 12.078,26 € |
| Chemioterapia ad alto dosaggio† + ASCT | 21,65% | 21,67% | 21,65% | 9,93% | – |
| DHAP | 10,05% | 9,70% | 10,05% | 0,00% | 66.887,87 € |
| IGEV | 4,64% | 4,56% | 4,64% | 0,00% | 68.544,47 € |
| BeGEV | 0,00% | 0,00% | 0,00% | 4,97% | 70.283,66 € |
| BV + Bendamustina | 0,00% | 0,00% | 0,00% | 4,97% | 80.498,84 € |
| BV + altra chemioterapia± | 3,09% | 3,42% | 3,09% | 0,00% | 122.625,35 € |
| BEACOPP | 3,87% | 3,99% | 3,87% | 0,00% | 71.884,26 € |
| Radioterapia | 27,84% | 20,53% | 27,84% | 0,00% | 353,00 € |
| Immunoterapia | 8,25% | 10,27% | 8,25% | 40,00% | – |
| Nivolumab | 4,95% | 5,25% | 4,95% | 23,45% | 56.088,84 € |
| Pembrolizumab | 3,30% | 3,50% | 3,30% | 16,55% | 110.311,08 € |
| BV + altra immunoterapia§ | 0,00% | 1,52% | 0,00% | 0,00% | 55.570,84 € |
| Trapianto allogenico | 3,09% | 4,18% | 3,09% | 0,00% | 83.984,30 € |
| Chemioterapia + radioterapia‡ | 0,52% | 1,14% | 0,52% | 0,00% | 7.434,87 € |
Note: *Coincidente con ABVD, braccio di confronto nello studio ECHELON-1. Si assume che la distribuzione dei trattamenti dei pazienti di stadio IV sia uguale alla distribuzione dei pazienti di stadio III e IV. †Per ECHELON, in cui il tasso di utilizzo di ciascun regime chemioterapico non è specificato, è stata applicata una redistribuzione delle market share secondo l’utilizzo riportato da Collins et al. (2018). ±Brentuximab vedotin (Adcetris®) + 3,5 cicli di DHAP. §Brentuximab vedotin (Adcetris®) + nivolumab. ‡Costo della radioterapia + costo di 3,5 cicli di DHAP.
A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina, dacarbazina; ABVD: doxorubicina, bleomicina, vinblastina e dacarbazina; DHAP: dexametasone, citarabina, cisplatino; IGEV: ifosfamide, gemcitabina, vinorelbina; BeGEV: bendamustina, gemcitabina, vinorelbina; BeEAM: bendamustina, etoposide, citarabina, melfalan; FEAM: fotemustina, etoposide, citarabina, melfalan; TBF: tiotepa, busulfan, fludarabina; BV: brentuximab vedotin (Adcetris®); BEACOPP: bleomicina, etoposide, doxorubicina, ciclofosfamide, vincristina, procarbazina, prednisone; ASCT: trapianto autologo di cellule staminali.
Risultati
Popolazione
In base alle fonti considerate si è stimata un’incidenza nei primi tre anni di commercializzazione di 299 pazienti con cHL CD30+ di stadio IV per il 2021 in Italia (Tab. III). Considerando il tasso di penetrazione di A+AVD, nel mondo futuro i pazienti trattati con A+AVD in 1L saranno 30, 60 e 90 pazienti nel primo, nel secondo e nel terzo anno, rispettivamente. Tenendo in considerazione la percentuale di pazienti che necessitano di almeno un trattamento di 2L+, si prevede che nel mondo futuro il numero di pazienti eleggibili a un trattamento di 2L+ sia di 70, 69 e 67 (Tab. III). La diminuzione del numero di pazienti eleggibili a una linea successiva tra scenario attuale e futuro e nei tre anni di analisi dello scenario futuro è una conseguenza del crescente utilizzo di A+AVD in 1L, trattamento più efficace rispetto allo SoC in termini di numero pazienti che necessitano di un trattamento successivo. Nel mondo attuale questo numero rimane invece costante e ammonta a 71 pazienti per tutti e tre gli anni (Tab. III).
Impatto sui costi
Nelle Figura 1 sono rappresentati i risultati dell’analisi per i due scenari principali in termini di: spesa totale per le terapie di 2L+, nel mondo attuale e in quello futuro, e differenza di costi tra i due mondi. Nei tre anni in analisi, nei due scenari principali, l’introduzione di A+AVD in 1L è associata a una riduzione dei costi dei trattamenti di 2L+ totale di € 1,74 M nello scenario base e di € 3,09 M nello scenario real world. I risparmi annuali crescono all’aumentare dell’utilizzo di A+AVD passando da € 276 mila a € 911 mila nello scenario base e da € 496 mila a € 1,60 M nello scenario real world.
Analisi di sensibilità
Dall’analisi di sensibilità sul possibile impatto di diversi sconti confidenziali dei trattamenti ad alto costo (Fig. 2) emerge una variazione del risparmio cumulativo che va da –1% (–€ 1,74 M) a –38% (–€ 1,08 M) nello scenario base e dal –5% (–€ 2,93 M) al –58% (–€ 1,29 M) nello scenario real world. Il risparmio si riduce al diminuire del costo di acquisizione dei farmaci ad alto costo utilizzati in 2L+, in quanto maggiormente utilizzati dopo una prima linea di SoC che di A+AVD.
Dall’analisi di sensibilità sulle variabili di popolazione (Fig. 3) emerge che un incremento dell’incidenza del cLH in Italia o del numero di trattamenti di 2L+ successivi a SoC in 1L è associato a un incremento del risparmio totale (fino a € 2,46 M nello scenario base e fino a € 4,08 M nello scenario real world) mentre un aumento del numero di trattamenti di 2L+ successivi ad A+AVD in 1L è associato a una riduzione del risparmio totale (fino a € 1,02 M nello scenario base e fino a € 2,10 M nello scenario real world).
| Mondo attuale | Mondo futuro | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Trattati con SoC in 1L | Trattati con SoC in 1L | Trattati con A+AVD in 1L | |||||||
| Anno 1 | Anno 2 | Anno 3 | Anno 1 | Anno 2 | Anno 3 | Anno 1 | Anno 2 | Anno 3 | |
| Pazienti eleggibili al trattamento di 2L | 299 | 299 | 299 | 299 | 299 | 299 | 299 | 299 | 299 |
| % Pazienti che ricevono 2L+ | 23,67% | 23,67% | 23,67% | 23,67% | 23,67% | 23,67% | 20,09% | 20,09% | 20,09% |
| Quota di mercato | 100% | 100% | 100% | 90% | 80% | 70% | 10% | 20% | 30% |
| Pazienti che ricevono 2L+, per alternativa | 71 | 71 | 71 | 64 | 57 | 49 | 6 | 12 | 18 |
A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; SoC: Standard of Care; 1L: prima linea; 2L: seconda linea.
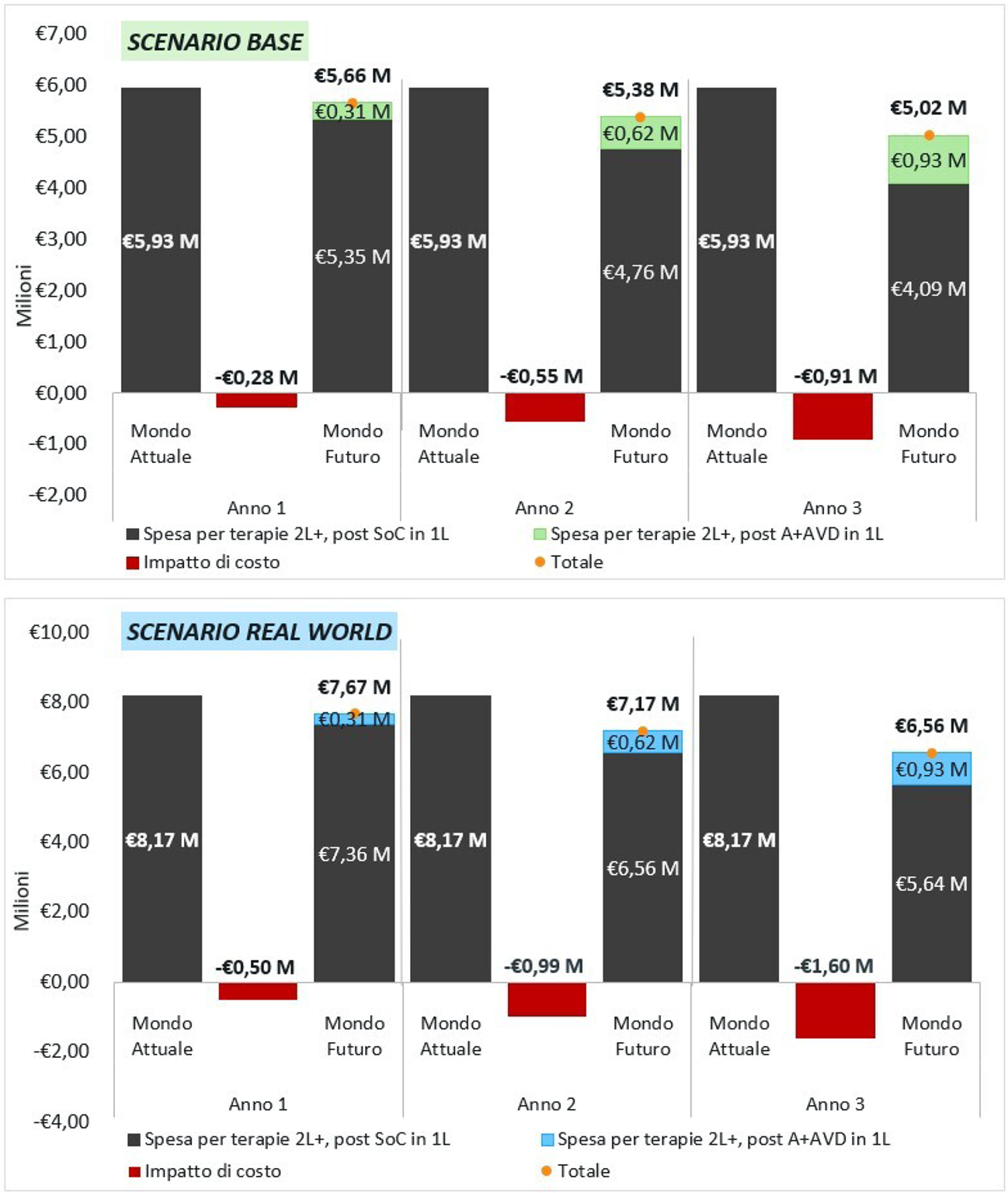
Fig. 1 - Risultati principali dello scenario base e real world. A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; SoC: Standard of Care; 1L: prima linea.
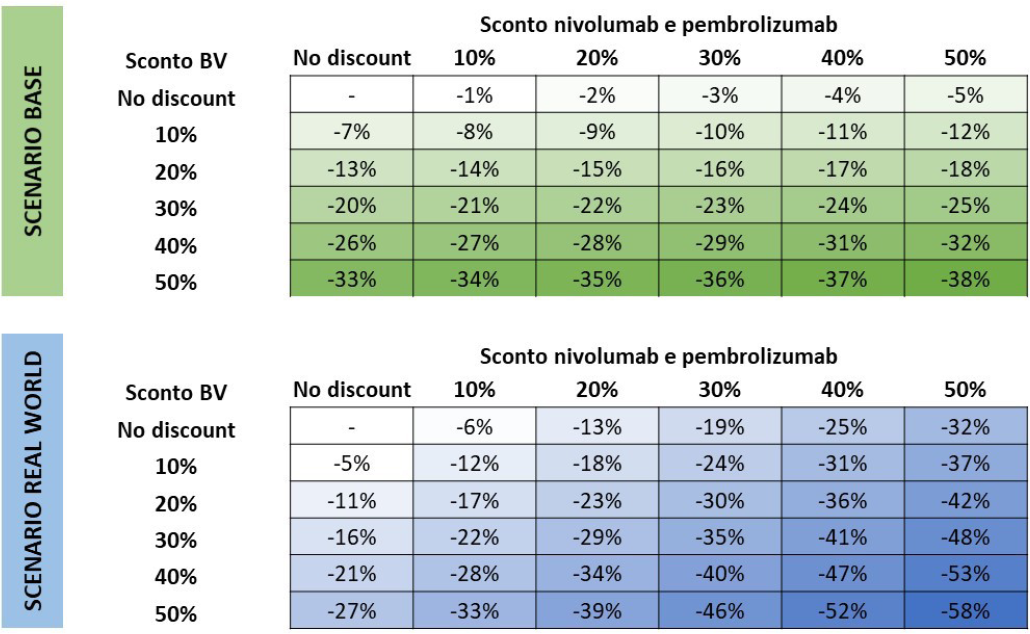
Fig. 2 - Variazione dei risultati nell’analisi di sensibilità sull’impatto di possibili sconti dei trattamenti ad alto costo. BV: brentuximab vedotin
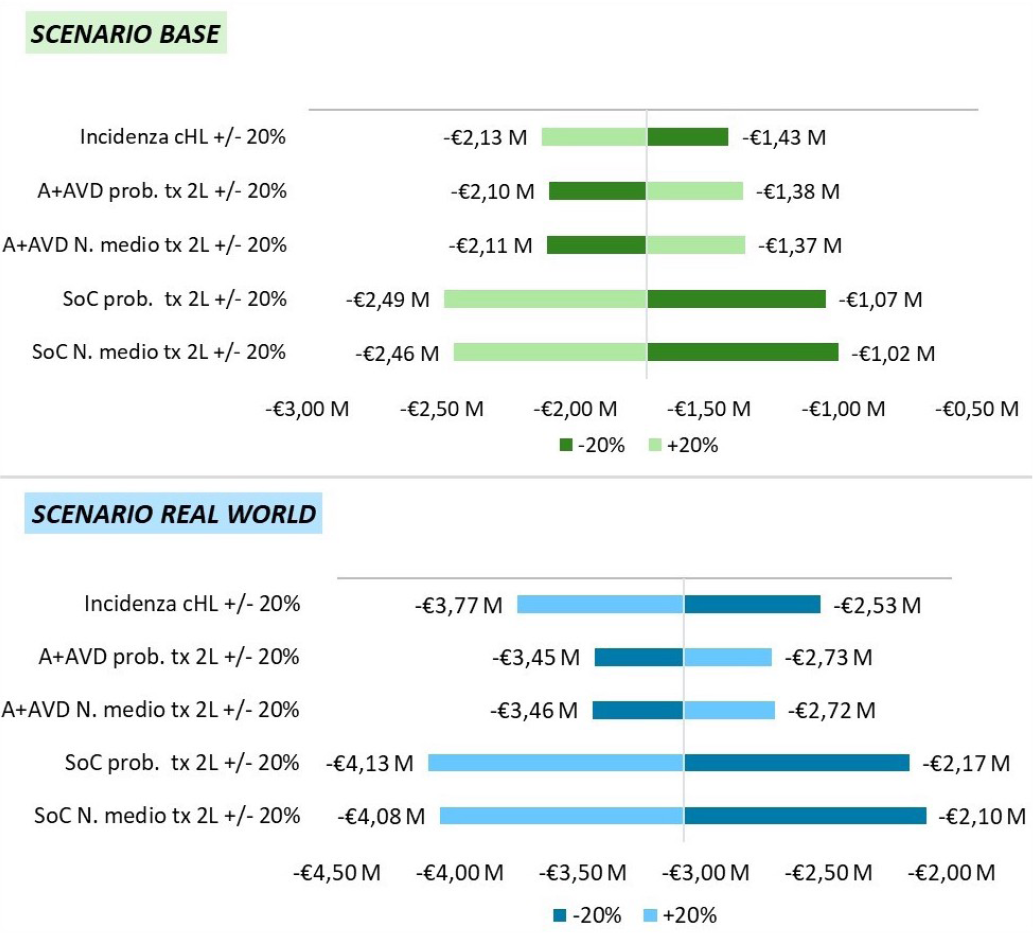
Fig. 3 - Analisi di sensibilità univariate su parametri di popolazione. cHL: Linfoma di Hodgkin classico; A+AVD: brentuximab vedotin (Adcetris®), doxorubicina, vinblastina e dacarbazina; SoC: Standard of Care; 2L: seconda linea.
Dall’analisi sulle market share delle immunoterapie in 2L+ nello scenario real world emerge come all’aumentare del loro utilizzo (dall’8,25% dello scenario base fino al 30,00%) i risparmi sui costi di 2L+ diminuiscano progressivamente, fino a –€ 2,56 M (–17%).
Discussione
Al meglio delle conoscenze degli Autori, questo è il primo studio sia a livello nazionale che internazionale che stima il risparmio di 2L+ dei trattamenti associati all’introduzione di A+AVD in 1L per i pazienti con HL di stadio IV non precedentemente trattati.
Dallo studio è emerso che, in linea con l’indicazione autorizzata per i pazienti affetti da cHL di stadio IV CD30+ non precedentemente trattati, I’introduzione di BV in 1L porta a dei potenziali risparmi dei trattamenti di 2L+.
In particolare, nei primi tre anni di commercializzazione, si prevede che l’introduzione del regime A+AVD in 1L sia associata a un risparmio crescente in termini di trattamenti di 2L+ per un impatto di costo complessivo di –€ 1,74 M nello scenario base che arriva fino a –€ 3,09 M nello scenario real world. I risultati della presente analisi sono dovuti a tre driver principali: 1) la percentuale minore di pazienti che ricevono un trattamento di 2L+ dopo essere stati trattati con A+AVD in 1L o SoC (20,09% vs 23,67%); 2) il minor ricorso a trattamenti di 2L+ per i pazienti trattati in 1L con A+AVD (1,47 vs 1,69); 3) la distribuzione delle market share di 2L+ condizionale al trattamento ricevuto in 1L.
Le analisi di sensibilità condotte per fare fronte a queste incertezze mostrano che in tutti gli scenari considerati l’introduzione di A+AVD in 1L porta a un risparmio di spesa per i trattamenti di 2L+ che varia tra € 4,08 M ed € 1,02 M.
Limitazioni
Persistono delle limitazioni ed elementi di incertezza che potrebbero avere un impatto sui risultati.
I risparmi possono essere stati sovra-stimati considerando che la popolazione inclusa nell’analisi è più ampia (CD30+, stadio IV) rispetto a quella per cui il farmaco è attualmente rimborsato in Italia (CD30+, stadio IV e non candidabili al trattamento con bleomicina). Dall’altra parte, le stime di risparmio possono aumentare se si considerano altri vantaggi economici associati all’introduzione di A+AVD in 1L, come per esempio la riduzione di neoplasie secondarie e di eventi avversi in 2L+ (9).
Un’ulteriore fonte di incertezza è associata all’utilizzo dello studio ECHELON-1 (9) per stimare la distribuzione dei trattamenti di 2L+ nello scenario di base e il numero medio per paziente di trattamenti successivi in entrambi gli scenari principali. I dati dello studio clinico sono infatti riferiti ai pazienti CD30+ di stadio III e stadio IV (rispettivamente il 36% e il 64% del campione dello studio) per cui si è assunto che lo SoC di 2L+ dei pazienti di stadio IV sia uguale a quello dei pazienti di stadio III. Tuttavia questa assunzione sembra consistente in quanto i dati di Oncoview, dove la maggior parte del campione è rappresentata da pazienti allo stadio IV, non hanno rivelato differenze nella distribuzione delle terapie successive tra i pazienti allo stadio III e quelli allo stadio IV. Si noti inoltre che non è stato però possibile validare questa assunzione in base alla letteratura pubblicata. Inoltre la reale pratica clinica potrà differire da quella emersa in uno studio svolto in un ambiente controllato, specialmente in un contesto in continua evoluzione come quello relativo al trattamento dei pazienti con cHL. Alla luce di questa limitazione, è stata condotta un’analisi che facesse leva su dati real word dove si sono confermati risultati di risparmi sulla spesa dei trattamenti di 2L+ associati all’introduzione di A+AVD in 1L.
Infine, un’ulteriore fonte di incertezza è relativa ai dati di Oncoview utilizzati nello scenario real world. In questo caso, è stato assunto che lo SoC di 2L+ dei pazienti CD30+ non sia differente da quello della totalità dei pazienti di stadio IV, in quanto i dati non sono disponibili per la sotto-popolazione CD30+.
Infine, alcune stime di costi si sono basate sulle tariffe nazionali in vigore nel 2022, che, pur rappresentando la metodologia standard per gli studi di costo (27), potrebbero non riflettere sempre i costi reali (28-30).
Da notare che la generalizzazione dei risultati ad altri paesi è limitata a causa dei diversi costi di acquisizione e delle pratiche cliniche che possono emergere in altri contesti.
Conclusioni
Oltre ai vantaggi clinici legati all’introduzione in prima linea di brentuximab vedotin in combinazione con doxorubicina, vinblastina e dacarbazina per il trattamento dei pazienti cHL CD30+ dimostrati dai risultati dello studio di fase III ECHELON-1, il modello mostra anche dei vantaggi economici sul costo delle linee successive. Questo risultato subisce delle variazioni a seconda delle stime di popolazione, degli sconti confidenziali e delle market share considerati, ma il risparmio persiste nei vari scenari esplorati.
Disclosures
Conflict of interest: At the time the study was performed Francesca Fiorentino and Beatrice Canali were employees of IQVIA Italia. Federica Demma and Paola Morelli are employees of Takeda Italia S.p.A.
Financial support: This study was supported by a non conditional grant by Takeda Italia S.p.A.
Bibliografia
- 1. Opinto G, Agostinelli C, Ciavarella S, Guarini A, Maiorano E, Ingravallo G. Hodgkin Lymphoma: A Special Microenvironment. J Clin Med. 2021;10(20):4665. CrossRef PubMed
- 2. AIRTUM. I numeri del cancro in Italia 2020. 2020. Online (Accessed July 2022)
- 3. Luminari S, Cesaretti M, Rashid I, et al. Incidence, clinical characteristics and survival of malignant lymphomas: a population-based study from a cancer registry in northern Italy. Hematol Oncol. 2007;25(4):189-197. CrossRef PubMed
- 4. Brice P, de Kerviler E, Friedberg JW. Classical Hodgkin lymphoma. Lancet. 2021;398(10310):1518-1527. CrossRef PubMed
- 5. Associazione Italiana di Oncologia Medica (AIOM). Linee guida. Linfomi; 2018.
- 6. Gazzetta Ufficiale della Repubblica Italiana: Serie Generale n.223 del 17-09-2021. Online (Accessed July 2022)
- 7. Gazzetta Ufficiale della Repubblica Italiana. Online (Accessed July 2022)
- 8. European Medicines Agency (EMA): CHMP post-authorisation summary of positive opinion for Adcetris (II-70). 26 March 2020. Online (Accessed July 2022)
- 9. Straus DJ, Długosz-Danecka M, Connors JM, et al. Brentuximab vedotin with chemotherapy for stage III or IV classical Hodgkin lymphoma (ECHELON-1): 5-year update of an international, open-label, randomised, phase 3 trial. Lancet Haematol. 2021;8(6):e410-e421. CrossRef PubMed
- 10. Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010;363(19):1812-1821. CrossRef PubMed
- 11. Connors JM, Jurczak W, Straus DJ, et al; ECHELON-1 Study Group. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2018;378(4):331-344. CrossRef PubMed
- 12. Collins GP, Rueda A, Salles G, von Tresckow B, Zaja F. Management of Hodgkin lymphoma in the era of brentuximab vedotin: real-world data from five European countries. Leuk Lymphoma. 2018;59(9):2113-2120. CrossRef PubMed
- 13. Esquirol A, Pascual MJ, Garcia-Cadenas I, et al. Combining Three Different Pretransplantation Scores Improves Predictive Value in Patients after Haploidentical Stem Cell Transplantation with Thiotepa, Busulfan, and Fludarabine Conditioning and Post-Transplantation Cyclophosphamide. Transplant Cell Ther. 2021;27(7):614.e1-614.e8. CrossRef PubMed
- 14. Garcia-Sanz R, Sureda A, de la Cruz F, et al. Brentuximab vedotin and ESHAP is highly effective as second-line therapy for Hodgkin lymphoma patients (long-term results of a trial by the Spanish GELTAMO Group). Ann Oncol. 2019;30(4):612-620. CrossRef PubMed
- 15. Herrera AF, Moskowitz AJ, Bartlett NL, et al. Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2018;131(11):1183-1194. CrossRef PubMed
- 16. Musso M, Scalone R, Marcacci G, et al. Fotemustine plus etoposide, cytarabine and melphalan (FEAM) as a new conditioning regimen for lymphoma patients undergoing auto-SCT: a multicenter feasibility study. Bone Marrow Transplant. 2010;45(7):1147-1153. CrossRef PubMed
- 17. Ramos CA, Grover NS, Beaven AW, et al. Anti-CD30 CAR-T Cell Therapy in Relapsed and Refractory Hodgkin Lymphoma. J Clin Oncol. 2020;38(32):3794-3804. CrossRef PubMed
- 18. Santoro A, Magagnoli M, Spina M, et al. Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin’s lymphoma. Haematologica. 2007;92(1):35-41. CrossRef PubMed
- 19. Santoro A, Mazza R, Pulsoni A, et al. Five-year results of the BEGEV salvage regimen in relapsed/refractory classical Hodgkin lymphoma. Blood Adv. 2020;4(1):136-140. CrossRef PubMed
- 20. Visani G, Malerba L, Stefani PM, et al. BeEAM (bendamustine, etoposide, cytarabine, melphalan) before autologous stem cell transplantation is safe and effective for resistant/relapsed lymphoma patients. Blood. 2011;118(12):3419-3425. CrossRef PubMed
- 21. AIFA. Riassunto delle Caratteristiche del Prodotto. Adcetris. Online (Accessed July 2022)
- 22. AIFA. Riassunto delle Caratteristiche del Prodotto. Opdivo. Online (Accessed July 2022)
- 23. Riassunto delle Caratteristiche del Prodotto. Keytruda. Online (Accessed July 2022)
- 24. Gazzetta Ufficiale della Repubblica Italiana: GU Serie Generale n.23 del 28-01-2013 – Suppl. Ordinario n. 8 – Allegato I. Online (Accessed July 2022)
- 25. Lucioni C, Iannazzo S, Mazzi S, Saporiti G, Chiroli S. Cost-effectiveness of ponatinib in chronic myeloid leukemia in Italy. Glob Reg Health Technol Assess. 2015;1:1-16. Online
- 26. ISTAT. Rivaluta. Online (Accessed August 2022)
- 27. Tarricone R. Cost-of-illness analysis. What room in health economics? Health Policy. 2006;77(1):51-63. CrossRef PubMed
- 28. Palmieri V, Baldi C, Di Blasi PE, et al. Impact of DRG billing system on health budget consumption in percutaneous treatment of mitral valve regurgitation in heart failure. J Med Econ. 2015;18(2):89-95. CrossRef PubMed
- 29. Filetti S, Ladenson PW, Biffoni M, D’Ambrosio MG, Giacomelli L, Lopatriello S. The true cost of thyroid surgery determined by a micro-costing approach. Endocrine. 2017;55(2):519-529. CrossRef PubMed
- 30. Berto P, Lopatriello S, Aiello A, et al. Cost of laparoscopy and laparotomy in the surgical treatment of colorectal cancer. Surg Endosc. 2012;26(5):1444-1453. CrossRef PubMed