 |
AboutOpen | 2022; 9: 92-104 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2450 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di costo utilità di brigatinib rispetto ad alectinib nel trattamento del NSCLC ALK positivo in pazienti precedentemente non trattati con un inibitore di ALK
Cost-utility analysis of brigatinib compared to alectinib in the treatment of ALK-positive NSCLC in patients previously not treated with an ALK inhibitor
Objective: The aim of this economic evaluation was to assess the cost-utility of brigatinib versus alectinib in the treatment of naïve patients to anaplastic lymphoma kinase-positive advanced non-small cell lung cancer (ALK-positive aNSCLC) from the perspective of the Italian National Health Service (INHS).
Methods: A partitioned survival model with four health states (progression-free [PFS], no central nervous system progression [CNS-PFS], central nervous system progression [CNS-PD] and death) was used. The clinical data (progression-free survival, overall survival and time to progression) was based on the ALTA-1L trial for brigatinib and on ALEX trial for alectinib. Utility values were derived from EORTC QLQ-C30 scores evaluated in the ALTA-1L trial and literature. Costs included frontline therapies, subsequent therapies, best supportive care (BSC), administration, concomitant medications, adverse events and health states. Direct medical costs and benefits (quality-adjusted life-years, QALYs) were discounted at a 3.0% annual rate. Uncertainty was assessed using deterministic (DSA) and probabilistic sensitivity analyses (PSA).
Results: The analysis showed that brigatinib was dominant versus alectinib; brigatinib led to a gain of 0.216 QALYs and to a treatment cost reduction of € 85,635. The results of the DSA showed that no parameters of the model significantly modified the base case result.
Conclusions: This economic evaluation suggested that, compared with alectinib, brigatinib can be considered a valid cost-utility option from the perspective of INHS in the treatment of patients with ALK-positive aNSCLC.
Keywords: Alectinib, ALK-positive, Brigatinib, Cost-utility, Italian NHS, NSCLC
Received: July 4, 2022
Accepted: September 27, 2022
Published online: October 24, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Nel 2020, secondo la stima fornita dal rapporto “Numeri del Cancro 2021”, sono state effettuate circa 40.850 nuove diagnosi di carcinoma del polmone, di cui il 67% (27.550) negli uomini e il 33% (13.300) nelle donne (1). Il carcinoma del polmone costituisce la seconda tipologia di neoplasia a maggior frequenza negli uomini (15%) e la terza nelle donne (6%) (1). Dal momento che rientra in quel gruppo di patologie oncologiche la cui diagnosi avviene spesso quando la malattia è già in stadio avanzato, la sopravvivenza a 5 anni dalla diagnosi del carcinoma polmonare è piuttosto bassa (uomini: 16,4%; donne: 22,7%) (1). A fronte di circa 34.000 decessi stimati nel 2021, il carcinoma polmonare rappresenta la prima causa di morte per cancro negli uomini e la seconda nelle donne (in aumento in queste ultime +5%) (1,2). Nel 2020, complessivamente, si è stimato che in Italia ci fossero circa 117.000 soggetti vivi con una diagnosi pregressa di carcinoma polmonare, di cui il 34% aveva sviluppato la neoplasia da meno di 2 anni, il 23% da 2-5 anni, il 17% da 5-10 anni e solo il 25% da oltre 10 anni (2).
All’interno di questo scenario epidemiologico il carcinoma polmonare non a piccole cellule (NSCLC) rappresenta il sottotipo istologico a maggior prevalenza, caratterizzandone circa l’84% dei casi (3). Approssimativamente, si stima che il 3-5% dei casi di NSCLC sia causato da riarrangiamenti nel gene ALK (Anaplastic Lymphoma Kinase) (4-6). Considerando il numero di nuove diagnosi indicato nel rapporto “Numeri del Cancro 2021”, si possono quindi stimare circa 1.000-1.700 nuovi casi di NSCLC con mutazione del gene ALK.
Il continuo progresso nella conoscenza della natura molecolare del carcinoma del polmone ha permesso lo sviluppo in questi anni di terapie a bersaglio molecolare (terapie target) che ne hanno migliorato significativamente gli esiti clinici (7,8). Tra queste, gli inibitori della tirosinchinasi (Tyrosine Kinase Inhibitor, TKI) hanno radicalmente cambiato l’approccio terapeutico nel trattamento del NSCLC avanzato (aNSCLC) ALK+, a tal punto che le Linee Guida raccomandano di effettuare il test per questa mutazione su tutti i pazienti con NSCLC a istologia non squamosa (9). Crizotinib (10) è stato il primo TKI mirato per il trattamento del aNSCLC ALK+ che ha dimostrato di essere superiore (aumento della progressione libera da malattia, PFS) alla chemioterapia, rappresentando per diversi anni lo standard of care per questi pazienti (11). Successivamente, a causa di problematiche di resistenza e di non tollerabilità (12-15) associate al trattamento con crizotinib, sono stati approvati TKI di seconda generazione, quali alectinib (16) e brigatinib (17). L’efficacia di questi TKI di seconda generazione nel trattamento dei pazienti con aNSCLC ALK+ precedentemente non trattati con un inibitore ALK (ALK naïve) è stata valutata tramite la conduzione di studi di confronto diretto (Head-to-Head) rispetto a crizotinib (18,19). In entrambi i confronti è stata evidenziata una maggiore efficacia (aumento della PFS) dei TKI di seconda generazione (18,19).
Alla luce sia della maggiore efficacia di alectinib e di brigatinib sia della crescente necessità espressa dai decisori di stimare il valore delle nuove terapie, soprattutto in ambito oncologico, l’obiettivo della presente valutazione economica è stato quello di determinare, nella prospettiva del Servizio Sanitario Nazionale (SSN), il rapporto di costo-efficacia incrementale (ICER) di brigatinib rispetto ad alectinib nel trattamento di pazienti adulti con aNSCLC ALK+, precedentemente non trattati con un inibitore di ALK (pazienti naïve).
Metodi
Modello
L’analisi di costo utilità (Cost-Utility Analysis, CUA) è stata condotta tramite l’utilizzo di un pre-esistente modello di sopravvivenza sviluppato in ambiente Excel®. La struttura logico-formale del modello prevede quattro possibili stati di salute: i) libero da progressione della malattia (PFS), ii) progressione della malattia senza metastasi cerebrali (CNS-PFS), iii) progressione della malattia con metastasi cerebrali (CNS-PD) e iv) morte (Fig. 1). Il tempo che ciascun paziente trascorre in ognuno dei quattro stati di salute è stato stimato applicando la metodologia della partitioned survival analysis (PartSA). Con questa metodologia, un’ipotetica coorte di pazienti viene seguita nel tempo attraverso una serie di stati di salute esaustivi e mutuamente esclusivi. A differenza di quanto avviene nel modello di Markov, il numero di pazienti presente in qualsiasi stato di salute, ad ogni istante di tempo (t) considerato, non è determinato dalle matrici di transizione, ma è stimato in base alle rispettive curve di progressione della malattia (progression free survival, PFS) e di sopravvivenza complessiva (overall survival, OS) dei trattamenti oggetto del confronto. In questo specifico caso l’OS viene suddivisa negli stati di salute PFS, CNS-PFS e CNS-PD. La probabilità (p) che ha un paziente, in riferimento a un determinato tempo (t), di permanere nello stato di salute PFS è data dalla rispettiva area sotto la curva della PFS. La probabilità che un paziente al tempo t ha di permanere nello stato di salute CNS-PFS è data dalla differenza tra l’area sotto la curva della CNS-PFS e l’area sotto la curva della PFS. La probabilità che un paziente al tempo t ha di permanere nello stato di salute CNS-PD è data dalla differenza tra l’area sotto la curva dell’OS e l’area sotto la curva della CNS-PFS. L’utilizzo di questa tipologia di modello viene prevalentemente adottato per valutare trattamenti in ambito oncologico, dove è fondamentale poter separare le curve di PFS e OS.
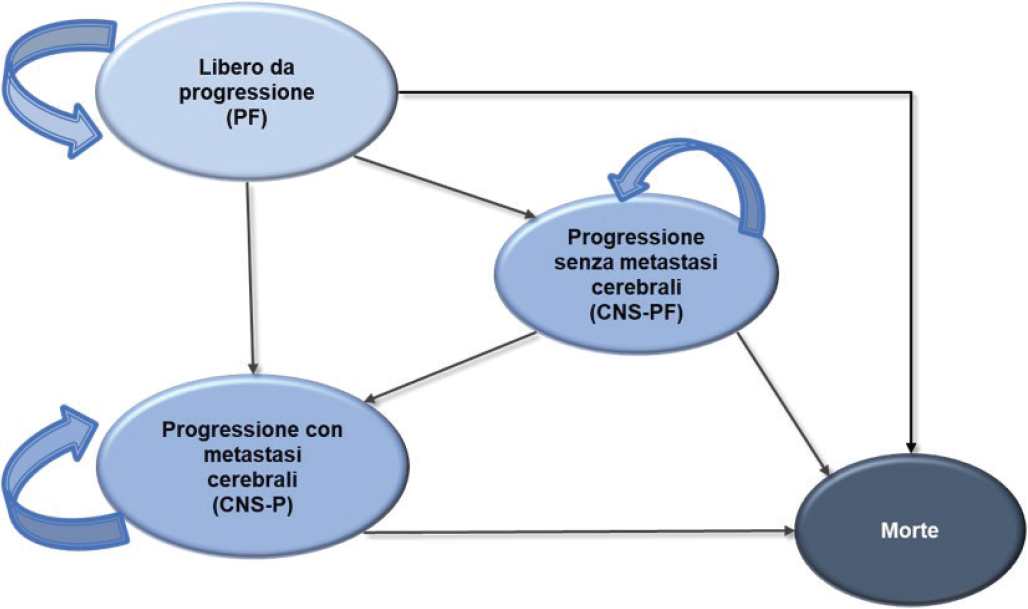
L’analisi è stata condotta considerando un orizzonte temporale lifetime (30 anni) commisurato all’aspettativa di vita di questi pazienti. La struttura del modello di costo-efficacia (cost-utility model, CUM) è caratterizzata dalla presenza di cicli della durata di 28 giorni, finalizzati a replicare la lunghezza dei cicli di trattamento delle due alternative terapeutiche considerate (alectinib e brigatinib).
Il paziente entra nel modello nello stato di salute PFS. Successivamente, il paziente può rimanere nel medesimo stato di salute oppure passare negli stati di salute CNS-PFS, CNS-PD o Morte. Il paziente che arriva nello stato di salute CNS-PFS può rimanervi nei successivi cicli oppure passare negli stati di salute CNS-PD o Morte. Il paziente che arriva nello stato di salute CNS-PD può rimanervi nei successivi cicli oppure passare nello stato di Morte. Nella costruzione logico-formale della CUM si è assunto che la progressione della malattia sia irreversibile; per esempio, un paziente può passare dallo stato di salute PFS a quello CNS-PFS, ma non viceversa.
I risultati della CUA di brigatinib rispetto ad alectinib vengono qui presentati in termini di costo incrementale per anno di vita corretto per la qualità (quality adjusted life years, QALY). In accordo con quanto indicato dalle Linee Guida dell’Associazione Italiana di Economia Sanitaria (AIES), costi (diretti sanitari) e benefici (QALY) futuri (ovvero che si manifestano oltre l’anno) sono stati scontati applicando un tasso annuo del 3,0% (20).
Dati clinici
In assenza di uno studio di confronto diretto, al fine di investigare l’efficacia di brigatinib rispetto a quella di alectinib nel trattamento di pazienti con aNSCLC ALK+ precedente non trattati con un ALK inibitore, è stato condotto un confronto indiretto. Tale confronto è stato effettuato sulla base dei dati clinici raccolti per brigatinib nella seconda interim analysis dello studio ALTA-1L (19,21) disponibile durante la fase di sviluppo del modello Excel originale e, per alectinib, nello studio ALEX (18,22-24). La presenza in entrambi gli studi di crizotinib, quale comparatore, ha fornito il necessario collegamento inter-trial per condurre il confronto indiretto. Dal momento che lo studio ALTA-1L (19,21) e lo studio ALEX (22-24) presentano delle differenze che ne limitano l’interpretazione tramite un semplice confronto indiretto, la comparazione dei risultati dei due studi è avvenuta applicando le anchored Matching-Adjusted Indirect Comparisons (aMAIC). Questa metodologia utilizza i dati a livello di singolo paziente (individual patient data, IPD) al fine di far corrispondere le caratteristiche cliniche al basale dei soggetti trattati con un farmaco in uno o più studi clinici rispetto a quelle riportate in altri studi clinici per soggetti trattati con un altro trattamento. Effettuata questa fase di bilanciamento delle popolazioni considerate, risulta poi possibile confrontare i risultati clinici associati ai trattamenti osservati. La percentuale di metastasi cerebrali al basale è stata identificata come l’unica variabile in grado di modificare l’efficacia del trattamento basata sui dati raccolti a livello di singolo paziente nello studio ALTA-1L (19,21). Pertanto, è stata considerata una correzione dello sbilanciamento nelle metastasi cerebrali al basale tra i due studi. Al fine di ottenere la stima dell’efficacia relativa (hazard ratio, HR) di brigatinib rispetto ad alectinib sono stati condotti due abbinamenti separati sulle percentuali di metastasi cerebrali al basale: i) i dati dei pazienti di brigatinib in ALTA-1L (19,21) sono stati abbinati al braccio alectinib in ALEX (18,22-24) e ii) i dati dei pazienti di crizotinib in ALTA-1L (19,21) sono stati abbinati al braccio crizotinib in ALEX (18,22-24). La somministrazione di una precedente chemioterapia non è stata invece identificata come una variabile in grado di influire sull’effetto del trattamento (sempre utilizzando i dati a livello di singolo paziente dello studio ALTA-1L (19,21)). Tuttavia, al fine di consentire un confronto più omogeneo con lo studio ALEX (18,22-24), sono state esplorate le analisi di sottogruppo utilizzando i dati dei pazienti naïve a una precedente chemioterapia per lo studio ALTA-1L (19,21).
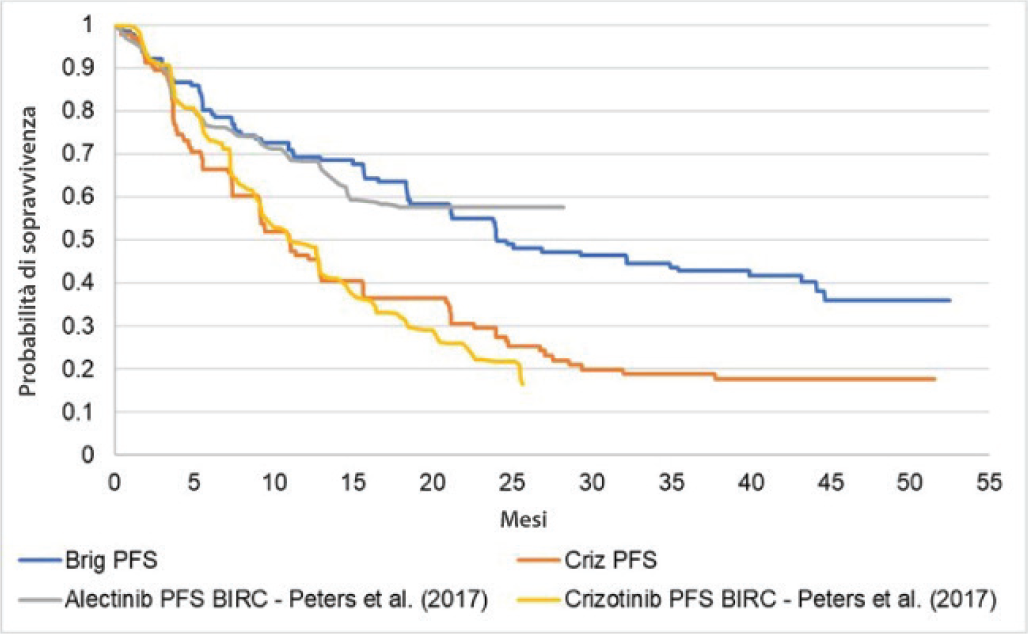
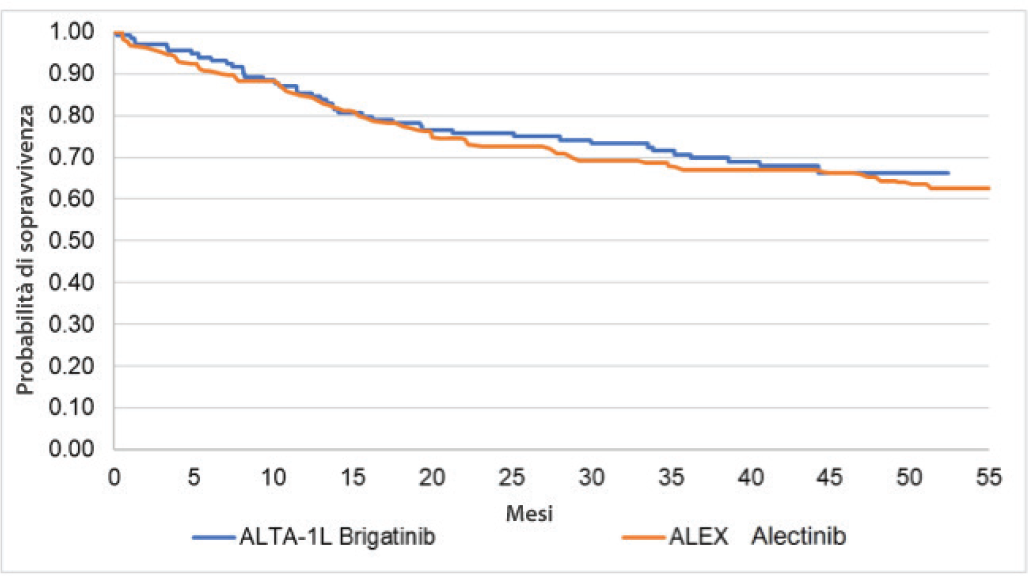
La Tabella I riporta nel dettaglio gli HR, calcolati tramite le aMAIC, di brigatinib rispetto ad alectinib in relazione con gli outcome PFS, CNS-PFS e OS. La Figura 2 presenta il confronto delle curve di Kaplan-Meier delle PFS relative agli studi ALTA-1L (19) e ALEX (18). Nonostante nello studio ALTA-1L (19) sembrerebbe esserci una separazione anticipata delle curve di PFS tra brigatinib e crizotinib, la tendenza complessiva delle curve di PFS di brigatinib e alectinib sembra essere simile. L’HR tra la PFS di brigatinib e quella di alectinib è risultato pari a 0,977 (0,620-1,540). La permanenza nello stato di PFS di brigatinib è stata estrapolata sulla base della rispettiva curva di Kaplan-Meier (19) applicando la distribuzione parametrica esponenziale, che ha prodotto il miglior fitting ai dati valutato applicando i bayesian information criterion (BIC) e akaike information criterion (AIC). Considerando quindi tale estrapolazione e l’HR rispetto ad alectinib, è stata stimata una PFS media (non scontata) di 3,50 anni per brigatinib e una di 3,43 anni per alectinib. Dal momento che nello studio ALEX (18) non è stata pubblicata alcuna curva riguardante la progressione della malattia libera da metastasi cerebrali (CNS-PFS) di alectinib, nel presente modello, per il calcolo della permanenza nel relativo stato di salute, si è assunto di applicare lo stesso HR utilizzato per la PFS (Tab. I). Replicando quindi quanto fatto nel calcolo della PFS (distribuzione parametrica esponenziale della curva di CNS-PFS di brigatinib e HR di brigatinib rispetto ad alectinib) è stata stimata una CNS-PFS media (non scontata) di 2,44 anni per brigatinib e di 2,39 anni per alectinib. La Figura 3, infine, presenta le Kaplan-Meier per l’OS di brigatinib (ALTA-1L) (19) e di alectinib (ALEX) (24). Sulla base di queste curve è stato calcolato un HR di 0,929 (0,514-1,677) dell’OS di brigatinib rispetto a quella di alectinib. Le stime di OS sono state corrette (aMAIC) tenendo conto dei differenti protocolli adottati negli studi ALTA-1L (19,21) e ALEX (18,22-24). Nel protocollo dello studio ALTA-1L (19,21) era infatti pre-specificato il crossover tra brigatinib e crizotinib, mentre non lo era nello studio ALEX (18,22-24) tra alectinib e crizotinib. Sulla base dell’estrapolazione dei dati (distribuzione parametrica esponenziale) si stima un’OS media (non scontata) di 8,48 anni per brigatinib e di 7,93 anni per alectinib. La permanenza dei pazienti nello stato di salute CNS-PD viene infine calcolata come la differenza del tempo trascorso in OS meno il tempo trascorso negli stati di PFS e di CNS-PFS. Nello specifico, la CNS-PD media (non scontata) associata a brigatinib considerata nel modello è pari a 2,53 anni, mentre quella associata ad alectinib è pari a 2,12 anni.
| Caso base | Hazard Ratio | IC95% |
|---|---|---|
| PFS | 0,977 | 0,620-1,540 |
| CNS-PFS | 0,977 | 0,620-1,540 |
| OS | 0,929 | 0,514-1,677 |
Trattamento
Nel caso base della CUA si è assunto che la durata del trattamento d’elezione con brigatinib o alectinib fosse uguale al tempo trascorso senza progressione della malattia. Sulla base dello studio ALTA-1L (19) e del technology appraisal di alectinib sottomesso al NICE (National Institute for Health and Care Excellence) (25) è stata poi considerata un’intensità di dose relativa (Relative Dose Intensity, RDI) dell’83,8% per brigatinib e del 95,6% per alectinib. La RDI è stata definita come il rapporto tra la quantità di farmaco erogata nell’unità di tempo e quella prevista da un regime di riferimento.
In caso di interruzione della terapia d’elezione, il modello prevede la somministrazione di una terapia successiva. Al fine di pesare l’effetto differenziante (impatto clinico ed economico) determinato dalle sole terapie d’elezione, sulla base di un’expert opinion internazionale, è stata adottata nel modello una successiva linea di trattamento uguale per brigatinib e alectinib. Questa successiva linea di trattamento prevede che:
− il 5% dei pazienti possa ricevere la somministrazione di un’immunoterapia (nella CUA è stata assunta la somministrazione di atezolizumab), seguita successivamente dalla best supportive care (BSC)
− il 5% dei pazienti possa ricevere la somministrazione di un VEGF-R (nella CUA è stata assunta la somministrazione di atezolizumab), seguita successivamente da BSC
− il 50% dei pazienti possa ricevere una chemioterapia composta da pemetrexed più cisplatino (nella CUA è stata assunta la somministrazione di pemetrexed 500 mg/m2 + cisplatino 75 mg/m2 ogni 3 settimane per un massimo di quattro cicli, seguita dalla somministrazione di mantenimento con pemetrexed 500 mg/m2 ogni 3 settimane), seguita successivamente da BSC
− il 40% dei pazienti possa ricevere solo BSC.
Eventi avversi
Il profilo di sicurezza di brigatinib e di alectinib è stato considerato includendo nel modello tutti gli eventi avversi (EA) di grado 3-4 che si sono verificati con un’incidenza ≥ 3%, rispettivamente, nello studio ALTA-1L (19) e nello studio ALEX (24). La durata dell’evento avverso (EA) è stata posta uguale a quella del ciclo del modello. Solo quando il paziente è in trattamento con uno dei due farmaci d’elezione, il modello valuta l’effetto che la manifestazione dell’EA esercita sulla qualità di vita e sul costo di gestione della malattia. La Tabella II riporta nel dettaglio i tassi di incidenza (tasso per ciclo) degli EA associati a brigatinib e ad alectinib.
| Evento avverso | Costo unitario | Fonte | Tasso per ciclo | |
|---|---|---|---|---|
| Brigatinib | Alectinib | |||
| Aumento della creatinchinasi | € 47,66 | (25) | 0,0090 | 0,0090 |
| Aumento dell’amilasi | € 47,66 | (25) | 0,0020 | 0,0019 |
| Nausea | € 1.995,00 | (41) | 0,0008 | 0,0006 |
| Ipertensione | € 963,00 | DRG134 | 0,0048 | 0,0047 |
| Aumento AST | € 47,66 | (25) | 0,0015 | 0,0015 |
| Aumento ALT | € 47,66 | (25) | 0,0015 | 0,0015 |
| Aumento dei livelli sierici di lipasi | € 47,66 | (25) | 0,0053 | 0,0052 |
| Neutropenia | € 511,00 | (41) | 0,0005 | 0,0004 |
| Anemia | € 293,80 | (42) | 0,0010 | 0,0011 |
| Diarrea | € 1.995,00 | (41) | 0,0008 | 0,0006 |
| Vomito | € 1.995,00 | (41) | 0,0005 | 0,0004 |
| Aumento GGT | € 47,66 | (25) | 0,0008 | 0,0006 |
| Polmonite | € 2.291,00 | DRG90 | 0,0018 | 0,0017 |
| Lesione renale acuta | € 1.883,00 | DRG321 | 0,0000 | 0,0000 |
| Astenia | € 307,00 | (41) | 0,0005 | 0,0004 |
| Progressione neoplastica | € 4.161,00 | DRG082 | 0,0010 | 0,0011 |
| Embolia polmonare | € 4.009,00 | DRG078 | 0,0008 | 0,0006 |
| Aumento fosfatasi alcalina nel sangue | € 47,66 | (25) | 0,0010 | 0,0011 |
| Ipercolesterolemia | € 47,66 | (25) | 0,0000 | 0,0000 |
| Ipertrigliceridemia | € 47,66 | (25) | 0,0003 | 0,0002 |
| Edema | € 3.802,00 | DRG087 | 0,0000 | 0,0000 |
| Neuropatia periferica | € 1.210,00 | DRG019 | 0,0000 | 0,0000 |
| Deficit cognitivo | € 2.850,00 | DRG012 | 0,0003 | 0,0002 |
| Iperlipidemia | € 47,66 | (25) | 0,0000 | 0,0000 |
| Costo degli EA per ciclo | € 22,22 | € 21,31 | ||
Utilità
Lo studio ALTA-1L (19) ha raccolto i dati di qualità di vita correlata alla salute (Health-Related Quality of Life, HRQoL) tramite la somministrazione del questionario EORTC-QLQ-C30 (versione 3.0) e dello specifico modulo per il cancro del polmone (QLQ-LC13, versione 3.0). L’EORTC QLQ-C30 è un questionario specifico per le malattie oncologiche con un punteggio basato sulla valutazione di cinque scale funzionali, di tre scale sintomatologiche e di una scala sullo stato di salute e sulla qualità di vita del paziente. Tuttavia, dal momento che l’EORTC QLQ-C30 non incorpora informazioni sulle preferenze dei pazienti, non può essere usato “direttamente” nelle valutazioni economiche. Pertanto, è stato necessario convertire (mapping exercise) i dati dell’EORTC QLQ-C30 in punteggi di utilità EQ-5D-3L. Tale conversione è avvenuta applicando l’algoritmo pubblicato da Longworth et al. (26), poiché ritenuto il più idoneo nell’area del cancro ai polmoni (27). Tuttavia, poiché riferiti a un arco temporale limitato, i dati di qualità di vita raccolti nello studio ALTA-1L (19) non sono idonei a valutare l’utilità correlata alla progressione della malattia nel tempo. Pertanto, in linea con la metodologia adottata dal NICE (28), sono stati applicati dei moltiplicatori per tenere conto dell’impatto sulla qualità di vita delle metastasi cerebrali e della somministrazione della chemioterapia e della BSC. Così facendo, al fine di considerare l’impatto (utilità) sulla progressione della malattia determinato dalle metastasi cerebrali, nella CUA è stato considerato un moltiplicatore del 75,36%. Tale moltiplicatore è stato calcolato come rapporto tra l’utilità associata alle metastasi cerebrali (0,52) e l’utilità associata alle metastasi polmonari controlaterali (0,69) stimate da Roughley et al. nei pazienti con aNSCLC, tramite la somministrazione del questionario EQ-5D (29). Un moltiplicatore del 90,24% è stato invece applicato per valutare l’impatto della chemioterapia sulla progressione della malattia. Tale valore deriva dal rapporto dell’utilità associata ai pazienti in trattamento con pemetrexed (0,74) rispetto a quella dei pazienti trattati con crizotinib (0,82) stimate nello studio PROFILE 1007, condotto su pazienti precedentemente trattati con aNSCLC ALK+ (30). Infine, è stato applicato un moltiplicatore del 70,28% al valore di utilità sulla progressione della malattia per stimare l’impatto della BSC. Tale valore è stato calcolato rapportando l’utilità associata allo stato di progressione della malattia (0,473) rispetto a quella associata allo stato di salute di un paziente responder (0,673) stimato da Nafees et al. nel trattamento del NSCLC (31).
Sulla base dei valori di utilità raccolti nello studio ALTA-1L (19), in presenza di un evento avverso di grado 3-4, è stato associato un decremento di utilità di 0,03424. Infine, sulla base di quanto riportato nell’analisi condotta da Ara et al. (32), nel modello è stato considerato anche un decremento di utilità (-0,00026 ogni anno) associato all’aumento dell’età pazienti trattati. La Tabella III presenta i valori di utilità applicati nel modello.
Costi di trattamento
Sono stati considerati i costi diretti sanitari quali il costo del trattamento d’elezione (brigatinib o alectinib), il costo di trattamento dei farmaci successivi al trattamento d’elezione, il costo per la BSC, il costo di somministrazione, il costo dei farmaci concomitanti al trattamento d’elezione, il costo degli stati di salute e il costo degli eventi avversi associati al trattamento d’elezione.
| Categoria | Stati di salute | Valore | Fonte |
|---|---|---|---|
| Valori di utilità | Pre-progressione | 0,790 | (19,26,27) |
| Progressione in trattamento | 0,617 | (19,26,27) | |
| Progressione con metastasi cerebrali | |||
| Brigatinib | 0,543 | Calcolo | |
| Alectinib | 0,542 | Calcolo | |
| Progressione senza metastasi cerebrali | |||
| Brigatinib | 0,550 | Calcolo | |
| Alectinib | 0,549 | Calcolo | |
| Moltiplicatori | Chemioterapia | 90,24% | (30) |
| BSC | 70,28% | (31) | |
| Metastasi cerebrali | 75,36% | (29) | |
| Decrementi utilità | EA grado 3-4 | –0,03424 | (19,26,27) |
| Età | –0,00026 | (32) |
Trattamento d’elezione
Il costo del trattamento con brigatinib o alectinib è stato calcolato utilizzando per ciascun farmaco il rispettivo schema posologico e prezzo ex-factory pubblicato in Gazzetta Ufficiale (33,34) al netto delle riduzioni obbligatorie di legge applicate (Tab. IV). Nello specifico, lo schema posologico adottato nella CUA per brigatinib e alectinib (Tab. IV) è allineato con quanto indicato nei rispettivi studi clinici (ALTA-1L (19,21) e ALEX (18,22-24)) e RCP (16,17).
Trattamenti successivi
In caso di interruzione della terapia d’elezione il modello prevede la somministrazione di un successivo trattamento farmacologico con immunoterapia (atezolizumab), con VEGF-R (nintedanib) oppure con chemioterapia (pemetrexed più cisplatino) (si veda paragrafo “Trattamento”). Nella Tabella IV vengono riportati i relativi schemi posologici e i prezzi ex-factory (al netto delle riduzioni obbligatorie di legge applicate) adottati nella CUA. Sulla base dei dati di letteratura è stata considerata una durata media di trattamento di 33,83 settimane per l’immunoterapia (35), di 14,78 settimane per VEGF-R (36,37) e di 26,90 settimane per la chemioterapia (38).
Best supportive care
In linea con la pratica clinica, al termine della somministrazione delle possibili linee di trattamento (trattamento d’elezione e trattamenti successivi) si assume nella CUA che il paziente riceva una BSC. Quest’ultima è stata valorizzata con un costo medio per ciclo di € 525,93. Tale costo riflette il consumo di risorse indicato nel technical report di brigatinib sottomesso al NICE (39). La Tabella V descrive nel dettaglio le categorie di risorse sanitarie considerate, il relativo consumo e la valorizzazione per ciclo del modello.
| Trattamento | Posologia | Confezione | Prezzo ex-factory confezione |
|---|---|---|---|
| Terapia d’elezione | |||
| Brigatinib (induzione) | 90 mg - una volta al giorno (primi 7 giorni) | 28 cpr 90 mg | € 2.354,50 |
| Brigatinib (mantenimento) | 180 mg - una volta al giorno | 28 cpr 180 mg | € 4.709,00 |
| Alectinib | 600 mg - due volte al giorno | 224 cps | € 6.460,00 |
| Successive linee di trattamento | |||
| Immunoterapia | |||
| Atezolizumab | 1.200 mg ogni 3 settimane | 1.200 mg concentrato per soluzione per infusione 60 mg/mL 1 flaconcino 20 mL | € 4.602,75 |
| VEGR-F | |||
| Nintedanib | 200 mg - due volte al giorno | 120 capsule molli da 100 mg | € 2.583,33 |
| Chemioterapia | |||
| Pemetrexed* | Pemetrexed 500 mg/m2 + cisplatino 75 mg/m2 ogni 3 settimane per un massimo di quattro cicli seguito dalla somministrazione di mantenimento con pemetrexed 500 mg/m2 ogni 3 settimane | 25 mg/mL concentrato per soluzione per infusione uso endovenoso 1 flaconcino da 4 mL | € 165,10 |
| Pemetrexed* | 25 mg/mL concentrato per soluzione per infusione uso endovenoso 1 flaconcino da 20 mL | € 825,51 | |
| Cisplatino* | 1 flaconcino EV 50 mL 1 mg/mL | € 12,86 | |
| Inibitore della tirosinchinasi | |||
| Lorlatinib | 100 mg di lorlatinib assunti per via orale una volta al giorno | 30 cpr 100 mg | € 4.500,00 |
*È stato considerato il prezzo del generico.
| Categoria | Dosaggio | Frequenza per ciclo | Costo unitario | Costo per ciclo |
|---|---|---|---|---|
| Radioterapiaa | n.a. | 0,25 | € 145,70 | € 36,43 |
| Steroidi (desametasone)b | 0,5 mg/die | 28,00 | € 22,92 | € 35,30 |
| Aspirinac | 75 mg/die | 28,00 | € 0,43 | € 12,04 |
| Morfinab | 50 mg/die | 28,00 | € 4,13 | € 115,64 |
| Bifosfonatob | 10 mg/die | 28,00 | € 0,75 | € 21,00 |
| Denosumabb | 120 mg ogni 4 sett | 1,00 | € 296,85 | € 296,85 |
| Dietistad | n.a. | 0,42 | € 20,66 | € 8,68 |
| Costo totale per ciclo | € 525,93 | |||
aè stata considerata la tariffa rimborsata dalla Regione Lombardia per la radioterapia stereotassica sedute successive alla prima (cod 92.24.7).
bè stato considerato il prezzo ex-factory (farmaci di classe A).
cè stato considerato il prezzo al pubblico di € 12,90 per la confezione da 30 capsule molli da 75 mg di Cardioral.
dè stata considerata come proxy la tariffa nazionale rimborsata per la visita generale (cod 89.7).
n.a. = non applicabile.
Costi di somministrazione
In presenza di farmaci somministrati per via orale (per esempio, brigatinib e alectinib), nel modello non è stato considerato alcun costo di somministrazione. Mentre, se il trattamento viene somministrato per via endovenosa, è stato considerato un costo di € 44,00 applicando come proxy la tariffa MAC01 rimborsata dalla Regione Lombardia per la somministrazione della chemioterapia con somministrazione di farmaci ad alto costo (40).
Costo farmaci concomitanti
Nel modello sono state considerate anche le terapie farmacologiche concomitanti somministrate in aggiunta alla terapia d’elezione. I farmaci concomitanti associati a brigatinib sono stati desunti dallo studio ALTA-1L (19,21), includendo quelli somministrati ad almeno il 10% dei pazienti. In assenza di ulteriori evidenze cliniche, si è assunto nella CUA per alectinib che il tipo di farmaci concomitanti e la proporzione di pazienti che li ricevono durante il trattamento fosse sovrapponibile a quanto considerato per brigatinib. Il costo dei farmaci concomitanti viene considerato nella CUA solo per i pazienti in trattamento d’elezione e corrisponde a un costo medio per ciclo di € 116,94. Nella Tabella VI viene riportato il dettaglio dello schema posologico e dei costi dei farmaci concomitanti considerati.
Costo per stato di salute
Il consumo di risorse associato agli stati di salute PFS (in trattamento d’elezione), CNS-PFS (interruzione trattamento d’elezione) e CNS-PD (progressione della malattia con metastasi cerebrali) è stato desunto da quanto indicato nel report (technology appraisal) di alectinib sottomesso al NICE (25). Indipendentemente dal trattamento d’elezione somministrato, il costo del primo ciclo nello stato di salute PFS è pari a € 24,53, mentre quello dei cicli successivi è di € 123,85 (Tab. VII). Il costo medio del ciclo nello stato di salute CNS-PFS è di € 151,73 (Tab. VIII). Il consumo addizionale di risorse sanitarie associato allo stato di salute CNS-PD, corrispondente a un massimo di 6 sedute di radioterapia stereotassica e di radioterapia cerebrale e a una resezione chirurgica (Tab. VIII), è stato valorizzato con un importo di € 3.985,22, al quale è stato aggiunto un costo per ciclo di € 3,78, corrispondente alla somministrazione di steroidi. La Tabella IX, in ultimo, riporta il dettaglio dei costi unitari delle singole prestazioni sanitarie erogate per valorizzare i consumi associati ai tre stati di salute indicati sopra.
| Farmaci concomitanti | Confezione | Dose | Costo per confezione | % utilizzo | Costo per ciclo |
|---|---|---|---|---|---|
| Paracetamoloa | Acetamol 500 mg 20 cpr | 3.000 mg/die | € 3,70 | 60,3% | € 18,74 |
| Metoclopramidea | Metoclopramide Accord 10 mg 30 cpr | 10 mg/die | € 7,00 | 10,3% | € 0,67 |
| Desametasoneb | Varcodes 2 mg 30 cpr | 8 mg/die | € 10,13 | 22,8% | € 8,62 |
| Metoclopramide cloridratob | Metoclopramide Salf 10 mg/2 mL 5 fiale 2 mL | 10 mg/die | € 1,40 | 11,8% | € 0,92 |
| Loperamide cloridratoa | Loperamide Hexal 2 mg 15 cps | 500 mcg/die | € 6,20 | 13,2% | € 0,19 |
| Amoxicillinab | Amoxicillin Aurobindo Italia 500 mg 12 cps | 500 mg/die | € 1,90 | 16,9% | € 0,75 |
| Enoxaparina sodicab | Enoxaparina Rovi 10.000 UI (100 mg)/1 mL 10 siringhe | 1 mg/kg/died | € 66,41 | 11,0% | € 14,36 |
| Acido acetilsalicilicoa | Cardioral 75 mg 30 cps | 300 mg/die | € 12,90 | 13,2% | € 6,37 |
| Loperamidea | Loperamide Angelini 2 mg 30 cps | 8 mg/die | € 4,80 | 12,5% | € 2,24 |
| Acetilcisteinaa | Acetilcisteina 300 mg/3 mL 5 fiale 3 mL | 100 mg/kg/died | € 5,30 | 10,3% | € 23,76 |
| Sennaa | Pursennid 12 mg 30 cpr | 12 mg/die | € 8,20 | 8,8% | € 0,68 |
| Omeprazolob | Mepral 20 mg 14 cpr | 40 mg/die | € 5,63 | 18,4% | € 4,14 |
| Idrocortisonec | Plenadren 20 mg 50 cpr | 20 mg/die | € 409,74 | 11,8% | € 26,99 |
| Lorazepama | Lorazepam ABC 1 mg 30 cpr | 2 mg/die | € 5,78 | 8,8% | € 0,95 |
| Furosemideb | Furosemide Mylan 25 mg 60 cpr | 50 mg/die | € 2,64 | 12,5% | € 0,31 |
| Ibuprofeneb | Brufen 600 mg 30 cpr | 600 mg/die | € 3,72 | 8,8% | € 0,31 |
| Levofloxacinab | Levofloxacina ABC 500 mg 5 cpr | 500 mg/die | € 6,25 | 7,4% | € 2,57 |
| Pantoprazolob | Pantoprazolo EG 40 mg 14 cpr | 80 mg/die | € 7,30 | 9,6% | € 2,79 |
| Prednisoneb | Cison 20 mg 20 cpr | 20 mg/die | € 5,87 | 19,1% | € 1,57 |
| Costo per ciclo | € 116,94 | ||||
aprezzo al pubblico (farmaco classe C).
bprezzo al pubblico (farmaco classe A).
cprezzo ex-factory (farmaco classe H).
dè stato considerato un paziente con peso medio corporeo di 70 kg.
| Primo ciclo | ||||
|---|---|---|---|---|
| Categorie | Descrizione | Frequenza/mese | % pazienti consumo risorse | Costo per mese |
| Visite | Prima visita oncologica | 1,00 | 100% | € 22,50 |
| Esami | Emocromo | 1,00 | 100% | € 3,17 |
| ALT | 1,00 | 100% | € 1,00 | |
| Costo totale per mese: | € 26,67 | |||
| Costo totale per ciclo: | € 24,53 | |||
| Cicli successivi | ||||
| Categorie | Descrizione | Frequenza/mese | % pazienti consumo risorse | Costo per mese |
| Visite | Seconda visita oncologica | 0,75 | 100% | € 13,43 |
| Visita MMG | 1,00 | 10% | € 2,07 | |
| Esami | Emocromo | 1,00 | 100% | € 3,17 |
| ALT | 1,00 | 100% | € 1,00 | |
| Tomografia computerizzata | 0,50 | 100% | € 32,55 | |
| Risonanza magnetica nucleare torace | 0,20 | 50% | € 18,13 | |
| Radiografia torace | 0,30 | 50% | € 2,32 | |
| Elettrocardiogramma dinamico | 1,00 | 100% | € 61,97 | |
| Costo totale per mese: | € 134,63 | |||
| Costo totale per ciclo: | € 123,85 | |||
| Utilizzo di risorse indipendentemente dal sito di progressione della malattia | ||||
|---|---|---|---|---|
| Categorie | Descrizione | Frequenza/mese | % pazienti consumo risorse | Costo per mese |
| Visite | Seconda visita oncologica | 1,25 | 100% | € 22,38 |
| Visita MMG | 1,00 | 50% | € 10,33 | |
| Esami | Emocromo | 1,50 | 100% | € 4,76 |
| ALT | 1,50 | 100% | € 1,50 | |
| Tomografia computerizzata | 0,75 | 100% | € 48,82 | |
| Risonanza magnetica nucleare torace | 0,50 | 80% | € 72,51 | |
| Radiografia torace | 0,50 | 60% | € 4,65 | |
| Costo totale per mese: | € 164,94 | |||
| Costo totale per ciclo: | € 151,73 | |||
| Utilizzo di addizionale di risorse per pazienti con metastasi cerebrali | ||||
| Categorie | % pazienti consumo risorse | Somministrazioni | ||
| Radioterapia stereotassica | 50,00% | 6 | ||
| Radioterapia cerebrale | 5,00% | 6 | ||
| Resezione chirurgica | 5,00% | 1 | ||
| Desametasone | 10,00% | n.a. | ||
| Costo per trattamento interrotto | € 3.985,22 | |||
| Costo per ciclo | € 3,78 | |||
n.a. = non applicabile.
| Categoria | Costo unitario | Fonte |
|---|---|---|
| Prima visita oncologica | € 22,50 | Tariffario Regione Lombardia (cod 89.7B.6) |
| Visita oncologica di controllo | € 17,90 | Tariffario Regione Lombardia (cod 89.01.F) |
| Visita MMG | € 20,66 | Tariffario nazionale (cod 89.7) |
| Alanina Aminotransferasi (ALT) | € 1,00 | Tariffario Nazionale (cod 90.04.5) |
| Emocromo | € 3,17 | Tariffario Nazionale (cod 90.62.2) |
| Tomografia computerizzata | € 65,09 | Tariffario Nazionale (media cod 87.41; 87.41.1; 87.42.1; 87.42.2; 87.42.3) |
| Radiografia torace | € 15,49 | Tariffario Nazionale (cod 87.44.1) |
| Risonanza magnetica nucleare torace | € 181,28 | Tariffario Nazionale (cod 88.92.1) |
| Elettrocardiogramma dinamico | € 61,97 | Tariffario Nazionale (cod 89.50) |
| Desametasone | € 37,82 | Prezzo pubblico |
| Radioterapia stereotassica | € 1.019,89 | Tariffario Regione Lombardia (cod 92.24.7 + cod 92.24.8) |
| Radioterapia cerebrale | € 838,76 | Tariffario Regione Lombardia (media cod 92.24.1; 92.24.2; 92.24.3; 92.24.5) |
| Resezione chirurgica | € 13.478,50 | Tariffario Nazionale (media: DRG001; DRG002) |
Costo eventi avversi
Il costo per ciclo relativo alla gestione degli aventi avversi correlati alla somministrazione del trattamento d’elezione è di € 22,22 per brigatinib e di € 21,31 per alectinib. Nello specifico gli eventi avversi nausea, neutropenia e astenia sono stati valorizzati riportando quanto indicato in una recente analisi di costo-efficacia condotta in Italia nel trattamento di pazienti con aNSCLC ALK+ (41). Si è assunto di valorizzare gli eventi avversi diarrea e vomito con lo stesso importo associato alla nausea (41). L’anemia è stata valorizzata riportando quanto indicato in uno studio condotto in ambito italiano finalizzato alla stima dei costi di alcuni EA nel trattamento di prima linea dei pazienti con NSCLC (42). Gli EA polmonite, lesione renale acuta, progressione neoplastica, embolia polmonare, edema, nefropatia periferica, ipertensione e deficit cognitivo sono stati invece valorizzati sulla base delle corrispondenti tariffe DRG (43). Infine l’aumento della creatinchinasi, l’aumento dell’amilasi, l’aumento AST, l’aumento ALT, l’aumento della fosfatasi alcalina nel sangue, l’aumento dei livelli sierici di lipasi, l’aumento GGT, l’ipercolesterolemia, l’ipertrigliceridemia e l’iperlipidemia, sulla base di quanto indicato nel report di alectinib sottomesso al NICE (25), sono stati valorizzati considerando l’esecuzione di due emocromi (tariffa nazionale: cod 90.62.2) e di due visite generali (tariffa nazionale: cod 89.7).
Analisi di sensibilità
Con l’obiettivo di valutare la solidità dei risultati stimati dalla CUA a fronte di variazioni dei valori dei parametri (in quanto stime campionarie) utilizzati nel caso base, sono state condotte un’analisi deterministica (Deterministic Sensitivity Analysis, DSA), un’analisi probabilistica (Probabilistic Sensitivity Analysis, PSA) e un’analisi di scenario.
Nello specifico, in riferimento alla DSA, è stata condotta un’analisi di sensibilità a una via (one way sensitivity analysis, OWSA) facendo variare in sequenza i principali parametri della CUA, utilizzando, quando possibile, il rispettivo intervallo di confidenza o, in alternativa, assumendo una variazione del ±10%.
Per quanto riguarda, invece, la PSA, sono state effettuate 1.000 iterazioni del modello, facendo, ogni volta, variare simultaneamente e casualmente i valori dei parametri secondo le distribuzioni probabilistiche loro assegnate e ricalcolando i risultati. Il prodotto della PSA è stato, quindi, presentato nella forma della superficie di accettabilità del rapporto di costo utilità incrementale (Cost-Effectiveness Plane). Quest’ultima mostra la dispersione dei 1.000 risultati delle iterazioni, ciascuno in funzione delle rispettive variazioni incrementali di beneficio (QALY) e di costo di brigatinib rispetto ad alectinib.
Dal momento che lo scenario base potrebbe non riflettere l’attuale prezzo di brigatinib e di alectinib, in quanto ai costi considerati nel caso base potrebbero essere praticati degli sconti aggiuntivi, è stata condotta un’analisi di scenario per valutare l’impatto che diverse ipotesi di sconto potrebbero determinare sul calcolo dell’ICER per QALY di brigatinib. Nello specifico, è stato ipotizzato che, per entrambi i farmaci, il prezzo possa variare applicando uno sconto compreso tra lo 0% e il 40%, considerando successivi scaglioni di 5 punti percentuali. Il rapporto incrementale di costo utilità è stato valutato considerando tutte le possibili combinazioni di sconto ipotizzato.
Infine, con l’obiettivo di riflettere l’attuale pratica clinica italiana (44), in caso di interruzione della terapia d’elezione è stato ipotizzato uno scenario alternativo per la successiva linea di trattamento rispetto a quello considerato nel caso base. Tale scenario alternativo prevede che:
− dopo interruzione di brigatinib il 100% dei pazienti possa ricevere una chemioterapia composta da pemetrexed più cisplatino (nella CUA è stata assunta la somministrazione di pemetrexed 500 mg/m2 + cisplatino 75 mg/m2 ogni 3 settimane per un massimo di quattro cicli, seguita dalla somministrazione di mantenimento con pemetrexed 500 mg/m2 ogni 3 settimane);
− dopo interruzione di alectinib il 100% dei pazienti possa ricevere una terapia composta da lorlatinib (nella CUA è stata assunta la somministrazione di 100 mg di lorlatinib (45) valorizzata considerando il relativo prezzo ex-factory al netto delle riduzioni obbligatorie di legge applicate) (Tab. IV).
Risultati
Analisi costo-efficacia incrementale
Il tempo medio trascorso nello stato di salute PFS è risultato pari a 3,180 anni per brigatinib e a 3,114 anni per alectinib, mentre la sopravvivenza media (OS) pari a 6,873 anni per brigatinib e a 6,498 per alectinib (Tab. X). Rispetto ad alectinib, viene stimato per il paziente trattato con brigatinib un incremento sia della durata media della PFS (0,066 anni) sia dell’OS (0,375 anni) (Tab. X). Correggendo tali valori per la qualità di vita corrispondente, si ottengono 4,410 QALY (di cui 2,460 in PFS) per il paziente trattato con brigatinib e 4,195 QALY (di cui 2,410 in PFS) per quello trattato con alectinib (Tab. X). Lungo l’orizzonte temporale lifetime, il costo di trattamento associato al paziente che inizia il percorso di cura con brigatinib è di € 215.674, mentre per quello che riceve alectinib è di € 301.282 (Tab. X). In entrambi i casi, la maggiore componente del costo di trattamento è costituita dalla terapia d’elezione, seguita dai costi associati alle successive terapie farmacologiche. Complessivamente, a fronte di un incremento dei QALY (+ 0,216) e di una riduzione dei costi di trattamento (-€ 85.635), brigatinib risulta dominante rispetto ad alectinib nel trattamento dei pazienti con aNSCLC ALK+ precedentemente non trattati con un inibitore di ALK (Tab. X).
| Brigatinib | Alectinib | Differenza Brigatinib vs. Alectinib | |
|---|---|---|---|
| OS | 6,873 | 6,498 | 0,375 |
| – PFS | 3,180 | 3,114 | 0,066 |
| – CNS-PFS | 1,898 | 1,866 | 0,031 |
| – CNS-PD | 1,796 | 1,518 | 0,277 |
| QALY | 4,410 | 4,195 | 0,216 |
| – PFS | 2,460 | 2,410 | 0,051 |
| – CNS-PFS | 1,011 | 0,993 | 0,018 |
| – CNS-PD | 0,943 | 0,795 | 0,147 |
| – EA | –0,004 | –0,004 | 0,000 |
| Costo di trattamento | € 215.647 | € 301.282 | –€ 85.635 |
| – Trattamento d’elezione | € 164.969 | € 253.664 | –€ 88.695 |
| – Trattamento concomitante | € 4.903 | € 4.803 | € 100 |
| – PFS | € 5.094 | € 4.988 | € 106 |
| – CNS-PFS + CNS-PD | € 8.463 | € 7.721 | € 742 |
| – Trattamento successivo | € 31.287 | € 29.230 | € 2.056 |
| – Eventi avversi | € 932 | € 875 | € 57 |
| ICER per QALY di Brigatinib vs. Alectinib | Dominante | ||
Analisi di sensibilità
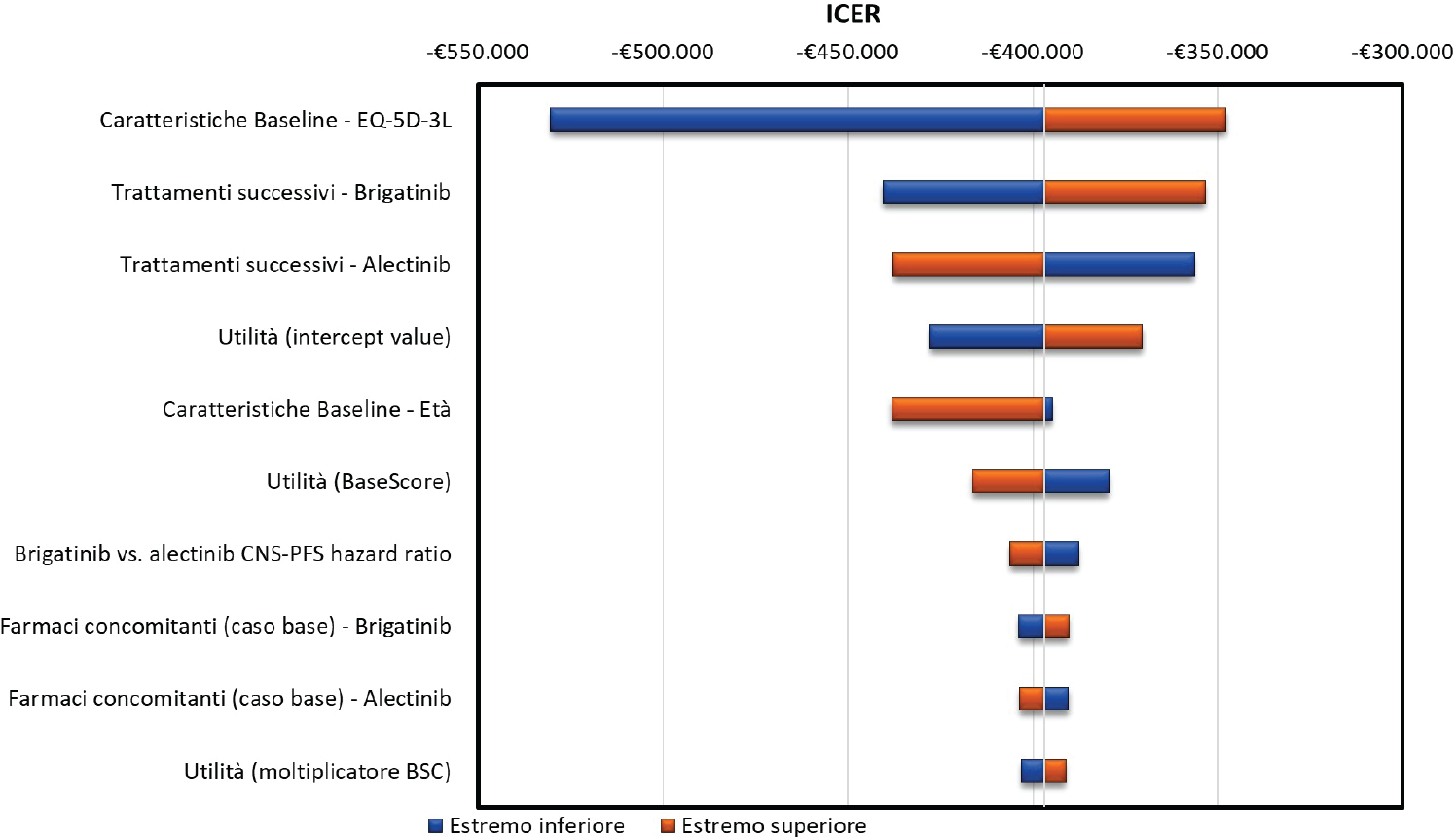
La Figura 4 presenta un diagramma a tornado che riporta la variazione del rapporto di costo-efficacia incrementale di brigatinib rispetto ad alectinib in funzione dei dieci parametri che maggiormente influiscono sul risultato del caso base. I risultati dell’OWSA mostrano come in realtà nessuno di questi parametri modifichi significativamente il risultato del caso base, riportando sempre la dominanza di brigatinib rispetto ad alectinib.
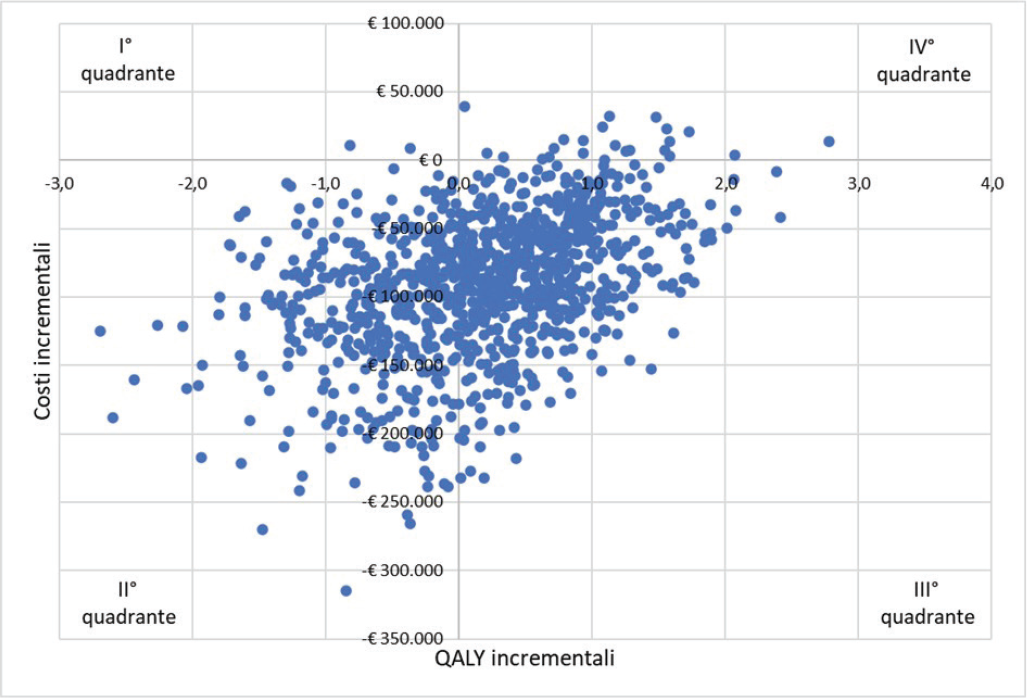
La Figura 5 riporta invece il risultato dell’analisi di sensibilità probabilistica (PSA), ovvero la superficie di accettabilità del rapporto di costo-efficacia incrementale di brigatinib rispetto ad alectinib. Tale Figura mostra come quasi tutta la dispersione delle 1.000 iterazioni sia racchiusa nel secondo e nel terzo quadrante. Sempre sulla base delle 1.000 iterazioni, la Figura 5 indica che la probabilità di brigatinib di essere dominante rispetto ad alectinib sarebbe pari al 59,4%.
I risultati dell’analisi di scenario, riportati nella Tabella XI, considerano 81 possibili combinazioni di sconto. La probabilità che brigatinib, a fronte di un valore soglia di € 40.000 (20), sia dominante o costo-efficace rispetto ad alectinib sarebbe del 98,8%, mentre solo nell’1,2% dei casi non risulterebbe costo-efficace.
| ICER | Sconto alectinib | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0% | 5% | 10% | 15% | 20% | 25% | 30% | 35% | 40% | |
| Sconto brigatinib | |||||||||
| 0% | D | D | D | D | D | D | D | Sì CE | No CE |
| 5% | D | D | D | D | D | D | D | D | Sì CE |
| 10% | D | D | D | D | D | D | D | D | D |
| 15% | D | D | D | D | D | D | D | D | D |
| 20% | D | D | D | D | D | D | D | D | D |
| 25% | D | D | D | D | D | D | D | D | D |
| 30% | D | D | D | D | D | D | D | D | D |
| 35% | D | D | D | D | D | D | D | D | D |
| 40% | D | D | D | D | D | D | D | D | D |
D = brigatinib è dominante rispetto ad alectinib; Sì CE = brigatinib è costo-efficace rispetto ad alectinib considerando un valore soglia di € 40.000; No CE = brigatinib non è costo-efficace rispetto ad alectinib considerando un valore soglia di € 40.000.
Infine, in caso di adozione di uno scenario alternativo per la successiva linea di trattamento a fronte del fallimento della terapia d’elezione che prevede una strategia diversificata per i due TKI, viene confermata la dominanza di brigatinib rispetto ad alectinib. Nello specifico, lungo un orizzonte lifetime, il modello stima 4,417 QALY per il paziente trattato con brigatinib e 4,222 QALY per quello trattato con alectinib, mentre associa un costo di trattamento di € 218.645 per il paziente che inizia il percorso di cura con brigatinib e di € 329.664 per quello trattato con alectinib.
Discussione
Se da un lato la disponibilità prima di crizotinib e poi dei TKI di seconda generazione, quali brigatinib e alectinib, ha generato significativi miglioramenti clinici nel trattamento del NSCLC ALK+, dall’altro ha sollevato la necessità dei decisori di disporre di valutazioni economiche finalizzate a valutarne la costo-efficacia. Affinché si possano valutare nel complesso i principali benefici e i costi associati ai farmaci osservati, le analisi di costo-efficacia devono essere condotte lungo un orizzonte temporale di lungo periodo (p. es., lifetime), aspetto che spesso si scontra con la relativa breve durata degli studi clinici. Tale scenario motiva il ricorso a modelli di simulazione, progettati per estrapolare nel lungo periodo gli esiti trovati dagli studi clinici nel breve periodo. In accordo con tale impostazione, il presente modello di costo-efficacia, attraverso la successione di quattro stati di salute, ha cercato di replicare la storia naturale del percorso clinico del paziente con aNSCLC ALK+ precedentemente non trattato con un inibitore di ALK. Il modello ha così permesso di stimare il rapporto di costo-efficacia di brigatinib rispetto ad alectinib.
L’analisi di costo-efficacia, basata sull’utilizzo di un partitioned survival model popolato principalmente dai dati clinici degli studi ALTA-1L (19,21) e ALEX (18,22-24) e condotta nella prospettiva del SSN italiano, ha determinato la dominanza di brigatinib rispetto ad alectinib, a fronte di un aumento dell’efficacia (0,216 QALY) e di una riduzione dei costi di trattamento (-€ 85.635).
Potenziali limiti dell’analisi
Come spesso accade il ricorso a un modello di simulazione può lasciare alcune zone di incertezza sui risultati ottenuti. Un primo motivo di incertezza risiede nel fatto che l’analisi di costo-efficacia tra brigatinib e alectinib non poggia le proprie basi su un confronto diretto, ma indiretto. I principali dati di efficacia di brigatinib e di alectinib sono stati infatti estrapolati rispettivamente dallo studio ALTA-1L (19,21) e ALEX (18,22-24). Si ricorda tuttavia che, in assenza di uno studio head-to-head, il ricorso al confronto indiretto rappresenta a oggi una metodica accettata, soprattutto nell’ambito delle valutazioni economiche. Un secondo motivo di incertezza riguarda i coefficienti di utilità utilizzati. Poiché non stimati dallo studio ALTA-1L (19,21), anche se in linea con la metodologia adottata dal NICE (28), sono stati applicati dei moltiplicatori per tenere conto dell’impatto sulla qualità di vita delle metastasi cerebrali e della somministrazione della chemioterapia e della BSC. Un terzo motivo di incertezza nei risultati dell’analisi potrebbe risiedere nel fatto che, dal momento che nello studio ALEX (18) non è stata pubblicata alcuna curva riguardante la progressione della malattia libera da metastasi cerebrali (CNS-PFS) di alectinib, per il corrispondente calcolo della permanenza nel relativo stato di salute si è assunto di applicare lo stesso HR utilizzato per la PFS. Un quarto motivo di incertezza riguarda il fatto che, in assenza di specifici dati, si sono assunte per alectinib la stessa tipologia di farmaci concomitanti e la stessa proporzione di pazienti che li ricevono adottata per brigatinib. Un quinto motivo di incertezza è invece riferito all’assunzione che in caso di fallimento della terapia d’elezione il modello contempli la somministrazione di una linea di trattamento successiva (immunoterapia, VEGF-R e chemioterapia) uguale per entrambi i TKI. Tale scelta è stata effettuata sulla base di una expert opinion internazionale per far sì che i risultati del modello fossero principalmente influenzati dalle terapie d’elezione e non anche da differenti successive linee di trattamento. Comunque, al fine di replicare l’attuale pratica clinica italiana (44), è stata condotta un’analisi di scenario nella quale sono state adottate due differenti successive linee di trattamento a fronte del fallimento della terapia d’elezione. Anche in questo caso, brigatinib è risultato dominante (maggiore efficacia e minori costi) rispetto ad alectinib. Infine, in assenza di specifiche indicazioni, l’ultimo aspetto di incertezza riguarda, in alcuni casi, il ricorso ad assunzioni o a proxy per la valorizzazione dei consumi sanitari.
Nell’ottica di limitare o “pesare” tali eventuali incertezze, è stata condotta un’ampia analisi di sensibilità. L’analisi deterministica (OWSA) ha evidenziato come nessuno dei principali parametri del modello sia in grado di modificare significativamente il risultato del caso base, confermando la dominanza di brigatinib rispetto ad alectinib. L’analisi probabilistica, attraverso 1.000 iterazioni casuali del calcolo del risultato, ha stimato una probabilità del 59,4% che brigatinib sia dominante rispetto ad alectinib. Infine, dal momento che il prezzo ex-factory (al netto delle riduzioni temporanee di legge) adottato nel caso base potrebbe non riflettere il reale prezzo di cessione praticato alle strutture sanitarie per brigatinib e alectinib, l’analisi di scenario, valutando tutte le possibili combinazioni delle scontistiche ipotizzate per i due TKI, ha stimato una probabilità del 98,8% che brigatinib, a fronte di un valore soglia di € 40.000 (20), sia dominante o costo-efficace rispetto ad alectinib.
In assenza di analisi simili, non è stato possibile confrontare i presenti risultati con quelli pubblicati in altri studi. Tuttavia, in una recente valutazione economica (46), condotta in ambito nazionale, si afferma che, rispetto a crizotinib, alectinib e brigatinib siano costo-efficaci e che tra i due TKI brigatinib sia caratterizzato dal minor costo per mese in PFS in riferimento sia alla popolazione intention-to-treat sia a quella con metastasi cerebrali (46). Anche se questa analisi non ha condotto un confronto diretto tra i due TKI di seconda generazione, ha almeno confermato il cost-saving associato all’utilizzo di brigatinib.
Conclusioni
Alla luce dei presenti risultati, si ritiene possibile affermare che l’utilizzo di brigatinib costituisca una valida opzione di trattamento alternativa ad alectinib nel trattamento di pazienti adulti con aNSCLC ALK+, precedentemente non trattati con un inibitore di ALK. Con l’obiettivo di catturare i costi e le utilità che differenziano le opzioni di trattamento alternative, si sottolinea come il presente modello di costo-efficacia abbia incluso nella valutazione dei risultati anche l’evoluzione della malattia in riferimento alla manifestazione delle metastasi cerebrali, frequentemente associate al carcinoma del polmone. Complessivamente, a fronte di un incremento dei QALY e di una riduzione dei costi di trattamento, brigatinib risulta dominante rispetto ad alectinib nel trattamento dei pazienti con aNSCLC ALK+ precedentemente non trattati con un inibitore di ALK.
Acknowledgements
Gli autori ringraziano MAPCOM Consulting per il contributo dato alla validazione dell’analisi e alla stesura del manoscritto.
Disclosures
Conflict of interest: FD e PA are employees of Takeda Italia S.p.A, HC and IK are employees of Takeda UK Ltd. RR has no financial interest related to this study to disclose.
Financial support: medical writing and publication of this study was supported by Takeda Italia S.p.A.
Bibliografia
- 1. I numeri del cancro in Italia 2021. Online (Accessed June 2022)
- 2. Associazione Italiana di Oncologia Medica (AIOM) Linee guida neoplasie del polmone. Edizione 2021 aggiornata ad ottobre 2021. Online (Accessed June 2022)
- 3. Howlader N, Noone AM, Krapcho M, et al. SEER Cancer Statistics Review, 1975–2016. Online (Accessed June 2022)
- 4. Barlesi F, Mazieres J, Merlio JP, et al; Biomarkers France contributors. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet. 2016;387(10026):1415-1426. CrossRef PubMed
- 5. Koivunen JP, Mermel C, Zejnullahu K, et al. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res. 2008;14(13):4275-4283. CrossRef PubMed
- 6. Gainor JF, Varghese AM, Ou SH, et al. ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS: an analysis of 1,683 patients with non-small cell lung cancer. Clin Cancer Res. 2013;19(15):4273-4281. CrossRef PubMed
- 7. Reck M, Paz-Ares L. Immunologic checkpoint blockade in lung cancer. Semin Oncol. 2015;42(3):402-417. CrossRef PubMed
- 8. Gridelli C, de Marinis F, Cappuzzo F, et al. Treatment of advanced non-small-cell lung cancer with epidermal growth factor receptor (EGFR) mutation or ALK gene rearrangement: results of an international expert panel meeting of the Italian Association of Thoracic Oncology. Clin Lung Cancer. 2014;15(3):173-181. CrossRef PubMed
- 9. Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol. 2013;8(7):823-859. CrossRef PubMed
- 10. Crizotinib (XALKORI®) Riassunto delle caratteristiche di prodotto. Online (Accessed June 2022)
- 11. Solomon BJ, Mok T, Kim DW, et al; PROFILE 1014 Investigators. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014;371(23):2167-2177. CrossRef PubMed
- 12. Doebele RC, Pilling AB, Aisner DL, et al. Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non-small cell lung cancer. Clin Cancer Res. 2012;18(5):1472-1482. CrossRef PubMed
- 13. Shaw AT, Kim TM, Crinò L, et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2017;18(7):874-886. CrossRef PubMed
- 14. Novello S, Mazières J, Oh IJ, et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase (ALK)-positive non-small-cell lung cancer: results from the phase III ALUR study. Ann Oncol. 2018;29(6):1409-1416. CrossRef PubMed
- 15. Kim DW, Tiseo M, Ahn MJ, et al. Brigatinib in Patients With Crizotinib-Refractory Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer: A Randomized, Multicenter Phase II Trial. J Clin Oncol. 2017;35(22):2490-2498. CrossRef PubMed
- 16. Alectinib (ALECENSA®) Riassunto delle caratteristiche di prodotto. Online (Accessed June 2022)
- 17. Brigatinib (ALUNBRIG®) Riassunto delle caratteristiche di prodotto. Online (Accessed June 2022)
- 18. Peters S, Camidge DR, Shaw AT, et al; ALEX Trial Investigators. Alectinib versus crizotinib in untreated ALK-positive non–small-cell lung cancer. N Engl J Med. 2017;377(9):829-838. CrossRef PubMed
- 19. Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus crizotinib in ALK-positive non–small-cell lung cancer. N Engl J Med. 2018;379(21):2027-2039. CrossRef PubMed
- 20. Fattore G. Proposta di linee guida per la valutazione economica degli interventi sanitari in Italia. Pharmacoeconomics-Ital-Res-Articles. 2009;11:83-93. CrossRef
- 21. Takeda Pharmaceuticals Ltd. Clinical Study Report AP26113-13-301: A Phase 3 Multicenter Open-label Study of Brigatinib (AP26113) versus Crizotinib in Patients with ALK-positive Advanced Lung Cancer. 2020.
- 22. Camidge DR, Dziadziuszko R, Peters S, et al. Updated efficacy and safety data and impact of the EML4-ALK fusion variant on the efficacy of alectinib in untreated ALK-positive advanced Non–Small cell lung cancer in the global phase III ALEX study. J Thorac Oncol. 2019;14(7):1233-1243. CrossRef PubMed
- 23. Mok TSK, Shaw AT, Camidge RD, et al. updated OS and safety data from the randomised, phase III ALEX study of alectinib (ALC) versus crizotinib (CRZ) in untreated advanced ALK+ NSCLC. Ann Oncol. 2019;30(Supp.5):v607. CrossRef
- 24. Peters S, Mok TSK, Gadgeel SM, et al. Updated overall survival (OS) and safety data from the randomized, phase III ALEX study of alectinib (ALC) versus crizotinib (CRZ) in untreated advanced ALK+ NSCLC. J Clin Oncol. 2020;38(Suppl. 15):9518-9518. CrossRef
- 25. National Institute for Health and Care Excellence (NICE). Alectinib for untreated ALK-positive advanced non-small-cell lung cancer [TA536] published 08/08/2018. Online (Accessed June 2022)
- 26. Longworth L, Yang Y, Young T, et al. Use of generic and condition-specific measures of health-related quality of life in NICE decision-making: a systematic review, statistical modelling and survey. Health Technol Assess. 2014;18(9):1-224. CrossRef PubMed
- 27. Arnold DT, Rowen D, Versteegh MM, Morley A, Hooper CE, Maskell NA. Testing mapping algorithms of the cancer-specific EORTC QLQ-C30 onto EQ-5D in malignant mesothelioma. Health Qual Life Outcomes. 2015;13(1):6. CrossRef PubMed
- 28. Ara RW. A., NICE DSU Technical Support Document 12: the use of health state utility values in decision models. School of Health and Related Research, University of Sheffield; 2011.
- 29. Roughley A, Damonte E, Taylor-Stokes G, Rider A, Munk VC. Impact of Brain Metastases on Quality of Life and Estimated Life Expectancy in Patients with Advanced Non-Small Cell Lung Cancer. Value Health. 2014;17(7):A650. CrossRef PubMed
- 30. Blackhall F, Kim DW, Besse B, et al. Patient-reported outcomes and quality of life in PROFILE 1007: a randomized trial of crizotinib compared with chemotherapy in previously treated patients with ALK-positive advanced non-small-cell lung cancer. J Thorac Oncol. 2014;9(11):1625-1633. CrossRef PubMed
- 31. Nafees B, Stafford M, Gavriel S, Bhalla S, Watkins J. Health state utilities for non small cell lung cancer. Health Qual Life Outcomes. 2008;6(1):84. CrossRef PubMed
- 32. Ara R, Brazier JE. Using health state utility values from the general population to approximate baselines in decision analytic models when condition-specific data are not available. Value Health. 2011;14(4):539-545. CrossRef PubMed
- 33. Regime di rimborsabilità e prezzo, a seguito di nuove indicazioni terapeutiche, del medicinale per uso umano «Alunbrig». (Determina n. DG/1200/2020). (20A06597) (GU Serie Generale n.305 del 09-12-2020). Online (Accessed June 2022)
- 34. Classificazione del medicinale per uso umano «Alecensa», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 1124/2018). (18A05072) (GU Serie Generale n.176 del 31-07-2018). Online (Accessed June 2022).
- 35. National Institute for Health and Care Excellence (NICE). Atezolizumab for treating locally advanced or metastatic non-small-cell lung cancer after chemotherapy [TA520] published 05/16/2018. Online (Accessed June 2022)
- 36. Reck M, Kaiser R, Mellemgaard A, et al; LUME-Lung 1 Study Group. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial. Lancet Oncol. 2014;15(2):143-155. CrossRef PubMed
- 37. National Institute for Health and Care Excellence (NICE). Nintedanib for previously treated locally advanced, metastatic, or locally recurrent non-small-cell lung cancer [TA347] published 07/22/2015. Online (Accessed June 2022)
- 38. Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet. 2017;389(10072):917-929. CrossRef PubMed
- 39. National Institute for Health and Care Excellence (NICE). Brigatinib for treating ALK-positive advanced non-small-cell lung cancer after crizotinib [TA571] published 03/20/2019. Online (Accessed June 2022)
- 40. Nomenclatore Tariffario – Regione Lombardia. Online (Accessed June 2022)
- 41. Ravasio R, Tiseo M, Pradelli L et al. Cost-effectiveness analysis of alectinib versus crizotinib in first-line treatment of anaplastic lymphoma kinase-positive advanced non-small cell lung cancer. Glob Reg Health Technol Assess. 2019;6:1-11. CrossRef
- 42. Favaretto A, Grossi F, Morabito A, Ravasio R. Il costo degli eventi avversi associati ad afatinib, erlotinib e gefitinib nel trattamento del tumore del polmone non a piccole cellule con mutazione EGFR. Glob Reg Health Technol Assess. 2017;4(1):e187-e196. CrossRef
- 43. Remunerazione delle prestazioni di assistenza ospedaliera per acuti, assistenza ospedaliera di riabilitazione e di lungodegenza post acuzie e di assistenza specialistica ambulatoriale. Supplemento ordinario n.8 alla Gazzetta Ufficiale n. 23 del 28 gennaio 2013, Serie generale. Online (Accessed June 2022)
- 44. Associazione Italiana di Oncologia Medica (AIOM). Linee guida Neoplasie del Polmone. Edizione 2021, aggiornata a ottobre 2021. Online (Accessed June 2022)
- 45. Lorlatinib (LORVIQUA®) Riassunto delle caratteristiche di prodotto. Online (Accessed June 2022)
- 46. Giuliani J. Brigatinib is a cost-effective treatment in first-line anaplastic lymphoma kinase mutation-positive (ALK + ) advanced non-small cell lung cancer (NSCLC) with brain metastases. J Oncol Pharm Pract. 2022 Apr;28(3):691-694. CrossRef PubMed