 |
AboutOpen | 2022; 9: 66-69 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2435 REVIEW |
 |
Gestione dell’emorragia nel paziente cardiochirurgico
Management of bleeding in cardiac surgery patients
Perioperative bleeding is a common occurrence in patients who underwent cardiac surgery, however, to this day its categorization is still missing. A universal multistaged definition was created based on easily measured clinical endpoints, such as total blood loss from chest tubes within 12 hours, allogeneic blood products transfused, surgical reexploration including cardiac tamponade, delayed sternal closure, and the need for salvage treatment. In bleeding prediction point-of-care tests have a limited positive predictive value and a high negative predictive value, meaning they should not be used as standard practice to evaluate the bleeding risk. Instead, if in the clinical picture there are clear evidences of hemorrhage, tests and algorithms are useful in directing treatment. Viscoelastic testing allows for accurate and dynamic coagulation assessment; stepwise escalating algorithms have been developed based on their use. As a first step residual heparin is measured and, if necessary, protamine is administered. As a second step platelet count and function are assessed and if needed are treated with desmopressin and platelet concentrate transfusion. Thirdly, fibrinogen levels are determined and integrated as needed. Then, soluble coagulation factors are measured and integrated with either 4-factor PCC or rFVIIa. Next hyperfibrinolysis is evaluated and if needed treated with tranexamic acid and fibrinogen concentrate. As the sixth, and last, step surgical complications are considered as the cause of the bleeding and exploratory surgery is performed. In conclusion, although progresses have been made in characterization and management of perioperative bleeding many aspects are still unclear and require further study.
Keywords: Algorithms, Cardiac surgery, Hemorrhage, Perioperative bleeding, Viscoelastic testing
Received: June 1, 2022
Accepted: June 8, 2022
Published online: July 31, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il sanguinamento eccessivo dopo un intervento di cardiochirurgia può comportare un aumento della morbilità e della mortalità nei pazienti. Il sanguinamento perioperatorio è comune tra i pazienti sottoposti a chirurgia cardiaca, tuttavia la sua definizione è variabile e manca di standardizzazione. Una definizione universale nella cardiochirurgia dell’adulto è stata proposta nel tentativo di descrivere e quantificare con precisione il sanguinamento e per facilitare le future indagini su questa difficile problematica clinica (1).
È stata elaborata così una definizione multistadio sulla base di endpoint clinici facilmente misurabili, tra cui:
- la perdita totale di sangue dai tubi toracici entro 12 ore;
- la trasfusione di emoderivati allogenici;
- la riesplorazione chirurgica, compreso il tamponamento cardiaco;
- la chiusura sternale ritardata e la necessità di un trattamento di salvataggio.
Il prerequisito per attivare un protocollo di intervento nel paziente cardiochirurgico è che ci sia evidenza di sanguinamento. I test al point-of-care (POCT) di coagulazione, infatti, hanno potere predittivo positivo (PPV) assai ridotto per la previsione di sanguinamento (<10%, vale a dire su 10 malati con test alterati, solo un paziente sanguinerà). Pertanto, l’applicazione di routine di questi test e dei conseguenti algoritmi dovrebbe essere evitata. Al contrario, test e algoritmi si dimostrano molto utili nei casi in cui ci siano già evidenze di sanguinamento o fattori predisponenti al sanguinamento come per esempio quando si hanno: i) pazienti ad altissimo rischio di sanguinamento per le loro caratteristiche (p. es., farmaci in circolo, conta piastrinica bassa, coagulopatia nota) o per la procedura chirurgica (p. es., dissezione aortica, chirurgia molto complessa); ii) pazienti con evidenza di sanguinamento microvascolare in sala operatoria; iii) pazienti con evidenza di eccessiva perdita di sangue con drenaggio toracico in terapia intensiva.
Il potere predittivo negativo (NPV) dei POCT di coagulazione, al contrario, è molto alto (>95%, vale a dire che, su 100 malati con test normali, 95 non andranno incontro a emorragia e coloro che sanguineranno non avranno deficit dei fattori della coagulazione).
Dovrebbe essere seguito un approccio di esclusione (step-by-step ruling out approach) per risalire alle cause emorragiche e in questo gli algoritmi verticali si mostrano essere molto più utili di quelli orizzontali. Negli algoritmi verticali si escludono gli elementi uno per uno, fino a isolare la causa del problema.
L’ordine di approccio alle diverse cause di sanguinamento seguito negli algoritmi è importante e dipende da: i) semplicità dell’approccio terapeutico; ii) probabilità delle diverse cause (p. es., disfunzione piastrinica, che è più probabile rispetto a bassi fattori di coagulazione, i quali vanno considerati successivamente); iii) fisiopatologia della coagulazione.
A oggi non sono ancora disponibili studi comparativi tra i vari algoritmi esistenti.
Algoritmo basato su test viscoelastici
I test viscoelastici forniscono una valutazione dinamica della coagulazione, esplorando il tempo per la formazione del coagulo e la forza del coagulo (2).
Step 1
Si valuta l’eparina residua. Se si esclude questo problema si passa allo step 2, altrimenti si procede con la somministrazione di protamina. Si sconsiglia di valutare l’ACT (Tempo di Coagulazione Attivato) basale perché si tratta di un test di coagulazione sensibile all’eparina. L’ACT aumenta in risposta a moltissimi fenomeni che non è detto portino a emorragia.
Step 2
Si valuta la conta/funzione piastrinica. Se si escludono problemi relativi a questo aspetto, si passa allo step 3, altrimenti si eseguono una trasfusione di concentrato piastrinico o un’infusione di desmopressina.
Per guidare la strategia di trasfusione vengono utilizzati i valori di ROTEM® e TEG®.
I valori di riferimento ROTEM® per intervenire sono: FIBTEM A10 >10 mm ed EXTEM A10 <40 mm; quelli per TEG sono: MA (maximum amplitude) <40 mm e FF (functional fibrinogen) <8 mm.
Esistono inoltre algoritmi di trasfusione mirata intraoperatoria di cardiochirurgia non diretti da TEG®/ROTEM®, come quello formulato dalla Società di Anestesiologia Cardiovascolare (3).
Sebbene le Linee Guida esistenti suggeriscano l’utilizzo di trasfusioni di desmopressina e/o concentrato piastrinico in caso di disfunzione piastrinica in pazienti emorragici, non esistono in letteratura valori di cut-off per l’attività piastrinica. La Società Europea di Anestesiologia consiglia di eseguire una trasfusione di concentrato piastrinico in pazienti sanguinanti con una conta piastrinica inferiore a 50 * 109/L o in terapia con farmaci antipiastrinici.
Lo studio PLATFORM mira a identificare la relazione tra la funzione piastrinica dopo bypass cardiopolmonare (CPB) e il sanguinamento grave, trovando adeguati valori predittivi della funzione piastrinica per il sanguinamento grave. Si tratta di uno studio prospettico di coorte su 494 pazienti adulti sottoposti a chirurgia cardiaca con bypass cardiopolmonare. La raccolta dei dati è durata un anno (4).
I pazienti hanno ricevuto test di funzionalità piastrinica (aggregometria a elettrodi multipli: ADPtest e TRAPtest) prima dell’intervento chirurgico e dopo bypass cardiopolmonare e test di coagulazione di routine prima dell’intervento e all’arrivo in terapia intensiva. È emerso come ADPtest e TRAPtest fossero significativamente (P = 0,001) associati a sanguinamento grave, così come il tempo di tromboplastina parziale attivato (aPTT), il rapporto normalizzato internazionale (INR) e la concentrazione di fibrinogeno (4).
Il miglior PPV per il sanguinamento grave è stato trovato con un test ADP ≤ 8 U (PPV: 41,7%; NPV: 89,6%). Il NPV e il PPV di diversi valori di cut-off dell’ADPtest sono mostrati nella Tabella I. Il rischio relativo di sviluppare sanguinamento severo quando l’ADPtest post-CPB è ≤8 U è 6,1 (intervallo di confidenza 95% 2,3-16,1, P = 0,001). Il NPV più alto è stato trovato a un ADPtest ≥18 U (PPV: 23,2%; NPV: 94%). Il rischio relativo di sviluppare un sanguinamento grave quando il test ADP post-CPB è ≥18 dopo la correzione per l’aPTT è pari a 0,24 (intervallo di confidenza 95% 0,12-0,48, P = 0,001) (4).
| ADPtest (U) | Valore predittivo negativo | Valore predittivo positivo |
|---|---|---|
| 4 | 88,2% | 27,7% |
| 6 | 88,4% | 33,8% |
| 8 | 89,6% | 41,7% |
| 10 | 90,4% | 36,0% |
| 12 | 92,2% | 34,7% |
| 14 | 92,8% | 30,6% |
| 16 | 93,8% | 27,9% |
| 18 | 94,0% | 23,2% |
| 20 | 93,9% | 20,7% |
ADP: adenosina difosfato. In bold, italic, il miglior compromesso tra valore predittivo negativo e valore predittivo positivo.
Step 3
Si valutano i livelli di fibrinogeno. Se i valori sono normali si passa allo step 4, altrimenti si integra con fibrinogeno.
Il deficit di fibrinogeno e di fattori della coagulazione sono possibili determinanti del sanguinamento. È stato osservato che il concentrato di fibrinogeno limita il sanguinamento postoperatorio dopo un complesso intervento chirurgico al cuore, portando a una significativa riduzione delle trasfusioni di emoderivati allogenici. L’integrazione di fibrinogeno evita la necessità di plasma fresco congelato (FFP) e riduce la necessità di qualsiasi tipo di trasfusione. Sono stati analizzati 116 pazienti che rispettavano i seguenti criteri: età ≥18 anni, intervento cardiochirurgico complesso di CPB pianificato con durata prevista di 90 minuti o più e presenza di almeno uno dei seguenti fattori di rischio: età >65 anni, chirurgia non elettiva, livello di creatinina sierica >1,36 mg/dL. I pazienti sono stati assegnati in modo casuale al braccio con trattamento o con placebo.
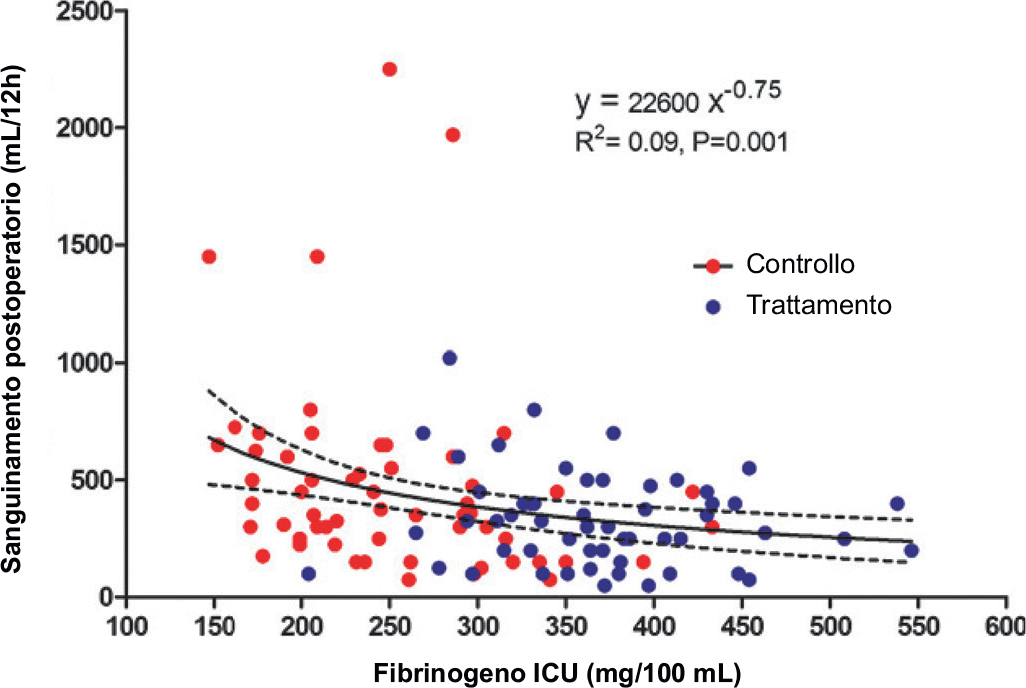
Fig. 1 - Livelli di fibrinogeno in correlazione con il sanguinamento postoperatorio. ICU: intensive care unit. Adattata da (5) con il permesso dell’Editore.
Il grafico nella Figura 1 mostra un’associazione negativa significativa (P = 0,001) tra i valori di fibrinogeno all’arrivo in terapia intensiva e il sanguinamento postoperatorio, tra i pazienti trattati con fibrinogeno concentrato o con soluzione salina (placebo) (5).
Questi dati mostrano che, nel contesto della cardiochirurgia complessa, le trasfusioni di FFP potrebbero essere completamente evitate utilizzando una strategia basata su concentrati purificati di fattori della coagulazione e che è stato necessario il solo fibrinogeno per controllare il sanguinamento postoperatorio, senza che nessun paziente richiedesse complessi protrombinici completi (PCC). Questo approccio ha comportato una necessità significativamente inferiore di trasfusione di globuli rossi, una minore quantità di emoderivati allogenici trasfusi e un minor sanguinamento postoperatorio (5).
Per quanto la supplementazione di fibrinogeno sia stata proposta sia per prevenire che per trattare il sanguinamento postoperatorio in cardiochirurgia, i valori trigger e target della concentrazione ottimale di fibrinogeno e la dose di concentrato di fibrinogeno richiesta rimangono incerti. Lo studio Zero-Plasma Trial ha valutato i valori target di fibrinogeno e la corrispondente dose di concentrato di fibrinogeno per l’integrazione. Da questo studio è emerso che i valori di cut-off sono per il fibrinogeno 285 mg/100 mL e per il valore di FIBTEM 13,5 mm (6).
Questi numeri forniscono i valori target, con NPV del 100%. Per i valori trigger invece sono necessari i PPV, per i quali bisogna analizzare coorti molto numerose. In uno studio retrospettivo del 2016 sono stati esaminati i dati raccolti in modo prospettico su 2.800 pazienti adulti sottoposti a operazioni cardiache. L’analisi statistica dei dati ha portato all’identificazione di un livello di fibrinogeno di 115 mg/dL come un ragionevole valore trigger con un PPV del 50%. Secondo questo studio, sulla base di un NPV del 98% nella popolazione complessiva, si potrebbero identificare valori di concentrazione del fibrinogeno target di 275-300 mg/dL (Tab. II) (7).
| Livelli di fibrinogeno | Tutti i casi (N = 2.800) | Escludendo i pazienti con altri fattori isolati (N = 2.051) | ||||
|---|---|---|---|---|---|---|
| PPV | NPV | P | PPV | NPV | P | |
| 75 mg/dL | 100% | 95,4% | 0,002 | 100% | 95,0% | 0,003 |
| 100 mg/dL | 67% | 95,4% | 0,006 | 67% | 95,0% | 0,007 |
| 115 mg/dL | 50% | 95,4% | 0,012 | 50% | 95,0% | 0,014 |
| 125 mg/dL | 20% | 95,4% | 0,076 | 20% | 95,0% | 0,088 |
| 150 mg/dL | 15% | 95,6% | 0,002 | 15% | 95,2% | 0,004 |
| 175 mg/dL | 10% | 95,9% | 0,001 | 10% | 95,9% | 0,001 |
| 200 mg/dL | 9,1% | 96,4% | 0,001 | 9,1% | 96,4% | 0,001 |
| 225 mg/dL | 7,7% | 96,9% | 0,001 | 7,7% | 97,0% | 0,001 |
| 250 mg/dL | 6,4% | 97,0% | 0,001 | 6,9% | 97,3% | 0,001 |
| 275 mg/dL | 5,8% | 97,2% | 0,001 | 6,4% | 97,5% | 0,001 |
| 300 mg/dL | 5,6% | 98,0% | 0,001 | 6,2% | 98,5% | 0,001 |
Step 4
Si valutano i livelli dei fattori solubili della coagulazione. Se questi ultimi sono normali, si passa allo step 5, altrimenti si integra con PCC a 4 fattori e, nei casi più gravi, con Fattore VIIa ricombinante (rFVIIa).
I membri del sottocomitato per le trasfusioni e l’emostasi dell’Associazione europea di anestesiologia cardiotoracica hanno eseguito una revisione sistematica della letteratura sul PCC a quattro fattori (8).
Sono stati valutati il dosaggio, l’efficacia, la sicurezza dei farmaci e le strategie di monitoraggio in diversi scenari. Mentre vi sono prove dell’efficacia del PCC a quattro fattori per una varietà di scenari di sanguinamento, mancano chiaramente dati convincenti sulla sua sicurezza. Nel paziente con coagulopatia con sanguinamento massivo, si raccomanda la somministrazione di un bolo iniziale di 25 UI.kg–1. Questo vale per: l’inversione acuta della terapia con antagonisti della vitamina K, la rianimazione emostatica, in particolare nei traumi, e l’inversione degli anticoagulanti orali diretti quando non è disponibile un antidoto specifico. In pazienti ad alto rischio di complicanze tromboemboliche, per esempio nella cardiochirurgia, deve essere presa in considerazione la somministrazione di un bolo iniziale di mezza dose (12.5 UI.kg–1). Un secondo bolo può essere indicato se la coagulopatia e l’emorragia microvascolare persistono e se sono ampiamente scartate altre cause di sanguinamento.
Step 5
Si valuta l’iperfibrinolisi. Se si esclude si passa allo step 6, altrimenti si somministrano acido tranexamico e fibrinogeno concentrato.
L’acido tranexamico previene numerosi quadri di sanguinamento severo e va somministrato insieme al fibrinogeno che viene consumato a causa della fibrinolisi. La diagnosi di iperfibrinolisi è complessa poiché i test a disposizione sono assai poco sensibili.
Step 6
Si valutano le complicanze chirurgiche. Se vengono escluse si procede a investigare altre cause, altrimenti si agisce sull’emostasi e sulla riesplorazione.
Conclusioni
Concludendo, rimangono molti aspetti ancora poco investigati, coinvolti nel sanguinamento severo perioperatorio, che richiederanno ulteriori analisi nel prossimo futuro.
Acknowledgements
We would like to thank Antonella Managò and Francesca La Rosa who, on behalf of Health Publishing & Services Srl, provided publishing support and journal styling services.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: CSL Behring funded the publishing support and journal styling services. CSL Behring had no role in the conduct of the research, in the preparation of the article, in the study design, in the collection, analysis and interpretation of data, in the writing of the report, and in the article for publication.
Bibliografia
- 1. Dyke C, Aronson S, Dietrich W, et al. Universal definition of perioperative bleeding in adult cardiac surgery. J Thorac Cardiovasc Surg. 2014;147(5):1458-1463.e1. CrossRef PubMed
- 2. Ranucci M, Baryshnikova E. Sensitivity of Viscoelastic Tests to Platelet Function. J Clin Med. 2020;9(1):189. CrossRef PubMed
- 3. Raphael J, Mazer CD, Subramani S, et al. Society of Cardiovascular Anesthesiologists Clinical Practice Improvement Advisory for Management of Perioperative Bleeding and Hemostasis in Cardiac Surgery Patients. Anesth Analg. 2019;129(5):1209-1221. CrossRef PubMed
- 4. Ranucci M, Pistuddi V, Di Dedda U, Menicanti L, De Vincentiis C, Baryshnikova E. Platelet function after cardiac surgery and its association with severe postoperative bleeding: the PLATFORM study. Platelets. 2019;30(7):908-914. CrossRef PubMed
- 5. Ranucci M, Baryshnikova E, Crapelli GB, Rahe-Meyer N, Menicanti L, Frigiola A; Surgical Clinical Outcome REsearch (SCORE) Group. Randomized, double-blinded, placebo-controlled trial of fibrinogen concentrate supplementation after complex cardiac surgery. J Am Heart Assoc. 2015;4(6):e002066. CrossRef PubMed
- 6. Ranucci M, Baryshnikova E. Fibrinogen supplementation after cardiac surgery: insights from the Zero-Plasma trial (ZEPLAST). Br J Anaesth. 2016;116(5):618-623. CrossRef PubMed
- 7. Ranucci M, Pistuddi V, Baryshnikova E, Colella D, Bianchi P. Fibrinogen Levels After Cardiac Surgical Procedures: Association With Postoperative Bleeding, Trigger Values, and Target Values. Ann Thorac Surg. 2016;102(1):78-85. CrossRef PubMed
- 8. Erdoes G, Koster A, Ortmann E, et al. A European consensus statement on the use of four-factor prothrombin complex concentrate for cardiac and non-cardiac surgical patients. Anaesthesia. 2021;76(3):381-392. CrossRef PubMed