 |
AboutOpen | 2022; 9: 47-51 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2433 REVIEW |
 |
Aspetti fisiopatologici, test coagulativi e test viscoelastici (POCT) nella gestione dell’emorragia grave
Classical and Point-of-Care tests in severe hemorrhage management
Hemorrhage is defined as an acute loss of blood from the cardiovascular system. The hemostatic cascade (comprising the vasculature, coagulation factors, the fibrinolytic and the platelet systems) is the physiological mechanism meant to control this event. Coagulation assessment is fundamental in the monitoring and treatment of hemorrhage. Over the years several classical laboratory-based diagnostic tests have been developed for the management of severe hemorrhage, however their main downside is the time necessary to obtain a result, which can be significant (between 40 minutes and an hour) and therefore not be entirely representative of a fast-changing clinical picture. Based on this need of faster results, Point-of-Care tests have been developed and implemented, since they can represent a diagnostic tool that allows a reduction of the time interval before appropriate intervention. They rely on instruments able to determine blood clot formation in whole blood samples upon activation of coagulation with specific reagents, and activation of platelets upon exposure to different drugs. The present review proposes an overview of both the available Point-of-Care tests such as Thrombelastography, for the assessment of blood clot formation, Impedance Aggregometry, for the function of platelets, and those still under improvement or missing entirely.
Keywords: Blood Coagulation Tests, Hemorrhage, Hemostasis, Platelet Function Tests, Point-of-Care Systems, Thrombelastography
Received: June 1, 2022
Accepted: June 9, 2022
Published online: July 31, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’attivazione della cascata coagulativa può avvenire attraverso una via estrinseca oppure una via intrinseca. La prima interviene in particolare quando si presentano, per esempio, danni dei tessuti che determinano una liberazione di fattore tissutale (TF) che è in grado di legare il fattore VII (FVII) della coagulazione, formando un complesso che attiverà la cascata coagulativa trasformando il fattore X (FX) in FX attivato (FXa). Il FXa, in seguito, attiva la protrombina in trombina, la quale trasforma il fibrinogeno in fibrina che, dopo polimerizzazione spontanea e azione del FXIIIa, porterà alla formazione del coagulo stabile. Si tratta di una via veloce, cosiddetta “d’emergenza”; in realtà, in vivo, il complesso TF-FVIIa attiva preferenzialmente il fattore IX (FIX) in fattore IX attivato (FIXa) che a sua volta trasformerà il FX in FXa. Si tratta, per quanto riguarda quest’ultima, della via preferenziale di attivazione della coagulazione che spiega anche le ragioni del sanguinamento nel paziente emofilico con carenza di fattore VIII (co-fattore nell’attivazione del FX da parte del FIXa).
La via intrinseca invece può attivarsi per esempio per effetto di un danno endoteliale quale si può avere in una condizione di infiammazione. Viene esposto il collagene subendoteliale che è in grado di attivare la via intrinseca, molto più “lunga” rispetto a quella estrinseca, che giunge però anch’essa all’attivazione della via comune, ovvero del FX in FXa.
Vi è una serie di sistemi di inibizione fisiologica della coagulazione tra cui ben noto è quello dell’antitrombina. Si tratta di una proteina che lega, bloccandoli, i fattori II, X e IX attivati, ma anche altri fattori attivati. È presente anche il sistema della proteina C/proteina S in cui la proteina C attivata, attraverso il suo co-fattore proteina S, inattiva il fattore VIIIa e Va della coagulazione. Questi ultimi non hanno un’attività enzimatica bensì fungono da co-fattori ovvero da acceleratori della cascata coagulativa; in caso di una loro carenza, le reazioni enzimatiche della cascata coagulativa si rallentano favorendo una condizione pro-emorragica (emofilia A e paraemofilia).
Quando si esegue un PT (tempo di protrombina), si attiva la via estrinseca e si valuta il tempo di formazione del coagulo; viceversa, un PTT (tempo di tromboplastina parziale) si ottiene attivando la via intrinseca con sostanze inerti quale, per esempio, la silice micronizzata. In questi test globali, in realtà, si utilizza del plasma derivante dalla centrifugazione del sangue e quindi ci si pone in una condizione sperimentale ben diversa da quanto avviene in vivo, dove la coagulazione si verifica in presenza di tutte le componenti ematiche e dell’endotelio.
Le piastrine rappresentano delle superfici ottimali sulle quali avvengono i processi coagulativi. In caso di una loro mancanza, la cascata enzimatica che porta alla formazione del coagulo e dell’emostasi non può pertanto funzionare in modo ottimale.
Gli endoteli sono le superfici dove fondamentalmente risiedono i meccanismi di inibizione fisiologica della coagulazione. Quando per varie ragioni gli endoteli sono “perturbati”, l’antitrombina può perdere la sua capacità inibitoria per alterazioni dei glicosamminoglicani (le nostre eparine endogene) presenti nella loro superficie.
Il sistema fibrinolitico entra in gioco costantemente quando si forma della fibrina, in particolare quando la bilancia coagulativa non è compensata in modo adeguato e si verifica una spinta eccessiva verso la produzione di fibrina. L’incremento del D-dimero è frutto dell’attività del sistema fibrinolitico che degrada la fibrina formata e stabilizzata ad opera del FXIIIa. Il test del D-Dimero è pertanto aspecifico nella diagnostica del tromboembolismo venoso perché, se presente, non significa necessariamente sia presente un trombo all’interno di un vaso. È invece espressione di presenza di fibrina formata e stabilizzata, vale a dire di attivazione del sistema coagulativo con fibrino-formazione che può anche, ma non necessariamente, condurre alla formazione di un trombo e all’occlusione di un vaso. Cosa che, nella maggior parte dei casi, di fatto non si verifica.
La trombina possiede svariate altre attività tra cui una serie di funzioni cellulari come, per esempio, la stimolazione della proliferazione dei fibroblasti, la regolazione della crescita dei neuroni, la mitogenesi delle cellule del muscolo liscio e molte altre. Quando la trombina viene inibita con un anticoagulante, si verificano di fatto un’interferenza o un blocco di una serie di azioni che vanno quindi al di là della semplice inibizione della cascata coagulativa.
Un concetto molto importante è sicuramente quello del livello minimo dei fattori della coagulazione per mantenere una normale emostasi in condizioni fisiologiche (Tab. I). I valori riportati si riferiscono alla soglia entro cui può ancora avvenire un’emostasi normale, vale a dire in assenza di uno dei fattori scatenanti (p. es., intervento chirurgico), i pazienti possono rimanere asintomatici benché i livelli di quel determinato fattore, anche se ridotti, siano superiori a un determinato valore.
Test laboratoristici classici e Point-of-Care
Quando si deve affrontare un’emorragia severa, si presentano due problematiche che riguardano la coagulazione. La prima è legata alla coagulopatia da perdita in quanto l’emorragia determina di per sé la perdita di fattori e inibitori della coagulazione. Il secondo problema consiste in una coagulopatia diluizionale, generata dalla somministrazione di liquidi o emoderivati che porta a una riduzione del numero di piastrine e dei livelli di fibrinogeno. Possono subentrare poi lo shock, l’acidosi e l’ipotermia. Si genera un circolo vizioso con effetti negativi sulla coagulazione che si oppone alla risoluzione dell’emorragia stessa.
| Fattore | Concentrazioni plasmatiche necessarie per una normale emostasi |
|---|---|
| I | 100 mg/dL |
| II | 30-40% |
| V | 30-40% |
| VII | 30-40% |
| VIII | 30-40% |
| IX | 30-40% |
| X | 30-40% |
| XI | 20% |
| XII | Non necessario (?) |
| XIII | 1% |
| PK | Non necessario (?) |
| HMWK | Non necessario (?) |
Un altro elemento importante è rappresentato dall’iperfibrinolisi che risulta associata a una mortalità molto elevata in corso di emorragia.
Il pannello classico dei test che si è chiamati a eseguire, nel caso in cui un paziente presenti un’emorragia severa, è costituito da: conta piastrinica, PT, aPTT, TT (tempo di trombina), ACT (tempo di coagulazione attivato), fibrinogeno, FDP (prodotti di degradazione del fibrinogeno)/D-dimero, AT (antitrombina).
Per ottenere i risultati di questi test è tuttavia necessario attendere dai 40 minuti a più di un’ora di tempo, in base ai diversi contesti organizzativi dei laboratori di urgenza. Pertanto, quando i risultati di questi test divengono disponibili, sono poco rappresentativi del reale assetto coagulativo di un determinato paziente in corso di emorragia severa, in quanto nel frattempo si è intervenuti con l’infusione di liquidi e di emoderivati e altri farmaci.
Da qui, la necessità di utilizzare dei test non convenzionali ma Point-of-Care (1-3), che possano fornire una rapida risposta utile nelle decisioni terapeutiche per quel paziente in corso di emorragia severa. Queste apparecchiature valutano la formazione del coagulo su del sangue intero, dopo attivazione della coagulazione con reagenti specifici. All’interno delle cuvette contenenti sangue intero, un pistoncino ruota avanti e indietro di pochi gradi. Una volta attivata la coagulazione nel campione di sangue, si formerà progressivamente un coagulo che tenderà a ostacolare il movimento del pistoncino. Si genererà un segnale elettrico di “impedenza” che verrà rappresentato dal tromboelastogramma. Molto semplicemente, tanto più si genera fibrina e si stabilizza, tanto più il coagulo diviene consistente, tanto più il pistoncino risulterà impedito nel suo movimento e il tracciato tromboelastografico aumenterà di ampiezza. I vantaggi di tale metodica POC possono essere così riassunti: i risultati sono ottenuti su sangue intero, i test sono eseguiti direttamente al letto del paziente e le risposte sono disponibili in pochi minuti. Inoltre, i test viscoelastici sono utili perché le apparecchiature, la cui gestione è molto semplice, sono oggi disponibili anche in versione completamente automatizzata. Il problema che si può riscontrare può essere, semmai, di tipo interpretativo.
Nella fase iniziale, quando il pistoncino è libero di muoversi perché il sangue non è coagulato, si avrà una linea piatta del tracciato. Man mano che si forma il coagulo, si verificherà un aumento dell’ampiezza del tracciato tromboelastografico. La massima ampiezza sarà dunque espressione dell’entità e della qualità del coagulo.
La tromboelastografia consente di ottenere informazioni anche sulla presenza di iperfibrinolisi. Se il coagulo, infatti, viene aggredito dal sistema fibrinolitico, il pistoncino del sistema sarà nuovamente libero nel suo movimento per cui il tracciato diminuirà progressivamente in ampiezza fino anche a tornare, come nelle fasi iniziali, a una linea piatta.
In sintesi, la fase iniziale della formazione del coagulo (linea piatta) può essere immaginata come la fase iniziale di attivazione della coagulazione con trombinogenerazione. Quando la trombina agendo sul fibrinogeno lo trasforma in fibrina e si genera il coagulo, l’ampiezza del tromboelastogramma via via aumenta. Il tromboelastogramma descrive quindi la trombinogenerazione, la formazione della fibrina e la sua polimerizzazione con formazione del coagulo su sangue intero e, infine, l’effetto fibrinolitico sul coagulo stesso.
Tra i diversi test disponibili, può essere attivata la via estrinseca utilizzando un reagente che contiene fattore tissutale come nei test del PT. Possono essere utilizzati reagenti che attivano la via intrinseca come si fa per esempio nel PTT. Se si è interessati a valutare la formazione del coagulo senza il contributo delle piastrine, si può procedere attivando la via estrinseca e bloccando l’attivazione piastrinica, cosa che permette una valutazione più precisa della formazione del coagulo dipendente dai livelli di fibrinogeno e di polimerizzazione della fibrina. Se è presente un’alterazione del tracciato tromboelastografico dovuto all’iperfibrinolisi, l’aggiunta di un antifibrinolitico al campione in esame permette di correggere gli effetti di quest’ultima sulla lisi del coagulo, rispristinando un tracciato normale. Infine, l’utilizzo dell’enzima eparinasi in grado di neutralizzare l’effetto dell’eparina permette di studiare campioni ematici di pazienti in corso di trattamento con questo anticoagulante (per esempio, pazienti cardiochirurgici in circolazione extracorporea).
Fondamentalmente i test coagulativi classici non aiutano nella scelta della terapia in fase acuta nei pazienti con emorragia grave. L’utilizzo, invece, delle metodiche POC permette di scegliere prontamente il trattamento (con emoderivati o altri farmaci) più appropriato per un certo paziente con emorragia severa in ogni determinato momento.
Nella Figura 1, è presentato un esempio di tracciato tromboelastografico in un caso di trauma pelvico con rottura dell’aorta. Il coagulo è poco consistente per la mancanza di fibrinogeno (in FIBTEM c’è una linea piatta). Si può osservare un’iperfibrinolisi sia nella fase finale sia in quella iniziale nella formazione del coagulo. Il coagulo pertanto viene degradato velocemente ed è necessario intervenire sia bloccando la fibrinolisi (acido tranexamico) che ripristinando i livelli di fibrinogeno.
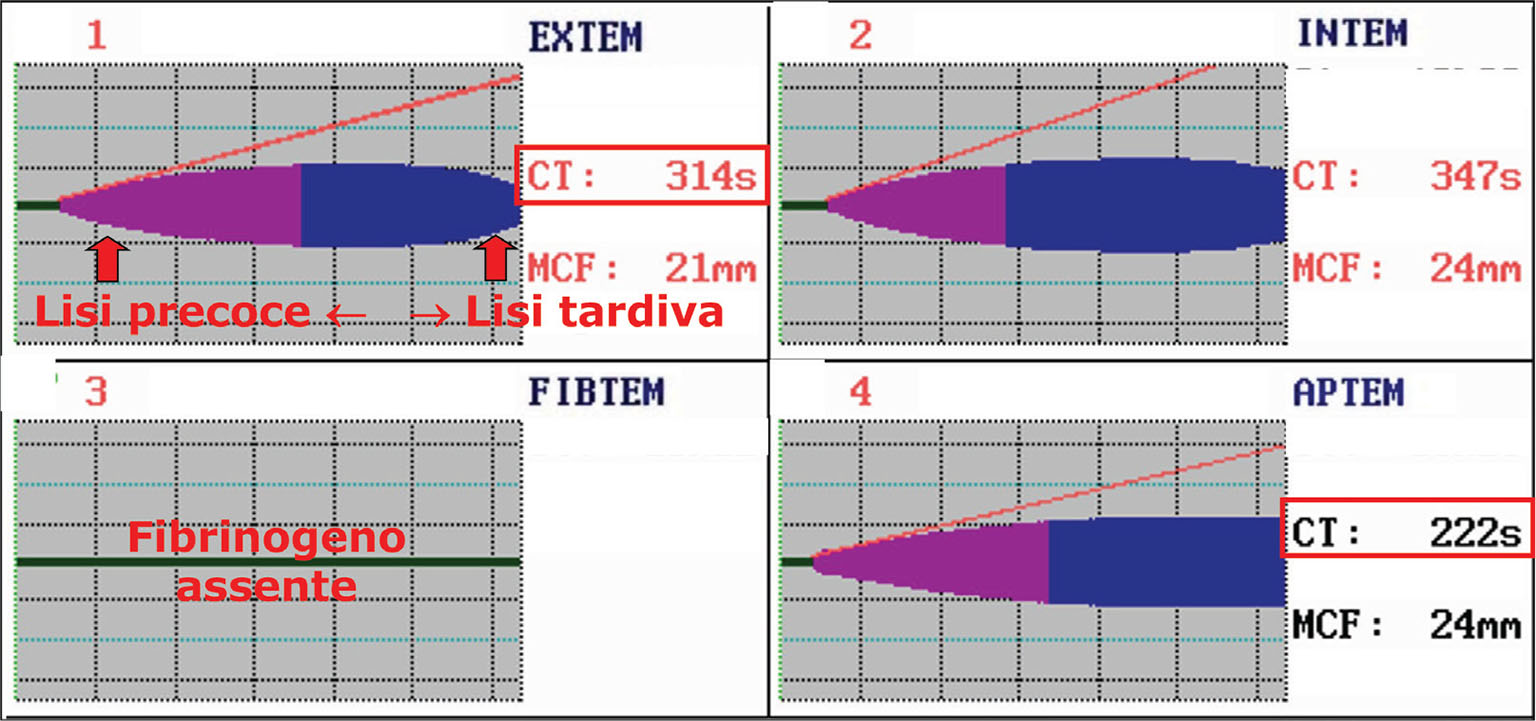
Fig. 1 - Tracciati ROTEM® di un caso di trauma pelvico con rottura dell’aorta. CT: clotting time; MCF: maximum clot firmness. Per gentile concessione del Professor Simioni.
In un altro esempio (Fig. 2), si può invece osservare un caso di tromboelastogramma eseguito in fase finale di bypass aorto-coronarico. Si potrebbe pensare di intervenire con acido tranexamico per la condizione di iperfibrinolisi evidente nel tracciato. È fondamentale in questi casi, però, chiedersi se il paziente stia sanguinando o meno. Il trattamento non deve essere mirato alla correzione del test tromboelastografico ma alla cura del paziente. Nel caso specifico, il paziente non aveva alcun sanguinamento in atto e il tracciato torna normale spontaneamente senza alcun intervento terapeutico dopo circa 30 minuti dal termine del bypass.
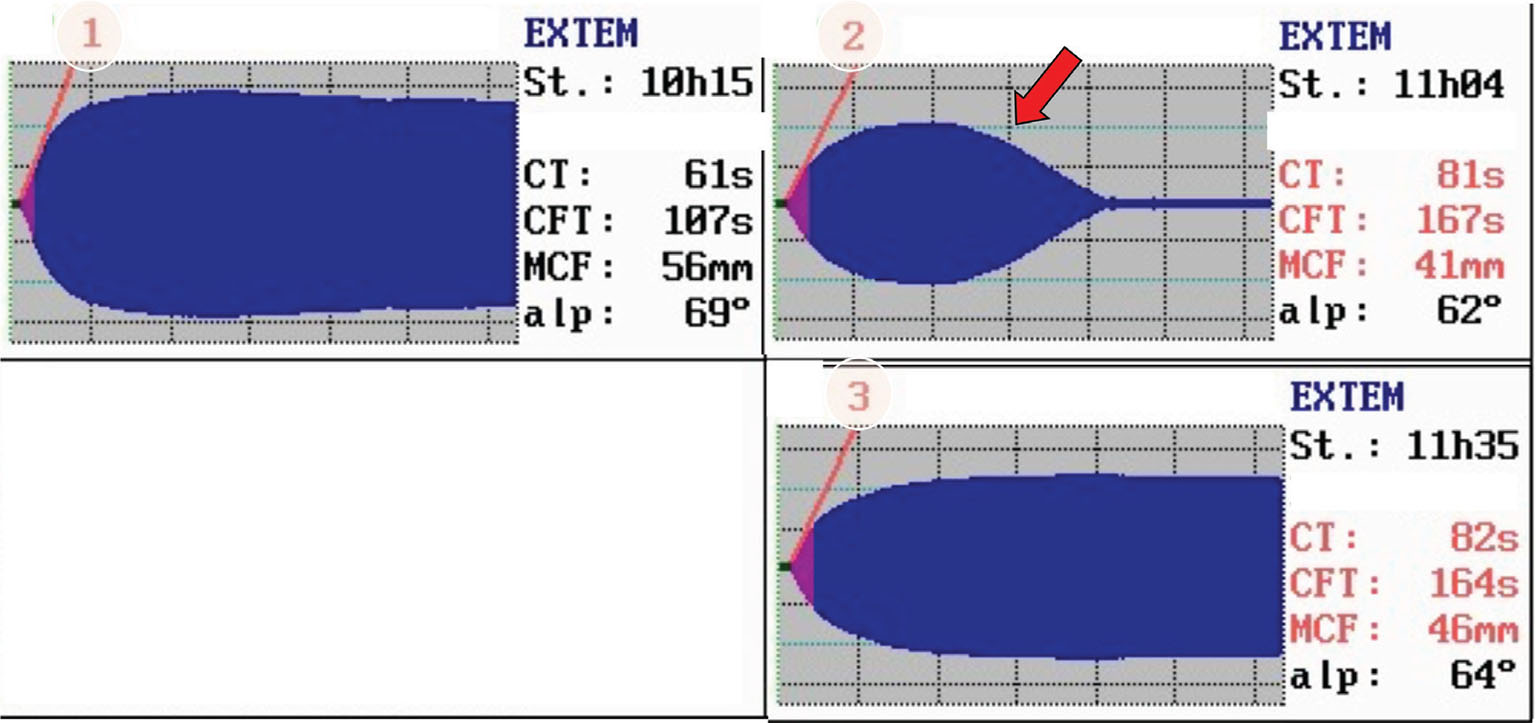
Fig. 2 - Tracciati ROTEM® di una fase finale di bypass aorto-coronarico. CT: clotting time; CFT: clotting formation time; MCF, maximum clot firmness. Per gentile concessione del Professor Simioni.
Per poter interpretare correttamente la funzione piastrinica sono necessari dei POC dedicati (4). Ne esistono vari, tra loro abbastanza sovrapponibili dal punto di vista tecnologico ma in grado di fornire informazioni diverse sui vari aspetti della funzione piastrinica più o meno indotta dai comuni agonisti. Per esempio, nell’aggregometro a impedenza Multiplate®, due elettrodi sono immersi nel campione di sangue intero che permette tra questi il passaggio di corrente elettrica. In caso di aggiunta di agonisti, le piastrine, aggregandosi, si depositeranno sulla superficie degli elettrodi per cui il passaggio della corrente verrà modificato conseguentemente.
In pochi minuti sarà possibile avere informazioni sull’aggregazione piastrinica indotta da agonisti e/od ostacolata da farmaci antagonisti (acido acetilsalicilico, clopidogrel ecc.).
L’area sotto la curva (integrale) è proporzionale all’entità dell’aggregazione piastrinica dopo aggiunta di agonisti. Esistono diversi test Multiplate® e i più utilizzati sono TRAPtest (attivatore trombina), ASPItest (attivatore acido arachidonico) e ADPtest (attivatore ADP). Il loro utilizzo permette di valutare la funzione piastrinica in presenza di farmaci antiaggreganti (acido acetilsalicilico, clopidogrel ecc.).
In un paziente in trattamento con ASA 100 mg, l’aggregazione piastrinica viene inibita nell’ASPItest, mentre quella complessiva risulta normale così come quella indotta dall’ADP (Fig. 3).

Fig. 3 - Tracciati ASPItest, TRAPtest, ADPtest Multiplate® di un paziente in trattamento con dose giornaliera di ASA 100 mg. AU: aggregation units. Per gentile concessione del Professor Simioni.
Se un paziente è in terapia con clopidrogel, il test dell’acido acetilsalicilico risulterà normale (ASPItest), mentre quello con l’ADP sarà inibito (Fig. 4).

Fig. 4 - Tracciati ASPItest e ADPtest Multiplate® di un paziente in trattamento con dose giornaliera di Clopidogrel 75 mg. AU: aggregation units. Per gentile concessione del Professor Simioni.
Sono in via di sviluppo degli strumenti che permettono oggi di ottenere dati sulla trombinogenerazione di un determinato campione in circa 25-45 minuti. Purtroppo, si tratta di tempistiche ancora troppo lunghe per la gestione di un’emorragia critica. Si sta tuttavia lavorando per rendere questi test di trombinogenerazione, molto utilizzati per la ricerca in campo medico, più vicini alla pratica clinica.
Conclusioni
In conclusione, le evidenze scientifiche disponibili sull’utilizzo dei diversi test POC non sono ancora così sufficienti e solide da consentire raccomandazioni forti sulla gestione diagnostico-terapeutica dei pazienti con sanguinamento grave.
Al momento sono in fase di studio prototipi di apparecchiature sempre più complesse in grado di valutare altre componenti implicate nella formazione del coagulo, come il flusso, la distanza dall’endotelio e i sistemi di inibizione fisiologica sulle superfici endoteliali.
Una grande assente nella valutazione della fisiopatologia della coagulazione attraverso i test POC attualmente disponibili, specialmente nei pazienti con emorragia severa, è la componente legata all’endotelio: non sono infatti ancora disponibili metodiche che permettano di indagare contestualmente l’interazione tra coagulazione ed endotelio in molte situazioni patologiche che sono alla base delle emorragie severe.
Acknowledgements
We would like to thank Antonella Managò and Francesca La Rosa who, on behalf of Health Publishing & Services Srl, provided publishing support and journal styling services.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: CSL Behring funded the publishing support and journal styling services. CSL Behring had no role in the conduct of the research, in the preparation of the article, in the study design, in the collection, analysis and interpretation of data, in the writing of the report, and in the article for publication.
Bibliografia
- 1. Boscolo A, Spiezia L, De Cassai A, et al. Are thromboelastometric and thromboelastographic parameters associated with mortality in septic patients? A systematic review and meta-analysis. J Crit Care. 2021;61:5-13. CrossRef PubMed
- 2. Haas T, Görlinger K, Grassetto A, et al. Thromboelastometry for guiding bleeding management of the critically ill patient: a systematic review of the literature. Minerva Anestesiol. 2014;80(12):1320-1335. PubMed
- 3. Spiezia L, Radu C, Marchioro P, et al. Peculiar whole blood rotation thromboelastometry (Rotem) profile in 40 sideropenic anaemia patients. Thromb Haemost. 2008;100(6):1106-1110. CrossRef PubMed
- 4. Casso G, Lanzi F, Marcucci CE. Point-of-Care Platelet Function Tests. In: Marcucci CE, Schoettker P, eds. Perioperative Hemostasis: Coagulation for Anesthesiologists. Springer Berlin Heidelberg; 2015:45-63. CrossRef